대한소화기학회지 2007;49:60-71 □ REVIEW □
서 론
위암은 발생률과 이로 인한 사망률이 감소하고 있으나 아 직도 전 세계에서 두 번째로 많이 발생하는 악성 종양이다.
전 세계적으로 2002년에 93만 명의 위암 환자가 새로 발병
했으며 70만 명의 환자가 위암으로 사망하여 사망률은 10만 명당 8.3-14.3명이었다.1 우리나라에서는 전체 암 발생의 21%가 위암이고 인구 10만 명당 24명이 위암으로 사망하고 있다.2,3 Helicobacter pylori (H. pylori) 감염은 사람에서 가장 흔한 만성 감염으로서 전 세계 인구의 50% 이상이 감염되
한국인의 위암 발생에서 가장 중요한 인자는 무엇인가:
Hel ic ob a c t er p y l or i, 숙주 인자 또는 환경 인자?
한림대학교 의과대학 내과학교실
김 학 양
Wh a t i s t h e M o s t I m p o r t a n t F a c t o r f o r G a s t r i c C a r c i n o g e n e s i s i n K o r e a n s : H e l i c o b a c t e r p y l o r i , H o s t F a c t o r o r E n v i r o n m e n t a l F a c t o r ?
H a k Y a n g K i m , M . D.
Department of Internal Medicine, Hallym University College of Medicine, Seoul, Korea
Epidemiological data including our studies demonstrated the association between Helicobacter pylori (H. pylori) infection and gastric cancer. However, this significant clinical outcome happens only in a small portion of infected person. This suggests that other contributors including host genetic and environmental factors might be involved in the disease process. Studies on the association between virulent strains of H. pylori and clinical outcomes failed to show significant results in Korea. Cytokine gene polymorphism such as interleukin-1 (IL-1) has been thought to play a role in gastric carcinogenesis. Our studies showed the controversial role of IL-1,
TNF-A, IL-10 and IL-2 gene polymorphisms in the development of gastric cancer in Korea. Chronic infection andinflammation leading to tumorigenesis are mediated in part through the recognition of various stimuli by toll-like receptors (TLRs). Our studies on the polymorphisms of TLR4 and TLR2 showed no mutant form in Koreans.
These discrepancies might reflect the genetic differences between Caucasians and Koreans or might be due to prevalent genetic polymorphisms with masked effect in gastric carcinogenesis in Koreans. As other candidate risk factors, there are constant or inconsistent results on the effect of dietary intake in gastric cancer. There are numerous similar risk for gastric carcinogenesis with different risk ratio including environmental factors in Caucasians and Koreans. Under the background of prevalent H. pylori infection and genetic polymorphisms, environmental factors including diet may potentiate their role in gastric carcinogenesis in Koreans. (Korean J
Gastroenterol 2007;49:60-71)Key Words: Environmental factor; Gastric cancer; Helicobacter pylori; Host factor; Polymorphism
연락처: 김학양, 134-701, 서울시 강동구 길동 445 한림대학교 의과대학 강동성심병원 소화기내과 Tel: (02) 2224-2113, Fax: (02) 478-6925 E-mail: bacter@hallym.or.kr
Correspondence to: Hak Yang Kim, M.D.
Division of Gastroenterology, Department of Internal Medicine Kangdong Sacred Heart Hospital, Hallym University College of Medicine, 445, Gil-dong, Gangdong-gu, Seoul 134-701, Korea Tel: + 82-2-2224-2113, Fax: + 82-2-478-6925
E-mail: bacter@hallym.or.kr
김학양. 한국인 위암 발생 위험 인자 61
어 있지만 선진국의 감염률은 25% 정도로 최근에 H. pylori 감염률이 감소하고 있지만 개발도상국이나 후진국에서는 80% 이상으로 아직도 많은 사람이 감염되어 있다.4,5 우리나 라도 예외는 아니어서 전 국민의 46.6%, 성인에서는 69.4%
의 감염률로 아직은 감염률이 높다.6
H. pylori가 세상에 알려진 지도 20년이 넘었으며 그동안 상부위장관 질환 특히 소화성궤양과 위암에서의 병태 생리, 진단과 치료에 큰 변화를 초래하였으며 상부위장관 이외의 장기와 다양한 질환에서도 관련에 대한 연구가 진행되었다.
H. pylori 감염에 대한 높은 관심은 당연하며, 무엇보다도 가 장 큰 관심의 대상은 위암일 것이다.
1994년 세계보건기구는 H. pylori를 확실한 발암인자(class I carcinogen)로 규정하였다.7 그러나 H. pylori 감염은 일반인 에서 흔하지만 위암은 비교적 드물게 발생하여 H. pylori에 감염된 100명 중 1-2명에서만 발생한다.8 따라서 위암이 발 생할 위험성이 있는 사람을 미리 알아내는 것과 이 과정 중 에 관여하는 인자를 규명하는 것은 국민 보건에 중요하며 위암을 예방하기 위한 검사의 필수 요건이기도 하다. 잘 알 려져 있는 바와 같이 위암은 만성 위염에서 위축성 위염으 로 진행된 후 장상피화생을 거쳐 이형성증 그리고 암으로 발전하는 일련의 다단계 연속 현상9으로 이해하고 있다. 우 리나라에서도 H. pylori 감염에 관하여 특히 위암과 관련된 많은 연구 논문이 발표되어 있다.
저자는 저자의 발표논문을 중심으로 한국인에서 위암 발 생에 관여하는 인자에 대하여 검토해 보고 가능하다면 여러 인자 중 어떤 인자가 중요하며 향후 어떤 방면의 연구가 필 요한지에 대하여 고찰하고자 한다.
Helicobacter pylori
1. 한국인의 H. pylori 감염
1998년 대한 H. pylori연구회에서 상부위장관 증상이 없는 사람 5,732명을 대상으로 시행한 전국 역학조사 결과에 따 르면 H. pylori 감염률은 전 국민에서 46.6%였으며 16세 이 상의 성인에서는 69.4%, 40대에서는 78.5%라는 높은 감염률 을 보였다.6 위암이 여자보다 남자에서 많이 발생하므로10 H. pylori 감염률도 남자에서 높을 것으로 예상하였으나 전 체 남녀 감염률에는 차이가 없어 다른 국내 연구11,12와 일 치하였다. 그러나 성인에서는 남자와 여자의 H. pylori 감염 률이 각각 69.4%와 64.2%로 의미 있는 차이를 보여 우리나 라에서 위암 발생이 남자에서 많다는 사실과 무관하지 않았 다. 그러나 남녀에서의 H. pylori 감염률은 미국과 유럽에서 상이하며 이런 결과가 인종 차이 때문인지는 확실하지 않 다. 그렇지만 H. pylori 감염이 있는 사람이 상부위장관 질
환, 특히 위암이 발생할 수 있는 고위험군13에 속함을 감안 한다면 한국인에서 H. pylori 감염률이 높다는 것은 일단 위 암 발생 가능성이 높음을 의미한다.14
소화성 궤양 환자 1,031명을 대상으로 H. pylori 감염률을 조사한 저자 등15의 보고에 따르면 위궤양 66%, 십이지장궤 양 79%, 위 및 십이지장 동반궤양 71%의 감염률을 보였다.
또한 H. pylori 감염 환자의 배우자가 H. pylori 감염률이 높 고, 이들 배우자가 상부위장관 질환이 있을 가능성이 있다 고 보고하였고16 300명의 위암 환자 가족과 426명의 대조군 을 조사하여 위암 환자 가족에서 H. pylori에 의한 위암 발 생 가능성이 높다는 국내 보고17는 한국인에서 H. pylori 감 염의 중요성을 보여준다.
2. 한국인 위암과 H. pylori 감염
저자 등18이 위암 환자와 대조군 160쌍을 대상으로 시행 한 전향 환자-대조군 연구에서 H. pylori 감염률이 위암 환 자에서 60%, 대조군에서는 51.9%로 의미 있는 차이가 없었 으며 위암의 위치별, 조직형별로도 차이를 보이지 않아 한 국인 위암에서는 H. pylori가 의미 있는 인자가 되지 못하였 다. 이는 발암의 전 과정에서 H. pylori 감염이 반드시 있어 야 하는 것은 아니며 경과 중 H. pylori 양성에서 음성으로 되었을 가능성이 있으며 20대와 30대의 높은 H. pylori 감염 률은 위암으로 진행하는 중요한 요인으로 작용할 수 있을 것으로 예측하였다. 이 결과는 H. pylori에 감염된 젊은 환자 는 나이 많은 환자보다 위암 발생의 상대 위험도가 높으며 나이가 들면서 위암 발생의 상대 위험도는 감소하여 70세 이상이 되면 무의미해져 젊은 연령의 H. pylori 감염이 중요 하다는 보고13,19,20와 일치한다. 저자 등의 연구18는 위암의 위험 인자 중 나이만을 보정한 연구로서 연구에 필요한 환 자와 대조군 수를 계산하여 136쌍으로 미리 결정하고 나이, 성별, 교육 수준, 경제 수준 등 외적 인자를 보정한 전향 연 구21에서는 위암 환자와 대조군에서 H. pylori 감염률이 각각 53%와 40%로 위암 환자에서 대조군보다 의미 있게 높아 H.
pylori 감염이 위암과 관계가 있음을 알았으며 식이와 같은 환경 인자의 중요성도 간과해서는 안 될 것으로 보고하였 다. 그러나 우리나라와 같이 H. pylori 감염률이 높은 지역에 서 위암 환자에서 H. pylori 감염이 얼마나 되는지에 대한 비교는 한국인의 H. pylori 감염률이 기본적으로 높아 큰 의 미는 없을 것으로 생각한다.
전 세계적으로 최근 남녀 모두에서 위암 발생이 감소하는 데22 이에는 예외도 있어 일본 미야기 지역에서는 남자에서 위암 발생률이 감소하지 않았으며 인도의 봄베이에서는 아 직도 낮은 발생률을 유지하는 등의 지역적인 차이가 있다.
반면 위 분문부(cardia) 선암은 증가하는 추세에 있는데23,24 50개 나라를 조사한 결과에 따르면 반드시 일치하지 않고
62 The Korean Journal of Gastroenterology: Vol. 49, No. 2, 2007
지역과 인종적으로 차이를 보였다. 또한 이러한 현상은 일 본 같이 위암 발생이 많은 지역에서는 위암 중 분문부암이 차지하는 비율이 적지 않아 변화가 있어도 뚜렷하지 않지만 백인에서처럼 위암 발생이 낮은 경우에는 분문부암의 발생 도 적어 변화가 조금만 있어도 뚜렷하게 나타나는 때문25으 로 생각되어 결과 해석에서 지역을 감안할 필요가 있다. 위 암 발생이 감소하고 위 분문부암이 증가하는 이유에 대한 확실한 설명은 없지만 H. pylori 감염률이 감소하는 것에 기 인한다고 알려져 있다. 저자 등26이 1991년부터 2000년까지 새롭게 위암으로 진단 받은 환자 2,395명과 위 분문부암 환 자 158명을 대상으로 위암의 위치와 조직형의 변화를 조사 하였는데 우리나라에서는 위 분문부암이 증가하거나 조직 형이 변화하는 등의 결과는 관찰되지 않았으며 이는 일본에 서도 같은 결과였다. H. pylori 감염률의 감소에 따라 위암 발생 부위, 조직형의 변화가 온다는 서양의 보고가 옳다면 한국인의 H. pylori 감염률 변화는 없을 것으로 예상한다. 따 라서 위암 환자와 전국민에서의 H. pylori 감염률에 대한 조 사를 하여 위암의 발생이 감소하는지 그렇다면 H. pylori 감 염률의 감소에 기인하는지에 대한 규명이 필요하다. 이는 위암 예방을 위하여 H. pylori 감염의 박멸이 필요한지에 대 한 기초 자료가 될 것이다. 비록 환자 발생이 감소하더라도 위암은 아직도 많은 나라에서 호발하는 위협적인 존재임은 확실하다.
3. 독성 인자(virulence factor)
H. pylori 감염이 있는 모든 사람에서 위암이 발생하는가?
물론 아니며 H. pylori에 감염된 일부에서만 위암이 발생한 다.8 그러므로 H. pylori가 위암 발생의 위험 인자라면 특정 한 독성 인자를 갖는 H. pylori 균주가 위암 발생과 관계가 있을 것을 의심하여 많은 연구가 발표되었다. H. pylori의 독 성 인자로는 CagA (cytotoxin associated gene A), VacA (vaculoating cytotoxin A), IceA, BabA 및 OipA 등이 있다. 그 중 대표적인 독성 인자가 CagA이다. CagA 양성 H. pylori가 CagA 음성 H. pylori 보다 위암 발생 위험도를 높이는 것으로 알려져 있지만27 이에 반대되는 결과들28도 있다. 저자 등29이 위암 환자와 만성위염 환자에서 CagA 양성률을 조사한 바 에 따르면 각각 56%와 70%로 위암이 없는 많은 사람에서도 CagA 양성임을 확인하였으며 우리나라의 다른 보고17,30,31와 도 유사하였다. 우리나라 H. pylori 균주 대부분이 CagA 독 성 인자를 갖고 있어 위암과는 의미 있는 차이를 보이지는 못했지만 이보다는 오히려 대부분의 한국인이 위암 발생 위 험도가 높은 H. pylori 균주에 감염되어 있다는 사실이 더 중요하다. CagA 음성 균주도 H. pylori 감염이 없는 경우보 다 위암 발생 위험도를 높일 수 있다는 점을 간과해서는 안 된다. 다른 독성 인자로는 VacA을 들 수 있는데 만성위염과
위암 환자에서 VacA 양성률은 각각 55%와 35%로32 위암과 VacA는 연관성이 없다는 국내의 다른보고30,31와 일치하였 다.
다양한 상부위장관 질환과 H. pylori 독성 균주에 대한 많 은 연구가 있으나 결과는 지역에 따라 다르며 특정 독성 인 자와 특정 질환 간의 관계 역시 확신할 수 없다. 따라서 앞 으로 지역, 나라 또는 인종별로 흔한 H. pylori 균주와 특정 질환과의 관계에 대한 연구가 필요하며 이를 기초로 같은 질환이라도 지역이나 나라 또는 인종에 따라 다르게 나타나 는 현상을 설명할 수 있을 것이다.
4. 위암과 십이지장궤양이 공존할 수 있는가?
우리나라에서는 임상의가 소화불량 환자를 진료할 때 그 원인이 위궤양이나 십이지장궤양뿐만 아니라 위암인 환자 도 종종 접할 수 있다. 저자 등33은 심각한 상부위장관 질환 을 의미하는 경고 징후(alarm sign)가 있는 환자에서도 상부 위장관내시경검사를 하기 전까지는 이런 증상 또는 징후만 으로 진단하기 어렵다고 보고한 바 있다. 일반적으로 십이 지장궤양의 존재는 낮은 위암 발생 위험도를 의미하며 십이 지장궤양은 위암 발생을 억제한다.34,35 즉, 십이지장궤양의 경우, 위 전정부에 국한되는 염증으로 체부의 위산 분비는 감소하지 않으나 위암 환자에서는 위의 전반적인 염증으로 위축이 초래되고 위산 분비는 감소하는 환경이라는 정반대 되는 성질을 갖고 있다. 그러나 H. pylori 감염은 서로 다른 성질과 환경에 기초하는 이 두 질환과 밀접한 관계를 맺고 있으며 CagA 또는 VacA 독성 인자가 이 두 질환과 연관성 이 있다.
같은 원인 또는 같은 인자가 서로 다른 질환을 일으키는 것이 과연 가능한가? 아직까지는 서로 다른 성질의 이 두 질환의 발생이 다른 H. pylori 균주, 환경 요인, 유전 요인에 의한 것인지 아니면 이들의 복합적인 작용에 의한 것인지 모른다.36저자 등은 십이지장궤양과 위암이 동반되어 있는 환자를 대상으로 H. pylori 감염을 조사하여 위암 환자에서 십이지장궤양이 있을 때는 궤양 상태가 반흔기 상태이며 이 들 환자에서는 H. pylori가 발견되지 않고 50대 이후에서 진 행 위암으로 나타나는 반면에 십이지장궤양이 활동기에 있 는 환자에서 위 병변(궤양)이 발견되는 경우에는 이는 조직 검사에서 위암이 아닌 위궤양이며 H. pylori가 발견되는 젊 은 환자임을 관찰하였다.37 이는 십이지장궤양이 젊은 나이 에 발병하고 전정부 위염 상태가 그대로 유지되면 위암은 발생하지 않으나 일부 환자에서 위염이 체부로 진전되는 경 우에는 위산 분비가 감소되어 십이지장궤양은 반흔기 상태 로 남고 이후에는 위암 발생의 위험도가 증가한다고 설명하 였다.38 한국인에서 이렇게 서로 다른 두 질환이 동반될 확 률이 예상보다 높을 수 있으며 십이지장궤양과 위암은 반드
Kim HY. Rick Factors for Gastric Carcinogenesis in Korea 63
시 공존할 수 없는(mutually exclusive) 질환이 아니라 H.
pylori가 일으키는 서로 다른 시기(different stage)의 질환일 수 있다. 위에 감염된 H. pylori는 여러 균주가 있을 수 있음 은 이미 잘 알려져 있는데 이들 질환을 일으키는 별개의 H.
pylori 균주(disease specific strain)가 있을 가능성도 있다.39 한국과 미국의 cagA 유전자가 서로 다르다는 사실이 지역 적으로 서로 다른 H. pylori가 있다는 것을 의미한다. 최근에 는 지역에 따라서 장상피화생이 십이지장궤양 환자의 위 체 부에서도 나타날 수 있다고 보고되었고40 중국에서도 위암 과 십이지장궤양이 같이 발생하는 것이 흔하지는 않지만 아 주 드물지도 않았다.41
숙주 인자: 단일염기 유전자다형성
H. pylori 감염자의 일부에서만 위암이 발생하는 이유는 무엇인가? 감염에 대한 인체의 반응은 사람마다 서로 다른 데 이는 유전적인 차이에 기인할 수 있다. H. pylori 감염에 대한 반응도 마찬가지이며 독성 인자에 대한 반응도 숙주에 따라 결정된다. 숙주의 여러 유전 인자들이 거론되는데 이 중 암 발생에서 개인 혹은 유전 차이를 설명하는 이론 중 하나로 특정 사이토카인의 단일염기 유전자다형성(single nucleotide polymorphism)에 대한 연구가 활발하다. 유전자다 형성은 암 발생에서 개개인의 유전적인 소인이 여러 외부 요소에 대해 어떻게 작용하는지, 즉 유전자-환경 사이의 상 호작용에 대한 중요한 해답이 될 수 있다.
1. 사이토카인
대표적인 것이 interleukin (IL)-1인데 IL-1β 유전자(IL-1B) 와 IL-1 receptor antagonist 유전자(IL-1RN)의 특정 유전자형 이 IL-1β의 생산을 증가시켜 위산 분비를 저해하고 H.
pylori 감염에 대하여 만성적인 위산 분비 저하를 유발시켜 위암 발생 위험도를 높인다고 보고42,43된 후 IL-1B-511 T형 보유자와 IL-1RN *2형 보유가 위암 발생 위험인자로 알려져 이에 대한 관심이 높아졌다. 이후 다양한 연구가 여러 나라 에서 발표되었으나 그 결과가 항상 일치하지 않았다. 서양의 결과와는 대조적으로 동양에서의 연구44,45들은 유전자 다형 성에 따른 위암 발생의 유의한 차이가 없었다. 국내 연구46-50 에서도 위선암 발생과 IL-1B 유전자 다형성과는 연관성이 없 었다. 다만 IL-1B-31C,49 또는 IL-1B-31T/T51가 위험 인자로서 가능성이 제기되었으나 서로 일치하는 결과가 없었다. 저자 등52이 IL-1B-511, IL-1B-31, IL-1RN의 유전자 다형성을 조사 한 바에 따르면 IL-1B-511 T 보유자는 위암 환자군에서 51%, 대조군에서 56%, IL-1RN *2형 보유자는 각각 6%와 8%로 유의한 상관 관계가 없었으며 H. pylori 감염 여부와 위암의 조직형에 따른 차이도 없었다. 그러나 위암 발생과
관계될 것이라는 IL-1B-511 T 보유자는 전체 대상자 중 50%
이상이었으나 IL-1RN *2형 보유자는 소수에 불과하여 IL- 1RN만을 대상으로 생각한다면 오히려 한국인에서는 위암 발생을 억제할 수 있는 유전자형을 많이 보유하고 있다는 사실인데 과연 이러한 IL-1B와 IL-1RN의 상반된 결과가 한 국인 위암 발생에 어떤 방향으로 영향을 미칠지는 미지수이 다. 또한 IL-1B-31의 C/C형 24.4%, C/T형 62.2%, T/T형 13.3%로 서양인의42 10.7%, 38.2%, 51%와는 빈도에서 반대 현상을 보여 한국인과 서양인의 유전적인 차이를 보여 주었 다. 더욱이 IL-1B-511과 IL-1RN 유전자다형성과 위산 분비에 관한 국내53와 중국54의 연구에서도 이들 유전자다형성에 따 른 위산 분비의 차이가 없어 서양인과는 다른 결과를 보였 다. 이 이유로는 위염 또는 위 위축이 있는 환자들이 포함되 었으며 동양인에서는 서양인에 비하여 벽세포(parietal cell) 수가 50%에 불과하며 위산 분비도 기본적으로 적다는 사실 을 들 수 있다. 한국인을 포함한 동양인에서 벽세포의 수가 적어 IL-1B와 IL-1RN의 유전자다형성이 실제로 위산 분비에 큰 영향을 끼치지 못하는 것인지 또는 이들의 실제 역할이 미미한 것인지는 연구가 필요하다.
IL-1B 유전자다형성과 더불어 다른 사이토카인의 유전자 다형성을 살펴보면 IL-10과 tumor necrosis factor (TNF)-α는 다양한 염증과 악성 질환에서 중요한 조절자의 역할을 하는 데 이 역할은 복합적이며 염증 반응과 면역체계 조절에서 서로 다른 역할을 담당한다.55,56IL-10은 항염증 작용을 나타 내며 B 세포의 증식과 분화를 조절하여 면역조절 기능을 가지며 IL-10 유전자다형성에 따라 IL-10 생산에 영향을 끼 쳐57 IL-10-1082A, IL-10 819T, IL-10-592A 보유자(ATA haplo- type)에서는 IL-10의 생산이 적었다. 반면 TNF-α는 염증 사 이토카인으로서 위산 분비를 억제하며 H. pylori 관련 질환 에서 중요한 매개자로 지목을 받고 있으며 역시 유전자다형 성에 의하여 생산에 영향을 받아58 TNF-A-308A 보유자에서 는 TNF-α의 전사가 증가된다. 따라서 이들 사이토카인의 생산에 영향을 미치는 개개인의 유전자다형성이 염증 반응 과 발암 과정의 질과 정도를 조절하는 중요한 인자로 간주 되고 있다. 위암 122명, 위궤양 58명, 십이지장궤양 52명과 대조군 120명에서 IL-10-1082/-592와 TNF-A-308의 유전자형 의 빈도를 조사한 바에 따르면 각 군별로 IL-10-1082A는 90% 이상, IL-10-592A는 60% 이상이었고 TNF-A-308A는 모 든 군에서 10% 미만으로 이들 유전자다형성이 한국인의 위 암과 소화성 궤양 환자에서 발생 위험도를 높이거나 낮추지 않았다. 특히 위암의 위치, 조직형과 H. pylori 감염 여부에 따른 연관성도 없었다.59이는 한국인에서 IL-10-1082A와 IL- 10-592A형이 서양인에 비하여 월등히 높은 빈도였으나 TNF- A-308A형은 찾기가 힘들 정도로 빈도가 낮아서 유럽에서 TNF-A-308A 보유형과 IL-10 ATA haplotype이 서양인의 원
64 대한소화기학회지: 제49권 제2호, 2007
위부 위암과 관련이 있다는 보고60,61와는 차이가 있었으나 메타 분석한 결과62와는 일치하였다.
반면 대만에서는 IL-10을 많이 생산하는 유전자형이 오히 려 위암 발생과 연관이 있었다.63 그러나 IL-1B와 IL-1RN의 경우와 마찬가지로 IL-10과 TNF-A 유전자다형성이 한국인 에서는 발암 과정에서 서로 상쇄 작용을 하는 유전자형이 많다는 것이 위암의 발암 과정에서 어떤 방향으로 작용할지 는 의문이다. 이를 설명하기 위해서는 IL-10과 TNF-α의 기 능에 대하여 다시 한번 생각해 볼 필요가 있다. 서양인에서 의 대부분 연구는 H. pylori 감염에 의한 심한 염증이 위암 으로 되기 쉽다는 가설을 기반으로 하고 있는데 실제로는 IL-10이 염증 매개체의 분비를 막으며 APC 유전자의 작용 을 억제하고 T 림프구의 기능을 직접 억제하는 등의 다양한 방법으로 발암 과정에 작용한다.64이것은 IL-10은 서양인에 서처럼 항염증 사이토카인으로서 발암 과정에 영향을 미치 기도 하지만60 암 세포를 제거하기 위한 면역억제 역할63도 한다는 의미이다. 하지만 한국인에서는 아직 IL-10이 어떤 방향으로 위 발암 과정에 영향을 미치는지 모르며 IL-10과 TNF-α의 기능 중 어느 한쪽의 작용이 우세할 수 있는지 의 문이다.
위암과 연관되어 있는 유전자다형성이 중복되어 있는 환 자에서는 위암 발생 위험도가 증가한다. IL-1B, IL-1RN, IL-10 및 TNF-A의 유전자다형성의 중복과 위암과의 관계를 본 연구에서도 유전자다형성이 5개까지 중복되어 있는 환 자가 있었지만 중복된 유전자다형성의 수가 4개와 5개인 환 자 수는 적어 비교가 어려웠고 3개가 중복되어 있는 환자는 위암과 대조군 모두에서 60% 이상으로 많은 환자에서 중복 됨을 관찰할 수 있었으며 위암 발생과는 연관성이 없었다 (Table 1).65 즉 한국인에서는 60% 이상에서 위암 발생과 연 관 있다는 유전자다형성이 중복되어 있어 유전적으로 위암 발생의 위험을 내재하고 있다.
IL-2도 위산 분비를 억제하고 위 위축을 잘 일으키는 것 으로 최근에 알려져 있는데66 IL-2 유전자다형성과 위암 또 는 소화성 궤양과의 상관 관계는 알려져 있지 않다. 위암 122명, 위궤양 116명, 십이지장궤양 104명 및 건강 대조군 100명에서 IL-2-330T/T 유전자형이 대조군에서 72%로 일본 에서의 39.6%보다 월등히 많았으며 위 위축을 잘 일으키는 것으로 알려진 IL-2-330T 유전자형은 위암 발생 위험도를 높이지 않았다.67
2. Toll-like receptors 앞에서 열거한 연구 결과52,59,65,67
와 같이 H. pylori가 위 점 막과 접촉한 후의 과정을 매개하는 사이토카인 유전자다형 성이 한국인 위암 발생과 관련이 없다면 염증 반응이 일어 나기 이전 단계, 즉 면역체계의 초기 단계는 유전적으로 차
이가 없는 것인가?
위 상피 세포는 위에 들어온 세균 감염에 대한 숙주의 첫 번째 방어 기전이며 면역 반응에 참가한다. 사람의 면역 반 응 조절의 최전선 역할을 담당하는 것은 선천면역(innate immunity)인데 이는 세균에 의하여 발현되는 pathogen-asso- ciated molecular patterns (PAMPs)를 인지한다. 선천면역을 관장하는 것은 toll-like receptor (TLR)이며 TLR는 PAMPs를 인지하여 염증 사이토카인의 발현을 매개한다.68-70 일반적으 로 그람 음성 세균에 대한 염증 반응은 수 주 내에 소실되 거나 숙주 자체를 사망하게 만드는 데 반하여 H. pylori에 감염된 사람의 대부분은 스스로 감염을 제거하지 못하며 H.
pylori 위염이 수십년 내지는 평생 동안 지속한다.71이런 이 유로 TLR 유전자다형성에 관한 연구가 H. pylori 연관 상부 위장관 질환의 연구에 필요하다. 이미 10여 종류의 TLRs가 알려져 있으며72그 수는 늘어나고 있으나 아직 개개의 TLR 의 역할은 잘 밝혀져 있지 않다. 각각의 TLRs들은 서로 다 른 PAMPs에 반응하여 면역 반응을 활성화한다.
TLR4와 TLR5는 다양한 그람 음성 세균의 lipopolysaccharide (LPS)와 flagellin에 각각 반응하며73,74 이는 그람 음성 세균 의 감염에 대한 숙주 방어 기전으로 작용하는데 H. pylori는 LPS와 flagellin을 모두 갖고 있다. LPS는 다양한 염증 및 알 레르기 질환에서 중요한 역할을 하며 대장암 세포의 성장을 촉진하여 대장암 발생에 직접적인 영향이 있다. 따라서 LPS 에 대한 개개인의 반응 정도 차이는 여러 질환의 발생, 심한 정도 또는 예후와 관련되어 있다. 이것이 기존의 대장 질환이 나 H. pylori와 연관하여 가장 잘 알려져 있는 TLR4와 TLR5의 유전자다형성과 위암의 관계에 관하여 관심을 갖게 되는 이 유다.
가장 먼저 알려진 것은 TLR4인데 TLR4 Asp299Gly 유전자 다형성은 LPS에 대한 기도 반응을 저하시킨다.75 위암, 소화 성 궤양 및 대조군에서 TLR4 Asp299Gly 유전자다형성에 대 하여 조사한 바에 따르면 대상 환자 282명(위암 122명, 위궤 양 58명, 십이지장궤양 52명, 대조군 50명) 중에서 돌연변이 Table 1. Association between IL-1B, IL-1RN, IL-10 and TNF-A Polymorphisms and Gastric Cancer according to the Frequency of Combined Polymorphisms
Frequency of Gastric Gastric Duodenal
Control combined cancer ulcer ulcer
(n=50)(%) polymorphisms (n=122)(%) (n=58)(%) (n=52)(%)
1 3 (2.5) 2 (3.4) 1 (1.9)
2 21 (17.2) 7 (12.1) 11 (21.2) 6 (12.0) 3 84 (68.9) 35 (60.3) 32 (61.5) 33 (66.0) 4 13 (10.7) 13 (22.4) 7 (13.5) 10 (20.0) 5 1 (0.8) 1 (1.7) 1 (1.9) 1 (2.0)
김학양. 한국인 위암 발생 위험 인자 65
형(mutant form)은 1명도 발견되지 않아 한국인에서는 TLR4 유전자다형성이 극히 드물었으며76 위암 환자에서의 역할도 미미할 것으로 결론지었다. 이는 일본에서 TLR4 유전자다형 성이 발견되지 않았다는 보고77와 일치한다. 그러나 TLR4 유 전자다형성이 7-12%에서 발견된다는 서구 보고78와는 다른 결과여서 한국인과 서양인은 유전적으로 서로 다른 상황임 을 알 수 있으며 같은 유럽 지역에서조차 TLR4 유전자다형 성과 대장 질환과의 관계에 상반된 보고78,79가 있다. 최근에 는 TLR4의 유전자다형성이 LPS에 대한 반응에 장애가 되지 않는다는 보고가 있으며 LPS에 대한 반응이 저하된 모든 사람에서 TLR4 돌연변이가 있는 것은 아니며, TLR4 돌연변 이가 있는 모든 사람에서 LPS에 대한 반응이 감소되어 있 는 것도 아니어서75TLR4 유전자다형성의 역할에 의문을 주 고 있다.
이와 더불어 H. pylori에 의한 TLR4와 TLR5 mRNA 발현 이 IL-8 같은 사이토카인의 생산을 조절하는 능력이 없어 H. pylori와 관련된 염증 반응에서 중요한 역할을 하지 않을 것이라는 결과를 관찰하여80 최근 관심이 증가하고 있는 TLR2 Arg677Trp 유전자다형성에 대하여 조사하였다. TLR2 는 다양한 세균의 lipoprotein, peptidoglycan, lipoteichoic acid, LPS 등과 상호 작용하며 nuclear factor (NF)-κB 활성화를 통하여 H. pylori 감염에서 중요한 역할을 한다.81,82우리나라 에서는 TLR2 유전자다형성이 제1형 당뇨병,83결핵84 및 류 마티스 관절염85의 병태생리에 관여할 것이라고 보고된 적 이 있다. 그러나 저자 등86의 연구에서는 H. pylori 감염이 확 인된 소화성궤양 환자 39명과 대조군 45명에서 TLR4와 마 찬가지로 돌연변이형이 발견되지 않아 균혈증87과 비결핵 항산균 폐질환88에서의 국내 연구 결과와 일치하여 한국인 의 소화성 궤양에서의 역할에 의문점을 남겼다. 앞으로 많은 위암 환자를 대상으로 한 검토가 필요하다.
이상의 한국인을 대상으로 한 TLR 유전자다형성에 대한
연구결과76,86에 따르면 한국인에서는 면역 반응의 초기 단
계에 작용하는 TLR의 돌연변이형이 발견되지 않아 위암과 의 관계에 대해서 규명을 할 수 없었으나 H. pylori에 대항 하여 위에서 염증 반응이 잘 생기며 이런 염증 반응이 지속 됨에 따라 위암으로의 진행이 가속화될 수 있을 것으로 생 각한다. 그러나 TLR의 유전자다형성은 서양인과는 다르게 나타나 이것이 어떻게 위암의 발암 과정에 영향을 미치는지 는 미지수이다.
또한, 위의 면역체계가 H. pylori에 대한 인지 단계에서는 작동을 잘 하지만 어떤 이유로 H. pylori를 제거하지 못하고 남아 있어 지속적인 염증 반응을 일으키게 하는지도 규명이 필요하며, 면역 생성을 피하는 데 있어 H. pylori 자체 인자 에 대한 연구가 필요하다.
3. 한국인과 서양인에서 유전자다형성의 차이
어떤 이유로 동양인 또는 한국인의 유전자다형성에 관한 연구 결과와 서양인의 결과가 다른 것이며 이런 결과가 나 타내는 의미는 무엇인가? 유전자다형성이 위암 발생에 영 향을 미칠 수 있다는 관점은 논리적인 가설로 인정할 수 있 으며 실제로 몇몇 연구에서도 다형성의 유의한 빈도 차이를 보고하기도 하였다. 그러나 이러한 차이도 임상적으로 적용 하기에는 미미하며 유전자다형성의 빈도는 인종이나 지역 에 따라 차이가 크며 같은 나라 안에서도 인종에 따라 차이
89가 있는 반면 실제로는 다형성 자체가 극히 드물어 저자 등의 연구76,86에서와 같이 결과를 얻지 못하는 경우도 있다.
특히 한국인에서는 위암 발생과 관련이 있다고 알려진 사이 토카인 유전자형 중에 위암의 위험 인자가 되는 유전자형이 많아 대조군과 비교가 어렵다는 문제가 있다. 따라서 한국 인은 서양인보다는 기본적으로 위암 발생이 잘 될 수 있는 위험에 유전적으로 노출되어 있다는 점이 중요하다. 그러나 한국인에서도 위암 발생은 개인별로 차이가 있다. 즉 IL-1B 와 IL-1RN의 예에서 보듯이 한국인에서는 위암 발생에 대하 여 서로 상반된 작용을 할 것으로 예측되는 유전자형이 많 은 사람에서 공존하며 따라서 이런 공존이 발암 과정에 어 떤 역할을 할지는 미지수이다.
서양에서와 같이 위암 전구 병변에서의 유전자다형성이 일정한 역할을 하는 것이 증명된다면 이후의 발암 과정을 유지하고 이끌어가는 인자는 식이를 포함한 다양한 환경 인 자일 것이다. 잘 알려진 바와 같이 위암 발생에는 유전적인 영향뿐만이 아니라 환경적인 요인이 크게 작용한다. 그러므 로 개개인의 유전적 차이도 중요하지만 다양한 환경 요인과 더불어 위암 발생에 기여하는 것으로 생각한다. 그러나 이 러한 유전 요인을 규명하려는 노력은 계속되어야 한다.
환경 인자-식이
왜 H. pylori 감염과 함께 위암에 대한 유전자다형성의 유 전적인 소인이 있는 사람의 일부에서만 위암이 발생하고 유 전적인 소인이 있는 모든 사람에서 위암이 발생하지 않는 가? 위암 발생의 위험 인자로 환경 인자를 빼놓을 수 없는 데 사회경제적인 수준, 음주, 흡연, 식이 습관과 냉장고 사 용 등이 거론되고 있으며 H. pylori 감염도 환경 인자로 볼 수 있다. 가장 잘 알려진 것으로는 신선한 야채나 과일이 결 여된 식이습관일 것이며 이외에도 고염분 식이(high salt diet), nitrate 또는 nitrite가 많이 포함된 음식, 훈제된 고기나 생선, 고탄수화물 식이 등이 위암 발생의 위험도를 증가시 키는 것으로 되어 있으나 결과가 항상 일치하는 것은 아니
다.90-92 저자는 주로 식이와 관련된 최근의 우리나라 연구
66 The Korean Journal of Gastroenterology: Vol. 49, No. 2, 2007
결과를 토대로 기술하고자 한다.
고염분 식이 섭취, 아스코빅산(ascorbic acid) 또는 카로테 노이드(carotenoid) 섭취 부족은 위암의 중요한 위험 인자로 이에 대한 많은 연구가 있다. 그러나 방법 면에서 대부분의 연구는 설문지를 통해 염분 섭취의 정도를 조사하였으므로 염분의 첨가 여부와 첨가된 양이 어느 정도인지 확실히 알 수 없는 것이 연구의 제한점이다. 일례로 고염분 식이가 위 암 발생에 영향이 있다는 연구 결과91,93도 있지만 반대되는
결과90,92도 있다. 저자 등94이 염분 섭취를 정량적으로 측정
하기 위하여 위암 환자 52명과 대조군 45명에서 단순 소변 검체의 sodium과 creatinine의 배설 비율로서 염분 섭취 정도 를 측정하여 위암과의 연관 관계를 조사한 바에 따르면 두 군 간의 염분 섭취량은 차이가 없었다. 염분 섭취량에 따른 H. pylori 감염률에도 차이가 없었는데 이 결과에 대해서는 일본에서도 반대되는 결과95,96가 있다. 그러나 한국인의 염 분 섭취는 세계적으로 높은 수준으로 알려져 있어97위암 환 자군과 대조군 사이의 비교가 무의미할 수 있다. 고염분 섭 취가 위암의 강력한 원인 인자임을 뒷받침하는 역학 및 실 험 증거들은 많이 있으나 실제로 염분 섭취량을 정량적으로 측정한 연구는 별로 없어 이에 대한 추가 연구가 필요하며 한국인의 염분 섭취에 대한 체계적인 자료가 없는 상황에서 이에 대한 광범위한 조사도 필요하다.
앞서 언급한 저자 연구21에서 위암 환자와 대조군 각각 136명에서 식이 섭취를 연구자가 직접 설문지를 통하여 조 사하였는데 배추김치, 마늘, 버섯, 두유 등의 섭취는 위암 발생 위험을 감소시키며 콩과 함께 조리된 쌀, 구운 소고기, 깍두기와 동치미 등은 위암 발생 위험을 증가시켰다.98 또한 신선한 채소와 콩 식품을 많이 섭취하는 것도 위암 발생 위 험을 감소시켰다. 고염분 식이는 위암 발생 위험을 증가시 키지 않았다. 이 연구에서는 고염분 식이의 한 가지로 간장 으로 조리한 음식이 포함되어 있으나 간장은 한국인이 매일 섭취하고 있어 사람에 따른 염분 섭취의 차이가 크지 않고 기본적으로 한국인에서는 염분 섭취가 많다는 점을 이유로 들 수 있으며 간장이 발암을 억제99,100할 수도 있기 때문이 라 생각한다. 그러나 이는 염분 섭취를 정량적으로 측정한 연구94와도 동일한 결과이다. 김치는 한국인이 매일 섭취하 는 중요한 반찬 중의 한 가지이며 전통적인 발효건강 식품 이나 이에 대한 결과 역시 상반된다. 즉, 김치는 고 농도의 nitrate를 함유하고 있는데 발효 과정 중에 nitrate 농도는 줄 어들고 2차 아민(amine)이 지속적으로 증가한다. 특히 새우 젖으로 발효시킨 중국산 양배추 김치에서 더욱 그러하여101 김치가 위에서 소화되면서 발생한 nitrosodimethylamine이 증 가102하고 위 점막에 직접 작용하여 발암을 유발할 수 있다.
그러나 김치에 대한 상반된 결과들이 있어 이에 대한 규명 이 필요하다.
유전자와 환경 인자의 상호작용과 위암과의 관계에 대한 연구가 적고 이들의 결과가 항상 일치하는 것은 아니지만 cytochrome P450 1A1 (CYP1A1) 유전자다형성과 식이의 상 호 작용과 위암과의 관계를 보면 한국인에서 CYP1A1 Ile/
Val 또는 Val/Val 유전자형과 김치는 위암 발생의 위험 인자 였으며 cytochrome P450 2E1 (CYP2E1), glutathione S-trans- ferase mu 1 (GSTM1), aldehyde dehydrogenase 2 (ALDH2) 의 유 전자다형성은 일부 환경 인자의 위암에 대한 영향을 조정할 수 있어서103 중요하다. 그러나 음식물의 발암 인자에 의해 서 위암이 발생하기까지는 20년 이상의 시간이 필요하므로 과거의 정확한 식이습관에 대한 정보를 얻기는 어려우며 위 암과 식이와의 직접적인 인과 관계를 밝히는 것이 중요하다.
한국인은 일반적으로 저단백, 저지방, 고염분 식이를 많 이 섭취하고 신선한 야채나 채소는 적게 섭취하는데 음식물 중 어떤 성분이 위암 발생을 조장하는지는 확실하지 않다.
전 세계적으로 소화성 궤양과 위암의 발생률이 차이가 있고 위암 발생률이 높은 지역에서 낮은 지역으로의 이민자에서 는 위암 발생이 적다는 점104에서 유전적인 인자보다는 환경 적인 인자105,106가 위암 발생, 즉 위 위축의 진전에 더욱 중 요한 역할을 한다고 볼 수 있다. 그러나 다른 방향으로 생각 한다면 한국인은 H. pylori 감염이나 유전 소인과 같은 위암 의 위험 인자를 많은 사람이 갖고 있음에도 대부분의 한국 인에서 위암이 발생하지 않는다. 위암의 발생에는 식이를 포함한 환경 요인이 작용을 할 것이며 반대로 위암 발생을 억제하는 데도 식이가 중요한 역할을 하고 있을 것이다. 위 암 발생을 억제하는 식이를 가려내는 것은 위암 발생을 조 장하는 식이를 알아내는 것 이상으로 중요하다. 따라서 한 국인에서 대규모의 체계적이고 종합적인 식이습관에 대한 조사와 그 인과 관계를 밝히는 연구가 필요하다.
한국인의 위암 발생을 예방할 수 있는 방법은 있는가?
위암 발생을 줄이거나 예방하기 위한 노력이 오래 전부터 계속되어 왔으나 현재 특별한 방안이 제시되고 있지는 못하 다. 우선 생각해 볼 수 있는 방법은 위암 발생의 제1차 위험 인자인 H. pylori 감염을 치료하는 방법이며 이에 대한 연구 가 전 세계에서 의욕적으로 진행되었으나 중도에서 연구가 중단되었거나 최근에 종료된 연구 결과에서도 희망적인 결 론을 얻지 못하고 있다.107,108우리나라에서 이에 대한 연구 는 아직 없으며 더욱이 모든 사람에서 H. pylori 검사를 하 고 치료를 하는 것이 합당한지도 의문이고 경제성, 항생제 내성 등 고려해야 할 문제점이 많다.109,110 또한 cagA 또는 vacA와 같은 독성 인자를 갖고 있는 H. pylori 감염과 유전 자다형성이 있는 사람에서 H. pylori 감염을 박멸하면 위암 발생 위험도를 낮출 수 있다고 제안되었지만 이에 대한 확
Kim HY. Rick Factors for Gastric Carcinogenesis in Korea 67
실한 결론도 없다.
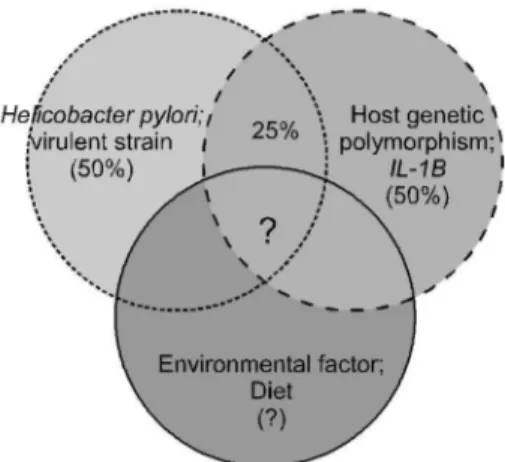
전술한 바와 같이 저자 등의 연구18,21,29,52
처럼 CagA 양성 인 H. pylori 감염이 한국인의 50% 정도에서 있고 IL-1B 유 전자다형성이 있는 사람들 또한 50% 정도라면 이들 위험 인자가 공존하는 사람들은 최소 25%는 될 것이며 이는 전 체 위암 환자의 40% 이상에 해당할 것으로 추산할 수 있다 (Fig. 1). 이들에서 H. pylori 감염을 박멸하는 것을 고려해 볼 수 있으나 이에 대한 연구가 진행되지 않았으며 현재까 지의 연구 결과로는 H. pylori 감염을 치료한다 하더라도 위 암 발생을 완전히 예방할 수 없다. 또한 여기에 식이를 포함 한 환경 인자를 고려한다면 어느 정도의 사람들에서 예방 효과가 있을지는 미지수이다(Fig. 2).
결 론
위염의 유형에는 다양한 형태가 있으며 이는 십이지장궤 양이나 위암의 발생과 밀접한 관련을 맺고 있다. 위염을 일 으키는 가장 중요한 원인 인자인 H. pylori 감염에 대하여 어떤 유형의 위염이 발생할지를 결정하는 일차 요소는 H.
pylori 균주의 종류보다는 식이와 같은 환경 요인이라는 보 고는 우리들에게 큰 의미가 있다. 또한 H. pylori 감염과 위 암 발생의 위험 요소인 특정 유전자다형성을 갖고 있는 일 부의 사람에서만 위암이 발생하는지에 대한 해답을 찾는 것 이 중요하다. 위암 발생에는 복잡하고 다양한 인자가 관계 하고 유전뿐 아니라 식이를 포함한 환경 인자가 중요한 역 할을 할 것이다. 유전 인자, H. pylori 감염 및 비롯한 환경
인자는 같이 작용하여 위암을 유발한다. 즉 H. pylori 감염과 유전 소인이 서로 작용하여 위의 저산증을 유발하고 위 위 축이 발생하는 동안 환경 인자는 발암 과정을 매개하며 이 작용은 H. pylori 감염이 소실되어도 지속된다.
한국인과 서양인은 위암의 위험 인자로 간주되는 H.
pylori 감염, 유전자다형성과 같은 유사 요소들을 공유하고 있으나 서로 다른 정도나 빈도 차이의 환경 요인에 노출되 어 있다. 즉 한국인은 높은 H. pylori 감염률, 위암 관련 유전 자형의 높은 빈도 등 기본적으로 서양인보다 위암 발생에 취약한 환경 배경과 유전 소인에 노출되어 있어 현재의 위 암 발생률을 보인다. 따라서 위암 발생의 위험 인자로 H.
pylori, 유전 인자도 중요하지만 한국인에서는 식이 습관을 비롯한 환경 요인이 더욱 중요한 것으로 생각한다. 한편, 위 암 발생의 위험 인자를 찾는 것 이상으로 위암 발생의 억제 인자를 알아내는 것도 중요하다. 나아가서 한국인에서 위암 발생을 줄일 수 있는 여러 인자에 대한 종합적이고 체계적 인 연구가 필요하다.
감사의 글
이번 종설에 인용된 저자 등의 연구 결과가 발표되기까지 논문 작성과 실험 등에 힘써주신 강동성심병원 소화기내과 의 김경호, 박준용, 신운건 선생님 및 전공의 선생님들, 소 화기 연구실의 김성만, 이정윤 선생님과 현재는 개인 진료 활동을 하고 있는 이자영 선생님의 그동안의 노고에 감사를 드립니다.
Fig. 1. Risk proportion for gastric cancer attributable to each risk factor. According to our previous results, the high risk proportion for gastric cancer according to the risk factors in Koreans is crudely estimated. The risk proportion for gastric cancer attributable to CagA (+) H. pylori infection and IL-1B host genetic polymorphism is 50%, respectively. This proportion can be attributed to 40% of Korean gastric cancer patients in our study.
However, it is questionable and currently not available to measure the effect of environmental factors including diet.
Fig. 2. Factors for the determination of clinical outcomes in Korea.
During the multi-step and multi-factorial process of gastric carci- nogenesis, H. pylori infection, host genetic factors such as genetic polymorphism and environmental factors including diet play interconnected roles like a saw-toothed wheel. Under the backg- round of prevalent H. pylori infection and genetic polymorphism, the environmental factors may potentiate their role in gastric carcinogenesis.
68 대한소화기학회지: 제49권 제2호, 2007
참고문헌
1. Ferlay J, Bray F, Pisani P, et al. GLOBOCAN 2002: Cancer Incidence, Mortality and Prevalence Worldwide, Version 2.0.
IARC CancerBase No. 5. Lyon: IARC Press, 2004.
2. Yearly report of Korea on cancer development (1991. 1. 1- 1999. 12. 31). Ministry of Health and Welfare for Korean Government 2000.
3. Yearly statistical report on causes of death (1991. 1. 1-1999.
12. 31). Korea National Statistical Office 2000.
4. Parsonnet J. The incidence of Helicobacter pylori infection.
Aliment Pharmacol Ther 1995;9:45-52.
5. Pounder RR. The prevalence of Helicobacter pylori in different countries. Aliment Pharmacol Ther 1995;9:33-40.
6. Kim JH, Kim HY, Kim NY, et al. Seroepidemiological study of Helicobacter pylori infection in asymptomatic people in South Korea. J Gastroenterol Heaptol 2001;16:969-975.
7. International Agency for Research of Cancer, Monographs on the evaluation of carcinogenic risks of human (Vol 160), In- fection with Helicobacter pylori, Lyon 1994;170-240.
8. Graham DY. Can therapy even be denied for Helicobacter pylori infection? Gastroenterology 1997;113(suppl 6):S113-S117.
9. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. Cancer Res 1992;52:6735-6740.
10. Replogie ML, Glaser SL, Hiatt RA, Parsonnet J. Biologic sex as a risk factor for Helicobacter pylori infection in healthy young adults. Am J Gastroenterol 1995;142:856-863.
11. Choi KH, Lee SH, Park YH. Prevalence of Helicobacter pylori infection among Korean adults in Pusan. Korean J Gastroenterol 1996;28:758-763.
12. Song JB, Lee SH, Shin YM, Choi KH, Lee SD, Park YH.
Seroprevalence of Helicobacter pylori infection in patients without gastric symptoms. Korean J Gastroenterol 1997;29:
310-316.
13. Nomura A, Stemmermann GN, Chyou PH, Kato I, Perez- Perez GI, Blaser MJ. Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii. N Engl J Med 1991;325:1132-1136.
14. Parsonnet J. Helicobacter pylori: the size of the problem. Gut 1998;43(suppl 1):S6-S9.
15. Jang MK, Kim HY, Cho BD, et al. Prospective study for the prevalence of Helicobacter pylori infection in patients with gastric ulcer and duodenal ulcer among Korean population.
Korean J Med 1997;52:457-464.
16. Kim HY, Kim JS, Park SJ, et al. Prevalence of Helicobacter pylori infection in spouses and its clinical significance.
Korean J Gastroenterol 1998;31:740-747.
17. Chang YW, Han YS, Lee DK, et al. Role of Helicobacter pylori infection among offspring or siblings of gastric cancer patients. Int J Cancer 2002;101:469-474.
18. Kim HY, Cho BD, Chang WK, et al. Helicobacter pylori infection and the risk of gastric cancer among the Korean population. J Gastroenterol Hepatol 1997;12:100-103.
19. Parsonnet J, Friedman GD, Vandersteen DP, et al. Helico- bacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991;325:1127-1131.
20. Forman D, Newell DG, Fullerton F, et al. Association between infection with Helicobacter pylori and risk of gastric cancer: Evidence from a prospective investigation. BMJ 1991;302:1302-1305.
21. Chang WK, Kim HY, Kim DJ, et al. Association between Helicobacter pylori infection and the risk of gastric cancer in the Korean population: prospective case-controlled study. J Gastroenterol 2001;36:816-822.
22. Parkin DM, Whelan SL, Ferlay J, Storm H. Cancer incidence in five countries. Vol. I-VIII. IARC CancerBase No. 7, Lyon.
2005.
23. Devesa SS, Blot WJ, Fraumeni Jr JF. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer 1998;83:2049-2053.
24. Kubo A, Corley DA. Marked multi-ethnic variation of eso- phageal and gastric cardia carcinomas within the United States. Am J Gastroenterol 2004;99:582-588.
25. Forman D. Counting cancers at the junction-a problem of routine statistics. Eur J Gastroenterol Hepatol 2002;14:99-101.
26. Lee JY, Kim HY, Kim KH, et al. No changing trends in incidence of gastric cardia cancer in Korea. J Korean Med Sci 2003;18:53-57.
27. Parsonnet J, Friedman GD, Orentreich N, Vogelman H. Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection. Gut 1997;40:297-301.
28. Enrothy H, Kraaz W, Engstrand L, Nyrgen G, Rohan T.
Helicobacter pylori strain types and risk of gastric cancer: a case-control study. Cancer Epidemiol Biomarkers Prev 2000;
9:981-985.
29. Kim HY, Kim JH, Kim YB, et al. Role of Helicobacter pylori CagA in the development of gastric cancer in Korea.
Korean J Gastroenterol 1998;31:160-166.
30. Kim KC, Park HJ, Lee HW, et al. Relation of serum gastrin and pepsinogen levels to serologic recognition of CagA and VacA in Helicobacter pylori infection. Korean J Gastroenterol 1997;29:25-34.
31. Lee JW, Jeong S, Kim IH, et al. Relationship between gene subtype of Helicobacter pylori virulence factor and upper
김학양. 한국인 위암 발생 위험 인자 69
gastrointestinal diseases. Korean J Gastroenterol 2001;38:89- 97.
32. Lee JH, Kim HY, Bae YD, et al. Helicobacter pylori VacA and gastric cancer. Korean J Gastrointest Endosc 2000;21:
602-607.
33. Lee JH, Kim HY, Rho SH, et al. Dyspepsia in Korean Population: Who needs endosocpy? Korean J Gastrointest En- dosc 2001;22:1-7.
34. Hansson LE, Nyren O, Hsing AW, et al. The risk of stomach cancer in patients with gastric or duodenal ulcer disease. N Engl J Med 1996;335:242-249.
35. Molloy RM, Sonnenberg A. Relation between gastric cancer and previous peptic ulcer disease. Gut 1997;40:247-252.
36. Graham DY, Go MF, Genta RM. Helicobacter pylori, duo- denal ulcer, gastric cancer: tunnel vision or blinder? Ann Med 1995;27:589-594.
37. Kim HY, Kim YB, Park CK, Yoo JY, Graham DY. Co- existing gastric cancer and duodenal ulcer disease: Role of Helicobacter pylori infection. Helicobacter 1997;2:205-209.
38. Graham DY. Helicobacter pylori: its epidemiology and its role in duodenal ulcer disease. J Gastroenterol Hepatol 1991;
6:105-113.
39. Hirschl AM, Richter M, Makristathis A, et al. Single and multiple strain colonization in patients with Helicobacter pylori- associated gastritis: detection by macrorestriction DNA anal- ysis. J Infect Dis 1994;170:473-475.
40. El-Zimaity HM, Gutierrez O, Kim JG, et al. Geographic differences in the distribution of intestinal metaplasia in duodenal ulcer patients. Am J Gastroenterol 2001;96:666- 672.
41. Zhao L, Shen ZX, Luo HS, Yu JP. Clinical investigation on coexisting of duodenal ulcer and gastric cancer in China. Int J Clin Pract 2005;59:1153-1156.
42. El-Omar EM, Carrington M, Chow WH, et al. Interleukin-1 polymorphisms associated with increased risk of gastric can- cer. Nature 2000;404:398-402.
43. Machado JC, Pharoah P, Sousa S, et al. Interleukin 1B and Interleukin 1RN polymorphisms are associated with increased risk of gastric carcinoma. Gastroenterology 2001;121:823-829.
44. Kato S, Onda M, Yamada S, Matsuda N, Tokunaga A, Matsukura N. Association of the ilterleukin1beta genetic poly- morphism and gastric cancer risk in Japanese. J Gastroenterol 2001;36:696-699.
45. Zeng ZR, Hu PJ, Hu S, et al. Association of interleukin 1B gene polymorphism and gastric cancers in high and low prevalence regions in China. Gut 2003;52:1684-1689.
46. Park JY, Cho YG, Kim CJ, et al. Association of the
interleukin-1 beta and interleukin-1 receptor antagonist genetic polymorphism and Korean gastric cancer. J Korean Gastric Cancer Assoc 2002;2:163-167.
47. Lee JS, Kim GH, Heo J, et al. Helicobacter pylori cagA gene and host interleukin-1 beta and interleukin-1 receptor antagonist gene polymorphisms in gastric cancer. Korean J Gastroenterol 2003;41:438-446.
48. Lee SG, Kim B, Choi W, Lee I, Choi J, Song K. Lack of association between pro-inflammatory genotypes of the inter- leukin-1 (IL-1B -31 C/+ and IL-1RN *2/*2) and gastric cancer/duodenal ulcer in Korean population. Cytokine 2003;
21:167-171.
49. Kang WK, Park WS, Jin HM, Park CH. The role of the interleukin-1 beta gene polymorphism in the gastric carcino- genesis. Korean J Gastroenterol 2004;44:25-33.
50. Kim N, Cho SI, Yim JY, et al. The effect of genetic poly- morphisms of IL-1 and TNF-A on Helicobacter pylori-induced gastroduodenal disease in Korea. Helicobacter 2006;11:105- 112.
51. Lee JH, Youn YK, Choe KJ, Kim JP. The roles of Helico- bacter pylori infection and interleukin-1beta polymorphism in gastric cancer. J Korean Surg Soc 2002;62:209-217.
52. Kim HY, Lee JY, Kim KH, et al. Polymorphism of IL-1B and IL-1RN genes in the patients with gastric cancer and peptic ulcer disease. Helicobacter 2004;9:495.
53. Lee HS, Lee IS, Choi MG, Kim SW, Lee SM, Chung IS.
Does interleukin-1 beta polymorphism affect gastric acid out- put in chronic gastritis patients? Helicobacter 2004;9:521.
54. Hu S, Song QB, Yao PF, et al. No relationship between IL-1B gene polymorphism and gastric acid secretion in younger healthy volunteers. World J Gastroenterol 2005;11:6549-6553.
55. Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes. Nature 1996;383:787-793.
56. Clerici M, Shearer GM, Clerici E. Cytokine dysregulation in invasive cervical carcinoma and other human neoplasias: time to consider the TH1/TH2 paradigm. J Natl Cancer Inst 1998;
90:261-263.
57. Gibson AW, Edberg JC, Wu J, Westendorp RGJ, Huizinga TWJ, Kimberly RP. Novel single nucleotide polymorphisms in the distal IL-10 promoter affect IL-10 production and enhance the risk of systemic lupus erythematosus. J Immunol 2001;166:3915-3922.
58. Stuber F, Petersen M, Bokelmann F, Schade U. A genomic polymorphism within the tumor necrosis factor locus influ- ences plasma tumor necrosis factor-alpha concentrations and outcome of patients with severe sepsis. Crit Care Med 1996;
24:381-384.
70 The Korean Journal of Gastroenterology: Vol. 49, No. 2, 2007
59. Lee JY, Kim HY, Kim KH, et al. Association of poly- morphism of IL-10 and TNF-A genes with gastric cancer in Korea. Cancer Lett 2005;225:207-214.
60. El-Omar EM, Rabkin CS, Gammon MD, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphism. Gastroenterology 2003;124:
1193-1201.
61. Machado JC, Figueiredo C, Canedo P, et al. A proinflam- matory genetic profile increases the risk for chronic atrophic gastritis and gastric carcinoma. Gastroenterology 2003;125:
364-371.
62. Persson C, Canedo P, Machado J, El-Omar E, Forman D.
The polymorphisms of pro-inflammatory genes associated with gastric cancer: a meta-analysis. Helicobacter 2006;11:
340.
63. Wu MS, Wu CY, Chen CJ, Lin MT, Shun CT, Lin JT.
Interleukin-10 genotypes associate with the risk of gastric carcinoma in Taiwanese Chinese. Int J Cancer 2003;104:
617-623.
64. Fortis C, Foppoli M, Gianotti L, et al. Increased interleukin- 10 serum levels in patients with solid tumors. Cancer Lett 1996;104-1-5.
65. Kim HY, Lee JH, Lee JY, et al. Association between genetic polymorphisms of various cytokines and gastric cancer in Korea. Gut 2004;53(suppl VI):A97.
66. Togawa S, Joh T, Itoh M, et al. Interleukin-2 gene polymor- phisms associated with increased risk of gastric atrophy from Helicobacter pylori infection. Helicobacter 2005;10:172-178.
67. Shin W, Kim H, Kim S. Polymorphisms of IL-1B, IL-1RN and IL-2 genes in patients with gastric cancer and peptic ulcer diseases in Korea. Helicobacter 2006;11:327.
68. Gerwirtz AT, Navas TA, Lyons S, Godowski PJ, Madara JL.
Cutting edge: bacterial flagellin activates basolaterally espressed TLR5 to induce epithelial proinflammatory gene expression. J Immunol 2001;167:1882-1885.
69. Aderem A, Ulevitch RJ. Toll-like receptors in the induction of the innate immune response. Nature 2000;406:782-787.
70. Brightbill HD, Modlin RL. Toll-like receptors: molecular mechanisms of the mammalian immune response. Immuno- logy 2000;101:1-10.
71. Israel DA, Salama N, Krishna U, et al. Helicobacter pylori genetic diversity within the gastric niche of a single human host. Proc Natl Acad Sci USA 2001;98:14625-14630.
72. Takeuchi O, Kawai T, Sanjo H, et al. TLR6: a novel member of an expanding toll-like receptor family. Gene 1999;231:59- 65.
73. Feldman M, Bryan R, Rajan S, et al. Role of flagella in
pathogenesis of Pseudomonas aeruginosa pulmonary infection.
Infect Immun 1998;66:43-51.
74. Dobrovolskaia MA, Vogel SN. Toll-like receptors, CD14 and macrophage activation and deactivation by LPS. Microbes Infect 2002;4:903-914.
75. Arbour NC, Lorenz E, Schutte BC, et al. TLR4 mutations are associated with endotoxin hyporesponsiveness. Nat Genet 2000;25:187-191.
76. Kim HY, Kim KH, Park JY, et al. The association between Asp299Gly polymorphism in TLR-4 gene and the risk of gastric cancer in Korean population. Helicobacter 2005;
10:467.
77. Okayama N, Fujimura K, Suehiro Y, et al. J Clin Lab Anal 2002;16:56-58.
78. Franchimont D, Vermeire S, El-Housni H, et al. Deficient host-bacteria interactions in inflammatory bowel disease? The toll-like receptor (TLR)-4 Asp299Gly polymorphism is asso- ciated with Crohn's disease and ulcerative colitis. Gut 2004;
53:987-992.
79. Arnott ID, Nimmo ER, Drummond HE, et al. NOD2/
CARD15, TLR4 and CD14 mutations in Scottish and Irish Crohn's disease patients: evidence for genetic heterogeneity within Europe? Genes Immun 2004;5:417-425.
80. Park JY, Kim HY, Lee JY, et al. Macrolide-affected toll-like receptor 4 expression from Helicobacter pylori-infected mono- cytes does not modify interleukin-8 production. FEMS Im- munol Med Microbiol 2005;44:171-176.
81. Smith Jr MF, Mitchell A, Li G, et al. Toll-like receptor 2 and TLR5, but not TLR4, are required for Helicobacter pylori-induced NF-κB activation and chemokine expression by epithelial cells. J Biol Chem 2003;35:32552-32560.
82. Ding SZ, Torok AM, Smith Jr. MF, Goldberg JB. Toll-like receptor 2-mediated gene expression in epithelial cells during Helicobacter pylori infection. Helicobacter 2005;10:193-204.
83. Park Y, Park S, Yoo E, Kim D, Shin H. Association of the polymorphism for toll-like receptor 2 with type-1 diabetes susceptibility. Ann N Y Acad Sci 2004;1037:170-174.
84. Yim JJ, Lee HW, Lee HS, et al. The association between microsatellite polymorphisms in intron II of the human toll- like receptor-2 gene and tuberculosis among Koreans. Genes Immun 2006;7:150-155.
85. Lee EY, Yim JJ, Lee HS, Lee YJ, Lee EB, Song YW.
Dinucleotide repeat polymorphism in intron II of the human toll-like receptor-2 gene and susceptibility to rheumatoid arthritis. Int J Immunogenet 2006;33:211-215.
86. Park JY, Kim HY, Kim KH, et al. Toll-like polymorphism and Helicobacter pylori infection in Korean peptic ulcer
Kim HY. Rick Factors for Gastric Carcinogenesis in Korea 71
patients. J Gastroenterol Hepatol 2005;20(suppl):A306.
87. Ryu YJ, Kim EJ, Koh WJ, Kim H, Kwon OJ, Chang JH.
Toll-like receptor 2 polymorphisms and nontuberculous myco- bacterial lung diseases. Clin Vaccine Immunol 2006;13:818- 819.
88. Yoon HJ, Choi JY, Kim CO, et al. Lack of toll-like receptor 4 and 2 polymorphisms in Korean patients with bacteremia.
J Korean Med Sci 2006;21:979-982.
89. Mitchell HM, Ha M, Goh K, Fock K, Forman D. Significant differences in the distribution of polymorphisms in IL-1β- 511, IL-1β-1473 and IL1RN between ethnic groups resident in Malaysia. Helicobacter 2005;10:506.
90. Nomura AMY, Grove JS, Stemmermann GN, et al. A pros- pective study of stomach cancer and its relation to diet, cigarettes and alcohol consumption. Cancer Res 1990;50:
627-631.
91. Lee JK, Park BJ, Yoo KY, et al. Dietary factors and stomach cancer: a case-control study in Korea. Int J Epi- demiol 1995; 24:33-41.
92. Galanis DJ, Klonel LN, Lee J, et al. Intakes of selected foods and beverages and incidence of gastric cancer among the Japanese residents of Hawaii: a prospective study. Int J Epidemiol 1998;27:173-180.
93. Nazario CM, Szklo M, Diamond E. Salt and gastric cancer:
a case-control study in Puerto Rico. Int J Epidemiol 1993;
27:790-797.
94. Kyong TY, Kim HY, Chae GS, et al. Salt consumption as a risk of gastric cancer and Helicobacter pylori infection.
Korean J Med 1998;55:169-175.
95. Tsugane S, Tei Y, Takahasi T, Watanabe S, Sugano K.
Salty food intake and risk of Helicobacter pylori infection.
Jpn J Cancer Res 1994;85:474-478.
96. Shinchi K, Ishii H, Imanishi K, Kono S. Relationship of cigarette smoking, alcohol use, and dietary habits with Helicobacter pylori infection in Japanese Men. Scand J Gastroenterol 1997;32:651-655.
97. Joossens JV, Hill MJ, Elliott P, et al. Dietary salt, nitrate and stomach cancer mortality in 24 countries. Int J Epide- miol 1996;25:494-504.
98. Kim HJ, Chang WK, Kim MK, Lee SS, Choi BY. Dietary factors and gastric cancer in Korea: a case-control study. Int J Cancer 2002;97:531-535.
99. Park KY, Baek KA, Rhee SH, et al. Antimutagenic effect of kimchi. Food Biotechnol 1995;4:141-145.
100. Hirayama T. Epidemiology of stomach cancer in Japan.
With special reference to the strategy for the primary pre- vention. Jpn J Clin Oncol 1984;14:159-168.
101. Kim JH, Shin HS. Effects of main raw material and jeot-kal (fermented fish sauce) on formation of N-nitrosamines during kimchi fermentation. J Food Hyg Safety 1997;12:333-339.
102. Kim KR, Shin JH, Lee SJ, Kang HH, Kim HS, Sung NJ.
The formation of N-nitrosamine in kimchi and salt-fermented fish under simulated gastric digestion. J Food Hyg Safety 2002;17:94-100.
103. Nan HM, Park JW, Song YJ, et al. Kimchi and soybean pastes are risk factors of gastric cancer. World J Gastro- enterol 2005;11:3175-3181.
104. Kumagai T, Malaty HM, Graham DY, et al. Acquisition versus loss of Helicobacter pylori infection in Japan: Results from an 8-year birth cohort study. J Infect Dis 1998;178:
717-721.
105. Malaty HM, Graham DY, Isaksson I, et al. Co-twin study of the effect of environment and dietary elements on acquisi- tion of Helicobacter pylori infection. Am J Epidemiol 1998;
148:793-797.
106. Malaty HM, Engstrand L, Pedersen NL, et al. Helicobacter pylori infection: genetic and environmental influences. A study of twins. Ann Intern Med 1994;120:982-986.
107. Wong BC, Lam SK, Wong WM, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA 2004;14:187- 194.
108. Saito D, Boku N, Fujioka T, et al. Impact of H. pylori eradication on gastric cancer prevention: endoscopic results of the Japanese intervention trial (JITHP-study), a rando- mized multi-center trial. Gastroenterology 2005;128:A4.
109. Fendrick AM, Chernew ME, Hirth RA, Bloom BS, Band- ekar RR, Scheiman JM. Clinical and economic effects of population-based Helicobacter pylori screening to prevent gastric cancer. Arch Intern Med 1999;159:142-148.
110. Parsonnet J, Harris RA, Hack HM, Owens DK. Modeling cost-effectiveness of Helicobacter pylori screening to prevent gastric cancer: a mandate for clinical trials. Lancet 1996;348:
150-154.