저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
이학 석사학위 논문
신경섬유종증 제1형의 악성전개에
관여하는
TNS3
유전자의 역할 규명
아 주 대 학 교 대 학 원
의생명과학과/ 분자의학전공
안 수 용
신경섬유종증 제1형의 악성전개에
관여하는
TNS3
유전자의 역할 규명
지도교수 정 선 용
이 논문을 이학 석사학위 논문으로 제출함.
2018년 2월
아 주 대 학 교 대 학 원
의생명과학과/ 분자의학전공
안 수 용
i -국문요약- 신경섬유종증 제 1 형의 악성전개에 관여하는TNS3 유전자의 역할 규명 신경섬유종증 제1형(Neurofibromatosis Type 1; NF1)은 신경섬유종, 밀크 커피색 반점 등을 포함하여 다양한 임상증상이 나타나는 질환으로 상염색체 우 성 유전 질환으로 약 3,500명중 1명꼴로 발생한다. 특히, 30~40%의 환자에서 말초신경을 따라 양성종양인 피부신경섬유종과 총상신경섬유종이 발생되고, 환 자의 약 10%에서는 악성말초신경초종양(malignant peripheral nerve sheath tumor; MPNST)이 발생되며, 이러한 악성의 MPNST 는 화학요법과 방사능에 낮은 반응을 보이며 환자의 높은 사망률로 이어진다. 본 연구에서는 신경섬유 종증 제1형의 정상세포 또는 양성종양세포의 악성화 전개(tumor progression) 에 관여하는 핵심유전자(key gene)를 발굴하여, 악성화 관여 기전 규명과 치 료 타겟 분자(Therapeutic target molecule)로서의 가능성 검증에 대해 연구 하고자 하였다.
3명의 신경섬유종증 제1형 환자의 수술조직으로부터 분리한 정상조직, 양성 종양조직, 악성종양조직을 재료로, DNA methylation array와 차세대염기서열장 치(NGS) 기반의 whole-genome RNA-sequencing을 실시하여 3명의 환자 악성종양조직에서 공통으로 발현량이 현저하게 증가되어 있는 TNS3 유전자를 발굴하였다. 또한, 악성말초신경초종양 세포주인 sF02.2, sNF96.2, S462의 3 종의 세포에서 모두 TNS3 mRNA의 발현량이 크게 증가되어 있었다.
악성말초신경초종양 S462 세포에서 short hairpin RNA(shRNA)를 사용하
여 TNS3 유전자의 발현을 억제하였 때, 신경섬유종증 제1형의 악성화에 중요
한 역할을 하는 Ras, ERK1/2의 활성화가 억제되었다. 따라서, TNS3 shRNA가 악성말초신경초종양세포의 apoptosis에 미치는 영향에 대해 분석하였다. TNS3
ii
shRNA를 단독처리에서는 악성말초신경초종양 세포의 apoptosis에 큰 영향이 없었으나, 기존에 악성말초신경초종양과 육종(sarcoma) 등의 악성종양에 주로 사용하는 ICE(Ifosfamide, Carboplatin, Etoposide)와 CVM(Cisplatin, Vinblastine, Methotrexate) 항암제와 병용으로 처리하였을 시에는 cell viability 억제와 apoptosis 증가에 뚜렷한 시너지 효과가 나타났다.
TNS3 short interfering RNA(siRNA)의 in vivo 유효성 평가를 위해 누드마우 스에 S462 세포를 주입하여 신경섬유종증 제1형 악성종양 xenograft 마우스 를 제작하였다. 신경섬유종증 제1형 악성말초신경초종양 xenograft 마우스에 TNS3 siRNA, ICE, CVM 단독 또는 병용 주입시에 3가지 모두에서 종양 부피, 종양 무게, 종양 크기 등이 대조군에 비해 유의하게 적은 항암효과가 나타났으 며, TNS3 siRNA+ICE와 TNS3 siRNA+CVM의 병용투여 시에 더 확실한 항 암효과가 관찰되었다. 본 연구결과는 신경섬유종증 제1형의 악성화 기전의 규명에 중요한 자료를 제공할 뿐만 아니라, 향후의 TNS3 siRNA와 항암제의 병용 투여를 통한 신경 섬유종증 제1형의 치료법 개발에 크게 활용될 수 있을 것으로 기대된다. 핵심어: 신경섬유종증 제1형, 상염색체 우성질환, NF1 유전자, 돌연변이, 악성 전개, 악성말초신경초종양, TNS3, xenograft, siRNA, 항암제
iii 차 례 국문 요약 ... i 차례 ... iii 그림 차례 ... v 표 차례 ... vii Ⅰ. 서론 ... 1 Ⅱ. 실험재료 및 방법 ... 7
A. Cell line and cell culture ... 7
B. Whole-genome DNA methylation chip array 사용 epigenetic alteration 분석 ... 7
C. Western blot analysis ... 7
D. Ras activation assay ... 8
E. Total RNA 추출 및 cDNA 합성 ... 8
F. Quantitative PCR (qPCR) ... 9
G. Cell viability assay ... 9
H. Xenograft mouse 제작 ... 10
I. 항암제 및 short interfering RNA(siRNA) 투여 ... 10
J. 종양의 적출 및 중량 측정 ... 13
K. Fluorescence activated cell sorter(FACS) analysis ... 13
L. Short hairpin RNA(shRNA) construct ... 13
M. 통계처리 ... 14
Ⅲ. 결과 ... 15
A. 환자 유래 종양조직에서 과발현 되어있는 TNS3 유전자 발굴 ... 15
iv
C. MPNST 세포에서 TNS3 knockdown 시의 Ras signaling pathway
관련 단백질 발현 양상 분석 ... 21 D. TNS3 shRNA 와 항암제의 병용 처리시의 효과 분석 ... 23 E. TNS3 shRNA 와 항암제의 병용 처리시의 apoptosis 효과 분석 ... 29 F. In vivo 실험용 siTNS3의 검증 ... 32 G. In vivo실험용 xenograft 마우스 제작 및 siTNS3 효과 평가 ... 34 H. NF1 악성종양 xenograft 마우스에 TNS3 siRNA 및 항암제의 단독 및 병용 처리 시의 항암 효과 분석 ... 36 Ⅳ. 고찰 ... 41 Ⅴ. 결론 ... 44 참고 문헌 ... 45 ABSTRACT ... 53
v 그림 차례
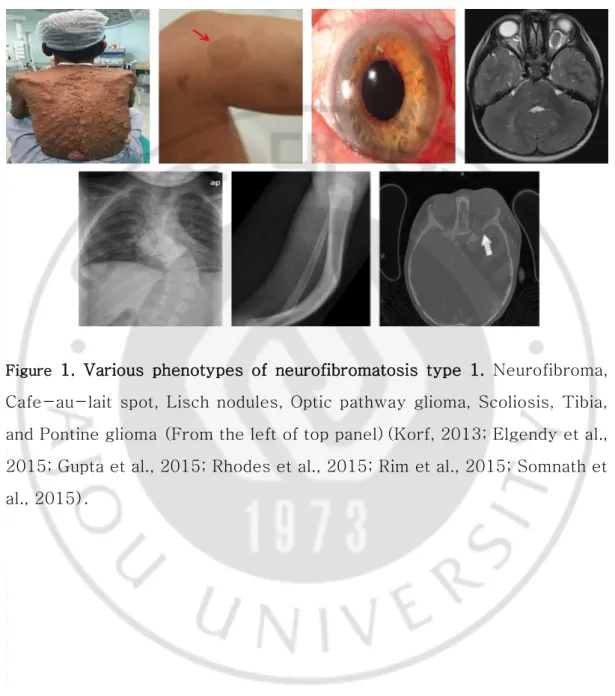
Figure 1. Various phenotypes of neurofibromatosis type 1. ... 2
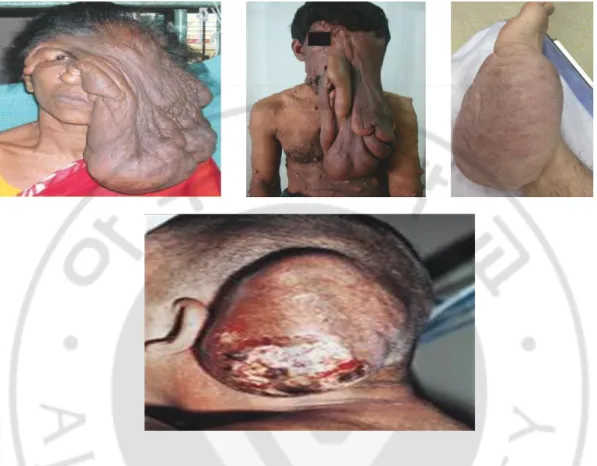
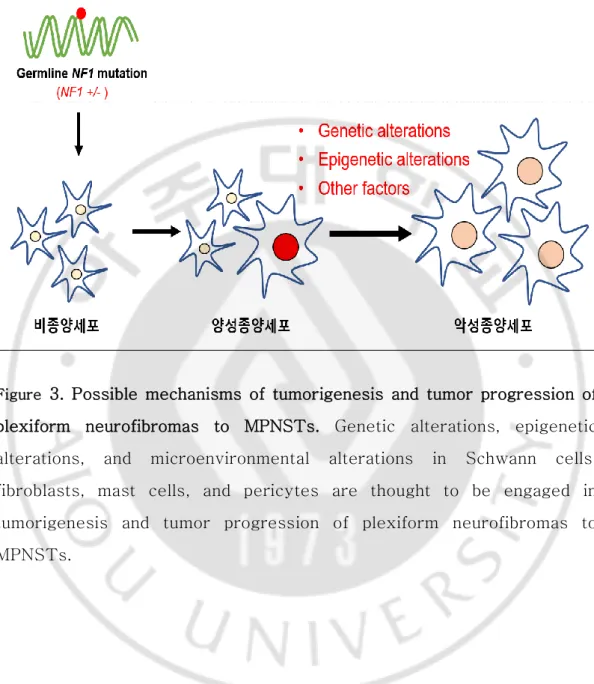
Figure 2. Various phenotypes of plexiform neurofibromas and MPNSTs found in patients with NF1. ... 3 Figure 3. Possible mechanisms of tumorigenesis and tumor progression of plexiform neurofibromas to MPNSTs. ... 5
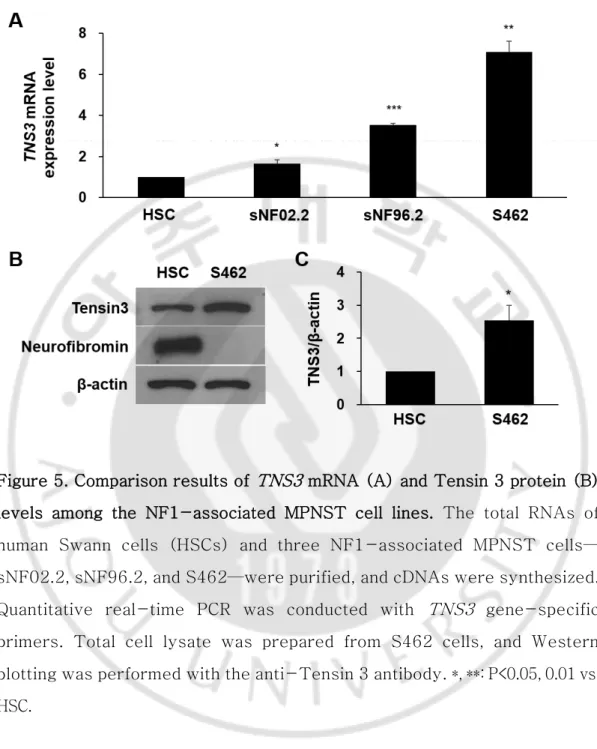
Figure 4. Results of immunohistochemistry with the anti-phosphorylated-EGFR antibody in normal, benign, and malignant tumor tissues from NF1 patients. ... 16 Figure 5. Comparison results of TNS3 mRNA (A) and Tensin 3 protein (B) levels among the NF1-associated MPNST cell lines. ... 20
Figure 6. Western blot analysis of proteins involved in the Ras signaling pathway in TNS3-knockdown S462 cells. ... 22
Figure 7. Results of the cell viability test of anticancer drugs in NF1-associated MPNST S462 cells and normal Swann cells. ... 24 Figure 8. Effects of co-treatment of TNS3 shRNA and ifosfamide, carboplatin, and etoposide (ICE) anticancer drugs on the cell viability of NF1-associated MPNST S462 cells and normal Swann cells. 26
Figure 9. Effects of the co-treatment of TNS3 shRNA and cisplatin, vinblastine, and methotrexate (CVM) anticancer drugs on cell viability of NF1-associated MPNST S462 cells and normal Swann cells. ... 28
vi
Figure 10. Effects of co-treatment of TNS3 shRNA and ICE or CVM anticancer drugs on caspase-3 and Ras activation of NF1-associated MPNST S462 cells. ... 30
Figure 11. Effects of co-treatment of TNS3 shRNA and ICE or CVM anticancer drugs on apoptosis of NF1-associated MPNST S462 cells. ... 31
Figure 12. Evaluation of siRNAs for TNS3 knockdown and the effects of the selected siRNA No. 2 on the inhibition of ERK1/2 and Ras activation in NF1-associated MPNST S462 cells. ... 33
Figure 13. Evaluation of TNS3 siRNA No. 2 for the delivery and knockdown effect of TNS3 mRNA expression by local injection into the tumors in xenograft mice. ... 35
Figure 14. Antitumor effects of single and combination treatments of TNS3
siRNA and ICE or CVM anticancer drugs on tumor volume and weight in NF1-associated MPNST xenograft mice. ... 37
Figure 15. Representative pictures of NF1-associated MPNST xenograft mice administered TNS3 siRNA and/or ICE or CVM anticancer drugs. ... 39
Figure 16. Representative pictures of tumors removed from NF1-associated MPNST xenograft mice administered TNS3 siRNA and/or ICE or CVM anticancer drugs. ... 40
vii 표 차례
Table 1. Study design of the treatment with anticancer drugs and siTNS3
in the NF1-associated MPNST malignant tumor xenograft mouse model. ... 12
Table 2. Histological features of the three patients with NF1-associated MPNSTs. ... 15
Table 3. Description of significant genes that are differentially expressed in primary MPNST cells from patients with NF1... 18
1 I. 서론
신경섬유종증 제 1 형(neurofibromatosis type 1; NF1)은 3,000~3,500 명중 1 명 꼴로 발생하는 상염색체 우성 유전 질환이다. NF1 의 다양한 임상증상으로는 밀크 커피색 반점(café-au-lait spot), 홍채결절(Lish nodules), 시신경교종(optic pathway glioma), 경골형성이상(tibial glioma), 등이 있다(Yohay, 2006)(Figure 1). 특히, 신경이 있는 신체 어디에서나 종양이 발생할 수 있으며 다발성이기 때문에 신경섬유종증 이라고 한다(Gutmann, 2001). NF1 환자의 30~40%에서 양성종양인 총상신경섬유종(plexiform neurofibroma)이 발생되며, 환자 중 약 10%에서는 악성말초신경초종양(malignant peripheral nerve sheath tumor; MPNST)으로 양성종양이 악성화 된다(Huson et al., 1988; Cichowski and Jacks, 2001; Ferner, 2007)(Figure 2).
NF1 발생 원인은 NF1 유전자의 돌연변이로 인해 발병한다. NF1 유전자가 암호화 하고있는 Neurofibromin 단백질은 아미노산 1125-1537 부위에 activation 상태인 GTP-Ras 를 inactivation 상태인 GDP-Ras 로 전환하여 조절하는 GAP-related domain(GRD) 영역을 가지고 있다(Johannessen et al., 2005). NF1 환자의 약 50%는 유전이 아닌 자연 발생적인 NF1 유전자의 돌연변이로 발병된다. NF1유전자에 mutation 이 발생할 경우, neurofibromin 의 부족으로 의한 Ras 의 활성을 조절하는 기능이 손실로 인해 Ras 단백질이 과잉 활성화되어 NF1 이 발병한다(Rubin and Gutmann, 2005). NF1 유전자 돌연변이는 Ras signal pathway 의 여러 downstream pathway 에 영향을 미친다(Dilworth et al., 2006). NF1 에서는 GTP-Ras 의 증가에 의해 MEK kinase 와 mitogen-activated protein(MAP) kinase 의 ERK1/2 를 포함한 kinase cascade 를 활성화시킴으로써 세포의 증식, 분화, 사멸 등에 관여한다(Feldkamp et al., 1999; Reuter et al., 2000; Gottfried et al., 2006).
2
Figure 1. Various phenotypes of neurofibromatosis type 1. Neurofibroma, Cafe-au-lait spot, Lisch nodules, Optic pathway glioma, Scoliosis, Tibia, and Pontine glioma (From the left of top panel)(Korf, 2013; Elgendy et al., 2015; Gupta et al., 2015; Rhodes et al., 2015; Rim et al., 2015; Somnath et al., 2015).
3
Figure 2. Various phenotypes of plexiform neurofibromas and MPNSTs found in patients with NF1. Plexiform neurofibromas (Upper panel) and malignant peripheral nerve sheath tumor(MPNST) (Lower panel)(Leroy et al., 2001; Agarwal et al., 2007; Menon and Kumar, 2010; DeFazio et al., 2015).
4 NF1 환자에서 나타나는 양성종양의 악성전개(tumor progression)는 예측이 불가능하고 유전성이기 때문에 근본 치료는 불가능하다. 신경섬유종인 MPNST 로 악성화가 진행된 경우, 종양의 절제 등의 대중요법만이 유일한 치료법이나, 다발적으로 발생하고 종양의 위치에 따라 수술이 불가능한 경우가 많아 암의 진행시기에 관계없이 환자의 생명과 직결된다. NF1 의 전통적인 치료방법으로 방사선 요법, 외과적 수술 절제, 세포독성약이 있지만 장기간의 효과는 크게 없는 것으로 밝혀졌다(Dilworth et al., 2006). NF1 의 종양형성과 악성전개에 관여하는 기전에 대한 많은 연구가 있어왔으나, 아직 정확한 기전은 밝혀져 있지 않고 있다(Wiest et al., 2003; Holtkamp et al., 2004; Jeong et al., 2008). NF1 의 종양형성과 악성전개는 말초신경을 따라 존재하는 세포인 Schwann cell 에서의, (1)DNA 돌연변이, 염색체 이상, copy number variation(CNV), loss of heterozygosity(LOH) 등의 유전체불안정성 유발(genomic instability)과 같은 유전적 변이(genetic alteration), (2)유전자의 methylation, histon 단백질의 acetylation 등과 같은 후성유전적 변이(epigenetic alteration), (3)Fibroblast cell, mast cell 등의 Schwann cell 주위의 세포에서의 미세환경 변화(microenvironmental alteration) 등의 체세포변이(somatic alteration)가 종양형성과 악성전개의 핵심적 원인이라 추측되고 있다(Figure 3).
5
Figure 3. Possible mechanisms of tumorigenesis and tumor progression of plexiform neurofibromas to MPNSTs. Genetic alterations, epigenetic alterations, and microenvironmental alterations in Schwann cells, fibroblasts, mast cells, and pericytes are thought to be engaged in tumorigenesis and tumor progression of plexiform neurofibromas to MPNSTs.
6 NF1은 질환의 우성유전으로 인해 50%의 자손에 대물림 되나, 다른 유전질 환과는 특이하게 부모로부터의 유전이 아닌 새로운 돌연변이(de novo mutation)에 의한 경우가 환자의 약 50%에 달하기 때문에 유전질환임에도 불 구하고 환자가 매우 많다(약 3,500명 중 1명 발병). 환자들은 결혼해서 아이 를 가질 것인가에 대한 고민, 다른 사람과 다르다는 자포자기의 감정을 많이 호소하고 있다. NF1은 매우 다양한 질병 양상과 경과를 보이며 합병증과 악성 화에 대한 불확실성과 정확한 질병 경과 기전이 밝혀져 있지 않아 어떤 경우에 경한 경과를 밟고 어떤 경우에 중한 경과를 밟는 것인지는 예측이 어려우며, 특히 환자의 약 10%에서 나타나는 양성종양의 악성전개에 대한 예측이 불가 능하다. 또한, 육체적인 고통과 추한 외모로 인한 정신적 문제로 고통을 호소하는 환 자가 많다. 특히, 총상심경섬유종증은 양성종양임에도 종양세포의 끊임없는 성 장으로 인해 외형적인 문제와 근본 치료 부재에 따른 문제로 인해 환자들이 겪 고 있는 정신적, 육체적 고통은 매우 크다. 무엇보다도 유전성이기 때문에 다기 관에 다발적으로 발병하며, 병소의 절제 이외에 특별한 치료방법이 없으며, 수 술로 종양을 제거했더라도 재발하기도 한다. 특히, 종양이 뇌, 척추 등의 심부 에 다발적으로 발생하였을 경우는 제거 수술조차 불가능한 경우가 많아 치료제 개발에 대한 필요성이 매우 큰 질환이다. 본 연구에서는, NF1 환자의 정상조직, 총상신경섬유종, 악성종양 조직을 연 구 재료로 하여, DNA methylation의 변화에 의한 후성유전적 변이와 whole genome RNA sequencing 등의 전장유전체분석(whole-genome analysis)을 통해 체계적으로 NF1 악성전개에 중심적인 역할을 하는 핵심유전자(key gene) 를 발굴하고, 그 유전자가 NF1 발병에 어떤 역할을 하는지를 in vitro 및 in vivo 실험을 통해 연구하고자 하였다.
7
II. 실험 재료 및 방법
A. Cell line and cell culture
정상 세포인 Human Schwann cell(HSC)(ScienCell Research Laboratories)와 MPNST 세포인 sNF96.2, sNF02.2, S462(American Type culture Collection, USA)는 10% FBS(Hyclone Laboratories, Logan, USA), penicillin(100 U/ml)와 streptomycin(100 μg/ml)을 첨가한 Dulbecco’s modified Eagle’s medium(Hyclone Laboratories, Logan, USA)로 배양 하였다.
B. Whole-genome DNA methylation chip array 사용 epigenetic alteration 분 석
암 관련 유전자에 대한 DNA methylation이 일어나는 영역(CpG island)의 1,505 부위가 심어져 있는 DNA methylation chip(ILLUMINA, GoldenGate Methylation Cancer Panel I)을 이용하여 정상과 악성조직 간의 DNA methylation profiling을 비교 분석하였다. 각각의 세포의 genomic DNA를 Zymo Research사의 EZ DNA Methylation-Gold kit를 사용하여 bisulfite conversion 한 다음, biotin으로 labeling하여 chip에 hybridization하여 washing 후 leader기로 signal을 검출하였다.
C. Western blot analysis
배양한 세포를 50 μg/ml PMSF, Protease inhibitor cocktail 이 첨가된 lysis buffer(150 mM Nacl, 1% Nonidet P-40, 0.5% sodium deoxycholate, 0.1% SDS)와 혼합하여 단백질을 추출한 뒤 여기서 얻어진 시료를 Lowry protein assay reagent kit(Bio-rad laboratories, U.S.A.) 방법으로 정량
8
분석하여 SDS-PAGE loading buffer(5X)와 섞은 후, 100℃에서 10 분간 가열하였다. 이를 loading 한 후 8-15% SDS-PAGE gel 에 전기영동하여 분리하고, Polyvinylidene fluoride (PVDF, Immobilon-P membrane (0,45 ㎛), Millipore Corporation, U.S.A.)에 흡착 이동 시켜, 다음과 같이 각각의 특이 항체로 Western blot analysis 를 시행하여 분석하였다.
사용한 1 차 항체는 TNS3(Tensin 3) 1:3000 (Sigma Aldrich, U.S.A.), ERK, phospo-ERK, cleaved-Caspase3, Bcl-2, Total Ras 1:3000(cell signaling, Thecnology, Inc. Beverly, MA., U.S.A.), Neurofibromin, β-actin 1:3000(Santa Cruz Biotechnology, INC, U.S.A.), 2 차 항체로는 peroxidase 가 conjugation 된 goat anti-rabbit antibody, goat anti-mouse antibody 1:5000 (Santa cruz Biotechnology, INC, USA)를 이용하여 반응시킨 뒤, WEST-ZOL Plus (iNtRON Biotechnology, KOREA)를 처리하여 필름에 현상하였다.
D. Ras activation assay
Ras activation assay kit(Upstate Biotech. Lake Placid, NY)는 kit 의 실험방법에 따라 사용되었다. assay 는 cell lysate 로부터 Ras-GTP 를 분리하기 위하여 affinity precipitation 을 이용하였다. cell lysate 는 Raf-1 RBD fusion 단백질을 결합한 agarose 와 함께 incubation 하였다. agarose bead 는 centrifuge 하여 모은 후 lysis buffer 로 washing 하였다. 최종적으로 sample buffer 를 첨가하여 95℃에서 5 분간 가열 후 Western blotting 을 실행 하였다.
E. Total RNA 추출 및 cDNA 합성
배양한 세포에서 Trizol™ reagent(Invitrogen Co., U.S.A.)를 이용하여 RNA 를 추출하고, 그 중 RNA 3 ㎍을 이용하여 DNase I(Invitrogen Co.,
9
U.S.A.) 3U 을 처리하여 남아있는 gDNA 를 제거한 후 cDNA 를 합성하였고, 합성한 cDNA 를 이용하여 PCR 로 증폭하여 확인하였다. 사용한 primer 는 RNA 가 PCR 의 주형이 될 수 없으며, intron 영역은 gDNA 에만 존재하는 특성을 이용하여 제작하였다. PCR 결과 gDNA 가 완전히 제거된 것으로 확인이 된 RNA 를 TransScriptII Reverse Transcriptase PCR Kit(Qiagen, U.S.A.)를 이용하여 cDNA 를 합성하였다. Xenograft mouse 에서 적출한 종양의 경우 Homogenizer 를 사용하여 종양을 분쇄한 후 Trizol™ reagent(Invitrogen Co., U.S.A.)를 이용하여 RNA 를 추출하여 위와 같은 방법으로 cDNA 를 합성하였다.
F. Quantitative PCR (qPCR)
배양한 세포에서 total RNA 를 추출하여, 합성한 cDNA 를 주형으로 하여 유전자 특이 primer 를 사용하여 PCR 로 증폭하였다. 이때 Double Strand DNA 에 결합하여 형광을 나타내는 STBR Green(TaKaRa, Shiga, Japan)를 cDNA(150 ng)에 첨가 하여 형광강도를 ABI Prism 7000 Sequence Detection System(Applied Biosystems; Foster City, CA, U,S,A)로 측정하였다. 사용한 primer sequence 는 아래 표와 같다.
Human Fw 5'-CGT TCT TTG GGC TCA GTC TC-3' Rv 5'-CTG AAG CCT TGG AAA AGT CG-3' Mouse Fw 5'-GAG GGG TGG TAA AGG ACG C-3'
Rv 5'-GGA GGG CTC CAT TAA TGC TGA A-3'
G. Cell viability assay
D-Plus™ CCK cell viability assay kit(DonglinLS, Korea)를 사용하여 cell viability 를 측정하였다. 96-well plate 에 cell(7×10³)을 배양하여 약물을 처리 24 시간 후 CCK(10 μl)를 첨가된 media(100 μl)로 바꾸어 주고
10
2 시간 incubation 하여 450 nm 로 ELISA microplate reader (Bio-Rad Model 680)를 이용하여 측정하였다. H. Xenograft mouse 제작 8 주령 mouse 에 S462 cell 을 1,000 rpm 으로 5 분 원심분리하여 상층액을 제거한 후 PBS 에 1 × 107 cells/ml 로 준비한 후, 우측 등부위의 피하에 0.1 ml/head 씩 투여하여 이식하였다. 종양의 부피를 측정하여 약 80~120 𝑚𝑚3 에 도달한 개체를 선별하고, 종양의 부피 및 체중을 기초로 하여 균등하도록 군분리하였다. 관찰기간 동안 주 2 회, 캘리퍼스(caliper)를 사용하여 종양의 장축(maximum length, L)과 단축(perpendicular width, W)을 측정하고, 다음의 계산식에 대입하여 종양의 부피(tumor volume, TV)를 계산하였다.
TV(𝑚𝑚3) = 𝐿(𝑚𝑚) × 𝑊2(𝑚𝑚2) ×1
2
I. 항암제 및 short interfering RNA(siRNA) 투여
Ifosfamide, Etoposide, Carboplatin, Cisplatin, Methotrexate(MTX)의 경우 투여 농도에 따라 생리식염수에 조제하여 복강주사(intraperitoneal injection) 하였으며, Vinblastine 은 농도에 따라 생리식염수에 조제하여 정맥주사 (intravenous injection) 하였다. TNS3 유전자의 발현억제를 위해서 4 종류의 siRNA 를 합성하였다(Cosmogenetech, Korea). Sequence 는 아래 표와 같다. siTNS3 의 경우 5% glucose 용액에 siTNS3(10 μg)와 in vivo -JETPEI(Polyplus, France)를 섞고 15 분간 incubation 후 종양조직에 국부주입(local injection)하였다. 항암제와 siTNS3 의 투여 방법과 투여 용량은 아래의 Table 1 과 같다.
11
siTNS3 #1 5'-GCC CUU GAC AGG UUU GCA ATT-3'
5'-UUG CAA ACC UGU CAA GGG CTT-3' siTNS3 #2 5'-GGU CCC AAC ACU UGU ACA ATT-3'
5'-UUG UAC AAG UGU UCG GAC CTT-3' siTNS3 #3 5'-GGU UGU AGC UCA CCA GUA UTT-3'
5'-AUA CUG GUG AGC UAC AAC CTT-3' siTNS3 #4 5'-CCC AGC AAA GCG TTC AAA CTT-3'
12 Ta b le 1 . S tu d y d e si g n o f th e t re a tm e n t w it h an tic an ce r d ru g s an d s iT NS 3 in t h e NF 1 -a ss o ci ated MP NST m al ig n an t tu m o r x e n o g ra ft m o u s e m o d e l.
13 J. 종양의 적출 및 중량 측정
Mouse 를 CO2 가스로 마취시킨 후, 종양을 적출하여 중량을 측정하였다.
적출된 종양은 다음의 계산식에 대입하여 종양 성장 억제율(tumor growth inhibition rate, IR)을 계산하였다.
IR(%) = (1 – T/C) × 100
T: mean tumor weight of the test substance group and comparative substance group, C: mean tumor weight of the negative control group
K. Fluorescence activated cell sorter(FACS) analysis
세포의 apoptosis가 얼마나 일어났는지 확인하기 위해 Annexin V-PE Apoptosis detection kit(BD Bioscience Pharmigen, USA)을 사용하여 형광표 지세포분리기(Becton Dickinson Bioscience, USA)로 분석하였다. 항암제를 처 리하고 24시간 뒤에 세포를 수집하여, PBS(Phosphate buffered saline)로 2번 washing한 뒤 1X106 의 세포를 1X Annexin V binding buffer(BD Bioscience pharmigen) 400㎕에 부유시킨 후, 100㎕씩 4개의 5㎖ culture tube에 옮기고 Annexin V-PE 를 5㎕씩 넣고 빛이 차단된 실온에서 15분간 염색하였다. 각 각의 tube에 400㎕의 1X Annexin binding buffer를 넣어 가볍게 섞어준 다음, 형광표지세포분석기를 사용하여 측정된 결과를 WinMDI 2.9(Joseph Trotter, Scripps Research Institute, USA)로 분석하였다.
L. Short hairpin RNA(shRNA) construct
pLKO vector 에 cloning 되어 있는 shTNS3 construct Sigma Aldrich, USA)를 구매하여 Lentiviral particle 제작한 후 MPNST cell 인 S462 에
14
infection 하였다. 그 후 selection 을 위해 1 주일동안 puromycin(1 μg/ml) 처리 하였다. shTNS3 construct 의 sequence 는 다음과 같다.
shTNS3
#1
5'-CTC CCA GCA AAG CGT TCA AAC-3'
5'-GTT TGA ACG CTT TGC TGG GAG-3'
shTNS3
#2
5'-CGG GAC TAT GGG AAG GTT GAA-3'
5'-GAG TAA TTC AAC CTT CCC ATA-3'
M. 통계처리
In vitro 그래프의 유의성 검증을 위해 Student’s t-test 를 사용하였다. In vivo 실험에서 얻어진 체중, 종양의 부피 및 종양의 중량은 SAS(Version 9.3, SAS Institute Inc., USA)를 사용하여 검정하였다. 체중, 종양의 부피 및 종양 의 중량은 Bartlett test 를 실시하여 등분산성을 검정하였다(유의수준: <0.05). 등분산성인 경우 one-way analysis of variance(ANOVA)를 실시 (유의수준: <0.05) 하여 유의성이 관찰되면 음성대조군에 대한 각 시험군의 유의성을 확 인하기 위해 Dunnett's t-test 의 다중검정을 실시하였다(유의수준: 단측 <0.05 및 <0.01). 등분산성이 기각되면 Kruskal-Wallis test 를 실시(유의수 준: <0.05)하여 유의성이 관찰되면 음성대조군에 대한 각 시험군의 유의성을 확인하기 위해 Steel’s test 의 다중검정을 실시하였다.
15 III. 결과
A. 환자 유래 종양조직에서 과발현 되어있는 TNS3 유전자 발굴
악성종양으로 수술 받은 3 명의 NF1 환자의 수술 조직에서 H&E staining 과 Swann cell 및 fibroblast cell 마커인 S100 항체를 이용한 IHC(immunohistochemistry), phosphorylated-EGFR 항체(악성에서 발현량이 높음)를 이용한 IHC 실험을 통해 정상(normal)조직, 양성종양(benign tumor)조직, 악성종양(malignant tumor)조직을 병리학적으로 검증함(Table 2, Figure 4).
Table 2. Histological features of the three patients with NF1-associated MPNSTs. 환자 성별 진단나이 조직학적 판독 NF1 돌연변이 H&E S100 pEGFR P1 남 32 Normal + - c.4861_4862GT>AG Malignant + ++ P2 남 12 Benign + + c.4537C>A 20 Malignant + ++ P3 남 21 Benign + + c.6792C>A 23 Malignant + ++
16
Figure 4. Results of immunohistochemistry with the anti-phosphorylated-EGFR antibody in normal, benign, and malignant tumor tissues from NF1 patients. Paraffin-embedded tissue sections of normal, benign, and malignant tumor tissues from three patients with NF1 were stained with the anti-pEGFR antibody (viewed at 400×).
17
다양한 세포가 혼재된 조직이 아닌, 동일한 유형의 세포에서 유전자 발현을 분석하기 위해, 3 명의 환자 수술조직으로부터 분리한 정상조직, 양성종양 조직(PN), 악성종양 조직(MPNST)에서 primary fibroblast 세포를 분리· 배양하였다. Primary 배양 세포에서 추출한 RNA 로부터 합성한 cDNA 를 이용하여 next-generation sequencer(NGS)를 이용한 whole-genome RNA sequencing(RNA-seq)을 통해 유전자의 발현량을 비교·분석하였으며, whole-genome DNA methylation chip array 를 통해 정상과 악성 또는 양성과 악성 세포 간의 유전자의 promoter 영역의 CpG island 의 methylation 차이를 분석하였다. 악성세포에서 발현량이 명확하게 up-regulation 또는 down-regulation 되는 유전자를 분석하였으며, 3 명의 환자 샘풀에서 공통적으로 변화가 있는 유전자로서 TNS3, EGFR, BCL2L1, IFITM1, NF1 의 5 종의 유전자를 발굴하였다(Table 3). 본 연구에서는 TNS3 유전자에 초점을 맞추어 연구를 진행하였다. TNS3 유전자는 3 명 모두의 악성종양세포에서 methylation 이 현저히 감소하였으며, 또한 RNA-seq 결과에서도 TNS3 mRNA 의 발현량이 악성세포에서 크게 증가하였다.
18
Table 3. Description of significant genes that are differentially expressed in primary MPNST cells from patients with NF1.
유전자 NF1 악성 종양에서의 발현 패턴 코드하는 단백질 기능 TNS3 regulation up-tensin-like SH2 domain containing 1 (tensin 3) Actin remodeling에 관여하는 단백질로 서 다양한 암에서 과발현 되어 있음이 밝혀짐. promoter 영역의 methylation 에 의한 발현조절이 보고되어 있음. Tensin 3는 Rho GTPase signalling과 cell adhesion 조절에 대해 밝혀져 있으 며, Src 에 의해 인산화(활성화)되어 종 양의 악성화에 관여하는 것으로 알려져 있음.
EGFR regulation
up-epidermal growth factor
receptor
세포 표면에 존재하는 단백질로서 암에 서 과발현 되어 있음이 밝혀져 있음. 특 히, cancer cell의 growth, motility, invasion, metastasis 에 관여하고 있음 이 알려져 있음. BCL2L1 regulation up-anti-apoptotic protein BCL2-like 1 (Bcl-xL) 미토콘드리아 매개의 세포자멸사 (apoptosis)에 관여하는 단백질로서 많 은 암세포에서 과발현 되어 암세포의 사 멸 억제와 항암제내성 등에 영향을 끼치 는 것으로 잘 알려져 있음.
IFITM1 regulation
down-interferon induced transmembrane protein 1 바이러스 감염 시의 대응기작으로서의 역할이 잘 알려진 단백질로서, 암의 종 류에 따라 암에서 발현이 증가 또는 감 소된다는 상반된 보고가 있음.
NF1 regulationdown- neurofibromin 1
NF1 환자의 원인 유전자로서 많은 NF1 유전자 돌연변이가 발견됨. GTP-Ras의 inactivation에 관여하는 tumor suppressor 단백질 임. NF1의 악성세 포에서 한쪽 allele의 mutation과 더불 어 정상 allele의 발현이 감소되게 되어 있음.
19 B. MPNST 세포주에서 TNS3 발현량 분석
다양한 NF1-연관 MPNST 세포주에서 TNS3 발현량 변화를 조사하기 위해 normal human Swann cell line 인 HSC 세포와 MPNST cell line 인 sNF02.2, sNF96.2, S462 세포에서 qPCR 을 시행하였다. 실험한 3 종의 MPNST 세포주 모두에서 TNS3 의 발현량이 HSC 세포주 보다 증가하였으며, 특히 S462 cell 에서 큰 차이를 보였다(Figure 5A). S462 cell 에서 Western blotting 으로 Tensin 3 단백질량을 비교·분석한 결과에서도 Tensin 3 의 발현량이 높은 것을 확인하였다(Figure 5B).
20
Figure 5. Comparison results of TNS3 mRNA (A) and Tensin 3 protein (B) levels among the NF1-associated MPNST cell lines. The total RNAs of human Swann cells (HSCs) and three NF1-associated MPNST cells— sNF02.2, sNF96.2, and S462—were purified, and cDNAs were synthesized. Quantitative real-time PCR was conducted with TNS3 gene-specific primers. Total cell lysate was prepared from S462 cells, and Western blotting was performed with the anti-Tensin 3 antibody. *, **: P<0.05, 0.01 vs. HSC.
21
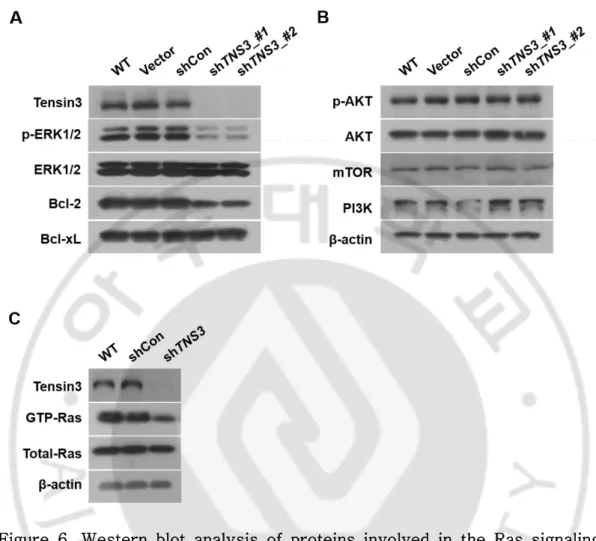
C. MPNST 세포에서 TNS3 knockdown 시의 Ras signaling pathway 관련 단백질 발현 양상 분석
2 종류의 TNS3 shRNA construct 를 S462 cell 에서 사용하여 TNS3
knockdown 하였을 때 Ras signaling pathway 관련 단백질 발현 양상을 조사하였다. Tensin 3 단백질에 대한 Western blotting 결과에서 2 종류의
TNS3 shRNA construct 모두 gene silencing 이 잘 되었음을 확인하였다(Figure 6A).
TNS3 knockdown S462 세포에서 ERK1/2 의 활성화 형태인 phosphorylated ERK1/2(p-ERK1/2) 단백질의 량이 감소하였으며, anti-apoptosis 단백질인 Bcl-2 도 감소하였다(Figure 6A). 하지만, Ras 의 다른 signaling pathway 단백질인 AKT, mTOR, PI3K 의 양적 차이는 보이지 않았다(Figure 3B).
다음은 TNS3 knockdown S462 세포에서 Ras 단백질의 활성화 형태인
GTP-Ras 의 양적 변화를 확인하였다. TNS3 의 발현량이 줄어들었을 때 GTP-Ras 의 양도 함께 감소하는 것을 밝혔다(Figure 6C).
22
Figure 6. Western blot analysis of proteins involved in the Ras signaling pathway in TNS3-knockdown S462 cells. Total cell lysates were prepared from S462 cells infected with shRNA lentiviral constructs, and Western blotting was performed with the antibodies indicated. WT: wild type, Vector: pLKO vector, shCon: shRNA for non-target control sequence.
23
D. TNS3 shRNA 와 항암제의 병용 처리시의 효과 분석
앞 실험에서 TNS3 shRNA 처리에 의해 GTP-Ras, p-ERK1/2 의 감소가 확인되어 TNS3 shRNA 를 항암제와 병용 투여했을 시에 시너지 효과가 있을 것으로 예상되었다. 기존에 MPNST 와 육종(sarcoma) 등에 주로 사용하는 ICE(Ifosfamide, Carboplatin, Etoposide)와 CVM(Cisplatin, Vinblastine, Methotrexate) 항암제를 S462 MPNST 세포에 농도별로 24 시간 처리하여 cell viability 를 분석하여 항암제의 효과를 조사하였다(Figure 7A). 또한 HSC 세포에도 동일한 농도와 시간으로 이들 항암제를 처리하여 정상세포에서의 세포독성을 조사하였다(Figure 7B). 과적으로 정상세포 독성이 적으면 면서 MPNST 세포의 cell viability 억제에 효과적인 것은 Cisplatin, Carboplatin, Etoposide 로 나타났다.
다음은, TNS3 shRNA 와 ICE 및 CVM 항암제의 병용처리시의 시너지 효과에 대해 조사하였다. ICE 의 농도는 S462 세포의 cell 가 50% 정도인 Ifosfamide 1.8 mM, Carboplatin 90 μM, Etoposide 30 μM 로 정하였다(Figure 8A). TNS3
shRNA 단독처리 시에 약 10% 정도의 cell viability 억제효과가 있었으며, ICE 와의 병용 처리시에는 30% cell viability 로 ICE 단독 처리의 50% 보다 더 효과가 있었다(Figure 8B). 정상 HSC 세포에도 동일한 농도로 TNS3
shRNA 와 ICE 를 병용 처리한 결과에서도 cell viability 억제효과가 있었으나, S462 세포와 비교하면 세포 생육억제 효과가 적었다(Figure 8C).
CVM 항암제의 경우에서도 다양한 농도의 Cisplatin 과 Vinblastine 조합에서 CVM 단독처리에 비해 TNS3 shRNA 와 CVM 병용 처리시에 cell viability 억제효과가 더 좋았다(Figure 9A). 정상 HSC 세포에서도 TNS3
shRNA 와 CVM 병용 처리에 의한 cell viability 억제효과가 있었으나, S462 세포와 비교하면 세포 생육억제 효과가 적었다(Figure 9B).
25
Figure 7. Results of the cell viability test of anticancer drugs in NF1-associated MPNST S462 cells and normal Swann cells. Six anticancer drugs—ifosfamide, carboplatin, etoposide, cisplatin, vinblastine, and methotrexate—were used to treat S462 cells (A) and human Swann cells (HSCs) (B) with the indicated concentrations for 24 h. The cell viability was measured in each treated cell, and relative cell viability values normalized to non-treated control cells are shown. *, **: P<0.05, 0.01 vs. Mock.
27
Figure 8. Effects of co-treatment of TNS3 shRNA and ifosfamide, carboplatin, and etoposide (ICE) anticancer drugs on the cell viability of NF1-associated MPNST S462 cells and normal Swann cells. (A) Dose-dependent suppression of the cell viability of S462 cells by ICE. (B, C) Cell viability of single treatment of TNS3 shRNA and ICE (ifosfamide, 1.8 mM; carboplatin, 90 μM; etoposide 30 μM) and co-treatment of TNS3 shRNA and ICE in S462 cells (B) and HSC cells (C) for 24 h. Relative cell viability values normalized to treated control cells are shown. Mock: non-treated cells, shCon: shRNA for the non-target sequence, Puro: puromycin. *, **: P<0.05, 0.01 vs. 0 in A or Mock in B and C. †, ##: P<0.05, 0.01 vs. indicated.
28
Figure 9. Effects of the co-treatment of TNS3 shRNA and cisplatin, vinblastine, and methotrexate (CVM) anticancer drugs on cell viability of NF1-associated MPNST S462 cells and normal Swann cells. Cell viability of a single treatment of TNS3 shRNA and CVM and co-treatment of TNS3
shRNA and CVM in S462 cells (B) and HSC cells (C) for 24 h. Relative cell viability values normalized to non-treated control cells are shown. Mock: non-treated cells, shCon: shRNA for the non-target sequence, Puro: puromycin. *, **, ***: P<0.05, 0.01, 0.01 vs. Mock. ##, ###: P<0.01, 0.001 vs. indicated.
29
E. TNS3 shRNA 와 항암제의 병용 처리시의 apoptosis 효과 분석
TNS3 shRNA 를 ICE(Ifosfamide, Carboplatin, Etoposide)와 CVM(Cisplatin, Vinblastine, Methotrexate) 항암제와 동시에 S462 MPNST 세포에 처리했을 시의 caspase-3 cleavage 가 증가되었으며, GTP-Ras 는 감소되었다(Figure 10). 또한, S462 MPNST 세의 apoptosis 정도를 FACS 를 사용하여 정량한 결과에서도 TNS3 shRNA 와 ICE 또는 CVM 항암제의 동시 처리시에 apoptosis 가 증가 되는 것을 확인하였다(Figure 11).
30
Figure 10. Effects of co-treatment of TNS3 shRNA and ICE or CVM anticancer drugs on caspase-3 and Ras activation of NF1-associated MPNST S462 cells. Cells were treated with TNS3 shRNA or control shRNA with or without ICE (ifosfamide, 1.8 mM; carboplatin, 90 μM; etoposide, 30 μM) or CVM (cisplatin, 3 μg/ml; vinblastine, 10 nM; methotrexate, 300 nM) for 24 h. Cells were harvested and analyzed by Western blotting with caspase-3 and Tensin 3 antibodies (A), and the activated form of GTP-Ras was detected by GTP-GTP-Ras activation assay analysis and Western blotting (B).
31
Figure 11. Effects of co-treatment of TNS3 shRNA and ICE or CVM anticancer drugs on apoptosis of NF1-associated MPNST S462 cells. Cells were treated with TNS3 shRNA or control shRNA with or without ICE (ifosfamide, 1.8 mM; carboplatin, 90 μM; etoposide, 30 μM) or CVM (cisplatin, 3 μg/ml; vinblastine, 10 nM; methotrexate, 300 nM) for 24 h. Cells were harvested and analyzed by a FACS with Annexin V and PE (A), and cells corresponding to early and late apoptosis were counted (B). *: P<0.05 vs. shCon. #: P<0.05 vs. indicated.
32 F. In vivo 실험용 siTNS3의 검증
TNS3 유전자 발현 억제의 효과를 관찰하기위한 in vivo 실험을 위해 TNS3
유전자에 대한 short interfering RNA(siRNA) 4 종류를 제작하여 S462 세포에서 평가하였다. siTNS3 No.2(#2)와 No.4(#4)의 2 종류의 TNS3
siRNA 를 처리한 S462 세포에서 Tensin 3 단백질 발현량이 현저히 감소되었으며, 특히 siTNS3 No.2(#2)의 경우 p-ERK1/2 와 GTP-Ras 감소의 효과가 좋았다(Figure 12). 따라서, 향후의 in vivo 실험에서는 모두 siTNS3 No.2(#2)를 사용하였다.
33
Figure 12. Evaluation of siRNAs for TNS3 knockdown and the effects of the selected siRNA No. 2 on the inhibition of ERK1/2 and Ras activation in NF1-associated MPNST S462 cells. Cells were treated with four different siRNAs (No. 1–4) against the TNS3 gene and cultured for 2 days. Cells were harvested and analyzed by Western blotting with Tensin 3 and ERK1/2 and phospho-ERK1/2 (A) antibodies (A). Cells were treated with siRNAs No. 2 (#2) against TNS3 gene and cultured for 2 days. Cells were harvested and analyzed by Western blotting with ERK1/2 and phospho-ERK1/2, and the activated form of GTP-Ras was detected using GTP-Ras activation assay analysis and Western blotting (B). siCon: siRNA for non-target sequence.
34
G. In vivo실험용 xenograft 마우스 제작 및 siTNS3 효과 평가
NF1 MPNST Schwann 세포(S462)를 누드마우스에 주입하여 NF1 악성종양 xenograft 마우스 모델을 구축하였다. siTNS3(#2)에 cy3를 tagging하여 종 양에 직접 주사(local injection)한 48시간 후에 siTNS3가 종양조직에 제대로 전달되었는지를 형광으로 확인하였고(Figure 13A), 종양을 적출하여 qPCR을 통하여 siTNS3를 주사하지 않은 xenograft 마우스에서 적출한 종양과 TNS3
mRNA의 발현량을 비교하여, siTNS3를 주사에 의한 TNS3 발현 억제를 확인 하였다(Figure 13B).
35
Figure 13. Evaluation of TNS3 siRNA No. 2 for the delivery and knockdown effect of TNS3 mRNA expression by local injection into the tumors in xenograft mice. TNS3 siRNA No. 2 labelled with Cy-3 (40 μg/200 μl) was directly injected into the tumor tissue of NF1-associated MPNST xenograft mouse S462 cells. After 2 days, the mice were scanned using the Fx-Pro fluorescence detection system. TNS3 siRNA was extracted from the injected tumor tissue, and the Tensin 3 protein level was assessed and compared with tumor tissue from non-injected MPNST xenograft mice (negative control; NC) using Western blotting (B). *: P<0.05 vs. NC.
36
H. NF1 악성종양 xenograft 마우스에 TNS3 siRNA 및 항암제의 단독 및 병용 처리 시의 항암 효과 분석
TNS3 siRNA(#2), ICE(Ifosfamide, Carboplatin, Etoposide) 항암제, CVM(Cisplatin, Vinblastine, Methotrexate) 항암제를 단독 또는 병용 처리하여 43 일간 사육하면서 종양의 부피와 형태를 관찰하여 항암효과를 조사하였다. TNS3 siRNA, ICE, CVM 3 가지 모두에서 종양 부피, 종양 무게, 종양 크기 등이 대조군에 비해 유의하게 적은 항암효과가 나타났으며, TNS3
siRNA+ICE 와 TNS3 siRNA+CVM 의 병용투여 시에 더 확실한 항암효과가 관찰되었다(Figure 14, Figure 15). 3 주간의 TNS3 siRNA 처리기간 이후에도 종양의 크기가 증가하지 않고 계속 유지되었다.
적출된 종양의 크기에서도 TNS3 siRNA+ICE 와 TNS3 siRNA+CVM 의 병용투여 군에서 가장 작았다(Figure 16). 이러한 결과는, TNS3 유전자 발현 억제가 ICE, CVM 의 NF1 악성종양에 대한 항암 효과를 증가시키는 시너지 작용한다는 사실을 시사한다.
38
Figure 14. Antitumor effects of single and combination treatments of TNS3
siRNA and ICE or CVM anticancer drugs on tumor volume and weight in NF1-associated MPNST xenograft mice. TNS3 siRNA No. 2 and ICE (ifosfamide, 1.8 mM; carboplatin, 90 μM; etoposide, 30 μM) or CVM (cisplatin, 3 μg/ml; vinblastine, 10 nM; methotrexate, 300 nM) were injected by single or combination injections, as described in the Material and Methods section, with local injection into tumor tissues and intravenous injection or intraperitoneal injection of NF1-associated MPNST xenograft mice (n = 8 in each group). Mice were fed for 43 days. The tumor volumes in each group were calculated every 3 or 4 days (A, D), and after sacrificing the mice on the 43rd day, tumors were removed, and their volumes (B, E) and weights (C, F) were measured. *, **: P<0.05, 0.01 vs. NC. #, ##: P<0.05, 0.01 vs. indicated.
39
Figure 15. Representative pictures of NF1-associated MPNST xenograft mice administered TNS3 siRNA and/or ICE or CVM anticancer drugs. TNS3
siRNA No. 2 and ICE or CVM were injected by single or combination injections as described in the Material and Methods section. Mice were fed for 43 days, and after sacrificing them, pictures including the tumor morphology were taken; representative pictures of two mice in each experimental group were observed.
40
Figure 16. Representative pictures of tumors removed from NF1-associated MPNST xenograft mice administered TNS3 siRNA and/or ICE or CVM anticancer drugs. TNS3 siRNA No. 2 and ICE or CVM were injected by single or combination injections, as described in the Material and Methods section. Mice were fed for 43 days, and after sacrificing them, the tumors were extracted, and representative pictures of three mice in each experimental group were observed.
41 VI. 고찰 NF1은 가장 유병률이 높은 유전질환중의 한가지임에도 불구하고 국내에서는 NF1을 전문적으로 연구하는 연구자는 거의 없는 실정이다. 국외에서는 유전학 적인 접근에 의한 유병률 조사, 임상증상의 다양성 분석, 유전자 돌연변이 및 염색체 이상에 대한 분석 등의 연구, 분자세포생물학적인 접근에 의한 NF1의 발병 및 악성화 기전 및 관여 단백질 발굴 및 기능 분석 등의 연구, 다양한 약 제를 이용한 치료제(1, 2, 3상의 임상시험) 및 치료법 개발에 대한 연구가 최근 활발히 진행되고 있으며, NF1에 대한 연구논문이 매우 많이 보고되고 있다 (Barquero et al., 2015; Kresak and Walsh, 2016; Rad and Tee, 2016) 2015).
NF1에 대한 임상적 연구로는 미국 국립보건원에서 화학치료요법에 대한 2-3단계의 임상시험(R115777약제-임상 제 2-3단계, pirfenidone약제-임상 제 3단계, tipifarnib약제-임상 제 2-3단계, methotrexate약제-임상 제 2-3단계 등)을 진행하고 있으나 기대만큼의 큰 효과가 보고되지 않고 있다(Plotkin et al., 2013; Gutmann, 2014; Karajannis and Ferner, 2015).
최근 NF1의 종양형성과 악성전개의 기전 규명에 대한 연구로서 DNA methylation 변화,micro RNA(miRNA) 발현 변화 등의 후성유전적인 변이 에 대한 연구가 활발히 진행되고 있다(Masliah-Planchon et al., 2013; Farid et al., 2014; Nobeyama and Nakagawa, 2016).
본 연구에서, 환자 유래의 종양조직 및 primary cell 을 이용한 전장유전체 분석, methylation 분석 및 유전자 발현분석 연구에서, 핵심적인 치료 타깃 분자로서 TNS3(tensin-like SH2 domain containing 1, Tensin 3)를 발견하였다. TNS3 는 NF1 의 악성종양 조직 및 세포에서 과발현 (hyperexpression)되어 있으며, 상의 Schwann 세포(HSC)와 NF1 악성종양 Schwann 세포주(S462)에서의 Tensin 3 단백질과 TNS3 mRNA 발현량을 비교 한 결과, 악성에서 TNS3 유전자의 발현이 증가 되어 있음을 확인하였다.
42
TNS3 은 염색체 7p 12.3 에 위치하고 있으며 307 kb 의 genomic DNA 로 구성되어 있고 1,445 개의 아미노산으로 구성된 155 kDa 의 단백질을 cording 하고있다(Cui et al., 2004). 이러한 TNS3는 actin binding 과 integrin 결합에 연관이 있는 domain 을 N-terminal 과 C-terminal 에 가지고 있어 cell migration, adhesion 에 영향을 준다고 알려져 있다(Lo, 2004; Qian et al., 2009a; Haynie, 2014). Tensin 3 는 Rho GTPase signaling 과 cell adhesion 조절에 대해 밝혀져 있으며(Blangy, 2017a; Vess et al., 2017), Src 에 의해 인산화(활성화)되어 종양의 악성화에 관여하는 것으로 알려져 있다(Qian et al., 2009b).
Tensin 3 단백질은 focal adhesion molecule 중 하나로 세포 부착의 조절에 필수적인 역할을 하며 세포 외 기질 접착물에 신호 분자를 수집하기 위한 발판으로 주로 사용되고 Rho GTPase 활성화 단백질인 DLC1(deleted in liver cancer 1)을 RhoA 로부터 분리하여 GTPase RhoA 의 활성을 증가 시킨다(Cao et al., 2012; Hodge and Ridley, 2016; Blangy, 2017b). RhoA 의 경우 많은 악성 종양과 위암에서 과발현 되어있는 것으로 밝혀져 있으며 약물의 효능에 영향을 주며 이를 이용 하여 anti-cancer 유전자 치료에 적용될 수 있다고 보고되었다(Doublier et al., 2008; Schmidt et al., 2012). 최근 TNS3 가 다양한 cancer 에서 관련이 있다고 보고되고 있다(Creekmore et al., 2007; Corté et al., 2012; Veß et al., 2017).
NF1의 MPNST에 대한 전임상 및 임상시험에 대한 다양한 시도가 있다 (Kim et al., 2017; Staedtke et al., 2017). ICE(Ifosfamide, Carboplatin, Etoposide)를 이용한 sarcoma에 대한 임상시험도 시도 되고있으며(Lafay-Cousin et al., 2016; Watanabe et al., 2017), Ifosfamide를 이용한 MPNST 임 상시험(Hirbe et al., 2017)과 내성이 있는 환자에게 Carboplatin으로 치료 후 Etoposide를 처방하였을 때 큰 효과를 보였다는 보고가 있다(Steins et al., 2002). 또한, CVM(Cisplatin, Vinblastine, Methotrexate)을 이용한 항암 임상
43
시험도 보고 되고 있다(International Collaboration of et al., 2011; Galsky et al., 2015). 본 연구에서 사용한 TNS3 siRNA는 ICE 또는 CVM와 병용하여 NF1 MPNST 세포나 NF1 악성종양 xenograft 마우스에 처리하였을 때 매우 좋은 항암 효과가 있었다. 특히, xenograft 마우스 실험에서 TNS3 siRNA 단독 처 리에서도 뛰어나 항암 효과가 나타났으며(Figure 14-16), 항암제 처리 없이 3주간의 TNS3 siRNA 처리기간 이후에도 종양의 크기가 증가하지 않고 계속 유지되었기 때문에 TNS3 siRNA는 ICE나 CVM 항암제의 효과 증대의 시너지 효과뿐만 아니라 악성종양의 장기간의 증식 억제작용 효과도 있는 것으로 생각 된다. TNS3 siRNA의 이러한 효과는 매우 빠른 속도로 증식하는 NF1 돌연변 이에 의한 MPNST의 새로운 치료제로서 활용성이 높을 것으로 기대된다.
44 V. 결론
3명의 신경섬유종증 제1형(NF1) 환자의 악성종양조직과 NF1 유전자 돌연변 이가 있는 악성종양세포주에서 공통으로 발현량이 현저하게 증가되어 있는
TNS3 유전자를 발굴하였다. Short hairpin RNA(shRNA)를 사용한 TNS3 유
전자의 발현 억제로 인해 NF1 종양의 악성화에 중요한 역할을 하는 Ras signaling pathway에 관여하는 Ras와 ERK1/2의 활성화 억제가 나타나기 때
문에 TNS3 유전자는 NF1 악성종양의 치료 타겟 분자의 좋은 후보가 될 것으
로 사료된다.
NF1 악성종양 xenograft 마우스에 TNS3 short interfering RNA(siRNA)를 ICE(Ifosfamide, Carboplatin, Etoposide)와 CVM(Cisplatin, Vinblastine, Methotrexate) 항암제와 병용으로 투여하였을 시에 명확한 항암효과가 나타났으며, 이러한 결과는 TNS3 유전자 발현 억제를 통한 향후의 새로운 NF1 악성종양 치료제 개발에 유용한 자료로 활용될 수 있을 것으로 기대된다.
45 참고문헌
1. Agarwal AK, Gupta S, Guha G: Large plexiform neurofibroma: Unusual cause for blindness. PAKISTAN JOURNAL OF MEDICAL SCIENCES 23: 777, 2007
2. Barquero LA, Sefcik AM, Cutting LE, Rimrodt SL: Teaching reading to children with neurofibromatosis type 1: a clinical trial with random assignment to different approaches. Dev Med Child Neurol 57: 1150-1158, 2015
3. Blangy A: Tensins are versatile regulators of Rho GTPase signalling and cell adhesion. Biol Cell 109: 115-126, 2017a
4. Blangy A: Tensins are versatile regulators of Rho GTPase signalling and cell adhesion. Biology of the Cell 109: 115-126, 2017b
5. Cao X, Voss C, Zhao B, Kaneko T, Li SS-C: Differential regulation of the activity of deleted in liver cancer 1 (DLC1) by tensins controls cell migration and transformation. Proceedings of the National Academy of Sciences 109: 1455-1460, 2012
6. Cichowski K, Jacks T: NF1 tumor suppressor gene function: narrowing the GAP. Cell 104: 593-604, 2001
7. Corté H, Manceau G, Blons H, Laurent-Puig P: MicroRNA and colorectal cancer. Digestive and liver disease 44: 195-200, 2012 8. Creekmore AL, Ziegler YS, Bonéy JL, Nardulli AM: Estrogen
receptor α regulates expression of the breast cancer 1 associated ring domain 1 (BARD1) gene through intronic DNA sequence.
Molecular and cellular endocrinology 267: 106-115, 2007
46
phosphorylation of a novel tensin family member, tensin3. Molecular cancer research 2: 225-232, 2004
10. DeFazio MV, Ter Louw RP, Attinger CE, Barbour JR: Management of advanced plexiform neurofibromatosis of the foot presenting with skeletal deformation and intractable pain: An indication for proximal amputation. The Foot 25: 30-35, 2015
11. Dilworth JT, Kraniak JM, Wojtkowiak JW, Gibbs RA, Borch RF, Tainsky MA, Reiners JJ, Jr., Mattingly RR: Molecular targets for emerging anti-tumor therapies for neurofibromatosis type 1.
Biochem Pharmacol 72: 1485-1492, 2006
12. Doublier S, Riganti C, Voena C, Costamagna C, Aldieri E, Pescarmona G, Ghigo D, Bosia A: RhoA silencing reverts the resistance to doxorubicin in human colon cancer cells. Molecular Cancer Research
6: 1607-1620, 2008
13. Elgendy A, Alshawadfy E, Ali E, Altaweel A: Piebaldism Associated with Neurofibromatosis Type I: A Case Report. J Clin Exp Dermatol Res 6: 2, 2015
14. Farid M, Demicco EG, Garcia R, Ahn L, Merola PR, Cioffi A, Maki RG: Malignant peripheral nerve sheath tumors. Oncologist 19: 193-201, 2014
15. Feldkamp MM, Angelov L, Guha A: Neurofibromatosis type 1 peripheral nerve tumors: aberrant activation of the Ras pathway.
Surg Neurol 51: 211-218, 1999
16. Ferner RE: Neurofibromatosis 1. European Journal of Human Genetics 15: 131-138, 2007
17. Galsky MD, Pal SK, Chowdhury S, Harshman LC, Crabb SJ, Wong YN, Yu EY, Powles T, Moshier EL, Ladoire S, Hussain SA, Agarwal N,
47
Vaishampayan UN, Recine F, Berthold D, Necchi A, Theodore C, Milowsky MI, Bellmunt J, Rosenberg JE, Retrospective International Study of Cancers of the Urothelial Tract I: Comparative effectiveness of gemcitabine plus cisplatin versus methotrexate, vinblastine, doxorubicin, plus cisplatin as neoadjuvant therapy for muscle-invasive bladder cancer. Cancer 121: 2586-2593, 2015 18. Gottfried ON, Viskochil DH, Fults DW, Couldwell WT: Molecular,
genetic, and cellular pathogenesis of neurofibromas and surgical implications. Neurosurgery 58: 1-16; discussion 11-16, 2006 19. Gupta V, Sabri K, Whelan KF, Viscardi V: Rare case of optic pathway
glioma with extensive intra-ocular involvement in a child with neurofibromatosis type 1. Middle East African journal of ophthalmology 22: 117, 2015
20. Gutmann DH: The neurofibromatoses: when less is more. Human Molecular Genetics 10: 747-755, 2001
21. Gutmann DH: Eliminating barriers to personalized medicine: learning from neurofibromatosis type 1. Neurology 83: 463-471, 2014 22. Haynie DT: Molecular physiology of the tensin brotherhood of
integrin adaptor proteins. Proteins: Structure, Function, and Bioinformatics 82: 1113-1127, 2014
23. Hirbe AC, Cosper PF, Dahiya S, Van Tine BA: Neoadjuvant Ifosfamide and Epirubicin in the Treatment of Malignant Peripheral Nerve Sheath Tumors. Sarcoma 2017: 3761292, 2017
24. Hodge RG, Ridley AJ: Regulating Rho GTPases and their regulators.
Nature reviews Molecular cell biology, 2016
25. Holtkamp N, Mautner V-F, Friedrich RE, Harder A, Hartmann C, Theallier-Janko A, Hoffmann KT, von Deimling A: Differentially
48
expressed genes in neurofibromatosis 1-associated neurofibromas and malignant peripheral nerve sheath tumors. Acta neuropathologica
107: 159-168, 2004
26. Huson SM, Harper PS, Compston DA: Von Recklinghausen neurofibromatosis. A clinical and population study in south-east Wales. Brain 111 ( Pt 6): 1355-1381, 1988
27. International Collaboration of T, Medical Research Council Advanced Bladder Cancer Working P, European Organisation for R, Treatment of Cancer Genito-Urinary Tract Cancer G, Australian Bladder Cancer Study G, National Cancer Institute of Canada Clinical Trials G, Finnbladder, Norwegian Bladder Cancer Study G, Club Urologico Espanol de Tratamiento Oncologico G, Griffiths G, Hall R, Sylvester R, Raghavan D, Parmar MK: International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial. J Clin Oncol 29: 2171-2177, 2011
28. Jeong SY, Han JH, Park YY, Kim HJ: Identification of differentially expressed genes related to NF1-associated malignant transformation from a patient with neurofibromatosis type 1. Genes & Genomics (구 한국유전학회지) 30: 407-418, 2008
29. Johannessen CM, Reczek EE, James MF, Brems H, Legius E, Cichowski K: The NF1 tumor suppressor critically regulates TSC2 and mTOR. Proceedings of the National Academy of Sciences of the United States of America 102: 8573-8578, 2005
30. Karajannis MA, Ferner RE: Neurofibromatosis-related tumors: emerging biology and therapies. Curr Opin Pediatr 27: 26-33, 2015 31. Kim A, Stewart DR, Reilly KM, Viskochil D, Miettinen MM, Widemann
49
BC: Malignant Peripheral Nerve Sheath Tumors State of the Science: Leveraging Clinical and Biological Insights into Effective Therapies.
Sarcoma 2017: 7429697, 2017
32. Korf BR: Neurofibromatosis. Handbook of clinical neurology 111: 333-340, 2013
33. Kresak JL, Walsh M: Neurofibromatosis: A Review of NF1, NF2, and Schwannomatosis. J Pediatr Genet 5: 98-104, 2016
34. Lafay-Cousin L, Lindzon G, Taylor MD, Hader W, Hawkins C, Nordal R, Laperriere N, Laughlin S, Bouffet E, Bartels U: Successful treatment of primary intracranial sarcoma with the ICE chemotherapy regimen and focal radiation in children. J Neurosurg Pediatr 17: 298-302, 2016
35. Leroy K, Dumas V, Martin-Garcia N, Falzone M-C, Voisin M-C, Wechsler J, Revuz J, Créange A, Levy E, Lantieri L: Malignant peripheral nerve sheath tumors associated with neurofibromatosis type 1: a clinicopathologic and molecular study of 17 patients.
Archives of dermatology 137: 908-913, 2001
36. Lo SH: Tensin. The international journal of biochemistry & cell biology 36: 31-34, 2004
37. Masliah-Planchon J, Pasmant E, Luscan A, Laurendeau I, Ortonne N, Hivelin M, Varin J, Valeyrie-Allanore L, Dumaine V, Lantieri L, Leroy K, Parfait B, Wolkenstein P, Vidaud M, Vidaud D, Bieche I: MicroRNAome profiling in benign and malignant neurofibromatosis type 1-associated nerve sheath tumors: evidences of PTEN pathway alterations in early NF1 tumorigenesis. BMC Genomics 14: 473, 2013
50
craniovertebral junction instability. Journal of neurosciences in rural practice 1: 129, 2010
39. Nobeyama Y, Nakagawa H: Aberrant demethylation and expression of MAGEB2 in a subset of malignant peripheral nerve sheath tumors from neurofibromatosis type 1. J Dermatol Sci 81: 118-123, 2016 40. Plotkin SR, Blakeley JO, Dombi E, Fisher MJ, Hanemann CO, Walsh
KS, Wolters PL, Widemann BC: Achieving consensus for clinical trials: the REiNS International Collaboration. Neurology 81: S1-5, 2013
41. Qian X, Li G, Vass WC, Papageorge A, Walker RC, Asnaghi L, Steinbach PJ, Tosato G, Hunter K, Lowy DR: The Tensin-3 protein, including its SH2 domain, is phosphorylated by Src and contributes to tumorigenesis and metastasis. Cancer cell 16: 246-258, 2009a 42. Qian X, Li G, Vass WC, Papageorge A, Walker RC, Asnaghi L,
Steinbach PJ, Tosato G, Hunter K, Lowy DR: The Tensin-3 protein, including its SH2 domain, is phosphorylated by Src and contributes to tumorigenesis and metastasis. Cancer Cell 16: 246-258, 2009b 43. Rad E, Tee AR: Neurofibromatosis type 1: Fundamental insights into
cell signalling and cancer. Semin Cell Dev Biol 52: 39-46, 2016 44. Reuter CW, Morgan MA, Bergmann L: Targeting the Ras signaling
pathway: a rational, mechanism-based treatment for hematologic malignancies? Blood 96: 1655-1669, 2000
45. Rhodes SD, Zhang W, Yang D, Yang H, Chen S, Wu X, Li X, Yang X, Mohammad KS, Guise TA: Dystrophic spinal deformities in a neurofibromatosis type 1 murine model. PloS one 10: e0119093, 2015
51
Chromosome 15 Syndrome in a Korean Patient With Café-au-lait Spots. Annals of laboratory medicine 35: 474-476, 2015
47. Rubin JB, Gutmann DH: Neurofibromatosis type 1—a model for nervous system tumour formation? Nature Reviews Cancer 5: 557-564, 2005
48. Schmidt LJ, Duncan K, Yadav N, Regan KM, Verone AR, Lohse CM, Pop EA, Attwood K, Wilding G, Mohler JL: RhoA as a mediator of clinically relevant androgen action in prostate cancer cells. Molecular Endocrinology 26: 716-735, 2012
49. Somnath SR, Desai SM, Chakrabarti S, Sharma S: Case of von Recklinghausen's neurofibromatosis with esophageal neurofibroma.
Saudi Surgical Journal 3: 23, 2015
50. Staedtke V, Bai RY, Blakeley JO: Cancer of the Peripheral Nerve in Neurofibromatosis Type 1. Neurotherapeutics 14: 298-306, 2017 51. Steins MB, Serve H, Zuhlsdorf M, Senninger N, Semik M, Berdel WE:
Carboplatin/etoposide induces remission of metastasised malignant peripheral nerve tumours (malignant schwannoma) refractory to first-line therapy. Oncology reports 9: 627-630, 2002
52. Veß A, Blache U, Leitner L, Kurz AR, Ehrenpfordt A, Sixt M, Posern G: Dual phenotype of MDA-MB-468 cancer cells reveals mutual regulation of tensin3 and adhesion plasticity. J Cell Sci: jcs. 200899, 2017
53. Vess A, Blache U, Leitner L, Kurz ARM, Ehrenpfordt A, Sixt M, Posern G: A dual phenotype of MDA-MB-468 cancer cells reveals mutual regulation of tensin3 and adhesion plasticity. J Cell Sci 130: 2172-2184, 2017
52
Shigemura T, Sumi T, Koike K, Nakazawa Y: Dramatic Reduction in Tumor Size During 5 Months of Pazopanib Therapy in Combination With Ifosfamide, Carboplatin, and Etoposide in an Early Infant With Progressive Soft Tissue Sarcoma. J Pediatr Hematol Oncol 39: 154-156, 2017
55. Wiest V, Eisenbarth I, Schmegner C, Krone W, Assum G: Somatic NF1 mutation spectra in a family with neurofibromatosis type 1: toward a theory of genetic modifiers. Hum Mutat 22: 423-427, 2003 56. Yohay K: Neurofibromatosis types 1 and 2. The neurologist 12:
53 -ABSTRACT-
Roles of TNS3 gene in tumor progression of Neurofibromatosis Type 1
Su Yong An
Department of Medical Sciences The Graduate School, Ajou University
(Supervised by Professor Seon-Yong Jeong)
Neurofibromatosis type 1 (NF1) is one of the most common inherited autosomal dominant disorders. It is caused by a mutation in the NF1 gene, which encodes neurofibromin, a tumor suppressor with Ras-GAP activity that negatively regulates p21-RAS signaling. More than 95% of NF1 patients have benign dermal neurofibromas, while 30–40% of NF1 patients have benign plexiform neurofibromas (PNs) which can undergo malignant transformation to malignant peripheral nerve sheet tumors (MPNSTs).
The malignant tumor progression of PNs to MPNSTs has been observed in approximately 10% of patients with NF1, representing a major cause of mortality in these patients. This study aimed to identify novel genes that are closely involved in tumor progression in NF1, elucidate their roles in tumor progression, and evaluate their potential as the molecular targets for NF1 malignant tumors’ therapeutic treatment.
I screened differentially expressed genes between normal or benign and malignant tissues from patients with NF1 using whole-genome methylation array and next-generation sequencer–based whole RNA sequencing.
54
Several candidate genes were identified, and by reviewing these genes, I selected TNS3 for further studies. This was because the expression alterations of the TNS3 gene have been reported in relation to several tumors, but not NF1 tumors, as well as because the hyperexpression of
TNS3 was found in malignant tumors from all three NF1 patients tested. I found that the mRNA of TNS3 was highly expressed in MPNST cell lines, namely sNF02.2, sNF96.2, and S462; its gene product, Tensin 3, was also upregulated in S462 cells. However, when TNS3 expression was silenced by knockdown with shRNAs, the GTP-Ras and phosphorylated ERK1/2 levels were significantly reduced. Co-treatment of TNS3 shRNA and ifosfamide, carboplatin, and etoposide (ICE) or cisplatin, vinblastine, and methotrexate (CVM) anticancer drugs significantly increased the caspase-3 cleavage and apoptotic cell death, but it decreased Ras and ERK1/2 activation, indicating that TNS3 shRNA synergistically enhances the apoptosis of S462 MPNST cells.
To evaluate the effects of TNS3 shRNA in vivo, I established a xenograft NF1-associated MPNST mouse model by injecting the S462 cells into nude mice. Single and combination treatments of TNS3 siRNA and ICE or CVM anticancer drugs in the MPNST xenograft mice resulted in dramatic decreases in tumor volume, weight, and size, and TNS3 siRNA administration showed synergistic antitumor effects compared with single ICE and CVM treatments. No other phenotypic defects were observed in the mouse groups administered TNS3 siRNA.
Collectively, I found a new candidate TNS3 gene that may play a key role in the malignant tumor progression of NF1. Knockdown of the TNS3 gene led to a significant reduction of Ras and ERK1/2 activation, thereby enhancing MPNST cell apoptosis. Combination treatment of TNS3 siRNA
55
with ICE or CVM in an NF1-associated MPNST xenograft mouse model revealed synergistic, strong antitumor effects. This study may affect the understanding of the mechanisms of malignant transformation and lead to an effective application in the therapeutic treatment for NF1.
_________________________________________________________________________
Key words: Neurofibromatosis type 1 (NF1), autosomal dominant inheritance, NF1 gene, mutation, malignant progression, malignant peripheral nerve sheet tumor, TNS3, xenograft, siRNA, anti-cancer drug