동종 골수간엽줄기세포를 이용한 구조성 동종골의 유합 촉진
가톨릭대학교 의과대학 성빈센트병원 정형외과, 임상의학연구소�
이주엽∙신은영�∙최민혁�∙박종수∙송주현∙강용구
목 적: 구조성 동종골의 표면에 인공적으로 골막을 만들고, 이곳에 동종 골수간엽줄기세포를 부착하여 구조성 동 종골의 유합이 촉진되는지를 알아보고자 하였다.
대상 및 방법: 체중 2.5~3 kg의 New Zealand 토끼 30마리를 대상으로 하였다. 토끼의 대퇴골 간부 1.5~2 cm를 채취하여 구조성 동종골을 만들고, 영하 70도의 냉동고에서 일주일간 보관하였다. 실험군에서는 동일한 크 기의 대퇴골 결손을 만든 후 구조성 동종골을 골수강내 금속정으로 고정하였으며, 그 주위를 동종 골수간엽줄기 세포를 부착한 인공 골막으로 포장하였다. 대조군에서는 세포를 주입하지 않고 인공 골막만을 이용하였다. 동종 골 이식 후 4주, 8주, 12주에 단순 방사선 사진을 촬영하여 신생골의 형성 및 동종골의 유합 여부를 확인하였다.
또한 동종골 이식 후 4주, 8주, 12주에 토끼를 희생시켜 골유합의 정도를 조직학적 검사로 확인하였으며, 이식된 동종 골수간엽줄기세포가 언제까지 생존하는지를 공초점 현미경을 이용하여 확인하였다.
결 과: 4주 및 8주에 촬영한 단순 방사선 사진에서는 두 군 모두 골유합이 이루어지지 않았으나 12주에서는 실험 군의 5마리 중 3마리에서 골유합을 확인하여, 전혀 골유합이 이루어지지 않은 대조군과 차이를 보였다. 조직학적 검사상 동종골 이식 후 4주, 8주, 12주 모두 실험군에서 더욱 많은 신생골 및 골유합 소견을 관찰할 수 있었다.
공초점 현미경에서 PKH로 염색된 동종 골수간엽줄기세포는 8주까지 확인할 수 있었으며, 12주째에는 거의 관찰 할 수 없었다.
결 론: 저자들은 동종 골수간엽줄기세포를 포함한 Gelfoam을 이용한 인공 골막이 구조성 동종골의 유합을 촉진 할 수 있음을 확인할 수 있었다. 향후 골수간엽줄기세포를 포함한 인공 골막은 구조성 동종골의 임상 결과 개선 에 중요한 역할을 할 수 있을 것으로 판단된다.
색인 단어: 구조성 동종골, 골수간엽줄기세포, 골유합
Enhancement of Bone Allograft Incorporation with Allogenic Bone Marrow Mesenchymal Stem Cells
Joo-Yup Lee, M.D., Eun-Young Shin*, Min-Hyeok Choi*, Jong-Soo Park, M.D., Joo-Hyoun Song, M.D., Yong-Koo Kang, M.D.
� Address for Correspondence : Yong-Koo Kang, M.D.
Department of Orthopaedic Surgery, St. Vincent Hospital, 93 Ji-dong, Paldal-gu, Suwon-si, Gyeonggi-do 442-723, Korea
Tel : 82-31-249-7186, Fax : 82-31-254-7186, E-mail : ykang@vincent.cuk.ac.kr
�이 논문은 2005년 성빈센트병원 임상의학연구소 연구비와 2007년 가톨릭세포치료사업단 기초과학연구사업 연 구비에 의하여 이루어졌음.
서 론
광범위 골 결손이 동반된 정형외과 재건 수술에서 골 이식의 필요성은 계속 증가하고 있으며, 현재 미 국 내에서 약 100만 건의 골 이식술이 시행되고 있다
20). 실험적으로나 임상적으로 자가골 이식술이 동종 골 이식술보다 더 좋은 결과를 얻으며 빠른 생착을 얻는다는 것은 잘 알려져 있으나11,19), 악성 골 종양의 광범위 절제술, 인공관절 재치환술 시 광범위한 골 결손, 그리고 심한 외상에 의한 광범위 골 결손이 발 생하였을 때 이것을 치료하는 방법은 구조성 동종골 (structural bone allograft)이 유용한 방법이다.
구조성 동종골은 강도가 강하며, 현재까지 개발된 생적합성 인공 합성물에 비하여 우수한 기계적 특성 을 가지고 있다. 그러나 동종골의 조직 처리과정에 서 필연적으로 모든 세포가 제거되기 때문에 자가골 에 비하여 골 치유 능력이 매우 떨어지는 것이 현실 이다. 더욱이 구조성 동종골은 피질골(cortical bone)로 구성되어 있기 때문에, 해면골에 비하여 골의 재형성이나 신생혈관의 형성 능력이 현저히 부 족하다. 이러한 단점으로 인하여 구조성 동종골 이 식술 후 지연 유합 혹은 불유합, 동종골의 골절, 골 흡수, 감염 등의 합병증이 약 25~40%까지 보고되 고 있다11,13).
Department of Orthopaedic Surgery, Research Institute of Medical Science*, St. Vincent Hospital, the Catholic University of Korea
Purpose: To enhance the structural bone allograft healing with allogenic bone marrow mes- enchymal stem cells seeded into artificial periosteum to offer new strategies to revitalize structur- al bone allografts.
Materials and Methods: Thirty New Zealand white rabbit weighed 2.5~3 kg were divided into two groups. Segmental defect sized 1.5~2 cm was created on the femur, and the defect was filled with structural bone allograft which was stored in the deep freezer for a week. In experi- mental group, allografts were covered with artificial periosteum containing allogenic bone mar- row mesenchymal stem cells, whereas they were not included in control group. Radiographs of each femur were taken postoperatively on the 4th, 8th, 12th weeks to evaluate the progress of bone incorporation. Histologic evaluation was carried out with H & E, and Masson’s Trichrome stains, and presence of the PKH-stained bone marrow mesenchymal stem cells was confirmed with confocal microscopy.
Results: Bony union was not found in both groups at 4th and 8th weeks. At 12th weeks three out of five femurs in experimental group were united radiologically, but no bony union was found in control group. Histologic findings were also confirmed the enhancement of the allograft incorporation in experimental group. The PKH-stained bone marrow mesenchymal stem cells were found in the periosteal tissue at 4th and 8th weeks, but cells were almost disappeared at 12th weeks.
Conclusion: Incorporation of the structural bone allograft could be enhanced if allograft is covered with artificial periosteum (Gelfoam) containing bone marrow mesenchymal stem cells.
Key Words: Structural allograft, Bone marrow Mesenchymal stem cells, Enhancement of bone
healing이식골의 치유는 염증 반응을 거쳐 신생 혈관의 형성, 그리고 골수간엽줄기세포의 침투로 이루어지 며, 이는 골절의 치유 반응과 유사하다. 이중 피질골 은 해면골과는 다른 골재생 과정을 거치는데, 이때 골의 표면을 둘러싸는 골막(periosteum)이 중요한 역할을 한다10). 이 골막 내에는 골모세포로 분화가 가능한 다능성 중배엽 세포(multipotential mesodermal cell)가 존재하고 있으며, 이 세포들 이 피질골의 유합에 필수적인 역할을 담당한다10).
골수간엽줄기세포(bone marrow mesenchy- mal stem cell)는 줄기 세포의 한 종류로, 특별한 조건하에서 골모세포, 연골모세포, 지방세포, 근육 세포 등으로 분화할 수 있음이 알려져 있다15,17). 골 수간엽줄기세포는 골 치유 환경에서 특별한 분화 유 도 없이도 골모세포로 쉽게 분화할 수 있으며, 골수 천자로 쉽게 얻을 수 있고 배양이 쉬워 임상 적용이 용이할 것으로 예상된다.
본 연구의 목적은 구조성 동종골에서 인공적으로 Gelfoam을 이용하여 골막을 만들고, 이곳에 동종 골수간엽줄기세포를 부착하여 구조성 동종골의 생 착이 촉진되는지를 알아보는 것이다. 본 연구를 통 하여 구조성 동종골의 기능을 향상시키고, 불유합 및 골절의 합병증을 감소시킬 수 있는 새로운 방법 을 개발하고자 한다.
대상 및 방법
1. 구조성 동종골의 제조 및 보관
체중 2.5~3 kg의 New Zealand 토끼에 tileta- mine과 zolazepam 과용량을 혈관 주사하여 희생 하였다. 우측 대퇴골의 장축을 따라 외측에 절개선 을 가하고 외측 대퇴광근과 대퇴 이두근 사이로 대 퇴골의 간부를 노출하였다. 노출한 대퇴골의 간부를 전기톱을 이용하여 1.5~2 cm의 길이로 절단하고 원통형의 골편을 얻었다. 골편에 남아있는 연부 조 직을 제거한 후 70% ethanol과 생리 식염수로 세 번 세척하는 등 임상적으로 이용되는 구조성 동종골 의 처리 방법과 동일한 방법으로 골편을 처리하였 다. 처리된 골편은 -70�C에서 동결하여 최소 1주일
이상 보관한 후 이식 실험에 사용하였다.
2. 골수간엽줄기세포의 배양 및 염색
체중 2.5~3 kg의 New Zealand 토끼의 대퇴골과 경골의 근위부와 원위부를 제거하고 골간부에 남아 있는 골수를 10 ml의 α-MEM (Gibco, UK)이 들 어있는 주사기로 추출하였다. 추출한 골수는 70 μm 필터(Falcon, UK)로 걸러 골편을 제거하고, 1,500 rpm에서 5분간 원심 분리를 시행하였다. 얻어진 골 수 세포를 1.5~2.0×106cells/cm2의 밀도로 배양액 (α-MEM, 20% fetal bovine serum, 2 Mm L- glutamine, 100 U/ml penicillin, 100 μg/ml streptomycin)에 넣고 37�C, 습도 95%, CO25%
의 환경에서 72시간 동안 배양하였다. 그 후 부착되 지 않은 조혈 세포는 phosphate buffered saline (PBS)으로 세척하여 제거하고 배양액을 교체하였 다. 3~4일에 한 번씩 배양액을 교체하여 10일째에 세포를 0.25% trypsin과 1 mM EDTA를 이용하여 분리한 후, 일주일 동안 재 배양하여 골수간엽줄기세 포의 밀도가 2.0×106 cells/cm2이 되도록 하였다.
배양한 골수간엽줄기세포는 PKH-26 형광 염색 (PKH-26, Zynaxis Cell Science, Malvern, PA)으로 염색하여 이식 후 조직 내에서 세포의 생존 을 확인할 수 있도록 하였다.
3. 수술 방법
체중 2.5~3 kg의 New Zealand 토끼 30마리를 대상으로 하였다. 토끼를 tiletamine과 zolazepam 으로 마취한 후 우측 대퇴골의 장축을 따라 외측에 절 개선을 가하고 외측 대퇴광근과 대퇴 이두근 사이로 대퇴골의 간부를 노출하였다. 노출한 대퇴골의 간부 를 전기톱을 이용하여 1.5~2 cm의 길이로 절단하여 골 결손을 만들었다. 미리 제조된 구조성 동종골을 상온에서 해동한 후, 만들어진 골 결손부와 동일한 크기로 삽입하고 골수강내 금속정을 이용하여 고정 하 였 다 . 젤 라 틴 기 반 의 스 펀 지 인 Gelfoam� (Pharmacia&Upjohn, Kalamazoo, Michigan) 을 4×3 cm2크기로 절단한 후 골수간엽줄기세포 배
양액에 적셔 세포가 Gelfoam 내로 충분히 흡수되 도록 하였다. 대상 토끼를 15마리씩 두 군으로 나누 고, 실험군 15마리는 골수간엽줄기세포가 부착된 Gelfoam으로 동종골의 주위를 감쌌으며, 대조군 15마리는 PBS에 적신 Gelfoam을 동종골의 주위 에 삽입하였다. 수술한 토끼는 특별한 고정 없이 자 유로운 보행을 허용하였다.
4. 방사선학적 검사
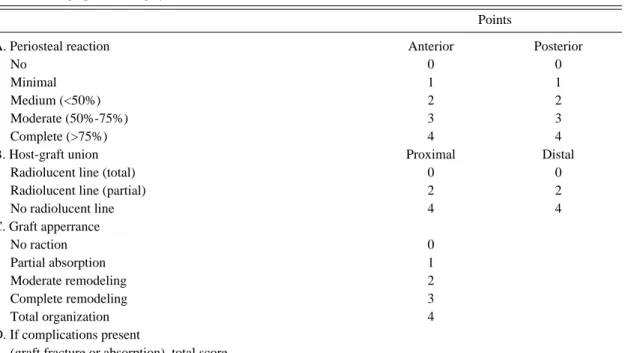
신생골의 형성 및 동종골의 유합 여부를 확인하기 위하여 동종골 이식 후 4주, 8주, 12주에 각 주당 5 마리씩 우측 대퇴골에 대한 단순 방사선 사진을 촬 영하였다. 방사선학적 평가는 Taira 등이 제안한 scoring system을 이용하여 신생골의 형성 정도, 골유합 여부, 이식골의 재형성 정도를 판정하였다18) (Table 1). 골유합은 이식골의 주위로 신생골이 완 전히 덮히고, 자가골과 이식골간의 간격이 소실되는 것으로 정의하였다.
5. 조직학적 검사
동종골 이식 후 4주, 8주, 12주에 각 주당 5마리씩 희생하여 수술한 우측 대퇴골을 노출하고 동종골의 유합 상태를 확인하였다. 전기톱을 이용하여 동종골 의 근위부 및 원위부의 자가골을 절단한 후 동종골 과 주위 연부조직을 포함하여 조직을 채취하였다.
채취한 조직은 10% buffered formaldehyde에 넣은 후, EDTA를 이용하여 5일간 탈회 과정을 시 행하였다. 만들어진 파라핀 블록은 5 μm 의 두께로 잘라 hematoxylin and eosin (H&E)염색 및 Masson’s Trichrome 염색을 시행하여 신생골의 형성 및 동종골의 유합 정도를 조직학적으로 확인하 였다. 또한 공초점 현미경(confocal microscopy) 을 통하여 PKH 형광 염색된 골수간엽줄기세포가 발현되는 정도 및 시기를 확인하였다.
결 과
실험에 사용된 New Zealand 토끼 30마리는 모
Table 1. Radiographic scoring system
Points
A. Periosteal reaction Anterior Posterior
No 0 0
Minimal 1 1
Medium (<50%) 2 2
Moderate (50%-75%) 3 3
Complete (>75%) 4 4
B. Host-graft union Proximal Distal
Radiolucent line (total) 0 0
Radiolucent line (partial) 2 2
No radiolucent line 4 4
C. Graft apperrance
No raction 0
Partial absorption 1
Moderate remodeling 2
Complete remodeling 3
Total organization 4
D. If complications present
(graft fracture or absorption), total score
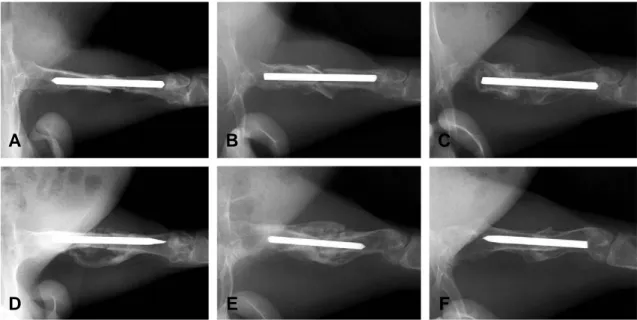
두 실험에 잘 적응하였으며, 실험 도중 사망한 경우 는 없었다. 또한 수술한 토끼는 실험 기간 중 특별한 고정 없이 자유로운 보행이 가능하였고, 창상 감염 이나 골절 등의 합병증은 발견되지 않았다. 단순 방 사선 사진상 실험군에서는 4주째에 동종골의 주위 로 신생골을 확인할 수 있었으나, 대조군에서는 신 생골을 관찰할 수 없었다(Fig. 1A, D). 8주째에는 실험군과 대조군 모두에서 신생골이 형성되었으나 실험군에서 생성된 신생골의 양이 월등히 많음을 알 수 있었다(Fig. 1B, E). Taira 등18)이 제안한 scoring system에 의하면 실험군은 7.2점, 대조군 은 3.2점으로 통계학적으로 의미 있는 차이를 보였 다(p<0.05).
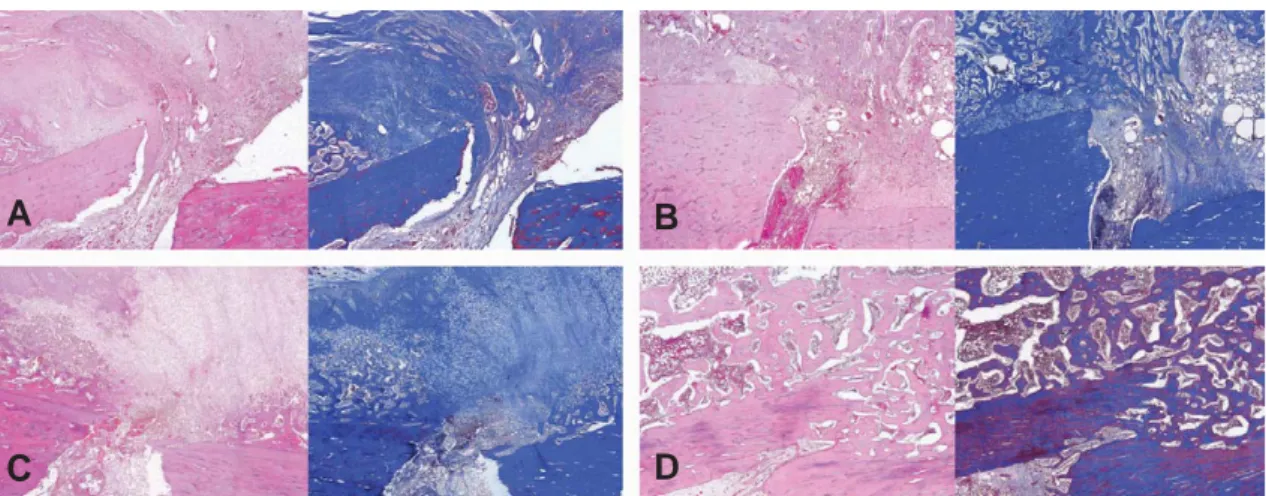
동종골 이식 후 4주 및 8주에 촬영한 단순 방사선 사진에서는 실험군 및 대조군 모두 골유합이 이루어 지지 않았으나, 12주에서는 실험군의 5마리 중 3마 리에서 골유합을 확인할 수 있었다(Fig. 1F). 대조 군에서는 12주째에 골유합이 이루어진 경우는 없었 다(Fig. 1C). 조직학적 검사상 대조군에서는 동종 골의 주위로 전혀 신생골이 형성되지 않았으나 (Fig. 2A), 실험군에서는 4주째부터 동종골의 표면 에 신생골이 형성되었음을 알 수 있었다(Fig. 2B).
고배율에서 동종골의 표면에 형성된 신생골은 섬유 조직과 유사한 형태를 나타내어, 자가 신생골에서 관찰된 연골 조직과는 차이가 있었다. 실험군에서는 8주 및 12주에서도 지속적으로 신생골의 양이 증가 하였고, 12주째에 자가골과 동종골 사이의 골 소주 (bony trabeculi)가 서로 합쳐져 완전한 골유합이 이루어졌음을 확인할 수 있었다(Fig. 2C, D).
공초점 현미경에서 PKH로 염색된 골수간엽줄기 세포는 주로 신생골의 주위에서 많이 관찰할 수 있 었으며(Fig. 3), 이것으로 이식된 골수간엽줄기세 포가 신생골의 형성에 관여하였음을 추정할 수 있었 다. 이식된 골수간엽줄기세포는 동종골 이식 후 8주 까지 확인할 수 있었으며, 4주에 가장 진하게 염색 되었고 시간이 갈수록 감소하여 이식 후 12주째에 는 거의 관찰할 수 없었다.
고 찰
구조성 동종골은 모든 세포가 제거되어 있기 때문 에 골 유합 능력이 떨어지며, 피질골로 구성되어 골 의 재형성이나 신생혈관의 형성 능력이 현저히 부족 하다12). 또한 구조성 동종골은 처리 과정에서 세균
Fig. 1. Radiographs of rabbit femur in control group (A, B, C) and experimental group (D, E, F) showed abundant callus formation (D, E) and bony union (F) in experimental group.
A B C
D E F
오염을 방지하기 위하여 방사선 조사를 시행하고, 장기간의 냉동 보관으로 인하여 동종골의 기계적 성 질을 약화시켜 이식된 동종골의 골절이 흔하게 발생 한다1-3).
동종골의 문제점을 극복하고자 하는 시도는 크게 세 가지로 구분할 수 있다. 첫째, 골수간엽줄기세포 를 투여하여 골 유합을 증가하려는 시도이다7). Bruder 등4)은 쥐의 대퇴골에 8 mm의 골 결손을 만들고, 이곳에 수산화인회석(hydroxyapatite)과
골수간엽줄기세포를 삽입하여 결손부의 치유가 가 능함을 보였다. 또한 Bruder 등5)은 추가적인 연구 에서 자가 골수간엽줄기세포를 부착한 수산화인회 석을 삽입한 결과 4주에 신생골이 형성되고, 8주 및 12주에 골유합이 이루어짐을 관찰하였다. 두번째 시도는 골 형성 단백질(bone morphogenic pro- tein, BMPs)등의 골 유도 인자를 주입하는 시도이 다. 이러한 시도는 척추 유합술이나 장관골의 불유 합에서 이미 임상적인 연구가 시행되고 있다6,9). 최 근의 연구에서 초기의 결과는 효과적인 것으로 나타 나고 있지만, 적절한 골 형성 단백질의 용량이나 반 감기 등에 대한 추가적인 연구가 필요한 상태이며, 특히 비용적인 측면이 문제점으로 제기되고 있다.
세 번째 시도는 골 유합에 관여하는 유전자를 주입 하려는 시도이다. Chen 등8)은 adeno-associat- ed virus (AAV)를 전달자로 이용하여 BMP-2 유 전자를 쥐의 근육내에 주입하고 3주 후에 이소성 골 이 발생함을 보고하였다. 그러나 이 시도 역시 유전 자의 방출 정도를 조절할 수 있어야 하며, 전달자로 이용되는 바이러스의 안전성 문제도 넘어야 할 과제 로 아직 임상적으로 적용하기에는 무리가 있다.
본 연구에서는 골수간엽줄기세포를 이용하여 구 조성 동종골의 생착이 촉진되는지를 알아보고자 하 였다. 골수간엽줄기세포는 골 치유 환경에서 특별한 분화 유도 없이도 골모세포로 쉽게 분화할 수 있으 Fig. 2. Histologic findings of allograft-host bone interface with H & E (left) and Masson’s Trichrome stains (right).
In control group (A), periosteal callus formation is not found on the allograft surface. In experimental group (B, C, D), abundant callus formation and bridging trabeculi are seen. (×40)
A B
C D
Fig. 3. Confocal microscopy showed PKH-stained allo- genic bone marrow mesenchymal stem cells (BMSCs). Cell membrane of BMSCs is stained red with PKH fluorescence. (× 200)
며, 골수 천자로 쉽게 얻을 수 있고 배양이 쉬워 임상 적용이 용이할 것으로 예상하였다. 또한 자가 세포 를 채취하여 배양한다면 임상적으로 적용하기 위한 안전성 문제도 극복할 수 있을 것으로 판단하였다.
골수간엽줄기세포를 장기간 골 표면에 부착시키 기 위한 전달 물질로 Gelfoam을 이용하였다.
Gelfoam 은 동종골의 표면을 감싸기에 적합하도록 잘 휘어지며, 생체 내에서 안전하고, 또한 시간이 지 나면 생체 내에서 흡수되므로 세포의 전달자로 매우 이상적이다. Ponticiello 등16)은 3주간 배양한 골수 간엽줄기세포를 Gelfoam에 부착하여 토끼의 관절 연골이 재생됨을 확인하였고, 이때 Gelfoam 은 면 역 반응이나 이물 반응 없이 2개월 이내에 생체에서 완전히 분해된다고 하였다.
골수간엽줄기세포를 이용한 장관골 불유합에 대 한 연구는 많이 진행되어 있으나, 실제 임상에서 문 제가 되는 구조성 동종골의 생착을 촉진하는 연구는 매우 드문 실정이다. Lucarelli 등14)은 양을 이용한 구조성 동종골의 연구에서 골수간엽줄기세포와 혈 소판 포함 혈장(platelet-rich plasma)을 구조성 동종골의 골수강내에 주입하여 골 유합을 촉진할 수 있다고 하였다. 그러나 실제 임상에서 구조성 동종 골의 골수강내에 세포를 주입하여 지속적으로 유지 하는 것은 매우 어려울 것으로 판단된다. 본 연구에 서는 Gelfoam을 사용하여 동종골의 표면에 인공 골막을 만드는 개념을 도입하였으며, 동종골 이식 후 8주째까지 PKH로 염색된 골수간엽줄기세포를 확인할 수 있었다. 그러나 12주째에는 염색된 골수 간엽줄기세포를 거의 관찰할 수 없었는데, 이는 동 종 세포를 사용하였기 때문에 이식된 토끼의 면역반 응에 의하여 세포가 제거된 것으로 추측할 수 있다.
이 기전에 대해서는 추가적인 연구가 필요할 것으로 판단된다.
본 연구는 실제로 임상에서 사용하는 방법을 대부 분 도입하여 실험하였다는데 그 의미가 있다. 동종 골의 고정 방법으로 많이 사용되는 골수강내 금속정 을 이용하였고, 전달 물질로 사용한 Gelfoam도 임 상에서 많이 사용되고 있으며, 자가 골수간엽줄기세 포를 배양하여 사용한다면 비교적 쉽게 임상에 적용 할 수 있을 것이다.
본 연구의 단점은 주입한 골수간엽줄기세포가 실 제로 어떻게 작용하는지를 밝히지 못했다는 것이다.
또한 실험군에서도 5마리 중 2마리에서는 완전한 골유합을 얻을 수 없었는데, 이는 골수간엽줄기세포 만으로는 임상에 적용하기에 부족함을 의미한다. 향 후 추가적인 연구를 통하여 골수간엽줄기세포의 작 용 기전을 밝히고 그 효율을 증가시킬 수 있다면 구 조성 동종골의 기능 향상과 불유합, 골절 등의 합병 증 감소에 큰 도움이 될 것으로 판단된다.
결 론
저자들은 골수간엽줄기세포를 포함한 Gelfoam을 이용한 인공 골막이 구조성 동종골의 유합을 촉진할 수 있음을 확인할 수 있었다. 향후 골수간엽줄기세포 를 포함한 인공 골막은 구조성 동종골의 임상 결과 개선에 중요한 역할을 할 수 있을 것으로 판단된다.
참고문헌
01) Akkus O, Rimnac CM: Fracture resistance of gamma radiation sterilized cortical bone allo- grafts. J Orthop Res, 19: 927-934, 2001.
02) Berrey BH Jr, Lord CF, Gebhardt MC, Mankin HJ: Fractures of allografts: frequency, treatment, and end-results. J Bone Joint Surg Am, 72: 825-833, 1990.
03) Boyce T, Edwards J, Scarborough N: Allograft bone. The influence of processing on safety and performance. Orthop Clin North Am, 30: 571-581, 1999.
04) Bruder SP, Kurth AA, Shea M, Hayes WC, Jaiswal N, Kadiyala S: Bone regeneration by implantation of purified, culture-expanded human mesenchymal stem cells. J Orthop Res, 16: 155- 162, 1998.
05) Bruder SP, Kraus KH, Goldberg VM, Kadiyala S: The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects. J Bone Joint Surg Am, 80:
985-996, 1998.
06) Burkus JK, Sandhu HS, Gornet MF, Longley
MC: Use of rhBMP-2 in combination with struc- tural cortical allografts: clinical and radiographic outcomes in anterior lumbar spinal surgery. J Bone Joint Surg Am, 87: 1205-1212, 2005.
07) Caplan AI, Bruder SP: Mesenchymal stem cells:
building blocks for molecular medicine in the 21th century. Trends Mol Med, 7: 259-264, 2001.
08) Chen Y, Luk KD, Cheung KM, Xu R, Lin MC, Lu WW, et al: Gene therapy for new bone forma- tion using adeno-associated viral bone morpho- genetic protein-2 vectors. Gene Ther, 10: 1345- 1353, 2003.
09) De Biase P, Cappanna R: Clinical applications of BMPs. Injury, 36 Suppl 3: S43-46, 2005.
10) Eyre-Brook AL: The periosteum: its function reassessed. Clin Orthop Rel Res, 189: 300-307, 1984.
11) Garbus DS, Masri BA, Czitrom AA: Biology of allografting. Orthop Clin North Am, 29: 199-204, 1998.
12) Goldberg VM, Stevenson S: The biology of bone grafts. Semin Arthroplasty, 4: 58-63, 1993.
13) Lord CF, Gebhardt MC, Tomford WW, Mankin HJ: Infection in bone allografts: inci- dence, nature and treatment. J Bone Joint Surg Am, 70: 369-376, 1988.
14) Lucarelli E, Fini M, Beccheroni A, Giavaresi G, Di Bella C, Aldini NN, et al: Stromal stem cells
and platelet-rich plasma improve bone allograft integration. Clin Orthop Rel Res, 435: 62-68, 2005.
15) Pereira RF, Halford KW, O’Hara MD, Leeper DB, Sokolov BP, Pollard MD, et al: Cultured adherent cells from marrow can serve as long- lasting precursor cells for bone, cartilage, and lung in irradiated mice. Proc Natl Acad Sci USA, 92: 4857-4861, 1995.
16) Ponticiello MS, Schinagl RM, Kadiyala S, Barry FP: Gelatin-based resorbable sponge as a carrier matrix for human mesenchymal stem cells in cartilage regeneration therapy. J Biomed Mater Res, 52: 246-255, 2000.
17) Prockop DJ. Marrow stromal cells as stem cells for non-hematopoietic tissues. Science, 276: 71- 74, 1997.
18) Taira H, Moreno J, Ripalda P, Forriol F:
Radiological and histological analysis of cortical allografts: an experimental study in sheep femora.
Arch Orthop Trauma Sug, 124: 320-325, 2004.
19) Stevenson S: Biology of bone grafts. Orthop Clin North Am, 30: S43-S52, 1999.
20) Yaszemski MJ, Payne RG, Hayer WC, Langer R, Mikos AG: Evolution of bone transplantation:
molecular, cellular and tissue strategies to engi- neer human bone. Biomaterials, 17: 175-185, 1996.