저작자표시-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. l 이 저작물을 영리 목적으로 이용할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위 논문
J
ur
katT 세포와 HMC-1세포에서
TI
M-3발현 조절 기전
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
윤 수 진
J
ur
katT 세포와 HMC-1세포에서
TI
M-3발현 조절 기전
지도교수
박 선
이 논문을 이학 석사학위 논문으로 제출함.
2011년
2월
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
윤 수 진
윤수진의 이학 석사학위 논문을 인준함.
심사위원장
김
경
민
인
심 사 위 원
신
호
준
인
심 사 위 원
박
선
인
아 주 대 학 교
대 학 원
2010년 12월 23일
국문요약
-J
ur
katT 세포와 HMC-1세포에서 TI
M-3발현 조절 기전
T cell/transmembrane,immunoglobulin,and mucin domain-3(TIM-3)는 TIM family에 속하는 분자로 마우스 Th1세포에 특이적인 세포 막 단백질로 처음 발 견되었다.이 분자는 T 세포와 비만세포 이외에도 대식세포,수지상세포 등 면역 에 관여하는 다양한 세포에서도 발현된다고 알려져 있다.현재까지 TIM-3가 면 역 반응에서 중요한 기능을 한다는 보고가 많이 되고 있는 반면 TIM-3발현 조 절 기작에 대해서는 많이 밝혀지지 않았다.본 연구에서는 T 세포주와 비만 세 포주에서 TIM-3의 발현 조절 기작을 밝히기 위해 다양한 inhibitor들을 사용한 결과 JurkatT 세포와 인간 CD4+ T 세포에서는 MEK 경로,HMC-1세포에서 는 MEK 경로와 SMAD 의존적 경로가 TIM-3발현에 중요하게 작용함을 밝혔 다.또한 T 세포에서 TIM-3 발현 조절에 중요하게 작용하는 promoter부분을 찾기 위해 다양한 길이의 TIM-3 promoter를 포함하는 luciferase reporter vector를 제작하여 luciferase 활성도를 측정하였다.그 결과 TIM-3 promoter -892/-870과 -144/-121부분이 자극에 의한 TIM-3발현 조절에 중요함을 밝혔 다.또한 전사 인자인 AP-1과 NF-κB가 TIM-3 발현 조절에 관여할 가능성을 제시하였다.본 연구의 결과는 면역 반응에서 중요하게 작용하는 TIM-3의 발현 조절 신호 전달 경로와 promoter부분을 밝힘으로써 TIM-3 발현 조절 기작을 이해하는데 기초를 제공할 것이다.
차
례
국문요약 ……… ⅰ 차례 ……… ⅱ 그림 차례 ……… ⅳ 표 차례 ……… ⅵ Ⅰ.서론 ……… 1 Ⅱ.재료 및 방법 ……… 5 A.세포배양과 CD4+T 세포의 분리 ……… 5 B.RNA 추출과 real-timeRT-PCR ……… 6C.Luciferasereportervector제작 ……… 7
D.CellTransfection……… 9
E.Luciferasereporterassay ……… 9
F.inhibitor실험 ……… 10
G.SDS-PAGE 와 Westernblotting ……… 10
H.세포 sorting……… 11
Ⅲ.결과 ……… 12
A.세포 활성에 의한 TIM-3mRNA 발현 증가 ……… 12
B.MAPK 경로에 의한 TIM-3전사 조절 ……… 16
C.JurkatT 세포에서 TIM-3promoter활성에 대한 MEK의 영향 ……… 24
D.JurkatT 세포에서 TIM-3발현에 중요한 promoter부분 분석 ………… 27
E.TIM-3발현에 관여하는 전사 인자의 탐색 ……… 31
Ⅳ.고찰 ……… 38
Ⅴ.결론 ……… 43
참고문헌 ……… 44
그 림 차 례
Fig.1.TIM-3mRNA wasincreased in JurkatT cellsand HMC-1cells stimulatedwithPMA andTGF-β,respectively……… 14
Fig.2.Theinduction ofTIM-3mRNA wasattenuatedby MEK inhibitors in celllines……… 19
Fig.3.ERK wasphosphorylated in JurkatT cellsby PMA stimulation, butnotinHMC-1cellsbyTGF-β stimulation……… 21
Fig.4.Theinduction ofTIM-3mRNA wasattenuatedby MEK inhibitors inhumanCD4+T cells……… 22
Fig.5.TIM-3 mRNA expression was increased in JurkatT cells by MEK-2overexpressionattheearlytimepoint……… 23
Fig.6.TheTIM-3 promoteractivity was reduced by MEK inihibitors inJurkatT cells……… 25
Fig.7.PMA-responsiveregioninTIM-3promoter……… 29
Fig.8.Theimplication ofAP-1sitewithin T3U(0.35)region in TIM-3 promoteractivity……… 33
Fig.10.The induction ofTIM-3 mRNA by TGF-β stimulation was attenuatedbysmadinhibitorinHMC-1cells……… 37
표 차 례
Ⅰ.서 론
자가 면역,알레르기,천식 그리고 바이러스 감염에 대한 면역 반응에서 중요 한 분자 중 하나로 T cell/transmembrane,immunoglobulin,and mucin(TIM) family가 밝혀졌다(Su 등,2008;Roselynn 등,2009).TIM family에 속하는 분자 는 마우스에서 8개(TIM-1-8),인간에서 3개(TIM-1,3,4)가 보고되었으며,마우 스의 TIM-1,TIM-3,TIM-4와 인간 TIM-1,TIM-3,TIM-4가 유사함이 밝혀졌 다(Marsh 등,1994;Encinas와 Kuchroo,2000;McIntire등,2004).이들은 제 1 형 세포 표면 당단백질로서 N-말단에 Immunoglobulin(Ig)-likedomain과 mucin domain, transmembrane domain을 가지며, tyrosine 인산화 motif를 가지는 (TIM-4제외)cytoplasmicregion으로 구성되어 있다.TIM family의 각 분자들 은 발현형과 기능에 차이가 있다.TIM-1은 주로 보조 T 세포 2형(Th2세포)에 서 발현되어 T 세포 활성에 강력한 공동 자극 분자 기능을 가지며(Umetsu 등, 2005),천식과 알레르기에 중요하게 작용한다(McIntire등,2003). TIM-3는 마 우스 보조 T 세포 1형(Th1세포)에 특이적인 세포 막 단백질로 처음 발견되었으 며(Monney등,2002;Sanchez-Fueyo등,2003),현재까지 보고된 바로는 Th1세 포뿐만 아니라 세포 독성 T 세포 1형(Tc1 세포)에서도 발현되고,이들 세포에 억제 신호를 전달하여 세포사를 유도한다(Zhu 등,2005).또한 TIM-3는 수지상 세포에서도 발현되어(Rodriguez-Manzanet등,2009)세포사가 유도된 세포의 포 식 작용과 항체의 cross-presentation을 매개한다고 보고되었다(Nakayama 등, 2009).이에 비해 TIM-4는 오로지 항원 제시 세포(antigen-presenting cells, APCs)에서만 발현되어 세포사가 유도된 세포의 포식 작용을 매개하고 내성을 유지하는데 있어서 중요한 역할을 한다고 밝혀졌다(Kobayashi 등, 2007; Miyanishi등,2007). TIM-3가 T 세포 면역 반응에서 중요한 역할을 한다는 것은 다양한 연구를 통해 증명되고 있다.TIM-3에 대한 특이 항체를 투여했을 때 자가 면역 질환인 Experimental autoimmune encephalomyelitis(EAE)가 더욱 악화되었다. 이는
TIM-3분자가 자가 면역 억제에 관여하던 것을 TIM-3에 대한 항체가 이를 억 제함으로써 자가 면역을 활성화시켜 나타나는 것으로 해석되었다.이와 유사하게 TIM-3에 대한 특이 항체를 투여한 마우스에서 심급성 질환이 발병하였다 (Monney 등,2002).TIM-3분자와 이의 ligand결합을 방해하고자 TIM-3세포 외 도메인 융합 단백질을 합성하여 마우스에 투여했을 때 Th1 세포의 분화와 Th1 사이토카인의 분비가 촉진되었다.그러므로 TIM-3와 그 ligand의 상호 작 용이 Th1세포 반응을 조절한다고 제시하였다.또한 TIM-3는 면역 관용에서도 중요한 역할을 한다는 것이 밝혀졌다.마우스에 TIM-3세포 외 도메인 융합 단 백질을 투여하면 항원에 의해 유도된 면역 관용이 저지되는 것을 확인할 수 있 었고,이와 유사하게 TIM-3가 결핍된 마우스에서 면역 관용이 생기지 않는 것을 확인했다(Sabatos등,2003). TIM-3가 선천면역과 후천면역에서 다른 역할을 가짐을 알 수 있다.TIM-3 는 정상적인 면역 체계에서 수지상세포에서도 발현된다.수지상세포의 TIM-3 신호와 Toll-likereceptor(TLR)의 시너지 효과는 수지상세포를 활성화시켜 TNF 와 같은 사이토카인을 생산하게 하고 Th1세포 활성을 촉진한다.한편 Th1세 포가 만들어지면 그 분화 말기에 TIM-3가 발현되고,Th1 세포가 분비하는 INF-γ에 의해 TIM-3ligand인 galectin-9의 발현도 증가한다.Th1세포 표면에 발현된 TIM-3와 galectin-9이 결합하게 되면 세포사가 유도되어 Th1세포 반응 이 종결된다(Kuchroo등,2008).즉,면역 반응의 초기 단계에서 TIM-3는 TLR 과 함께 염증 반응을 촉진시켜 Th1세포 반응을 유도하지만 분화 말기의 Th1 세포에서 TIM-3는 galectin-9과 결합함으로 세포사를 유도하여 Th1 세포 반응 의 종결에 관여한다. 면역반응에서 중요한 역할을 하는 비만세포는 히스타민와 헤파린을 다량 함 유하고 있는 입자를 많이 포함하는 세포로서 알레르기와 과민증에서 다양한 기 능을 한다고 알려져 있다.또한 병원체에 대한 방어와 치유에도 직접적으로 관련 하여 중요한 방어 기능을 한다고 알려졌으며 최근에는 다양한 면역학적,염증성, 발생학적 과정에서도 중요하게 작용한다고 보고되었다.이와 같이 면역 반응에서
중요한 역할을 하는 비만세포에 TIM-3가 발현한다는 보고가 있다.비만세포에 TGF-β 자극을 주면 TIM-3의 발현이 증가한다는 것을 microarray를 통해 밝힌 보고가 있으며(Wiener등,2007),비만세포에서 TIM-3신호전달이 선천 면역 반 응 동안 CD80과 CTLA-4의 발현 정도를 변화시킴으로서 염증성 심장 질병을 감소시킨다는 보고가 있다(Frisancho-Kiss등,2006). 위와 같은 기능을 하는 TIM-3의 신호 전달에는 TIM-3의 cytoplasmic domain에 있는 tyrosine잔기가 중요하다고 알려져 있다.이 부분은 마우스와 인 간 모두에서 보존되어 있으며,cytoplasmictail의 기부와 말단에 밀집되어 있다. 최근 보고에 따르면 그 중에서도 235번 tyrosine과 242번 tyrosine잔기의 인산화 가 T 세포 수용기(T cellreceptor,TCR)활성에 의해 개시되는 신호 전달을 강 화하는 원인이 되는 것으로 보고되었다.두 잔기를 함께 변화시켰을 때 reporter 의 활성화 정도가 감소되는 것을 확인한 반면 두 잔기를 하나씩 변화시켰을 때 는 그렇지 않음이 확인되었다(Lee등,2009). TIM-3의 기능이 활발히 연구되면서 TIM-3의 발현 조절 기작에 대한 연구 도 보고되기 시작했다.최근 발표에서 Th1세포 특이적 전사 인자인 T-bet이 마 우스 T 세포에서 TIM-3의 발현을 조절한다고 보고하였다.T-bet을 과발현 시 켰을 때 TIM-3가 계속적으로 발현하는 것을 확인하였고, T-bet이 TIM-3 promoter에 직접적으로 결합하는 것을 밝혔다(Anderson등,2010).
면역 반응에서 TIM-3역할의 중요성이 높아지고 있는 반면,TIM-3발현 조 절 기작에 대해서는 아직 많이 밝혀지지 않은 상태이다.본 연구에서는 면역 반 응에서 중요한 역할을 하는 T 세포와 비만세포에서 TIM-3 발현 조절 기작을 밝히고자 하였다.이를 위해 인간 말초 혈액에서 분리한 CD4+T 세포와 T 세포 연구에 많이 쓰이는 Jurkat T 세포주를 사용하였으며 인간 비만세포주인 HMC-1 세포주를 사용하여 연구하였다.비만세포의 경우,인간 혈액에서 비만 세포를 분리하여 배양하는 데에는 비용이 매우 많이 들고 어려움이 따르므로 정 상 비만세포는 포함시키지 못하였다.이러한 세포들을 사용하여 TIM-3의 발현 을 조절하는 신호 전달 분자와 전사 인자를 밝히고 TIM-3 발현에 중요한
Ⅱ.재료 및 방법
A.세포배양과 CD4+T 세포의 분리 Jurkat T 세포와 인간 CD4+ T 세포는 10 % FBS가 함유된 RPMI 1640(Gibco) 배지를 사용하였고, HMC-1 세포는 10 % FBS가 함유된 IMDM(Gibco)배지를 사용하여 37 ℃,5 % CO2세포 배양기에서 배양하였다. 실험에 사용할 세포는 하루 전에 배지를 교환해 준 뒤 사용하였다.인간 말초 혈액에서 CD4+ T 세포의 분리는 CD4 microbead(Miltenyi Biotec)를 이용하였다.먼저 혈액 10 ml에 E-PBS(pH 7.2,2mM EDTA)를 25 ml첨가한 후,Ficoll(GE Healthcare)15ml에 섞이지 않게 넣어준다.이것을 실 온에서 400 xg로 40분간 원심분리하여 PBMC 층만 새 tube 옮긴 후, 2PS-E-PBS(pH 7.2,2 mM EDTA,2 X peniciline/streptomycin)으로 50 ml을 채워 실온에서 200xg로 10분간 원심분리를 통해 2회 세척하였다.2PS-E-PBS 10ml로 재부유시켜 40um filter에 한 번 걸러준 후 세포 수를 측정하고 4℃에 서 200 xg로 15분간 원심분리 하였다.그 다음 BSA-E-PBS(pH7.2,2 mM EDTA,0.5% BSA)로 107개 세포 당 60ul로 부유시킨 후 FcR blocker(Miltenyi Biotec)를 107개 세포 당 20ul를 처리하고 냉장고에서 15분간 정치하였다.그 뒤 에 CD4microbead를 107개 세포 당 20ul로 처리를 해서 냉장고에서 30분간 정 치한 후 BSA-E-PBS를 107개 세포 당 2ml을 넣고 4℃에서 300xg로 10분간 원심분리 하였다.원심분리가 끝난 세포는 108개 세포 당 BSA-E-PBS 500ul로 재부유 시킨 뒤 rinsing된 MS column(MiltenyiBiotec)에 통과시켰다.column rinsing은 BSA-E-PBS 500ul로 공기방울이 들어가지 않게 한다.BSA-E-PBS 500 ul로 column을 3회 세척한 뒤 BSA-E-PBS 1 ml로 용리(elution)하고 새 column에 한 번 더 통과시켰다.위와 동일하게 세척하며 마지막 용리는 2ml로 하였다.얻어진 세포에 BSA-E-PBS를 3ml첨가하여 4℃에서 300xg로 10분 간 원심분리를 통해 한 번 세척해주고,10% FBS가 함유된 RPMI1640(Gibco)
배지 5ml에 부유시킨 뒤 세포 수를 측정하여 실험에 즉시 사용하였다.또한 분 리된 CD4+T 세포의 순도를 측정하기 위해 105개의 세포를 APC가 결합된 CD4 항체(BD,APC-conjugated mouseanti-human CD4monoclonalantibody)로 염 색한 후 Flow cytometry로 분석하였다.
B.RNA 추출과 real-timeRT-PCR
본 연구에서는 TIM-3 mRNA 수준을 측정하기 위하여 real-time RT-PCR 기법을 사용하였다.먼저 well당 106개의 세포를 분주한 후 JurkatT 세포와 HMC-1세포에 각각 PMA(Sigma)와 TGF-β(R&D)의 자극을 주었다.시간이 지 난 후 세포를 모두 모아 PBS(pH 7.2,1X peniciline/streptomycin)로 2회 세척하 고 RNA iso plus(TaKaRa) 300 ul로 세포를 완전히 용해시켰다. 60 ul chloroform(Sigma)을 첨가하고 잘 섞어준 뒤 실온에서 5분간 정치한 후 4℃에 서 13000rpm으로 15분간 원심분리를 하였다.원심분리하여 얻어진 상층액 100 ul를 새 tube에 옮겨 isoprophanol(Merck)50ul를 첨가하고 섞은 후 실온에서 5 분간 정치하고 4℃에서 13000rpm으로 15분간 원심분리를 하였다.상층액은 제 거하고 침전된 totalRNA에 75 % ethanol(Merck)500 ul를 넣은 후 4 ℃에서 10000rpm으로 10분간 원심분리를 통해 1회 세척한 후 0.1% DEPC water15 ~ 20 ul로 용해시켜 spectrophotometer로 정량한 뒤에 cDNA 합성에 사용하였 다.
Total RNA 1.5 ug을 cDNA 합성에 사용하였다. RNA 1.5 ug에 Oligo(dT)(0.5 ug/ul,IDT)1 ul와 10 mM dNTP(TaKaRa)1 ul를 섞은 후 0.1 % DEPC water로 total11ul를 맞춰 주고 65℃에서 5분간 정치한 후 얼음에서 1분 정도 식힌다.그 다음 5 X firststrand buffer 4 ul,0.1 M DTT 2 ul, SuperScriptⅡ Reverse Transcriptase(200 unit/ul,invitrogen) 0.1 ul,0.1 % DEPC water0.9ul를 첨가한 후 42℃에서 52분,70℃에서 15분 처리하였다.
사용하였다.사용한 TIM-3primer는 F :5‘-TCC AAG GAT GCT TAC CAC CAG-3',R :5'- GCC AAT GTG GAT ATT TGT GTT AGA TT-3'이고 TIM-3 FAM probe는 5'-ACA TGG CCC AGC AGA GAC ACA GAC ACT-3' 이다. 결과 보정을 위한 GAPDH 검출에는 GAPDH probe/primer premix(20X)(ABI)를 사용하였다.TIM-3반응에는 본 농도의 cDNA 5ul를 사용 하고,GAPDH 반응에는 1/10으로 희석한 cDNA 5 ul를 사용하였다.real-time RT-PCR 반응은 two-stepPCR protocol을 따라 95℃에서 10분 반응 후 95℃ 15초, 60 ℃ 1분의 반응을 40 cycle로 하여 ABI PRISM 7000 Sequence DetectionSystem을 사용하였고,결과는 ComparativeCT방법으로 분석하였다.
C.Luciferasereportervector제작
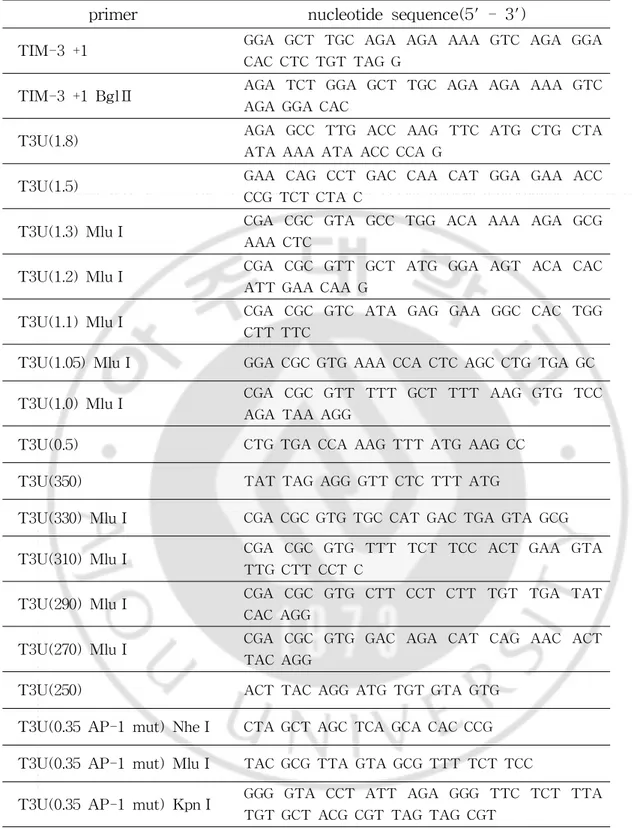
TIM-3 발현 조절에 관여하는 TIM-3 promoter 부분을 찾고자 TIM-3 promoterDNA 약 2 Kb를 주형으로 다양한 길이의 promoter부분을 포함하는 luciferasereportervector를 제작하였다.
다양한 primer를 합성하여(Table1)PolymeraseChain Reaction(PCR)기법으 로 증폭한 후,TopoTA cloning vector(Invitrogen)에 삽입하고 염기서열 확인하 였다.염기서열이 확인된 plasmid에서 TIM-3promoter부분을 제한효소를 이용 해 획득한 후 luciferasereportervector인 pGL3-Basicvector에 삽입하였다.
Table1.primerforamplification ofTIM-3promoter
primer nucleotidesequence(5'-3')
TIM-3+1 GGA GCT TGC AGA AGA AAA GTC AGA GGA
CAC CTC TGT TAG G
TIM-3+1BglⅡ AGA TCT GGA GCT TGC AGA AGA AAA GTC
AGA GGA CAC
T3U(1.8) AGA GCC TTG ACC AAG TTC ATG CTG CTA
ATA AAA ATA ACC CCA G
T3U(1.5) GAA CAG CCT GAC CAA CAT GGA GAA ACC
CCG TCT CTA C
T3U(1.3)MluⅠ CGA CGC GTA GCC TGG ACA AAA AGA GCG
AAA CTC
T3U(1.2)MluⅠ CGA CGC GTT GCT ATG GGA AGT ACA CAC
ATT GAA CAA G
T3U(1.1)MluⅠ CGA CGC GTC ATA GAG GAA GGC CAC TGG
CTT TTC
T3U(1.05)MluⅠ GGA CGC GTG AAA CCA CTC AGC CTG TGA GC
T3U(1.0)MluⅠ CGA CGC GTT TTT GCT TTT AAG GTG TCC
AGA TAA AGG
T3U(0.5) CTG TGA CCA AAG TTT ATG AAG CC
T3U(350) TAT TAG AGG GTT CTC TTT ATG
T3U(330)MluⅠ CGA CGC GTG TGC CAT GAC TGA GTA GCG
T3U(310)MluⅠ CGA CGC GTG TTT TCT TCC ACT GAA GTA
TTG CTT CCT C
T3U(290)MluⅠ CGA CGC GTG CTT CCT CTT TGT TGA TAT
CAC AGG
T3U(270)MluⅠ CGA CGC GTG GAC AGA CAT CAG AAC ACT
TAC AGG
T3U(250) ACT TAC AGG ATG TGT GTA GTG
T3U(0.35AP-1mut)NheⅠ CTA GCT AGC TCA GCA CAC CCG T3U(0.35AP-1mut)MluⅠ TAC GCG TTA GTA GCG TTT TCT TCC
T3U(0.35AP-1mut)KpnⅠ GGG GTA CCT ATT AGA GGG TTC TCT TTA TGT GCT ACG CGT TAG TAG CGT
D.CellTransfection
Jurkat T 세포와 HMC-1 세포는 electrophoration 기법을 사용하여 Transfection 하였다.electrophoration은 microporator(DigitalBio)와 Neon 100 ulkit(invitrogen)을 사용하였다.
각 세포에 적합한 배지를 12 wellplate에 2 ml씩 분주한 후 37 ℃,5 % CO2 세포 배양기에 미리 넣어둔다.세포를 모두 모은 후 PBS(pH 7.2,1 X
peniciline/streptomycin)로 1회 세척한 후 106/100ul가 되도록 PBS에 재부유 시 킨 후,실온에서 3000 rpm으로 3분간 원심분리 하였다.상층액을 제거하고 electrophoresisbuffer를 106/100ul가 되도록 넣고 실험군 당 DNA 4ug 씩 넣 고 섞어준다.Electrophoration 조건은 JurkatT 세포 경우에는 pulse voltage 1200width 40number1로 하고,HMC-1세포는 pulsevoltage1600width 20 number1로 하였다.
E.Luciferasereporterassay
다양한 길이의 TIM-3promoter를 포함하고 있는 vector들의 luciferase활성 도를 측정하기 위해 Luciferasereporterassay를 수행하였다.각 세포에 target vector(3.6ug)와 transfection efficiency 보정을 위한 pEGFP-N1(0.4ug)을 함께 transfection하고 JurkatT 세포는 24후에 PMA(50ng/ml)자극을 주고 HMC-1 은 42시간 뒤 TGF-β(2 ng/ml)로 자극을 주었다. 최종적으로 세포는 Transfection후 48시간째에 모두 거두어 luciferasereporterassay를 진행하였다. PBS(pH 7.2,1X peniciline/streptomycin)로 2회 세척 후 1mlPBS로 재부유시 켜 900 ul는 luciferase활성 측정에 사용하고 100 ul는 GFP 발현 측정을 위해 사용하였다. 900 ul의 세포를 다시 원심분리한 후 5 X cell lysis buffer(Promega)를 1 X로 희석한 한 용액 100 ul로 세포를 용해시켰다.용해된 세포를 13000rpm에서 1분간 원심분리한 뒤 상층액만 새 tube로 옮긴다.얻어진
상층액과 동량의 luciferin(Promega)을 넣고 적당히 섞어준 후 luminometer로 luciferase의 활성 정도를 측정하였다.GFP 발현은 Flow cytometer로 분석하였 다.
F.inhibitor실험
각 세포의 TIM-3발현 조절 경로를 파악하고자 다양한 inhibitor들을 사용하 여 real-time RT-PCR을 수행하였다. MAPK inhibitor(Calbiochem)로는 p38 inhibitor:SB202190(10 uM),SB203580(10 uM),JNK inhibitor:AS601245(10 uM),SP600125(10 uM),MEK inhibitor :PD98059(50 uM),U0126(50 uM), MEK1/2inhibitor(220nM),PI3K inhibitor:LY294002(50uM),SMAD inhibitor :SB431245(5uM, Tocris)를 사용하였다.
24wellplate에 106/ml씩 세포를 분주한 후,inhibitor들을 농도에 맞게 넣고 30분간 37℃,5% CO2세포 배양기에서 정치한 후 JurkatT 세포는 24시간 후
에 PMA(50ng/ml),HMC-1은 42시간 후 TGF-β(2ng/ml)로 자극을 주었다.
G.SDS-PAGE와 Westernblotting
각 세포에서 자극 시간에 다른 ERK의 인산화 정도를 알아보고자 Western blotting을 수행하였다. 106개의 세포를 FBS가 없는 배지 1 ml에서 4시간 starvation을 주고 나서 각 세포에 자극을 주었다.자극 시간이 끝난 세포는 tube 에 모아 원심분리하여 상층액을 제거하고 PBS(pH 7.2, 1 X peniciline/ streptomycin)1ml로 재부유시킨 후,4℃,13000rpm으로 1분씩 2회 washing 한 후 celllysisbuffer(with 1X proteaseinhibitor,1X phosphataseinhibitor) 를 넣어 충분히 섞은 후 얼음에 15분간 정치하였다.다음으로 4℃,13000rpm에 서 15분간 원심 분리하여 얻은 상층액만 새 tube에 옮긴 후 5 X SDS sample buffer를 넣고 100℃에서 10분간 정치하였다.
준비된 시료를 10% SDS gel에 걸고 stacking gel에서 70V,running gel에 서 100V로 SDS-PAGE를 진행하였다.Gelrunning이 끝나면 PVDF membrane 으로 250mA에서 2시간 동안 transfer하였다.Transfer가 끝난 membrane은 5 % skim milk(0.1 % TBST)로 1시간 동안 실온에서 blocking 한 후 0.1 % TBST로 간단히 3회 세척하였다.그 다음 검출하고자 하는 단백질에 대한 1차 항체를 5% BSA(0.1% TBST)에 적정 농도로 희석한 후 4℃에서 membrane 과 약 16시간 shaking incubation하였다.0.1% TBST로 실온에서 10분씩 3회 세척한 후 1차 항체에 대한 2차 항체를 적정 농도로 5 % skim milk(0.1 % TBST)에 희석해서 분주하고 실온에서 1시간 shaking incubation 하였다.0.1% TBST로 실온에서 10분씩 5회 세척한 후 ECL(pirece)을 막에 충분히 뿌린 후 실 온에서 3분간 정치하고 AGFA film에 exposure하여 develop 하였다.develop이 끝난 막에서 다른 단백질을 보기 위해서는 0.5% NaOH를 넣은 후 실온에서 10 분간 shaking incubation 한 후 0.1% TBST로 10분씩 3회 세척한 후 blocking
부터 위와 동일한 방법으로 진행하였다. 본 실험에서 사용한 항체는
phospho-ERK :Phospho-p44/42MAPK(Erk1/2)(Thr202/Tyr204)antibody(cell signaling), totla-ERK : p44/42 MAPK(Erk1/2) antibody(cell signaling), beta-actin : beta-actin antibody(cell singnaling), anti-Rabbit : HRP-Goat Anti-RabbitIgG(H+L)Conjugate(Zymed)
H.세포 sorting
JurkatT 세포에 과발현하고자 하는 DNA 3.2ug과 pEGFP-N10.8ug을 위 에 기술한 transfection 방법과 동일하게 세포에 이입한다.이입 후 약 40시간째 에 세포를 모아 원심분리하여 상층액을 제거하고 PBS(pH 7.2, 1 X peniciline/streptomycin)10ml로 1회 세척 후 PBS 10ml로 재부유시킨다.GFP 를 발현하는 세포들만 sorting한 후 5X105/500 ul씩 48 wellplate에 분주하여 PMA(50ng/ml)자극을 주었다.
Ⅲ.결 과
A.세포 활성에 의한 TIM-3mRNA 발현 증가 인간 T 세포가 활성화되면 TIM-3mRNA 발현이 증가되고,비만세포에서는 TGF-β 자극에 의해 TIM-3발현이 증가된다는 보고가 있다.본 연구에서는 위 와 같은 TIM-3의 발현 변화를 관찰하고자 T 세포주인 JurkatT 세포와 비만세 포주인 HMC-1 세포를 사용하여 조사하였다. Jurkat T 세포에서 PMA(50 ng/ml)와 ionophore(0.5 uM) 자극을 주고 TIM-3 mRNA 발현을 real-time RT-PCR로 측정하였다.그 결과 자극이 없는 조건에서도 TIM-3mRNA 발현이 관찰되었고 PMA 자극을 6시간 주었을 때 약 2배,24시간째에 약 7.5배 까지 TIM-3 mRNA 발현이 계속 증가하는 것을 관찰하였다.반면 ionophore자극을 24시간 동안 주었을 때는 자극을 주지 않은 것과 비교했을 때 TIM-3mRNA 발 현에 유의적인 차이가 없는 것을 관찰하였다.PMA와 ionophore를 함께 24시간 처리했을 때는 6배의 발현증가를 관찰하였다(Fig.1A). HMC-1 세포에 TGF-β(2 ng/ml)의 자극을 주고 TIM-3 mRNA 발현을 real-timeRT-PCR로 분석하였다.자극을 주지 않은 조건에서도 TIM-3mRNA 가 검출되었고 1시간 자극 후 2배 정도 증가하는 것을 확인할 수 있었다.6시간 후에 약 13.5배로 가장 높은 발현을 보이다가 24시간째에 약 9배로 TIM-3 mRNA 발현이 감소하는 양상을 보였다(Fig.1B). PMA 자극에 대해 HMC-1세포에서 TIM-3발현이 조절되는지,또한 TGF-β 처리에 의해 JurkatT 세포에서도 TIM-3발현이 조절되는지 알아보고자 실 험하였다.PMA 24시간 자극을 준 조건에서 JurkatT 세포는 이전 결과와 마찬 가지로 약 7.5배의 TIM-3mRNA 발현 증가를 보였고,HMC-1세포에서도 약 6 배 정도 발현이 증가되는 것을 볼 수 있었다.반면 TGF-β로 6시간 자극을 주 었을 때,HMC-1세포에서는 TIM-3mRNA 발현이 약 13.5배 증가함을 보였으 나 JurkatT 세포에서는 발현 증가가 관찰되지 않았다(Fig.1C).결과를 종합해 보면 JurkatT 세포와 HMC-1세포는 각각 PMA와 TGF-β 자극에 의해 활성화되었을 때 TIM-3 발현이 증가되는 것이 확인되었으며, HMC-1세포는 PMA 자극에 의해서도 TIM-3발현이 증가되는 것을 관찰할 수 있었다.
A.JurkatT cells B.HMC-1cells
Fig.1.TIM-3mRNA wasincreased in JurkatT cellsand HMC-1cells stimulated with PMA and TGF-β,respectively.(A)JurkatT cellswere incubated for indicated time in presence of PMA(50 ng/ml) and/or A23187(Ionopore,0.5uM).(B)HMC-1cellswereincubatedforindicatedtime in presence ofTGF-β(2 ng/ml).(C)JurkatT cells and HMC-1 cells were incubatedfor24hoursinthepresenceofPMA(50ng/ml)and6hoursin the presenceofTGF-β(2ng/ml).TIM-3mRNA expression levelswereanalyzed byreal-timeRT-PCR.TIM-3mRNA levelswerenormalizedtoGAPDH gene expression.*p<0.05,**p<0.005(versusnon-stimulatedcontrol).
B.MAPK 경로에 의한 TIM-3전사 조절
PMA 자극에 의한 T 세포의 활성은 Mitogen-activated protein (MAP) kinases(MAPK)경로를 거친다고 잘 알려져 있다.또한 이전 연구에서 TGF-β 의 자극에 의한 비만세포주의 TIM-3전사 활성에 MAPK 경로가 관여할 가능성 이 제시되었다.
본 연구에서 MAPK 활성이 JurkatT 세포와 HMC-1세포에서 TIM-3발현 조절에 영향을 미치는지 알아보고자 각 세포에 다양한 MAPK inhibitor를 처리 한 후 PMA와 TGF-β로 각각 자극을 주고 real-timeRT-PCR로 TIM-3mRNA 발현을 측정하였다.
JurkatT 세포에서는 PMA 자극을 주었을 때 자극을 주지 않은 세포에 비해 TIM-3mRNA 발현이 약 8.5배 증가하였다.p38경로를 억제시키는 SB202190과 SB203580을 처리하였을 때 PMA 자극에 의한 TIM-3발현 증가가 JurkatT 세 포에 비해 각각 40%,35% 정도 감소하는 것을 관찰하였다.JNK 경로에 대한 inhibitor중 AS601245에서도 40% 정도 감소하는 양상을 보였으나,SP600125의 경우에는 Jrukat T 세포와 유사한 양상을 보였다.MEK 경로를 억제시키는 PD98059를 처리한 세포에서는 약 50%,U0126을 처리한 세포에서는 70% 이상 의 TIM-3mRNA 발현 증가가 감소되었다(Fig.2A).결과적으로 JNK inhibitor 인 SP600125를 제외한 모든 inhibitor실험군에서 대조군에 비해 PMA에 의한 TIM-3mRNA 발현 증가가 감소된 것을 관찰할 수 있었다. HMC-1세포의 경우 inhibitor를 처리하지 않고 TGF-β의 자극만 주었을 때 TIM-3 mRNA 발현이 약 5.5배 증가한 것을 확인하였다.p38과 JNK에 대한 inhibitor를 처리하였을 때 TGF-β 자극에 의한 TIM-3 발현 증가가 SB202190, SB203580,AS601245에서는 inhibitor를 처리하지 않은 대조군과 비슷한 수준으로 증가되는 것을 확인할 수 있었고,SP600125를 처리한 실험군은 대조군에 비해 약 17% 정도 발현 증가가 감소된 것으로 보였으나 유의적인 차이는 없었다.반 면 MEK 경로에 대한 inhibitor인 PD98059와 U0126을 처리한 세포에서는 각각
35%,80% 정도 TIM-3발현 증가가 감소된 것을 확인할 수 있었다(Fig.2B). 실험 결과 MEK 경로가 HMC-1세포에서 TIM-3발현에 관여할 것이라고 생각 되어지나,PD98059에 의한 억제 효과가 JurkatT 세포에 비해 약하므로 또 다른 MEK inihibitor를 가지고 HMC-1 세포에서 TIM-3 발현에 대한 MEK 경로의 관련성을 한 번 더 확인하였다.그 결과 MEK1/2inhibitor를 처리한 세포에서도 동일하게 TIM-3mRNA 발현증가가 억제된 것을 관찰하였다(Fig.2C).그러므로 JurkatT 세포는 PMA 자극에 의한 TIM-3 mRNA 발현 증가에 p38 경로와 MEK 경로가 관여하며,HMC-1세포에서는 TGF-β 자극에 의한 TIM-3mRNA 발현 증가에 MEK 경로가 관여할 가능성을 제시하였다.
MEK 경로가 활성화되면 그 downstream 분자인 ERK를 인산화하여 신호를 전달한다고 잘 알려져 있다.그렇다면 위 실험에서 확인된 MEK 경로가 그 다음 신호로 ERK의 인산화를 가져오는지 알아보고자 JrukatT 세포와 HMC-1세포 를 각각 PMA와 TGF-β로 활성화 시킨 후,ERK 분자의 인산화를 Western blotting을 통해 알아보았다.그 결과,JurkatT 세포는 자극 후 5분부터 인산화 된 ERK가 검출되었고 15분에 가장 높은 ERK의 인산화를 보였으며 시간이 지남 에 따라 인산화가 감소하는 것을 관찰할 수 있었다(Fig.3A).반면,HMC-1세포 의 경우 TGF-β를 5~ 120분 까지 자극을 주었지만 자극을 주지 않았을 때와 동일한 수준의 ERK의 인산화가 관찰되었다(Fig.3B). 이러한 결과로 볼 때 JurkatT 세포는 TIM-3발현에 MEK 경로가 관여하 고 그 다음으로 ERK 분자의 인산화를 통해 그 발현이 조절될 가능성을 제시하 며,HMC-1세포의 경우에는 TIM-3가 발현하는데 MEK 경로가 관여하기는 하 지만 그 다음 신호로 ERK의 인산화가 확인되지 않았으므로 ERK가 아닌 다른 분자를 통해 TIM-3의 발현이 조절될 것이라고 생각되어진다. JurkatT 세포에서 TIM-3발현에 MEK 경로가 관여하는 것이 인간 CD4+ T 세포에서도 동일하게 나타나는지 확인해보았다.인간 말초 혈액에서 CD4+ T 세포를 분리하여 MEK 경로에 대한 inhibitor들을 처리하고 PMA로 활성화시킨 다음 TIM-3mRNA 발현을 real-timeRT-PCR로 측정해 보았다.JurkatT 세
포와 마찬가지로 인간 CD4+ T 세포에서도 PMA로 24시간 자극하였을 때 TIM-3mRNA 발현이 대조군에 비해 약 5배 정도 증가하는 것을 확인하였으며, MEK inhibitor를 처리한 세포 모두 PMA 자극에 의한 TIM-3mRNA 발현이 억 제된 것을 관찰하였다(Fig.4).이러한 결과는 인간 CD4+ T 세포에서도 Jurkat T 세포와 동일하게 TIM-3 발현 조절에 MEK 경로가 관여할 가능성을 제시한 다.
JurkatT 세포에서 MEK 경로가 TIM-3발현에 관여한다는 것을 한 번 더 증명하고자 MEK-2를 과발현하는 JurkatT 세포주를 확립하여 실험을 수행하였 다.먼저 MEK-2의 과발현이 되었는지 관찰하고자 PMA 자극에 의한 ERK의 인 산화 정도를 Western blotting으로 검출하였다.그 결과 JurkatT 세포에 비해 MEK-2가 과발현 된 세포에서 PMA 자극에 의한 ERK의 인산화가 증가된 것을 관찰하였다(Fig.5A).다음으로 JurkatT 세포와 MEK-2를 과발현하는 세포를 PMA로 자극한 후 real-time RT-PCR로 TIM-3 mRNA 발현을 측정한 결과 JurkatT 세포의 경우 6시간 자극 후 TIM-3 mRNA 발현이 약 2배 증가하고 24시간에 약 3배 증가하는 것을 관찰하였으나,MEK-2과발현 세포의 경우 6시 간에 약 4배 정도 증가하고 24시간에도 그 발현이 거의 유지되었다(Fig.5B).대 조군에 비해 MEK-2가 과발현되었을 때 TIM-3가 더 빠른 시간에 높게 발현되 는 것이 관찰된 결과 또한 MEK 경로가 TIM-3의 발현을 조절할 가능성을 제시 하였다.
A.JurkatT cells
Fig. 2. The induction of TIM-3 mRNA was attenuated by MEK inhibitors in celllines.(A)JurkatT cells and (B,C)HMC-1 cells were treated with the indicated inhibitors for 30 min and then stimulated with PMA(50 ng/ml)for24 hours and TGF-β(2 ng/ml)for6 hours respectively. TIM-3mRNA levelswereanalyzedby real-timeRT-PCR and normalized to GAPDH geneexpression.*p<0.05,**p<0.005(versusstimulatedcontrol).
Fig.3.ERK wasphosphorylated in JurkatT cellsby PMA stimulation, butnotin HMC-1 cells by TGF-β stimulation.(A)JurkatT cells and (B)HMC-1cellswerestimulatedwith PMA(50ng/ml)andTGF-β(2ng/ml), respectively,for indicated time and then phospho-ERK was determined by Westernblotting.Phospho-ERK levelswerenormalizedtototal-ERK levels.
B A
Fig.4.Theincreased TIM-3 mRNA levelby activation wasattenuated by MEK inhibitors in human CD4+ T cells.Human CD4+ cells were treated with indicated MEK inhibitors for30 min and then stimulated with PMA(50ng/ml)for24hours.TIM-3mRNA expression levelswereanalyzed byreal-timeRT-PCR andnormalizedtoGAPDH geneexpression.
Fig.5.TIM-3 mRNA expression was increased in JurkatT cells by MEK-2 overexpression atthe early time point.(A)JurkatT cells and MEK-2WT cellswerestimulatedwith PMA(50ng/ml)for15min and then phospho-ERK was detected by Western blotting.(B) Jurkat T cells and MEK-2 WT cells were stimulated with PMA(50 ng/ml) for the indicated time.TIM-3 mRNA expression levels were analyzed by real-time RT-PCR and normalized to GAPDH gene expression. MEK2-WT; Jurkat T cells overexprssingMEK-2**p<0.005.
A
C.JurkatT 세포에서 TIM-3promoter활성에 대한 MEK의 영향
실험 결과 JurkatT 세포의 경우 MEK 경로가 TIM-3발현을 조절하는 기 작일 가능성을 보였다.그렇다면 MEK 경로가 TIM-3 promoter활성에는 어떤 영향을 미치는지 알아보고자 하였다.
먼저 JurkatT 세포에서 TIM-3promoter의 어느 부분이 TIM-3발현에 가 장 중요한지 알아보고자 TIM-3promoter를 포함하는 luciferasereportervector 를 사용하여 luciferase reporterassay를 진행하였다.실험 결과 T3U(1.8)-luc, T3U(1.5)-luc,T3U(1.0)-lucvector모두에서 PMA 자극을 주었을 때 그렇지 않 은 세포에 비해서 luciferase활성도가 증가하는 것을 관찰할 수 있었다.그 중에 서도 T3U(1.5)-luc vector에서 PMA 자극에 의한 luciferase 활성 정도가 가장 높은 것을 관찰할 수 있었다(Fig 6A).그렇다면 T3U(1.5)-luc vector의 활성에 MEK 경로가 영향을 미치는지를 알아보고자 T3U(1.5)-lucvector가 이입된 세포 에 MEK inhibitor를 처리한 후 PMA 자극을 주고 luciferase활성을 측정하였다. 그 결과 대조군으로 사용한 pGL3-Basic에서는 자극의 유무와 inhibitor의 유무에 상관없이 luciferase의 활성이 거의 없는 반면 T3U(1.5)-luc vector의 경우에는 inhibitor를 처리하지 않은 조건에서 PMA 자극에 의해 luciferase의 활성이 약 3 배 정도 증가된 반면 PD98059를 처리한 조건에서는 PMA 자극에 의한 활성이 감소하였고,U0126를 처리했을 때는 PMA 자극에 의한 luciferase의 활성 증가가 거의 관찰되지 않았다(fig.6B).그러므로 JurkatT 세포에서 PMA 자극에 의한 TIM-3promoter활성이 MEK 경로의 영향을 받는다는 것을 알 수 있었다.
A
Fig.6.The TIM-3 promoteractivity was reduced by MEK inihibitors in JurkatT cells.(A)Variousluciferasereportervectorscontaining TIM-3 promoterweretransfected into JurkatT cells togetherwith GFP expression vectorfornormalizationoftransfectionefficiency.Thesecellswerestimulated with PMA(50 ng/ml)for24 hours.At48 hourposttransfection,luciferase activity was measured by luminometer and normalized to GFP expression level.(B)Luciferasereportervectorcontaining TIM-3promoter1.5kb region weretransfectedintoJurkatT cells.At24hoursposttransfection,thesecells were treated with PD98059(50 uM)orU0126(50 uM)for30 min and then stimulated with PMA(50 ng/ml) for 24 hours. Luciferase activity was measuredandnormalizedtoGFP expressionlevel.
D.JurkatT 세포에서 TIM-3발현에 중요한 promoter부분 분석
TIM-3promoter중 어느 부분이 TIM-3가 발현하는데 중요하게 작용하는지 를 알아보기 위해 다양한 길이의 TIM-3 promoter region을 가지고 있는 luciferasereportervector들을 제작하여 luciferasereporterassay를 수행하였다 (Fig.7A).
T3U(1.8)-luc,T3U(1.5)-luc,T3U(1.3)-luc,T3U(1.0)-luc vector를 이입한 JurkatT 세포에서 PMA 자극에 의해 luciferase활성도가 증가하는 것을 관찰할 수 있었다.그 중에서도 T3U(1.3)-luc과 T3U(1.0)-luc vector를 비교해 볼 때, PMA 자극에 의한 luciferase활성 정도가 크게 차이나는 것을 관찰할 수 있었다 (Fig 7B).아마도 T3U(1.3)과 T3U(1.0)사이에 PMA 자극에 반응하여 TIM-3 발현을 유도하는 부분이 있을 것이라고 추정되어 이 부분을 약 0.5 ~ 1kb 씩 deletion시킨 다양한 길이의 TIM-3 promoter를 포함하는 luciferase reporter vector를 제작한 뒤 luciferase reporterassay를 진행하였다.그 결과 T3U(1.3) ~ T3U(1.05)-luc vector에서는 luciferase 활성이 큰 차이 없이 비슷한 양상을 보였으나 T3U(1.05)와 T3U(1.0)vector에서는 PMA 자극에 의한 luciferase활성 에 차이가 있음을 관찰할 수 있었다(Fig.7C).다음으로 T3U(1.0)보다 짧은 길 이의 TIM-3promoter를 가지는 vector를 가지고 luciferasereporterassay 진행 한 결과 T3U(0.35)-lucvector에서 PMA에 의해 가장 높은 luciferase활성을 관 찰할 수 있었다(Fig.7D).또한 T3U(0.35)-luc vector에서는 PMA 자극이 없는 조건에서도 luciferase의 활성이 높게 관찰된 반면 T3U(0.25)-luc vector에서는 luciferase 활성이 거의 관찰되지 않았으므로 T3U(0.35)와 T3U(0.25) 사이가 TIM-3의 기본적인 발현을 유도하는데 중요한 부분이라고 추측하였다. 이에 20bp 씩 deletion 된 다양한 reporter vector들을 제작하여 luciferase reporter assay를 진행한 결과 T3U(0.29)와 T3U(0.27)사이에서 PMA에 의한 luciferase 활성이 가장 크게 차이나는 것을 관찰할 수 있었다(Fig.7E).위 결과들을 종합 해 보면 JurkatT 세포에서 PMA에 의한 TIM-3promoter활성을 증가시키는데
관여하는 부분은 -915/-870과 -144/-121이고,TIM-3promoter의 기본적인 활성 에 관여하는 부분은 -121/-105라고 생각되어진다.
A
Fig. 7. PMA-responsive region in TIM-3 promoter. (A) Diagram of luciferasereportervectors containing variouslength ofTIM-3 promoter.(B) Jurkat T cells were transfected with indicated luciferase reporter vectors together with GFP expression vector for normalization of transfection efficiency.Then these cells were stimulated with PMA(50 ng/ml) for 24 hours.At 48 hour post transfection,luciferase activity was measured by luminometerandnormalizedtoGFP expressionlevel.**p<0.005.
E.TIM-3발현에 관여하는 전사 인자의 탐색
T 세포를 활성화 시키는 PMA는 Ras신호 전달 경로를 통해 AP-1활성을 유도하고,PKCθ 경로를 통해 NF-κB를 활성화시킨다.이러한 전사 인자들은 핵 내에서 다양한 유전자의 전사를 조절하게 된다.그러므로 본 연구에서도 Jurkat T 세포의 TIM-3발현 조절에 위의 두 전사 인자가 관여하는지 분석하고자 하 였다.
TIM-3promoter에 대한 luciferasereporterassay결과 TIM-3전사 활성에 중요하다고 생각되어지는 -915/-870(T3U(1.05)/(1.0))과 -203/-105(T3U(0.35)/ (0.25))부분의 염기 서열 분석 결과 AP-1이 결합할 가능성 있는 부분이 확인되 었다.이 부분에 AP-1이 결합하여 TIM-3promoter활성에 영향을 미치는지 확 인하기 위하여 T3U(0.35)에 있는 AP-1 결합 부위를 mutation 시킨 reporter vector를 제작하였다.T3U(0.35)의 AP-1 결합 부위가 mutation된 vector실험 결과,정상 vector와 비교했을 때 PMA에 의한 TIM-3promoter활성이 통계적 으로 유의하게 감소되었다(Fig.8).이러한 결과가 TIM-3 promoter에 AP-1이 실제로 결합하여 활성을 증가시키는 것인지를 확인하기 위하여 Chipassay를 이 용하여 확인하고자 한다.
NF-κB는 T 세포가 활성화 될 때 PI3K 경로에 의해 활성화 된다고 잘 알려 져 있다.그러므로 본 연구에서는 먼저 PI3K에 대한 inhibitor실험을 수행하였 다.JurkatT 세포에 PI3K inhibitor를 처리한 후 PMA로 자극을 주고 real-time RT-PCR로 TIM-3mRNA 발현을 측정하였다.그 결과 inhibitor를 처리했을 때 PMA에 의해 유도되는 TIM-3 mRNA 발현 증가가 감소되는 것을 관찰하였다 (Fig.9A).이 결과는 TIM-3발현에 PI3K 경로가 관여할 것이라는 가능성을 제 시한다.그렇다면 이 경로의 활성이 NF-κB를 활성화시켜 TIM-3발현을 조절하 는지 알아보기 위하여 NF-κB p65와 p50을 각각 과발현 시킨 후 PMA로 자극을 주고 real-timeRT-PCR로 TIM-3mRNA 발현을 측정하였다.그 결과 대조군에 비해 p65가 과발현 된 세포에서 TIM-3의 발현이 증가된 것을 확인할 수 있었
다.반면 p50이 과발현 된 세포에서는 6시간 자극을 주었을 때에 TIM-3발현이 거의 증가하지 않았으며 24시간 자극하였을 때 대조군과 비슷한 수준으로 증가 하였다(Fig.9B).이러한 결과를 통해 NF-κB의 p65가 TIM-3의 발현을 증가시 키는 역할을 할 것이라고 생각되며,p50은 6시간 PMA 자극을 주었을 때 TIM-3 발현이 대조군에 비해 억제된 것으로 보아 아마도 TIM-3발현을 억제하는 역할 을 할 것이라 생각된다.그렇다면 이러한 NF-κB의 영향이 TIM-3promoter에서 도 작용하는지를 알아보고자 luciferasereporterassay를 수행하였다.염기 서열 분석 결과 NF-κB이 예측되는 서열이 발견된 T3U(1.1),T3U(1.2),T3U(1.3), vector를 가지고 실험을 진행하였다.각 reportervector와 p65,p50발현 vector 를 함께 이입한 후 PMA 24시간 자극을 주고 luciferase활성을 측정하였다.그 결과 real-timeRT-PCR과는 다르게 p65를 함께 과발현 시켰을 때는 luciferase 활성이 억제되며,p50을 함께 과발현 시켰을 때는 대조군과 비슷한 luciferase활 성이 관찰되었다(Fig.9C).이러한 상반된 결과를 해석하기 위해 Chip assay가 수행되어야 할 것이다.
Fig.8.Theimplication ofAP-1sitewithin T3U(0.35)region in TIM-3 promoter activity. T3U(0.35)-luc, T3U(0.35/ap-1 mut)-luc vectors, respectively weretransfectedintoJurkatT cells.Thesecellswerestimulated with PMA(50 ng/ml)for24 hours.At48 hourposttransfection,luciferase activity was measured by luminometer and normalized to GFP exrpession level.** p<0.005.T3U(0.35/ap-1 mut);T3U(0.35) of which putative AP-1 bindingelementwasmutated.
A B
Fig.9.The role of NF-κB in PMA-induced TIM-3 expression.(A) JurkatT cellswere treated with LY294002(50 uM)as PI3K inhibitorfor30 min and then stimulated with PMA(50 ng/ml)for24 hours TIM-3 mRNA expression levels were analyzed by real-time RT-PCR. TIM-3 mRNA expression levelswerenormalized to GAPDH geneexpression.(B)JurkatT cells were transfected with pcDNA3(vector control),p65 or p50 expression vector and then stimulated with PMA(50 ng/ml) for the indicated time. TIM-3mRNA levelswereanalyzedby real-timeRT-PCR and normalized to GAPDH gene expression. (C) Jurkat T cells were transfected with the indicated luciferase reporter vector together with pcDNA3, p65 or p50 expression vector.These cells were stimulated with PMA(50 ng/ml)for24 hours.At 48 hour post transfection,luciferase activity was measured by luminometerandnormalizedtoGFP expressionlevel.**p<0.005
F.HMC-1세포에서 SMAD 의존적 경로를 통한 TIM-3전사 조절 TGF-β에 의한 신호 전달은 위의 실험에서와 같이 SMAD 비의존적 경로를 거치기도 하지만 대표적으로는 SMAD 의존적 경로가 잘 알려져 있다.그러므로 HMC-1세포에서 TGF-β에 의해 TIM-3의 발현이 증가되는 것이 SMAD 의존 적 경로와 관련되는지를 확인해 보았다. HMC-1세포에 SMAD 경로를 억제하는 inhibitor를 처리한 후 TGF-β 자극 을 주고 real-time RT-PCR로 TIM-3 mRNA 발현을 측정하였다.그 결과 inhibitor를 처리하지 않았을 때 TGF-β 자극에 의해 TIM-3 mRNA 발현이 약 8배 정도 증가한 반면,SMAD inhibitor를 처리하고 자극을 주었을 때에는 자극 을 주지 않은 것과 동일한 수준의 TIM-3mRNA 발현이 관찰되었다(Fig.10). 그러므로 HMC-1세포에서 TIM-3mRNA 발현 조절에 SMAD 의존적 경로 가 관여할 가능성을 확인하였다.
Fig.10.The induction ofTIM-3 mRNA levelby TGF-β stimulation was attenuated by SMAD inhibitorin HMC-1 cells.HMC-1 cells were treated with SB431542(5 uM), a SMAD inhibitor for 30 min and then stimulated with TGF-β(2 ng/ml) for 6 hours.TIM-3 mRNA levels were analyzed by real-time RT-PCR and normalized to GAPDH gene expression. **p<0.005
Ⅳ.고 찰
본 연구에서는 T 세포와 비만세포에서 TIM-3발현 조절에 중요한 세포 내 신호 전달 과정과 TIM-3 promoter 부분을 분석하였다. 먼저 두 세포에서 TIM-3발현 변화를 일으키는 자극에 차이가 있음을 보였으며,PMA 자극에 의 한 T 세포의 TIM-3발현 조절에 MEK 경로가 관여하고,TIM-3promoter-1.5 kb부분이 PMA 자극과 MEK 활성에 반응하는 것을 밝혔으며 NF-κB가 관여할 가능성을 제시하였다.또한 T 세포에서 PMA 자극에 의해 TIM-3전사 활성을 조절할 가능성 있는 TIM-3promoter의 약 20bp부분을 동정하였다.한편 비만 세포에서 TGF-β 자극에 의한 TIM-3발현 증가에 SMAD와 MEK 활성이 모두 관여할 가능성을 관찰하였으며,TIM-3promoter부분 -1.8kb는 TGF-β에 반응 하지 않는 것을 관찰하였다.
T 세포에서 TIM-3 발현이 anti-CD3/CD28 또는 PMA, PMA와 ionophore(A23187)동시 자극에 의해 증가된다고 알려져 있다(William 등,2009). 본 연구에서도 JurkatT 세포와 인간 CD4+T 세포를 PMA로 자극했을 때 자극 시간에 따라 TIM-3 발현이 증가되는 것을 확인하였으나 ionophore단독으로는 TIM-3발현에 변화가 나타나지 않는 것을 보였다.또한 JurkatT 세포를 PMA 와 ionophore로 동시에 자극했을 때와 PMA 단독 자극했을 때 TIM-3발현 증 가량이 유사함을 보였다.그러나 PMA와 ionophore동시 자극 후 TIM-3 발현 변화 분석을 24시간에서만 수행하였으므로 다양한 시간에서 동시 자극이 TIM-3 발현에 어떠한 영향을 미치는지 조사되어야 할 필요가 있다.T 세포는 TGF-β 에 의한 TIM-3발현 변화가 관찰되지 않은 반면 비만세포에서 TGF-β 자극에 의해 TIM-3 발현이 증가된다는 이전 보고(Wiener등,2006)와 마찬가지로 본 연구에서도 비만세포주인 HMC-1세포에서 TGF-β 자극에 의해 TIM-3발현이 증가되는 것을 관찰할 수 있었다.또한 HMC-1세포를 PMA로 자극했을 때에도 TIM-3 발현이 증가되는 것을 밝혔다.이러한 결과는 세포와 자극의 종류에 따 라 TIM-3의 발현이 다르게 조절되고 있음을 제시한다.
본 연구에서 MEK 활성 경로가 TIM-3 발현 조절에 관여함을 보였다. MAPK 경로는 TCR 자극에 의해 활성화되며 PMA 자극에 의해서도 활성화 될 뿐만 아니라,TGF-β 자극에 의해서도 활성화 되는 경로이다.대표적인 MAPK 경로인 p38,JNK,MEK에 대한 inhibitor를 이용하여 실험한 결과 PMA 자극된 Jurkat T 세포와 TGF-β 자극된 HMC-1 세포에서 모두 MEK inhibitor가 TIM-3발현 조절에 영향을 미치는 것이 관찰되었다.이에 더해 MEK-2를 과발 현하는 JurkatT 세포에서 대조군에 비해 PMA 자극에 의한 TIM-3발현이 더 빠른 시간에 더 크게 증가하는 것이 관찰되었다.또한 TIM-3 promoter(약 1.5 kb)가 T 세포에서 PMA 자극에 반응하여 유전자 발현을 증가시켰으며,MEK inhibitor에 의해 활성이 감소되는 것을 관찰할 수 있었다.본 연구에서는 이러한 결과들을 통해 T 세포와 비만세포에서 TIM-3발현 조절에 MEK 경로가 공통적 으로 관여할 가능성을 최초로 제시하였다. TIM-3 발현 조절에서 MEK 활성에 의해 인산화되는 ERK의 중요성은 JurkatT 세포와 HMC-1세포에서 다를 수 있다.JurkatT 세포에서는 PMA 자 극 후 빠른 시간 내에 ERK의 인산화가 진행되었다가 시간이 지남에 따라 인산 화도 감소되는 것을 관찰할 수 있었으나,HMC-1 세포에서는 자극 이전에도 ERK의 인산화가 관찰되었으며,TGF-β 자극에 의한 ERK 분자의 인산화 증가 가 관찰되지 않았다.이러한 결과는 아마도 T 세포에서 PMA 자극 후 초기 시 간에 MEK-ERK 신호가 활성화되고 이러한 신호 전달에 의해 또 다른 분자가 활성화되어 TIM-3발현을 조절할 것을 제시한다.또한 이러한 결과는 비만세포 에서 TGF-β 자극에 의한 TIM-3발현에 일반적으로 잘 알려진 MEK-ERK 경 로가 아닌 다른 경로를 통해 TIM-3발현이 조절될 가능성을 제시한다.TIM-3 발현 조절에 있어 ERK의 역할에 대한 연구는 추후 진행되어야 한다.
본 연구에서는 TIM-3promoter-892/-870bp와 -144/-121bp가 JurkatT 세포에서 PMA 자극에 의한 TIM-3발현에 중요하게 작용하는 부분이라는 것을 밝혔다.현재까지 인간 TIM-3 발현 조절에 관여하는 promoter부분을 보고한 연구는 NK 유사 세포인 YT 세포에서 TIM-3polymorphisms과 알러지성 표현
형 간의 관련성을 분석함으로써 -214/+58bp와 -1.6kb/-914bp 부분이 중요하 다고 밝혔다(Zhang 등,2009).이 부분은 본 연구 결과에서 밝힌 promoter부분 을 포함하므로 T 세포와 NK 세포 모두에서 이 DNA 부분이 중요하게 작용할 가능성을 제시한다.이 promoter부분의 염기 서열을 바탕으로 결합 가능성 있는 전사 인자를 TESS site를 통해 분석해 보면 -892/-870 bp에는 Ets-2(v-ets erythroblastosisvirusE26oncogenehomolog2),Dof-2(DNA bindingwithone finger2),TCF-1(T cellfactor-1),TBP(TATA box binding protein),TFⅡ D(Transcription factorⅡD), LEF(Lymphoid enhancer-binding factor 1), MNB(DYRK1A(human), dual-specificity tyrosine-(Y)- phosphorylation regulated kinase 1A) 등이 있으며, -144/-121 bp 부분에는 Ets, TCF, Elf(E74-like factor 1 (ets domain transcription factor)), LEF, Dof, IRF-1(Interferon regulatory factor1),HOXA5(Homeobox protein Hox-A5)등 이 있다.이러한 전사 인자들 중 Elf-1은 여러 조혈모세포의 전사 조절에 관여한 다고 알려져 있으며 PKCθ에 의해 인산화 된다고 보고되어 있다.Elf-1은 Jurkat T 세포와 인간 T 세포에서 TCR zeta유전자의 promoter에 결합하여 그 유전자 의 전사를 활성화시킨다는 보고가 있다(George등,2003).한편 HMC-1세포에 서는 TGF-β 자극에 반응하는 promoter부분이 -1.8kb 내에서 관찰되지 않았 다. 본 연구에서는 T 세포에서 TIM-3 발현 조절에 AP-1과 NF-κB가 관련할 가능성을 보였다.AP-1과 NF-κB는 각각 MEK과 PKC 경로에 의해 활성화되어 다양한 유전자의 활성을 조절하는 전사 인자로 작용한다.먼저 AP-1의 관련성을 시험하고자 TIM-3 promoter -179/-169 bp에 있는 AP-1 결합 예상 부분이 mutation 된 promoter로 실험한 결과 PMA 자극에 의한 TIM-3promoter활성 이 억제되는 결과를 얻었고,-915/-870 bp 사이의 AP-1 결합 예상 부분을 deletion 시켰을 때 TIM-3promoter활성이 오히려 증가되는 결과를 얻었다.이 러한 결과는 AP-1이 TIM-3 promoter활성 조절에 관여할 가능성을 제시한다. NF-κB는 PKC 외에 PI3K 경로에 의해서도 활성화된다고 알려져 있다.T 세포
에 PI3K에 대한 inhibitor를 처리했을 때 TIM-3 발현이 억제되었으며 NF-κB 소단위인 p65를 과발현 시켰을 때 TIM-3발현이 증가되었고 p50을 과발현 시켰 을 때에는 TIM-3발현이 억제되는 것을 관찰할 수 있었다.이러한 결과는 AP-1 과 NF-κB가 T 세포의 TIM-3발현 조절에 관여할 가능성을 제시한다.현재까 지 밝혀진 TIM-3발현 조절에 관여하는 전사 인자는 마우스 CD4+ T 세포에서 T-bet(Anderson 등,2010),단핵구에서 STAT6 정도이다(Zhao 등,2009).최근 TIM-3발현 조절 기작에 대한 연구에서 마우스 CD4+ T 세포에서 T-bet이 관 여한다고 보고되었다.T-bet이 발현이 되지 않는 조건에서 TIM-3발현에 결함 이 생긴 것을 확인하였고 T-bet을 과발현 시켰을 때는 TIM-3가 계속적으로 발 현하는 것을 관찰할 수 있었다.또한 Chip assay를 이용하여 T-bet이 마우스 TIM-3promoter에 직접 결합하는 것을 확인하였다.이러한 결과를 통해 마우스 TIM-3유전자가 T-bet의 직접적인 전사 조절을 받는다는 것을 증명하였다.그 리고 비록 직접적인 결합의 증거는 확인되지 않았으나 STAT4가 결핍된 세포에 서도 TIM-3 발현이 감소된 것이 관찰되었기 때문에 STAT4가 마우스 TIM-3 발현을 조절하는데 있어서 직접적 또는 간접적으로 영향을 미칠 가능성이 있음 이 보고되었다.그러나 아직 T-bet과 STAT4가 인간 TIM-3발현 조절에도 영 향을 주는지는 확인되지 않았다. 현재까지 보고된 바로는 비만세포에서 TIM-3 발현이 TGF-β 자극에 의해 증가한다는 것은 밝혀졌으나 그 자극이 어떠한 경로를 통해 조절되는지는 아직 밝혀진 바 없다.다양한 세포가 TGF-β 자극에 의해 활성화되고 이러한 활성은 크게 SMAD 의존적 경로와 SMAD 비의존적 경로로 나뉜다.SMAD 의존적 경 로는 TGF-β 자극에 의해 인산화 된 SMAD 분자가 핵 내로 이동하여 유전자의 전사를 조절하고,SMAD 비의존적 경로는 MAPK 경로를 통해 유전자의 전사를 조절하게 된다.본 연구에서는 TIM-3발현이 비만세포에서 TGF-β 자극에 의해 증가되는 것을 관찰하였고 그 발현이 MEK 경로를 통해 조절될 가능성을 제시 함으로써 TGF-β 자극에 의해 비만세포에서 TIM-3발현이 SMAD 비의존적 경 로를 통해 조절될 가능성을 밝혔다.비만세포에 SMAD대한 inhibitor를 처리하였
을 때 TGF-β 자극에 의한 TIM-3 발현이 감소되는 것이 관찰되었으므로 SMAD 의존적 경로 또한 비만세포에서 TIM-3발현을 조절하는데 관여할 것으 로 생각되어진다.
TIM-3발현은 여러 질병에서 중요한 생물학적 결과를 가져온다.자가 면역 질환인 다발성 경화증(multiple sclerosis, MS)과 실험적 알러지성 뇌척수염 (experimentalallergicencephalomyelitis,EAE)모델에서 TIM-3의 발현이 정상 세포에 비해 감소되어 있었으며 IFN-γ의 분비가 증가되었다(Koguchi등,2006; Yang 등,2008).반면 HIV와 HCV에 감염된 환자에서는 TIM-3의 발현이 증가 되어 있으며 자극에 의한 T 세포 분화와 사이토카인 생산에 장애가 있고,이 T 세포의 TIM-3신호를 차단하면 세포 분화와 사이토카인의 생산이 증대되는 것 이 보고되었다(Jones등,2008;Golden-Mason 등,2009).그러므로 TIM-3발현 조절에 대한 이해는 이러한 질병에 대한 이해에 도움이 될 것이다. 본 연구에서는 PMA 자극에 의한 T 세포의 TIM-3발현 조절에 MEK 경로 가 관여하고,TGF-β 자극에 의한 HMC-1세포의 TIM-3발현 조절에 MEK 경 로와 SMAD 의존적 경로가 관여할 가능성을 제시하였다.또한 T 세포에서 TIM-3promoter-892/-870bp와 -144/-121bp가 TIM-3전사 조절에 중요하 게 작용함을 밝혔고,이러한 T 세포의 TIM-3발현 조절에 AP-1과 NF-κB 전 사 인자가 관여할 가능성을 제시하였다.본 연구 결과는 TIM-3발현 조절 이해 의 기초를 제공하며,TIM-3발현 조절이 병인에 관여하는 자가 면역 질환과 감 염성 질병의 이해와 치료법 개발에 도움이 될 것이다.
Ⅴ.결
론
TIM-3는 제 1형 세포 표면 당단백질로 활성화 된 T 세포와 TGF-β 자극에 의해 비만세포에서 발현된다고 알려져 있다.그러나 아직 TIM-3의 발현을 조절 하는 분자생물학적 기작은 잘 알려져 있지 않다.그러므로 본 연구에서는 면역 반응에 중요한 T 세포와 비만세포에서 TIM-3의 발현이 조절되는 분자생물학적 기작을 밝히고자 하였다. 먼저 T 세포주인 Jurkat T 세포와 비만세포주인 HMC-1 세포에서의 TIM-3 발현을 관찰하였고,JurkatT 세포는 PMA 또는 PMA와 ionophore 동시 자극에 의해 TIM-3 발현이 증가되고 HMC-1 세포는 TGF-β와 PMA 자극에 의해 TIM-3발현이 증가되는 것을 관찰하였다.TIM-3 발현 경로에 대한 실험한 결과 JurkatT 세포에서는 MEK-ERK 경로,HMC-1 세포에서는 MEK 경로와 SMAD 의존적 경로가 관여할 것으로 생각되어진다. TIM-3 발현에 중요한 promoter부분을 찾아보고자 TIM-3 promoter를 다양한 길이로 reportervector에 cloning하여 luciferaseassay를 진행한 결과,JurkatT 세포에서 TIM-3 promoter-892/-872 bp 부분과 -144/-121 bp 부분이 TIM-3 발현에 중요한 것으로 관찰되었고,AP-1과 NF-κB가 T 세포에서 TIM-3 발현 조절에 관여할 가능성을 제시하였다.참 고 문 헌
1.Anderson AC,etal.Th1 transcription factorT-betregulates the expressionofTim-3.EurJImmunol40:859-866,2010
2.EncinasJA,KuchrooVK.Mapping and identification ofautoimmunity genes.CurrOpinImmunol12:691-697,2000
3.Frisancho-KissS,NylandJF,DavisSE,BarrettMA,GatewoodSJ,Njoku DB,CihakovaD,SilbergeldEK,RoseNR,FairweatherD.Cutting edge:T cellIgmucin-3reducesinflammatoryheartdiseasebyincreasingCTLA-4 duringinnateimmunity.JImmunol.Jun1;176(11):6411-5,2006
4.George C.Tsokos,Madhusoodana P.Nambiar,Yuang-taugn Juang. Activation oftheEtstranscription factorElf-1requiresphosphorylation andglycosylation:DefectiveexpressionofactivatedElf-1isinvolvedin thedecreased TCR ζ chain geneexpression in patientswith Systemic LupusErythematosus.Ann.N.Y.Acad.Sci.987:240-245,2003
5.Golden-MasonL,etal.NegativeimmuneregulatorTim-3isoverexpressed on T cells in hepatitis C virus infection and its blockade rescues dysfuctioalCD4+andCD8+T cells.JVirol.83:9122-9130,2009
6.Jones RB,etal.Tim-3 expression defines a novelpopulation of dysfunctionalT cellswith highly elevated frequenciesin progressive HIV-1infection.JExpMed.205:2763-2779,2008
7.KobayashiN,et al.TIM -1 and TIM -4 glycoproteins bind phosphatidylserineand mediate uptakeofapoptoticcells.Immunity.
27:927-940,2007
8.KoguchiK,etal.Dysregulated T cellexpression ofTIM3in multiple sclerosis.JExpMed.203:1413-8,2006
9.KuchrooVK,Dardalhon V,Xiao S,Anderson AC:New rolesforTIM familymembersinimmuneregulation.Nat.8:577-580,2008
10.Lee J,Su EW ,Phuah J,Hainline S,Kane LP.Determination of cytoplasmictyrosineresiduesofTIM-3involvedin regulation ofTCR signaling[abstract].JImmunol.182:35,2009
11.Marsh DG,etal.LinkageanalysisofIL4andotherchromosome5q31.1 markersand totalserum immunoglobulin E concentrations.Science.
264:1152-1156,1994
12.McIntireJ,etal.Immunology:hepatitisA viruslinktoatopicdisease.
Nature.425:576,2003
13.McIntireJJ,Umetsu DT,DeKruyffRH.TIM-1,a novelallergy and asthmasusceptibility gene.SpringerSeminImmunopathol.25:335-348, 2004
14.MiyanishiM,TadaK,KoikeM,UchiyamaY,KitamuraT,NagataS. Identification ofTim4 as a phosphatidylserine receptor.Nature.
15.Monney L,etal.Th1-specificcellsurfaceprotein Tim-3 regulates macrophageactivation andseverity ofan autoimmunedisease.Nature.
415:536-541,2002
16.NakayamaM,etal.Tim-3mediatesphagocytosisofapoptoticcellsand thecross-presentation.Blood.113:3821-3830,2009
17.Rodriguez-ManzanetR,DeKruyffR,Kuchroo VK,Umetsu DT.The costimulatoryroleofTIM molecules.ImmunolRev.229:259-270,2009
18.SabatosDA,ChakravartiS,ChaE,SchubartA,Sanchez-FueyoA,Zheng XX,CoyleAJ,Strom TB,Freeman GJ,Kuchroo VK:Interaction of Tim-3 and Tim-3 ligand regulates T helpertype 1 responses and inductionofperipheraltolerance.NatImmounol.4:1102-1110,2003
19.Sanchez-FueyoA,etal.Tim-3inhibitsT helpertype1-mediatedaut o-and alloimmuneresponsesand promotesimmunologicaltolerance.Nat
Immunol.4:1093-1101,2003
20.Su EW ,Lin JY,Kane LP.TIM-1 and TIM-3 proteins in immune regulation.Cytokine.44:9-13,2008
21.Umetsu SE,etal.TIM-1 inducesT cellactivation and inhibitsthe developmentofperipheraltolerance.NatImmunol.6:447-454,2005
22.WienerZ,etal.TIM-3isexpressedinmelanomacellsandisupregulated inTGF-Betastimulatedmastcells.JInvestDermatol.127:906-914,2007
23.WienerZ,KohalmiB,PoczaP,JeagerJ,TolgyesiG,Toth S,GorbeE, Papp Z,Falus A.TIM-3 is expressed in melanoma cells and is upregulated in TGF-beta stimulated mastcells.J InvestDermatol.
Apr;127(4):906-914,2007
24.William D.Hastings,etal.TIM-3isexpressedonactivatedhumanCD4+ T cells and regulates Th1 and Th17 cytokines.EurJ Immunol.
39(9):2492-2501,2009
25.Yang L,etal.Lack ofTIM-3immunoregulation in multiplesclerosis.
Jimmunol.180:4409-14,2008
26.Zhang J,etal.LackofassociationofTIM-3polymorphismsandallergic phenotypes.BMC MedicalGenetics.10:62,2009
27.ZhaoJ,etal.Human pregnancy up-regulatesTim-3in innateimmune cellsforsystemicimmunity.JImmunology.182:6618-6624,2009
28.ZhuC,etal.TheTim-3ligandgalectin-9negativelyregulatesT helper type1immunity.NatImmunol.6:1245-1252,2005
ABSTRACT
-Regul
at
i
on Mechani
smsofTI
M-3expr
essi
on
i
n J
ur
katT cel
l
sandHMC-1cel
l
s
SuJinYun
DepartmentofBiomedicalSciences TheGraduateSchool,AjouUniversity
(SupervisedbyAssociateProfessorSunPark)
T cellimmunoglobulin and mucin domain-3(TIM-3) is expressed on T lymphocytes and mastcells.TIM-3 plays an importantrole in the immune responses butmolecular pathways thatregulate TIM-3 expression has not been wellexplored.In this study I found that TIM-3 transcription was increased in Jurkat T cells and HMC-1 cells by PMA and TGF-β stimulation,respectively.TIM-3induction wasinhibitedbyMEK inhibitionin both cells.Moreover,TGF-β-induced TIM-3 expression was inhibited by a SMAD inhibitorin HMC-1cells.Using luciferasereporterassay,Iidentified two regionsimportantforTIM-3transcription in JurkatT cells.From -892 to-870and-144to-121relativetothetranscriptionstartsiteisinvolvedin PMA-inducedtranscriptionofTIM-3.Inconclusion,ourresultssuggestMEK and SMAD pathways involved in TIM-3 transcription in T cells and mast cells,respectively.