저작자표시-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. l 이 저작물을 영리 목적으로 이용할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위 논문
TI
S21에 의한 세포이동 및
침투억제 연구
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
임 서 경
TI
S21에 의한 세포이동 및
침투억제 연구
지도교수
박 태 준
이 논문을 이학 석사학위 논문으로 제출함.
2011년
8월
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
임 서 경
임서경의 이학 석사학위 논문을 인준함.
심사위원장
박
태
준
인
심 사 위 원
임
인
경
인
심 사 위 원
윤
계
순
인
아 주 대 학 교
대 학 원
2011년 6월 23일
i
- 국문요약 –
TIS21 에 의한 세포이동 및 침투 억제연구
TIS21/BTG2/PC3 ( 12 -O- tetradecanoylphorbol -13- acetate - inducible sequence21 )는 p53 에 의해 유도되는 유전자로서, 증식억제 유전자 중 하나로 알려져 있다. 실제로, 본 연구에서 세포종류에 상관없이 TIS21 이 세포 내에서 과 발현 되면 세포 증식이 감소하는 것은 물론 세포 크기 또한 작아진다는 것을 관찰한 바 있다. TIS21 는 17KDa 의 매우 작은 크기의 유전자이지만, 암세포의 세포주기 및 세포분화에 역할을 한다고 보고 되어 왔다. TIS21 이 암세포에 중요한 기능을 하고 있을 가능성에도 불구하고 TIS21 과 암 전이에 관련한 기전에 대하여 알려진 바가 미미하다. 본 연구에서는 폐암세포 중 하나인 A549 세포에 아데노바이러스 TIS21(Ad-TIS21)을 과 발현 시켜 실험을 진행하였다. TIS21 이 과 발현된 세포 내에서 focal adhesion kinase(FAK) 의 Y576 과 Y925 의 인산화가 감소하는 것을 관찰하였고, TIS21 의 과 발현된 세포에서 FAK 의 상위 단계인 c-Src 의 활성도가 감소하는 것을 관찰하였다. TIS21 과 발현 세포 내에서 환원된 Src 이 증가하였으며, reactive oxygen species(ROS) 생성이 감소하였다. 또한 TIS21 은 FoxM1 의 인산화을 감소시켰고, matrix metalloprotase2(MMP2)의 발현 또한 감소시켰다. 또한 세포의 이동과 침투에 연관한 TIS21 의 기능을 AKT 가 조절하고 있는다. 이는 우리가 AKT 에 의해 TIS21 이 인산화가 되는 잔기를 변이 시킨 시스템을 사용하여 증명을 하였다. 그 결과, TIS21-Wt 그리고 탈 인산화 TIS21(TIS21-S31A)이 발현된 암 세포에서는 wound healing 저해, FAKY576의 인산화 감소 그리고 MMP-2 mRNA
발현의 감소를 보이는데 반하여 AKT 에 의해 인산화 TIS21 은 이러한 현상들이 나타나지 않고, 정상 암세포가 나타내는 양상과 비슷하게 회복되었다. 그러므로, 본 연구에서는 TIS21 이 미토콘드리아에서의 ROS 생성을 감소 시킴으로써
ii Src 의 활성을 감소 시키고 FoxM1 인산화의 감소에 따른 MMP2 발현을 억제하며, 이러한 기전은 AKT 키나아제에 의해 조절된다고 제시하고 있다. 그러므로 우리는 TIS21 과 발현 시스템에서 이러한 기전을 통하여 세포의 이동성과 침투성을 억제한다는 결론을 내었다. 핵심어: AKT, TIS21/BTG2/PC3, FAK, Src, MMP-2, ROS, FoxM1, Mitochondria
iii
차례
국문요약 ⅰ 차례 ⅲ 그림 차례 ⅵ Ⅰ. 서론 1 Ⅱ. 재료 및 방법 4 A. cell culture 4 B. Adenovirus preparation 4 C. Immunocytochemistry 4 D. Immunoblot analysis 5 E. Immunoprecipitation 5 F. Wound healing assay 6 G. Migration and invasion assay 6 H. In vitro Src kinase assay 7 I. Measurement of Src oxidation 7 J. Measurement of ROS 8 K. Gelatin zymography 8 L. RT-PCR 9iv
M. Generation of mitochondria targeting TIS21 9 N. Statistical analysis 10 Ⅲ. 결과 11 Part A. 1. TIS21 에 의한 A549 세포의 이동과 침투 11 2. TIS21 에 의한 FAK 활성의 억제 13 3. TIS21 에 의한 Src 키나아제 활성의 저해 15 4. TIS21 에 의한 ROS 생성감소와 Src 의 환원간의 상관관계 17 5. TIS21 에 의한 antioxidants 발현의 변화 19 6. 미토콘드리아로의 TIS21 위치와 그에 따른 ROS 생성 20 7. MT-TIS21 에 의한 암 세포 이동의 저해 21 8. TIS21 에 의한 matrix metalloproteinase-2 활성 저해 23 9. TIS21 에 의한 forkhead box M1(FoxM1)의 인산화 저해 24 Part B.
10. AKT 와 TIS21 과의 결합 25 11. AKT 에 의한 TIS21 의 인산화 26 12. TIS21 인산화에 따른 세포 이동저해 억제 27 13. TIS21 인산화에 따른 MMP-2 발현 억제 소실 29
v
Ⅳ. 고찰 30
Ⅴ. 결론 33
참고문헌 34
vi
그림차례
Part A.
Fig. 1. TIS21 inhibits cancer cell migration 11
Fig. 2. TIS21 inhibits cancer cell migration. 12
Fig. 3. TIS21 inhibits cancer cell invasion. 12
Fig. 4. TIS21 inhibits FAK tyr575 and tyr925 residues phosphorylation. 14
Fig. 5. TIS21 interaction with Src activity independently. 16
Fig. 6. TIS21 inhibits Src kinase activity. 16
Fig. 7. TIS21 increases Src reduction via reduction of ROS. 18
Fig. 8. Expression level of various antioxidants did not change
by TIS21. 19
Fig. 9. TIS21 locates in mitochondria and inhibits ROS generation. 20
Fig. 10. Migration of cells inhibits cancer cell by MT-TIS21. 22
Fig. 11. TIS21 inhibits MMP-2 expression. 23
Fig. 12. TIS21 inhibits FoxM1 phosphorylation. 24
Part B.
Fig. 13. AKT interacted with TIS21 in Huh7 cells. 25
vii
Fig. 15. Phospho-mimic TIS21 S31D mutant could not inhibit cancer cells
migration. 28
Fig 16. Phospho-mimic TIS21 S31D mutant could not inhibit FAKY576
phosphorylation. 28
Fig. 17. Phosphorylated TIS21 could not inhibit MMP-2 mRNA expression
1
Ⅰ. 서론
TIS21/BTG2/PC3 는 antiproliferative gene family(APRO)로써 다양한 암세포
에서 암 억제유전자로 밝혀져 있다(Atfi et al., 1994; Bian et al., 1997; Borghaei at al., 2004). BTG2는 정상 상피세포에서 발현되지만, 신장암, 전립선암 그리고 간암 같은 다양한 암 조직에서 BTG2의 발현이 소실된다(Bian J et al., 1997; Borghaei at al., 2004; Brown at al., 1996; Calalb at al., 1995; Chiarugi at al., 2003). 게다가 전이성 유방암에서 BTG2의 발현이 확연히 감소된다.( Chiarugi at al., 2003; Cooper at al., 1993). 또한 암에서의 BTG2의 발현은 전이과정에서 중요한 역할을 한다(Chiarugi at al., 2003; Cooper at al., 1993). 이렇듯 전이 과 정에 BTG2가 의미있게 관여하게 된다는 가능성이 보여지지만, 아직까지는 전이 과정에서 나타나는 암세포의 이동이나 침투와 BTG2와의 상관관계가 명확히 밝 혀지지 않았다. 암은 대부분 죽음을 유도한다. 암을 개선하기 위한 다양한 치료법이 나오고 있지만, 여전히 암은 건강을 위협한다. 암이 죽음을 부르게 되는 가장 큰 원인은 전이라고 해도 과언이 아니다. 암세포가 전이될 때, 세포는 기저막으로의 침투, 세포의 이동 및 성장 등의 다양한 과정을 거쳐 다른 조직에 암 세포를 퍼뜨리는 아주 위험한 현상이다. 많은 세포골격에 관여하는 단백질들은 세포와 세포(Cell-Cell), 세포와 세포외기질(Cell-ECM) 에 관여하고 더 나아가 세포의 이동이나 전이에 관계한다. 많은 암세포에서 facal adhesion kinase(FAK)는 focal adhesion과 actin 구조를 조절함으로써 다양한 경로를 통해 세포의 이동과 침투 에 관여한다(Giannoni at al., 2005, Giannoni at al., 2010). FAK은 전부 여섯개의 인산화가 가능한 잔기를 가지고 있는데, 이 잔기들은 자극의 종류에 따라서 선택 적으로 인산화가 된다(Fantel at al., 2002). 암세포에서의 FAK의 인산화에 의한 활성은 FAK의 다양한 하위 유전자들을 조절한다. FAK은 tyr397잔기에 자가 인 산화가 되면서 활성을 띠는데, 이렇게 활성화된 FAK은 Src의 SH2 도메인에 붙
2
는다(Grisaru-Granovsky at al., 2010; Hong at al., 2005). 이러한 인산화된 Src 과 FAKY397의 결합은 FAK의 tyr576와 tyr925를 인산화시킴으로써 FAK을 완전 히 활성화 시킨다(Lim at al., 1995; Lin at al., 1996). 이러한 FAK의 인산화는 암 세포의 이동성과 밀접한 상관관계가 있다.
게다가, Src의 활성화는 유방암, 전립선암 그리고 폐암 같은 악성종양의 성 장, 생존, 이동 그리고 전이의 원인이 된다(McLean G at al., 2005). Src의 활성 화에는 tyr527 탈인산화 잔기가 중요한 역할을 한다. Src의 tyr527잔기가 세포 내의 SH2도메인과 결합한 형태는 비활성화 형태로써 Src의 활성도가 떨어져 있 다(Mott at al., 2000). 이러한 비활성 상태에서 protein tyrosine phosphatases(PTPs)에 의한 tyr527의 탈인산화가 일어나면 활성형태로 전환된 다. SrcY527의 형태변화 이후에 인산화 잔기 Y416이 Src의 활성화에 의해 완전
한 활성화를 가지게 되는데(Nam at al., 2005; Park at al., 2008) 이때 ROS가 Src의 산화를 조절하여 Src을 완전하게 활성 시킨다(Prevot at al., 2000).
PI3K/AKT는 임간 암 세포에서 전이 기능을 조절하는 데에 중요한 유전자 이다. Gastric cancer, breast cancer, lung cancer, melanoma cell 같은 다양한 암 형성의 조기단계에서 PI3K/AKT가 증가해 있다. 다양한 암세포에서 세포의 이동과 침투가 기반되는 세포의 전이에는 AKT 뿐만 아니라 Erk, JNK, MAPK같 은 다양한 키나아제들이 관련되어 있다. 이렇듯 다양한 키나아제들은 각각의 하 위유전자의 활성을 조절하여 암 세포의 이동과 침투에 영향을 미친다. 이러한 키 나아제들은 또한 MMPs의 활성을 조절하여 암 세포의 침투에도 영향을 미친다 는 보고가 되어왔다. 현재 우리는 암세포의 이동과 침투에 있어서 TIS21의 역할을 조사하였다. 우리는 TIS21이 Src의 비활성과 FAK의 인산화를 감소시키는 데에 관여함으로 써 세포의 이동을 억제한다는 것을 입증하였다. 게다가 TIS21이 FoxM1의 인산
3 화 억제를 통한 MMP-2의 활성을 감소시킴으로써 암세포의 침투 역시 억제 한 다는 것을 밝혔다. 또한 AKT가 TIS21을 인산화 시킴으로써 이러한 세포이동성 및 침투성을 감소시키는 TIS21의 기능을 저해할 수 있는 가능성을 제시하는 바 이다.
4
Ⅱ. 재료 및 방법
A. Cell culture
A549(Human lung carcinoma), LnCaP, PC3 세포를 불활성화 시킨 fetal bovine serum(FBS, GIBCOBRL, Life technologies, NY) 10%와 1% antibiotics(GIBCOBRL, Life technologies, LY)를 첨가한 Rosewell Park Memorial Institute (RPMI 1640, GIBCOBRL, ) 또는 Dulbecco’s modified Eagle’ s medium(DMEM, GIBCOBRL, Bethesda, MD)에 배양했다.
B. Adenovirus preparation
CMV 인핸서와 치킨 β-actin 프로모터를 포함하는 E1, E3 가 제거된 아데노 바이랄 백터로 TIS21의 cDNA를 넣어준다. TIS21의 아데노바이러스(Ad-TIS21-HA)는 293 인간신장상피세포에서 증폭시켰고(Park at al., 2008), 바이러 스입자는 0.45 m 필터를 사용하여 정제하였다. 또한, 박테리아 -galactosidase 의 아데노바이러스 또한 대조군으로써 준비하였다.
C.Immunocytochemisry
A549 세포를 cover glass에서 배양 한 후, 4% paraformadehyde로 4 에서 20분간 고정해준 후, PBST(0.1% tween 20 이 포함된 PBS : 풀어써 주세요)로 5분간 3번 씻어준다. 세포를 실온에서 1시간 동안 PBST로 희석시킨 1.5% horse serum 으로 배양한다. 세포를 각각 일차항체 즉, anti-F-actin(Sigma, St, Louis, MO), anti-pFAKY925(Cell signaling, Danvers, MA), 그리고 hemagglutinin(HA, Santa Cruz Biotechnology, CA)으로 4 에서 하룻동안 배양
5
한다. 이차항체는(1:500) 1시간 동안 실온에서 배양한 후, 형광 현미경(Carl Zeiss, Axio Imager M1, Germany)으로 관찰한다.
D. Immunoblot analysis
세포 용출 액은 6~12%의 SDS-polyacrylamide gel electrophoresis(SDS-PAGE)을 통하여 분리된다. 분리된 단백질은 nitrocellulose membrane (Schleicher & Schuell, Dassel, Germany)로 옮겨진 후, FAK (Cell Signaling), p-FAKY397 (Cell Signaling), p-FAKY576 (Cell Signaling), p-FAKY925 (Cell Signaling), E-cadherin (Santa Cruz Biotechnology), p-SrcY416 (Cell Signaling),
p-SrcY527 (Cell Signaling), Src (Cell Signaling), p-Ser (BD transduction
laboratory, San Jose, CA), p-Thr (Zymed laboratory, San Jose, CA), FoxM1 (Santa Cruz Biotechnology), p-Erk1/2 (Epitomics, Burlingame, CA), p-AKT (Cell Signaling), p130CAS (Santa Cruz Biotechnology), hemagglutinin(HA) (Santa Cruz Biotechnology), paxillin (Santa Cruz Biotechnology), JNK (Santa Cruz Biotechnology), and b-actin (Sigma, St. Louis, MO)에 대한 항체로 4℃에 서 약 12시간 동안 처리한다.
E. Immunoprecipitation
Ad-LacZ 그리고 Ad-TIS21이 과 발현된 A549 세포를 E1A buffer로 용출 시키고, sonicator로 10초씩 3번 세포를 깨준다. 10,000rpm에서 5분간 원심분리 시켜준다. 상등액을 취한 후 각각 anti-FAK과 anti-FoxM1으로 4 에서 8시간 동안 반응시킨다. protein G-agarose beads(Invitrogen, Carlsbad, CA)를 넣고 4
6
blot을 수행한다.
F. Wound healing assay
3X105 의 A549 세포를 12well plate에 seeding 후 12시간 후에, Ad-LacZ 와 Ad-TIS21를 각각 100MOI 씩 infection 시킨다. 4시간 후 yellow tip으로 세 포를 긁어준 후, 10% serum이 포함된 RPMI로 3번 세포 찌꺼기를 제거한다. 그 후 현미경으로 세포간의 거리를 관찰 하고, 이틀 뒤 현상과 비교한다.
G. Migration and Invasion assay
Migration 과 Invasion 모두 transwell plate(24well, 8 m pore size; Costar, Cambridge, MA)를 사용하였다. 먼저 migration assay는 아래 구획에 10%혈청 이 포함된 RPMI 500 l로 채우고, 윗 구획에는 2X104 의 A549 세포를 100ul의
혈청이 포함되지 않은 RPMI로 풀어주어 채워준다. 그 후, 37OC 인큐베이터에서 12시간 동안 배양한다. 그 다음 insert 부분을 100% 메탄올로 세포를 10분간 고정시켜 주고, Haematoxylin과 Eosin을 차례로 5분씩 염색해준다. 그 후, PBS 로 여러 번 헹구어 준다. 필터를 말리기 전에 면봉으로 안쪽 세포 즉, migration 을 하지 않은 세포를 닦아준다. 필터를 자연건조 시킨 후, 현미경으로 migration 하는 세포의 개수를 샌다. 세포의 invasion(전이)실험 역시 transwell을 사용한다. 윗 구획의 필터 안 쪽에 Matrigel과 혈청이 포함되지 않은 RPMI의 비율이 1:3이 되도록 섞어주고, 이 혼합액을 50 l 넣어준다. 그 후, 상온에서 3시간 동안 건조시킨 후, 역시 혈 청이 포함되지 않은 RPMI로 rehydration시켜준다. 아래 구획에 10%혈청이 포 함된 RPMI 500 l로 채우고, 윗 구획에는 2X104 의 A549 세포를 100 l의 혈청 이 포함되지 않은 RPMI로 풀어주어 채워준다. 그 후, 37도 인큐베이터에서 30시
7 간 동안 배양한다. 그 다음 insert 부분을 100% 메탄올로 세포를 10분간 고정 시켜 주고, Haematoxylin과 Eosin을 차례로 5분씩 염색해준다. 그 후, PBS로 여 러 번 헹구어 준다. 필터를 말리기 전에 면봉으로 안쪽 세포 즉, migration을 하 지 않은 세포를 닦아준다. 필터를 자연건조 시킨 후, 현미경으로 invasion 하는 세포의 개수를 비교한다.
H. In vitro Src kinase assay
In vitro Src kinase 실험시 필요한 기질로써 enolase를 사용하였다 (Atfi at al., 1994). 간단하게 설명하자면, 4X106 개의 A549세포를 각각 Ad-LacZ 또는
Ad-TIS21으로 infection 시킨 후 2일 뒤에 500 l 의 RIPA buffer 로 세포를 용 해시킨다. 그리고, 500 g의 단백질을 anti-c-Src으로 면역침강법을 시행한다. 샘 플의 반은 전기영동을 시행하고, 나머지 반으로 c-Src 의 활성도를 측정한다. 5 g의 산으로 변성된 enolase(Sigma)는 면역침전체와 반응하게 하고, 반응용액 (20mM PIPES, pH7.0, 10mM MnCl2, 10mM Na3VO4)에 녹아있는 [ -32P] ATP
의 10 Ci와 10분 동안 30 에서 반응시킨다. 각각의 샘플은 SDS-PAGE gel을 사용하여 전기 영동한다. 전기영동한 젤은 자가방사법으로 분석한다.
I. Measurement of Src oxidation
Src의 산화력을 보기 위해서는 N-(biotinoyl)-N ’ -(iodoacetyl) ethylenediamine (BIAM)을 붙이는 방법을 사용한다 (Giannoni at al., 2005). 먼 저, 4x106 개의 A549 세포를 각각 Ad-LacZ 또는 Ad-TIS21으로 infection 시
8
100 M BIAM 이 포함된 0.5ml의 용출용액 (50mM Tris-HCl, pH7.5, 150mM NaCl, 0.5% [vol/vol] Triton X-100, 10 g/ml aprotinin, and 10 μg/ml leupeptin) 으로 얻어진 세포를 용출시킨다. Sonicator를 사용하여 10초간 세포를 깨주고, 10초간 얼음에서 방치해준다. 이 과정을 3번 반복하고 세포 용출 액을 상온에서 15분간 방치해준다. 세포 용출 액을 원심분리기를 사용하여 4 ℃ 에서 10,000rpm으로 10분간 돌려준 후, 상등액을 얻는다. 그 다음 anti-c-Src을 사 용하여 면역침전법을 시행한다. 그 후 HRP-활용한 streptavidin과 ECL을 사용 하여 산화정도를 관찰한다. J. Measurement of ROS 세포 내에서 생성되는 ROS를 측정 하기 위해서는 dichlordihydrofluorescin diacetate(DCF-DA) 형광물질을 사용하였다 (Chiarugi at al., 2003). 4x106 개의
A549 세포를 각각 Ad-LacZ 또는 Ad-TIS21 으로 infection 시킨 후 2일간 배 양한다. 그 다음 20 M이 되게 DCF-DA를 처리하여 37 인큐베이터에서 15분 간 배양한다. 그 다음 trypsin을 사용하여 세포를 얻어내고, 10,000rpm에서 5분 간 centrifuge 해준다. 펠렛을 PBS로 1번 씻어주고, 다시 centrifuge 해준 후, polystyrene round-bottom tube에 수집해준다. 그 다음 FACS(BD FACS Canto II, BD Biosciences, San Jose, CA) 분석을 해준다.
K. Gelatin zymography
먼저 1x106 개의 A549 세포를 24well 에 깔고, 각각 LacZ 또는 Ad-TIS21 으로 infection 시킨 후 24 시간 동안 배양한다. 혈청이 들어가지 않은 RPMI로 2번 씻어준 후 250 l의 배지로 37 이산화탄소 인큐베이터에서 24 시
9
간 동안 배양한다. 상등액을 얻어낸 후 10,000rpm 으로 4 에서 5분간 원심분 리 해준다. 상등액을 얻어낸 후 0.1%의 gelatin(Sigma) 이 포함된 9% SDS-PAGE로 전기영동 해준다. 그 다음, 젤을 워싱용액(200 mM NaCl, 5 mM CaCl2, 5 mM ZnCl2, 2.5 % Triton X-100, and 50 mM Tris-HCl, pH 7.5)으로 10분씩 3 번 씻어주고, developing 용액(without Triton X-100 in washing buffer)으로 37 이산화탄소 인큐베이터에서 12 시간 동안 보관한다. 젤을 Coomassie brilliant blue로 염색해준 후, destaining 용액으로 여러 번 염색을 빼주면 된다. L. RT-PCR
각각 A549 세포와 human diploid fibroblast(HDF)세포에서 RNA 를 추출한 다. 1 g 의 RNA로부터 oligo-dT primer를 사용하여 first strand cDNA를 합성 한 다. 프라이머는 각각 BTG2, sense 5 ’ -cctgggcagagagtgaaaag-3 ’ and antisense 5’-cctgggcagagagtgaaaag-3’; human glyceraldehyde-3-phosphate dehydrogenase (GAPDH): sense 5’-ggtgctgagtatgtcgtgga-3’ and antisense 5’ -gccatgccagtgagcttccc-3’; MMP-2: sense 5’-gtgctgaaggacacactaaagaaga-3’ and antisense 5 ’ -ttgccatccttctcaaagttgtagg-3 ’ ; MMP-3: sense cgcctgtctcaagatgatataaat-3’ and antisense 5’-ctgacagcatcaaaggacaa-3’으로 사용하였다. PCR의 조건은 denaturation은 94 에서 30초, annealing은 58 에 서 40초, extension은 72 에서 40초로, 모두 32싸이클로 반응 시켰다. PCR반 응물 확인은 2%의 아가로스 젤을 사용하였다.
M. Generation of mitochondria targeting TIS21
10
미토콘드리아에 TIS21가 위치함에 따른 역할을 분석하기 위하여, 우리는 미토콘 드리아를 표적으로 하는 TIS21 바이러스(MT-TIS21)를 제작하였다. 미토콘드리 아의 complexII를 표적하는 시퀀스는 TIS21의 N-terminus에 삽입하였다. N. Statistical analysis
정량화 시킨 데이터는 모두 독립된 여러 번의 실험의 결과를 standard deviation(SD)로 표기했다. 모든 정량 데이터는 t-test를 수행하였으며, p-value<0.05 로써 의미 있게 보여진다.
11
Ⅲ. 결과
Part A.
A. TIS21에 의한 세포 이동 및 세포 침투 억제 연구 우리는 이전에 다양한 암 세포와 암 조직에서 TIS21의 발현이 감소되어 있 는 것을 보고 한 바 있고, TIS21의 발현에 의하여 암의 크기 또한 감소하는 것 을 보고한 바 있다. 또한 보고된 논문에 의하면 BTG2 mRNA의 발현은 전이과 정에 관여되어 있는 것으로 보여진다(Chiarugi at al., 2003; Cooper at al., 1993; Dai at al., 2007). 그래서 TIS21이 전이에 관계되는 과정인 암세포의 이동이나 침투에 어떠한 역할을 하는지 알아보기로 한다. 먼저, In vitro wound healing assay에서 TIS21의 발현이 암세포(A549 폐암세포)의 이동성을 억제하는 것을 발견하였다 (Fig. 1). In vitro trans-well migration assay 에서 역시 TIS21의 과 발현이 세포의 이동성을 억제한다는 것을 관찰하였다 (Fig. 2). 또한 matrigel-coated filter를 이용하여 관찰한 전이성 역시 TIS21에 의하여 감소하는 것을 관 찰하였다 (Fig. 3). 이러한 연구 데이터들은 TIS21이 A549 폐암세포의 이동성과 침투성 모두 억제한다라는 것을 의미한다.Fig. 1. TIS21 inhibits cancer cell migration. Wound healing assay. A549 cells were plated in 12well culture dishes and grown to 100% confluence. After generating a single scratch in the monolayer, the cells were washed with PBS, and cultured for
12
another 48 hr in media. Photographs were taken immediately after wounding and 48 hr later.
Fig. 2. TIS21 inhibits cancer cell migration. Transwell migration assay. A549 cells (5x104) suspended in media were seeded in transwell. After 12hr in culture, cells that invaded the lower surface of the filters were counted.
Fig. 3. TIS21 inhibits cancer cell invasion. Invasion assay. A549 cells(5x104) suspended and seeded in Matrigel invasion inserts. After 30 hr in culture, cells that invaded the lower surface of the filters were counted.
13
B. TIS21에 의한 FAKY576/Y925 의 인산화 억제
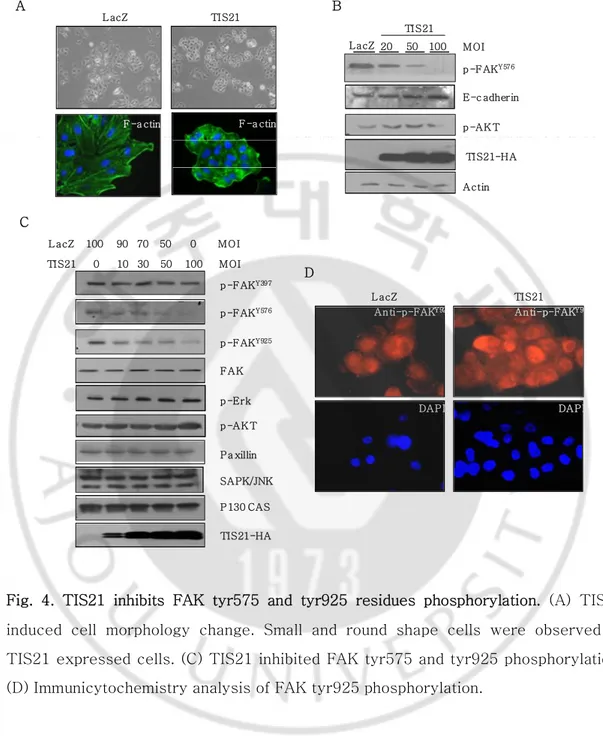
다음으로 본 연구에서는 TIS21이 암세포의 이동성을 저해하는 분자 생물학 적 기전을 연구하였다. TIS21이 과 발현 되었을 때 세포의 모양이 작고 둥글게 변하는 것을 관찰하였고, F-actin의 발현 또한 감소되는 현상을 관찰하였다 (Fig. 4A). 그러므로 우리는 세포와 세포(Cell-Cell) 또는 세포와 세포외기질(Cell-ECM)간의 상호작용에 영향을 미치는 단백질 발현 정도를 관찰하였다. 먼저, TIS21에 의한 E-cadherin의 발현정도의 변화를 관찰하지 못한 반면, FAKY576의 인산화의 정도가 눈에 띄게 감소하는 것을 관찰하였다 (Fig. 4B). 또한 TIS21은 FAK의 활성에 중요한 잔기들 즉, FAKY925와 FAKY576 의 인산화를 감소시키지만,
FAK의 자가인산화 잔기인 Y397의 인산화에는 변화가 관찰되지 않았다 (Fig. 4C). Immunocytochemistry 역시 TIS21이 FAKY925의 인산화를 저해하는 것이
관찰 되었다 (Fig. 4D). 다른 키나아제와 부착단백질 즉, p-Erk, p-AKT, paxillin, 그리고 JNK는 TIS21에 의한 발현차이를 보지 못하였다. 이 데이터들은 TIS21 이 Src의 키나아제 활성을 조절함으로써 FAK의 활성을 저해한다라는 것을 제시 한다.
14
Fig. 4. TIS21 inhibits FAK tyr575 and tyr925 residues phosphorylation. (A) TIS21 induced cell morphology change. Small and round shape cells were observed in TIS21 expressed cells. (C) TIS21 inhibited FAK tyr575 and tyr925 phosphorylation. (D) Immunicytochemistry analysis of FAK tyr925 phosphorylation.
p -F AKY397 p -F AKY576 p -F AKY925 F AK Pa xillin SAPK/JNK P130 CAS TIS21-HA p -Erk p -AK T TI S21 0 10 30 50 100 M OI L acZ 100 90 70 50 0 M O I C L acZ TI S21
An ti-p-FAKY925 An ti-p-FAKY925
DAPI DAPI D L acZ TI S21 F -a ctin F -a ctin A LacZ 20 50 100 TI S21 M OI p -F AKY576 p -AK T Actin TI S21-HA E-c adherin B
15
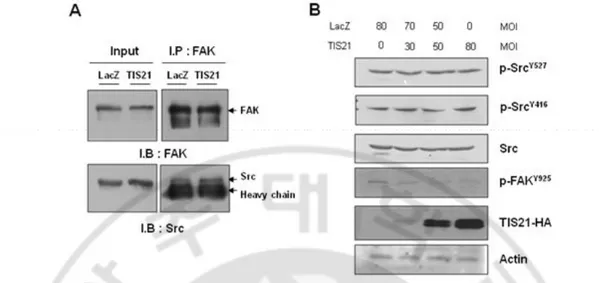
C. TIS21에 의한 Src kinase 활성도 변화 연구
TIS21이 FAKY397 의 발현에 영향을 주지 못하였지 때문에, 먼저 FAK과 Src의 interaction을 분석한 결과, Src은 FAK과 강하게 interaction하는 것을 알 수 있었다 (Fig. 5A). 따라서 본 연구에서는 TIS21의 과 발현에 의한 Src 키나 아제의 활성도를 즉정하였다. 그 결과, TIS21이 과 발현됨에 따라 FAKY925의 인
산화는 감소하지만 Src의 인산화 잔기인 SrcY416의 인산화와 탈인산화 잔기인
SrcY527의 인산화는 변화가 없었다 (Fig. 5B). 그래서 우리는 다음으로 TIS21에
의한 Src키나아제의 활성 정도를 측정하였다. 놀랍게도, TIS21이 과 발현된 세 포에서 Src 키나아제의 활성이 눈에 띄게 감소한 것을 관찰할 수 있었다 (Fig. 6). 이 데이터들로 우리는 TIS21이 Src키나아제의 활성을 인산화와 상관없이 저 해해준다는 것을 알 수 있다.
16
Fig. 5. Src interacted with FAK and Src phosphorylation was not changed by TIS21. (A) FAK interacted with Src independent of TIS21. (B) TIS21 did not modulate Src phosphorylation. Tyr527 and tyr416 residues phosphorylation were not influenced by TIS21.
Fig. 6. TIS21 inhibits Src kinase activity. TIS21 decreased Src kinase activity in vitro. Enolase was used as substrate and incubated with immunoprecipitated Src. Half of the immunoprecipitant was used as kinase assay and remain half was used western blot (lower panel). Three independent experiments were performed and represented as bar graph (right panel).
17
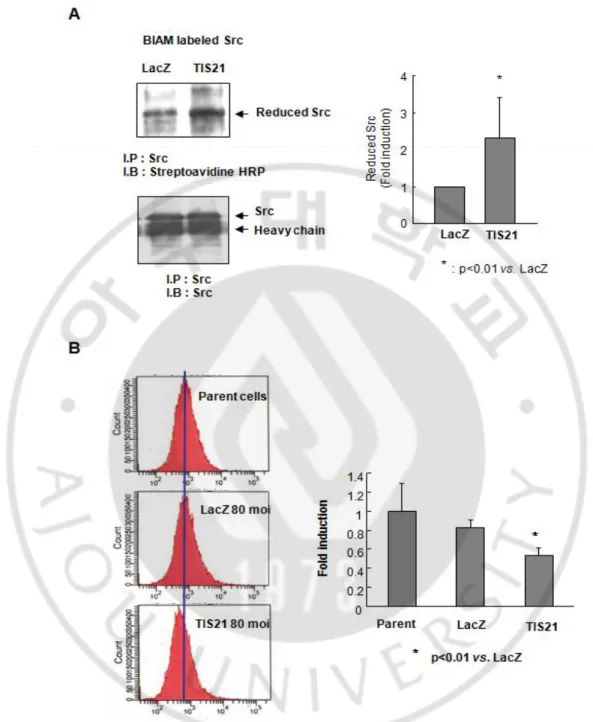
D. TIS21에 의해 유도된 활성산소 저해에 의한 Src 활성도 감소
이전에 Src의 활성이 ROS에 의하여 촉진된다라는 논문이 보고된 바 있다 (Prevot at al., 2000). 세포가 ECM에 붙는 과정 중 late stage에서 ROS가 Src 의 활성을 조절하고, 산화가 Src의 이황화 결합을 초래한다라는 논문 또한 보고 된 바 있다 (Prevot at al., 2000; QinH at al., 1999). 따라서 본 연구에서는 TIS21의 과 발현에 따른 Src의 산화정도를 조사하였다. 여기서 우리가 사용한 BIAM이라는 chemical은 환원된 시스테인 잔기에 붙을 수 있지만, 산화된 잔기 에는 붙지 못한다. TIS21이 과 발현된 세포용출액에 BIAM을 처리하였을 때, TIS21에 의해 환원된 Src이 의미있게 증가한 것을 보았다 (Fig. 7A). 다음으로 우리는 TIS21의 과발현에 따른 ROS생성 정도를 측정하였다. 그 결과, TIS21은 A549 세포의 ROS생성을 의미있게 감소시켰다 (Fig. 7B).
18
Fig. 7. TIS21 decreased oxidized Src via reduction of ROS. (A) TIS21 increased Src reduction. TIS21 expression was increased free cysteine and increased BIAM labeling. Three independent experiments were performed and represented as bar graph (right panel). (B) TIS21 inhibited ROS generation.
19
E. TIS21에 의한 항산화 단백질 발현 변화 연구
활성 산소의 발생이 TIS21과 발현 세포에서 관찰 되었기 때문에 TIS21에 의한 Catalase와 MnSOD같은 항산화제와 발현을 조사 하였다. 그 결과, TIS21 에 의한 항산화제 발현에는 변화가 없는 것을 보았다 (Fig. 8).
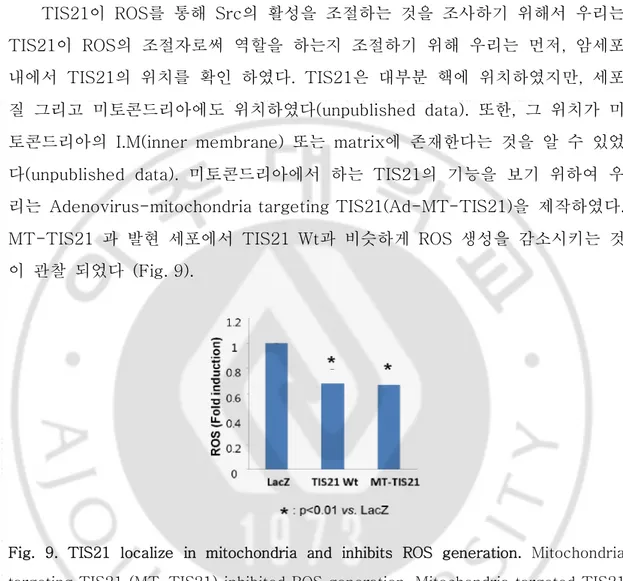
20 F. TIS21이 미토콘드리아로의 위치에 따른 활성산소 억제 연구 TIS21이 ROS를 통해 Src의 활성을 조절하는 것을 조사하기 위해서 우리는 TIS21이 ROS의 조절자로써 역할을 하는지 조절하기 위해 우리는 먼저, 암세포 내에서 TIS21의 위치를 확인 하였다. TIS21은 대부분 핵에 위치하였지만, 세포 질 그리고 미토콘드리아에도 위치하였다(unpublished data). 또한, 그 위치가 미 토콘드리아의 I.M(inner membrane) 또는 matrix에 존재한다는 것을 알 수 있었 다(unpublished data). 미토콘드리아에서 하는 TIS21의 기능을 보기 위하여 우 리는 Adenovirus-mitochondria targeting TIS21(Ad-MT-TIS21)을 제작하였다. MT-TIS21 과 발현 세포에서 TIS21 Wt과 비슷하게 ROS 생성을 감소시키는 것 이 관찰 되었다 (Fig. 9).
Fig. 9. TIS21 localize in mitochondria and inhibits ROS generation. Mitochondria targeting TIS21 (MT-TIS21) inhibited ROS generation. Mitochondria targeted TIS21 efficiently reduced ROS generation. Three independent experiments were performed and represented as bar graph.
21
G. 미토콘드리아에 위치하는 TIS21 에 의해 유도된 활성산소 저해에 의한 세포 이동 감소
지금까지, TIS2 이 FAKY576, FAKY925 의 인산화를 억제시킨다는 것을 증명하였다. 또한 Src 키나아제의 활성을 감소시키는데, 이때 미토콘드이아에서 생성되는 ROS 의 발현을 억제함을 MT-TIS21 을 사용하여 밝혔다. 비록 우리는 TIS21 이 미토콘드리아에서의 ROS 생산에 대한 정확한 메커니즘을 밝히지는 못하였지만, TIS21 에 의해 ROS 생성이 감소됨에 따라 암 세포의 이동과 전이에 영향을 줄 것이라고 가정하여 먼저 TIS21 과 MT-TIS21 이 과 발현된 A549 세포의 이동 차이를 비교하였다. 그 결과, TIS21 이 과 발현된 암세포는 앞의 데이터와 마찬가지로 세포 이동을 감소시켜 주었고, MT-TIS21 과 발현된 세포 또한 세포의 이동을 의미 있게 억제하고 있는 것을 볼 수 있었다. 그러므로 우리는 TIS21 이 미토콘드리아에서의 ROS 생성을 조절하고 이는 암 세포의 이동까지도 조절 한다라는 것을 알게 되었다 (Fig. 10).
22
Fig. 10. MT-TIS21 inhibits cell migration. (A) A549 cells were plated in 12 well culture dishes and grown to 100% confluence. After generating a single scratch with yellow tip in the monolayer, the cells were washed with PBS, and cultured for 48hr in media. (B) And after measure the distance of wound, it represented graph.
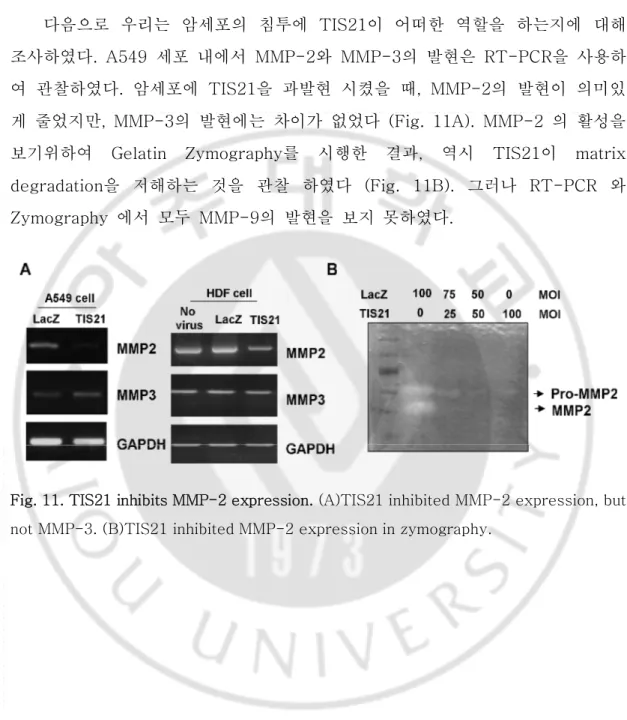
23 H. TIS21에 의한 MMP-2 발현감소 다음으로 우리는 암세포의 침투에 TIS21이 어떠한 역할을 하는지에 대해 조사하였다. A549 세포 내에서 MMP-2와 MMP-3의 발현은 RT-PCR을 사용하 여 관찰하였다. 암세포에 TIS21을 과발현 시켰을 때, MMP-2의 발현이 의미있 게 줄었지만, MMP-3의 발현에는 차이가 없었다 (Fig. 11A). MMP-2 의 활성을 보기위하여 Gelatin Zymography를 시행한 결과, 역시 TIS21이 matrix degradation을 저해하는 것을 관찰 하였다 (Fig. 11B). 그러나 RT-PCR 와 Zymography 에서 모두 MMP-9의 발현을 보지 못하였다.
Fig. 11. TIS21 inhibits MMP-2 expression. (A)TIS21 inhibited MMP-2 expression, but not MMP-3. (B)TIS21 inhibited MMP-2 expression in zymography.
24
I. TIS21에 의한 FoxM1 인산화 억제
이전에 우리는 TIS21이 forkhead box M1(FoxM1)을 전사활성을 저해한다 라는 데이터를 보고한 바 있다(Brown at al., 1996). FoxM1은 세포 성장에 관여 하고 있고, 또한 MMP-2와 MMP-9의 발현을 조절함으로써 세포의 이동에 관여 한다. 암세포에 TIS21의 과 발현시 FoxM1의 인산화 정도 보았고 그 결과, TIS21에 의해 phospho-threonine 잔기와 phospho-serine 잔기의 인산화가 감 소되는 것을 보았다 (Fig. 12). 이 데이터들은 TIS21이 FoxM1의 비활성화를 통 해 MMP-2의 억제에 의해 암세포의 침투를 억제한다라는 것을 의미한다.
Fig. 12. TIS21 inhibits FoxM1 phosphorylation. TIS21 inhibited FoxM1 phosphorylation. TIS21 induced p-ser, p-thr residues phosphorylation of FoxM1.
25
Part B.
J. AKT와 TIS21과의 결합 지금까지 암 세포의 이동 및 전이에 관여하는 데에 있어서 TIS21이 조절하 는 신호에 대하여 조사하였다. 하지만 이들은 TIS21이 과 발현된 상태에서 진행 한 실험이므로, TIS21을 활성 시켜줄 수 있는 키나아제를 알 수 없었다. 그러므 로 우리는 암 세포의 이동 및 전이를 조절하는 키나아제들과 TIS21과의 연관성 을 알아보았다. 다양한 암세포에서 AKT, Erk, MAPK같은 키나아제들이 하위 유 전자를 조절하여 암 세포의 이동에 관련되어 있다. 이러한 키나아제들은 또한 MMPs의 활성을 조절하여 암 세포의 침투에도 영향을 미친다는 보고가 되어왔 다(Kang et al., 2010; Meng et al., 2006). 그래서 우리는 이러한 키나아제들 중 TIS21과 상호작용을 하여 세포의 이동 및 침투에 영향을 미칠 것으로 생각하고 실험을 진행하였다. 실제로, 우리는dominant negative AKT(DN-AKT)와 TIS21 을 세포내로 주입시켰을 때에 반해서, constitutive active AKT(CA-AKT)와 TIS21을 같이 암 세포 내로 주입 시켜 주었을 때 CA-AKT와 TIS21간에 직접 적으로 결합 하는 것이 관찰되었다 (Fig. 13).Fig. 13. AKT interacted with TIS21 in Huh7 cells. Huh7 cells co-transfected with CA-AKT and TIS21 or DN-CA-AKT and TIS21. After 2days, we performed I.P.
26
K. AKT에 의한 TIS21의 인산화
TIS21에는 여러가지 키나아제에 의한 인산화가 가능한 잔기인 serine과 threonine 이 각각 19개, 7개가 존재한다. AKT에 의해서 TIS21의 어느 잔기가 인산화 되는지 규명하기 위하여 우리는 AKT에 의해 인산화 되기에 가능성이 있 는 잔기들을 골라 각각 alanine으로 부분적으로 변이를 주어서 그 잔기의 인산 화 가능성을 차례로 배제하였다. 그 다음 in vitro kinase assay를 시행하여 AKT에 의한 TIS21의 인산화 유∙무를 보았다. 그 결과, TIS21의 31번째 serine 이 AKT에 의해서 인산화되는 잔기임을 밝히었다 (Fig. 14).
27
L. TIS21 인산화에 따른 세포 이동저해 억제
이러한 AKT에 의한 TIS21의 인산화가 지금까지 우리가 관찰한 암 세포의 이동과 침투에 의미 있게 관여하고 있는지에 관하여 좀 더 자세히 알아보았다. Nonphosphomimic TIS21의 아데노 바이러스 (Ad-TIS21 S31A) 와 phosphomimic TIS21의 아데노 바이러스 (Ad-TIS21 S31D)를 제작하였고, 이를 A549 세포에 과 발현 시킨 후에 wound healing assay를 통한 암 세포의 이동 현상을 비교하였다. Control 에서는 활발하던 세포의 이동이 TIS21-Wt 과 발현 세포에서는 저해되었다. 마찬가지로 AKT에 의한 TIS21의 인산화를 저해한 TIS21 S31A 과 발현 세포에서도 세포의 이동을 저해하는 양상을 볼 수 있었다. 반면에 phosphomimic TIS21 과 발현 세포에서는 이와 같은 세포이동의 저해가 회복 되는 것을 발견하였다 (Fig. 15). 또한 TIS21에 의한 FAKY576의 저해되는
인산화가 TIS21 S31D에 의해서 회복되는 것을 발견 하였다(Fig. 16). 때문에 우 리는 TIS21 과 발현 세포에서 일어나는 암 세포의 이동성 저해가 AKT에 의해 일어난다고 생각한다.
28
Fig. 15. Phospho-mimic TIS21 S31D mutant could not inhibit cancer cell migration. A549 cells were plated in 12well culture dishes and grown to 100% confluence. The cells infected with TIS21 wt, S31 and S31D mutants. The cells were washed with PBS, and cultured for another 48 hr in media. Photographs were taken immediately after wounding and 48 hr later.
Fig. 16. Phospho-mimic TIS21 S31D mutant could not inhibit FAKY576 phosphorylation. A549 cells were plated in 6well culture dishes and grown to 100% confluence. The cells infected with TIS21 wt, S31 and S31D mutants dose dependently. And then using the cell lysate performed immunoblot.
29
M. TIS21 인산화에 따른 MMP-2 발현 억제 소실
AKT는 다양한 사이토카인이나 EGF, VEGF 같은 성장인자 그리고 인슐린에 의해 자극이 된다 (Yang et al., 2004; Chen et al., 1975). 이러한 자극에 의해 AKT가 활성을 띄게 되면 무수한 하위단계의 단백질을 활성화 또는 저해를 시킴 으로써 세포의 생존, 당 획득, 증식, 대사 그리고 혈관생성에 중요한 역할을 한 다. 또한, 최근에 AKT가 암 세포의 전이에 깊이 관여하고 있다는 논문이 보고 되어 오고 있다 (Kang et al., 2010; Meng et al., 2006). 그래서 우리는 AKT에 의해 인산화된 TIS21이 세포침투에 영향을 줄 것으로 보고 세포침투에 필요한 MMPs의 발현 양상을 비교분석 하였다. 그 결과 TIS21-Wt 과 발현 세포에서 MMP-2 mRNA level의 저해를 관찰한 반면, TIS21 S31D mutant 과 발현 세포 에서는 이와 같은 양상을 보지 못하였으며, 오히려 control 세포와 비슷한 양상 으로 발현하는 것을 관찰할 수 있었다 (Fig. 17).
30
Ⅳ. 고찰
TIS21의 발현은 같은 전립선 암세포간에서도 LNCap보다 사대적으로 전이 성이 더 높은 세포인 PC3 세포에서 TIS21의 발현 또한 상대적으로 감소되어 있 다. 게다가 이미 마이크로어레이 데이터에서 BTG2의 발현이 암세포의 전이와 관련 있다라는 보고가 존재한다. 그러므로 우리는 TIS21과 암세포의 이동및 침 투와의 관련성을 명확히 하기 위하여 실험을 진행하였다. 세포 이동 동안의 TIS21의 역할을 규명하기 위하여, 암세포 이동에 관여하고 있는 FAk과 Src의 단백질 발현 정도를 조사하였다. 그 결과, Src 키나아제에 의하여 FAKY576과FAKY925의 인산화가 감소하는 것을 관찰하였다. 그러나, TIS21과발현에 의한 Src의 활성화는 보지 못하였다. Src의 활성화를 측정한 데이터에서는 TIS21이 미토콘드리아에서의 ROS생성에 의한 Src의 활성을 의미있게 억제하는 것을 보 았다.
TIS21은 FAKY576과 FAKY925의 인산화를 감소시키지만, FAK의 tyr 397잔기
는 인산화에는 영향을 미치지 못하였다. 이 데이터들에 의하여 우리는 TIS21이 인산화된 FAK이 Src과 결합에는 영향을 미치지 않는 것을 알았다. Src의 tyr527잔기는 비인산화 잔기로써 protein tyrosine phosphatase에 의하여 탈인 산화가 되면, 구조적 변화가 생기고 이때 tyr416잔기가 자가 인산화 된다. TIS21은 이러한 두 타이로신 잔기의 인산화에는 영향을 주지 않지만, Src의 키 나아제 활성을 감소시킨다는 것을 in vitro와 in vivo 모두에서 관찰하였다. Giannoni et al 은 Src의 활성화를 유지하는 데에 ROS에 의한 Src의 산화가 매 우 중요하다라는 것을 밝혔다. BIAM 을 이용한 실험은 ROS가 Src내에서 cystein의 S-S결합형태를 증가시키는 것을 볼 수 있다. 우리가 Src의 산화적 단 계를 측정하였을 때, Src의 환원된 형태가 TIS21에 의하여 의미있게 증가한 것 을 보았고, ROS생성 또한 TIS21에 의하여 감소하는 것을 관찰하였다. 비록 Src 의 S-S결합형태를 보지는 못하였지만, BIAM을 이용한 데이터는 결합하지 않은
31
cystein 정도를 나타내 주고, TIS21 과 발현시 그 양상이 뚜렷이 감소하였다. Giannoni et al 이 발표한 논문에서는 lipooxygenase(LOX)에 의해 생성된 ROS 에 의해 Src의 활성이 조절된다(Giannoni at al) 라고 밝힌 바 있으나 우리는 LOX가 ROS를 생성하는지 안 하는지를 조사하지는 않았다. 하지만, 미토콘드리 아를 표적으로 하는 TIS21을 과 발현시킨 세포에서 ROS의 생성이 감소하는 것 을 보았다. ROS는 주로 미토콘드리아에서 생산된다(Fantel at al., 2002). 우리가 다양한 세포 내에서의 TIS21의 위치를 보았을 때, 핵과 세포질 그리고 미토콘드 리아에 위치하는 것을 보았고, 우리는 ROS가 미토콘드리아에서 생산되는 것에 대한 TIS21의 역할에 초점을 맞추었다. 아직 공식적인 데이터는 아니지만 우리 실험실에서는 TIS21이 미토콘드리아의 inner membrane 또는 matrix에 존재한 다는 것을 관찰한 바 있다. 또한 MT-TIS21은 미토콘드리아에 위치하는 것을 확인하였고, TIS21-Wt과 마찬가지로 ROS의 생성도 감소시키는 것을 확인한 바 있다. 비록 우리는 어떻게 TIS21이 ROS생성을 감소시키는지에 대한 매커니즘은 명확히 밝히지 못하였으나, 미토콘드리아에 위치하는 TIS21이 ROS생성에 영향 을 미친다고 생각한다. 이전에 보고된 논문에 의하면 protein arginine methyltransferase 1(PRMT1), HoxB9, CCR4-Not complex, Smad1/8, Erk1/2, 그리고 Pin1 같은 많은 단백질들이 TIS21과 결합한다고 알려져 왔다(Varnum at al., 1994; Lin at al., 1999; Prévôt at al., 2000; Rouault at al., 1998; Hong at al., 2005). 우리는 이러한 단백질이 TIS21의 기능을 결정할 것이라고 생각했고, TIS21이 이러한 단백질의 활성을 조절할 것이라고 가정했다. 먼저, 미토콘드리 아로의 TIS21의 위치가 ROS생성을 조절한다고 생각했지만, TIS21과 결합 하는 단백질과 미토콘드리아에 대한 연관성은 보고된 바가 없다.
과발현된 TIS21은 A549세포와 HDF세포의 MMP-2 발현을 저해했지만, MMP-3 발현에는 영향을 주지 못했다. MMP-2 발현에 관여하는 전사인자에는 p53, Sp1 그리고 FoxM1 같은 단백질들이 있다(Bian at al., 1997; Qin at al.,
32
1999; Dai at al., 2007). 이 중에서도 FoxM1은 MMP-2와 MMP-9의 발현에는 관여하지만, MMP-3 발현에는 관여하지 않는다(Dai at al., 2007; Wang at al., 2003). 우리는 TIS21이 FoxM1의 인산화를 저해함으로써 FoxM1의 전사활성을 저해한다라는 내용을 보고한 바 있다. 세포에 TIS21을 과발현 시키면, FoxM1 serine 과 threonine의 인산화 모두 감소했다. 우리는 TIS21에 의한 FoxM1의 비활성화가 MMP-2의 억제를 유도한다고 생각했다. MMP-3의 전사인자로써는 AP1 과 NF-kB가 있지만(Borghaei at al., 2004; Dedieu at al., 2006), 이들 역 시 TIS21에 의한 조절에 대해서는 보고된 바가 없다. 그래서 우리는 TIS21이 MMP-3의 발현은 조절하지 않는다고 생각했다. 실제로, TIS21 과발현 시 MMP-2, MMP-3 그리고 MMP-9의 발현을 RT-PCR로 측정한 결과, TIS21에 의한 MMP-2발현의 감소와 MMP-3발현에 영향을 미치지 않는 것을 보았다. 또 한 MMP-9의 발현은 관찰하지 못하였다. 이와 같은 현상을 zymography에서도 재현되었다. 우리는 수년간 TIS21/BTG2/PC3를 암 억제 유전자로써 연구해왔지만, 정확한 기능에 대해서는 조사하지 못하였다. 우리는 본 연구의 결과로써 TIS21이 암 억 제 유전자로써의 역할 뿐만 아니라 세포의 이동과 침투에도 역할을 한다고 제안 한다. 이때, FAK과 Src의 활성을 저해함에 따른 세포 이동의 조절과 FoxM1의 전사활성을 조절함에 따라 세포의 침투에 중요하다는 것을 제시하는 바이다.
33
Ⅴ. 결론
여기에서 우리는 TIS21이 폐암 세포 본연의 전이성에 역할을 한다고 판단 한 바, Ad-TIS21을 사용하여 실험을 진행하였다. TIS21 과 발현 시 A549 세포 의 이동성과 침투성 모두 감소하였고, 암세포의 이동성 및 침투성에 관여하고 있 는 유전자인 FAK과 Src의 활성 또한 감소하였다. 이때, Src에 의해 증가하는 ROS생성을 TIS21이 조절하며, 이는 ROS의 산화와 관련이 있다고 판단하였다. 정확한 기전은 밝히지 못하였으나, TIS21이 미토콘드리아에 위치함으로써 ROS 생성을 조절하고, 암세포의 이동과 침투를 저해한다. 이때, TIS21이 FoxM1의 인산화를 저해함으로써 MMP-2의 발현 또한 저해한다. 반면, AKT에 의해 인산화된 TIS21 과 발현 세포들은 이러한 암세포의 이동 성과 침투성의 저해기능을 소실함을 관찰하였고 뿐만 아니라 FAK의 인산화 및 MMP-2의 발현을 저해하는 기능에도 영향을 미치는 것을 관찰하였다. 그러므로 우리는 TIS21이 암세포의 이동성과 침투성에 관여하는 시그널 및 양상을 확인 하였으며 이러한 현상의 상위단계로써 AKT가 역할을 할 가능성을 제시하는 바이다.
34
참고문헌
1. Atfi A, Drobetsky E, Boissonneault M, Chapdelaine A, Chevalier S: Transforming growth factor beta down-regulates Src family protein tyrosine kinase signaling pathways. J Biol Chem 269: 30688-30693, 1994
2. Bian J, Sun Y: Transcriptional activation by p53 of the human type IV collagenase (gelatinase A or matrix metalloproteinase 2) promoter. Mol Cell Biol 17: 6330-6338, 1997
3. Borghaei RC, Rawlings PL, Jr., Javadi M, Woloshin J: NF-kappaB binds to a polymorphic repressor element in the MMP-3 promoter. Biochem Biophys Res Commun 316: 182-188, 2004
4. Brown MT, Cooper JA: Regulation, substrates and functions of src. Biochim Biophys Acta 1287: 121-149, 1996
5. Calalb MB, Polte TR, Hanks SK: Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity: a role for Src family kinases. Mol Cell Biol 15: 954-963, 1995
6. Chen IL, Yates RD: The fine structure and phosphatase cytochemistry of the golgi complex and associated structures in the sertoli cells of Syrian hamsters. Cell Tissue Res 157: 227-238, 1975
7. Chiarugi P, Pani G, Giannoni E, Taddei L, Colavitti R, Raugei G, Symons M, Borrello S, Galeotti T, Ramponi G: Reactive oxygen species as essential mediators of cell adhesion: the oxidative inhibition of a FAK tyrosine phosphatase is required for cell adhesion. J Cell Biol 161: 933-944, 2003
35
1051-1054, 1993
9. Dai B, Kang SH, Gong W, Liu M, Aldape KD, Sawaya R, Huang S: Aberrant FoxM1B expression increases matrix metalloproteinase-2 transcription and enhances the invasion of glioma cells. Oncogene 26: 6212-6219, 2007
10. Dedieu S, Lefebvre P: Retinoids interfere with the AP1 signalling pathway in human breast cancer cells. Cell Signal 18: 889-898, 2006 11. Fantel AG, Person RE: Involvement of mitochondria and other free
radical sources in normal and abnormal fetal development. Ann N Y Acad Sci 959: 424-433, 2002
12. Ficazzola MA, Fraiman M, Gitlin J, Woo K, Melamed J, Rubin MA, Walden PD: Antiproliferative B cell translocation gene 2 protein is down-regulated post-transcriptionally as an early event in prostate carcinogenesis. Carcinogenesis 22: 1271-1279, 2001
13. Giannoni E, Buricchi F, Raugei G, Ramponi G, Chiarugi P: Intracellular reactive oxygen species activate Src tyrosine kinase during cell adhesion and anchorage-dependent cell growth. Mol Cell Biol 25: 6391-6403, 2005
14. Giannoni E, Taddei ML, Chiarugi P: Src redox regulation: again in the front line. Free Radic Biol Med 49: 516-527, 2010
15. Grisaru-Granovsky S, Salah Z, Maoz M, Pruss D, Beller U, Bar-Shavit R: Differential expression of protease activated receptor 1 (Par1) and pY397FAK in benign and malignant human ovarian tissue samples. Int J Cancer 113: 372-378, 2005
16. Hong JW, Ryu MS, Lim IK: Phosphorylation of serine 147 of tis21/BTG2/pc3 by p-Erk1/2 induces Pin-1 binding in cytoplasm and
36
cell death. J Biol Chem 280: 21256-21263, 2005
17. Kang MH, Kim JS, Seo JE, Oh SC, Yoo YA: BMP2 accelerates the motility and invasiveness of gastric cancer cells via activation of the phosphatidylinositol 3-kinase (PI3K)/Akt pathway. Exp Cell Res 316: 24-37, 2010
18. Lim IK, Lee MS, Lee SH, Kim NK, Jou I, Seo JS, Park SC: Differential expression of TIS21 and TIS1 genes in the various organs of Balb/c mice, thymic carcinoma tissues and human cancer cell lines. J Cancer Res Clin Oncol 121: 279-284, 1995
19. Lin WJ, Gary JD, Yang MC, Clarke S, Herschman HR: The mammalian immediate-early TIS21 protein and the leukemia-associated BTG1 protein interact with a protein-arginine N-methyltransferase. J Biol Chem 271: 15034-15044, 1996
20. McLean GW, Carragher NO, Avizienyte E, Evans J, Brunton VG, Frame MC: The role of focal-adhesion kinase in cancer - a new therapeutic opportunity. Nat Rev Cancer 5: 505-515, 2005
21. Melamed J, Kernizan S, Walden PD: Expression of B-cell translocation gene 2 protein in normal human tissues. Tissue Cell 34: 28-32, 2002 22. Meng Q, Xia C, Fang J, Rojanasakul Y, Jiang BH: Role of PI3K and AKT
specific isoforms in ovarian cancer cell migration, invasion and proliferation through the p70S6K1 pathway. Cell Signal 18: 2262-2271, 2006
23. Meng XN, Jin Y, Yu Y, Bai J, Liu GY, Zhu J, Zhao YZ, Wang Z, Chen F, Lee KY, Fu SB: Characterisation of fibronectin-mediated FAK signalling pathways in lung cancer cell migration and invasion. Br J Cancer 101: 327-334, 2009
37
24. Mott JD, Thomas CL, Rosenbach MT, Takahara K, Greenspan DS, Banda MJ: Post-translational proteolytic processing of procollagen C-terminal proteinase enhancer releases a metalloproteinase inhibitor. J Biol Chem 275: 1384-1390, 2000
25. Nam S, Kim D, Cheng JQ, Zhang S, Lee JH, Buettner R, Mirosevich J, Lee FY, Jove R: Action of the Src family kinase inhibitor, dasatinib (BMS-354825), on human prostate cancer cells. Cancer Res 65: 9185-9189, 2005
26. Park TJ, Kim JY, Oh SP, Kang SY, Kim BW, Wang HJ, Song KY, Kim HC, Lim IK: TIS21 negatively regulates hepatocarcinogenesis by disruption of cyclin B1-Forkhead box M1 regulation loop. Hepatology 47: 1533-1543, 2008
27. Prevot D, Voeltzel T, Birot AM, Morel AP, Rostan MC, Magaud JP, Corbo L: The leukemia-associated protein Btg1 and the p53-regulated protein Btg2 interact with the homeoprotein Hoxb9 and enhance its transcriptional activation. J Biol Chem 275: 147-153, 2000
28. Qin H, Sun Y, Benveniste EN: The transcription factors Sp1, Sp3, and AP-2 are required for constitutive matrix metalloproteinase-2 gene expression in astroglioma cells. J Biol Chem 274: 29130-29137, 1999 29. Rouault JP, Prevot D, Berthet C, Birot AM, Billaud M, Magaud JP, Corbo
L: Interaction of BTG1 and p53-regulated BTG2 gene products with mCaf1, the murine homolog of a component of the yeast CCR4 transcriptional regulatory complex. J Biol Chem 273: 22563-22569, 1998
30. Schaller MD, Hildebrand JD, Shannon JD, Fox JW, Vines RR, Parsons JT: Autophosphorylation of the focal adhesion kinase, pp125FAK, directs
38
SH2-dependent binding of pp60src. Mol Cell Biol 14: 1680-1688, 1994 31. Schlaepfer DD, Hanks SK, Hunter T, van der Geer P: Integrin-mediated
signal transduction linked to Ras pathway by GRB2 binding to focal adhesion kinase. Nature 372: 786-791, 1994
32. Schlaepfer DD, Hunter T: Evidence for in vivo phosphorylation of the Grb2 SH2-domain binding site on focal adhesion kinase by Src-family protein-tyrosine kinases. Mol Cell Biol 16: 5623-5633, 1996
33. Schlaepfer DD, Mitra SK, Ilic D: Control of motile and invasive cell phenotypes by focal adhesion kinase. Biochim Biophys Acta 1692: 77-102, 2004
34. Schmidt M, Bohm D, von Torne C, Steiner E, Puhl A, Pilch H, Lehr HA, Hengstler JG, Kolbl H, Gehrmann M: The humoral immune system has a key prognostic impact in node-negative breast cancer. Cancer Res 68: 5405-5413, 2008
35. Sieg DJ, Hauck CR, Ilic D, Klingbeil CK, Schaefer E, Damsky CH, Schlaepfer DD: FAK integrates growth-factor and integrin signals to promote cell migration. Nat Cell Biol 2: 249-256, 2000
36. Song L, Morris M, Bagui T, Lee FY, Jove R, Haura EB: Dasatinib (BMS-354825) selectively induces apoptosis in lung cancer cells dependent on epidermal growth factor receptor signaling for survival. Cancer Res 66: 5542-5548, 2006
37. Struckmann K, Schraml P, Simon R, Elmenhorst K, Mirlacher M, Kononen J, Moch H: Impaired expression of the cell cycle regulator BTG2 is common in clear cell renal cell carcinoma. Cancer Res 64: 1632-1638, 2004
39
Moriyama H, Brachtel E, Edelman EJ, Ramaswamy S, Maheswaran S: Breast tumor progression induced by loss of BTG2 expression is inhibited by targeted therapy with the ErbB/HER inhibitor lapatinib. Oncogene, 2011
39. Tatosyan AG, Mizenina OA: Kinases of the Src family: structure and functions. Biochemistry (Mosc) 65: 49-58, 2000
40. van de Vijver MJ, He YD, van't Veer LJ, Dai H, Hart AA, Voskuil DW, Schreiber GJ, Peterse JL, Roberts C, Marton MJ, Parrish M, Atsma D, Witteveen A, Glas A, Delahaye L, van der Velde T, Bartelink H, Rodenhuis S, Rutgers ET, Friend SH, Bernards R: A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 347: 1999-2009, 2002
41. Varnum BC, Reddy ST, Koski RA, Herschman HR: Synthesis, degradation, and subcellular localization of proteins encoded by the primary response genes TIS7/PC4 and TIS21/PC3. J Cell Physiol 158: 205-213, 1994
42. Wang X, Bhattacharyya D, Dennewitz MB, Kalinichenko VV, Zhou Y, Lepe R, Costa RH: Rapid hepatocyte nuclear translocation of the Forkhead Box M1B (FoxM1B) transcription factor caused a transient increase in size of regenerating transgenic hepatocytes. Gene Expr 11: 149-162, 2003
43. Winkler GS: The mammalian anti-proliferative BTG/Tob protein family. J Cell Physiol 222: 66-72, 2010
44. Xu W, Harrison SC, Eck MJ: Three-dimensional structure of the tyrosine kinase c-Src. Nature 385: 595-602, 1997
40
Physiological functions of protein kinase B/Akt. Biochem Soc Trans 32: 350-354, 2004
(Prevot et al., 2000)
(Chen and Yates, 1975; Cooper and Howell, 1993; Atfi et al., 1994; Schaller et al., 1994; Schlaepfer et al., 1994; Varnum et al., 1994; Calalb et al., 1995; Lim et al., 1995; Brown and Cooper, 1996; Lin et al., 1996; Schlaepfer and Hunter, 1996; Bian and Sun, 1997; Xu et al., 1997; Rouault et al., 1998; Qin et al., 1999; Mott et al., 2000; Sieg et al., 2000; Tatosyan and Mizenina, 2000; Ficazzola et al., 2001; Fantel and Person, 2002; Melamed et al., 2002; van de Vijver et al., 2002; Chiarugi et al., 2003; Wang et al., 2003; Borghaei et al., 2004; Schlaepfer et al., 2004; Struckmann et al., 2004; Yang et al., 2004; Giannoni et al., 2005; Grisaru-Granovsky et al., 2005; Hong et al., 2005; McLean et al., 2005; Nam et al., 2005; Dedieu and Lefebvre, 2006; Meng et al., 2006; Song et al., 2006; Dai et al., 2007; Park et al., 2008; Schmidt et al., 2008; Meng et al., 2009; Giannoni et al., 2010; Kang et al., 2010; Winkler, 2010; Takahashi et al., 2011)
41
-ABSTRACT-
TIS21 inhibits cell migration and invasion Seo Kyung Lim
Department of Biomedical Sciences The Graduate School, Ajou University
(Supervised by Associate professor Tae Jun Park)
TIS21/BTG2/PC3 is tumor suppressor gene and frequently downregulated in cancer tissue. In human tissue, decreased BTG2 is correlated with cancer cell metastasis, suggesting that suppression of BTG2 has a critical role in cancer cell migration and invasion. When we overexpressed TIS21 in A549 cells, cell migration and invasion were dramatically inhibited. Furthermore, cell morphology was changed like round shape. TIS21 overexpression was correlated with downregulation of focal adhesion kinase (FAK) tyr576 and tyr925 residues phosphorylation. However, tyr397 which was autophosphorylation site was not influenced by TIS21 expression. c-Src phosphorylation which was upstream of FAK was not influenced by TIS21, however, c-Src kinase activity was significantly decreased by TIS21. When we measured Src oxidized state in the cells, TIS21 increased Src reduction
42
state and TIS21 inhibited ROS generation by localization in the mitochondria. Furthermore, TIS21 inhibited FoxM1 phosphorylation and downregulated MMP-2 expression. In conclusion, TIS21 inhibited cell migration and invasion by inhibition of Src by downregulation of ROS generation in mitochondria, furthermore, TIS21 inhibited FoxM1 phosphorylation and decreased MMP-2 expression.
AKT interacted with TIS21 and phosphorylated TIS21 at Ser31 in vitro. Phosphorylated TIS21 by AKT led to the loss of its inhibitory effects on cells migration and invasion. Furthermore, AKT mediated phosphorylation of TIS21 also abrogated its inhibitory effects on FAK phosphorylation as well as MMP-2 mRNA downregulation.
Key words: AKT, TIS21/BTG2/PC3, FAK, Src, MMP-2, ROS, FoxM1,