2
장 연료전지 열역학
충북대학교
Chapter 2.
연료전지 열역학
The purpose of this chapter
◈ 2 장의 목적
√ 열역학 : 한 형태에서 다른 형태로 에너지 변환 , 에너지론의 한 분야 √ 연료전지 : 에너지 변환장치 √ 연료전지 열역학 : 화학에너지의 전기적 에너지 변환 이해하는 열쇠 - 연료전지 반응이 자발적인가 판단 - 최대전압 한계 값 제시 - 연료전지에서 가능한 이론적인 이상적인 경우 제시 √ 연료전지 성능 이해 : 열역학 , 동역학 지식 필요2.1. Thermodynamics Review
Chapter 2. Fuel Cell Thermodynamics
2.1.2.
내부 에너지
2.1.1. What Is Thermodynamics?
◈ 내부 에너지 (U)
√ 원자 , 분자규모 미소한 운동과 입자들 사이 : 상호작용 관계된 에너지 √ 내부 에너지 ⇒ 화학결합과 관계 √ 내부 에너지 변환 량 ⇒ 열역학 1, 2 법칙 ⇒ Figure 2.1 √ Richard Feynman : 에너지가 무엇인지 우리는 아는 게 없다 .⇒ Law of thermodynamics, enthalpy, free energy
2.1.2. Internal Energy
Chapter 2. Fuel Cell Thermodynamics
Figure 2.1. Although this tank of H2 gas has no apparent macroscopic energy, it has significant internal energy. Internal energy is associated with microscopic movement (kinetic energy) and interactions between particles (chemical/ potential energy) on the atomic scale. 차원석 『 연료전지개론 』 한티미디어 , 2008 년
2.1.3.
열역학 제 1 법칙
√ 에너지 보존법칙
Chapter 2. Fuel Cell Thermodynamics
◈ The first law of thermodynamics
0
)
(
)
(
)
(
Energy
univ
d
Energy
system
d
Energy
surroundings
d
(2.1) gs surroundin systemd
Energy
Energy
d
(
)
(
)
(2.2)dW
dQ
dU
(2.3)pdV
dW
)
mech
(
(2.4)pdV
dQ
dU
(2.5)일 과 열
• 일 , 열
: 운반 상태의 에너지 , 주변의 환경이
나 사람들의 몸 사이에 전달되는 에너지
• 일
: 어떤 거리를 이동 힘을 가하면 이러한 에
너지가 전달
• 열
: 온도 차에 의해 에너지 전달
• 열역학 제 2 법칙 : 열은
100%
일로 변환
될 수 없다
• 열 병목현상
: 연료전지는 열변환 단계 우회
2.1.4. Second Low
Chapter 2. Fuel Cell Thermodynamics
√ 엔트로피 : 시스템 가능한 미소상태 수 , 시스템을 구성하는 가능한 방법 수 √ 엔트로피 : 무질서도 측정
☞ 가장 간단한 고립 시스템
◈ The second law of thermodynamics
(2.6)
log
k
S
Where, system the to accessible s microstate possible of number the denotes : constant s Boltzmann' : system the of entropy total the : k S2.1.4. Second Low
Chapter 2. Fuel Cell Thermodynamics
Figure 2.2. (a) The entropy of this 100 atom perfect crystal is zero because there is only one possible way to arrange the atoms to produce this configuration (b) When three atoms are removed from the crystal and placed on the surface, the entropy increases. This is because there are many possible always to configure a system of 100 atoms where 3 have been removed.
2.1.4. Second Low
Chapter 2. Fuel Cell Thermodynamics
√ 총 Z 개의 원자들 중 N 개의 원자를 취하는 경우 시스템 구성이 가능한 미소 상태수 : ) ! ( )! ( ! ! ) 1 ( ) 2 )( 1 ( N N Z Z N N Z Z Z Z (2.7) ☞ 그림 2.2b, 100 개의 원자 중 3 개를 취하는 가능한 방법 수 5 151 157 10 7 . 1 ) 6 )( 10 6 . 9 ( 10 3 . 9 (2.8) ☞ This is yields S=7.22ⅹ10-23J/K.
2.1.4. Second Low
Chapter 2. Fuel Cell Thermodynamics
√ 일정한 압력의 가역 열 전달 계에서 , 시스템의 엔트로피 변화 :
T
dQ
dS
rev (2.9)0
univdS
(2.10) √ 열역학 제 2 법칙에서 시스템과 그 주위의 계의 엔트로피의 변화는 증가하거 나 최소한 0 이 된다 : √ 실제 엔트로피를 정확히 계산할 수 없으나 , 열 전달이 시스템 엔트로피를 얼 마나 변화시키는지에 근거하여 유추2.1.5.
열역학적 퍼텐셜
Chapter 2. Fuel Cell Thermodynamics
◈ 시스템의 내부 에너지
☞ 식 (2.3) 과 (2.9) 로부터 , TdS ⇒ 가역적인 열 전달 , pdV ⇒ 기계적인 일dU
TdS
pdV
)
,
( V
S
U
U
(2.11) (2.12)T
dS
dU
V
P
dS
dU
S
(2.13) (2.14)2.1.5. Thermodynamic Potentials
Chapter 2. Fuel Cell Thermodynamics
√ S 와 V 의 측정 어려움 . T, P 로 측정하여 변환 . 새로운 열역학적 퍼텐셜 G(T, P) 정의 :
V
dV
dU
S
dS
dU
U
G
S V
(2.15) ☞ (dU/dS)V = T 와 (dU/dV)S = -p : (Gibbs free energy)pV
TS
U
G
(2.16) √ G 의 변화 ( 수학적 dG) :Vdp
pdV
SdT
TdS
dU
dG
(2.17) ☞ dU = TdS – pdV :Vdp
SdT
dG
(2.18)2.1.5. Thermodynamic Potentials
Chapter 2. Fuel Cell Thermodynamics
√ 식 (2.15) 와 유사하게 열역학 퍼텐셜 H :
V
dV
dU
U
H
S
(2.19) ☞ (dU/dV)S = -p: H : 엔탈피pV
U
H
(2.20)Vdp
pdV
dU
dH
(2.21) ☞ dU = TdS – pdV 적용Vdp
TdS
dH
(2.22) ☞ 미분2.1.5. Thermodynamic Potentials
Chapter 2. Fuel Cell Thermodynamics
√ 헬름홀츠 (Helmholtz) 자유 에너지 (F) :
TS
U
F
(2.23) ☞ 미분 , 계산 :pdV
SdT
dF
(2.24) √ U : 온도 , 부피 변화 없는 경우☞ 시스템 구성에 필요한 에너지 H : U+( 부피 0 부터 ) 시스템 차지 공간 만드는데 필요한 일 F : U – 등온상태 열 전달로 시스템 주변으로부터 얻는 에너지G
U
TS
pV
2.1.5. Thermodynamic Potentials
Chapter 2. Fuel Cell Thermodynamics
Figure 2.3. Pictorial summary of the four thermodynamic potentials. They relate to one another by offsets of the “energy from environment” term TS and the “expansion work” term pV. Use this diagram to help remember the relationships. 차원석 『 연료전지개론 』 한티미디어 , 2008 년
Chapter 2. Fuel Cell Thermodynamics
√ 몰 양은 고유한 양 , 화학반응에서 몰 양 근거 에너지 변화 계산 △ → 열역학 과정에서 초기상태와 최종상태 사이의 변화 rxn rxn rxns
v
g
ˆ
,
ˆ
,
ˆ
2.1.7.
표준 상태
√ 실온 : 25 → 298.15K℃√ 대기압 : 1 bar → 100 kPa, 1atm → 101.325 kPa
◈ STP (standard temperature and pressure)
2.1.6.
몰 용량
◈ 몰 용량
√ 고유 (Intrinsic) : T, P → 시스템의 크기에 무관 √ 비고유 (Extrinsic) : 내부에너지 , 엔트로피 → 시스템 크기와 연관 kJ molH kJ molO molH molO molH kJ rxn g ) ( 237 ) 2370 ) 2 /( 1 1 ( 5 : / 237 ˆ 2 2 2 2 2 2.1.8.
가역성
◈ 가역성
Chapter 2. Fuel Cell Thermodynamics
√ 가역적 : 열역학적 평형
√ 가역적 연료전지 전압 : 열역학적 평형에서 연료전지에 의해 생성된 전압 √ 가역적인 연료전지 전압 식들은 평형상태 조건에서 적용
- E : 열역학적으로 예상되는 가역적인 전압 - V : 연료전지의 비가역적인 작동전압
◈ Review general thermodynamics
Chapter 2. Fuel Cell Thermodynamics
2.2.
연료의 열 퍼텐셜 : 반응 엔탈피
√ 엔탈피 미분식 식 (2.22)Vdp
TdS
dH
(2.27) √ 정압과정 (dp = 0), 식(2.27) :TdS
dH
(2.28) ☞ 정압 상태에서 dH 를 dU 의 형태로 표현 :dW
dU
TdS
dH
(2.29) ☞ 연소열 : 연소반응과 관련된 엔탈피 변화 반응 엔탈피 , 반응열 : 화학반응에서 엔탈피 변화2.2.1.
반응 엔탈피의 계산
Chapter 2. Fuel Cell Thermodynamics
2.2.1.
반응 엔탈피의 계산
2.2.2.
엔탈피의 온도 의존성
Chapter 2. Fuel Cell Thermodynamics
T T p f fh
c
T
dT
h
0)
(
0
T T p fdT
T
T
c
s
s
0)
(
0
◈ 엔탈피 (H)
와 엔트로피 (S)
√ 온도에 따른 엔탈피 변화 : 열 용량 의존 (2.35) (2.36) √ 유사하게 온도에 따른 엔트로피 변화 : 열 용량 의존2.3. Work Potential of A Fuel Cell
Chapter 2. Fuel Cell Thermodynamics
2.3.1.
깁스 자유에너지의 계산
√ G = U + PV – TS 와 H = U + PV 이므로 (2.37)◈ 깁스 자유 에너지 (G)
TS
H
G
☞ 위 식을 미분하면 (2.38)SdT
TdS
dH
dG
√ 온도가 일정 ( 등온과정 ) (2.39)s
T
h
g
ˆ
ˆ
ˆ
√ G: 시스템 생성 전체에너지 , 시스템 뽑아낼 수 있는 최대 에너지 , 일 퍼텐셜√ 예제 2.2 : 수성가스화 전환반응 반응의 자발성 계산
2.3.1.
깁스 자유에너지의 계산
Chapter 2. Fuel Cell Thermodynamics
2.3.1.
깁스 자유에너지의 계산
2.3.1.
깁스 자유에너지의 계산
Chapter 2. Fuel Cell Thermodynamics
2.3.2.
깁스 자유에너지와 전기적 일과의 관계
◈ 깁스 자유 에너지 (G) 와 전기적 일 (W)
√ 식 (2.17) 로부터 , 깁스 자유 에너지 유도 :Vdp
pdV
SdT
TdS
dU
dG
(2.47) ☞ 기계적 일과 전기적인 일 포함 :)
(
pdV
dW
elecTdS
dW
TdS
dU
(2.48) ☞ dG 유도 elecdW
Vdp
SdT
dG
(2.49)Chapter 2. Fuel Cell Thermodynamics
☞ 일정 온도 , 압력 (dT, dP = 0): 최대 전기적일 깁스 자유에너지의 음수 값
elec
dW
dG
(2.50)2.3.2. Relationship Between Gibbs Free Energy and Electrical Work
☞ 몰 당량을 사용 식을 유도
rxn elec
g
dW
(2.51)Chapter 2. Fuel Cell Thermodynamics
2.3.2. Relationship Between Gibbs Free Energy and Electrical Work
그림 2-4. 일정 압력 온도 하에서 작동하는 가역 열역학적 엔진 ( 혹은 열기관 ) 의 도 표 . 반응물과 생성물이 각자 일정 압력 온도 상태에서 엔진에 들어가고 나온다 . 이
엔진은 반응물의 화학 (열 ) 에너지로 외부 일을 생성한다 . 또한 , 이 엔진은 등온등
Chapter 2. Fuel Cell Thermodynamics
2.3.3. 깁스 자유 에너지와 반응의 자발성 관계◈ 깁스 자유 에너지 (G) 와 반응의 자발성
√ ∆G 의 부호는 반응의 자발성 여부 표현 : favorable) ally (energetic s Spontaneou G m Equilibriu G e) unfavorabl ally (energetic eous Nonspontan G 0 0 0 ☞ If ΔG is zero, then no electrical work can be extracted from a reaction. ☞ If ΔG is greater than zero, then work must be input for a reaction to occur.
Chapter 2. Fuel Cell Thermodynamics
2.3.4.
깁스 자유 에너지와 전압의 관계
◈ 깁스 자유 에너지 (G) 와 전압 (V)
√ 전기적 일EQ
W
elec
(2.52) √ 전하가 전자에 의해 운반된다면nF
Q
(2.53) ☞ 식 (2.51), (2.52), 와 (2.53) 을 결합 (2.54)nFE
g
ˆ
t tan cons Faraday's F: ransferred lectrons t moles of e number of : nChapter 2. Fuel Cell Thermodynamics
2.3.4. Relationship Between Gibbs Free Energy and Voltage
√ 수소 - 산소 연료전지에서 반응 (2.55)
O
H
O
H
2 2 22
1
∵ 깁스 자유 에너지 변화 : -237kJ/mol ( 표준상태에서 생성물이 물일 때 ) ☞ 표준상태조건에서 수소 - 산소 연료전지의 가역전압V
.
l)
96,400C/mo
reactant)(
mol
/
mole
(
mol
/
J
,
nF
gˆ
E
rxn23
1
2
000
237
0 0
(2.56)Chapter 2. Fuel Cell Thermodynamics
2.3.5.
표준전극 전위 : 가역전압계산
◈ 가역전압계산
√ 표준전극전위 표 : 수소환원반응에 대한 다양한 화학적 반쪽반응의 표준상 태 가역전압을 보여준다 --√ 수소환원반응의 표준상태전위는 0 으로 정의 , 다른 반응과 비교하기 쉽다 . √ 전극전위 개념의 리스트 ( 표 2.1) √ 자세한 전극전위 표 : 부록 C √ 완전한 전기화학적 시스템에 의해 생성된 표준상태 전압 : 회로 안에 모든 전위를 더해 주면 됨 (2.57)
0 0 reactions half cellE
E
Chapter 2. Fuel Cell Thermodynamics
2.3.5. Standard Electrode Potentials: Computing Reversible Voltages
Electrod Reaction E0(V) Fe2+ + 2e- Fe⇌ -0.440 CO2 + 2H+ +2e- CHOOH⇌ (aq) -0.196 2H+ +2e- H⇌ 2 0.000 CO2 + 6H+ + 6e- CH⇌ 3OH + H2O 0.03 O2 + 4H+ + 4e- 2H⇌ 2O 1.229
Table 2.1. Selected List of Standard Electrode Potentials
Chapter 2. Fuel Cell Thermodynamics
√ 수소 - 산소 연료전지의 표준상태 전위 계산
2.3.5. Standard Electrode Potentials: Computing Reversible Voltages
229 1 2 1 229 1 2 4 4 2 1 000 0 2 2 0 2 2 2 0 2 2 0 2 . E O H O H . E ) O H e H O ( . E e H H cell ☞ 화학량론에 근거 O2 반응은 ½ 곱함 ☞ E0 는 ½ 곱하지 않음 ⇒ E0 값은 반응하는 물질의 양과 무관 ☞ 완전한 전기화학 반응 : 산화반응 한 개 + 환원반응 한 개 ☞ 전극전위 표 : 전극전위 크기 작은 쪽이 반대 방향으로 반응 진행
Chapter 2. Fuel Cell Thermodynamics
√ Fe2+-H+ 반응 : 수소 환원반응 (0V) > 철 환원반응 (-0.44V) ☞ 역방향 진행
2.3.5. Standard Electrode Potentials: Computing Reversible Voltages
☞ 철은 자발적으로 산화 Fe2+ 가 되고 , 수소기체 발생 ☞ 전체 전지 퍼텐셜 :0.440V ☞ 표준상태에서 자발적인 반응 ☞ 0.44V 보다 큰 외부 전압이 전지에 작용하면 ☞반응이 역방향 진행
000
.
0
2
2
H
e
H
2E
440
.
0
2
2
Fe
e
E
Fe
440
.
0
2 2
H
Fe
H
E
Fe
Chapter 2. Fuel Cell Thermodynamics
2.3.5. Standard Electrode Potentials: Computing Reversible Voltages
Chapter 2. Fuel Cell Thermodynamics
2.4.
비 표준상태 조건에서 연료전지의 가역전압 계산
◈ 가역 전압 계산
√ 표준상태와 다른 조건에서 연료전지 전압의 변화 고려 1. 온도에 따른 가역전압 변화 2. 압력의 영향 3. 물질의 활동도 ( 농도 ) 의 영향 ⇒ Nernst 식으로 표현 √ 임의 조건하에서 연료전지의 가역전압을 예측할 수 있는 열역학적 도구Chapter 2. Fuel Cell Thermodynamics
2.4.1.
온도에 따른 가역전압 변화
◈ 온도에 따른 가역전압 변화
√ 가역전압이 온도에 따른 변화 이해 . √ 깁스 자유에너지 미분 형 :Vdp
SdT
dG
(2.63) ☞ 온도로 미분S
dT
dG
p
(2.64) ☞ 몰 당량으로 변환 :sˆ
dT
)
gˆ
(
d
p
(2.65)Chapter 2. Fuel Cell Thermodynamics
√ 깁스 자유에너지와 가역전지전압의 관계 :
nFE
gˆ
(2.66)2.4.1. Reversible Voltage Variation with Temperature
√ 몰당량 식 (2.65) 과 식 (2.66)
nF
sˆ
dT
dE
p
(2.67) √ 일정압력에서 , ET 는 다음과 같이 계산)
T
T
(
nF
sˆ
E
E
T
0
0 (2.68)Chapter 2. Fuel Cell Thermodynamics
√ 식 (2.68) 의미
1. ŝ△ ( 양수 ) → ET 는 온도에 정비례
2. ŝ△ ( 음수 ) → ET 는 온도에 반비례
연료전지 반응에서 △ ŝ( 음수 ) 이므로 온도가 증가하면 가역전압은 감소
2.4.1. Reversible Voltage Variation with Temperature
√ H2-O2 연료전지 시스템
(∆ŝrxn = -44.43 J/(mol·K) (for H2O(g) as product))
)
)(
/
V
10
304
.
2
(
)
(
)
400
,
96
)(
2
(
)
/(
43
.
44
0 4 0 0 0T
T
K
E
T
T
K
mol
J
E
E
T
(2.69) ∴ 전지의 온도가 100 도 증가하면 ☞ 연료전지의 전압 23-mV 감소Chapter 2. Fuel Cell Thermodynamics
2.4.1. Reversible Voltage Variation with Temperature
Figure 2.4. Reversible voltage (ET) versus temperature for electrochemical ion of a variety of fuels. 차원석 『 연료전지개론 』 한티미디어 , 2008 년
Chapter 2. Fuel Cell Thermodynamics
2.4.2.
압력에 따른 가역전압 변화
◈ 압력에 따른 가역 전압 변화
√ 온도의 영향과 유사하게 전지전압의 압력의 영향은 깁스 자유에너지 미분 식 에서 계산 :Vdp
SdT
dG
(2.70) ☞ 일정온도에서 압력의 미분V
dp
dG
T
(2.71) ☞ 반응 몰당량 표현식
ˆ
)
ˆ
(
Tdp
g
d
(2.72)Chapter 2. Fuel Cell Thermodynamics
☞ 가역 전지전압과 깁스 자유에너지 관계nFE
g
ˆ
(2.73) ☞ 가역전지 전압을 압력의 함수로 표현 :nF
dp
dE
T
ˆ
(2.74)2.4.2.
압력에 따른 가역전압변화
⇒ 압력에 따른 가역전지전압의 변화는 반응의 부피변화와 관계가 있다 . ⇒ 르샤틀리에의 원리 : 시스템 압력 증가 ☞ 감소시키는 방향으로 반응 진행 반응의 부피변화가 음수 ☞ 전지전압 압력증가에 따라 증가 반응의 부피변화가 양수 ☞ 전지전압 압력증가에 따라 감소Chapter 2. Fuel Cell Thermodynamics
2.4.2. Reversible Voltage Variation with Pressure
√ 이상기체 방정식이 적용된다면 식 (2.74) 는 다음과 같이 표현 : 일반적으 로 기체만이 부피변화를 감지한다 . (2.75)
nFp
RT
n
dp
dE
g T
Where, gas of moles reactant of number the n gas of moles product of number the n reaction upon gas of moles of number total the in charge the Δn r p g : : : √ 온도에서와 같이 압력의 가역전압에 대한 영향은 미미하다 . ( 수소 - 산소 연료전지에 압력을 수소 3 기압 , 산소 5 기압을 주어도 가역 전압은 15mV 증가 )Chapter 2. Fuel Cell Thermodynamics
2.4.3.
농도에 따른 가역전압 변화 : Nernst 식
◈ 화학적 퍼텐셜 (µ)
√ 화학적 퍼텐셜 : 시스템의 화학적 성질이 변함에 따라 깁스 자유에너지 어떻 게 변하는지 설명 i j n P T i in
G
, ,
(2.76)Where, i :the chemical potentialof species iin phase
√ 화학적 퍼텐셜은 활동도 (a) 를 통해 농도와 관계 : i i i
RT ln
a
0
(2.77) Where, i species of activity the a conditions state standard at i species of potential chemical eferance r the i i : : 0 Chapter 2. Fuel Cell Thermodynamics
2.4.3. Reversible Voltage Variation with Concentration:
Nernst Equation
√ 물질의 활동도는 그물질의 화학적 특징과 연관 : 1 , ) / ( , / , ) ( ) / ( , / , 0 0 0 0 i i i i i i i i i i i a c c a c c a p p a p p a 물질 순수한 용액 비이상적 용액 이상적 희석한 기체 비이상적 이상기체 ◈ 깁스 자유 에너지 (G)
√ 식 (2.76) 과 (2.77) 을 결합하면 , 화학물질 i 에 대한 시스템의 깁스 자 유에너지 변화 계산
i i i i i i idn
RT
a
dn
dG
(
0ln
)
(2.78)Chapter 2. Fuel Cell Thermodynamics
2.4.3. Reversible Voltage Variation with Concentration:
Nernst Equation
√ l 몰의 A 에 대한 임의의 화학식 고려 (2.79)nN
mM
bB
A
1
b B A n N m M B A N Ma
a
a
a
RT
b
n
m
g
ˆ
(
0
0)
(
0
0)
ln
1
(2.80)state)
-standard
(
a
a
a
a
RT
g
g
b B A n N m M
1 0ln
ˆ
ˆ
(2.81)∴ 반트호프 등온선 (van’t Hoff isotherm), 깁스 자유에너지의 변화량을 반응 물과 생성물의 활동도 함수 ( 압력 , 농도 ) 로 표현 .
Chapter 2. Fuel Cell Thermodynamics
2.4.3. Reversible Voltage Variation with Concentration:
Nernst Equation
√ 깁스 자유에너지와 가역전지전압 관계 :nFE
gˆ
(2.82) √ 식 (2.81) 과 (2.82) 를 결합하면 b B A n N m Ma
a
a
a
nF
RT
E
E
0
ln
1 (2.83) √ 일반적인 Nernst 방정식 형태 (2.84)◈ Nernst equation
i i reactant productsa
a
nF
RT
E
E
ln
0 √ Nernst 방정식은 가역적인 전지화학적 전지전압의 변화를 물질의 농도 , 기체 압력과 기타 다른 것들의 함수로 나타내게 해준다 .Chapter 2. Fuel Cell Thermodynamics
수소 - 산소 연료전지 : H
2+ 0.5 O
2= H
2O (2.85)
√ 연료전지가 100 도 이하에서 작동되어 액체인 물이 생성되면 물의 활동도는 1 이 된다 . (2.82) √ 수소 - 산소 연료전지에서 - 1 기압에서 가역전압 : E=1.219 V ☞ 산소 1 기압과 비교 10mV 차이 ( 반응속도 측면은 또 다른 효과 ) - 수소 3 기압 , 공기 5 기압 : E=1.244 V 2 / 1 0 2 2 2ln
2
H O O Hp
p
a
F
RT
E
E
(2.86)◈ Nernst equation
2 / 1 0 2 21
ln
2
F
p
Hp
ORT
E
E
Chapter 2. Fuel Cell Thermodynamics
2.4.4.
농도 전지
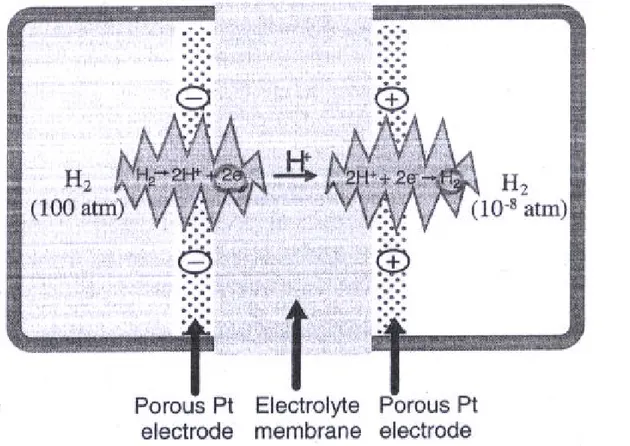
√ 농도전지 : 두 전극에 다른 농도의 동일한 화학물질로 구성된 전지 √ 화학물질의 활동도가 다르기 때문에 전압을 생성 √ 수소농도전지 : 수소연료 칸 100 기압 , 진공 칸 10-8 기압 인 경우 Nernst 식 : E=0.296V √ 전기화학적 퍼텐셜 : 열역학적 평형을 유지하기 위해 서로를 상쇄하는 화학 적 , 그리고 전기화학적 퍼텐셜의 개념 i i i i
z
F
~
(2.93)Where,
~
i : the electrochemical potential of speciesi
i
: the chemical potential of speciesi
i
z
: the charge number on the species : Faraday’s constantF
i
: the electrical potential experienced by speciesi
i
Chapter 2. Fuel Cell Thermodynamics
2.4.4. Concentration Cell
Figure 2.5. hydrogen concentration cell. A high-pressure hydrogen compartment and a low pressure hydrogen compartment are separated by a electrolyte-platinum membrane structure. This device will develop a voltage due to the difference in the chemical potential of hydrogen ween the two compartments. 차원석 『 연료전지개론 』 한티미디어 , 2008 년
Chapter 2. Fuel Cell Thermodynamics
2.4.5.
요약
√ 표준상태가 아닌 조건에서 가역적인 전기화학적 전지 전압에 효과 요약 . ☞ 온도에 따른 가역 전지 전압의 변화 nF s dT dE p ☞ 압력에 따른 가역전지 전압의 변화 nF v nFp RT n dp dE g T ☞ 화학적 활동도 ( 화학적 조성 , 농도 , 기타등등 ) 에 따른 변화 온도에 대한 Nernst 식은 충분치 않고 , 온도가 일정하지 않을 때 E0 ☞ET
i i v reactants v products a a nF RT E E 0 ln (2.98) (2.99) (2.100)Chapter 2. Fuel Cell Thermodynamics
2.5.
연료전지 효율
√ 실제 연료전지는 운전하는 동안 비 가역 반응손실 때문에 이상적인 연료전 지보다 효율이 낮다 . ( 연료전지의 이상적인 효율 = 깁스 자유에너지 변화 )2.5.1.
이상적인 가역 연료전지의 효율
√ 효율 ε 의 정의 energy total energy useful
h
work
(2.101) (2.102) √ 화학반응에서 효율 정의 : 일할수 있는 최대양은 깁스에너지의존h
g
H L HT
T
T
(2.105)Chapter 2. Fuel Cell Thermodynamics
2.5.1. Ideal Reversible Fuel Cell Efficiency
Chapter 2. Fuel Cell Thermodynamics
2.5.2.
실제 연료전지의 효율
√ 실제 연료전지의 효율은 가역적인 열역학 효율보다 언제나 작다 . 두 주요 이유는 다음과 같다 ; 1. 압력 손실 2. 연료 이용 손실 √ 연료전지의 실제 효율 ( ) , 다음과 같이 계산 √ 가역적인 열역학 : 이상적인 조건에서 연료의 모든 엔탈피 사용 불가 √ 연료전지 전압효율 : 비가역적인 반응 , 생기는 손실 ( 작동전압 / 가역전압 ) √ 연료이용효율 : 연료전지 생성된 전류 / 공급되는 총 열료 ( 과급률 λ 표현 ) real
)
(
)
(
)
(
thermo voltage fuelreal
fuel HHV realv
nF
i
E
V
h
g
/
(2.107) (2.111)Chapter 2. Fuel Cell Thermodynamics
2.5.2.
실제 연료전지의 효율
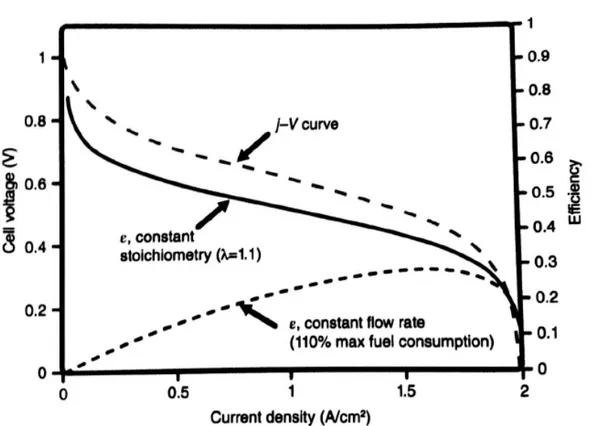
그림 2-9. 일정 유량 조건에 따른 일정 과급 조건 하에서의 연료전지 효율 .
일정과급조건 - 낮은 전류밀도에서 효율이 높다 .
Chapter 2. Fuel Cell Thermodynamics
2.6.
연료전지의 열 및 물질 균형
식 (2.126) 식 (2.127) 식 (2.128) STP 에서 수소연료전지 :100% 연료활용 , 0.7V, 10A 작동 전력 =7W ; 열 발생 =(1.48-0.7)V*10A=7.8W 연료전지 반응물 소모율 ν 연료의 반응 엔탈피 기준 입력에너지율 열생산율 , 출력전력 , 작동전압 , 작동전류 연료전지가 특정전압 , 전류에서 전기를 생산할 때 얼마만큼 열을 생성하는지 알 수 있다Chapter 2. Fuel Cell Thermodynamics
2.6.
연료전지의 열 및 물질 균형
식 (2.129) 식 (2.130) - 대부분 연료전지 소모하는 것 보다 더 많은 연료 공급 ( 성능저하 , 연구적 손상방지 ) - 입 출입 연료의 전체 질량 평형 필요 ( 생성 / 소모되는 물질 고려 ) 1000kA 전류 생성 , 20mol/s 공기공급 , 수소 산소 연료전지의 나가는 공기양 연료전지의 물 생산율Chapter 2. Fuel Cell Thermodynamics
2.6.
연료전지의 열 및 물질 균형
Chapter 2. Fuel Cell Thermodynamics
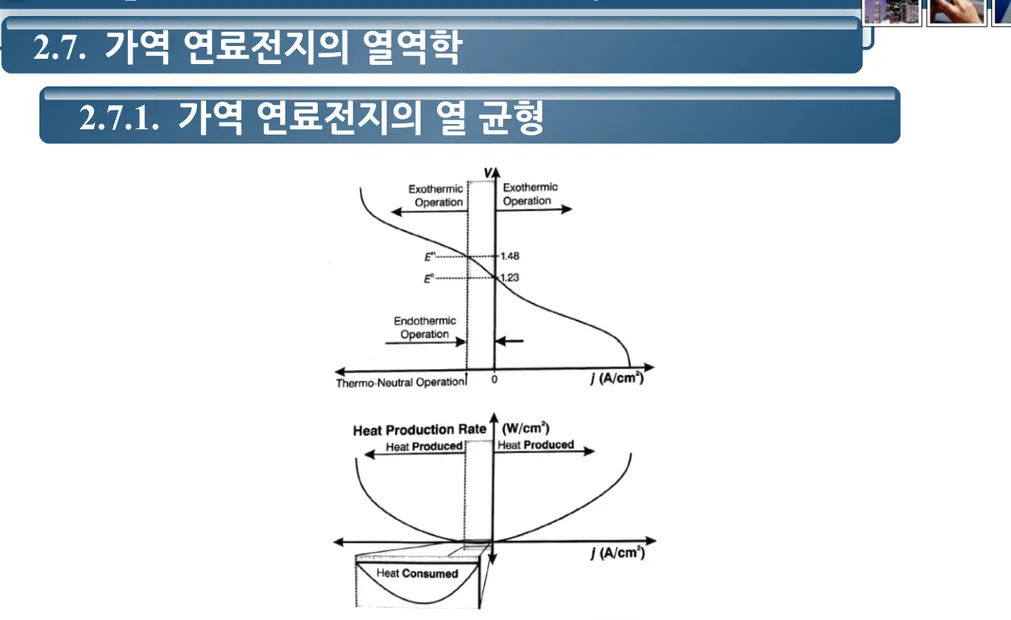
2.7.
가역 연료전지의 열역학
식 (2.131) 식 (2.132) 식 (2.133) 전기분해 효율의 이상적 ( 열역학적 ) 최대한계 표준상태에서 120% 가역 HHV 물 전기분해 효율 - 물 전기분해 효율 100% 이상 : 주변환경에서 비가역적 엔트로피 열 사용 연료전지모드와 비교 했을 때 비가역적 엔트로피 열흐름 방향 - 연료전지 : 주변으로 비가역적 엔트로피 열손실Chapter 2. Fuel Cell Thermodynamics
2.7.
연료전지의 열 및 물질 균형
식 (2.134) 식 (2.135) 식 (2.136) 전기분해 과정의 효율 전기분해와 수소 연료전지의 총과정 열역학적 왕복효율 =100% 전기분해장치의 열소모량은 전력공급과 생산된 화학적 힘의 균형Chapter 2. Fuel Cell Thermodynamics
2.7.
가역 연료전지의 열역학
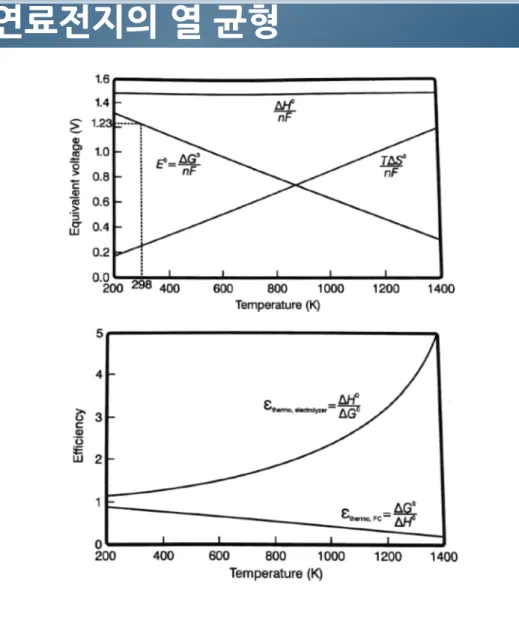
2.7.1.
가역 연료전지의 열 균형
그림 2-11. 연료전지와 전기분해장치 작동 영역을 보여주는 가역 연료전지의 열 평형 .
Chapter 2. Fuel Cell Thermodynamics
2.7.1.
가역 연료전지의 열 균형
Chapter 2. Fuel Cell Thermodynamics
Chapter Summary
The purpose of this chapter is understand the theoretical limits to fuel cell performance by applying the principles of thermodynamics. The main points introduced in this chapter include the following:
√ Thermodynamics provides the theoretical limits or ideal case for fuel cell mance.
√ The heat potential of a fuel is given by the fuel's heat of combustion or, more generally, the enthalpy of reaction.
√ Not all of the fuel is given by the Gibbs free energy, ΔG.
√ Electrical energy can only be extracted from a spontaneous ("downhill") chemical reaction. The magnitude of ΔG gives the amount of energy that is available ee") to do electrical work. Thus, the sign of ΔG indicates whether of not electrical work can be done, and the size of ΔG indicates how much electrical work can be done.
√ The reversible voltage of a fuel cell, E, is related to the molar Gibbs free energy by .
√ ΔG scales with reaction amount whereas and. E do not scale with reaction amount. nFE g g
Chapter 2. Fuel Cell Thermodynamics
Chapter Summary
√ E varies with temperature as . For fuel cells, is generally negative, therefore reversible fuel cell voltages tend to decrease whit increasing temperature. E varies whth pressure as :
√ The Nernst equation describes how E varies with reactant/product activites:
√ The Nernst equation intrinsically includes the pressure effects on reversible cell voltage but does not fully account for the temperature effects.
√ Ideal HHV fuel cell efficiency
√ Thermodynamic fuel cell efficiency generally decreases as temperature increases. Contrast this to heat engines, for which thermodynamic efficiency generally eases as temperature increases.
√ Real fuel cell efficiency is always less than the ideal thermodynamic efficiency. Major reasons are irreversible kinetic losses and fuel utilization losses. Total overall efficiency is given by the product of individual efficiencies.
. / / dT s nF dE s . / ) /( /dp n RT nFp v nF dE g