대한소화기학회지 2000;35:144 - 153
2)
접수: 1999년 8월 30일, 승인: 1999년 10월 29일
연락처: 한상준, 137-701, 서울시 서초구 반포동 505번지, 가톨릭대학교 의과대학 생리학교실 Tel: (02) 590-1170, Fax: (02) 532-9575, E-mail: sjhahn@cmc.cuk.ac.kr.
※ 현주소: 중앙대학교 약학대학 병태생리학교실
고양이 위 평활근에서 P ota s s iu m Ch a n n els 의 F lu ox et in e에 의한 조절작용
가톨릭대학교 의과대학 생리학교실
최진성・성종호・최재천・최복희・한상준・윤신희・심상수*・조양혁・김명석
E ffe c t s o f F lu o x e t i n e o n P o t a s s i u m Ch a n n e ls i n Ca t Ga s t r i c S m o o t h Mu s c le Ce l ls
J i n S u n g Ch oi , M.S., J o n g Ho S u n g , J a e Ch u n Ch o i , M.S., B ok H e e Ch o i , M.S., S a n g J u n e H a h n , M.D., S h i n H e e Yoo n , M.D., S a n g S o o S i m , P h .D.,*
Yan g Hy e ok J o , M.D. a n d My u n g S u k Ki m , M.D.
Department of Physiology, College of Medicine, The Catholic University of Korea, Seoul, Korea
Background/Aims: In this study, the effects of fluoxetine on voltage-activated potassium channels
and Ca2+-activated potassium channels were examined in isolated gastric smooth muscle cells of cat We measured intracellular calcium levels. The effects of fluoxetine on contractile activity of circular smooth muscle strips were also studied. Methods: We have used the whole-cell recording and excised inside-out patch clamp technique and dual wavelength ratio technique. We also measured isometric contraction of the muscle strips. Results: In whole-cell recordings, fluoxetine had a dua action on voltage-activated potassium currents. At lower concentration, fluoxetine (3-30 μM) decreased outwardly delayed rectifier potassium currents in a concentration-dependent manner with an IC50 value of 5.5 μM. However, at 100 μM, fluoxetine slightly increased potassium currents. Exposure of the cells to fluoxetine (100 μM) resulted in an increase in intracellular calcium levels. In excised inside-out recordings, application of fluoxetine (10 μM) to bath solution had no effect on single-channel conductances of Ca2+-activated potassium currents but increased noise level of open state (flicker block). Finally, fluoxetine did not show any effect on KCl-induced muscle contractionConclusions: We conclude that fluoxetine has inhibitory effects on outwardly delayed rectifier
potassium currents and blocks the open state of Ca2+-activated potassium currents in isolated gastric smooth muscle cells of cat. (Kor J Gastroenterol 2000;35:144 - 153)Key Words: Fluoxetine, Voltage-activated potassium channel, Calcium-activated potassium channel,
Smooth muscle, Cat stomach최진성 외 8인. 고양이 위 평활근에서 Potassium Channels의 Fluoxetine에 의한 조절작용 145
서 론
위장관 평활근에는 일반적으로 2종류의 K+ 이온 통로가 존재하는 것으로 기술되어 있다. 첫째로 전 압의존성 K+ 이온통로(voltage-activated potassium channels)는 활동전압이 발생하는 흥분세포 즉 신경 세포 등에서는 활동전압을 과분극시키는 것으로 알 려져 있으나,1 위장관 평활근에서는 위서파(gastric slow wave)의 탈분극(upstroke depolarization phase) 시 amplitude을 억제하며 서파의 plateau phase에 내 향성 Ca2+ 전류에 상응하는 외향성 전류를 발생시킨 다. 또한 전압의존성 K+ 이온통로는 평활근 세포의 안정막 전압 유지에 관여하여 평활근 세포의 수축조 절작용에 중요한 역할을 한다. 둘째로 Ca2+ 의존성 K+ 이온통로(Ca2+-activated potassium channels)는 세 포 내의 유리 Ca2+ 농도와 막전압의 탈분극에 의해 활성화되며 unitary conductance가 200 pS (Maxi potassium channels)이상을 나타낸다.2 위장관 평활 근에서 Ca2+ 의존성 K+ 이온통로는 위서파의 과분극 에 관여하는 것으로 알려져 있으나,3,4 이 이온통로가 위장관운동 조절에 어떠한 역할을 하는지 확실히 밝 혀지지는 않았다. 위장관운동은 위장관 평활근에서 발생하는 위서파에 의해 조절되며 이 서파의 조절은 평활근 세포막에 존재하는 이온통로 즉 Ca2+ 이온통 로와 K+ 이온통로의 활성화 및 비활성화의 균형에 의하여 결정된다. 그러므로 위 평활근에 존재하는 이온통로의 조절을 이해하는 것은 위장관운동 조절 기전을 이해하는 데 매우 중요하다.
Fluoxetine (Prozac)은 현재 정신과 영역에서 가장 널리 사용되는 항우울제의 하나로서 주된 약리작용 은 신경세포의 시냅스 간격(synaptic cleft)으로부터 특이적으로 sodium-dependent serotonin (5-hydroxy- tryptamine, 5-HT)의 재흡수를 차단(selective sero- tonin reuptake inhibitor, SSRI)함으로써 serotonergic neurotransmission만을 선택적으로 증가시킨다.5,6 그 러나 fluoxetine은 이러한 SSRI 작용 이외에 여러 이 온통로에 작용하는 것으로 보고되었다. 예를 들면 개의 공장(jejunum)에서 분리한 평활근세포에서 fluoxetine은 delayed rectifier K+ 전류를 감소시켰으
며, 이 감소 효과는 protein kinase C (PKC)를 경유하 여 일어난다고 보고되었다.7 그러나 최근의 본 교실 의 보고에 의하면 fluoxetine은 PC12세포에 존재하 는 전압의존성 K+ 이온통로, Ca2+ 이온통로 및 Na+
이온통로를 비특이적으로 억제하였으며 이와 같은 억제 효과는 protein kinase A 및 C와 G-단백질을 경 유하지 않고 일어났다.8 한편 fluoxetine은 Xenopus oocyte에서 발현시킨 전압의존성 K+ 통로(Kv1.1)와 nicotinic acetylcholine receptor에서 열린통로 차단제 (open channel blocker)로서 이온통로에 직접적으로 작용한다고 보고되었다.9,10 또한 Kv1.3를 발현시킨 CHO세포에서도 fluoxetine은 세포 내에서 열린통로 차단제로 작용함을 보고하였다.11
한편 fluoxetine을 복용한 환자의 20-30%에서 보 고되는 위장관 장애인 설사, 구토12의 원인의 하나로 위장관 평활근세포의 이온통로에 fluoxetine이 작용 할 가능성이 제시되었고, 약물에 의한 이온통로의 활성도 변화는 장기의 조절작용에 중요한 변화를 일 으키는 것으로 알려져 있다. 그러므로 본 연구에서 는 고양이 위 평활근세포를 분리한 후 patch clamp techniques 중 whole-cell 및 excised inside-out recor- dings 방법을 사용하여 전압의존성 K+ 이온통로 및 Ca2+ 의존성 K+ 이온통로에 대한 fluoxetine의 영향과 세포 내 Ca2+ 농도의 변화를 관찰하고, 마지막으로 근수축 조절작용에 미치는 영향을 밝히고자 하였다.
대상 및 방법
1. 근 절편 준비
실험 동물은 평균 체중이 대략 2 kg되는 성숙한 고양이를 암수 구별 없이 사용하였다. 하룻밤 동안 절식시킨 후 복강 내에 20% urethane (5 ml/kg)을 주 사하여 동물을 마취시킨 후 개복하여 위를 신속히 적출하였다. 적출한 위에서 점막을 제거한 후 위저 부(gastric fundus)로 부터 윤상근 표본(circular mus- cle preparation, 1.0×0.2 cm)을 만들었다. 표본은 대 만(great curvature)에 대해 직각 방향으로 주행하는 근 절편을 윤상근으로 간주하였다.13 이 모든 조작은 얼음으로 차게 한 Krebs 용액에서 시행하였다.
146 The Korean Journal of Gastroenterology : Vol. 35, No. 2, 2000
2. 등장성 근수축의 측정
근수축을 기록하기 위하여 근 표본을 유리 원통 (용적: 10 ml)에 장치하였으며, 원통 내에는 pH 7.4 이고 36±0.5℃로 가온된 Krebs 용액(mM; NaCl 120.8, KCl 4.5, NaHCO3 15.5, CaCl2 1.8, MgCl2 1.2, NaH2PO4 1.2, dextrose 5.6)을 넣었다. 한편 원통 내 용액의 온도를 일정하게 유지하기 위하여 원통 주위 를 36.5℃의 물로 지속적으로 관류하였다. 원통 내와 저장용 Krebs 용액에는 95% O2와 5% CO2 혼합가스 를 계속 공급하였다. 근 표본의 한쪽 끝 부위를 원통 밑바닥의 철사 고리에 고정하고, 다른 한쪽 끝부분 을 실로써 force transducer (Grass FT03, Quincy, MA, USA)에 연결한 후 이를 polygraph (Grass 7E) 에 다시 연결하였다. 근 표본은 2 g의 장력을 가한 상태로 30분 이상 원통 내 용액 속에 방치하여 용액 과 평형 상태를 이루게 한 후 수축곡선을 기록하였 다. 고농도의 KCl 용액은 Krebs용액 조성 중 NaCl 대신 KCl로 해당하는 mole수를 대치하여 만들었다.
3. 윤상근 평활근 단일세포 분리
평활근의 단일세포를 얻기 위해 근 절편을 4℃의 변형된 Kraft-Bruhe 용액(mM; L-glutamate 50, KCl 50, taurine 20, KH2PO4 20, MgCl2 3, glucose 10, HEPES 10, EGTA 0.5, pH 7.3 with KOH)에서 30분 간 안정화시킨 후 조직을 0.2% collagenase, 0.05%
dithiothreitol, 0.1% trypsin inhibitor, 0.2% BSA, 0.1% papain이 포함된 Ca2+이 없는 37℃의 생리식염 수(physiological salt solution, PSS, mM; NaCl 135, KCl 5, MgCl2 1, glucose 5, HEPES 10, pH 7.3 with Tris)에서 소화(digestion)시켰다. 위상차 현미경으로 단일세포가 잘 나오는 시기에 도달하였는지 관찰하 다가 적정 시기에 4℃의 변형된 Kraft-Bruhe 용액으 로 바꾸어 준 후 0.83 mm mesh에 걸러 통과한 부유 액을 사용하였다.
4. K + 전류의 측정
세포의 전기생리학적 실험을 위하여 4℃에서 petri dish 안에서 poly-L-lysine (Sigma)을 입힌 cover glass에 윤상근 평활근 단일세포를 부착시킨 다음 이
온전류를 측정하였다. Voltage-clamp recording은 실 온에서 whole-cell 및 excised inside-out recording 방 법을 사용하여 실시하였다.14 Patch 전극(PG10165-4, WPI, Sarasota, FL, USA)은 전극 내 용액이 들어 있 을 때 저항값이 2-4 MΩ 되는 것을 사용하였으며, whole-cell 전류는 Axopatch 1D amplifier (Axon Instruments, Foster City, CA, USA)를 사용하여 증폭 한 후 5 kHz로 필터하고 Digidata 1200A acquisition board (Axon Instruments)를 사용하여 10 kHz에서 디지털화하였다. K+ 전류 측정을 위해 세포 외부 용 액(mM)은 NaCl 140, KCl 5, CaCl2 1.3, MgCl2 1, HEPES 25, glucose 10 (pH 7.3, NaOH)을 사용하였 고, 전극 내(pipette) 용액은 KCl 140, CaCl2 1, MgC12 1, HEPES 10, EGTA 10, MgATP 2 (pH 7.3 KOH)를 사용하였다. Excised inside-out recordings시 에는 세포 외부 용액과 전극 내 용액을 반대로 사용 하였다. 기록하는 동안 세포에 계속 1 ml/min의 속 도로 시험용액을 흘려 주었다. Leak 전류와 capaci- tance는 보정하였고 series resistance는 대략 5-10 M Ω이었으며 만약 전류가 1 nA를 넘었을 때에는 series resistance를 보정하였다. Fluoxetine은 Tocris Cookson (Bristol, UK)에서 구입하였다.
5. 세포 내 Ca 2+ 농도 측정
세포 내 칼슘 측정 방법은 분리된 세포를 변형된 Hank' s 용액(mM; NaCl 135, KCl 5, MgCl2 1, CaCl2 2. Glucose 10, Hepes 10, pH 7.4 with NaOH)에 넣 어 세포를 안정화시키고 세포가 안정화되면 세포를 0.5% bovine serum albumin을 함유한 변형된 Hank' s 용액에 Ca2+에 민감한 형광색소인 fura-2 AM (10 μM) 을 넣어 실온에서 45분간 반응시킨 후 이를 3번 세 척하였다. 세포의 형광은 340 nm과 380 nm에서 자 극을 주고 방출된 형광 정도를 510 nm에서 측정하 였다. 세포의 형광률은 340 nm에서 측정된 형광량 을 380 nm에서의 양으로 나누어 그 비율로 계산하 였다. 형광은 InCaTM Imaging System (Intracellular Imaging Inc. Cincinnati, OH, USA)을 이용하여 측정 하였다. 세포 내 Ca2+의 농도는 in situ에서 만들어진 표준곡선으로부터 계산되었다.
Choi, et al. Effects of Fluoxetine on Potassium Channels in Cat Gastric Smooth Muscle Cells 147
6. 자료 분석 및 통계 검정
K+ 전류에 대한 자료의 수집과 분석은 pClamp 6.0 software (Axon Instruments)를 사용하였다. 농도- 반응곡선은 Origin 5.0 software를 사용하여 다음과 같은 logistic 최적화곡선으로 나타내었다.
Y=1/[1+(IC50/F)n]
IC50은 전류를 50% 억제하는 fluoxetine의 농도이 며, F는 fluoxetine의 농도이고, n은 Hill coefficient이 다. 모든 실험값은 평균±표준오차로 표시하였으며, 실험 성적은 t-검정(Student' s t-test)으로써 분석하였 으며, P값이 0.05 미만일 때 통계적으로 유의하다고 간주하였다.
결 과
1. 평활근세포에 존재하는 전압의존성 K + 전류의 확인
고양이 위에서 분리한 평활근세포에서 외향성 K+
전류를 whole-cell recordings 방법을 사용하여 기록 하였다. Fig. 1은 holding potential이 -80 mV인 상태 에서 +40 mV까지 200 msec동안 전기 자극을 주어 측정한 외향성 K+ 전류를 나타낸 것이다. 아무 처치 도 하지 않은 정상 세포인 경우 기록된 외향성 K+
전류는 비교적 서서히 활성화되고 200 msec의 전기 자극 동안 거의 전류의 크기가 감소되지 않는, 즉 비 활성화(inactivation)를 나타내지 않았다. 이 전류는 전형적인 delayed rectifier K+ 전류로서 K+ 전류 차 단제인 TEA (Tetraethylammonium) 30 mM을 세포 외액에 처치시 K+ 전류는 거의 차단되었다. 이 같은 TEA의 차단작용은 약물이 없는 세포외액으로 관류 시 정상으로 회복되었다.
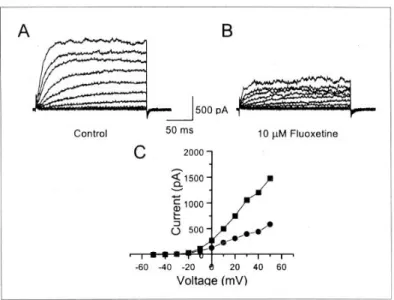
2. 자극 전압의 변화에 따른 fluoxetine의 영향 Fig. 2는 정상 및 fluoxetine (10 μM) 처치 후의 전 류-전압 관계(current-voltage relationship)의 변화를 나타낸 것이다. Holding potential을 -80 mV로 고정 하고 -50 mV부터 10 mV 간격으로 +50 mV까지 전
압을 증가시켜가며 전류를 기록한 것이다. 정상 세 포에서 외향성 K+ 전류는 -20 mV에서 서서히 활성 화되기 시작하여 전압이 증가할수록 기록된 전류의 크기도 증가하였다(Fig. 2A). 같은 세포에서 세포외 액에 fluoxetine (10 μM)을 처치 후 전류는 대부분의 전압에서 억제되었으며 활성화나 비활성화에는 영 향을 미치는 것 같지는 않았다(Fig. 2B). Fig. 2C는 전압-전류 관계를 나타낸 것으로 측정한 모든 전압 에서 기록된 K+ 전류가 억제되는 것을 보여준다.
3. K + 전류에 대한 f luox et in e의 농도 변화에 따른 영향
고양이 위 평활근세포의 외향성 K+ 전류는 fluoxe tine에 의해 농도의존적으로 억제되었다(Fig. 3).
Holding potential을 -80 mV인 상태에서 200 msec 동안 +40 mV로 10 sec마다 탈분극시키며 3, 10, 30 및 100 μM fluoxetine이 들어 있는 세포액을 차례로 세포에 관류시켰다(Fig. 3A). K+ 전류는 농도의존적 으로 감소하였으며 최대전류의 억제는 대조전류에 비해 3, 10, 30 및 100 μM fluoxetine의 처치시 각각 74.3±3.9, 49.1±3.3, 32.9±3.6 및 33.2±5.7%로 감 소하였다(n=5, Fig. 3B). 흥미로운 사실은 fluoxetine 의 작용은 농도의존적이었으나 fluoxetine 100 μM 시 더 이상 전류의 감소는 나타내지 않았으며 30 μM 에 비해 오히려 약간 증가하는 경향을 나타내었
Fig. 1. Typical whole cell potassium currents recorded from single cat stomach smooth muscle cell. A recording showing current traces obtained in the absence and pre- sence of TEA (30 mM). The block by TEA was com- pletely reversible upon washing. Holding potential was -80 mV and currents were evoked by stepping the potential to +40 mV for 200 msec.
148 대한소화기학회지 : 제 35 권 제 2 호 2000
다. 그러므로 100 μM을 제외하고 기록한 logistic 최 적화곡선에 의해 구한 IC50는 5.5 μM이었고, Hill
coefficient는 1.1이었다.
Fig. 2. Effect of fluoxetine on the potassium current-voltage relationship.
Whole cell potassium current traces in response to 200 msec voltage step to potentials from -50 to +50 mV (+10 mV increment) applied every 10 sec from a holding potential of -80 mV. Currents were measured in control conditions (A) and currents recorded in the presence of 10 μM fluoxetine (B) using the same protocol as in (A). (C) Current-voltage relations derived from the current traces as in (A, ■) and in (B, ●).
Fig. 3. Concentration-dependence of the effect of fluoxetine on potassium currents. The traces of the currents obtained in the absence and presence of 3, 10, 30, and 100 μM of fluoxetine are shown (A). Whole cell currents were elicited by 200 msec voltage step to +40 mV from a holding potential of -80 mV at 10 sec intervals. B.
Concentration-response curve. The data were fitted using the logistic equation in the text, with an IC50=5.5 μM and a Hill coefficient=1.1 (n=5).
최진성 외 8인. 고양이 위 평활근에서 Potassium Channels의 Fluoxetine에 의한 조절작용 149
4. F luox et in e이 세포 내 유리 Ca 2+에 미치는 영향
개의 공장으로부터 분리한 평활근세포에서 고농 도의 fluoxetine (1 mM)은 세포 내에 유리 Ca2+ 농도 를 증가시킨다고 보고하였다.7 본 실험에서도 fluoxetine (100 μM) 처치시 외향성 K+ 전류의 증가 가 세포 내 유리 Ca2+ 농도의 증가에 의한 이차적인 Ca2+ 의존성 K+ 이온통로의 활성화의 증가에 의한 것인지를 확인하기 위하여 fura-2 AM을 위 평활근 에 처치 후 세포 내 유리 Ca2+ 농도를 측정하였다 (Fig. 4). 세포 내 기초 상태의 유리 Ca2+ 농도는 135.8±34.2 nM이었으며 세포외액에 fluoxetine 100 μM처치시 약 5분 이내에 668.7±47.3 nM (n=3)로 세포 내 유리 Ca2+ 농도는 증가하였다.
5. Ca2+ 의존성 K+ 이온통로의 확인 및 f luoxe- t in e에 의한 변화
한편 현재까지 Ca2+ 의존성 K+ 이온통로에 대한 직접적인 fluoxetine의 작용에 대한 보고는 없다. 그 러므로 위 평활근세포에 존재하는 Ca2+ 의존성 K+
이온통로를 기록하기 위하여 inside-out patch recor- dings을 실시하였다. Fig. 5는 정상 상태에서 고양이 위 평활근세포에 존재하는 Ca2+ 의존성 K+ 이온통로 를 기록한 것이며 세포막전압을 양극으로 +10 mV 간격으로 탈분극시킴에 따라 이온통로의 open probability도 전압에 비례하여 증가되는 것을 보여 준다. 이 전류는 약 200 pS의 conductance을 가진 전 형적인 Maxi-K+ 이온통로이다. Fig. 6은 Ca2+의존성 K+ 이온통로에 대한 fluoxetine의 작용을 도시한 것 이다. 세포외액에 fluoxetine 10 μM 처치시 Ca2+ 의 존성 K+ 전류의 크기는 변화시키지 않았다. 그러나 이온통로가 열려 있는 기간 동안 빠르게 차단-비차 단(block-unblock)하는 flickering activity를 나타내었 다. Fluoxetine의 이러한 작용은 약물을 함유하지 않 은 용액으로 처치시 완전히 정상으로 회복되었다.
6. K Cl에 의한 근수축에 미치는 f luox et in e 의 영향
마지막으로 fluoxetine의 K+ 이온통로에 대한 억
Fig. 5. Voltage dependence of Ca2+-activated potassium channels in excised inside-out patch. At more positive potentials, open time probability increased. This patch contained at least 2 channels. Ca2+ concentration in bath solution was 10-7 M. Channel openings are upward (O) and closings are downward (C). Pipette: 140 mM K+.
bath: 140 mM K+.
Fig. 4. Effect of fluoxetine on intracellular free calcium ion. Cells were loaded with Fura-2 AM and stimulated with 100 uM fluoxetine. Changes in intracellular Ca2+ le- vels were monitored in real time by recording changes in the 340/380 fluorescence ratio of Fura-2 AM. Bath appli- cation of 100 μM fluoxetine induced a pronounced in- crease in intracellular Ca2+ levels.
150 The Korean Journal of Gastroenterology : Vol. 35, No. 2, 2000
제작용이 위 평활근의 수축작용에 미치는 영향을 관 찰하였다. KCl 20 mM에 의해 유발된 근수축에 fluoxetine 100 μM을 전처치시 KCl에 의한 근수축 에 아무런 영향을 미치지 못했다(Fig. 7).
고 찰
본 실험에서는 patch clamp 방법을 사용하여 고양 이 위 평활근세포에서 2가지 종류의 K+ 이온통로 즉 delayed rectifier K+ 이온통로와 Ca2+ 의존성 K+ 이 온통로가 존재하는 것을 전기생리학적으로 관찰하 였다. Fluoxetine은 분리한 고양이 위 평활근세포에 서 농도의존적으로 전압의존성 K+ 이온통로를 억제 하였고, Ca2+ 의존성 K+ 이온통로에서는 열린통로 차단제로서 작용하였다. 또한 fluoxetine은 고농도 (100 μM)에서 세포 내 Ca2+ 농도를 증가시켰다. 한 편 fluoxetine은 KCl에 의한 근수축에는 아무런 영향 을 미치지 못했다.
현재까지 fluoxetine은 여러 종류의 이온통로에 억 제적으로 작용한다고 보고되었다. 예로서 전압의존 성 K+ 이온통로, Na+ 이온통로, Ca2+ 이온통로 및 음 이온통로에 억제작용을 나타냈으며,8,10,11,15,16 ligand- gated 이온통로인 nicotinic acetylcholine receptor에 서도 열린통로 차단제로서 작용하였다.9 또한 fluoxetine은 이온통로에 직접 혹은 간접적으로 억제 작용을 나타내는 것으로 여겨진다. Fluoxetine은 개 의 공장(canine jejunum)에서 분리한 평활근세포에 서 기록된 delayed rectifier K+ currents을 protein kinase C을 경유하는 기전을 통해 억제하였으며,7 lens와 corneal epithelium의 전압의존성 K+ 이온통로 와 Na+ 이온통로는 ampotericin perforated-patch re- cordings에서 fluoxetine에 의해 억제되나 excised patch recording에서는 fluoxetine의 영향은 관찰되지 않는 사실17을 고려하면 fluoxetine 작용은 세포 내의 이차 전달물질을 통해 간접적으로 작용함을 시사한 다. 그러나 최근의 본 교실의 보고에 의하면 PC12 세포에 존재하는 전압의존성 K+ 이온통로에서 fluoxe tine은 protein kinase A 또는 C나 G-단백질을 경유 하지 않고 억제작용를 나타내었다.8 더구나 CHO 세 포와 Xenopus oocyte에 발현시킨 전압의존성 K+ 이 온통로 Kv1.3와 Kv1.1에서 fluoxetine은 열린통로 차 단제로서 직접 이온통로에 작용하는 것으로 보고되 었다.10,11 Fluoxetine이 이 실험에서 사용한 고양이 위 평활근세포에 존재하는 전압의존성 K+ 이온 통 Fig. 6. Effect of fluoxetine on Ca2+-activated potassium
channels. (A) Channel activity at a holding potential of +50 mV and a Ca2+ concentration of 10-7 M in normal conditions. (B) Increase in noise level of open state (flic- ker block) when 10 μM fluoxetine was applied to the external face of membrane. (C) Block by fluoxetine was completely reversible upon washing. Channel openings are upward (O) and closings are downward (C). Pipette: 140 mM K+. bath: 140 mM K+.
Fig. 7. Effects of fluoxetine on KCl-induced contraction of cat gastric smooth muscle strips. A strips of muscle was contracted with 20 mM KCl, washed in normal Krebs solution. Replacement of the medium with 100 μM fluoxetine and 20 mM KCl elicited a contraction. Fluoxe- tine did not alter KCl-induced smooth muscle contraction.
Choi, et al. Effects of Fluoxetine on Potassium Channels in Cat Gastric Smooth Muscle Cells 151
로에 직접 작용하는지는 알 수 없지만, Ca2+ 의존성 K+ 이온통로에서는 이온통로나 세포막에 직접적으 로 작용하여 차단작용을 일으키는 것으로 여겨진다.
본 실험에서 흥미로운 사실은 fluoxetine에 의한 전압의존성 K+ 이온통로의 억제작용이 저농도 즉 30 μM 이하에서는 농도의존적이나 그 이상 즉 100 μM에서는 오히려 K+ 전류를 약간 증가시키는 경향 을 나타내었다. 이는 fluoxetine 100 μM에서 세포 내 유리 Ca2+를 증가시키는 본 실험의 결과를 고려 할 때 증가된 Ca2+ 농도에 의한 이차적인 Ca2+ 의존 성 K+ 이온통로의 활성화의 증가에 의한 것으로 추 측된다. 그러나 위에서 기술한 바와 같이 fluoxetine 은 Ca2+ 의존성 K+ 이온통로에 직접 차단작용을 나 타내었다. 그러므로 고농도에서의 fluoxetine의 실질 적인 작용은 Ca2+ 증가에 의한 Ca2+ 의존성 K+ 이온 통로의 활성화와 직접적인 차단작용에 의한 결과를 종합한 영향을 나타낼 것으로 생각된다.
위장관 평활근에서 수축 및 이완작용은 궁극적으 로 세포 내 Ca2+ 농도에 의해 조절되며 세포 내 Ca2+
농도의 증가는 세포막전압의 탈분극에 의해 전압의 존성 Ca2+ 이온통로의 활성화에 의한 세포외액으로 부터 Ca2+의 유입에 의한 기전(electromechanical coupling)과 수용체 활성화에 의한 세포 내 Ca2+ 저 장소(sarcoplasmic reticulum)로부터 Ca2+ 이온을 유 리시키는 기전(pharmacomechanical coupling)에 의 해 조절되는 것으로 알려져 있다. 본 실험에서 100 μM fluoxetine처리시 세포 내 Ca2+ 농도의 증가는 위에서 기술한 2가지 기전에 의해 증가될 수 있으나 fluoxetine이 L-type 전압의존성 Ca2+ 이온통로를 억 제한다는 사실8을 고려하면 세포 내 Ca2+ 저장소로 부터 Ca2+ 이온을 유리시키는 것으로 추정된다. 평 활근세포의 막전압은 과분극을 일으키는 K+ 전류와 탈분극을 일으키는 Ca2+ 전류의 균형에 의해 결정되 며, K+ 통로가 활성화되면 막전압을 과분극시켜 세 포 내 Ca2+ 농도를 낮춤으로써 근이완을 일으킨다.
반대로 K+ 이온통로를 차단시 막전압의 탈분극을 초래하여 근수축을 일으킨다. 그러므로 막전압을 조 절하는 K+ 통로의 조절기전을 이해하는 것은 평활 근 수축조절을 이해하는 데 매우 중요하리라 여겨진 다. 본 실험에서 fluoxetine은 위 평활근세포에 존재
하는 전압의존성 K+ 이온통로와 Ca2+ 의존성 K+ 이 온통로에 모두 억제적으로 작용하고 또한 고농도시 세포 내 Ca2+ 이온을 유리시킴으로써 근수축을 일으 킬 것으로 추측되나 본 실험에서는 fluoxetine은 KCl 에 의한 근수축에 아무런 영향을 미치지 못했다. 이 는 본 실험에서는 관찰하지는 않았지만 위 평활근에 존재하는 전압의존성 L-type Ca2+ 이온통로가 fluoxetine에 의해 억제되어 일어날 것으로 추측되며, 위 평활근에 존재하는 전압의존성 L-type Ca2+ 이온 통로에 대한 fluoxetine의 작용에 대한 연구는 앞으 로 더 추구해야 할 과제이다.
임상적으로 우울증 치료시 fluoxetine의 경구 투여 에 의한 혈중 농도는 약 1 μM18,19로서 본 실험의 전 압의존성 K+ 전류에 대한 IC50 (5.5 μM)와 유사하 다. 그러므로 fluoxetine이 치료시 혈중 농도의 범위 안에서 위 평활근에 존재하는 K+ 이온통로 억제제 로서 작용하며, 특히 경구 투여 후 위장관 내에서 국 소적으로 농도가 증가할 수 있다. 이러한 사실은 fluoxetine 투여 후 발생하는 위장관질환 즉 구토 및 설사의 기전을 이해하는 데 매우 중요한 약리학적 의의를 가질 것이다.
요 약
목적: 분리한 고양이 위 평활근에 존재하는 전압 의존성 K+ 이온통로와 Ca2+ 의존성 K+ 이온통로에 대한 fluoxetine의 영향을 관찰하고자 하였다. 또한 fluorescent dye Fura-2 AM을 사용하여 세포 내 Ca2+
농도의 변화를 관찰하였으며, 근절편을 사용하여 근 수축에 미치는 영향을 관찰하였다. 대상 및 방법:
Patch clamp techniques 중 whole-cell recording 및 excised inside-out 방법을 사용하였다. 세포 내 Ca2+
농도의 측정은 dual wavelength ratio technique을 사 용하였으며 등장성 근수축곡선을 기록하였다. 결과:
whole-cell recording에서 fluoxetine은 고양이 위 평 활근에 존재하는 전압의존성 K+ 이온통로에 dual action을 나타내었다. 즉 낮은 농도(3-30 μM)에서는 농도의존적으로 K+ 전류를 억제하였으며 IC50은 5.5 μM이었다. 전압-전류곡선상 fluoxetine은 이 전류가 활성화되는 모든 전압 범위에서 억제하였다. 반대로
152 대한소화기학회지 : 제 35 권 제 2 호 2000
고농도 즉 100 μM fluoxetine시 K+ 전류는 오히려 약간 증가하는 경향을 나타내었다. 또한 100 μM을 세포에 처치시 세포 내 Ca2+ 농도는 증가하였다.
Excised inside-out patch recording시 10 μM fluoxe- tine 처치에 의해 Ca2+ 의존성 K+ 이온통로의 unitary conductance에는 변화가 없었으나 open state의 noise 를 증가시켰다(flicker block). 그러나 fluoxetine은 KCl에 의한 근수축에는 아무런 영향을 미치지 못했 다. 결론: fluoxetine은 분리한 고양이 위 평활근에 존재하는 전압의존성 K+ 이온통로에 억제적으로 작 용하고 Ca2+ 의존성 K+ 이온통로의 open state를 차 단하는 작용을 나타낸다.
색인단어: Fluoxetine, 전압의존성 K+ 이온통로, Ca2+ 의존성 K+ 이온통로, 평활근, 고양 이 위
감사의 글
본 연구는 1997년도 교육부 학술조성비(기초의 학: G-015712)에 의하여 시행되었음.
참 고 문 헌
1. Hille B. Ionic channels of excitable membrane. 2nd ed. Sunderland: Sinauer Associ Inc, 1992.
2. Singer JJ, Walsh Jr JV. Characterization of calcium activated potassium channels in single smooth mus cle cells using the patch-clamp technique. Pflügers Arch 1987;408:98-111.
3. Carl A, Sanders KM. Ca2+-activated K channels o canine colonic myocytes. Am J Physiol 1989;257 C470-C480.
4. Carl A, Bayguinov O, Shuttleworth CWR, Ward SM, Sanders KM. Role of Ca2+-activated K+ chan nels in electrical activity of longitudinal and circula muscle layers of canine colon. Am J Physio 1995;268:C619-C627.
5. Stark P, Fuller RW, Wong DT. The pharmacologica profile of fluoxetine. J Clin Psychiat 1985;46:7-13.
6. Fuller RW, Wong DT. Serotonin uptake and sero
tonin uptake inhibition. Ann NY Acad Sci 1990;600 68-78.
7. Farrugia G. Modulation of ionic currents in isolated canine and human jejunal circular smooth muscle cells by fluoxetine. Gastroenterology 1996;110:1438- 1445.
8. Hahn SJ, Choi JS, Rhie DJ, Oh CS, Jo YH, Kim MS. Inhibition by fluoxetine of voltage-activated ion channels in rat PC12 cells. Eur J Pharmaco 1999;367:113-118.
9. Garcia-Colunga J, Awad JN, Miledi R. Blockade o muscle and neuronal nicotinic acetylcholine recep tors by fluoxetine (Prozac). Proc Natl Acad Sc (USA) 1997;94:2041-2044.
10. Tytgat J, Maertens Ch, Daenens P. Effect of fluoxe tine on a neuronal, voltage-dependent potassium channel (Kv1.1). Br J Pharmacol 1997;122:1417- 1424.
11. Choi JS, Hahn SJ, Rhie DJ, Yoon SH, Jo YH, Kim MS. Mechanim of fluoxetine block of cloned voltage-activated potassium channel, Kv1.3. J Pharmacol Exp Ther 1999;29:1-6.
12. Messiha FS. Fluoxetine: Adverse effects and drug- drug interactions. Clin Toxicol 1993;31:603-630.
13. Mayer EA, Elashoff J, Walsh JH. Characterization of bombesin effects on canine gastric muscle. Am Physiol 1982;243:G141-G147.
14. Hamill OP, Marty A, Neher E, Sakmann B Sigworth FJ. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Arch 1981;
391:85-100.
15. Pancrazio JJ, Kamatchi GL, Roscoe AK, Lynch II C. Inhibition of neuronal Na+ channels by antide pressant drugs. J Pharmacol Exp Ther 1998;284:208 214.
16. Maertens C, Wei L, Voets T, Droogmans G, Niliu B. Block by fluoxetine of volume-regulated anion channels. Br J Pharmacol 1999;126:508-514.
17. Rae JL, Rich A, Zamudio AC, Candia OA. Effect o Prozac on whole cell ionic currents in lens and corneal epithelia. Am J Physiol 1995;269:C250-
최진성 외 8인. 고양이 위 평활근에서 Potassium Channels의 Fluoxetine에 의한 조절작용 153
C256.
18. Karson CN, Newton JEO, Livingston R, et al Human brain fluoxetine concentrations. J Neuropsy chiat Clin Neurosci 1993;5:322-329.
19. Altamura AC, Moro AR, Percudani M. Clinica pharmacokinetics of fluoxetine. Clin Pharmacokinet 1994;26:201-214.