81
복강경 보조 원위부 위 절제술의 초기 경험
한림대학교 의과대학 춘천성심병원 외과학교실, 1내과학교실, 2병리과학교실
이진원ㆍ김해성ㆍ류병윤ㆍ김홍기ㆍ이정훈ㆍ김한준ㆍ전장용ㆍ김진봉1ㆍ최영희2
Early Clinical Experience with Laparoscopy-assisted Distal Gastrectomy for Early Gastric Cancer
Jin Won Lee, M.D., Hae Sung Kim, M.D., Byoung Yoon Ryu, M.D., Hong Ki Kim, M.D., Jung Hun Lee, M.D., Han Joon Kim, M.D., Jang Yeong Jeon, M.D., Jin Bong Kim, M.D.1, Young Hee Choi, M.D.2
Departments of Surgery, 1Internal Medicine and 2Pathology, Chunchon Sacred Heart Hospital, Hallym University College of Medicine, Chuncheon, Korea
Purpose: For early gastric cancer, even though there are plenty of advantages for using a laparoscope in surgery, it is hard to perform laparoscopic gastrectomy unless surgeons are quite skilled at it. We have experienced more than 400 laparoscopic surgeries such as laparoscopic cholecystectomy, laparoscopic biopsy and laparoscopic splenectomy before the introduction of laparoscopy-assisted distal gastrectomy (LADG).
We analyzed the clinical results for our early experiences with 27 patients who underwent LADG by a surgeon who had much experience with open gastrectomy and laparoscopic cholecy- stectomy.
Methods: We analyzed 27 cases of early gastric cancer that were diagnosed through preoperative evaluation from July 2006 to July 2008. All of the cases were performed by one surgeon. We performed Billroth anastomosis and D1+β lymph node dissection for all the cases. We also compared our results of surgery with the other previous reports.
Results: The mean age was 61.9±11.5 year-old (range: 37
∼81); 19 of the patients were men and 8 were women. The Body Mass Index (BMI, kg/m2) was 24.5±3.2 (range: 18∼35);
there were 14 overweight peoples over 25 and 13 normal people below the age of 25. 24 cases were diagnosed as early gastric cancer and 3 cases were diagnosed as advanced gastric cancer. We experienced no conversion to open gastrectomy.
The length of the operation time was 177±22 minutes. There were 5 complications after surgery: 2 cases of anastomosis site bleeding, one case of colon perforation, one case of postoperative paralytic ileus and one case of delayed gastric emptying.
Conclusion: If we have experienced with other laparoscopic surgeries before starting LADG, we can overcome difficulties of LADG more easily.
Key words: Laparoscopy, Gastrectomy, EGC 중심단어: 복강경, 위 절제술, 조기위암
※ 통신저자:류병윤, 강원도 춘천시 교동 153번지 우편번호:200-704
한림대학교 춘천성심병원 외과 Tel:033-252-9970, Fax:033-243-6413 E-mail:byryu@hallym.or.kr
서 론
조기 위암에서 복강경을 이용한 수술은 1994년 일본의 Kitano 등1이 처음으로 도입한 이후 기존의 개복술 보다 여 러 가지 장점이 증명되면서 빠르게 확산되고 있는 추세이 다. 내시경 초음파의 발달과 건강검진에서 위 내시경의 활 성화로 조기 위암의 진단이 매년 늘어나고 있어 복강경을 이용한 위 절제술의 역할은 환자의 삶의 질 등에 많은 영향 을 미칠 것으로 생각된다. 그러나 개복술에 비해 배우기가 어려우며, 시간이 많이 소요되고, 종양학적으로 안정성에 대한 논란이 있어 개복술을 주로 시행하던 외과 의사가 쉽
게 복강경을 도입하기에는 어려움이 있다. 2004년 대한 위 암 학회의 보고에 의하면 복강경을 이용한 위암의 절제술 이 2002년부터 2004년까지 매년 2배씩 증가하여 2004년에 는 전국적으로 760예 이상이 시행되었다고 한다.2
저자들도 2005년부터 복강경 위 절제술을 도입하였으나 양성 질환의 쐐기 절제술에 국한되었고 2006년 7월부터 2008년 7월까지 27예의 조기위암에서 복강경 보조 원위부 위 절제술을 시행하였다. 1명의 술자가 2명의 조수와 한 팀 이 되어 개복 위 절제술을 300예 이상, 복강경 담낭 절제술 은 600예 이상 시술한 경험이 있다. 저자들은 제한된 환자 수지만 개복 위 절제술과 복강경 담낭 절제술의 경험이 풍 부한 술자에게 시행된 27명의 초기 경험을 통해 임상적 결 과를 후향적으로 분석하고자 한다.
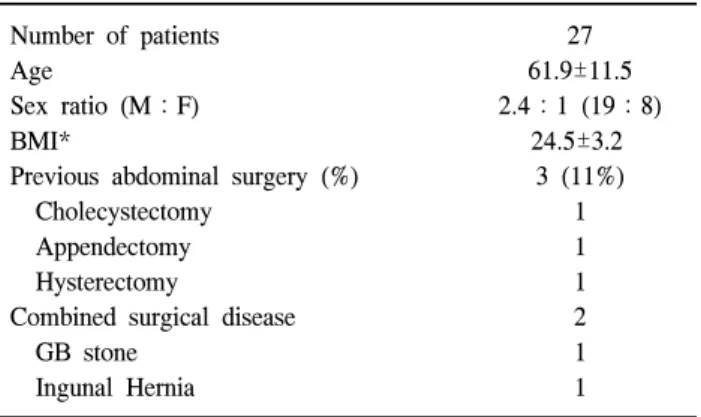
Table 1. Characteristics of clinical feature Number of patients
Age
Sex ratio (M:F) BMI*
Previous abdominal surgery (%) Cholecystectomy
Appendectomy Hysterectomy
Combined surgical disease GB stone
Ingunal Hernia
27 61.9±11.5 2.4:1 (19:8)
24.5±3.2 3 (11%)
1 1 1 2 1 1
*BMI = body mass index (kg/m2).
대상 및 방법 1) 대상
2006년 7월부터 2008년 7월까지 한림대학교 의과대학 외 과학교실 춘천성심병원에서 조기위암으로 진단되어 복강 경 보조 원위부 위 절제술을 시행한 27명의 환자를 대상으 로 후향적으로 분석하였다. 모든 환자는 한 명의 술자에 의 해 수술이 시행되었다. 수술 전에 위내시경과 조직 검사, 전 산화 단층 촬영, 내시경 초음파를 통해 점막층과 점막하층 에 국한되며 림프절 전이의 소견이 없는 조기 위암으로 진 단된 환자들이었으며 내시경 절제가 가능한 환자는 제외하 였다. 절제연 확보를 위해 병변의 위치 파악이 어려울 것을 생각되는 환자들은 술 전 내시경을 이용하여 hemoclip 4개 를 부착하였다.
2) 수술 팀
수술 팀은 1명의 술자와 1명의 제1조수 그리고 2명의 카 메라 조수로 구성되었다. 술자는 개복 위 절제술의 경험이 300예 이상 있었고, 복강경 담낭 절제술도 600예 이상의 경 험이 있었다. 제1조수는 1명으로 10예 이상의 위 절제술과 50예 이상의 복강경 담낭 절제술을 시행한 경험이 있었으며, 카메라 조수는 2명의 전문 간호사로 본원 외과학 교실에서 시행되는 모든 복강경 수술의 카메라 조수를 담당하고 있다.
3) 수술 방법
환자는 앙와위로 하였다. 환자의 왼쪽에 술자와 카메라 조수가 위치하였고, 오른쪽에 제1조수와 간호사가 위치하 였다. 술자는 십이지장 박리가 끝나면 환자의 우측으로 자 리를 옮겨 십이지장 절단하고 수술을 마칠 때까지 환자의 오른쪽에 위치하였다. 투관침은 모든 환자에서 5개가 사용 되었다. 배꼽하부에 Veress needle을 이용하거나 Hasson’s procedure로 이산화탄소로 기복을 만든 후 12 mm 투관침을 위치시키고 이곳을 통해 카메라를 삽입하여 복강내를 관찰 하였다. 좌상복부와 좌하복부, 우상복부와 우하복부의 투관 침은 복직근 외측에 5∼12 mm의 크기를 위치시켰다. 이산 화탄소를 이용한 기복압은 12∼15 mmHg였고, 30o 경사의 복강경을 이용하였다. 혈관의 결찰은 복강경용 클립(Endo ClipⓇ, Tyco Health Care, Norwalk, USA)을 이용하였다.
수술은 먼저 지혈 기구인 Harmonic scalpelⓇ (Ethicon- Endo surgery, Cincinnati, USA)을 이용하여 환자의 좌측에 술자가 위치하여 위대망 혈관으로부터 4 cm 떨어진 대망의 중간 부위에서 시작하여 십이지장 쪽으로 대망을 절제하였 다. 우위 대망 동정맥을 클립으로 결찰 한 후 절단하고 우위 동맥을 기시부에서 결찰 후 절단하였다. 십이지장이 박리 되면 술자와 제1조수가 위치를 바꾸어 유문하부 1 cm에서 복강경용 선형 자동 봉합기(Endo GIA60Ⓡ, Tyco Health
Care, Norwalk, USA)를 이용하여 십이지장을 절단하였다.
이후 림프절 8a, 9를 박리하고 좌위 동정맥을 결찰 후 절단 하였다. 위의 적출이 가능하면 검상돌기 직하방에 4∼6 cm 의 소절개창을 만들어 십이지장 절단 부위를 보강 봉합하 고 위를 꺼내어 Billroth II의 방법으로 위공장 문합술을 하 였다. 문합부 하방 30∼40 cm의 공장과 근위부 공장을 선형 자동 봉합기(GIA60Ⓡ, Tyco Health Care, Norwalk, USA)를 이 용하여 문합한 후 상복부의 소절개창 봉합이 끝나면 다시 기복을 만들어 지혈을 확인하고 개방형 배액관을 십이지장 맹단에 거치한 후 수술을 마쳤다. 림프절은 모두 D1+β (7, 8a, 9)를 시행하였고 초기 7예는 조직의 림프절 박리를 병리 과에서 하였으나 이후에는 수술 직후 외과에서 림프절을 박리하였다.
4) 통계 방법
비만도에 따른 남녀 성비와 수술 시간의 차이는 DBSTAT version 4.1 (DBSTAT Co., Chunchon, Korea)를 이용하여 chi-square test와 Student t-test를 사용하였으며, 평균±표준편 차로 표시하였다. p 값이 0.05 이하인 경우에 유의한 차이가 있다고 해석하였다.
결 과 1) 임상적 특성
전체 환자는 27명으로 연령은 61.9±11.5세였고 70세 이상 의 고령이 8명(29%) 있었다. 성별은 남자가 19명, 여자가 8 명으로 남자가 2배 이상 많았다. 체질량지수(Body Mass Index; BMI, kg/m2)는 24.5±3.2 kg/m2였다. 과거 복부 수술을 받았던 환자는 3명으로 담낭절제술이 1명, 충수절제술이 1 명, 산부인과적 수술이 1명 있었다. 이들은 장관 유착이 있 었지만 개복술로 전환된 경우는 없었다. 다른 외과적 질환 이 동반된 경우가 2예로 서혜부 탈장이 1예, 담석증이 1예 가 있어 모두 동시에 수술을 시행하였다(Table 1).
Table 2. Operative outcome Operation time (minute)
Number of dissected lymph node Open conversion
Postoperation hemoglobin (mg/dl) Immediate
After 24 hours After 72 hours First flatus (day) First sip of water (day) First soft diet (day)
172±22 12.8±1.7
0 12.8±1.7 (9∼16) 12.4±1.5 (10∼15) 12.4±1.1 (11∼15)
3.0±1.1 (2∼6) 4±1.0 (3∼7)
5.3±1.0 (4∼8) Table 5. Pathologic finding Early gastric cancer Advanced gastric cancer Tumor size (cm) Resection margin Proximal (cm) Distal (cm) Depth of invasion Mucosa Submucosa Propria muscle Serosa
Lymph node metastasis
24 (88.9%) 3 (11.1%) 1.5±0.7 3.2±0.43 6.3±0.38
9 15 3 0 0 Table 4. Postoperative complication
Number of patient (%) Total
Colon perforation Anastomosis bleeding Paralytic ileus
Delayed gastric emptying
5 (18.5) 1 2 1 1
Table 3. Operation time according to body mass index (BMI, kg/m2)
BMI<25 BMI≥25 p
Age
Sex (male:female) Operation time (minute)
61.9±13.3 11:2 170.0±15.8
61.9±9.9 8:6 173.5±27.5
0.999 0.118 0.693
2) 수술 결과
개복술로 전환된 예는 없었고, 수술 시간은 172±22분(130
∼310분)이었다. 모두 Billroth II 위공장 문합술이 시행되었 고, 림프절 절제는 D1+β를 하였다. 초기 첫 수술은 310분 이었고 이후 7번째 수술까지 평균 205분의 수술시간이 소 요되었다(Table 2). BMI에 따른 수술 시간은 정상 체중군에 서 170.0±15.8분, 비만군에서 173.5±27.5분으로 차이가 없었 다. 적출된 림프절의 수는 17±8개(3∼31)였다(Table 3). 수술 후 혈색소는 12.8±1.7 (mg/dl)이었고 수혈이 필요했던 환자 는 2명이었다. 이들 2명은 모두 문합부 출혈로 각각 9 pint와 2 pint의 수혈을 받았으나 재수술은 하지 않았다. 9 pint의 수혈을 하였던 예는 복강경 위절제술을 처음 시행하였던 환자로 혈색소의 변화가 심하지 않아 지속적인 수혈을 하 여 치료하였다. 수술 후 첫 가스 배출 기간은 3.0±1.1일이었 다. 처음으로 물을 섭취한 시기는 4±1.0일이었고, 연식을 시 작한 시기는 5.3±1.0일이었다. 수술 후 평균 재원일은 10.3±2.7일이었다(Table 2). 수술 후 합병증은 5예에서 발생 하였다. 대장 천공이 1예, 문합부 출혈이 2예, 수술 후 장 마비가 1예, 위 지연 배출 1예였다(Table 4). 대장 천공의 예 는 수술 다음날 복막염의 증상과 백혈구 증가가 있어 재수 술을 하였고 일차 봉합술 후에 회복되어 수술 후 19일째 퇴 원하였다.
3) 병리 조직 검사 결과
조기 위암이 24예였고 진행 위암이 3예였다. 병변의 침습 정도는 점막층에 국한된 경우가 9예, 점막하층까지 침범한 경우가 15예였다. 진행 위암은 3예 모두 고유 근층까지 침
범하였다. 종양의 크기는 1.5±0.7 cm이었다. 근위부 절제연 은 3.2±2.7 cm이었고 원위부 절제연은 6.3±3.8 cm이었다. 림 프절 전이는 없었다(Table 5).
고 찰
위암은 우리나라에서 가장 높은 빈도와 사망률을 차지하 고 있지만, 위 내시경 등의 건강검진의 활성화로 조기 위암 의 발견이 증가하고 있다.2 조기위암은 위 절제술만으로 5 년 생존율이 90%를 넘을 정도로 수술 효과가 좋아 수술 후 삶의 질에 대한 관심이 높아지기 시작하였다.3 여러 연구에 서 복강경을 이용한 위 절제술이 개복 위 절제술에 비해 통증이 적고, 수술 후 회복이 빠르며, 빠른 식이의 시작과 짧은 재원일, 미용상의 우수성 등 많은 장점들이 있다고 주 장하고 있다.3-6 그러나 이러한 많은 장점에도 불구하고 조 기 위암의 복강경 위 절제술은 무작위 전향적 연구가 부족 하며, 술 전 원발 병소의 침습을 정확히 검사하기 어렵고, 림프절 절제의 범위가 확립되어 있지 않아 논란이 될 수 있어, 앞으로 많은 연구가 필요할 것으로 생각된다.4 복강경 보조 원위부 위 절제술은 복강경 기구에 대해 외과의사가 어느 정도 숙련되지 않으면 시도하기 어렵고, 술기의 학습 곡선을 극복하는데 시간이 오래 걸려 쉽게 도입하기는 어 렵다. 학습 곡선에 대한 연구는 많지 않지만 Choi 등7은 약 7년 동안 202예를 대상으로 한 보고에서 60번째부터 수술
시간이 급격히 감소하였고 63번째를 학습 곡선을 극복한 시점이라 하여 복강경에 익숙하지 않은 외과의사가 적응하 는데 많은 경험이 필요함을 보고하였다. Kim 등8은 62예의 조기 위암을 1년 동안 집중적으로 복강경 보조 원위부 위 절제술을 시행하였는데, 30예부터 학습 곡선이 극복되었다 고 하였다.
수술 시간의 비교는 위의 재건술 방법, 림프절 절제의 범 위에 따라 차이가 나겠지만 Choi 등7은 초기 62예의 수술에 서 Billroth I 술식을 55예, Billoth II 술식을 7예에서 시행하 였는데 수술 시간은 250±41.7분이었고, 학습 곡선을 극복한 후기 140예에서 Billroth I 술식 127예, Billroth II 술식 13예 를 시행하였는데 수술 시간은 156±31.5분으로 보고하였다.
Kim 등8은 초기 30예 중 24예에서 Billroth I 술식을, 6예에서 Roux-Y 위공장 문합술을 시행하였고 림프절 절제는 D1+β 까지 하였는데, 수술 시간은 239±69.7분이었고, 후기 32예 에서는 Billroth I이 30예, Roux-Y 위공장 문합술이 2예에서 시행되었고 수술 시간은 170±32.6분이었다. Son 등9은 주로 Billroth I을 시행한 202예에서 림프절 절제 범위에 따라 수 술 시간을 분류하였다. 이들은 2예에서 시행된 D1+α는 343±88분, 37예의 D1+β는 239±81분, 163예의 D2는 203±51분의 수술 시간을 보고하였는데, 림프절 절제의 범 위가 늘어감에도 수술 시간이 짧아지는 것은 학습 곡선 극 복에 따른 술기의 발전에 의한 것으로 생각된다. Lim 등10은 Billroth II를 시행하였고 D2 림프절을 박리하였는데, 수술 시간은 302.3±59.9분으로 보고하였다. 저자들의 경우 모두 Billroth II 술식을 하였고 림프절은 D1+β를 시행하였다. 수 술 시간은 172±22분으로 단순한 비교는 어렵지만 다른 보 고보다 수술 시간이 짧았다. 이는 술자를 비롯한 전문 수술 팀이 복강경 보조 위 절제술을 도입하기 이전 복강경을 이 용한 다른 여러 수술을 접하였기 때문에 가능하였다고 생 각된다. Kim 등8도 체계적인 시스템의 조기 정착 역시 초기 복강경 위 절제술을 보다 빠르게 적응하게 되는 요인 중의 하나로 보고하였다.
위암 수술의 경우 환자의 비만은 림프절 절제시 많은 기 술적인 어려움을 야기하며 출혈을 증가시키고 이로 인해 수술 시간이 연장된다. 또한 비만은 학습곡선을 극복한 술 자에게 있어 수술 시간을 연장시키는 중요한 요인으로 보 고되었다.11 Noshiro 등12은 복강경 보조 원위부 위 절제술을 시행한 환자에서 BMI 24.2를 기준으로 하여 수술 시간은 정상 체중군에서 317±58분, 비만군에서 370±61분으로 비만 군에서 수술 시간이 유의하게 증가하였음을 보고하였다 (p=0.015). Kim 등8도 학습곡선을 극복한 시점에서 BMI 25를 기준으로 하여 정상 체중군에서 수술 시간은 191.6±29.3분, 비만군에서 수술 시간은 160.2±29.5분으로 유의하게 증가 하였다고 보고하였다(p=0.009). 그러나 Choi 등13은 BMI 23 을 기준으로 수술 시간은 정상 체중군에서 244.8±35.5분, 과 체중군에서 260.2±52.3분으로 과체중군에서 15분 정도 길
게 나타났으나 통계적인 유의성은 없었다고 보고하였다 (p=0.089). 저자들의 경우도 BMI 25를 기준으로 정상 체중 군에서 수술 시간은 170.0±15.8분, 비만군에서의 수술 시간 은 173.5±27.5분으로 유의한 차이가 없었다(p=0.693). 일반 적으로 남자는 내장 비만이 많고, 여자는 복벽 비만이 많은 데, 비만도가 수술 시간에 미치는 영향이 다르게 보고되는 원인은 각 연구마다 이러한 비만의 양상이 다른 남녀 구성 비의 차이 때문으로 생각된다. Noshiro 등12의 연구에서 남 녀의 구성비는 18:1이었고, Kim 등8의 연구에서는 남녀 비 가 20:12로 남자가 많았던 반면 Choi 등13의 연구에서는 남녀 비가 29:23으로 여성의 비율이 상대적으로 많았다.
저자들의 경우는 통계적인 유의성은 없었지만 정상 체중군 에서 남녀 비가 11:2였고, 비만군에서 남녀 비가 8:6으로 정상 체중군보다 비만군에서 여성의 비가 상대적으로 높아 두 군 사이의 수술 시간의 차이가 없었던 것으로 생각된다.
조기 위암의 림프절 전이는 매우 드물다는 것이 여러 연 구자들에 의해 보고되었지만, 림프절 절제의 범위는 아직 까지 논란이 많다.14-18 조기 위암에서 점막층을 침범한 경우 림프절 전이의 빈도는 약 2% (0∼4.8%)로 매우 낮고 대부분 의 경우 제1군 영역 림프절에 국한된다. 점막하층에 침윤한 경우에는 림프절 전이의 빈도가 약 20% (15∼25%)로 대부 분 제1군 영역 림프절에 국한되지만 크기가 2 cm보다 큰 경우 약 5%에서 제2군 영역 림프절까지 침범한다. 그러나 주로 7, 8a, 9번 림프절에 국한되는 것으로 보고되고 있
다.8,19-22 일본의 위암 진료 지침에서는 조기 위암의 림프절
절제 범위를 1.5 cm보다 큰 경우 D1+β를 권장하고 있고 1군 림프절 전이가 의심되고 크기가 2 cm 이상의 점막하층 암은 D2 수술을 권장하고 있다.23 수술 전 시행하는 내시경 초음파 검사의 정확도는 아직 기대하는 수준에 미치지 못 하고, 시행하는 술자에 따라 정확도의 차이가 있어 D2 림프 절 절제의 필요성을 주장한 보고도 있다.24,25 본 연구에서도 술 전 위내시경, 내시경 초음파, 컴퓨터 전산화 단층 촬영 등을 이용하여 조기 위암만을 수술 대상에 포함하였으나 병리 조직 검사에서 진행성 위암이 3예(11%) 있었다. 저자 들은 림프절 절제를 모두 D1+β 범위까지 하였고 17±8개 의 림프절을 박리하여, 평균 20∼30개의 림프절 절제를 보 고한 국내 다른 연구자들과 차이가 있었다.7-11 본 연구에서 는 초기 7예를 병리과에서 포르말린에 고정된 림프절을 박 리하여 평균 7개 정도의 림프절이 박리되었으나 이 후 조직 이 체외로 나온 직 후 외과에서 림프절을 박리하기 시작하 면서 림프절의 수가 평균 18개로 증가하였다.
수술 전 혈색소와 비교하여 2 mg/dl 이상 감소를 보였던 환자는 9명(33.3%)으로 이 중 2명(7.4%)의 환자는 비위관으 로 지속적인 출혈이 발견되어 수혈을 하였으나 다른 환자 들은 수술 후 24시간, 48시간에 검사한 혈색소가 유지되었 다. 여러 문헌에서도 수술 후 2.5∼16%에서8,9,26,27 수혈을 하 여 저자들과 차이가 없었다. 복강경 보조 원위부 위 절제술
후 합병증 발생률은 재건술식과, 림프절 절제범위, 술자의 숙련도, 환자의 구성 등에 따라 연구자 마다 다르겠지만 4.9
∼22.1%로 보고되고 있다.10-13,18,22,23
본 연구에서의 합병증 발생률은 18.5%로 다른 보고에 비해 높지 않았다. 처음 수 술을 하였던 예에서 대망을 박리하면서 대장이 손상되어 다음날 대장 천공에 의한 복막염 증상으로 재수술을 시행 하였다. 횡행 대장이 5 mm정도 천공되어 있었고 일차 봉합 술을 시행하였다.
외과의가 복강경 위 절제술을 처음 시작하는 데 있어 가 장 큰 어려움은 복강경 기구에 익숙하기까지 많은 시간이 걸린다는 점이다. 이로 인해 개복 위 절제술의 경험이 많은 외과의들도 학습곡선을 극복하기 위하여 많은 연구와 노력 을 기울이고 있다. 현재 전문화된 병원에서는 숙련된 경험 자에게 단기간에 많은 수의 환자를 접함으로써 학습곡선을 줄일 수 있다고 보고하지만,8 그러한 환경이 대부분의 복강 경 위 절제술을 시도하려는 외과의에게 해당하지는 않을 것이다
결 론
본 연구에서 저자들은 복강경 위 절제술을 도입하기 이 전 복강경을 이용한 조직 생검, 충수 절제술, 담낭 절제술, 비장 절제술 등을 시행하여 복강경 기구에 대해 숙달되어 있었고, 4인이 한 팀이 되어 복강경 수술에 대한 전문성을 갖추었다. 비록 제한된 수의 연구지만 복강경 위 절제술을 도입하기 전 전문팀을 구성하여 난이도가 어렵지 않은 다 른 복강경 수술을 많이 접한다면 복강경 위 절제술에 대한 어려움을 보다 수월하게 극복할 수 있을 것으로 생각한다.
참고문헌
1) Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy- assisted Billroth I gastrectomy. Surg Laparosc Endosc 1994;4:146-148.
2) Korean Gastric Cancer Association. Nationwide gastric cancer report in Korea. J Korean Gastric Cancer Assoc 2002;2:105-114.
3) Adachi Y, Shiraishi N, Shiromizu A, Bandoh T, Aramaki M, Kitano S. Laparoscopy-assisted Billoth I gastrectomy com- pared with conventional open gastrectomy. Arch Surg 2000;
135:806-810.
4) Azagra JS, Goergen M, De Simone P, Ibañez-Aguirre J.
Minimally invasive surgery for gastric cancer. Surg Endosc 1999;13:351-357.
5) Reyes CD, Weber KJ, Gagner M, Divino CM. Laparoscopic vs open gastrectomy. A retrospective review. Surg Endosc 2001;15:928-931.
6) Tanimura S, Higashino M, Fukunaga Y, Osugi H. Laparo- scopic distal gastrectomy with regional lymph node dissection
for gastric cancer. Surg Endosc 2003;17:758-762.
7) Choi YS, Park DJ, Lee HJ, et al. Time required to overcome the laparoscopic assisted distal gastrectomy learning curve in early gastric cancer in terms of operative and clinical parameters. J Korean Surg Soc 2006;70:370-374.
8) Kim JH, Jung YS, Kim BS, et al. Learning curve of a laparoscopy assisted distal gastrectomy for a surgeon expert in performing a conventional open gastrectomy. J Korean Gastric Cancer Assoc 2006;6:167-172.
9) Son TI, Kim SS, Choi WH, et al. Laparoscopy assisted distal subtotal gastrectomy with lymphadenectomy - 202 consecutive Cases. J Korean Surg Soc 2006;71:413-419.
10) Lim JT, Kim BS, Cheong O, et al. Comparative analysis of laparoscopy-assisted gastrectomy versus open gastrectomy. J Korean Gastric Cancer Assoc 2007;7:1-8.
11) Hyung WJ, Song C, Cheong JH, Choi SH, Noh SH. Factors influencing operation time of laparoscopy-assisted distal subtotal gastrectomy: analysis of consecutive 100 initial cases.
Eur J Surg Oncol 2007;33:314-319.
12) Noshiro H, Shimizu S, Nagai E, Ohuchida K, Tanaka M.
Laparoscopy-assisted distal gastrectomy for early gastric cancer: is it beneficial for patients of heavier weight? Ann Surg 2003;238:680-685.
13) Choi SM, Kim MC, Lee JH, et al. The effects of obesity for laparoscopy-assisted distal gastrectomy in patient with early gastric cancer. J Korean Surg Soc 2005;69:31-35.
14) Kitamura K, Yamaguchi T, Taniguchi H, Hagiwara A, Sawai K, Takahashi T. Analysis of lymph node metastasis in early gastric cancer: rationale of limited surgery. J Surg Oncol 1997;64:42-47.
15) Kunisaki C, Shimada H, Nomura M, Akiyama H. Appropriate lymph node dissection for early gastric cancer based on lymph node metastases. Surgery 2001;129:153-157.
16) Tsujitani S, Oka S, Saito H, et al. Less invasive surgery for early gastric cancer based on the low probability of lymph node metastasis. Surgery 1999;125:148-154.
17) Shimada S, Yagi Y, Shiomori K, et al. Characterization of early gastric cancer and proposal of the optimal therapeutic strategy. Surgery 2001;129:714-719.
18) Mochiki E, Kamiyama Y, Aihara R, Nakabayashi T, Asao T, Kuwano H. Laparoscopic assisted distal gastrectomy for early gastric cancer: Five years' experience. Surgery 2005;137:317-322.
19) Shiraishi N, Yasuda K, Kitano S. Laparoscopic gastrectomy with lymph node dissection for gastric cancer. Gastric Cancer 2006;9:167-176.
20) Adachi Y, Shiraishi N, Kitano S. Modern treatment of early gastric cancer: review of the Japanese experience. Dig Surg 2002;19:333-339.
21) Sano T, Sasako M, Kinoshita T, Maruyama K. Recurrence of early gastric cancer. Follow-up of 1475 patients and review of the Japanese literature. Cancer 1993;72:3174-3178.
22) Kurihara N, Kubota T, Otani Y, et al. Lymph node metastasis
of early gastric cancer with submucosal invasion. Br J Surg 1998;85:835-839.
23) Nakajima T. Gastric cancer treatment guidelines in Japan.
Gastric Cancer 2002;5:1-5.
24) Okamura S, Tsutsui A, Muguruma N, et al. The utility and limitations of an ultrasonic miniprobe in the staging of gastric cancer. J Med Invest 1999;46:49-53.
25) Lee JH, Kim YW, Ryu KW, et al. A phase-II clinical trial of laparoscopy-assisted distal gastrectomy with D2 lymph node
dissection for gastric cancer patients. Ann Surg Oncol 2007;
14:3148-3153.
26) Kim SG, Song KY, Kim SN, Park CY. Alterations in hepatic function after laparoscopic assisted distal gastrectomy: A Prospective Study. J Korean Surg Soc 2007;72:46-50.
27) Kim MC, Lee SG, Jung IK, Jung GJ, Kim HH. Comparison of laparoscopy-assisted by conventional open distal gastrec- tomy and extraperigastric lymph node dissection in early gastric cancer. J Korean Surg Soc 2005;68:24-29.