Korean J Vet Res(2016) 56(1) : 29~35 http://dx.doi.org/10.14405/kjvr.2016.56.1.29
29
<원례보저>
방사선으로 인한 산화적 손상에서 phloroglucinol의 모낭 보호 효과
김아름1·빙소진2·조진희2·Herath KHINM2·전유진3·이병걸4·박재우5·지영흔1,2*
1제주대학교 차세대융복합과학기술협동과정, 2수의과대학 수의학과, 3해양과학대학 수산생명의학전공,
4해양과학대학 토목공학과, 5공과대학 에너지공학과
(접수: 2016년 1월 22일, 수정: 2016년 3월 13일, 게재승인: 2016년 3월 18일)
Protective effect of phloroglucinol against gamma radiation-induced oxidative stress in hair follicles
Areum Kim
1, So Jin Bing
2, Jinhee Cho
2, KHINM Herath
2, You-Jin Jeon
3, Byung-Gul Lee
4, Jae-Woo Park
5, Youngheun Jee
1,2*
Departments of 1Advanced Convergence Technology & Science, 2Veterinary Medicine, 3Marine Life Sciences,
4Civil and Enviromental Engineering, and 5Nuclear and Energy Engineering, Jeju National University, Jeju 64243, Korea
(Received: January 22, 2016; Revised: March 13, 2016; Accepted: March 18, 2016)
Abstract : When exposed to gamma-rays, hair follicular cells immediately go through apoptosis, which hampers their rapid differentiation essential for the regeneration of hair. Phloroglucinol (PG) is a phenolic compound of Ecklonia cava, brown algae abundant in Jeju island, Korea. Containing plentiful polyphenols, PG is known for its instructive effects by inhibiting apoptosis, scavenging oxygen radicals, and protecting cells against oxidative stress. In this study, we demonstrate that PG rescues radiosensitive hair follicular cells from gamma radiation-induced apoptosis and DNA damage. To identify protective capacity of PG on hair follicles, we irradiated with 8.5 Gy (1.5 Gy/min) of gamma- rays to the whole body of C57BL/6 mice at day 6 after depilation with or without PG. In mice exposed to radiation, the expression of proapoptotic molecule p53 was downregulated in the skin of PG treated group. On immunohistochemical observation of the skin, PG inhibited the immunoreactivity of p53 and cleaved caspase-3. PG treatment protected hair follicular cells from cell death due to gamma-radiation. Our results suggest that PG presents radioprotective effects by inhibiting apoptosis of radiosensitive hair follicular cells and can protect hair follicular cells from gamma-ray induced damage.
Keywords : gamma-ray, hair follicular cells, oxidative stress, phloroglucinol, radioprotection
서 론
폴리페놀(polyphenol)성 물질로 알려진 phloroglucinol (PG)은 감태(Ecklonia cava)에 포함된 eckol, dieckol과 함께 플로로탄닌(phlorotannin) 성분을 함유하여, 면역조절(immu- nomodulation) 및 면역 활성(immune activation) [1], 항산 화 효과(antioxidant activity) [2], 항염 효과(anti-inflamma- tory effect) [24] 등 다양한 생리활성을 나타낸다고 알려졌다.
또한 PG는 방사선으로 인하여 손상된 골수 내 조혈모세포와 비장세포 등 면역세포의 세포자멸사(apoptosis)를 억제한다고 보고되었으며 [20], 방사선으로 인하여 손상된 소장 내 성체
줄기세포의 세포자멸사 억제 및 재생에 효과가 있음이 보고 되었다 [11].
최근 방사선 및 방사성 동위원소는 의학, 농업과 공업 등 다양한 분야에서 널리 사용하고 있다. 그에 따라 관련 기관 및 인력이 증가하고 있으며 의학 분야에서는 질병의 진단뿐 만 아니라 치료에도 이용하고 있다. 양전자 단층촬영(positron emission tomography)과 같은 진단용 장비가 연구, 개발됨에 따라 이 분야에 관련된 사람들의 방사선 피폭의 기회가 증 가하였다. 또한 암 환자의 발생이 증가하면서 암 조직의 사 멸을 위하여 외과적 수술 및 화학적 항암치료와 더불어 방 사선을 이용한 항암치료도 증가하는 추세에 있다 [15]. 방사
*Corresponding author
Tel: +82-64-754-3374, Fax: +82-64-756-3354
E-mail: yhjee@jejunu.ac.kr
선을 이용한 항암치료 시에는 종양세포뿐만 아니라 그 주변 부의 정상 조직에도 영향을 끼쳐 문제가 되고 있다. 방사선 에 인체가 노출되면 이로 인한 직접적인 DNA 손상이 일어 나거나, 활성산소(reactive oxygen species)에 의한 간접적 세포 손상을 일으키는 것으로 알려졌다 [19]. 이러한 방사선 의 직간접적 영향은 인체조직 중에서도 특히 분열 및 증식 속도가 빠른 골수의 조혈모세포, 소장 및 모낭 성체줄기세포 (hair follicle stem cells)가 방사선에 민감하며 [22], DNA, RNA 및 단백질의 손상 정도에 따라 세포의 기능을 잃거나 세포자멸사가 일어난다 [19, 20].
방사선 치료 시 그 부작용으로 나타나는 피부 손상과 탈 모 현상은 가시적, 형태학적으로 뚜렷한 변화로 보고되었다.
특히 방사선에 의하여 손상된 피부는 조사된 선량에 따라 다 양한 반응이 나타나는데 탈모, 홍반, 수포, 궤양 등 일반적인 화상의 증상과 비슷하다고 알려졌다. 그러나 방사선으로 인 하여 손상된 피부에서 나타나는 궤양은 방사선 특이적으로 심한 통증과 그 부위에 암이 호발하는 증상을 동반한다. 따 라서 이러한 피부 손상과 탈모 현상은 방사선 치료를 받는 환자에게 극심한 통증과 심리적인 고통을 주기 때문에 방사 선에 의한 피부 손상을 줄일 수 있는 방사선 방어제를 국내 외에서 개발 중이다 [5].
대표적인 방사선 방어제로 알려진 thiol 복합체인 WR- 2721 [Amifostin; S-2-(3-aminopropoylamino) ethylphosphero- thiotic acid]은 중간 대사산물의 독성으로 인한 두통, 구토, 식욕부진, 발열 등의 부작용이 보고되었고 일부 장기에서 방 사선 방어 효과를 저해함이 밝혀졌다 [4]. 따라서 화합물이 아닌 천연물에서 방사선 방어 효능을 가지는 물질을 찾는 연 구가 활발히 진행 중이다 [5, 20]. 특히 알로에 아보레센스 (Aloe arborescens) [7], 알로에 베라(Aloe vera) [12], 카모 마일(Matericaria chamomilla) [17], 아몬드(Prunus amygdalus) [5]와 병풀(Centella asiatica) [6] 등은 방사선에 의해 손상 된 피부에서 피부 염증 반응에 대한 항염 효과(anti- inflammatory effect)가 보고되었으나, 방사선에 의한 직접적 손상에 대한 보호 효과에 관한 연구는 제한적이다. 따라서 본 연구를 통해 방사선으로 인하여 손상된 마우스 피부의 모 낭세포에 대한 PG의 방사선 방어 효과를 규명하고자 한다.
재료 및 방법
실험동물
실험동물은 6–7주령 C57BL/6 마우스(OrientBio, Korea)를 사용하였다. 실험동물은 표준 사육조건 온도 23 ± 1oC, 습도 50± 5%로 유지되는 환경에서 사료(LabDiet 5L79; Orient- Bio)와 음수는 자유롭게 섭취하도록 하였다. 실험군은 정상 대 조군(Non IR), 방사선 조사 대조군(IR), 및 시료 병행 처리군 (IR+PG)으로 나누어 실험하였다. 본 연구는 제주대학교 실험 동물윤리위원회에 동물실험 계획서를 제출하여 승인 받았으 며(동물실험 승인번호 2015-0028), 동물실험 및 관리는 제주 대학교 실험동물윤리위원회의 윤리적 기준에 따라 시행하였다.
시료와 처치
실험에 사용한 모든 마우스는 털의 동기화를 위하여 실험 시작 6일 전 일괄적으로 제모하였고, 6일간의 휴지기를 가지 며 안정화했다. PG(Sigma, USA)는 아세톤에 희석하여 방사 선 조사 17.8시간 전 제모한 마우스의 등 피부에 10 mg/
1.5 cm2의 용량으로 도포하였다.
방사선 조사
등 부위 털을 제모한 마우스에 대한 방사선 조사는 close- fitting perspex box(3 × 3 × 11 cm)를 이용하여 제주대학교 원자력과학기술연구소의 60Co 감마선 조사기(Theratron-780 teletherapy; C-188 9.9 TBq; Nordion, Canada)를 이용하여 100 cm의 거리에서 1.5 Gy/min의 선량률로 8.5 Gy를 1회 전 신 조사하였다.
Hematoxylin-eosin(H&E) 염색
8.5 Gy의 방사선 조사 후 8시간째 부검하였고, 이때 마우 스 모낭의 정중 단면을 얻기 위해 털의 방향을 고려하여 등 쪽 피부를 채취하였다. 조직 고정 과정에서 마우스 피부 조 직의 수축과 말림 현상을 최소화하기 위하여 마우스 등 쪽 피부를 넓게 펼쳐 침 핀을 이용하여 우드락에 부착한 후, 10% 중성 포르말린에 담가 고정하였다. 이후 통상적인 방법 에 따라 파라핀 블록을 제작하였다. 파라핀 블록을 3 μm로 박절하여 이를 슬라이드에 부착한 뒤, 탈파라핀화를 위하여 xylene에 3분씩 3단계를 거치고 100%, 95%, 90%, 80%, 70% ethanol에 단계적으로 3분씩 담가 함수시킨 후 흐르는 물에서 5분간 수세하여 알코올을 제거하였다. Mayer’s hematoxylin 용액을 이용하여 핵을 염색하였고 eosin 용액을 이용하여 세포질과 결합조직 등을 염색한 후 흐르는 물에서 3분간 수세하였다. 그 후 70%, 80%, 95%, 100% ethanol 에 단계적으로 3분씩 담근 후 xylene에 3분씩 3단계를 거쳐 탈수 및 투명화 과정을 거친 뒤 봉입하였다.
면역조직화학(Immunohistochemistry) 염색
파라핀 블록을 3 μm로 박절하여 이를 슬라이드에 부착한 뒤, 탈파라핀화를 위하여 xylene에 3분씩 3단계를 거치고 100%, 95%, 90%, 80%, 70% ethanol에 3분씩 담가 함수 시켰다. 그 후 항원성 부활화를 위하여 citrate 완충액(10 mM, pH 6.0)을 마이크로웨이브 오븐을 이용하여 예열하였다. 예 열된 citrate 완충액에 슬라이드를 담근 후 10분간 열처리를 하고 흐르는 물에서 5분간 수세하였다. 조직 내 내인성 peroxidase를 억제하기 위하여 30분간 0.3% 과산화수소 용액 에 담가 두었다. 또한, 비특이적 면역반응을 방지하기 위하 여 blocking goat serum을 30분간 반응시킨 후 조직 내 p53, cleaved caspase-3와 Ki-67의 발현을 확인하기 위하여, p53 항체(1 : 200; Santa Cruz Biotechnology, USA), cleaved caspase-3 항체(1 : 100; Cell Signaling Technology, USA) 와 Ki-67 항체(1 : 100; Abcam, UK)를 상온에서 1시간 동 안 반응시킨 후, 4oC에서 하룻밤 동안 반응시켰다. 반응이
끝난 후 biotinylated anti-rabbit IgG(Vector Laboratories, USA)를 실온에서 45분 동안 반응시킨 다음 3,3'-diamino- benxidine(DAB)을 이용하여 발색하였고 양성 반응이 나타 난 조직은 hematoxylin 용액으로 대조염색을 하였다. 각 단계 사이에는 phosphate buffered saline(PBS)과 0.3%
PBS-triton X100으로 충분히 세척하였다. 탈수 및 투명화 과정을 위하여 70%, 80%, 95%, 100% ethanol에 단계적 으로 3분씩 담근 후 xylene에 3분씩 3단계를 거친 후 봉입 하였다.
TUNEL assay
파라핀 블록을 3 μm로 박절하여 이를 슬라이드에 부착한 뒤, 탈파라핀화를 위하여 xylene에 3분씩 3단계를 거치고 100%, 95%, 90%, 80%, 70% ethanol에 3분씩 담가 함수 시킨 후 조직 내 내인성 peroxidase를 억제하기 위하여 5분 간 3% 과산화수소 용액에 담가 두었다. 그 후 equilibration buffer와 10분간 상온에서 반응시킨 뒤 working strength TdT enzyme과 37oC에서 1시간 동안 반응시키고 working strength stop/wash buffer에 담가 15초간 살짝 흔들어준 후 10분 동안 상온에 방치하였다. Anti-digoxignenin conjugate 와 30분간 상온에서 반응시킨 후 DAB를 이용하여 발색하였 고 양성 반응이 나타난 조직은 methyl green 용액으로 대조 염색하였다. 각 단계 사이에는 PBS와 증류수를 이용하여 충 분히 세척하였다. 100% n-butanol과 xylene을 이용하여 탈 수와 투명화 과정을 거친 후 봉입하였고, terminal deoxyri- bonucleotidyl transferase-mediated d-uridine 5' triphosphate nick end labelling(TUNEL) assay는 Peroxidase In Situ Apoptosis Detection Kit(Millipore, USA)를 구입하여 사용 하였다.
Western blot analysis
방사선 조사 8시간 후 부검한 마우스의 피부를 채취한 뒤, lysis buffer(40 mM Tris pH 8.0, 120 mM Nacl, 0.1 mM phenylmethysulfonyl fluoride, 0.5μg/μL leupeptin, 10 mM sodium orthovanadate; Sigma-Aldrich, USA; 2μg/mL aprotinin; Millipore)에 넣고 균질화기(homogenizer)를 이용 하여 마쇄한 후, 14,240 × g로 20분 동안 원심분리하고 상층 액을 취해 단백질을 추출하였다. 추출한 단백질은 정량하여 10% sodium dodecyl sulfate-polyacrylamide gel electro- phoresis를 이용하여 동일한 양의 단백질을 전기영동 하였다.
분리된 단백질은 니트로셀룰로오스 막(nitrocellulose mem- brane; Bio-Rad Laboratories, USA)에 120분 동안 100 V로 전이시켰다. 그 후 비특이적인 반응을 억제하기 위하여 2%
탈지분유(skim milk; Maeil, Korea)를 사용하여 실온에서 1 시간 동안 반응시켰다. 1차 항체로 p53(1 : 250; Santa Cruz Biotechnology)을 사용하여 실온에서 1시간 동안 반응시킨 뒤 biotinylated anti-rabbit IgG(Vector Laboratories)를 사용 하여 실온에서 45분간 반응시키고, horseradish peroxidase- conjugated anti-rabbit IgG를 사용하여 45분간 반응시켰다.
단백질 밴드는 ECL Detection Kit(Cyanagen, Italy)를 이용 해 발현시켰고, Fusion Solo(Vilber Loumat, Germany)를 이용하여 각각의 밴드 이미지를 얻은 후 Image J 프로그램 (National Institute of Health, USA)을 이용하여 p53과 β- actin 밴드의 밀도(densitometric analysis)를 구하고, p53/ β- actin으로 나타내어 분석하였다.
조직의 분석과 통계 처리
각각의 실험은 3회 이상 반복(각 군당 n = 3 이상)하였으 며, H&E 염색과 TUNEL assay를 실시한 조직의 분석은 광학현미경의 200배율 및 400배율을 이용하여 개체 당 40개 의 follicle에서 세포자멸사 양성 세포 수를 관찰한 다음 개 체 당 평균을 산출하고 각 군별로 평균값을 구하여 평균 값 ± 표준오차로 나타내어 하나의 모낭 당 세포자멸사 양성 세포의 수를 산출하였다. 면역조직화학 염색을 한 조직의 분 석은 광학현미경의 200배율 및 400배율을 이용하여 관찰한 후, Image J 프로그램을 이용하여 p53, cleaved caspase-3 및 Ki-67의 양성 세포 수를 관찰한 다음 개체 당 평균을 산출하고 각 군별로 평균값을 구하여 평균값 ± 표준오차로 나타내었다. 또한, dBSTAT 프로그램을 이용하여 ANOVA test를 실시하였으며, p < 0.05 및 0.01의 수준에서 유의성을 검정하였다.
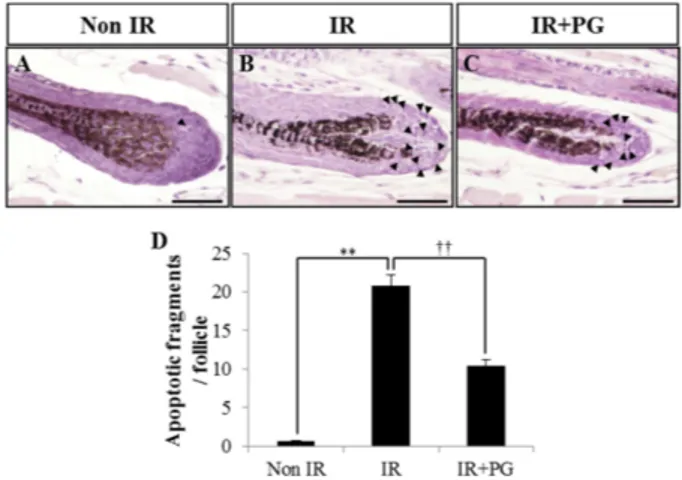
Fig. 1. Phloroglucinol (PG) protects hair follicular cells from gamma-rays irradiation-induced damages in mice. PG (10 mg/
1.5 cm2) was applied once at 17.8 h before 8.5 Gy whole body irradiation at a dose rate of 1.5 Gy/min and source-surface distance of 100 cm. Mice were sacrificed and skins were obtained at 8 h after irradiation. Hair follicle sections were stained with hematoxylin-eosin. The number of apoptotic fragments per follicles of skin section was counted using a light microscope, and 40 hair follicles per skin section were recorded. (A) Non-irradiated mice (Non IR). (B) 8.5 Gy- irradiated mice (IR). (C) 8.5 Gy-irradiated plus PG (10 mg/1.5 cm2) treated mice (IR+PG). (D) The number of apoptotic fragments per hair follicles of skin sections from each group was presented in the column. Values are indicated as the mean± standard error (SE) (**p < 0.01, ††p < 0.01). Scale bars = 30µm.
결 과
PG의 도포가 모낭의 세포자멸사에 미치는 영향 평가 H&E 염색을 통해 모낭세포에서 핵의 위축, 염색질 응축 및 세포질 분절과 같은 형태학적 변화를 확인하였다(Fig. 1).
하나의 모낭 당 apoptotic fragments 수를 확인한 결과, Non IR군의 apoptotic fragments의 수는 0.7 ± 0.07개였으나 (p < 0.01), 8.5 Gy의 방사선을 조사한 IR군에서는 20.8 ± 1.40개로 확연히 증가했다(p < 0.05). 반면에 IR+PG군은 10.3± 0.80개로 유의적으로 감소함을 확인할 수 있었다 (p < 0.01). 이상의 실험결과를 통하여, PG의 도포에 따른 마 우스 모낭의 세포자멸사 억제 효과를 확인할 수 있었다.
PG의 도포가 모낭의 TUNEL 양성 세포 발현에 미치는 영향 평가
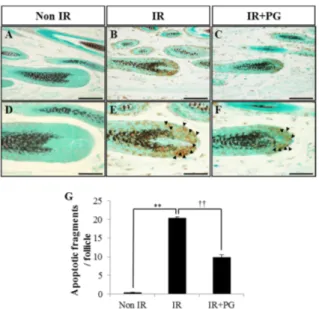
TUNEL assay를 통해 모낭세포에서 핵의 위축, 염색질 응 축 및 세포질 분절과 같은 형태학적 변화를 확인하여, H&E 염색과 함께 in situ DNA-end labeling을 이용한 TUNEL assay를 통하여 apoptotic fragments를 확인하였다(Fig. 2).
그 결과, H&E 염색과 마찬가지로 Non IR군에서는
apoptotic fragments 수가 0.4 ± 0.05개로 미미하였으나(Fig.
2A, D, and G), 8.5 Gy의 방사선을 조사한 IR군에서는 20.5± 0.25개로 apoptotic fragments 수가 증가함을 확인할 수 있었다(Fig. 2B, E, and G; p < 0.01). 반면에 IR+ PG 군에서는 apoptotic fragments 수가 9.9 ± 0.67개로 IR군보다 유의적으로 감소함을 확인할 수 있었다(Fig. 2C, F, and G;
p < 0.01). 따라서 PG의 도포가 방사선을 조사한 마우스 모 낭의 세포자멸사를 억제하는 것을 알 수 있었다.
PG의 도포가 모낭의 p53 양성 세포 발현에 미치는 영 향 평가
Western blot analysis와 면역조직화학염색을 통해 PG의 도포가 방사선을 조사한 마우스 피부의 모낭에서 p53 발현 에 미치는 영향을 확인하였다(Fig. 3).
Fig. 2. PG protects hair follicular cells from gamma-ray irradiation induced damage in mice. PG (10 mg/1.5 cm2) was applied once at 17.8 h before 8.5 Gy whole body irradiation at a dose rate of 1.5 Gy/min and source-surface distance of 100 cm. Mice were sacrificed and skins were obtained at 8 h after irradiation. Hair follicle sections were stained with terminal deoxyribonucleotidyl transferase-mediated d-uridine 5' triphos- phate nick end labelling (TUNEL). The number of apoptotic fragments per follicles of skin section was counted using a light microscope, and 40 hair follicles per skin section were recorded. (A and D) Non IR. (B and E) IR. (C and F) IR+PG.
(G) The number of apoptotic fragments per hair follicles of skin sections from each group was presented in the column.
Values are indicated as the mean± SE (**p < 0.01, ††p < 0.01).
Scale bars = 60µm (A–C), 30 µm (D–F).
Fig. 3. Inhibitory effects of PG on radiation-induced apoptosis in hair follicles. PG (10 mg/1.5 cm2) was applied once at 17.8 h before 8.5 Gy whole body irradiation at a dose rate of 1.5 Gy/min and source-surface distance of 100 cm. Mice were sacrificed and skins were obtained at 8 h after irradiation. (A and B) Western blot analysis of p53 expression modulated by PG. (A) Expression levels of p53 protein in skin of Non IR (lanes 1 and 2), IR (lanes 3 and 4), and IR+PG (lanes 5 and 6) were analyzed by western blot analysis. (B) Densitometric analysis of p53 molecule was evaluated. (C–H) Staining with p53 antibody was performed on skin sections. Positive cells stained by immunohistochemistry were quantified using Image J software under a high-power-field light microscope. (C and F) Non IR. (D and G) IR. (E and H) IR+PG. (I) The number of p53 positive cells of skin sections from each group was presented in the column. Values are indicated as the mean± SE (**p < 0.01, †p < 0.05, ††p < 0.01). Scale bars = 60 µm (C–E), 30µm (F–H).
Western blot 결과 세포자멸사를 유도하는 분자인 p53은 53 kD에서 밴드가 관찰되었다. 8.5 Gy의 방사선을 조사한 IR 군에서 p53의 발현이 확연히 증가하였으며, IR+PG 군에서 는 p53의 발현이 감소하는 것을 확인할 수 있었다(Fig. 3A).
또한 p53의 양적 변화에 대한 밴드의 밀도 분석(densitometric analysis) 결과 IR군보다 PG를 도포한 IR+PG군에서 유의성 있게 약 4.08배 감소하는 것을 확인할 수 있었다(Fig. 3B;
p < 0.05).
면역조직화학염색 결과에서는 Non IR군의 p53 양성 세포 의 수가 1.8 ± 0.4개로 미미하였으나(Fig. 3C, F, and I), 8.5 Gy를 조사한 IR군에서는 23.6 ± 2.5개로 확연하게 증가 하였으며(Fig. 3D, G, and I; p < 0.01) IR+PG군에서는 14.8± 0.89개로 IR군보다 유의적으로 감소함을 확인할 수 있 었다(Fig. 3E, H, and I; p < 0.01). 이상의 실험결과를 통하 여, PG는 세포자멸사 유도에 영향을 미치는 인자로 알려진 p53의 발현 억제를 유도해 세포자멸사를 감소시킴을 확인할 수 있었다.
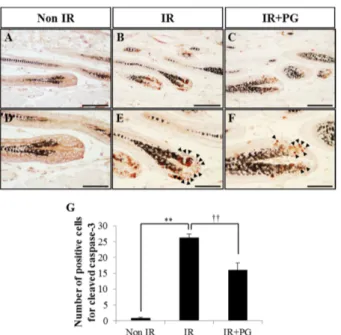
PG의 도포가 모낭의 cleaved caspase-3 양성 세포 발현 에 미치는 영향 평가
면역조직화학염색을 통해 PG가 세포자멸사 유도에 영향을
미치는 인자 중 하나인 cleaved caspase-3의 발현을 억제하 여 세포자멸사를 감소시킴을 확인할 수 있었다(Fig. 4). Non IR군에서는 cleaved caspase-3의 양성 세포의 수가 0.9 ± 0.18개로 미미한 수준으로 발현하였으나(Fig. 4A, D and G), IR군에서는 26.2 ± 1.25개로 크게 증가하였고(Fig. 4B, E and G; p < 0.01), IR+PG군에서는 16.1 ± 2.21개로 IR군 보다 cleaved caspase-3의 양성 세포의 수가 유의적으로 감 소함을 확인할 수 있었다(Fig. 4C, F and G; p < 0.01).
PG의 도포가 모낭의 Ki-67 양성 세포 발현에 미치는 영향 평가
세포 주기 중 DNA가 합성되는 S기의 후반부터 G2기를 거쳐 세포질 분열이 일어나 세포가 둘로 나뉘는 M기 중반 부까지 발현되는 것으로 알려진 Ki-67의 양성 세포 발현을 면역조직화학염색을 통해 확인하였다(Fig. 5). 세포 재생을 평 가한 결과, Non IR군에서 Ki-67 양성 세포의 수는 27.2 ± 0.36개였고(Fig. 5A and D), 8.5 Gy를 조사한 IR군에서는 14.4± 0.07개로 Non IR군보다 큰 폭으로 감소하였다(Fig.
5B and D; p < 0.01). 반면에 IR+PG군에서는 Ki-67 양성 세포의 수가 21.9 ± 0.11개로 IR군보다 유의적으로 증가하였 음을 확인할 수 있었다(Fig. 5C and D; p < 0.05). 이상의 실험결과를 통하여, PG의 도포가 방사선으로 손상된 마우스 모낭세포의 복구를 증진시키는 효과가 있음을 확인할 수 있 었다.
Fig. 4. Inhibitory effects of PG on radiation-induced apoptosis in hair follicles. PG (10 mg/1.5 cm2) was applied once at 17.8 h before 8.5 Gy whole body irradiation at a dose rate of 1.5 Gy/min and source-surface distance of 100 cm. Mice were sacrificed and skins were obtained at 8 h after irradiation.
Staining with cleaved caspase-3 antibody was performed on skin sections. Positive cells stained by immunohistochemistry were quantified using image J software under a high-power- field light microscope (400×). (A and D) Non IR. (B and E) IR. (C and F) IR+PG. (G) The number of cleaved caspase-3 positive cells of skin sections from each group was presented in the column. Values are indicated as the mean± SE (**p <
0.01, ††p < 0.01). Scale bars = 60 µm (A–C), 30 µm (D–F).
Fig. 5. Proliferative effects of PG against radiation-induced damage in hair follicles. PG (10 mg/1.5 cm2) was applied once at 17.8 h before 8.5 Gy whole body irradiation at a dose rate of 1.5 Gy/min and source-surface distance of 100 cm. Mice were sacrificed and skins were obtained at 8 h after irradiation.
Staining with Ki-67 antibody was performed on skin sections.
Positive cells stained by immunohistochemistry were quantified using image J software under a high-power-field light micro- scope (400×). (A) Non IR. (B) IR. (C) IR+PG. (D) The number of Ki-67 positive cells of skin sections from each group was presented in the column. Values are indicated as the mean± SE(**p < 0.01, ††p < 0.01). Scale bars = 30 µm.
고 찰
인체의 방사선 감수성은 각각 다르게 나타나는데 그 차이 는 세포의 종류, 분화 정도 및 증식률에 따라 다르며 세포 분열 및 증식이 빠른 세포가 방사선 감수성이 크다고 알려 졌다 [21]. 피부의 부속기관(skin appendages)인 털은 방사선 에 의하여 일시적 탈모와 영구적 탈모를 일으키는데, 특히 분화능이 큰 피부의 모낭줄기세포는 방사선 감수성이 크기 때문에 방사선 치료 시 나타나는 탈모와 관련이 있다 [18].
현재까지 방사선 치료법의 발달과 함께 방사선 방어제의 개 발도 함께 이루어져 왔으나, 강한 독성으로 인한 부작용과 함께 복수의 약제 병용으로 인한 복합 부작용이 나타나는 문 제가 있다고 보고되었다 [13].
현재로써는 방사선 특이적인 피부 보호제에 관한 연구는 미비한 실정으로 [12], 천연물에서 방사선 방어 효능을 가진 물질과 방사선에 의하여 손상된 피부를 개선하는 효과가 있 는 물질을 찾기 위한 노력이 계속되고 있다 [5]. Chen 등 [6]의 보고에 따르면, 병풀의 항염 효과가 방사선으로 인하여 손상된 피부 질환 개선에 간접적인 영향을 미치는 것이 알 려졌다. 또한 Amber 등 [3]은 알로에 베라의 보습 효과가 방사선으로 인하여 손상된 피부 장벽 기능의 개선으로 이어 져 피부 독성을 감소시켰고, 그 효과는 알로에 베라에 포함 된 폴리페놀 성분에서 기인한 것이라고 보고하였다. 폴리페 놀성 물질로 알려진 PG는 감태에 포함된 dieckol과 함께 플 로로탄닌 성분을 함유하여 방사선 조사로 인한 손상에 대해 활성산소 생성 억제 [14], 소장움 세포 손상 억제 [11] 및 말초혈액세포의 세포자멸사 억제 [20] 등의 방사선 방어 효 과가 있음이 보고되었다. 본 연구에서도 PG는 방사선 조사 로 인하여 손상된 모낭세포의 세포자멸사를 유의적으로 감소 시키는 것을 확인하였고, 이는 PG에 포함된 유효 활성 성분 인 폴리페놀 및 플로로탄닌 성분에서 기인한 것으로 보인다.
모낭세포와 같이 방사선 감수성이 큰 세포는 방사선 조사 후 몇 시간 이내에 세포자멸사를 쉽게 관찰할 수 있다 [16].
방사선에 의한 모낭세포의 핵과 염색질 응축 등 세포자멸사 의 형태학적 변화 [8]를 확인하기 위하여 H&E 염색을 한 결과 IR군보다 PG를 도포한 IR+PG군에서 세포자멸사가 유 의적으로 감소함을 확인하였다. 또한, 세포자멸사를 확인하 기 위하여 in situ DNA-end labeling을 이용한 TUNEL assay를 실시하여 모낭세포에서 TUNEL 양성 세포의 수를 확인한 결과 IR군보다 IR+PG군에서 세포자멸사가 유의적으 로 감소하여 H&E 염색 결과와 일치한다.
세포자멸사에는 많은 인자가 관여하고 있으며, 특히 방사 선에 의한 세포자멸사는 p53 의존적인 경로를 거친다고 알 려졌다 [10]. 방사선 조사 후 세포자멸사에 관여하는 여러 단백질이 발현되는데, 대표적인 것이 p53과 bax 단백질이다 [10]. 세포자멸사를 유도하는 단백질은 p53과 bax를 활성화 해 세포자멸사를 유도하며, bcl-2는 항상성 유지를 위하여 p53과 bax와 같은 세포자멸사 유도 단백질이 증가할 경우 감소하게 된다 [9]. 또한 방사선 조사로 인하여 활성화된
p53으로 인하여 세포주기가 지연되는데, 이때 손상을 복구하 지 못하면 그 세포는 세포자멸사를 진행한다 [10, 23]. p53 의 발현 양상 변화를 Western blot analysis와 면역조직화학 염색을 통해 확인한 결과 IR군보다 PG를 도포한 IR+PG군 에서 p53의 발현이 유의적으로 감소함을 확인하였고, 이는 이전의 결과인 H&E 염색과 TUNEL assay의 결과와도 일 치한다. 세포자멸사를 일으키는 p53 경로에 caspase cascade 가 관여하며, 특히 inhibitor caspase인 caspase-9의 활성화를 통하여 effector caspase인 caspase-3를 활성화해 최종적으로 세포자멸사를 유도한다 [16]. Cleaved caspase-3의 발현 정 도를 면역조직화학염색으로 확인한 결과 IR군보다 IR+PG군 에서 cleaved caspase-3 양성 세포의 수가 유의적으로 감소 하였다. 이로써, 방사선으로 인하여 손상된 모낭세포는 p53 의존적인 경로를 거쳐 세포자멸사를 유도하는 것으로 생각 되나, 이를 뒷받침하기 위해서는 anti-apoptotic 분자인 bcl-2 와 bcl-xL, pro-apoptotic 분자인 bax와 bak에 대한 추가적 인 연구가 더 필요하다.
Ki-67은 세포 재생의 마커로써 세포 주기 중 DNA가 합 성되는 S기부터 세포질 분열이 일어나는 M기 중반부까지 발 현한다고 알려졌는데, IR군보다 IR+PG군에서 Ki-67 양성 세 포의 수가 유의적으로 증가한 결과로 볼 때 방사선으로 인 하여 손상된 모낭세포에 PG의 도포가 세포자멸사의 억제뿐 만 아니라 방사선에 의해 감소한 모낭세포의 재생능도 상승 시키는 것으로 생각한다.
연구 결과를 종합해보면 PG는 방사선에 민감한 모낭세포 의 손상을 억제하고 방사선 조사로 인해 억제된 모낭세포의 재생능을 향상시키는 것으로 보인다. 이러한 결과는 피부 및 모낭세포에 대한 방사선 방어제 및 방사선 치료 시 보조제 로써 PG의 응용 가능성을 시사하고 있다.
감사의 글
이 논문은 2015년 해양수산부 재원으로 한국해양과학기술 진흥원의 수산실용화기술개발사업(D11507215H480000120)과 제주씨그랜트사업 “손상된 성체줄기세포에 대한 방사선 보호 효능을 지닌 해양생물 유래 신소재 개발”의 지원을 받아 수 행한 연구입니다.