pISSN: 0378-6471 eISSN: 2092-9374
http://dx.doi.org/10.3341/jkos.2011.52.9.1104
= 증례보고 =
결막 내 이식했던 양막을 이용한 난치성 각막 윤부결핍 질환 치료 1예
김태형⋅정재훈⋅전연숙⋅김재찬 중앙대학교 의과대학 중앙대학교병원 안과학교실
목적: 양안 화학 화상 후 발생한 심한 윤부결핍 환자에서 기존 치료에 반응하지 않고 지속적으로 상태가 악화되어 결막 내 이식했던 양막을 이용하여 성공적으로 치료하였기에 이를 보고하고자 한다.
증례요약: 43세 남자환자가 6년 전 발생한 양안 화학화상 이후 지속적으로 발생한 윤부결핍으로 자가결막피판이식, 양막이식, 전층각막 이식, 동종윤부이식, 배양각막상피세포이식 등을 시행하였으나 각막상피세포결손이 악화되어 각막 천공이 발생하여 수술이 필요하였 다. 과거력상 안압 조절을 위해 삽입한 방수유출장치의 실리콘 관이 결막 마찰로 노출되어 양막으로 실리콘 관을 감싸준 후 안정적으 로 유지되어 결막 밑에 위치한 양막에 중배엽 줄기세포가 있을 것으로 가정하고, 이식된 양막 일부를 이용하여 각막천공부위에 이식하 였다. 수술 후 6개월까지 각막 천공 재발 없이 외안부 상태는 안정적으로 유지되었다. 조직검사 및 면역조직화학염색상 이식한 양막에 중배엽 줄기세포로 추정되는 세포를 확인할 수 있었다.
결과: 난치성 안구표면질환에 있어 중배엽 줄기세포를 골수에서 유도하여 직접적으로 창상 치유에 관여하는 세포를 유도하는 매개체로 결막 내 이식한 양막이 유용할 수 있음을 확인하였다.
<대한안과학회지 2011;52(9):1104-1108>
■ 접 수 일: 2010년 7월 5일 ■ 심사통과일: 2011년 1월 5일
■ 게재허가일: 2011년 6월 5일
■ 책 임 저 자: 김 재 찬
서울시 동작구 흑석동 224-1 중앙대학교병원 안과
Tel: 02-6299-1689, Fax: 02-795-6295 E-mail: Jck50ey@kornet.net
* 본 논문의 요지는 2009년 대한안과학회 제102회 학술대회에서 비디오로 발표되었음.
* 이 연구는 보건복지가족부 보건의료연구개발사업의 지원에 의하여 이루어진 것임(과제고유번호: A084721).
각막손상에 의해 상피의 결손이 발생하면 각막상피의 세 포분열이 정상시보다 왕성하게 이루어진다. 이때 각막윤부 줄기세포가 빠르게 분열하여 주변부 각막에 많은 일시적 증 폭세포를 제공하고 이들이 상피의 결손부위로 이동하면서 휴지기의 세포로 분화하여 결손부위를 채우게 된다.1-5하지 만, 손상이 심할 경우 각막의 세포만으로는 회복이 불가능한 데, 지속적 각막상피결손 및 각막윤부결핍 환자의 경우, 손상 시 탈분화할 간질세포 및 상피세포가 부족할 뿐 아니라 회복 에 관여할 수 있는 중배엽 줄기세포의 이주 역시 어렵다.6-8 이에 대한 수술적 치료로 자가윤부이식,9동종윤부이식,10,11 배양된 각막상피세포이식,12-14양막이식, 점막이식 등의 윤 부결핍을 보강하고 안구 표면 환경을 호전시키기 위한 시 도가 이루어지고 있지만, 손상이 심한 경우, 이러한 다양한 기존 치료 방법을 시도함에도 불구하고 악화될 수 있다.
이에 저자들은 기존의 치료에도 불구하고 지속적으로 악 화되는 난치성 윤부결핍 환자에서 기존에 외안부에 이식되 어 있던 양막을 이용하여 성공적으로 치료한 1예를 경험하 였기에 이를 보고하고자 한다.
증례보고
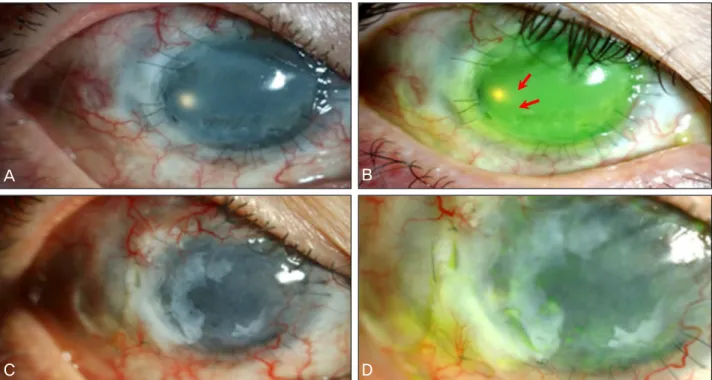
43세 남자 환자가 6년 전 양안 화학 화상 후 발생한 윤부 결핍으로 자가결막피판이식, 7회의 양막이식, 3회의 전층 각막이식, 동종윤부이식, 배양각막상피세포이식 등을 6년 에 걸쳐서 시행하였다. 그러나 윤부결핍은 호전되지 않고 각막상피세포 결손이 6년간에 걸쳐 지속적으로 악화되어 미세한 각막천공까지 발생하여 또다시 수술적인 치료가 필 요하였다. 세극등현미경검사상 상측과 하측 일부를 제외한 전체 각막에 지속적인 상피세포 결손과 각막윤부결핍이 관 찰되었다. 또한 8-9시 주변부 각막에 다수의 미세 천공 (Fig. 1A, B)이 확인되었다.
각막 천공의 처치 및 윤부결핍으로 인한 외안부의 안정 화를 목표로 수술을 계획하였다. 환자 과거력상 전층각막이 식 후 안압이 조절되지 않아 전방유출장치를 삽입하고, 3년 후 결막과 유출장치 실리콘 관의 마찰로 인해 실리콘 관이 노출되어 양막으로 실리콘 관을 감싸준 후 다시 한 겹의 양 막을 덮어주고, 주변 결막을 박리하여 결막결손을 치료한적
A B
C D
Figure 1. (A, B) Slit lamp photograph shows total limbal cell deficiency and perforation at 8 to 9 o’clock (red arrows), (C, D)
Anterior segment photograph shows that the ocular surface is well maintained well and graft remains healthy at postoperative 6 months after transplanted amniotic membrane.이 있었다. 지속적인 각막 손상에 따라 창상 치유를 위해 결막 밑에 위치한 양막에 중배엽 줄기세포가 모여 있을 것 으로 가정하고, 이식되어 있는 양막 일부를 이용하여 각막 천공부위에 이식하고자 하였다.
수술은 국소마취로 진행되었으며, 12시 방향 아메드 밸 브 실리콘 관이 노출되었던 부위 결막을 박리하여 이식되 어 있던 양막 일부를 채취하였다. 절개 후 이식되어 있는 양막 일부를 박리하여 채취하였다. 채취한 양막을 천공 부 위에 알맞도록 조직편을 만들어 9시와 4시 천공 부위에 이 식하였다. 이식된 양막의 생착을 돕기 위해 이식부위 전체 를 덮을 수 있도록 일시적 양막이식술을 시행하였다.
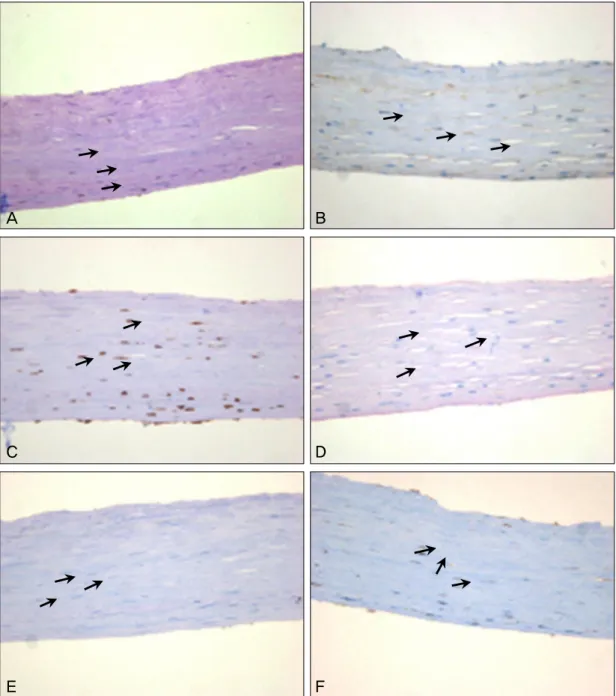
이식 후 6개월까지 세극등현미경검사, 안압검사를 시행 하였으며, 수술 후 6달까지 천공 부위와 윤부결핍 부위의 이 식 상태는 잘 유지(Fig. 1C, D)되어 안정된 안구 표면 상태 를 유지하였다. 이식 수술 후 남은 일부 양막에 대한 조직검 사 및 면역현미경 검사상 중배엽 줄기세포 표지인자인 CD29 (integrin-β-1), vimentin, c-kit, VEGF, hSTRO-1,SMA에 서 양성소견을 보이는 세포 성분을 확인할 수 있었다(Fig. 2).
이식해두었던 양막에 중배엽 줄기세포가 유도되었음을 확 인할 수 있었다.
고 찰
각막윤부결핍증을 치료하기 위해 다양한 수술 방법이 보
고되어 있다. Kenyon and Tseng9은 손상된 눈에 자가각막 윤부이식술을 시행하여 총 26안, 모두 18개월의 경과 관찰 동안 빠른 상피화 및 각막의 혈관증식이 억제됨을 보고하 였다. 하지만 질환이 양측성으로 환자의 반대쪽 조직을 사 용할 수 없는 경우나 이식할 부분의 넓이가 큰 경우에는 부 적합하다. 동종 조직 이식술의 경우 이식 거부 반응 및 이 를 억제하기 위해 고가의 항대사제를 복용해야 하며 장기 간 관찰 결과 이식실패라는 문제점이 있다.15-19
Pellegrini et al20은 손상 받지 않은 눈의 윤부세포를 콘 택트렌즈를 매개체로 하여 배양, 증식시켜 이식하는 방법을 보고하였으며, Koizumi et al21은 토끼에서 자가배양윤부세 포 이식 매개체로 양막을 이용하여 성공적인 결과를 보고 하였다. 하지만 배양 각막상피세포 이식술의 경우, 배양 시 오염, 이식 후 눈 깜박임에 의한 각막 상피의 탈락, 상피세 포의 비 영구성, 이식된 세포의 거부반응, 이를 억제하기 위 한 항 대사제의 복용 등의 단점이 있다.20.21
양막을 안구에 이식하는 경우, 기저막 역할을 하여 각막 상피세포의 이주와 성장을 촉진하고 정상상피세포 특성을 유지하며, 염증을 억제하고, 신생혈관 및 반흔 형성을 억제 하는 기능을 가지고 있다.22 이러한 특성으로 지속적인 각 막상피결손, 각막궤양상피결손, 결막결손, 화학 및 열 화상 에 의한 안구 손상, 각막윤부세포결핍, 각막 천공 등의 치료 에 양막을 이식한 사례가 보고되어 있다.23-30하지만 조직 내에 이식했던 양막을 중배엽 줄기세포의 매개체로 이용하
A B
C D
E F
Figure 2. Transplanted amniotic membrane biopsy shows many mesenchymal stem cells. (A) c-kit (B) CD29
(integrin-β-1) (C) SMA (D) hSTRO-1 (E) VEGF (F) vimentin (×400).여 이식한 예는 보고되어 있지 않다.
중배엽 줄기세포는 조직의 특정 세포로만 분화하는 제한 적 분화 능에서 탈피하여 다양한 종류의 세포로 분화 가능 한 다능성을 가지며31손상된 각막 상피에서 분비되는 성장 인자는 중배엽 줄기세포의특성 변화를 유도한다.32Ye et al33은 각막화상 토끼 실험에서 중배엽 줄기세포를 전신적 으로 정맥 투여한 경우 분화, 증식 등을 통해 각막의 재상 피화가 촉진되고, 신생혈관을 억제하는 효과가 있음을 보고 하였다. 하지만 골수중배엽 줄기세포를 정맥 내 주사 혹은 점안하는 방법을 이용한 치료의 경우, 다능성에 의해 줄기
세포의 분화 방향을 예측하기 어려우며 암세포의 증식을 촉진시킬 수 있는 단점이 있다. 따라서 중배엽 줄기세포를 창 상부위로 바로 이동시켜 자가치유력을 극대화하는 것이 이상 적이다. 대조군으로 양막과 정상 결막에서는 나타나지 않은 중배엽 줄기세포의 표식자로 알려진 CD29 (integrin-β-1), vimentin, c-kit, VEGF, hSTRO-1, SMA 등이 본 증례에 서와 같이 결막 하에 이식한 양막에서는 양성으로 나타난 것을 확인할 수 있었다. 결막 내에 이식한 양막에 중배엽 줄기세포가 골수에서 유도된 상태로, 이를 각막윤부결핍 및 천공 부위에 이식할 경우 중배엽 줄기세포를 이식하는 효
과를 갖게 되고 손상된 각막상피세포에서 분비되는 성장 인자에 의해 이식된 양막 내의 중배엽 줄기세포의 특성 변 화가 유도될 것으로 생각된다. 그러므로 기존 수술방법에 비해 각막 상피세포 재생의 효과가 뛰어나며, 이식 거부반 응이 없어 항대사제를 복용할 필요가 없다. 또한 이식 부위 에 맞추어 크기 및 두께 조절이 가능하다.
따라서 본 증례와 같이 수 차례 수술적 치료에 반응하지 않는 난치성 안구표면질환에 있어 중배엽 줄기세포를 골수 에서 유도하여 직접적으로 창상 치유에 관여하는 세포를 유도하는 매개체로 결막 내 이식한 양막의 유용성을 확인 할 수 있었으며, 천공 부위에 이식한 양막이 중배엽 줄기세 포 전달체 역할을 하여 상피 결손 회복에 중대한 역할을 한 것으로 생각된다. 이를 활용하여 중배엽 줄기세포가 유도된 매개체에 각막윤부상피세포, 결막상피세포, 비강점막세포 등을 증폭시켜 창상 부위에 이식하여 난치성 안구표면질환 의 새로운 치료법으로 이용할 수 있을 것으로 기대된다.
또한 본 증례에서는 양막을 이용하였으나, 양막 이외에 도 콜라겐 막 혹은 이식 후 남은 각막 등도 이용 가능할 것 으로 생각된다. 특히 콜라겐 막을 이용하게 되면 결합력을 더욱 보강할 수 있을 것이며, 이식 후 남은 각막을 이용한 다면 양막 사용시의 불투명성을 해결할 수 있으며 각막상 피재생에 더욱 효과적일 것으로 생각한다.
참고문헌
1) Zieske JD, Bukusoglu G, Gipson IK. Enhancement of vinculin synthesis by migrating stratified squamous epithelium. J Cell Biology 1989;109:571-6.
2) Chung EH, Hutcheon AE, Joyce NC, Zieske JD. Synchronization of the G1/S transition in response to corneal debridement. Invest Ophthalmol Vis Sci 1999;40:1952-8.
3) Hall PA, Watt FM. Stem cells: the generation and maintenance of cellular diversity. Development 1989;106:619-33.
4) Thoft RA, Friend J. The X, Y, Z hypothesis of corneal epithelial maintenance. Invest Ophthalmol Vis Sci 1983;24:1442-3.
5) Sandvig KU, Haaskjold E, Bjerknes R, et al. Cell kinetics of con- junctival and corneal epithelium during regeneration of differ- ent-sized corneal epithelial defects. Acta Ophthalmol 1994;172:
43-8.
6) Kotton DN, Ma BY, Cardoso WV, et al. Bone marrow-derived cells as progenitors of lung alveolar epithelium. Development 2001;
128:5181-8.
7) Ferrari G, Cusella-De Angelis G, Coletta M, et al. Muscle re- generation by bone marrow-derived myogenic progenitors. Science 1998;279:1528-30.
8) Okamoto R, Yajima T, Yamazaki M, et al. Damaged epithelia re- generated by bone marrow-derived cells in the human gastro- intestinal tract. Nat Med 2002;8:1011-7.
9) Kenyon KR, Tseng SC. Limbal autograft transplantation for ocular surface disorders. Ophthalmology 1989;96:709-23.
10) Tsai RJ, Tseng SC. Human allograft limbal transplantation for cor- neal surface reconstruction. Cornea 1994;13:389-400.
11) Kwitko S, Marinho D, Barcaro S, et al. Allograft conjunctival transplantation for bilateral ocular surface disorders.
Ophthalmology 1995;102:1020-5.
12) Shimazaki J, Aiba M, Goto E, et al. Transplantation of human lim- bal epithelium cultivated on amniotic membrane for the treatment of severe ocular surface disorders. Ophthalmology 2002;109:1285-90.
13) Ti SE, Grueterich M, Espana EM, et al. Correlation of long term phenotypic and clinical outcomes following limbal epithelial transplantation cultivated on amniotic membrane in rabbits. Br J Ophthalmol 2004;88:422-7.
14) Park GS, Je J, Kim JC. Stepwise surgical approach for in vivo ex- pansion of epithelial stem cells to treating severe acute chemical burns with total limbal deficiency. Korean J Ophthalmol 2003;
17:75-82.
15) Jenkins C, Tuft S, Liu C, Buckley R. Limbal transplantation in the management of chronic contact lens-associated epitheliopathy.
Eye 1993;7:629-33.
16) Coster DJ, Aggarwal RK, Williams KA. Surgical management of ocular surface disorders using conjunctival and stem cell allografts.
Br J Ophthalmol 1995;79:977-82.
17) Holland EJ, Schwartz GS. The evolution of epithelial trans- plantation for severe ocular surface disease and a proposed classi- fication system. Cornea 1996;15:549-56.
18) Henderson TR, Coster DJ, Williams KA. The long term outcome of limbal allografts: the search for surviving cells. Br J Ophthalmol 2001;85:604-9.
19) Pels E, van der Gaag R. HLA-A,B,C, and HLA-DR antigens and dendritic cells in fresh and organ culture preserved corneas.
Cornea 1984;3:231-9.
20) Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated human epithelium. Lancet 1997;349:990-3.
21) Koizumi N, Inatomi T, Quantock AJ, et al. Amniotic membrane as a substrate for cultivating limbal corneal epithelial cells for autolo- gous transplantation in rabbits. Cornea 2000;19:65-71.
22) Rama P, Bonini S, Lambiase A, et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of pa- tients with total limbal stem cell deficiency. Transplantation 2001;72:1478-85.
23) Prabhasawat P, Tesavibul N, Komolsuradej W. Single and multi- layer amniotic membrane transplantation for persistent corneal ep- ithelial defect with and without stromal thinning and perforation.
Br J Ophthalmol 2001;85:1455-63.
24) Shin KS, Chung IY, Seo SW. The effect of amniotic membrane transplantation for corneal ulcer and ocular surface diseases. J Korean Ophthalmol Soc 2003;44:1305-10.
25) Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane trans- plantation for conjunctival surface reconstruction. Am J Ophthalmol 1997;124:765-74.
26) Tamhane A, Vajpayee RB, Biswas NR, et al. Evaluation of amni- otic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns.
Ophthalmology 2005;112:1963-9.
27) Meller D, Pires RT, Mack RJ, et al. Amniotic membrane trans- plantation for acute chemical or thermal burns. Ophthalmology 2000;107:980-9.
=ABSTRACT=
Amniotic Membrane Transplanted in Conjunctiva as a Mesenchymal Stem Cells Carrier for Limbal Stem Cell Deficiency
Tae Hyung Kim, MD, Jae Hoon Jeong, MD, PhD, Yeoun Sook Chun, MD, PhD, Jae Chan Kim, MD, PhD
Department of Ophthalmology, Chung-Ang University Hospital, Chung-Ang University College of Medicine, Seoul, Korea
Purpose: To report the use of amniotic membrane (AM) as a mesenchymal stem cell (MSC) carrier in cornea perforation with severe limbal stem cell deficiency due to a chemical burn on both eyes.
Case summary: The patient in the present study is a 43-year-old man with a history of bilateral alkaline chemical injury six years previously. The patient suffered from total limbal stem cell deficiency (LSCD) in the injured eyes and underwent numerous operations including autologous conjunctival flap, AM graft, penetrating keratoplasty, keratolimbal autograft and ex vivo expanded limbal allogrft. However, the patient’s ocular condition deteriorated due to persistent LSCD, which led to corneal perforation resulting in the need for an urgent therapeutic operation. In the patient’s past ocular history, Ahmed valve implantation was performed for uncontrolled IOP. Revision of the Ahmed tube due to exposure and con- junctival erosion was performed again via placement of an AM over the exposed tube one year previous to presentation to our hospital. The authors performed a transplanted AM graft at the cornea perforation using sub-conjunctival AM believed to contain MSCs. Six months postoperatively, the ocular surface was well mainatained and the graft remained healthy.
Transplanted AM showed morphological and immunohistochemical findings similar to those of MSCs.
Conclusions: Results from the present study confirm that AM transplanted into the conjunctiva is a useful carrier of bone marrow-derived MSCs in severe ocular surface diseases.
J Korean Ophthalmol Soc 2011;52(9):1104-1108
Key Words: Amniotic membrane, Limbal stem cell deficiency, Mesenchymal stem cells, Severe ocular surface disease
Address reprint requests to Jae Chan Kim, MD, PhD
Department of Ophthalmology, Chung-Ang University Hospital
#224-1 Heukseok-dong, Dongjak-gu, Seoul 156-755, Korea
Tel: 82-2-6299-1689, Fax: 82-2-795-6295, E-mail: Jck50ey@kornet.net 28) Tseng SC, Prabhasawat P, Barton K, et al. Amniotic membrane
transplantation with or without limbal allografts for corneal sur- face reconstruction in patients with limbal stem cell deficiency.
Arch Ophthalmol 1998;116:431-41.
29) Ucakhan OO, Köklü G, Firat E. Nonpreserved human amniotic membrane transplantation in acute and chronic chemical eye injuries. Cornea 2002;21:169-72.
30) Hanada K, Shimazaki J, Shimmura S, Tsubota K. Multilayered amniotic membrane transplantation for severe ulceration of the
cornea and sclera. Am J Ophthalmol 2001;131:324-31.
31) Kicic A, Shen W, Rakoczy PE. The potential of marrow stromal cells in stem cell therapy. Eye 2001;15:695-707.
32) Shin MS, Hong HS, Son YS, Kim JC. Effects of damaged human corneal epithelial cells on differentiation of human mesenchymal stem Cell. J Korean Ophthalmol Soc 2007;48:423-30.
33) Ye J, Yao K, Kim JC. Mesenchymal stem cell transplantation in a rabbit corneal alkali burn model: engraftment and involvement in wound healing. Eye 2006;20:482-90.