구제역 바이러스 혈청형 A와 O 에피토프 재조합단백질 백신의 구제역 방어 효능
박미나, 이혜영, 이현수, 임대석, 문상범*
Protective Effect of Foot and Mouth Disease Virus Serotype A and O Epitope-constituted Recombinant Protein Vaccine
Mi Na Park, Hae Young Lee, Hyun Soo Lee, Dae Seog Lim, and Sang Bum Moon*
Received: 25 November 2020 / Revised: 27 December 2020 / Accepted: 28 December 2020
© 2020 The Korean Society for Biotechnology and Bioengineering
Abstract: Foot-and-mouth disease (FMD) is a highly conta- gious viral disease susceptible to cloven- hoofed animals such as cattle, pig and goat, consequently exerting a bad influence on the livestock industry. Although various FMD vaccines have been developed for several decades, the efficacy of cur- rent FMD vaccines is restrictive because of the FMD virus (FMDV) diversity. The aim of this study was to determine whether the FMD virus (FMDV) serotype A and O epitope recombi- nant protein vaccine shows protective effects in a FMD ani- mal model using pigs. To manufacture the recombinant protein vaccine, three or six replicates of VP1 epitopes of A/
Pocheon/SKR/2010 and O/Andong/SKR/2010 FMDV strains were used and coupled with a swine immunoglobulin G heavy-chain constant region. Pigs were vaccinated twice (interval of 4 weeks) intramuscularly and examined the serum titers of FMDV specific antibody and neutralization antibody.
After FMDV challenge, the gross lesions and clinical signs in FMD were assessed, and the viremia was measured by RT- PCR assay using oral swabs. In the field experiment using pigs, FMDV-specific antibodies were markedly induced in the sera of FMD vaccine-immunized pigs. In addition, produced antibodies dramatically inhibited FMDV in vitro. Moreover, from challenge test in pigs to test the potency of FMD vac- cine, at least more than 93% of vaccinated pigs were clearly protected from FMD. Taken together, these results strongly
demonstrate that FMDV bivalent epitope-constituted recom- binant protein vaccine shows obviously protective effects against two different serotypes (A, O) of FMDV.
Keywords: Foot-and-mouth disease, FMDV O & A serotype, recombinant protein vaccine, pig
1. INTRODUCTION
구제역(Foot-and-mouth disease, FMD)은 소, 돼지, 염소, 사슴 과 같은 우제류의 입, 발굽, 혀 등에 수포를 형성하면서 침 흘 림, 발열, 식욕 부진을 일으키며 전염성이 매우 높은 가축 전 염병이다 [1]. 모든 우제류 동물이 구제역에 대한 감수성을 지니고 있으나 동물의 종에 따라 감수성은 다르며 [2], 일부 소에서는 구제역에 대한 유전적 저항성을 나타내기도 한다.
감염된 동물은 호흡기를 통해 구제역 바이러스가 배출되는 데 돼지의 경우 소, 양에 비해 배출되는 바이러스가 약 100배 정도 높은 것으로 알려져 있다 [3]. 구제역 바이러스가 감염 되면 viremia를 일으키며, 열이 수반된다 [1,4]. 상피세포에서 바이러스가 증식되면 수포를 동반한 특징적인 병변이 발생 되는데 이 때 바이러스의 함유량이 가장 높고 발생된 수포가 터지면서 최대 감염시기를 나타낸다 [5]. 소와 돼지에서 구 제역에 대한 연구가 가장 많이 보고되었으며, 소의 경우 치 사율은 돼지에 비해 높은 편은 아니나 임신우는 유산을 일으 킬 수 있다. 돼지의 경우에는 상대적으로 면역력이 소보다는 약한 것으로 알려져 있으며, 초기증상으로 수포를 동반한 파 행이 일어나며 최대 감염시기를 지나면 극심한 통증이 수반 되고 발굽이 탈락된다. 어린 돼지의 경우 심부전으로 급사하
㈜파로스백신
Pharos vaccine Inc., Seongnam 13201, Korea Tel: +82-31-8035-3404, Fax: +82-31-8035-3457 E-mail:moon@pharosvaccine.com
Research Paper
며 소에 비해 감수성이 높아 구제역 바이러스 노출 24-48 시 간이내 임상증상을 관찰할 수 있는 것이 특징이다 [1,6].
FMD는 Picornaviridae계통의 Apthovirus속에 속하는 FMD 바이러스(FMDV)가 원인체로 7종류의 혈청형(O, A, C, Asia1, SAT1, SAT2, SAT3)과 80여종의 혈청아형이 밝혀져 있으며, 변이가 빈번히 일어나는 것으로 알려져 있다. 또한, 구제역 바이러스는 혈청형 간의 교차면역은 이루어지지 않는 것으 로 알려져 있다 [7]. 특히 O, A, Asia1의 3가지 혈청형이 전 세계적으로 발생빈도가 가장 높다 [8]. 국내에는 1911년 첫 감염 보고되었으며(수의과학 검역원, 1999), 2010년 경상북 도 안동의 한 양돈장에서 발생한 구제역이 전국적인 확산되 었다. 가축방역당국의 노력에도 불구하고, 전국의 우제류 동 물 약 340만두가 살처분되었다. 이후, 현재까지 거의 매년 산 발적으로 A, O형 구제역이 발병하고 있다.
구제역 방역은 살처분, 이동통제, 백신 접종 등 각 나라별 로 정책이 상이하다. 우리나라의 경우 2010년 구제역파동 이 후, 백신 접종 정책을 실시하고 있는데 현재 국내 구제역 예 방 백신은 균주의 불활화를 통한 사백신을 수입하여 접종하고 있다. 또한 구제역은 상기 서술한 바와 같이 다양한 혈청형 이 존재하기 때문에 다가(Multivalent) 백신을 사용하고 있다.
국제적으로 구제역 백신생산은 세계동물보건기구(OIE)에서 규정하고 있다. 구제역백신은 1926년 구제역 바이러스를 불 활화하면서 개발되었으며, 1960년대 세포배양법의 개발과 농축 및 정제법들이 개선되면서 구제역백신이 가지고 있던 문제점이 해결되기 시작하였다. 하지만, 현재 국내 구제역 예방백신은 전량 수입에 의존하고 있으며, 모두 불활화를 거 친 사백신 형태로써 다음과 같은 단점이 있다 [9]. 구제역 바 이러스를 사용하는 방법으로 생물안전등급 (Biosafety level) 3에 해당하는 시설을 사용해야 하며, 불활화를 거치지만 2007년 영국 구제역 백신공장에서 제조공정상 문제가 생겨 바이러스가 유출된 사례도 있다 [10]. 또한 각각의 혈청형에 대한 백신을 제조하여 혼합하는 방법으로 다가백신을 제조한 다는 점에서 우리나라와 같은 지역적 특성을 가지고 있는 나 라에서는 예방대응이 신속하지 않다는 단점을 가지고 있다.
원인체인 구제역 바이러스(foot-and-mouth disease virus, FMDV)는 정방향의 외가닥 RNA바이러스로 1개의 ORF (open reading frame) 을 가지는 약 8.5 kb 염기로 이루어져 있 다. 뉴클레오캡시드(neucleocapsid)를 구성하는 4개의 구조 단백질(Structural Protein, SP) VP1, VP2, VP3, VP4 중 VP1에 바이러스 감염성과 중화항체의 생산을 유도하는 부위가 존 재함이 알려져 있다 [11]. 구제역예방의 중요부분으로 알려 진 VP1 (Viral protein 1)의 아미노산 잔기 141-160, 200-213 영역은 B 세포와 T 세포 에피토프(epitope, 항원결정기)로 작 용되며 VP1 내에 아미노산이 β-sheet 구조로 G-H loop가 존 재한다. G-H loop 내에는 세포 표면 수용체와 쉽게 결합할 수 있는 보존된 구조인 Arg-Gly-Asp (RGD) 영역을 포함하고 있다[12]. RGD 영역은 B 세포와 T 세포 에피토프로서 숙주 에서 중화항체를 유도할 수 있다 [13]. 이러한 주요 면역성 유도 부위를 이용한 백신 개발이 이루어지고 있다 [14]. 면역
조절 분자와 다중 VP1 에피토프를 조합하여 발현하는 Ad5 벡터를 시험하였다 [15,16]. B 세포 에피토프 합성폴리머 펩 타이드로 백신접종된 돼지는 구제역 감염에 대해 충분히 보 호되었다 [17].
IgG의 중쇄불변부위(Fc, Crystallizable fragment) 부분과 바 이러스를 결합한 불활화 백신 접종으로 항체 생산의 유도가 증가되어 바이러스 공격접종에 대한 방어능이 확인되었으 며 [18], 인간 IgG의 중쇄불변부위를 세포 표면에 발현한 인 간 IgG의 Fc 도메인이 탐식세포 표면의 Fc 수용체를 자극하 게 되면 탐식세포를 활성화시킬 수 있다 [19]. 또한 IgG 중쇄 불변부위는 B 세포 면역 반응과 세포매개 T 세포를 모두 자 극하여 항체의 생산을 증가시킨다 [20]. 돼지 면역글로불린 (IgG)의 중쇄불변부위와 VP1 에피토프 일부를 결합한 백신 은 돼지에서 FMDV 특이적 면역 반응을 유도 할 수 있음이 입증되었다 [21,22].
본 연구에서는 FMDV A, O 혈청형의 감염을 예방하기 위 해 면역반응을 유도할 수 있는 RGD 영역을 포함하는 에피 토프에 돼지 IgG 중쇄불변부위를 결합하여 재조합단백질 백 신을 설계하였다. 이 재조합단백질 백신은 각 혈청형의 특이 항체 생성과 공격접종시험(virus challenge test)에서 방어가 유도됨을 확인하였다.
2. MATERIALS AND METHODS
2.1. 재조합단백질 항원 설계
돼지 면역글로불린 (IgG) 중쇄불변부위의 N-말단에 FMDV A와 O 혈청형의 VP1 아미노산 잔기 141-160, 200-213 영역 을 펩타이드 링커 (GGSSGG)로 각각 3회 직렬중복으로 연결 하고, C-말단에 FMDV A 혈청형의 VP1 아미노산 잔기 141- 160, 200-213 영역을 3회 직렬중복하고, 양끝 말단에 His-tag 을 연결하였다 (Fig. 1).
2.2. 유전자 클로닝
설계된 재조합단백질 유전자 서열을 코돈 최적화 (codon optimization) 후 GenScript (New Jersey, USA)사에 화학적 합 성을 의뢰하였다. 합성된 유전자는 pET28b(+) 발현벡터에 제한효소 NdeI과 XhoI으로 절단하여 삽입되었다. pET28-재 조합단백질 유전자에 대한 서열분석 (sequencing analysis)을 통해 삽입된 목적유전자의 서열이 해당서열과 일치함을 확 인하였다.
2.3. 재조합단백질 발현과 정제 2.3.1. 재조합단백질의 발현
재조합단백질 발현 벡터는 대장균 BL21 (DE3) (RBC Bio- science, xindian, Taiwan)에 형질전환 시켜 발현 균주를 확보하 고 0.5 mM IPTG를 첨가한 후 5시간 동안 발현을 유도하였다.
8,500 rpm에서 20분간 원심분리하여 세포를 회수한 후, 고압
세포파쇄기(PandaPlus2000, GEA Niro Soavi, Italy)을 사용하
여 세포를 파쇄하여 봉입체 (inclusion body, IB)를 회수하였다.
2.3.2. 재조합단백질 정제
회수된 봉입체를 4시간 이상 가용화하여 봉입체 용해액을 준비하였다. 니켈-친화 크로마토그래피 (Ni-NTA affinity chromatography) 컬럼에 봉입체 용해액을 흡착시켜 용출된 분획은 투석기 (Vivaflow, USA)를 사용하여 용매교환 및 농 축하였다. 정제 완료된 재조합단백질을 확인하기 위하여 10%
SDS-PAGE 분석을 실시하고, Bradford 정량법 (Thermo Fisher scientific, Waltham, MA, USA)으로 농도를 결정하였다.
2.4. 백신 제조
정제가 완료된 재조합단백질 항원의 40%(v/v)에 60.0%(w/v) mineral oil로 채워서 18,000 rpm으로 20분간 균질화하여 밀 봉용기에 나누어 담아 냉암소(4
oC)에 보관하였다.
2.5. 동물실험 2.5.1. 기니피그
제조된 재조합단백질 백신의 효과를 목적 동물인 돼지에서 확인하기 앞서 최적의 백신 투여량 확인을 위한 항체양성 전 환율 시험을 기니피그에서 진행하였다. 구제역 바이러스 A형 과 O형에 대한 항체 형성을 확인하기 위해 4주령의 암컷 기니 피그 (약 250~300 g body weight)를 ㈜코사바이오 (Seongnam- si, Korea)에서 구입하여 사용하였다. 백신 접종 후 0일, 15일, 28일 42일째 기니피그 심장에서 혈액 5 mL을 채혈하여 분리 한 혈청에서 구제역 바이러스 A형과 O형에 대한 SP 항체형 성률을 확인하였다.
2.5.2. 돼지
목적 동물인 돼지에서 재조합단백질 백신의 최적 투여량을 확인하기 위하여 농장에서 10주령 돼지에 330 µg/mL의 백신 을 1 mL-단회접종, 1 mL-2회 접종과 2 mL-단회 접종, 2 mL-2회 로 구분하여 접종하였다. 재조합단백질 백신 2회 접종군은 1 차 접종 28일 후에 2차 접종을 실시하였다. 백신 접종 후 15 일, 28일, 42일째 돼지 경정맥에서 혈액 5 mL을 채혈하여 분 리한 혈청에서 구제역 바이러스 A, O 혈청형 각각의 SP 항 체형성률을 확인하였다.
2.6. 돼지 야외 임상시험
백신접종 후 91일 동안 항체형성률과 중화항체가를 확인하 기 위해 경북지방 3개의 양돈농가에서 8~10주령의 FMDV NSP 항체, FMDV A와 O 혈청형 SP 항체 모두가 음성인 돼 지, 총 81마리(27 마리/농장, 3농장)를 선정하여 사용하였다.
각 농장별로 백신군 돼지 22두와 미백신군 돼지 5두로 나누 어 시험하였으며, 접종방법은 우측 경부에 1두분 (2 mL)을 접종한 후, 4주 뒤 같은 방법으로 2차 접종하였다. 채혈은 백 신접종 후 0, 14, 28, 42, 56, 70, 84, 91일째 경정맥에서 채혈 하여 얻은 혈액으로부터 혈청을 분리한 후 –20
oC에 보관하 여 실험에 사용하였다.
2.7. ELISA
2.7.1. 비구조단백질 (Non-structural protein, NSP) 항체 ELISA FMD의 자연감염 여부를 조사하기 위하여 상용 ELISA Kit 로 NSP 항체의 존재유무를 확인하였다. VDPro FMDV NSP AB ELISA kit (Median diagnostics, Korea)는 재조합 FMDV 비구조단백질 3AB 항원이 흡착된 플레이트를 사용하는 것 으로서 제조사의 매뉴얼에 따라 검사를 실시하였다. 450 nm 의 파장에서 흡광도(Optical density, OD)를 측정하였고, 제조 사의 계산식 (가검시료 평균 OD/음성대조 평균 OD)에 따라 얻은 sample to positive (S/P) ratio 수치가 0.6 이하일 경우 양 성, 0.6 초과일 경우 음성으로 판정하였다.
2.7.2. 구조단백질 (Structural protein, SP) 항체 ELISA 구제역 백신접종 후 혈청에서 anti-FMDV 혈청형 A와 O의 구조단백질 항체를 확인하였다. 농림축산검역본부에서 권 장하는 PrioCheck FMDV ELISA Kit (Prionics Lelystad B.V., Netherlands) type A 와 type O를 각각 사용하여 제조사 매뉴 얼에 따라 실시하였다. 450 nm 파장에서 흡광도 (Optical density, OD)를 측정하였고, 제조사의 계산식{100-(corrected OD450 test sample/corrected OD450 max) × 100}으로 얻은 Percentage inhibition (PI)으로 환산하였으며, PI 수치가 50 이 상일 경우 양성, 50 미만일 경우 음성으로 판정하였다.
2.8. 바이러스중화시험 (Virus neutralizing test, VNT) 농림축산검역본부의 구제역 백신연구센터 생물안전 3등급 실험실에서 세계동물보건기구(OIE)에 제시된 동물에 대한 진단 검사 및 백신 매뉴얼에 따라 중화시험을 진행하였다.
비동화한 시험혈청을 2배 단계희석하여 준비하고, 혈청희석 액과 동일한 양의 바이러스를 100 TCID50 (tissue culture infective dose 50)/50 μL 되도록 첨가하여 37
oC, 5% CO
2배양 기에서 1시간 동안 반응하였다. LF-BK 세포(소 신장세포) (Swaney LM, 1988) 를 배양 플레이트에 첨가하고 3일후 세포 병변효과 (cytopathic effect, CPE)를 확인하였다. 50% 이상 세포병변효과가 확인된 희석 배수의 역수를 중화항체가로 하여 log10으로 산출하였다.
2.9. 공격접종시험 (Challenge test)
구제역 바이러스 공격접종시험을 통한 구제역 재조합단백 질 백신의 감염 방어율을 확인하였다. 동물실험은 농림축산 검역본부 동물실험윤리위원회(IACUC) 규정에 따라 진행하 였다 (IRB number: 20170926).
2.9.1. 병독성 바이러스 준비
구제역 백신연구센터의 생물안전 3등급 동물실험 시설에서
병독성 FMDV A/SKR/2010 (A/포천주)를 구제역 음성인 돼
지 2마리의 발굽패드에 10
4TCID50 이상 피내 투여한 후 생
긴 수포액을 채취하였다. 채취된 수포액은 구제역 바이러스
적정법 (titration)에 따라 역가 (titer)를 결정하여 바이러스를
준비하였다. 기간을 두어 같은 방법으로 FMDV O/SKR/2010
(O/안동주)도 준비하였다.
2.9.1.1 구제역 바이러스 적정법
96-well 배양 플레이트에 2 × 10
5cells/mL 으로 배양한 LF- BK 세포에 구제역 바이러스를 DMEM 배지에 10배 단계 희 석 후 well 당 100 μL씩 분주시킨 후, 1시간 감작시켰다. 3일 동안 배양 후, 현미경으로 세포병변효과 (cytopathic effect, CPE)를 관찰하고 CPE가 발생한 wells의 수를 이용하여 Spearman-Kärber method 로 구제역 바이러스의 TCID50을 계 산하였다.
2.9.2. 돼지 준비
공격접종시험은 구제역 NSP 항체, SP-A 항체, SP-O 항체가 음성인 8~10주령의 돼지 18 마리를 농장에서 선별하여 시험 하였다. 대조군은 구제역 항체가 없는 미백신군 2마리를 준 비하고, 백신접종군은 재조합단백질 백신 (330 µg/mL) 2 mL 을 우측 경부에 1차 접종하고 4주에 2차 접종한 후 2주차에 생물안전 3등급 동물사로 옮겼다.
2.9.3. 공격접종시험
백신의 감염 방어율을 확인하기 위해 백신접종군 돼지 16마 리와 미백신군 2마리, 총 18마리 돼지를 백신접종군 2차 접 종 후 2주차에 농림축산검역본부의 생물안전 3등급 동물사 에 옮긴 후 1일 계류하였다. 18마리 돼지에 병독성 구제역 바 이러스 10
4TCID50을 발굽의 제구부 피내 (intradermal) 직접 주사하여 감염 시켰다. 10일 동안 1일 1회 임상증상 관찰, 체 온 측정 및 구강 swab 채취를 실시하였다. 임상지표로 구제 역 감염이 확진된 돼지는 도태시켰다.
2.9.4. 공격접종 후 임상증상
구제역 감염 초기 증상인 발열, 무기력증, 식욕부진, 침흘림 증상이 나타나고 증상 경과로 40
oC 이상 발열, 수포, 파행으로 진행 시 구제역으로 확진하였다. 바이러스 접종 부위인 전우 측 발굽의 제구부 피내에 수포가 발생하는 경우에는 구제역
발병으로 보지 않았다. 구제역 임상증상 판정은 OIE 예방약 표준지침서(Manual of Vaccines for Terrestrial Animals)에 제시 된 감염 방어율시험(Percentage of protection against generalised foot infection, PPG)의 규정에 따라 실시하였다 [23].
2.9.5. 임상증상 평가 지표 및 스코어링
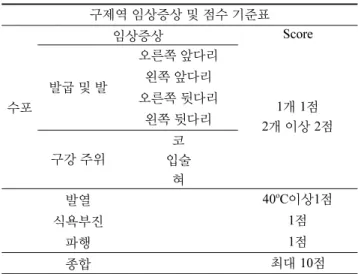
Table 1의 평가 지표에 따라 임상증상을 스코어링을 하였다.
2.10. 바이러스 검출
FMDV 접종 후 1일부터 10일까지 백신접종군 16마리와 미 백신군 2마리 돼지에서 타액과 혈액을 채취하였다. 채취한 샘플로부터 MagNA Pure 시스템 (Roche Diagnostics GmbH, Germany) 을 사용하여 바이러스 유전물질을 추출하였다. 구 제역 바이러스의 copy 수 계산을 위하여 AccuPower FMDV real-time RT-PCR master mix kit (BIONEER, Korea)를 사용 하였다. 검출되는 형광값은 QuantStudio3 system (Thermo scientific)을 이용하여 정량 분석하였다.
2.11. 통계 분석
본 연구 결과의 통계적 유의성은 GraphPad prism v7.0 (San Diego, CA, USA) 을 사용하여 Students t-test 및 Newman- Keuls test를 이용한 oneway ANOVA 방법으로 검증하여 분 석하였다 (*p <0.05, **p <0.01, ***p <0.001).
3. RESULTS
3.1. 재조합단백질 항원 설계
돼지 면역글로불린 (IgG) 중쇄불변부위의 N-말단에 FMDV A와 O 혈청형의 VP1 아미노산 잔기 141-160, 200-213 영역 을 펩타이드 링커 (GGSSGG)로 각각 3회 직렬중복으로 연결 하고, C-말단에 FMDV A 혈청형의 VP1 아미노산 잔기 141- 160, 200-213 영역을 3회 직렬중복시킨 아미노산 서열을 유 Table 1. Clinical scores for pigs
구제역 임상증상 및 점수 기준표
수포
임상증상 Score
발굽 및 발
오른쪽 앞다리
1개 1점 2개 이상 2점 왼쪽 앞다리
오른쪽 뒷다리 왼쪽 뒷다리
구강 주위 코
입술 혀
발열 40oC이상1점
식욕부진 1점
파행 1점
종합 최대 10점
Fig. 1. The structure of the recombinant protein.
Construction of a recombinant plasmid containing three copies of
two epitopes. represents the antigenic epitope corresponding to tandem-
repeat aa141to160, 200 to213 of VP1 of FMDV type A and O.
전자 최적화 (codon optimization)한 후 합성하여 확보하고, 발현 벡터에 삽입하여 재조합단백질 발현용 플라스미드 벡 터를 제작하였다 (Fig. 2).
3.2. 재조합단백질 발현 확인 및 정제
대장균 발현시스템에서 IPTG 유도로 불용성 단백질 (Insoluble protein) 형태의 봉입체로(Inclusion body) 발현되었으며, 예
상 분자량 79 kDa 크기에서 확인되었다 (Fig. 3(a)). FPLC 시 스템에서 His-tag이 표지된 불용성 단백질을 가용화하여 니 켈 컬럼에 흡착시킨 후 용출 및 농축과정을 거쳐 정제된 재 조합단백질을 회수하였다. 재조합단백질은 10% SDS-PAGE 전기영동을 통해 약 79 kDa의 분자량과 순도를 확인하였다 (Fig. 3(b)).
3.3. 기니피그에서 SP 항체 확인
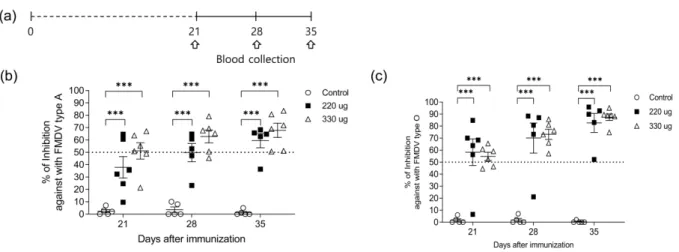
구제역 재조합단백질 백신 농도에 따른 항체형성 효능을 확 인하기 위하여 기니피그 대퇴부 근육 내에 재조합단백질 백 신 110 µg/head 또는 165 µg/head를 주사하였다. 기니피그는 21 일, 28일, 35일에 채혈하여 혈청내에 구제역 바이러스 A와 O형에 대한 항체형성을 확인하였다. 구제역 바이러스 A형 에 대한 항체형성률은 110 µg으로 접종하였을 때, 접종 후 28일 기준으로 60% 항체형성을 보였고, 165 µg으로 접종하 였을 때에는 80% 항체형성을 보였다. 접종 후 35일째에는 110 µg으로 접종한 군에서 80%, 165 µg으로 접종한 군에서 100% 항체형성을 보였다. 두 군 모두 점차적으로 평균 항체 형성률은 증가하는 경향을 확인하였다(Fig. 4(b)).
구제역 바이러스 O형에 대한 항체형성률은 접종 후, 28일 째 110 µg으로 접종한 군에서는 80% 그리고 165 µg으로 접 종한 군에서는 100% 항체형성을 확인하였으며, 접종 후 35 일 째에는 두 군 모두 100% 항체형성을 보였다. 하지만, 165 µg으로 접종한 군이 평균 항체형성률이 더 높았다. 구제 역 재조합단백질 백신의 투여량은 기니피그에서 165 µg으로 접종하였을 때, 높은 항체양성 전환율을 보였다. 재조합백신 접종으로 구제역 바이러스 A와 O형에 대한 항체형성능을 기니피그 동물실험에서 확인할 수 있었다 (Fig. 4(c)).
3.4. 백신 투여량 및 항체형성률 확인
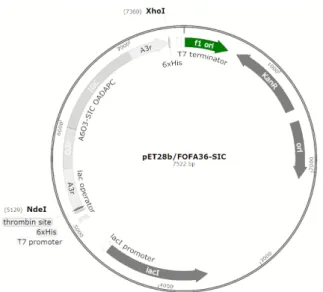
기니피그 사전 동물실험을 통해 330 µg/mL을 재조합단백질 기준용량으로 설정하고 재조합단백질 백신을 제조하였다. 실 Fig. 2. Schematic diagram for construction of recombinant protein
expression vector system.
The His-Tag peptide, the mature N-terminal and C-terminal repeats region are shown. Construction of a recombinant plasmid containing 3 (FMDV serotype O) and 6 (FMDV serotype A) times of VP1 epitopes (141-160 aa and 200-213 aa). Represents the antigenic epitope corresponding to tandem-repeat aa 141 to 160, 200 to 213 of VP1 of FMDV serotype A. Represents the antigenic epitope corresponding to tandem-repeat aa 141 to 160, 200 to 213 of VP1 of FMDV serotype O.
Fig. 3. The expression and purification of the recombinant FMDV proteins detected by SDS-PAGE.
(a) SDS-PAGE profiles of the expressed recombinant proteins w/ or w/o IPTG induction. Lane M: prestained protein ladder; Lane 1: E.
coli BL21(DE3) lysates without IPTG; Lane 2: E. coli BL21(DE3) lysates with 0.5 mM IPTG after 4 hours. (b) SDS-PAGE profile showing the affinity purification results using Ni-NTA resin. Lane M: prestained protein ladder; Lane 1: Inclusion body (IB); 2:
Unbound protein (Flow-through); 3: 50 mM Imidazole (washing step); Lane 4, 5, 6, 7, 8, 9: Eluted purified using 250 mM Imidazole
each elusion fraction.
제 목적동물의 체표면적 (BSA, body surface area) 환산법을 적 용하여 백신 투여량을 설정하였다. 재조합단백질 330 µg/mL 을 1 mL 또는 2 mL로 주사하였다. 또한 투여 횟수를 결정하 기 위해 각 투여군은 단회 혹은 2회 투여하였다. 목적동물인 10주령 돼지를 각 군당 6마리씩 설정하고 접종 전, 접종 후 15일, 28일, 42일에 각 개체의 혈액을 채취하여 구제역 바이 러스 A와 O형의 항체가를 확인하였다.
FMDV A 혈청형에 대한 항체양성률은 330 µg 접종군과 달 리 660 µg 접종군에서는 양성전환 시점이 접종 후 28일부터 나타났으며 PI값이 더 높았다. 또한 단회 혹은 2회 접종한 모 든 군에서 접종 후 42일간 점차적으로 항체양성률이 높아짐 을 확인하였다. FMDV O 혈청형에 대한 항체양성률은 A 혈 청형보다 660 µg으로 접종한 군에서 전반적으로 높은 항체형 성률을 보였으며 A 혈청형처럼 단회 혹은 2회 접종한 군에서 42일간 점차적으로 항체양성률이 높아지는 것을 확인하였다.
단회 접종군의 항체양성률은 660 µg 접종군에서 몇몇 개 체에서 나타났으나 전반적으로 항체양성률이 낮았고, 42일 째에는 330 µg 접종군에서 오히려 PI값이 A와 O 혈청형 모
두 낮아지는 경향을 나타내었다. 그러나 2회 접종군의 A와 O 혈청형에 대한 항체양성률은 접종 후 42일째에 모든 개체 가 양성 전환되었으며 PI값이 시간이 지날수록 증가하는 경 향이 나타났다 (Fig. 5).
3.5. 구조단백질 항체형성률 및 중화항체가 3.5.1. SP 항체형성률
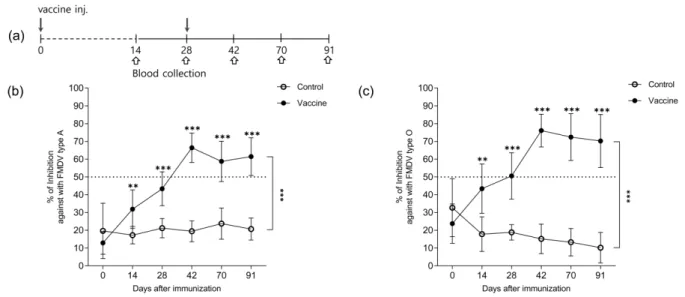
재조합단백질 백신 접종 후, 3개월 (0, 14, 28, 42, 69, 91일) 동안 FMDV A와 O 혈청형 구조단백질(SP)에 대한 항체형성 률을 확인하였다. 1차 접종 후 14일째부터 대조군에 비해 항 체양성률은 A와 O 혈청형 모두 유의하게 차이남을 확인하 였다. FMDV A 혈청형에 대한 항체는 42일째에 100% (63/
63) 항체양성율을 보였고, 70일째에는 81% (51/63), 91일째 에는 88.8% (56/63)로 나타났다 (Fig. 6(b)).
FMDV O 혈청형에 대해서는 42일째에 98.5%(62/63) 양성 전환율을 보였고, 91일째에는 90.5% (57/63) 항체양성율을 유지하였다(Fig. 6(c)).
Fig. 4. Humoral specific immune responses in recombinant protein vaccine immunized guinea pigs.
(a) Schematic view of immunization and blood sampling schedule (n = 6/each group). The percentage of inhibition against with FMDV serotype A (b) or O (c) were measured by ELISA in serum samples collected at day 21, 28, 35 after immunization. ***p < 0.01
Fig. 5. Dose define and injection time of recombinant protein vaccine.
Detection of FMDV specific antibody response in pig serum analyzed by competition ELISA assay (n = 6/each group). Blood samples
were collected at 0, 15, 28 and 42 days after immunization. The percentage of inhibition against with FMDV serotype A (a) or O (b) were
measured by ELISA in serum samples. The second injection group were injected twice interval of 4 weeks from post injection. *p < 0.05
3.5.2. 중화항체가
FMDV A (A/Pocheon/SKR/2010) 혈청형 중화항체가는 42일 째에 평균 1.96 log10 (혈청 91배 희석) 보였으며 91일째 평 균 1.53 log10 (혈청 32배 희석)이상으로 유지되었고 (Fig. 7 (a)), FMDV O (O/Andong/SKR/2010) 혈청형 중화항체가는 42일째 평균 1.79 log10 (혈청 61배 희석) 보였으며 91일째 평균 1.51 log10 (혈청 32배 희석) 이상으로 유지되었다 (Fig.
7 (b)). FMDV 중화항체가는 SP 항체가와 유사한 패턴으로 42 일째까지 지속적으로 증가하고, 91일까지 유지되었다.
3.6. 공격시험을 통한 임상증상 관찰
재조합단백질의 효력과 효능을 시험하기 위해, 목적동물인 돼 지에서 공격접종시험을 수행하였다. 재조합단백질 백신접종 군과 미접종군을 대조군으로 비교 시험하였다. 구제역 임상증 상이 나타나면 당일 도태시키고 필요한 샘플을 수집하였다.
3.6.1. Clinical signs
3.6.1.1. FMDV A 혈청형 (A/Pocheon/SKR/2010) 감염 대조군에서 병독성 FMDV 접종된 발에 2 dpc (days post challenge) 에 수포가 관찰되었고 체온은 3 dpc동안 40
oC 이하 Fig. 6. Specific antibody against two serotypes of FMDV in pigs.
(a) Immunization schedule for raising specific antibody against FMDV serotype structural proteins (SP) in three farms. Blood samples were collected at 0, 14, 28, 42, 70, 91 days post-vaccination for FMDV SP ELISA test. Detection of FMDV specific antibody response in serum analyzed. (b) PI values of type A SP-ELISA (PI >50) from sera of pigs vaccinated twice interval of 4 weeks with 660 µg recombinant FMD protein vaccine. (c) PI values of type O SP-ELISA (PI >50) from sera of pigs vaccinated twice interval of 4 weeks with 660 µg recombinant FMD protein vaccine. It increased continuously until day 42, and α-FMDV SP was maintained until day 91. *p
< 0.05, ** p < 0.01, ***p < 0.001.
Fig. 7. FMDV-specific immune responses in pigs measured by virus neutralizing antibody test.
Blood samples were collected at 0, 14, 28, 42, 70, and 91 days after immunization for the virus neutralizing antibody test. The neutralizing tests were measured against FMDV serotype A (a) and O (b). Each data points represents the mean ± SEM (control; n = 15, vaccine;
n = 66). Neutralizing antibody against two serotypes of FMDV were measured by VNT (1.21 log10 for positive baseline). *** p <0.001.
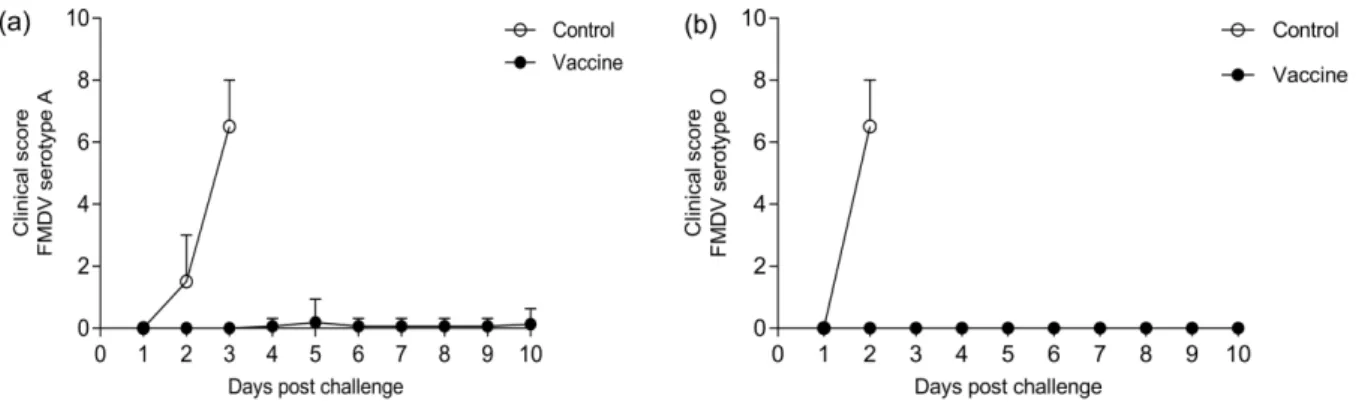
로 유지되었다. 병독성 FMDV가 접종되지 않은 나머지 발과 코에는 3 dpc에 수포 및 파행이 관찰되어 대조군 두 개체는 임상스코어 기준 5점을 초과한 3 dpc에 도태시켰다. 백신접 종군 15마리 돼지는 임상증상이 없었으나, 백신접종군 중 1 마리는 4 dpc부터 수포가 관찰되었고 매우 낮은 임상스코어 를 유지하였다 (Fig. 8(a)).
3.6.1.2. FMDV O 혈청형 (O/Andong/SKR/2010) 감염 대조군에서 병독성 FMDV가 접종된 발에 1 dpc에 수포가 관 찰되고 체온은 2 dpc 동안 40
oC 이하로 유지되었다. 병독성 FMDV가 접종되지 않은 나머지 발에 수포가 관찰되어 대조 군 두 개체는 임상스코어 기준 5점을 초과한 2 dpc에 도태시 켰다. 백신접종군 16마리 돼지는 10 dpc 동안 임상증상이 관 찰되지 않았다 (Fig. 8(b)).
3.6.2. Viremia 와 Virus shedding
3.6.2.1. FMDV A 혈청형 (A/Pocheon/SKR/2010) 감염 병독성 FMDV 접종 후, 대조군에서는 도태시점에 viremia와
shedding virus가 모두 검출되었다. 감염이 발생한 직후 백신 접종군 15마리 돼지는 바이러스가 검출되지 않았으나, 백신 접종군 중 한 마리 돼지의 3 dpc의 구강 면봉 샘플에서 바이 러스가 확인되었고, 7 dpc에서 검출 한계 이하로 떨어졌다.
혈중 바이러스는 확인되지 않았다 (Fig. 9(a)).
3.6.2.2. FMDV O 혈청형 (O/Andong/SKR/2010) 감염 백신접종군 모든 돼지는 병독성 FMDV O 접종 후 바이러스 가 검출되지 않았다. 모든 대조군 돼지는 감염이 발생한 직후 (1 dpc) 타액 및 혈청에서 바이러스가 검출되었다 (Fig. 9 (b)).
3.6.3. 공격접종 후 혈청 내 비구조단백질에 대한 항체 변화 FMDV 감염 후 대조군은 모두 2~3 dpc에 구제역 확진되어 도태시켰다. 구제역에 감염될 경우 NSP 항체는 감염 후 5~7 dpc에 검출가능한데 [24], 대조군 혈액에서 NSP 항체 형성이 확인되지 않았다. 백신접종군 중 FMDV A 혈청형에 감염된 1 마리 돼지는 10 dpc 혈청에서 NSP 항체에 대해 양성으로 확인되었으며, 백신접종군은 모두 NSP 항체에 음성이었다.
Fig. 8. Clinical scoring post challenge with FMDV virulent two serotypes.
The Clinical scores were determined by the addition of points distributed as follows criteria: lameness (1 point); vesicles on feet and hoof, dependent on the number of feet affected and with a maximum of 2 points; visible mouth lesions on the tongue (1 point), gums or lips (1 point), or snout (1 point), with a maximum of 3 points. (a) Challenge test for FMDV serotype A (A/Pocheon/SKR/2010) and (b) FMDV serotype O (O/Andong/SKR/2010) were tested until 10 days after FMDV inoculation, respectively.
Fig. 9. Clinical outcome of challenge test with virulent FMDV.
Viremia and nasal shedding virus copies were determined each group by qRT-PCR. Results were showed Mean ± SEM from (a) FMDV
serotype A (A/Pocheon/SKR/2010) and (b) FMDV serotype O (O/Andong/SKR/2010).
4. DISCUSSION
T 세포 에피토프가 탠덤 반복된 재조합 키메라 단백질은 단 일 항원 단백질 보다 면역원성을 증가시키는 것으로 알려져 있다 [25]. 또한 면역반응을 유도할 수 있는 항원의 면역원성 이 높아져 중화항체의 형성 및 감염 방어력이 강화되고 [26], 돼지 IgG 불변중쇄부분을 삽입하여 세포에서 항체 생산 유 도가 증가되었다 [21, 27]. 재조합단백질 구제역백신은 짧은 에피토프 펩타이드와 비교했을 때 면역원성이 강했으며 긴 반감기를 보였다 [28, 29, 30]. VP1 재조합단백질 구제역백신 이 기니피그와 돼지에서 강한 면역반응에 의해 중화항체를 유도하여 구제역 바이러스 감염으로부터 보호된다고 보고 되었다 [31].
본 연구에서는 재조합단백질 백신의 면역원성을 높이기 위해 돼지 IgG 중쇄불변부위를 중심으로 양말단에 FMDV A 와 O 혈청형에 대한 2종의 VP1 에피토프를 배열하고, 구제 역 바이러스 VP1 에피토프의 반복 배열 횟수를 FMDV A 혈 청형 6회, O 혈청형 3회 증가시켜 2가 백신으로 고안하였다.
효능평가에 앞서 재조합단백질 백신에 의한 구제역 바이러 스 중화항체가 형성되는 것을 확인하기 위해 예비 실험으로 기니피그에 접종하여 구제역 바이러스에 대한 특이항체를 확인하였다. 목적동물 돼지에서도 FMDV A와 O 혈청형 각 각에 대한 SP 항체가 100% 형성됨을 확인하였다. 또한 돼지 의 혈청 내 특이항체의 구제역 바이러스 중화능을 확인한 결 과 91일 동안 FMDV A 혈청형(포천주) 중화항체가는 평균 1.53 log10, FMDV O 혈청형(안동주) 중화항체가는 평균 1.51 log10 으로 유지되었다. 이러한 재조합단백질 백신으로 유도된 이러한 중화항체가 바이러스의 재감염이나 바이러 스가 혈류를 따라 전파되는 것을 억제하는데 매우 효과적으 로 작용한다고 보고되었다 [32].
재조합단백질 백신 접종으로 면역화된 돼지에게 직접 병 독성 바이러스를 접종하여 감염 방어능을 확인하기 위해 Podal Generalization (PPG) 시험방법에 따라 공격접종을 설 계하였다. 유럽약전(European Pharmacopoeia)과 OIE에 제시 된 백신 품질평가의 기존 표준실험은 백신역가시험(PD50 시험)이었지만, 최근 백신의 전체 투여용량으로 시험되는 감 염방어율(Percentage of protection against generalised foot infection, PPG) 시험이 추가되었다. OIE 매뉴얼과 유럽약전 에서 정규 백신 접종에 사용할 예정인 백신에 대해, 백신의 예방효과는 PPG 시험에서 감염방어율이 90% 이상인 경우 구제역을 최소한 75% 이상 방어한다고 제시하고 있다 [23].
이를 토대로 구제역백신의 감염 방어능 확인을 위해 백신 투 여용량 전량으로 면역화한 돼지를 대상으로 병독성 균주를 접 종하여 감염 여부를 판정하는 공격접종시험 (virus challenge test)을 설계하였다 [33]. 본 연구의 PPG 시험에서는 미백신 대 조군과 백신접종군 돼지를 비교하여 바이러스 배출, 구제역 임상증상을 평가하였다. 본 실험에 사용된 재조합단백질 백 신으로 면역화된 백신접종군에서는 FMDV O 혈청형(안동 주) 균주를 감염시킨 전 개체 (16마리)에서 구제역 특유의 임
상증상인 수포가 발생하지 않았고 (100% PPG값), FMDV A 혈청형 (포천주) 균주를 감염시킨 16마리 중 15마리 (93.7%
PPG값)에서도 구제역 감염증상이 관찰되지 않았다. 여기에 서 얻은 90% 이상의 PPG 시험결과는 구제역 방역 목적으로 현재 상용화된 고역가 6PD50 이상 역가의 백신과 동등한 방 어 역가임을 보여주고 있다 [34,35,36,37,38].
공격접종시험에서 구제역 임상증상이 관찰된 미백신 대조 군 돼지의 구강 면봉에서 분리된 배출 바이러스는 2~3일째 에 검출되었다. 반면 본 연구의 재조합단백질 백신접종군에 서는 구제역 감염 후 10일 동안 FMDV 배출 및 임상증상이 없었으며, 이전 연구와 같이 임상증상이 없는 동물은 바이러 스혈증 (viremia)을 발생시키지 않는다는 사실을 입증하였다 [39,40,41,42]. 대조군과 백신접종군의 구제역 임상증상 및 바이러스 배출은 유의적인 차이를 보였다 (p >0.005).
본 연구에서 개발한 구제역 재조합단백질 백신은 우제류 의 구제역 감염에 대한 감수성 감소와 바이러스 배출을 줄이 고, 국내에서 최근 발생한 FMDV 안동주와 포천주의 확산 및 전파를 막는 역할을 할 것으로 기대되며, 이는 향후 발생 이 우려되는 다양한 구제역 바이러스 혈청형에 대한 효과적 인 예방 백신 개발로 이어질 것임을 시사한다.
5. CONCLUSION
본 연구의 구제역 예방 재조합단백질 백신은 국내 최초의 돼 지를 이용한 공격접종시험에서 구제역 감염 예방에 대하여 현저하게 우수한 효능을 보였다. 뿐만 아니라 2가 백신으로 고안되어 하나의 재조합단백질로 구제역 바이러스 2종 혈청 형을 동시에 예방하는 결과를 얻을 수 있었다. 재조합단백질 구제역 예방백신에 의해 형성된 체내 면역이 바이러스의 증 식을 억제시켜 발병에 따른 임상증상이 완화되거나 동시에 배출하는 바이러스의 양이 감소되어 인근 가축에게 구제역 바이러스의 전파를 방어할 수 있을 뿐만 아니라 지속적으로 방어능을 유지시킬 수 있음을 시사한다. 이러한 결과로 향후 다양한 구제역 바이러스 혈청형에 대한 효과적인 다가 백신 개발을 기대하게 하며, 이는 국가 구제역 방역체계에서 전국 적인 확산을 최소화하는데 기여하고 선진화된 구제역 예방 백신을 확보할 수 있을 것으로 사료된다.
본 연구의 중요성은 기존의 FMDV 불활성화 사백신을 대 체하는 비바이러스성 재조합단백질 백신 개발 가능성뿐만 아니라 그 동안 수입에 의존해 온 구제역백신을 향후 순수한 국내기술로 대체할 수 있다는 점에서 그 의의가 크다고 할 수 있다.
Acknowledgements
이 논문은 2020년도 농림축산식품부 주관으로 가축질병대응
기술 연구개발사업 진행과제에 대한 성과로써 작성되었음.
REFERENCES
1. Grubman, M. J. and B. Baxt (2004) Foot-and-mouth disease. Clin Microbiol Rev. 17: 465-493.
2. Davies, G. (2002) Foot and mouth disease. Res Vet Sci. 73: 195- 199.
3. Sørensen, J. H., D. K. J. Mackay, C. O. Jensen and A. I. Donald- son (2000) An integrated model to predict the atmospheric spread of foot-and-mouth disease virus. Epidemiol Infect. 124: 577-590.
4. Yoo, H.S. (2011) Foot and Mouth Disease: Etiology, Epidemiol- ogy and Control Measures. Infect Chemother. 43: 178-185.
5. Donaldson, A.L. and S. Alexandersen (2002) Predicting the spread of foot and mouth disease by airborne virus. Int. Epizoot. 21: 569- 575.
6. Kitching, R.P. (2002) Clinical variation in foot and mouth disease:
cattle. Rev Sci Tech. 21: 499-504.
7. Alexandersen, S., Z. Zhang, A. L. Donaldson and A. J. Garland (2003) The pathogenesis and diagnosis of foot-and-mouth disease.
J Comp Pathol. 129: 1-36.
8. Sobrino, F., M. Sáiz, M. A. Jiménez-Clavero, J. I. Núñez, M. F.
Rosas, E. Baranowski. and V. Ley (2001) Foot-and-mouth dis- ease: a long known virus, but a current threat. Vet Res. 32: 1-30.
9. Doel, T.R. (2003) FMD vaccines. Virus Res. 91: 81-99.
10. Cottam E. M., W. Jemma and J. K. Nick (2008) Transmission Pathways of Foot-and-Mouth disease virus in the Kingdom in 2007. Plos Pathog. 4: e1000050-1000055
11. Barteling, S.J. (2002) Development and performance of inacti- vated vaccines against foot and mouth disease. Rev Sci Tech. 21:
577-588.
12. Sobrino, F. and E. Domingo (2004) Foot and mouth disease: cur- rent perspectives. 1st ed, pp.125. Horizon Bioscience, Wymond- ham, Norfolk, England.
13. Wang, C. Y., T. Y. Chang, A. M. Walfield, J. Ye, M. Shen and S. P.
Chen (2002) Effective synthetic peptide vaccine for foot-and- mouth disease in swine. Vaccine. 20: 2603-2610.
14. Lyons, N. A., Y. S. Lyoo, D. P. King and D. J. Paton (2016) Chal- lenges of generating and maintaining protective vaccine-induced immune responses for foot-and-mouth disease virus in pigs. Front Vet Sci. 30: 102-105.
15. Du, Y., P. Jiang, Y. Li, H. He, W. Jiang, X. Wang and W. Hong (2007) Immune responses of two recombinant adenoviruses expressing VP1 antigens of FMDV fused with porcine granulo- cyte macrophage colony-stimulating factor. Vaccine. 25: 8209- 8219.
16. Du, Y., Y. Li, H. He, J. Qi, W. Jiang, X. Wang, B. Tang, J. Cao, X.
Wang and P. Jiang (2008) Enhanced immunogenicity of multiple- epitopes of foot-and-mouth disease virus fused with porcine inter- feron alpha in mice and protective efficacy in guinea pigs and swine. J. Virol. Methods. 149: 144-152.
17. Blanco, E., B. Guerra and B.G. Torre (2016) Full protection of swine against foot-and-mouth disease by bivalent B-cell epitope dendrimer peptide. Antiviral Res. 129: 74-80.
18. Takashima, Y., M. Tsukamoto and H. Ota (2005) Immunization with pseudorabies virus harboring Fc domain of IgG makes a con- tribution to protection of mice with lethal challenge. Vaccine. 23:
3775-3782.
19. Stabila, P. F., S. C. Wong, F. A. Kaplan and W. Tao (1998) Cell surface expression of a human IgG Fc chimera activates macro- phages through Fc receptors. Nat Biotechnol. 16: 1357-1360.
20. Pratt, K. P. and A. R. Thompson (2009) B-cell and T-cell epitopes in anti-factor VIII immune responses. Clin Rev Allergy Immunol.
37: 80-95.
21. Li, G., W. Chen, W. Yan, K. Zhao, M. Liu, J. Zhang, L. Fei, Q. Xu, Z. Sheng, Y. Lu and Z. Zheng (2004) Comparison of immune responses against foot-and-mouth disease virus induced by fusion proteins using the swine IgG heavy chain constant region or beta- galactosidase as a carrier of immunogenic epitopes. Virology. 328:
274-281.
22. Shao, J. J., C. K. Wong, T. Lin, S. K. Lee, G. Z. Cong, F. W. Sin, J.
Z. Du, S. D. Gao, X. T. Liu, X. P. Cai, Y. Xie, H. Y. Chang and J.
X. Liu (2011) Promising multiple-epitope recombinant vaccine against foot-and-mouth disease virus type O in swine. Clin and vaccine Immunol. 18: 143-149.
23. OIE Terrestrial Manual (2017) Chapter 2.1.5. Foot and mouth dis- ease, requirements for vaccines and diagnostic biologicals (tests on the final product: potency). vol. 2: 20-21.
24. Crowther, J. and F. Joint (2007) The use of non-structural proteins of foot and mouth disease virus (FMDV) to differentiate between vaccinated and infected animals.; IAEA-TECDOC-1546: 3-48.
25. Kjerrulf, M., B. Löwenadler, C. Svanholm, and N. Lycke, (1997) Tandem repeats of T helper epitopes enhance immunogenicity of fusion proteins by promoting processing and presentation. Mol Immunol. 34: 599-608.
26. Donald, N.F. (2014) Functions of Antibodies. Microbiol Spectr. 2:
1-17.
27. Chan, E.W.C, H. T. Wong, S. C. S. Cheng, W. Y. Yan, Z. X.
Zheng, Z. T. Sheng, L. Q. Zhu and Y. Xie (2000) An immunoglob- ulin G based chimeric protein induced foot-and-mouth disease specific immune response in swine. Vaccine. 19: 538-546.
28. Bona, C., T. D. Brumeane and H. Zaghouani (1994) Immunoge- nicity of microbial peptides grafted in self immunoglobulin mole- cules. Cell. Mol. Biol. 40: 21-30.
29. Clarke, B. E., S. E. Newton, A. R. Carroll, M. J. Francis, G. Apple- yard, A. D Syred, P. E. Highfield, D. J. Rowlands and F. Brown (1987) Improved immunogenicity of a peptide epitope after fusion to hepatitis B core protein. Nature. 330: 381-384.
30. Zhao, K., G. H. Chen, Z. Y. Zhang, W. Y. Yan and Z. X. Zheng (2000) Using swine self IgG H chain as a carrier to construct a recombinant vaccine against type O foot-and-mouth disease virus infection. Chin. J. Biotechnol. 16: 679-683.
31. Cubillos, C., G. Beatriz, B. G. Torre, J. Bárcena, D. Andreu, F.
Sobrino and E. Blanco (2012) Inclusion of a specific T cell epi- tope increases the protection conferred against foot-and-mouth dis- ease virus in pigs by a linear peptide containing an immunodo- minant B cell site. Virology Journal. 9: 66-70.
32. Charan, S., H. Hengartner and R. M. Zinkernagel (1987) Antibod- ies against the two serotypes of vesicular stomatitis virus mea- sured by enzyme linked immunosorbent assay: immunodominance of serotype specific determinants and induction of asymmetrically cross-reactive antibodies. Virology Journal. 61: 2509-2514.
33. Goris, N., E. Maradea, R. D’Aloia, N. Fondevila and N. Mattion (2008) Foot-and-mouth disease vaccine potency testing in cattle
using homologous and heterologous challenge strains: Precision of the “Protection against Podal Generalisation” test. Vaccine. 26:
3432-3437.
34. Vianna Y.L., V. Astudillo, I. Gomes, G. Fernandez, C. E. Rozas and J. A. Ravison (1993) Potency control of foot-and-mouth dis- ease vaccine in cattle. Comparison of the 50% protective dose and the protection against generalization. Vaccine. 11: 1424-1428.
35. Ahl, R., B. Haas, R. J. Lorenz and G. Wittmann (1990) Alternative potency test of FMD vaccines and results of comparative antibody assays in different cell systems and ELISA. Report of the Session of the Research Group of the Standing Technical Committee of the European Commission for the Control of Foot-and-Mouth Dis- ease. Lindholm, Denmark, 25-29 June: 51-90.
36. Barnett, P.V., R. J. Statham, W. Vosloo and D. T. Haydon (2003) Foot-and-mouth disease vaccine potency testing: determination and statistical validation of a model using a serological approach.
Vaccine. 21: 3240-3248.
37. Mouton, L., A. Dekker, M. Bleijenberg, M. Blanchet, M. Martin, P. Hudelet and S. Goutebroze (2018) A foot-and-mouth disease SAT2 vaccine protects swine against experimental challenge with a homologous virus strain, irrespective of mild pathogenicity in
this species. Vaccine. 36: 2020-2024.
38. Waters, R., A. B. Ludi and V. L. Fowler (2018) Efficacy of high- potency multivalent foot-and-mouth disease virus vaccine in cattle against heterologous challenge with a field virus from the emerg- ing A/ASIA/G-VII lineage. Vaccine. 36: 1901-1907.
39. Francis, M.J. and L. Black (1983) Antibody response in pig nasal fluid and serum following foot-and-mouth disease infection or vaccination. J. Hyg. 91: 329-334.
40. Cox, S.J., C. Voyce, S. Parida, S. M. Reid, P. A. Hamblin and D. J.
Paton (2005) Protection against direct-contact challenge following emergency FMD vaccination of cattle and the effect on virus excretion from the oropharynx. Vaccine. 23: 1106-1113.
41. Cox, S.J., C. Voyce, S. Parida, S. M. Reid, P.A. Hamblin and G.
Hutchings (2006) Effect of emergency FMD vaccine antigen pay- load on protection, sub-clinical infection and persistence follow- ing direct contact challenge of cattle. Vaccine. 24: 3184-3190.
42. Harmsen, M. M., H. P. Fijten, B. Engel, A. Dekker and P. L. Eblé (2008) Passive immunization of pigs with bispecific llama single- domain antibody fragments against foot-and-mouth disease and porcine immunoglobulin. Vet Microbiol. 132: 56-64.