석사학위 청구논문
Chemisorption of small organic molecules having functional groups on Si(001)2×1 surfaces
국 민 대 학 교 대 학 원 화 학 과 물 리 화 학 전 공
황 한 나
2002
석사학위 청구논문
Chemisorption of small organic molecules having functional groups on Si(001)2×1 surfaces
지도교수 성 명 모 김 윤 수
이 논문을 이학 석사학위 청구논문으로 제출합니다.
2002년 12월 일
국 민 대 학 교 대 학 원 화 학 과 물 리 화 학 전 공
황 한 나
2002
이 논문을 황한나의 이학 석사학위 논문으로 인정함
2002년 12월 일
심사위원장 곽 현 태
심 사 위 원 박 찬 량
심 사 위 원 성 명 모
요 약
작용기를 가지는 작은 유기 분자들과 Si(001)2×1 표면과의 화학 흡착
저에너지 전자 회절법 (LEED), X선 광전자 분광법 (XPS), 자외선 광전자 분광법 (UPS), Auger 전자 분광법 (AES), 열탈착 분광법 (TDS), 및 방사광 가속기 (SRPES)를 이용한 광전자 분광법을 통하여 Si(001)2×1 표면 위에서 의 다 작용기를 가지는 유기 분자의 화학적 반응성과 열적 안정성 등에 관한 연구를 수행하였다.
4-Mercapto-1-butanol (MB) 분자는 실온에서 OH 기와 SH 기의 S와 O 원자가 Si dimer 원자의 dangling bond와 화학 결합을 이루면서 표면에 평 행하게 흡착한다. 기질의 온도가 증가하면서 Si(001)2×1 표면에 흡착한 MB 분자는 S와 O 원자로부터 alkyl chain이 해리하여 250 °C에서는 butene, 350
°C에서는 etylene으로 탈착한다. Butene과 etylene이 탈착한 후 C 1s peak의 세기는 50 % 정도 감소하고 표면에 남아 있는 일부 alkyl chain은 새로 생긴 Si 원자의 dangling bond와 Si-C 결합을 형성한다. 500 °C 이상에서는 S, O 원자의 탈착과 함께 C 원자의 확산으로 Si1-xCx에 의한 c(4×4) 구조가 나타 난다.
Vinylacetic acid (VAA) 분자는 실온에서 Si(001)2×1 표면 위에 흡착할 때 Si dimer 구조를 유지하면서 unidentate 형태로 화학 결합을 이룬다. 이러한 반응은 C=C 기에 의한 [2+2]고리화 첨가반응이 아닌 COOH 기의 해리 반응 으로 RCOO*와 H*가 각각 Si dimer 원자와 결합을 형성한다. Si 2p 핵심부 준위 스펙트럼의 fitting 결과에서 VAA의 포화 흡착에 의한 새로운 두 개의 성분 (SO, SH)이 나타났다. SO, SH 성분은 각각 Si-OOCR, Si-H 결합의 기여 로 나타난 것이다. C 1s 스펙트럼에서 O=C-O, -C-C-, -C=C 결합에 의한
세 가지 성분과 O 1s 핵심부 스펙트럼에서 Si-O, C=O 결합에 의한 두 가지 성분이 관찰되었다. 그리고 C=C 기나 C=O 기에 의한 [2+2]고리화 첨가반응 또는 hetero-[2+2] 반응의 기여로 생기는 성분은 나타나지 않았다. LEED와 C 1s, O 1s 및 Si 2p 핵심부 준위 스펙트럼을 통해 VAA 분자의 해리 및 탈 착에 관한 연구를 수행하였다.
1,3-Butadiene (BD) 분자는 Si(001)2×1 표면 위에서 [4+2]고리화 첨가반응 에 의해 Si dimer 원자와 고리 화합물을 형성한다. BD이 포화 흡착한 Si 2p 핵심부 준위 스펙트럼의 fitting 결과에서 Si-C 결합에 의한 1개의 성분이 관 찰되었다. 흡착한 BD의 최상층과 둘째 층의 C 원자는 화학적 환경이 다름에 도 불구하고 C 1s 핵심부 준위 스펙트럼에서 1개의 성분만 나타났다. 그러나 가전자 스펙트럼에서는 최상층의 C 이중 결합 그리고 Si 원자와 결합한 둘 째 층의 C 원자의 기여에 의해 σ (Si-C), π (C=C), σ (C-C), 및 σ (C=C) 성 분들이 관찰되었다. 또한 Si 표면 위에서의 금속-유기 분자의 다층막 형성을 시도해 보기 위해 알칼리 금속 중 칼륨 (K)을 BD이 흡착된 Si 표면 위에 흡 착시켰다. LEED와 AES를 통해 다층막의 가능성을 확인하였다.
2-Silyl-1,3-disilacyclopent-4-ene (SDC) 분자를 Si(001)2×1 표면 위에 5 L 정도 노출시킨 후 측정한 Si 2p 핵심부 준위 스펙트럼과 가전자대 스펙트 럼에서 Si 표면와 SDC 분자의 화학 결합에 의해 표면 성분이 완전히 사라지 고 Si dimer 구조를 유지한다. SDC 분자와 Si 표면 사이의 화학 결합은 [2+2]고리화 첨가반응에 의한 것으로 추측되지만 본 연구 결과에서는 확실한 근거를 제시하지 못하였다. Si 2p와 C1s 핵심부 준위 스펙트럼의 fitting 결 과에서 흡착한 SDC 분자 안의 화학적 환경이 다른 각 원자들의 기여로 인 해 나타나는 성분들이 관찰되었다. SDC 분자는 310 °C에서 ethylene으로 탈 착하고 탈착 후에는 SiC 표면에 의한 2×2 구조가 관찰된다.
List of Tables
표 1. Surface core level shifts (SCLSs) and intensity ratio of all surface components relative to bulk component for Si 2p core level spectra.
표 2. Surface core level shifts (SCLSs) relative to C1 (-C-C) component for C 1s core level spectra and binding energy for O 1s core level spectra, intensity ratios of all components relative total intensity for spectra and Gaussian width.
표 3. Fitting parameter for Si 2p and C 1s core level spectra.
List of Figures
그림 1. Three- and two-dimensional structures of Si(001) surface.
그림 2. Energy level diagram.
그림 3. Possible reaction pathways for EVK on Si(001)2×1 surface.
그림 4. 4-Mercapto-1-butanol (MB) molecule.
그림 5. Possible reaction pathways for MB on Si(001)2×1 surface.
그림 6. Vinylacetic acid (VAA) molecule.
그림 7. Possible reaction pathways for VAA on Si(001)2×1 surface.
그림 8. 1,3-Butadiene (BD) molecule.
그림 9. Possible reaction pathways for BD on Si(001)2×1 surface.
그림 10. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) molecule.
그림 11. Possible reaction pathways for SDC on Si(001)2×1 surface.
그림 12. LEED optics.
그림 13. Examples for overlayer structures and their patterns.
그림 14. Schematic energy diagram for photoemission from solid EK, E1s and e are the kinetic energy of photoelectron, binding energy of 1s core electron, and work function, respectively.
그림 15. Schematic illustration of the photoelectron spectroscopy of bulk solid and surfaces. The major surface contribution in a photoelectron spectrum are the surface states in valence bands and surface core levels.
그림 16. Schematic experimental arrangement for photoelectron spectroscopy of solid surface.
그림 17. "Universal curve" for mean free path of electrons in solids as a function of their kinetic energy.
그림 18. (a) 방사광 발생, (b) 포항 방사광 가속기의 구성.
그림 19. LEED pattern and unit cell of clean Si(001)2×1 surface, schematic illustration of double-domain of 2×1 and 1×2 surface.
그림 20. Si 2p core level curve fitting of clean Si(001)2×1 surface at RT.
그림 21. (a) S 2p (b) O 1s core level curve fitting of MB-saturated Si(001)2×1 surface at RT.
그림 22. C 1s core level curve fitting of MB-saturated Si(001)2×1 surface at RT.
그림 23. LEED patterns of (a) MB-saturated Si(001)2×1 surface at RT and (b) c(4×4) structure at 600 °C
그림 24. Intensity ratio variation of C 1s, S 2p and O 1s XP spectra as a function of annealing temperature.
그림 25. Thermal desorption spectra of MB-saturated Si(001)2×1 surface.
그림 26. C 1s core level curve fitting of (a) MB-saturated Si(001)2×1 surface at RT and (b-f) the annealed surface.
그림 27. LEED patterns of (a) clean and (b) VAA-saturated Si(001) 2×1 surface at RT.
그림 28. Si 2p core level curve fitting of (a) clean 2×1 (b-d) 1 L, 2 L, 5 L exposures at normal emission and (e) 5 L exposure at θe = 60°
그림 29. (a) O 1s and (b) C 1s core level curve fitting for VAA-saturated at RT.
그림 30. Some possible way for coordination of carboxylate ion with a metal.
그림 31. Schematic illustration of dissociative adsorption of VAA on Si(001)2×1 surface.
그림 32. Intensity ratio variation of C 1s and O 1s core level spectra as a function of annealing temperature and (1×1) LEED pattern at 350 °C.
그림 33. O 1s core level curve fitting of (a) the VAA-saturated Si(001)2×1 surface at RT and (b-d) the annealed surface.
그림 34. Si 2p core level curve fitting of (a) the VAA-saturated Si(001)2×1 surface at RT and (b-f) the annealed surface.
그림 35. Intensity ratio variation of components for Si 2p core level spectra as a
function of annealing temperature.
그림 36. Initial state of surface oxidation and their surface core level shifts.
그림 37. C 1s core level curve fitting of (a) the VAA-saturated Si(001)2×1 surface at RT and (b-e) the annealed surface.
그림 38. Intensity ratio variation of components for C 1s core level spectra as a function of annealing temperature.
그림 39. Si 2p core level curve fitting of BD-saturated Si(001)2×1 surface at RT.
그림 40. LEED pattern of BD-saturated Si(001)2×1 surface at RT.
그림 41. C 1s core level curve fitting of BD-saturated Si(001)2×1 surface at RT.
그림 42. Valence band spectra with increasing exposed of BD on Si(001)2×1 surface at RT.
그림 43. K(LLV) peak intensity ratio of AES with increasing exposed K on clean and BD/Si(001)2×1 surface at RT.
그림 44. Model of (a) K on clean Si(001)2×1 and (b) K on BD/Si(001)2×1 surface.
그림 45. STM image of 0.5 L exposed SDC on clean Si(001)2×1 surface.
그림 46. Si 2p core level spectra of (a) clean 2×1 (b-d) 0.2 L, 1 L, 5 L exposure at normal emission and (e) d)-a) spectrum.
그림 47. Si 2p core level curve fitting of (a) clean 2×1 (b-c) 0.4 L, 5 L exposure at normal emission and (d) clean 21 (e-f) 0.4 L, 5 L exposure at θe = 60°.
그림 48. C 1s core level curve fitting of (a) normal emission and (b) θe = 60° at SDC-saturated Si(001)2×1 surface.
그림 49. LEED pattern of (a) SDC-saturated Si(001)2×1 surface at RT (b) diffuse 1×1 structure at 400 °C (c) diffuse 2×2 structure at 600 °C . 그림 50. Thermal desorption spectra of SDC-saturated Si(001)2×1 surface and
intensity ratio variation of C 1s core level spectra as a function of annealing temperature (inset).
그림 51. Si 2p core level spectra as a function of annealing temperature at normal emission and subtracting a) spectrum from each spectrum.
그림 52. Si 2p core level spectra as a function of annealing temperature at θe = 60° and subtracting a) spectrum from each spectrum.
목 차
요약...ⅰ List of Tables...ⅲ List of Figures...ⅳ
Ⅰ. 서론
Ⅰ-1. 연구 배경 ...1
Ⅰ-2. Si(001)2×1 표면 ...2
Ⅰ-3. 작용기를 가지고 있는 유기 분자들의 흡착 메커니즘 ...5
가. 불포화 탄화수소 (unsaturated hydrocarbon) ...6
나. 다른 작용기 (OH, COOH, C=O)를 가지는 유기 분자들 ...7
Ⅰ-4. 실험 목적 및 실험에 사용된 유기 분자 소개 ...9
가. 4-Mercapto-1-butanol (MB) ...10
나. Vinylacetic acid (VAA) or 3-Butenoic acid ...13
다. 1,3-Butadiene (BD) ...14
라. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) ...16
Ⅱ. 실험 Ⅱ-1. 실험 방법 ...18
가. 깨끗한 Si(001)2x1 표면의 준비 ...18
나. 유기 분자의 흡착 및 탈착 ...19
Ⅱ-2. 표면 분석 방법 및 이론 ...20
가. 저에너지 전자 회절법 (LEED) ...20
나. 열탈착 분광법 (TDS) ...23
다. 광전자 분광법 ...23
다. Curve fitting ...30
Ⅲ. 결과 및 논의 Ⅲ-1. Clean Si(001)2×1 ...31
Ⅲ-2. 4-Mercapto-1-butanol (MB) ...34
Ⅲ-3. Vinylacetic acid (VAA) ...45
Ⅲ-4. 1,3-Butadiene (BD) ...64
Ⅲ-5. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) ...71
Ⅳ. 결론 Ⅳ-1. 4-Mercapto-1-butanol (MB) ...81
Ⅳ-2. Vinylacetic acid (VAA) ...81
Ⅳ-3. 1,3-Butadiene (BD) ...82
Ⅳ-4. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) ...83
Ⅴ. 참고 문헌 ...84
Ⅰ. 서론
Ⅰ-1. 연구 배경
산업 사회의 중심에 증기 기관의 발명으로 대표되는 기계공학이 있었다면 정보화 사회의 중심에는 트랜지스터의 발명을 필두로 한 전자 공학이 있고 또한 정보화 사회의 바탕에는 어느 곳이나 반도체가 있다.
반도체 산업의 주역인 제 1세대 반도체 규소 (silicon, Si)는 특히 전자 자 기 소자에 범용되고 있다. 제 2․3세대 반도체 즉 화합물 반도체에 대한 연 구도 진행되고 있지만 여전히 반도체 산업에 이용되고 있는 규소는 다른 반 도체 물질보다 자원이 풍부하고 반도체로서의 좋은 특성을 지녀 현재 가장 많이 사용되고 있다.
킬비 박사는 “한 조각 실리콘 위에 저항, 커패시터, 트랜지스터, 다이오드 를 함께 만들면 많은 전기 회로를 극도로 축소할 수 있다”라는 문구를 연구 노트에 적어 놓기도 했는데 마이크로 또는 나노소자 기술에서 그만큼 더 작 고 더 효율적이고 더 간편하고 더 쉽게 작동하는 고성능 소재를 요구하고 있 다. 근래에는 반도체 표면과 유기 물질과의 반응성에 대한 연구가 다방면에 서 이루어지고 있는데 그 이유 역시 molecular electronic devices, chemical/biological sensors 등으로 응용할 수 있기 때문이다 [1-3]. 최근 많 은 관심이 집중되고 있는 단일 전자를 이용하는 차세대 전자 소자나 Lab-on-a chip에 관한 연구가 그 대표적인 예라고 할 수 있는데 이는 모두 표면과 유기 물질 간의 반응성에 기본을 두고 있다.
유기 화합물은 현재 반도체 제조 공정에서 photoresistor (PR) 등으로 실제 사용되고 있지만 열적 안정성과 같은 단점으로 인해 그 이용 범위가 한정적 이다. 그럼에도 불구하고 표면 성질의 변화를 유도해 원하는 표면 성질을 부 여할 수 있고 표면 반응을 제어하는 데 있어 그 응용성이 매우 크므로 이에 대한 보다 자세하고 기초적인 연구가 많이 진행되어야 할 것이다.
표면과 유기 분자와의 순수한 화학 반응을 연구하기 위해서는 다른 영향을 배재할 수 있는 독립적인 공간을 필요로 하는데 그것이 바로 진공 용기 (vacuum chamber)이다. 보통 2.5×1019 molecule/cm2 이하의 밀도를 가지는 공간을 진공이라고 하는데 표면 실험을 하기 위한 진공 용기 안의 조건은 초 고진공 (ultrahigh vacuum ; UHV) 즉 10-8 Torr 이하의 진공도이다. 초고진 공 조건이 반드시 갖추어져야 하는 이유는 깨끗한 표면을 오래 유지하기 위 해서이다. 진공도가 좋을수록 진공 용기 내부에 깨끗한 시료 표면과 반응할 수 있는 기체 분자들의 양이 적어지기 때문에 오염을 최소화할 수 있고, 표 면의 정보를 가지고 방출되어 나오는 전자들의 평균 자유 행로 (mean free path)가 길어져 충돌에 의한 손실을 줄일 수가 있으므로 보다 정확한 정보를 얻을 수 있다 [4].
Ⅰ-2. Si(001)2×1 표면
일반적으로 표면 (surface) 또는 계면 (interface)은 한 상이 다른 상과 맞 닿은 면을 의미한다. 표면은 내부 원자들과 달리 표면 위쪽 원자의 부재 (不 在)로 인하여 내부로 끌어당겨지는 알짜힘 (net force)이 작용하게 된다. 이 알짜힘에 의하여 표면 원자들은 내부 원자들과는 다른 여러 가지 성질들을 나타내게 된다. 구조적으로 알짜힘을 최소화시키면서 안정화하기 위해 표면 원자들은 완화 (relaxation), 재구성 (reconstruction) 등의 원자 재배열을 통 하여 내부 원자들과는 다른 기하학적 배열과 물리적, 화학적 성질을 나타낸 다. 따라서 어떤 물질의 표면과 계면에서 원자 간의 반응 그리고 표면 원자 들과 금속 또는 유기 분자 같은 흡착질 (adsorbate) 간의 상호 작용은 표면 에서의 물리적, 화학적 특이성을 보이게 된다.
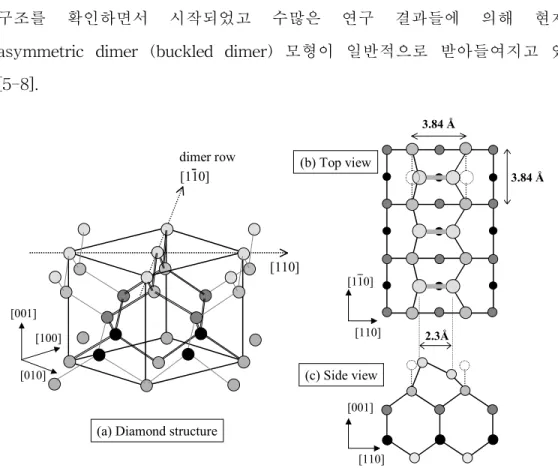
반도체 산업에서 가장 다양하게 응용되고 있는 Si(001) 면의 표면 재배열
에 대한 연구로는 Schlier와 Farnsworth 등이 LEED를 사용하여 2×1 재배열 구조를 확인하면서 시작되었고 수많은 연구 결과들에 의해 현재는 asymmetric dimer (buckled dimer) 모형이 일반적으로 받아들여지고 있다 [5-8].
[110]
[100]
[010]
[110]
dimer row
(a) Diamond structure [001]
그림 1. Three- and two-dimensional structures of Si(001) surface.
[110]
2.3Å
3.84 Å
[110]
[110]
[001]
(b) Top view
(c) Side view
3.84 Å
Si의 다이아몬드 구조를 그림 1(a)에서 3차원적으로 나타내었고 그림 1(b) 와 (c)는 그 top view와 side view를 나타낸 것이다. Si(001) 표면의 원자 즉 표면에 드러나 있는 Si 원자는 원래 그 단위포 (unit cell)의 길이가 [110], [110] 방향으로 각각 3.84 Å인 1×1 주기성을 가지게 된다. 그러나 표면의 원 자는 위쪽 결합의 부재에 의하여 이웃한 Si 표면 원자와 결합하여 dimer를 이루게 된다. 그리고 dimer를 이루면서 표면의 주기성이 바뀌게 되는데 이 때의 표면 구조는 2×1 주기성을 가진다. 점선으로 표시한 원이 표면에 드러 나 있는 Si 원자의 본래 위치 (1×1 주기성)를 나타내며 점무늬의 실선으로
표시한 원은 dimer를 이룸으로써 자리 잡은 위치 (2×1 주기성)를 나타낸다.
하나의 dimer에서 두 Si 원자 간의 거리는 2.3 Å 정도로 bulk의 Si-Si 결합 길이인 3.84 Å보다 짧다 [9].
이상적인 Si(001) 표면의 원자는 원래 그 주기가 1×1이고 한 원자에 dangling bond (DB)를 2개씩 가지게 되지만, 표면 에너지를 줄이는 방법으로 DB 수를 줄이면서 표면에 있는 두 개의 Si 원자가 서로 짝을 이루어 (dimer) σ 결합을 형성하게 된다. 그렇게 되면 원자 한 개당 DB 수가 하나씩 남게 되는데 전하의 이동으로 전하 분포의 평형이 깨져 비대칭적인 요소에 의해 뒤틀린 구조 (buckling structure)를 형성한다.
σ σ∗
σ σ∗
π∗π
σ σ∗
DBdown DBup
그림 2. Energy level diagram representing (a) four degenerate DBs from two bulk-like surface, (b) dimer-bond formation depicted by a σ-bonding level and σ*-antibonding level, with two DBs remaining on each surface atom, (c) splitting of the DB levels as a result of π-π* interaction, (d) buckled dimer with further separation of the DB levels associated with the up and down dimer atoms.
δ+ δ-
(a) (b) (c) (d)
Dimer를 이룬 두 개 Si 원자는 두 원자 간의 전하 이동에 의해 전하 분포 가 달라지는데 up dimer는 전하 풍부 (charge-rich)한, down dimer는 전하 부족 (charge-deficient)한 상태를 가지게 된다. 이 과정을 에너지 준위로 표
현한 것이 그림 2이다 [10]. 이렇게 강한 σ 결합과 약한 π 결합을 하고 있는 dimer의 형태는 ethylene (C=C)과 구조상으로나 전기적으로 매우 비슷하다고 볼 수 있지만 ethylene은 planar 구조, Si dimer는 non-planar 구조를 가지고 있다. 그리고 Si dimer는 charge-rich한 상태와 charge-deficient한 상태가 공 존하므로 symmetric dimer로 구성되어 있는 C(001)2×1 표면 등에 비하여 상 대적으로 불안정한 상태이고 일반적으로 외부 전하의 공격에 더욱 민감하다.
따라서 Si(001)2×1 표면은 유기 분자들과의 화학적 반응성이 매우 크다 [11].
유기화학에서의 분자 간의 화학적 반응과는 달리 고체 표면과 유기 분자의 반응은 그 유기 분자가 가지는 작용기 (functional group)에 따라서 여러 가 지 다양한 반응 메커니즘이 존재한다. 이에 관한 여러 연구가 최근 진행되고 있는데 이미 여러 가지 계산 결과와 함께 다양한 실험 결과도 보고 되었다.
따라서 Si(001)2×1 표면 위에서의 유기 분자 흡착, 해리 및 탈착 메커니즘 에 대한 전반적인 이해는 학문적으로 반도체 표면과 유기 분자들의 반응에 대한 이상적인 모델을 제시할 수 있고 또한 그 응용적 측면에서 표면의 화학 적 성질의 변화, 자기 조립 분자 박막, 분자 소자 등의 연구에 기여할 수 있 으므로 그 의미가 크다고 할 수 있다.
Ⅰ-3. 작용기를 가지고 있는 유기 분자들의 흡착 메커니즘
작용기를 가지고 있는 유기 분자들의 흡착 가능한 여러 종류의 모델을 세 우고 각각의 반응 경로 (reaction pathway)를 계산하여 가장 안정한 흡착 메 커니즘을 제시한 이론적 연구 결과와 함께 HREELS (high-resolution electron energy loss spectroscopy), FTIR (fourier transform infrared spectroscopy), STM (scanning tunneling microscopy), PES (photoelectron spectroscopy), TDS (thermal desorption spectroscopy), NEXAFS (near
edge x-ray absorption fine structure) 등의 여러 표면 분석 기술을 이용한 실험적 결과가 있다. 반도체 표면 위에서의 유기 분자들의 흡착 메커니즘에 대한 연구 결과들 중에서 본 연구에 사용된 유기 분자의 작용기와 관련된 몇 가지 이론적, 실험적 결과들을 정리하였다.
가. 불포화 탄화수소 (unsaturated hydrocarbon)
대표적으로 Hamers 등의 연구에 의해서 C 이중 결합 (-C=C-)을 가지는 불포화 탄화수소의 반응성은 많은 실험 결과들에서 -C=C-와 Si dimer(Si=Si)가 [2+2]고리화 첨가반응 (cycloaddition reaction)에 의해 Si-C의 강한 σ 결합을 이루는 것으로 잘 알려져 있다 [12-15]. 유기화학에서, 두 개 의 ethylene 분자가 고리 화합물을 형성하는 [2+2]고리화 첨가반응은 적당한 파장의 빛의 존재 하에서는 쉽게 진행되지만 열을 가했을 때는 진행되지 않 는다. ethylene의 고리화 첨가반응은 두 π 전자가 관여하게 되는데 그것은 π
1과 π2*로 두 개의 π 분자 궤도함수를 갖는다. 바닥 상태에서 π1은 결합 궤 도함수 HOMO (highest occupied molecular orbital)이고 π2*는 반결합 궤도 함수 LUMO (lowest unoccupied molecular orbital)이다. 두 ethylene의 [2+2]
고리화 첨가반응은 결합이 일어나기 위해 겹쳐지는 HOMO, LUMO의 위상 이 같지 않으므로 열적 에너지에 의해 유발되는 [2+2]고리화 첨가반응은 대 칭-금지반응 (symmetry-forbidden reaction)이라고 불린다.
유기 분자 간의 [2+2]고리화 첨가반응은 열적으로 일어날 수 없고 어떤 조 건에서 일어날 수 있어도 대단히 높은 활성화 에너지가 필요하다. 그러나 Si, Ge, C(001) 표면 위에서는 dimer가 가지는 특이성에 의해 유기 분자의 -C=C-가 표면의 dimer와 [2+2]고리화 첨가반응을 일으킨다. 유기 분자와 Si, Ge, C(001) 표면과의 [2+2]고리화 첨가반응이 가능한 이유를 π-π*
surface-state band gap, π bond strength 등으로 설명하고 있다 [15-17].
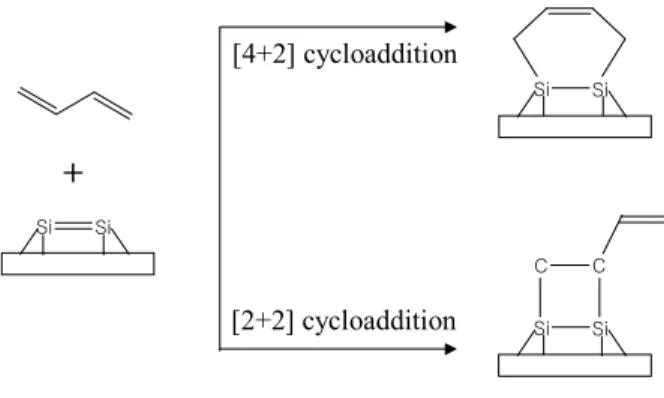
불포화 탄화수소 중에서 4개의 π 전자를 가지는 1.3-diene의 경우 [2+2]와
[4+2]고리화 첨가반응의 가능성을 이론적으로 제시하였는데 [4+2]고리화 첨가 반응은 바닥 상태 (열 유발에 대한)에 대한 HOMO, LUMO의 위상이 잘 일 치하여 대칭-허용반응 (symmetry-allowed)이므로 Si, Ge, C(001) 표면 위에 서 1.3-diene의 반응은 [4+2]고리화 첨가반응이 더 우세하다.
다양한 1.3-diene의 유기 분자와 Si dimer의 [2+2]와 [4+2]고리화 첨가반응 에 대한 실험 또는 계산 결과에서도 [4+2]고리화 첨가반응이 더 우세하며 [4+2]고리화 첨가반응에 의한 생성물이 더 안정한 에너지 상태임이 보고 되 었다 [15, 18-19].
나. 다른 작용기 (OH, COOH, C=O)를 가지는 유기 분자들
여러 가지 이론적, 실험적 결과에서 OH 기를 가지는 분자들의 흡착 메커 니즘은 OH 기의 해리에 의한 흡착 (dissociative adsorption)이 가장 쉬운 경 로로 설명하고 있다.
기체 상태의 유기 분자는 초기 분자 상태 그대로 Si 표면 위에 접근하게 되고 lone-pair 상태의 O 원자와 charge-deficient한 down dimer 원자가 결 합을 형성하면서 O와 H 원자의 해리를 유도한다. 분자 상태에서 해리 상태 로 가기 위한 활성화 에너지는 매우 낮으므로 O와 H 원자가 쉽게 해리하고 H 원자는 up dimer 원자와 결합을 이룬다 [20].
Si(001)2×1 표면 위에 methanol 흡착의 경우 보고 된 계산 결과에 의하면 OH 기가 해리하기 위한 활성화 에너지는 3.8 kcal/mol 정도이며 전이 상태 (해리 상태)의 에너지가 처음 상태 (흡착 전)보다 10.5 kcal/mol 정도나 낮은 에너지이므로 자발적 반응이 이루어지고 흡착 후 생성물의 에너지도 약 -65.3 kcal/mol 로 매우 안정한 상태를 이루는 것으로 보고 되었다 [21]. OH 기의 해리 흡착은 계산 결과뿐 아니라 water, methanol, ethanol, formic acid 등의 PES, FTIR, HREELS, NEXAFS 실험 결과와도 일치하는 흡착 메커니 즘이다 [22-28].
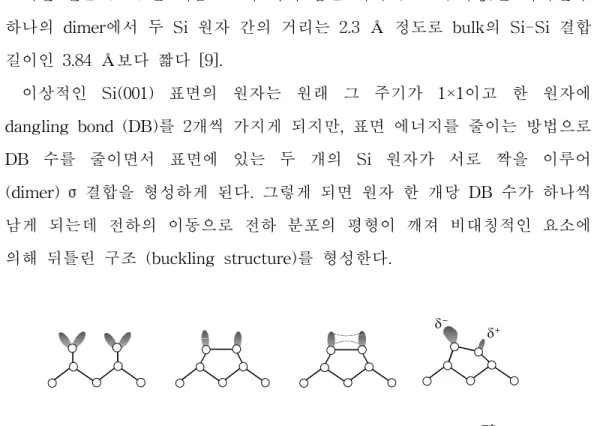
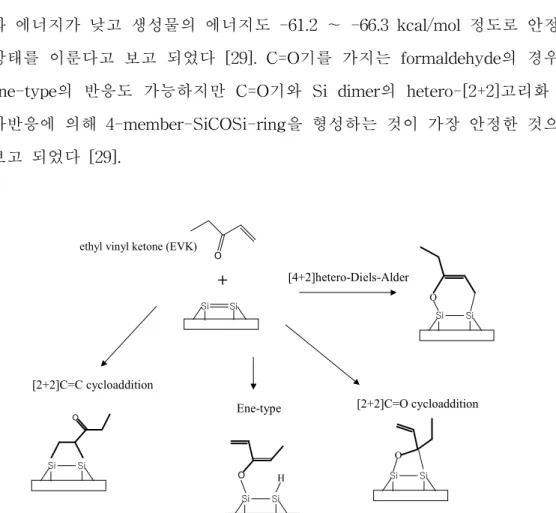
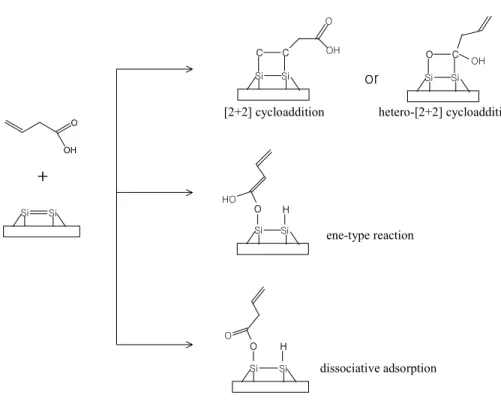
COOH 기를 가지는 가장 간단한 분자 formic acid의 경우 OH 기의 해리 흡착, C=O 기의 hetero-[2+2]고리화 첨가반응과 ene-type의 반응 (그림 3 참 조)으로 세 가지 가능한 경로를 제시하였지만 역시 OH 기 해리 흡착의 활성 화 에너지가 낮고 생성물의 에너지도 -61.2 ∼ -66.3 kcal/mol 정도로 안정한 상태를 이룬다고 보고 되었다 [29]. C=O기를 가지는 formaldehyde의 경우는 ene-type의 반응도 가능하지만 C=O기와 Si dimer의 hetero-[2+2]고리화 첨 가반응에 의해 4-member-SiCOSi-ring을 형성하는 것이 가장 안정한 것으로 보고 되었다 [29].
그림 3. Possible reaction pathways for EVK on Si(001)2×1 surface.
Si Si
O O
O
Si Si
Si Si O
Si Si O
Si Si H
+
[2+2]C=C cycloaddition
Ene-type
[4+2]hetero-Diels-Alder
[2+2]C=O cycloaddition ethyl vinyl ketone (EVK)
마지막으로 C=O 기와 C=C 기를 함께 가지는 ethyl vinyl ketone (EVK) 분자의 흡착 메커니즘이다. 가능한 반응 경로를 그림 3에 나타내었다. EVK 분자의 경우는 두 개의 작용기 C=O와 C=C 기에 의해 다양한 반응 경로를 제시하였다. C=C와 Si dimer에 의한 [2+2]고리화 첨가반응, C=O와 Si dimer
에 의한 hetero-[2+2]고리화 첨가반응 그리고 hetero-[4+2]고리화 첨가반응과 C=O 기의 ene-type 반응에 관하여 각각의 활성화 에너지와 생성물의 에너지 를 계산하였고 몇 가지 실험 결과도 보고 되었다 [30].
Ⅰ-4. 실험 목적 및 실험에 사용된 유기 분자
본 연구에서는 Si(001)2×1 표면 위에 여러 가지 작용기를 가지는 간단한 유기 분자들의 화학 반응에 관한 흡착 메커니즘을 살펴보고 흡착된 유기 분 자의 열적 안정성과 탈착 메커니즘을 구명하고자 한다. 우선 초고진공 분위 기에서 실험을 수행함으로써 다른 화학 반응을 가능한 한 배재한 순수한 Si 표면과 유기 분자가 가지고 있는 여러 작용기와의 화학 흡착에 관한 메커니 즘의 이상적인 모델을 세움으로써 다음과 같은 응용 분야에 화학적 배경을 제시할 수 있다.
작용기에 따른 유기 분자의 흡착 메커니즘을 알아내면 여러 작용기의 화학 적 반응성 또는 선택성을 이용하여 원하는 형태의 building blocks이 가능해 지고 표면의 성질을 조절할 수 있다. 그리고 예를 들어 작용기의 하나는 표 면과 반응하고 다른 하나의 작용기가 최상층에 존재한다면 금속이나 다른 분 자들을 이용하여 결합을 유도함으로써 유기 분자-유기 분자 또는 유기 분자 -금속-유기 분자 등의 다양한 형태의 다층막 (multilayer)을 만들 수 있다.
또한 유기 분자와 금속을 함께 이용하면 그 표면의 전하 밀도의 다양하고 인 위적인 조작이 가능해져 분자 단위의 전기적 소자로서의 응용성이 더욱 커진 다.
본 연구에서 대상으로 하는 유기 분자들은 첫째, 표면과 반응을 한 후 남 게 되는 다른 작용기와 또 다른 금속이나 유기 분자와의 화학적 반응을 유도 할 수 있는 다작용기 (multifunctional group)를 가지는 유기 분자를 선택하
였다. 둘째, 표면 위에서 대표적 흡착 메커니즘으로 알려진 해리 흡착 (dissociative adsorption)과 비해리 흡착 (non-dissociative reaction) 예를 들 면 고리화 첨가반응 (cycloaddition reaction)과 같은 반응이 경쟁적으로 일어 날 수 있는 유기 분자들을 선택하였다. 셋째는 표면에서 작용기와의 반응을 제외한 다른 형태의 부가적인 반응, 예를 들면 작용기의 결합에 의한 분자의 뒤틀림 현상 등을 가능하면 배제하기 위해 간단한 형태의 작은 유기 분자들 을 대상으로 하였다.
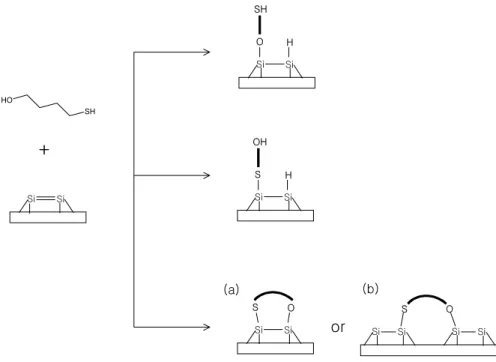
가. 4-Mercapto-1-butanol (MB)
4-Mercapto-1-butanol (MB)은 C 4개의 비교적 짧은 alkyl chain과 hydroxyl 기와 mercapto 기를 분자의 양 끝에 함께 가지고 있는 유기 분자 이다. MB 분자를 그림 4에 나타내었다.
Hydroxyl group Mercapto group
HO
SH
그림 4. 4-Mercapto-1-butanol (MB) molecule.
Hydroxyl group Mercapto group
HO
SH
그림 4. 4-Mercapto-1-butanol (MB) molecule.
1-3절에서 설명한 바와 같이, 분자 한쪽 끝에 OH 기를 가지는 water, methanol, ethanol 등과 같은 유기 분자들의 Si(001)2×1 표면 위에서의 흡착 메커니즘은 여러 실험, 이론적 결과에 따라 hydroxyl (OH) 기의 O와 H 원 자가 해리하면서 각각 2×1 표면의 up dimer, down dimer Si 원자들과 화학 결합하는 것으로 알려져 있다 [22-28]. 그리고 Si 표면 위에 benzenethiol을
흡착시킨 실험 결과에서 mercapto (SH) 기는 S와 H 원자로 해리하여 각각 Si 표면 위에 흡착함을 보였다 [31]. 이렇게 각각의 작용기를 이용한 흡착에 관한 연구는 많이 보고 되어 있지만 두 개의 작용기를 모두 가지고 있는 유 기분자와 Si dimer 간의 화학 결합 및 탈착에 관한 자세한 연구는 보고 된 바가 없다.
Mercapto (SH) 기의 S 원자는 Au와 화학 결합을 잘 형성하므로 용액상에 서의 자기조립 분자막 (self-assembled monolayers, SAMs) 실험이 많이 이 루어지고 있다. 그러나 Au-S 결합은 열에 약하고 그 결합 세기가 30-35 kcal/mol 정도에 해당하지만 S 원자가 Si과 반응할 경우 그 결합 (Si-S)은 54 kcal/mol 정도로 좀 더 강한 결합을 형성한다고 알려져 있다 [31]. 또한 용액에서 수행된 SAMs 실험 결과들을 보면 alkyl chain의 길이가 길어질수 록 접촉각이 커지는데 그것은 표면 위에 유기 분자들이 정렬되는 정도가 커 진다는 것을 의미한다. 그리고 Au 표면 위에 같은 thiol 분자를 용액에서와 진공에서 반응시킬 경우, 용액에서는 수직으로 잘 정렬되지만 진공에서는 표 면에 평행하게 흡착한다는 실험 결과도 있다 [32].
MB는 길이가 6-6.5 Å 정도로 비교적 짧고 (Si dimer와 dimer 사이의 길 이 (5.38 Å)와 비슷함), OH, SH 기의 두 작용기가 Si dimer 위에서 비슷한 흡착 메커니즘을 나타내므로 이 두 요소가 Si 표면 위에서 어떠한 반응성 또 는 선택성을 나타내는지 그 흡착 메커니즘 그리고 열적 안정성과 해리 및 탈 착 메커니즘을 구명하기 위한 실험을 수행하였다. Si(001)2×1 표면 위에서의 MB 분자의 흡착 메커니즘에 관한 개요도를 그림 5에 나타내었다. 두 작용기 의 경쟁적 흡착에 의해 OH, SH 기가 Si dimer의 DB와 각각 결합하는 경우 와 두 작용기의 유사한 흡착 메커니즘에 의해 표면에 평행하게 흡착하는 경 우를 나타내었다. MB 분자의 흡착 형태에 따라서 해리 및 탈착 반응이 다르 게 나타날 것이다.
HO
SH
Si Si
Si Si
O H
SH
Si Si
S H
OH
Si Si
S O
Si Si Si Si
S O
or
+
그림 5. Possible reaction pathways for MB on Si(001)2×1 surface.
(a) (b)
나. Vinylacetic acid (VAA) 또는 3-Butenoic acid
Vinylacetic acid (VAA)는 여러 개의 작용기 (multi-functional group)를 가지면서도 비교적 간단한 유기분자 (그림 6)라고 할 수 있다. VAA는 크게 vinyl 기, carboxyl 기 두 개의 작용기를 가진다고 볼 수 있지만 carboxyl 기 자체가 carbonyl 기, hydroxyl 기로 각각 작용기 역할을 할 수 있기 때문이 다 [29-30].
Carboxyl group Vinyl (C=C–) group
( Carbonyl, –C=O )
( Hydroxyl, –OH )
O OH
그 림 6. Vinylacetic acid (VAA) m olecule.
Carboxyl group Vinyl (C=C–) group
( Carbonyl, –C=O )
( Hydroxyl, –OH )
O OH
그 림 6. Vinylacetic acid (VAA) m olecule.
VAA 분자 안의 작용기에 따라 가능한 반응 경로를 그림 7에 나타내었다.
1-3절에서 설명한 대로 vinyl 기 (-C=C)는 Si dimer와 [2+2]고리화 첨가반응 에 의해 고리화합물을 형성할 수 있고 carbonyl (-C=O) 기 역시 hetero-[2+2]고리화 첨가반응이 가능하며 ene-type의 반응도 가능하다. 또한 OH 기에 의한 해리 흡착도 가능하다.
본 연구에서는 VAA 분자가 formic acid의 경우처럼 OH 기에 의한 해리 흡착이 일어나는지 다른 작용기의 반응성도 나타내는지 그 흡착 메커니즘과 해리 및 탈착 메커니즘을 구명하기 위한 실험을 수행하였다 [25-27].
O OH
Si Si
Si Si
C C OH
O
Si Si
O C
OH
Si Si
Si Si H O HO
H
O O
or
+
그림 7. Possible reaction pathways for VAA on Si(001)2×1 surface.
[2+2] cycloaddition hetero-[2+2] cycloaddition
ene-type reaction
dissociative adsorption
다. 1,3-Butadiene (BD)
Si(001)2×1 표면과 고리 화합물을 형성하는 유기분자로 ethylene에 대한 연구가 많이 보고 되었는데 이 물질을 제외하면 1,3-butadiene (BD)이 C=C 를 활용할 수 있는 가장 간단한 유기 분자로 여겨지며 앞에서 설명한 바와 같이 [2+2] 보다는 [4+2]고리화 첨가반응이 활성화 에너지가 낮고 반응 후 생 성물의 에너지 상태가 더 안정하기 때문에 [4+2]고리화 첨가반응이 더 우세 하다고 여겨지고 [4+2]고리화 첨가반응 후 생기는 -C=C-를 또 하나의 작용 기로 활용할 수 있을 것으로 기대된다. BD 분자와 가능한 반응 경로를 그림 8과 9에 나타내었다. BD이 Si(001)2×1 표면 위에 흡착할 경우 [4+2]고리화 첨가반응에 의해 결합한 것이 [2+2]고리화 첨가반응에 의한 것보다 24.8
kcal/mol 더 안정하다는 계산 결과도 보고 되었다 [19].
C=C–
그림 8. 1,3-Butadiene (BD) molecule.
C=C–
그림 8. 1,3-Butadiene (BD) molecule.
[4+2] cycloaddition
Si Si
Si Si
Si Si
C C
[2+2] cycloaddition
+
그림 9. Possible reaction pathways for BD on Si(001)2×1 surface.
BD이 Si 표면 위에 [4+2]고리화 첨가반응에 의해 흡착된다면 해리 반응 없이 분자 자체로 흡착이 일어날 것이고 다른 유기 분자보다 열적으로 더 안 정할 것으로 예상된다. 본 연구에서는 BD의 흡착 메커니즘과 열적 안정성에 관한 실험과 흡착 후 생기는 C 이중 결합 (-C=C-)이 반응성을 나타내는지
확인하기 위해 알칼리 금속 중 칼륨 (potassium, K)을 선택하여 유기 분자- 금속 다층막에 관한 기초적인 실험을 수행하였다.
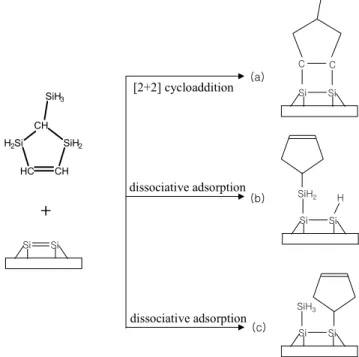
라. 2-Silyl-1,3-disilacyclopent-4-ene (SDC)
2-Silyl-1,3-disilacyclopent-4-ene (SDC)는 MOCVD (metal organic chemical vapor deposition) 방법으로 SiC 박막 성장을 위한 단일 선구물질 (single precursor)로 한국과학기술연구원 (KIST)에서 합성한 화합물이다.
Silyl group
–C=C–
CH H
2Si
HC CH
SiH
2SiH
3그림 10. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) molecule.
Silyl group
–C=C–
CH H
2Si
HC CH
SiH
2SiH
3그림 10. 2-Silyl-1,3-disilacyclopent-4-ene (SDC) molecule.
그림 10에서 보다시피 SDC는 Si과 C 원자가 한 층씩 교차하여 있고 두 원자의 수도 같으며 전체적으로는 고리 모양을 하고 있다. 또한 고리의 아래 부분에 해당하는 두 C 원자가 이중 결합을 하고 있으므로 Si 표면의 dimer 와 [2+2]고리화 첨가반응에 의한 흡착이 가능할 것으로 생각한다. 한편으로 silane 분자가 가지고 있는 silyl (-SiH3) 기의 반응성에 관한 여러 실험 결과 들에 의하면 silyl 기 역시 하나의 작용기로서 Si 표면 위에서 반응성을 나타 내고 있다 [33,34]. Methylsilane의 경우는 분자 상태의 흡착인 전이 상태를
거쳐 좀 더 안정한 상태로 가기 위해 H3Si-CH3 결합이 해리하고 -SiH3와 -CH3가 각각 Si dimer 원자와 결합을 이룬다고 보고 되었다 [34].
CH H2Si
HC CH
SiH2 SiH3
Si Si
Si Si
C C
Si Si SiH2 H
Si Si SiH3
그림 11. Possible reaction pathways for SDC on Si(001)2×1 surface.
+
[2+2] cycloaddition
dissociative adsorption (a)
(b)
(c) dissociative adsorption
여러 실험 결과들을 근거로 SDC의 가능한 흡착 메커니즘의 경로를 추측 해 보았고 그 반응 경로를 그림 11에 나타내었다. C 이중 결합과 Si dimer에 의한 [2+2]고리화 첨가반응과 해리에 의한 반응 경로를 함께 나타내었다.
SDC의 작용기에 따른 Si 표면 위에서의 흡착 메커니즘과 열적 안정성 및 SiC의 초기 형성에 관한 연구를 수행하였다.
Ⅱ. 실험
Ⅱ-1. 실험 방법
본 연구에서는 XPS (X-ray photoelectron spectroscopy), UPS (ultraviolet photoelectron spectroscopy), LEED (low energy electron diffraction), AES (Auger electron spectroscopy), TDS (thermal desorption spectroscopy), SRPES (synchrotron radiation photoelectron spectroscopy), STM (scanning tunneling microscopy) 등 그 실험 목적에 따라 5 종류의 각기 다른 초고진 공 시스템에서 실험을 수행하였다. 기본 진공도는 표면 위에서의 유기분자들 의 흡착, 탈착 메커니즘 연구를 위해 2×10-10 Torr 이하로 유지하였다. 본 실 험에 앞서 각 용기에서 공통적으로 각 분석 장비를 통해 깨끗한 Si(001)2×1 표면의 준비, 흡착 분자들의 청정도 등을 확인하였고 구체적인 방법은 아래 와 같다.
가. 깨끗한 Si(001)2×1 표면의 준비
기질로 n-type Si(001) 웨이퍼 조각 (5 × 20 × 0.5 mm3)을 사용하였다. 진 공용기 안에 넣기 전 5% HF 용액에 수십 초 간 담가 기존의 자연 산화막을 제거하고 H-terminated 상태 (Si-H)로 Si 웨이퍼의 자체 저항을 이용하여 직접 DC 전류를 흘리는 가열 방법을 사용하였다. 시료 온도의 측정은 optical pyrometer를 이용하여 광학적으로 측정하였다. 기질의 온도를 수 시 간 이상에 걸쳐 느린 속도로 증가하여 800 ℃ 정도가 되면 시료와 Ta 시료 대 주위의 불순물 탈착을 위해 수 시간 동안 이 온도를 유지하였다. 마지막 으로 C 등 시료 내부의 불순물 등을 제거하고 2×1 구조로의 재배열을 유도 하기 위하여 기질의 온도를 빠른 속도로 1250 ℃까지 올렸다가 내리는 방법 (flashing)을 수 차례 반복하여 깨끗한 Si(001)2×1 표면을 얻었다.
Si 표면의 청정도와 2×1 구조로의 재배열 여부는 실험 목적에 따라 사용한
각 초고진공 용기에 부착된 표면 분석 방법을 통하여 확인하였다. 우선 LEED를 통해 2×1 표면 구조의 회절점들의 세기와 크기를 확인하고 광전자 스펙트럼에서는 진공 중의 유기 분자 혹은 물 분자 등의 흡착에 의한 C 또 는 O의 오염이 없는지 확인하였다. 또한 가전자대 스펙트럼 (valence band spectrum) 상에서 2×1 구조의 dangling bond의 오염 정도에 민감한 surface state에 해당하는 peak의 상대적 세기 등을 통해서 깨끗한 표면이 형성되었 음을 확인하였다. 또한 유기 분자의 흡착을 전후하여 Si의 표면 상태를 계속 확인하였다.
나. 유기 분자의 흡착
실험에 사용한 유기 분자들 중에서 MB (4-mercapto-1-butanol), VAA (vinylacetic acid), SDC (2-silyl-1,3-disilacyclopent-4-ene) 분자들은 상온에 서 액체로, BD (1,3-butadiene) 분자는 기체 상태로 존재한다. 실험에 앞서 불순물을 측정 한계 이하로 줄이기 위하여 우선 각 dosing line 등은 수 시간 이상 충분한 bake-out 후 turbo pump로 differential pumping하여 실험에 적 당한 고진공 상태를 유지하였다. 또한 MB, VAA, SDC의 경우 액체 질소를 이용하여 freeze-pump-thaw cycles 방법으로 불순물을 제거하였고 기체 상 태인 BD의 경우는 dosing line을 통해 수 차례 이상 퍼징하였다. 실험에 사 용한 각 초고진공 시스템에서 공통적으로 부착된 QMS를 통하여 용기 내에 주입되는 유기 분자의 순도를 확인하였다. 용기 내에 주입되는 양은 langmuir (1 L = 10-6 Torr․s)의 단위로 leak valve를 통하여 조절하였고 분 자 주입 시 진공도는 ∼10-8 Torr 이하로 유지하였다.
Ⅱ-2. 표면 분석 방법 및 이론
본 연구에서 사용한 분석 방법은 LEED, XPS, UPS, SRPES, TDS 및 STM 등이다. LEED를 통해 표면의 기하학적 구조와 배열에 대한 분석이 이 루어졌고, 표면 원자와 흡착 분자의 화학적 환경과 전자 상태에 관한 연구를 위해 XPS, UPS를 사용하였다. 또한 표면에 대한 더 많은 정보와 높은 분별 능의 스펙트럼을 얻기 위해 포항 방사광 가속기의 2B1 빔라인을 사용하였다.
또한 흡착 분자의 열적 안정성 또는 탈착 메커니즘을 알기 위해 QMS를 통한 TDS 실험이 이루어졌다. SDC 분자의 경우는 STM을 통해 흡착 상태 의 표면 이미지를 관찰하였다.
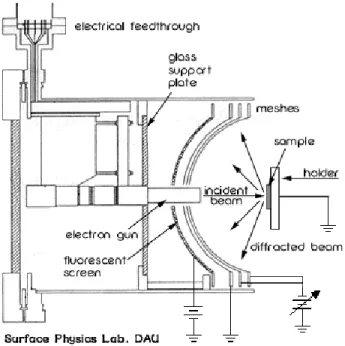
가. 저에너지 전자 회절법 (Low Energy Electron Diffraction, LEED) LEED는 표면에 입사되는 전자빔에 의해 표면으로부터 탄성 충돌되어 나 오는 전자빔의 회절 무늬를 해석하여 깨끗한 또는 유기 분자가 흡착된 표면 구조를 해석하는 분석 장비이다. 이 전자들의 에너지 범위는 20-1000 eV 정 도로 전자의 평균 자유 행로 (mean free path) 5-20 Å에 해당하는 에너지이 다. 따라서 표면으로부터 수 원자 층의 구조적 해석에 대한 정보를 얻기에 좋은 분석 장비이다.
LEED 장치는 크게 세 부분으로 구성되어 있다. LEED 장치의 개요도를 그림 12에 나타내었다.
1. 20-500 eV 사이의 평행한 단일 에너지 전자빔을 만들어 내는 전자총과 광학 렌즈 부분
2. 시료를 움직이고 가열할 수 있는 시료 부착 장치 3. 탄성 산란 전자의 검출 장치
그림 12. LEED optics.
전자총에서 일정한 에너지로 방출된 전자들은 mesh의 구심에 있는 시료에 서 산란이 일어나 사방으로 방출하게 된다. 이때 방출되는 전자가 외부의 영 향을 받지 않게 하기 위해서 첫 번째 mesh에 시료와 같이 접지를 시켜준다.
방출된 전자들이 스크린의 형광 물질과 부딪쳐 회절 무늬가 나타나는데, 이 때 형광 물질에 부딪치면서 방출되는 전자가 회절 무늬에 영향을 끼칠 것을 막아 주기 위해 두 번째나 세 번째의 mesh에 retarding potential을 가해 준 다.
LEED의 무늬로부터 표면 원자의 2차원적인 배열 주기를 알 수 있다. 또한 회절점의 세기로부터 표면의 구조와 배열 정도를 알 수 있다. LEED 형광판 에 나타나는 회절 무늬는 표면에 주기적으로 배열된 격자들을 반영해 주는 역격자 (reciprocal lattice)가 된다. Bragg 법칙과 Laue 조건에 의해 역격자
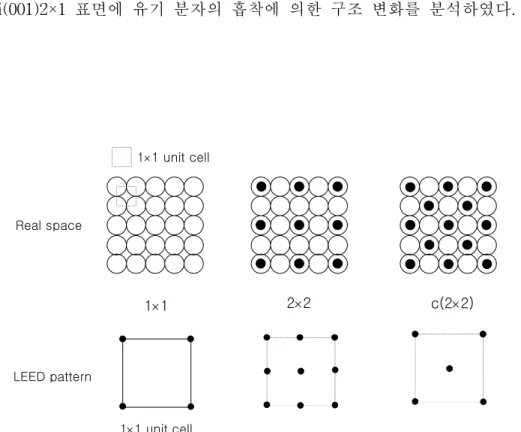
벡터로 실격자 벡터를 알 수 있게 되고 실제 표면 구조를 예측할 수 있게 된 다. 표면 구조와 역격자 LEED 무늬의 간단한 예를 그림 13에 나타내었다.
본 연구에서는 유기 분자의 흡착 전후의 LEED 무늬의 해석을 통해 Si(001)2×1 표면에 유기 분자의 흡착에 의한 구조 변화를 분석하였다.
1×1 unit cell
1×1 unit cell LEED pattern
Real space
1×1 2×2 c(2×2)
그림 13. Examples for overlayer structures and their patterns.
나. 열 탈착 분광법 (Thermal desorption spectroscopy, TDS)
탈착 (desorption)은 표면 위에 흡착된 흡착질 (adsorbate)이 외부의 자극에 의해서 표면으로부터 떨어져 나오는 현상을 의미한다. 흡착질을 표면으로부 터 탈착시키기 위해서 일반적으로는 기질을 서서히 가열하는 방법으로 탈착 활성화 에너지를 공급한다. 탈착 활성화 에너지는 표면과 흡착질 사이의 화 학 결합을 끊는 데 필요한 에너지이며 이 탈착 활성화 에너지를 측정하여 흡 착 에너지를 구하기도 한다. 탈착 활성화 에너지를 가하는 방법으로 전자, 이 온, 전자기장, 열에너지 등이 사용되는데 주로 열 탈착 현상을 이용하여 탈착 활성화 에너지, 탈착 온도, 반응 메커니즘, 탈착 메커니즘 등을 연구한다.
본 연구에서도 열 탈착 현상을 이용하였고 주로 탈착 온도와 메커니즘 연 구에 중점을 두었다. 기질의 온도를 가열하는 속도는 1.1 K/s로 하였고 quadrupole mass를 통해 탈착종을 관찰하였다.
다. 광전자 분광법 (Photoemission)
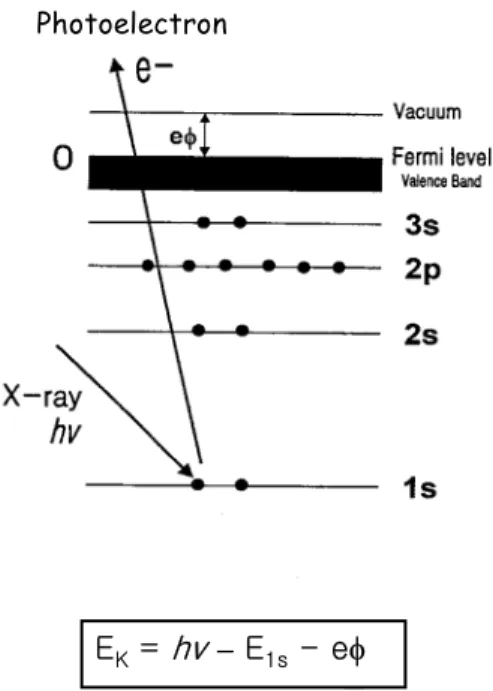
광전자 분광법의 원리는 1905년에 발표한 Einstein의 광전 효과의 이론이 다. 즉 금속 표면이 빛 에너지 hν를 받았을 때 금속 표면으로부터 전자가 방출되는데 이 방출되는 전자를 광전자라고 한다. 이 전자의 운동 에너지는 빛의 에너지, 전자의 결속 에너지 그리고 금속의 일함수로 나타낼 수 있으므 로 광전자의 운동 에너지를 정밀히 측정하면 전자의 결속 에너지가 계산된 다. 이 광전자의 운동 에너지 Ek는 Einstein의 광전 효과 관계식에 의해 식 (1)과 같이 표현된다.
Ek= hν - Eb- eΦ [식 1]
그림 14. Schematic energy diagram for photoemission from solid.
EK, E1sand eφ are the kinetic energy of photoelectron, binding energy of 1s core electron, and work function, respectively.
Photoelectron
EK= hv – E1s - eφ
Electron spectroscopy에서 말하는 결속 에너지 Eb는 어떤 특정한 궤도에 속한 전자를 운동 에너지가 영인 자유 전자로 떼어내는 데에 필요한 에너지 를 의미한다. 그림 14에서 보는 바와 같이 hν라는 에너지를 가지는 광자가 어떤 시료의 1s 준위의 전자를 떼어 내기 위해 드는 에너지가 결속 에너지 (Eb) 즉 E1s이다 (시료의 Fermi 준위를 기준점으로 한 것임). 금속 시료를 관 찰할 때는 보통 금속의 Fermi 준위가 에너지의 기준점이 되지만 금속에 흡 착된 분자의 궤도함수들을 기체 상태 분자의 궤도함수들과 비교할 때에는 Eb를 알아야 하므로 금속의 일함수 eΦ도 알아야 된다. 따라서 에너지의 기 준점을 잡기 위하여 주로 쓰이는 물질은 금, 구리, 탄소 등이다.
광전자 스펙트럼은 보통 전자의 에너지에 대하여 그 에너지를 가지는 전자
의 개수를 도시함으로써 얻는다. 그림 15에 광전자 스펙트럼을 개념적으로 표현하였다.
photoelectron
bulk band gap bulk valence band
bulk atoms surface atoms surface parallel
surface normal surface core level shift
bulk core level surface states
surface core level bulk core level bulk valence band
surface states
N(E) EKin
secondary electrons
그림 15. Schematic illustration of the photoelectron spectroscopy of bulk solid and surfaces. The major surface contribution in a photoelectron spectrum are the surface states in valence bands and surface core levels.
여기서 전자가 한 물질로부터 방출될 때 운동 에너지의 손실 없이 방출 (일차 전자 : primary electron)하기도 하지만 비탄성 충돌에 의해 그 에너지 일부를 잃고 방출 (이차 전자: secondary electron)하기도 한다. 광전자 스펙 트럼에서 바로 이러한 이차 전자들이 background를 이루고 있다.
일차 전자는 물질의 핵심부 준위 (core level)와 가전자대 (valence band)의 전자 상태로부터 각각의 에너지를 가지고 나오게 되는데, 그림에서 보듯이 표면에 있는 원자는 bulk의 원자가 가지는 에너지 준위와 다르다. 가전자대 의 영역에서는 표면 상태 (surface state)로, 핵심부 준위 영역에서는 표면 핵 심부 준위의 결속 에너지 이동 (surface core level shift, SCLS)이라는 형태 로 나타나게 된다. 표면 상태는 표면층에 한정된 2차원적인 전자 상태이다.
그리고 이 상태는 표면의 배열 구조가 bulk와 달라지는 것에 기인한다. 광전 자 분광법으로 측정된 가전자대의 스펙트럼에서 표면 상태는 몇 가지 특성에 의하여 bulk의 가전자대와 구분된다. 한편 표면에서 재배열 현상이나 다른 물질의 흡착에 의한 화학적 환경의 변화는 표면 원자에 bulk와는 다른 가전 자대 전하 분포 (valence charge distribution)를 야기하게 된다. 이러한 가전 자대 전하 분포의 차이에 의하여 표면 원자의 핵심부 준위는 bulk 원자의 핵 심부준위 결속 에너지에 대하여 결속 에너지 이동 (binding energy shift)을 일으키게 된다.
광전자 분광기의 기본 장치는 그림 16에서 보듯이 전자를 방출할 수 있는 광원 (light source), 에너지를 분석할 수 있는 전자 에너지 분석기 그리고 전 자를 검출할 수 있는 검출기의 세 부분으로 구성된다.
그림 16. Schematic experimental arrangement for photoelectron spectroscopy of solid surface.
hv
surface normalθe Photoelectron
Electron analyser
P
Synchrotron Radiation
Electron multiplier (Detector)
(+) V
(-) V
e-
핵심부 전자 (core electron)를 시료로부터 방출하기 위해 Al-Kα1,2 (hν = 1486.6 eV)와 Mg-Kα1,2 (hν = 1253.6 eV)의 X선을 주로 이용하고 있는데 이 방법이 흔히 ESCA라고도 불리는 XPS (x-ray photoelectron spectroscopy) 방법이다. 가전자대 (valence band)의 전자방출을 자세히 보기 위해서 UV (HeⅠ및 He Ⅱ)를 광원으로 쓰기도 하는데 이것이 바로 UPS (ultraviolet photoelectron spectroscopy)이다. UV는 광원 자체가 낮은 에너지를 가지고 있고 X선에 비하여 peak가 훨씬 좁은 half width를 가지고 있기 때문에 분 자 궤도함수를 관찰하는데 매우 적합하다.
그림 17은 광전자의 운동 에너지의 변화에 대한 평균 자유 행로를 나타낸 것이다. 표면 원자에 대한 정보를 상세히 얻기 위해서는 적당한 광원 에너지 를 선택함으로써 표면으로부터 수층 깊이 (2-10 Å)에 해당하는 평균 자유
행로 (mean free path)를 가지도록 광전자의 운동 에너지를 수십 eV 정도로 조절해야 한다. 식 1에 의해서 광원의 에너지 범위를 계산할 수 있고 방사광 가속기를 이용하는 경우 실험적으로 그 에너지를 선택할 수 있다.
EK(eV)
Escape depth (Å)
surface sensitive
그림 17. “Universal curve” for mean free path of electrons in solids as a function of their kinetic energy.
본 연구의 주된 실험 결과가 바로 광전자 스펙트럼인데 포항 가속기 연구 소에서 이루어진 실험이다. 방사광 가속기란 광속과 거의 같은 속도 (예를 들어 20억 전자볼트의 경우 광속보다 1 작은 속도 혹은 광속의 99.999997 %) 로 가속된 전자빔이 진로 (또는 방향)를 바꿀 때 그 곡선의 접선 방향으로 좁은 퍼짐을 가지고 방출되는 매우 강력한 빛을 만들어 내는 장치이다. 그림 18(a)과 같이 전자의 운동 방향을 바꾸어 원운동을 하게 하려면 전자의 운동 방향에 수직 방향으로 자기장을 걸어주는 방법을 이용한다. 이 때 발생되는
빛의 세기, 파장 범위 등은 가속되는 전자의 에너지와 원운동 하도록 하는 전자석의 자기장의 세기에 의해 변화한다. 예를 들어 포항 방사광 가속기 휨 자석 방사광관의 경우 10 m 떨어진 거리에서 단지 4 mm 정도밖에 퍼지지 않는 좁은 퍼짐의 광이 나오게 된다. 방사광은 실험실에서 쓸 수 없다는 단 점만을 제외하면 모든 면에서 다른 광원을 압도하는데 그것이 바로 방사광의 특징 중에 가장 높이 평가받는, 빛의 집중 정도를 나타내는 높은 휘도이다.
광의 세기가 클수록 그리고 빛의 퍼짐이 작아질수록 휘도는 큰 값을 갖게 되 는데 이러한 특성 때문에 그림 18(b)에서 보듯이 20 혹은 30 m 떨어진 곳에 서도 충분히 센 광을 이용하여 실험이 가능하게 된다 [35]. 또한 방사광은 펄 스성, 편광성을 가지고 있고 무엇보다도 특정한 파장을 골라서 사용할 수 있 다는 강점을 가지고 있어 본 연구에 매우 적합한 광원으로 사용되었다.
그림 18. (a) 방사광 발생, (b) 포항 방사광 가속기의 구성.
(a)
(b)
전자 에너지 분석기 (electron energy analyzer)는 운동 에너지 영에서부터 최대값까지의 전자들을 일정한 시간 동안 일정한 에너지 구간 (ΔE)에서 검출 한다. 즉 analyzer가 에너지 축을 한 번 거치면 N(E) vs. E curve가 얻어진 다. analyzer는 CHA라 불리는 concentric hemispherical analyzer를 많이 사 용한다.
검출기로는 channeltron type의 전자 증배관 (electron multiplier)이 많이 사용된다.
라. Curve fitting
핵심부 준위 스펙트럼에서 표면과 bulk의 성분에 의한 기여를 분해하여 정 확한 결속 에너지의 이동과 그 세기를 알기 위해서는 curve fitting이 필요하 다. 일반적으로 이러한 curve fitting을 위하여 각 성분에 대하여 비금속인 경 우는 Voigt 함수를, 금속인 경우는 Doniach-Sunjic 함수를 사용한다. 본 연 구에서 사용된 Voigt 함수는 전형적인 Lorentzian 과 Gaussian 함수를 복합 한 형태이다. 여기서 Lorentzian 부분은 광전자 최종 상태의 수명을 표현하고 Gaussian 부분은 장비와 열적 현상에 의한 스펙트럼의 퍼짐 (broadening)을 표현한다. 이차 전자에 의한 background는 적분화 방법 (integrated background method)에 의하여 계산된다.
Ⅲ. 결과 및 논의
Ⅲ-1. clean Si(001)2×1
유기 분자의 흡착에 앞서 Si(001) 기질의 표면 구조, 그리고 깨끗한 표면을 확인하기 위해 LEED 무늬의 분석과 Si 2p 핵심부 준위의 광전자 스펙트럼 측정을 수행하였다. 그림 19는 LEED를 통해서 관찰한 깨끗한 2×1 구조이다.
회절점들의 크기가 작고 그 강도가 센 것으로 보아 표면 구조가 넓은 영역에 형성되었음을 알 수 있다. 이상적인 Si 표면은 평평한 부분의 terrace와 각 terrace 사이에 원자 한 층 높이를 가진 step으로 이루어져 있는데 Si(001)2×1 표면의 경우 terrace마다 Si dimer row의 방향이 교차되어 있다.
따라서 그림 19와 같이 2×1 구조의 회절 무늬와 1×2 구조의 회절 무늬가 겹 쳐서 나타나게 된다.
1×1 unit cell
2×1 unit cell
1×2 unit cell
그림 19. LEED pattern and unit cell of clean Si(001)2×1 surface, schematic illustration of double-domain of 2×1 and 1×2 surface.
2×1 2×1 1×2 Terrace
Step
그림 20(a), (b)는 포항 방사광 가속기의 2B1 빔라인에서 광원의 에너지를 137 eV로 선택하여 측정한 깨끗한 S(001)2×1 표면의 Si 2p 핵심부 준위 스 펙트럼이다. 이미 보고 된 Landemark 등의 결과를 근거로 하여 스펙트럼을 fitting한 결과 Si(001)2×1 asymmetric dimer 구조에 기인하는 5개의 성분들 로 구성되어 있음을 확인하였다. 그림 20(c)는 Si(001)2×1 구조의 단면을 그 림으로 표현한 것인데 U, D, S, C, B라고 표기한 것은 각각 구조 모델에서 up dimer, down dimer, second layer, third layer 또는 defect, 그리고 bulk를 의미한다 [36].
그림 20(a), (b)의 스펙트럼의 curve fitting에 사용한 변수들은 여러 가지 가 있다. Spin-orbit splitting은 600 meV, branching ratio는 0.5로 모든 성분 에 적용시켰고 bulk 성분의 Gaussian width는 290 mV, 표면 성분 (U, D, S, C)의 Gaussian width는 310 mV로 하였다. Lorentzian width는 모든 성분에 50 mV를 사용하였고 각 성분의 결속 에너지 이동은 bulk 성분에 대하여 각 각 -0.5 (U), +0.062 (D), +0.236 (S), -0.228 (C) eV이다. 이 값은 Landemark 등에 의하여 보고 된 PES 연구 결과와 거의 일치한다 [36].
그림 20(a), (b)의 두 스펙트럼과 그림 20(c)의 Si 단면도에서 U 성분은 검 은색으로 D 성분은 회색으로 표현했는데 각각 up dimer와 down dimer에 의 한 기여에 의해 나타난 성분이다. 최상층에 존재하는 Si 원자는 asymmetric dimer 구조를 형성함으로써 두 dimer 원자 간의 전하 분포 이동에 의해 상 대적으로 (-) 전하를 가지는 것이 up dimer, (+) 전하를 가지는 것이 down dimer이다. 기하학적 구조 변화와 전하 분포에 의해 U 성분과 D 성분이 B 성분과는 다른 에너지 위치에서 나타나게 된다. S 성분은 up dimer와 down dimer에 의해 전하 분포의 변화가 생긴 둘째 층 원자들의 기여로 나타나는 것이다. C 성분은 아직 논란의 여지가 있지만 third layer와 표면 결함에 의 한 기여로 설명하고 있다 [37-38].
또한 그림 20(a)의 스펙트럼은 표면에 수직한 방향 (normal emission)에서 측정한 것이고 그림 20(b)는 방출각 (emission angle) 60° 즉 표면으로부터 30°되는 각도 (takeoff angle)에서 측정한 것이다. 기질과 분석기의 각을 좁히 면 상대적으로 표면 성분에 의한 기여도가 크므로 표면에 더욱 민감한 정보 를 알 수 있는데 그림 20(b)에서 보듯이 최상층에 해당하는 U와 D의 성분은 그림 20(a)의 스펙트럼과 비교해 상대적으로 그 세기가 더욱 증가하였다. 이 로써, 표면에 드러나 있는 up dimer와 down dimer의 존재가 확인되었고, U 와 D의 성분의 상대적 세기와 다른 오염에 의한 성분이 나타나지 않은 것으
로 보아 깨끗한 Si(001)2×1 구조가 형성되었음을 알 수 있었다.
Ⅲ-2. 4-Mercapto-1-butanol (MB)
그림 21은 깨끗한 Si(001)2×1 표면 위에 MB 분자를 포화 흡착시킨 후 XPS로 측정한 S 2p와 O 1s의 핵심부 준위 스펙트럼과 fitting 결과이다. 가 능한 한 표면에 민감한 스펙트럼을 얻기 위해 방출각을 70°로 하였다. 두 스 펙트럼에서 흰 원은 측정 결과이고 한 가지 성분 (점선)으로 fitting한 결과 (실선)가 측정한 스펙트럼과 잘 일치하였다.
Fitting 변수는 Gaussian width를 1.3 eV, Lorentzian width를 100 meV로 두 스펙트럼에 모두 적용시켰다. S 2p XP 스펙트럼의 경우 spin-orbit splitting을 1.15 eV, branch ratio는 1:0.5 로 하였다 [36].