대한소화기학회지 2000;35:687 - 703
H e licob ac t e r p y lori에 의한 인체 호중구 세포사멸의 억제
서울대학교 의과대학 내과학교실, 간연구소, 한양대학교 의과대학 내과학교실*, 미생물학교실 및 의과학 연구소†
김주성・윤병철*・김정목†・정현채・송인성・김정룡
Ap o p t o s i s o f H u m a n N e u t r o p h i ls Is In h i b i t e d b y H el i c ob a c t er p yl or i
J o o S u n g Ki m , M.D., B y u n g Ch u l Yo o n , M.D.*, J u n g Mo gg Ki m , M.D.†, Hy un Ch ae J u n g, M.D., In S un g Son g, M.D. a nd Chu n g Yon g Kim , M.D.
Department of Internal Medicine and Liver Research Institute, Seoul National University College of Medicine, Seoul; Department of Internal Medicine* and Microbiology, Institute of Biomedical Science†,
Hanyang University College of Medicine, Seoul, Korea
Background/Aims: Helicobacter pylori (H. pylori) infection in human causes persistent neutrophil infiltration into gastric mucosa. The mechanisms of perpetuation of mucosal inflammation have not been clearly defined. It was believed that a prolongation of neutrophil life-span could contribute to the pathogenesis of H. pylori infection. Therefore, we examined whether the water-soluble surface proteins of H. pylori can influence the apoptosis of neutrophils. Methods: After neutrophils were stimulated with H. pylori water extract (HPWE), neutrophil apoptosis was evaluated by fluorescent microscopy with Hoechst 33342 staining, electron microscopy, TUNEL assay, and cytosolic oligonu- cleosome-bound DNA enzyme linked immunosorbent assay for up to 48 hours. Cytotoxicity was determined by trypan blue exclusion test and LDH assay. To elucidate regulatory mechanisms of neutrophil apoptosis by HPWE, the expression of Fas, Fas ligand (FasL) and tumor necrosis factor receptor 1 (TNF-R1) mRNA and proteins was analyzed by reverse transcription-polymerase chain reaction, ribonuclease protection assay, Northern blotting and Western blotting. Cell surface ex- pression of these death factors was also measured by flow cytometry. Results: Stimulation with HPWE inhibited neutrophil apoptosis and cytotoxicity for up to 48 hours. Expression of FasL mRNA and proteins, and cell surface expression of Fas, FasL and TNF-R1 in stimulated neutrophils were suppressed as compared with controls. Conclusions: H. pylori water-soluble surface proteins inhibit neutrophil apoptosis in vitro. This may be caused by suppression of Fas, FasL and TNF-R1 expres- sion on the neutrophil surface. (Kor J Gastroenterol 2000;35:687 - 703)
Key Words: Helicobacter pylori, Neutrophil, Apoptosis, Fas, Fas ligand
접수: 2000년 3월 19일, 승인: 2000년 5월 29일
연락처: 정현채, 110-744, 서울시 종로구 연건동 28, 서울대학교 의과대학 내과학교실 Tel: (02) 740-8112, Fax: (02) 743-6701
※ 이 논문은 1998년도 한국학술진흥재단의 연구비의 지원을 받았음(KRF-98-001-F00349).
688 대한소화기학회지 : 제 35 권 제 6 호 2000
서 론
Helicobacter pylori는 위점막을 파고들지 않는 비 침습성 세균으로 만성 위염 및 재발성 소화성 궤양 의 중요한 원인인자이며,1-3 최근에는 위선암 및 저 위도 위점막관련림프조직 림프종(low-grade gastric mucosa-associated lymphoid tissue lymphoma)과도 관련이 있음이 밝혀졌다.4,5 H. pylori 감염의 위점막 반응은 호중구, 단핵구 및 림프구 등의 염증세포들 이 점막으로 침윤하는 것이 특징적인데, 특히 호중 구의 침윤이 뚜렷하다.6 조직에 침윤된 호중구 수가 증가될수록 반응성 산소대사물 및 단백분해효소들 의 분비량이 증가되어 조직 손상에 기인한 소화성 궤양이 유발될 수 있다. 그러나 H. pylori에 감염된 위점막에서 지속적으로 호중구가 유입되는 정확한 기전은 아직까지 규명되지 못하였다.
CXC chemokine이 호중구에 대한 화학주성을 나 타내고 활성화시키는 친염증성(proinflammatory) cytokine임이 확인된 후,7 H. pylori로 유발된 위점막 의 염증반응에서 매우 중요한 역할을 담당할 것으 로 생각되고 있다. 즉, H. pylori를 인체 위상피세포 주에 감염시킨 연구8,9 및 H. pylori에 감염된 인체 위점막을 대상으로 한 연구10에서 chemokine mRNA 발현 및 단백질 분비가 증가되었음이 보고된 바 있 다. 최근 저자들은 H. pylori 배양상청액에 의하여 활성화된 호중구에서 interleukin-8 (IL-8)의 발현 증 가를 확인하였고,11 H. pylori 표면의 수용성 단백질 을 투여하였을 때 호중구에서 growth-related onco- genes 발현이 상향 조절되었으며, 실제로 위점막에 서 호중구가 활성화되었음을 보고한 바 있다.12
세포사멸(apoptosis, programmed cell death)은 세 포 항상성 유지 및 면역반응 조절에 매우 중요한 역 할을 담당하고 있다. Apoptosis의 특징은 endonu- clease 활성화의 결과로 초래되는 세포 수축, 세포막 농포 형성(blebbing), 염색질 농축 및 핵 분절을 들 수 있다. 그런데 이같은 apoptosis는 여러 유전자 생 성물에 의해 정확히 조절된다.13 이와 같은 조절기능 을 하는 세포표면물질로 Fas, Fas ligand (FasL) 및 tumor necrosis factor receptor 1 (TNF-R1)가 거론되
고 있다.14 세포표면에 있는 Fas 및 TNF-R1에 FasL 및 TNFα가 결합(engagement)하면 세포막에 연결되 어 있는 단백질에 신호를 전달하여 apoptosis가 유 도된다.
인체 호중구를 시험관에서 배양하면 자연적으로 apoptosis가 진행되어 대부분이 72시간 내에 세포사 (cell death)에 이르게 된다.15 일단 호중구가 apop- tosis되면 조직 대식세포(macrophage)에 의해 탐식 되어 분해된다. 따라서 혈관 내에 있는 호중구가 정 상 조직에 침윤하더라도 apoptosis를 거쳐 사멸하므 로 세포 내에 있는 독성물질이 주위로 유출되지 않 는다. 그러나 염증 부위에 침윤한 호중구는 활성화 됨과 동시에 세포생존이 연장되고 독성물질 분비가 항진된다. 이와 같이 호중구 apoptosis는 염증성 조 직 손상의 조절에 중요한 현상으로 인정되고 있으 나, 호중구가 염증성 조직에 침윤한 후 실제적 세포 사 과정, 특히 세포생존의 조절기전은 잘 알려지지 않고 있다. 뿐만 아니라 H. pylori에 감염된 위점막 에서 지속적인 호중구 침윤기전이 명확히 제시된 바 없으며, H. pylori에 의한 호중구 apoptosis 조절 에 대해서도 아직까지 보고된 바 없다. 본 연구에서 는 H. pylori에 감염된 위점막에 침윤된 호중구는 apoptosis가 억제되어 염증반응이 지속될 것이라는 가설을 세우고 이를 규명하고자 H. pylori 수용성 표 면 단백질에 의한 호중구 apoptosis 및 세포사 조절 을 확인하였다. 또한, H. pylori에 의한 호중구 apop- tosis 조절기전을 파악하기 위하여 Fas, FasL 및 TNF-R1 mRNA 발현, 단백질 생성 및 세포표면에서 의 발현을 조사하였다.
대상 및 방법
1. H . py lori 수용성 추출물(w a t er e x t r a c t ) 제조
1) H . p y lori 균주
본 연구에 사용된 H. pylori 균주(HP99)는 서울대 학교병원에 내원한 십이지장궤양 환자의 위점막에 서 분리한 후 병독유전자 및 공포성 세포독소 생성 을 확인하였다.11 HP99은 cagA+/cytotoxin+이었다.
김주성 외 5인. H. pylori에 의한 호중구 세포사멸 억제 689
2) H . p y lori 수용성 추출물 제조
HP99를 계대배양 횟수가 10회를 넘지 않는 범위 내에서 대량으로 배양하였다. H. pylori 수용성 추출 물은 이전의 보고16에서 약간 변형된 방법으로 제조 하였다. 배양된 균을 증류수에 109/ml의 농도로 부 유시키고 부유액을 실온에 10분 동안 둔 다음 20초 동안 vortexing하였다. 12,000 rpm으로 15분 동안 원 심분리한 후 상청액을 ultrafiltration membrane (Diaflo ultrafilter, Amicon, Inc., Beverly, MA, USA) 을 이용하여 10,000 Da 이하의 물질을 제거함과 동 시에 농축한 다음 -70℃에 보관하였다. 사용 직전에 18,000 rpm으로 20분 동안 원심분리한 후 상청액을 0.2 m 필터에 통과시켰다.
대조실험을 위하여 H. pylori와 유사한 Campylo- bacter jejuni, Campylobacter fetus subsp. fetus 및 비 병원성 Escherichia coli DH5α(Promega, Madison, WI, USA) 수용성 추출물을 동일한 방법으로 제조 하였다.
3) H . p y lori 수용성 추출물에서의 성분 확인 H. pylori 수용성 추출물에서의 총단백량17 및 urease 활성도11,18를 이전의 보고와 동일하게 측정하 였다. 총단백량은 3.3 mg/ml이었고, urease 활성도는 91 U/ml이었으며 urease 특이활성도는 27.6 U/mg of protein/ml이었다. H. pylori 수용성 추출물에서 lipo- polysaccharide (LPS) 함유량을 확인하기 위하여 Limulus amebocyte lysate assay (Pyrotell test, Asso- ciates of Cape Cod, Inc., Falmouth, MA, USA)를 이 용하여 endotoxin 활성도를 측정하였다. Lyophilized standard endotoxin이 들어있는 tube에 H. pylori 수 용성 추출물 200 L를 넣고 잘 섞은 다음 37℃에서 1시간 동안 둔 후 gel clot이 일어나는 지를 확인하 였다. Endotoxin 활성도는 gel clot이 일어나는 최소 량의 U.S. standard endotoxin unit (EU)로 정의하였 다. 본 연구에 사용되었던 H. pylori 수용성 추출물 에서의 endotoxin 활성도는 0.125 EU/ml 이었다.
2. 인체 호중구의 분리 및 배양 1) 호중구의 분리
건강한 공혈자의 말초혈액에서 분리된 buffy coat 에 2% dextran 용액을 첨가하여 30분 동안 실온에 두었다. 그 상청액에 1/4 volume의 Histopaque-1077 (Sigma, St. Louis, MO, USA)을 첨가하여 1,450 rpm 으로 30분 동안 원심분리한 후 침전된 pellet을 얻었 다. 남아있는 적혈구는 0.2% NaCl로 처리하여 완전 히 제거하였고, 순수분리된 호중구를 phosphate- buffered saline (PBS)으로 세척하여 실험에 사용하 였다.
2) 생존도 및 순도 확인
Hemacytometer로 세포수를 측정한 후 trypan blue exclusion test로 세포의 생존도를 확인하였다. 세포 형태를 현미경으로 확인하고 단핵구에 특이적인 fluorescein isothiocyanate (FITC)-conjugated anti- CD14 antibody (Becton Dickinson, San Jose, CA, USA)를 이용한 flow cytometry (Becton Dickinson) 로 단핵구 오염 정도를 측정함으로써 순도를 확인 하였다. 호중구의 생존도 및 순도가 각각 95%를 넘 는 경우에 다음 실험으로 진행하였다.
3) 호중구의 배양
RPMI-1640 배지(Sigma)에 10 mM HEPES (Sigma), 2 mM L-glutamine 및 10% fetal bovine serum (Hyclone Laboratories, Logan, UT, USA)을 첨가하 여 호중구를 배양하였으며, 배양용기는 호중구의 활 성화를 방지하기 위하여 polypropylene tube를 사용 하였다.
3. 호중구에 H . p y lori 수용성 추출물 투여 호중구 세포수가 5×106/ml이 되도록 배양액에 suspension시킨 후 배양액만 넣은 대조군과 H.
pylori 수용성 추출물을 첨가한 군을 각각 배양시켰 다. H. pylori 수용성 추출물을 연속 희석하여 호중 구 apoptosis를 cytosolic oligonucleosome-bound DNA ELISA 방법으로 측정하였을 때, 호중구 apop- tosis를 유의하게 억제하는 최소 농도는 50 μl/ml이
690 The Korean Journal of Gastroenterology : Vol. 35, No. 6, 2000
었다. 그러므로 본 연구에서는 H. pylori 수용성 추 출물을 50 μl/ml 농도로 투여하였다. 대조실험으로 호중구 apoptosis를 억제하는 것으로 알려진 E. coli LPS (10 μg/ml, Sigma) 및 apoptosis를 유도하는 것 으로 알려진 cycloheximide (5 μg/ml, Sigma)를 첨가 하여 호중구를 배양하였다.
4. 호중구의 a popt os is 측정 1) 형광현미경 관찰
106개의 세포를 PBS에 부유시킨 후 3.7% glu- taraldehyde를 가한 후 얼음에 10분 동안 두었다.
Hoechst 33342를 5 g/ml의 농도가 되도록 투여한 후 실온에 5분 동안 두었다. 이후 cytospin (Cytos- pin3, Shandon, Cheshire, England)을 이용하여 세포 를 슬라이드에 부착시키고, 형광현미경(Axiophot Photomicroscope, Carl Zeiss, Oberkochen, Germany) UV filter를 이용하여 관찰하였다. 세포 핵이 분절되 었거나 염색질의 형광강도가 농축된 세포를 apop- tosis로 진행된 세포로 파악하였다.
2) 전자현미경 관찰
107개의 세포를 2.5%의 glutaraldehyde에 전고정 후, 1% osmium tetroxide에서 후고정을 하고 저농도 의 에탄올에서 고농도 순으로 탈수를 시행하였다.
이어서 에폭시수지(Polyscience, USA)에 포매를 한 후 세포의 보존 상태가 좋고 필요한 부위를 선정하 여 ultramicrotome (Sorvall MT-6000, Dupont, France)으로 60-80 μm 두께로 초박절편을 만들어 uranyl acetate와 lead citrate로 전자염색을 시행 후 투과형 전자현미경(H-700, Hitachi, Japan)으로 저배 율 및 고배율에서 관찰하고 사진을 촬영하였다.
3) T er m in a l deox y n uc le ot idy l t r a n s f e r a s e- media ted deox yuridine t r iphos pha te nick- e n d la b elin g (T U N E L) a s s a y
5×106개의 세포를 PBS 0.5 ml에 부유시키고, 1% paraformaldehyde 5 ml을 가한 후 얼음에 15분 동안 두었다. 300×g로 5분 동안 원심분리한 후 상 청액은 버리고 2번 PBS로 세척하였다. Cell pellet을 PBS 0.5 ml에 부유시키고 ice-cold 70% ethanol 5
ml을 가한 후 -20℃에 하루 이상 보관하였다.
TUNEL assay는 양성 대조군 및 음성 대조군과 함 께 사용하였다. Ice-cold 70% ethanol에 부유된 세포 를 1000×g로 5분 동안 원심분리하여 pellet을 얻었 다. Wash buffer로 2회 세척한 후 staining solution 50 l로 부유시킨 후 37℃에서 60분 동안 두었다.
Staining solution은 TdT reaction buffer, TdT enzyme, FITC-dUTP 및 distilled H2O로 구성되었다.
이후 rinse buffer로 2회 세척하고 남은 cell pellet에 propidium iodide/RNase solution 1 ml에 부유시킨 후 실온에서 30분 동안 어두운 곳에 둔 다음 flow cytometry (Becton Dickinson)를 이용하여 측정하였 다. 이상의 실험은 Complete Flow Cytometry Kit (APO-DIRECT, PharMingen, San Diego, CA, USA) 를 이용하여 시행하였다.
4) Cy t os olic olig on uc le os om e- bou n d DN A E LIS A
105개의 세포에 lysis buffer 0.2 ml을 가한 후 실 온에 30분 동안 둔 다음, 20,000×g로 10분 동안 원 심분리한 후 상청액을 분리하여 ELISA (Cell Death Detection ELISAPLUS Kit, Boehringer Mannheim)를 시행하였다. 대상 검체 20 l에 anti-histone, anti- DNA-POD 및 incubation buffer로 구성된 immuno- reagent 80 l를 가한 후 실온에 2시간 동안 두었다.
Incubation buffer 250 l로 3회 세척한 후 substrate solution 100 l를 가하고 20분 동안 둔 후 405 nm 파장(reference filter: 492 nm)하에서 ELISA reader 로 광학지수를 측정하였다.
5. 호중구의 cy t ot ox icit y 측정 1) T r y pa n blue e x c lu s ion t es t
105개의 세포를 PBS 0.1 ml로 부유시킨 후 0.4%
trypan blue 0.1 ml을 가한 다음 10분 동안 두었다.
Hematocytometer에 부유액을 가하고 광학현미경으 로 관찰하였다. 세포가 염색되지 않으면 살아있는 세포, 염색되면 죽은 세포로 간주하여 count하였다.
2) LDH a s s a y
세포가 파괴되어 세포 내 LDH가 방출되는 정도
Kim, et al. Inhibition of Neutrophil Apoptosis by H. pylori 691
를 검출하는 Cytotoxicity Detection Kit (LDH) (Boehringer Mannheim)를 이용하여 세포독성 정도 를 측정하였다. 호중구 배양상청액 0.1 ml에 catalyst 및 dye solution으로 구성된 reaction mixture 0.1 ml 을 가한 후 실온에 20분 동안 어두운 곳에 두었다.
490 nm 파장(reference filter: 630 nm)하에서 ELISA reader로 광학지수를 측정하였다.
6. 호중구에서 F a s , F a s lig a n d 및 T N F - R1 유전자 발현
1) 역전사 P CR( RT - P CR) (1) 호중구로부터 RNA 추출
대조군과 H. pylori water extract군에서 각 시간대 별로 guanidinium thiocyanate-phenol-chloroform법을 이용하여 호중구로부터 RNA를 추출하였다.
(2) 역전사
추출한 1 g RNA를 0.1 g oligo (dT)15 및 50 unit 역전사효소(Moloney murine leukemia virus reverse transcriptase, Gibco Research Laboratories, Gaithersburg, MD, USA)와 함께 37℃에서 60분 동 안 반응시켜 cDNA를 만들었다. 이 때 사용된 buffer 는 10 mM Tris (pH 8.3), 50 mM KCl, 5 mM MgCl2, 1 mM씩의 dATP, dCTP, dGTP 및 dTTP로 구성되었다.
(3) cDNA PCR
상기 방법으로 만든 cDNA를 10 mM Tris (pH 8.3), 50 mM KCl, 1.5 mM MgCl2, 200 M씩의 dATP, dCTP, dGTP 및 dTTP 그리고 25 pmole씩의 sense primer와 antisenser primer가 포함된 50 L의 buffer에서 PCR thermal cycler로 증폭시켰다. 사용 한 primer의 염기서열은 Table 1과 같다. 반응액을 95℃에서 5분간 가열한 후 85℃에서 7분 가량 유지 시키면서 각 반응관에 2.5 unit의 Taq DNA poly- merase를 첨가하였다. 증폭프로그램은 Fas의 경우 95℃에서 1분간 denaturation시키고, 60℃에서 1분 동안 annealing 및 72℃에서 1분 동안 extension이 일어나도록 하며, FasL의 경우 95-55-72℃로 각각 1 분 동안 시행하였다. TNF-R1의 경우는 95℃에서 45 초 동안 denaturation시키고, 65℃에서 1분 45초 동 안 annealing 및 extension이 일어나도록 하였다. 이 와 같은 cycle의 총 횟수는 Fas는 33회, FasL는 40회 및 TNF-R1은 33회로 정하였다. 역전사 및 cDNA PCR 과정 각각에서 음성 대조군을 두었으며, 양성 대조군은 phytohemagglutinin으로 활성화시킨 말초 혈액 단핵구로부터 추출한 RNA를 이용하였다.
PCR이 끝난 후 2% NuSieve agarose gel로 전기영동 하여 band를 확인하였다.
Table 1. Oligonucleotide Primers and Size of the PCR Product for Fas, Fas Ligand and Tumor Necrosis Factor Receptor 1 Genes
Genes Primer sequence Size of PCR product (bp)
Fas Sense Antisense Fas ligand
Sense Antisense TNF-R1
Sense Antisense
5'-CGGAGGATTGCTCAACAAC-3'
5'-TTGGTATTCTGGGTCCG-3'
5'-CAGCTCTTCCACCTACAGAAGG-3'
5'-AGATTCCTCAAAATTGACCAGAGAGAG-3'
5'-TCGCTACCAACGGTGGAAGTCC-3'
5'-TGTCTAGGCTCTGTGGCTTGTGGGC-3'
397
510
356
TNF-R1, tumor necrosis factor receptor 1.
692 대한소화기학회지 : 제 35 권 제 6 호 2000
(4) Semiquantitative analysis
역전사 후 얻은 cDNA에 Fas, FasL, TNF-R1 및 β-actin에 특이한 primer를 이용하여 PCR을 시행한 후 PCR product를 전기영동하여 Polaroid film에 image를 기록하였다. Polaroid film을 영상밀도계 (imaging densitometer GS-670, BioRad, Hercules, CA, USA)로 처리하여 각 PCR band의 peak에 해당 하는 면적을 구하였다. 그 후 목표 RNA로부터의 PCR product와 -actin RNA로부터의 PCR product 면적비를 구하여 비교하였다.
2) Ribon u clea s e pr ot e ct ion a s s a y
호중구에 H. pylori 수용성 추출물을 투여하여 24 시간 배양한 후 guanidinium thiocyanate-phenol- chloroform법을 이용하여 RNA를 추출하였다. Fas 및 TNF-R1의 발현을 ribonuclease protection assay (hAPO-3 multi-probe template set 및 RiboQuant RPA kit, PharMingen)로 동시에 분석하였다. In vitro transcription은 [α32P]UTP와 T7 RNA poly- merase가 포함된 transcription buffer에서 이루어졌 으며, DNase 투여 후 riboprobe를 분리하였다.
Riboprobe의 표지능(labeling efficiency)은 scintilla- tion counter로 측정한 cherenkov 활성도(activity)로 확인한 다음 제조회사에서 제시한 적정 활성도로 희석하였다. Riboprobe set에 호중구 RNA 20 μg을 넣고 90℃로 열을 가한 후 56℃로 낮추고 overnight annealing 하였다. RNase 및 proteinase K를 투여한 다음 phenol/chloroform 추출 및 ammonium acetate, ethanol 침전으로 protected RNA hybrid를 순수분리 하였다. 5% acrylamide gel을 이용하여 전기영동하 였고 autoradiography를 시행하였다. RNA band는 imaging densitometer (GS-670)를 이용하여 분석하 였고, internal control인 L32, GAPDH의 비(ratio)로 표준화하였다.
3) N or t he r n blot
Fas ligand RNA를 검출하기 위하여 Northern blotting을 시행하였다. 호중구 RNA 20 μg을 agarose- formaldehyde gel에서 전기영동한 후 ethidium bro-
mide로 염색하여 RNA loading 되었음을 확인하였 다. Gel 내의 RNA를 Capillary blotting으로 positively charged nylon membrane (Ambion, Austin, TX, USA)으로 transfer하였다. Transfer 정도는 ethidium bromide 염색 정도로 확인하였다. RNA를 vacuum oven에 고정시킨 다음, prehybridization 과정을 거쳐 random priming (Prime-It RmT random primer labeling kit, Stratagene, La Jolla, CA, USA)에 의하 여 [α32P]dCTP로 표지된 cDNA probe (510 bp)와 hybridization을 시행하였다. Autoradiography 후 imaging densitometer를 이용하여 RNA band를 정량 하였다.
7. 호중구에서 F a s , F a s lig a n d 및 T NF - R1 단백질 발현
1) 호중구에서의 단백질 생성
호중구 내에서 Fas, Fas ligand 및 TNF-R1 단백질 생성을 Western blotting으로 확인하였다. 107개의 세포에 CHAPS lysis buffer (20 mM HEPES, 140 mM NaCl, 10 mM CHAPS, 2 mM EDTA, 1 mM EGTA, 5 mM orthovanadate, 500 μM molybdate, 1 mM PMSF, 1 mM benzamidine 및 각각 20 μg/ml 농도의 antipain, leupeptin, pepstatin, pH 7.4)를 가한 후 얼음에 15분 동안 둔 다음, 4℃에서 15,000×g로 15분 동안 원심분리하여 그 상청액을 -70℃에 보관 하였다. Cell lysate 20 μg을 2X SDS sample buffer 에 1:1로 혼합하여 5분 동안 가열한 후 SDS polyacrylamide gel에 전기영동한 다음 nitrocellulose membrane (Hybond ECL, Amersham, Buckingham- shire, England)에 transfer하였다. 10% bovine serum albumin으로 밤새 blocking 시킨 후 anti-Fas (Ab-1) polyclonal antibody (Calbiochem, Cambridge, MA, USA), anti-Fas ligand monoclonal antibody (Trans- duction Laboratories, Lexington, KY, USA) 및 anti- TNF-R1 monoclonal antibody (R&D Systems, Min- neapolis, MN, USA) 1:1000으로 희석한 1차항체를 2시간 동안 가한 다음 세척하였다. Horseradish peroxidase에 결합된 2차항체를 1시간 동안 가한 후 enhanced chemiluminescence system (ECL, Amer- sham, Buckinghamshire, England)을 이용하여 blot을
김주성 외 5인. H. pylori에 의한 호중구 세포사멸 억제 693
확인하였다.
2) 호중구 배양상청액에서의 단백질 확인 호중구를 24, 48시간 배양한 다음 원심분리하여 호중구 배양상청액을 얻었다. 배양상청액을 ultrafi- ltration membrane (Diaflo ultrafilter, Amicon, Inc.,) 을 이용하여 10,000 Da 이하의 물질을 제거함과 동 시에 농축하였다. 배양상청액을 Lowry 방법으로 총 단백량을 측정한 후, 총단백량을 30 μg으로 맞추어 상기 방법과 동일하게 Western blotting을 시행하였다.
8. 호중구 표면에서의 F a s , F a s lig a n d 및 T N F - R1 발현
호중구 표면에서의 Fas, Fas ligand 및 TNF-R1 발 현 정도를 flow cytometry로 측정하였다. 2×106개
의 세포에 2% paraformaldehyde를 가한 후 얼음에 서 20분 동안 둔 다음 세척하였다. Anti-Fas (Ab-2) monoclonal antibody (Calbiochem), anti-Fas ligand monoclonal antibody (Transduction Laboratories) 및 anti-TNF-R1 monoclonal antibody (R&D Systems) 1 차항체를 30분 동안 가한 후 세척하였다. FITC- conjugated anti-mouse IgG1 monoclonal antibody (PharMingen, San Diego, CA, USA) 2차항체를 30 분 동안 가한 후 세척한 다음 flow cytometry를 이 용하여 mean fluorescence intensity를 측정하였다.
9. 통계적 분석
결과는 mean±SE로 제시하였으며, 통계적 분석 을 위하여 Wilcoxon rank sum test를 사용하였다.
P<0.05일 때 통계적으로 유의한 것으로 평가하였다.
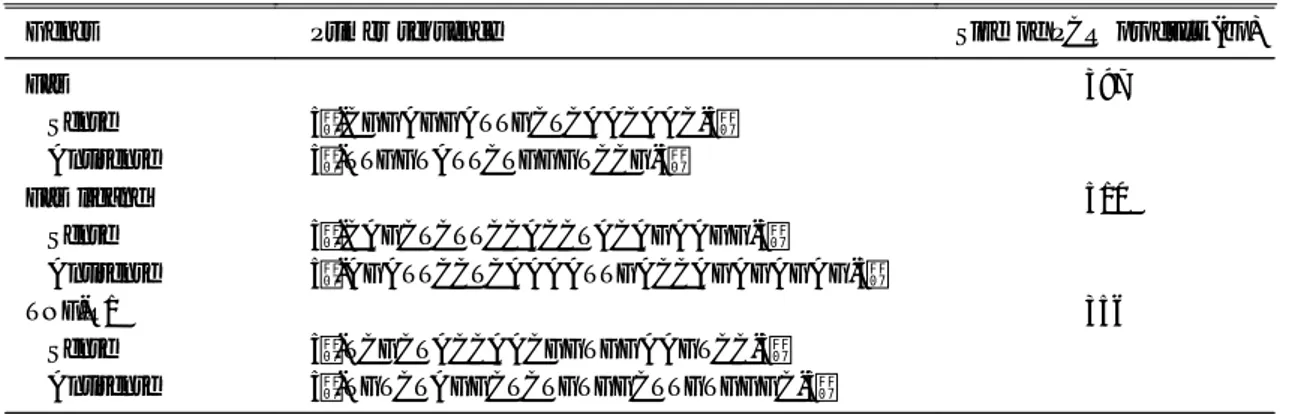
Fig. 1. Fluorescent microscopy using DNA-specific fluorochrome staining. After neutrophils were incubated, cells were fixed with glutaraldehyde and stained with Hoechst 33342. Apoptotic cells were characterized by enhanced fluorescence in fragmented nuclei and the presence of condensed chromatins in their nuclei (magnification ×1,000).
(A), freshly isolated neutrophils; (B), neutrophils treated with cycloheximide (5 μg/ml) for 12 h, showing the typical appearance of apoptotic cells; (C), neutrophils cultured with medium only for 24 h; (D), neutrophils co-cultured with H. pylori water extract for 24 h.
694 The Korean Journal of Gastroenterology : Vol. 35, No. 6, 2000
결 과
1. 호중구의 a popt os is 측정 1) 형광현미경 관찰
H. pylori 수용성 추출물을 첨가하고 24시간 동안 호중구를 배양한 다음 Hoechst 33342 염색 후 형광 현미경 관찰 결과 대조군에 비해 호중구 apoptosis 가 현저히 억제되었음을 확인하였다(Fig. 1). 특징적 인 apoptosis 세포는 분절된 핵에 형광강도가 강하 게 발현되었으며, 핵에 염색질의 형광이 농축되어 관찰되었다.
2) 전자현미경 관찰
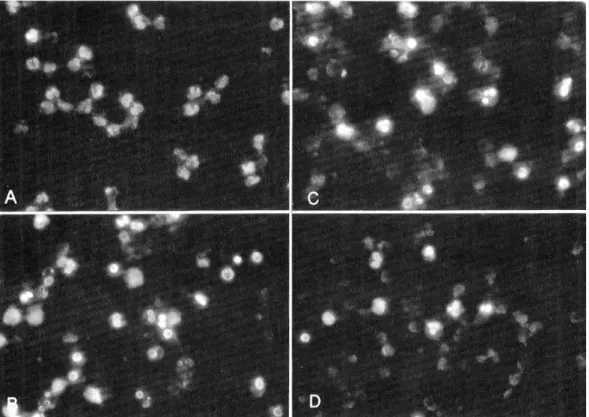
H. pylori 수용성 추출물을 첨가하고 24시간 동안 호중구를 배양한 다음 투과 전자현미경 관찰 결과 대조군에 비해 호중구 apoptosis가 현저히 억제되었 음을 확인하였다(Fig. 2). 고배율로 개개 세포의 특 징적인 apoptosis 형태를 관찰하였고, 저배율로 한 시야에서 전체 세포 중 apoptosis 세포의 분획을 측 정할 수 있었다.
3) T U NE L a s s a y
호중구에서 FITC-dUTP 결합을 flow cytometry로
Fig. 2. Transmission electron microscopy of neutrophil apoptosis. (A), a freshly isolated normal neutrophil (magnification ×11,200); (B), an apoptotic neutrophil with electron dense chromatins in the fragmented nuclei (magnification ×12,600); (C), neutrophils cultured with medium only for 24 h (magnification ×3,160); (D), neutrophils co-cultured with H. pylori water extract for 24 h (magnification ×3,160).
Kim, et al. Inhibition of Neutrophil Apoptosis by H. pylori 695
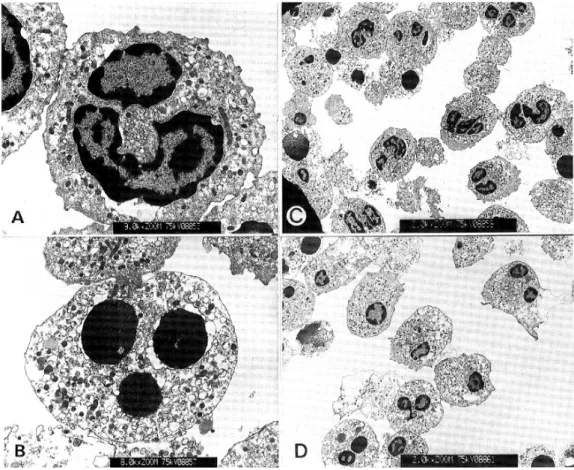
분석하였을 때, H. pylori 수용성 추출물을 첨가한 군에서 대조군에 비해 DNA fragmentation이 현저히 감소되었다(Fig. 3). Apoptosis가 일어난 세포는 pro- pidium iodide에 염색되지 않고 FITC-dUTP에 대한 형광강도가 증가되어 나타난 세포로 규정하였다. E.
coli LPS를 전처치하였을 때에도 호중구 apoptosis가 감소되었으며, 그 정도는 수용성 추출물을 첨가한 군과 비슷하였다.
4) Cy t os olic olig on ucleos om e - boun d DNA E LIS A
Apoptosis의 정도를 정량적으로 측정하는 방법으 로 cytosolic oligonucleosome-bound DNA ELISA가 개발되어 있다. 처치를 행하지 않았던 호중구를 시 험관에서 배양한 결과 apoptosis가 매우 빨리 진행되
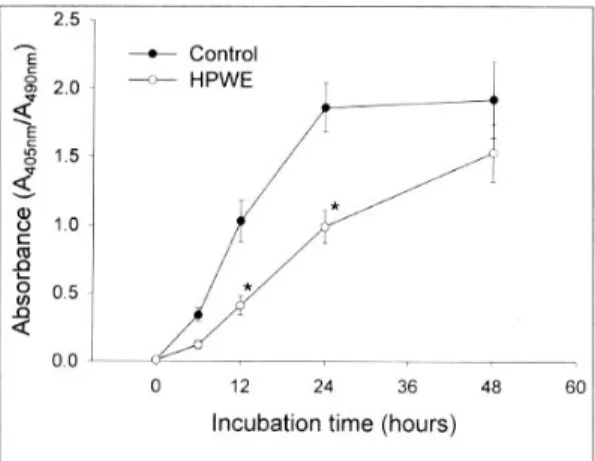
었지만, H. pylori 수용성 추출물을 첨가한 군에서는 apoptosis 진행이 억제되었음을 확인하였다(Fig. 4).
H. pylori와 유사한 세균인 C. jejuni, C. fetus subsp. fetus 및 E. coli DH5α 수용성 추출물을 호중 구에 투여하여 배양한 후 cytosolic oligonucleosome- bound DNA ELISA를 시행한 결과 호중구 apoptosis 는 대조군과 차이가 없었다(Fig. 5).
2. 호중구의 cy t ot ox icit y 측정
Trypan blue exclusion test 결과 H. pylori 수용성 추출물군에서 대조군에 비해 세포생존율이 높았다.
호중구 배양상청액에서 LDH assay 결과 H. pylori 수용성 추출물군에서 대조군에 비해 LDH 분비량이 적게 나타났다(Fig. 6). 그러나 C. jejuni, C. fetus subsp. fetus 및 E. coli DH5α 수용성 추출물을 호중
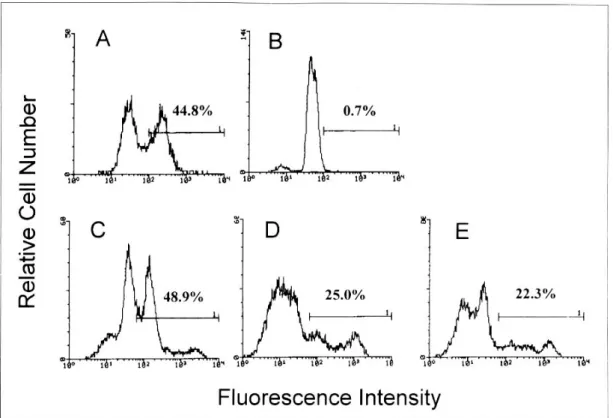
Fig. 3. Terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nick-end labeling assay for the detection of apoptosis. A complete flow cytometry kit for apoptosis was performed according to the manufacturer' s instruction. (A), a positive control; (B), a negative control; (C), neutrophils cultured with medium only for 24 h; (D), neutrophils co-cultured with H. pylori water extract for 24 h; (E), neutrophils incubated with E. coli lipopolysaccharide (10 μg/ml) for 24 h. Data shown is representative of three separate experiments.
696 대한소화기학회지 : 제 35 권 제 6 호 2000
Fig. 4. Enzyme immunoassay for the quantitative determi- nation of cytoplasmic histone-associated-DNA fragments.
Neutrophils were incubated with H. pylori water extract (HPWE) or medium only (control) for 48 h, and then cells were lysed at the designated time point. The absorbance of samples at 409 nm using a reference wave-length of 490 nm was measured using an ELISA reader. Values repre- sent means±SE of four separate experiments.
* p<0.05 compared with controls.
Fig. 6. Lactate dehydrogenase assay in the neutrophil culture supernatants. After neutrophils were incubated with H. pylori water extract (HPWE), E. coli lipopolysaccharide (LPS, 10 μg/ml) or medium only (control) for 48 h, cell culture supernatants were mixed with diaphorase and tetrazolium salt, and incubated in the dark for 20 min at room temperature. The absorbance of samples at 490 nm using a reference wave-length of 630 nm was measured.
Values represent means±SE of four separate experiments.
* p<0.05 compared with controls.
Fig. 7. Lactate dehydrogenase assay in the neutrophil culture supernatants of water extracts of H. pylori and H.
pylori-related bacteria. After neutrophils were incubated with water extracts of H. pylori (HPWE), C. jejuni (CJWE), C. fetus subsp. fetus (CFWE), and E. coli DH5 (ECWE) or medium only (control) for 24 h and 48 h, cell culture supernatants were mixed with diaphorase and tetrazolium salt, and incubated in the dark for 20 min at room temperature. The absorbance of samples at 490 nm using a reference wave-length of 630 nm was measured.
Values represent means SE of three separate experiments.
* p<0.05 compared with controls.
Fig. 5. Apoptosis of neutrophils co-cultured with water extracts of H. pylori and other bacteria that are closely related to H. pylori. After neutrophils were incubated with water extracts of H. pylori (HPWE), C. jejuni (CJWE), C.
fetus subsp. fetus (CFWE), and E. coli DH5α (ECWE) or medium only (control) for 24 h, cells were lysed and apoptosis was determined quantitatively using enzyme immunoassay for the cytoplasmic histone-associated-DNA fragments. The absorbance of samples at 409 nm using a reference wave-length of 490 nm was measured using an ELISA reader. Values represent means±SE of four separate experiments.
* p<0.05 compared with controls.
김주성 외 5인. H. pylori에 의한 호중구 세포사멸 억제 697
구에 투여하여 배양한 후 LDH assay를 시행한 결과 호중구 cytotoxicity는 대조군과 차이가 없었다(Fig. 7).
3. 호중구에서 F a s , F a s lig a n d 및 T N F - R1 유전자 발현
RT-PCR 결과 호중구에서 Fas, FasL 및 TNF-R1 mRNA가 기본적으로 발현(constitutive expression)되 고 있음을 확인하였다. 유전자 반정량분석 결과 Fas 및 TNF-R1 mRNA는 자극군이나 대조군 간에 차이 가 없었으나 FasL mRNA 발현은 자극군에서 대조 군에 비해 band intensity가 35-55% 감소되었다(Fig.
8). RT-PCR 결과를 재확인하기 위해서 ribonuclease protection assay 및 Northern blotting을 시행하였다.
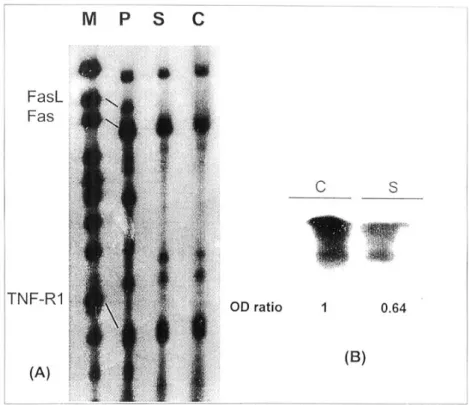
Ribonuclease protection assay 결과 자극군에서의 Fas 및 TNF-R1 RNA는 대조군과 차이가 없었으며, Fas ligand는 양군 모두 검출되지 않았다(Fig. 9A).
Fas ligand에 대한 Northern blotting 결과 자극군에 서의 RNA band가 대조군에 비해 35% 정도 감소되 어 RT-PCR의 결과와 일치하였다(Fig. 9B).
4. 호중구에서 F a s , F a s lig a n d 및 T N F - R1 단백질 발현
1) 호중구에서의 단백질 생성
Fas, Fas ligand 및 TNF-R1 유전자 발현이 단백질 생성으로 이어지는지를 확인하기 위하여 Western blotting을 시행하였다. 그 결과 신선분리된 호중구 에서 상기 단백질이 생성됨을 확인하였으며, Fas 및 TNF-R1 단백질량은 자극군이나 대조군 간에 차이 가 없었으나 FasL 단백질량은 자극군에서 대조군에 비해 30-40% 감소되었다(Fig. 10).
2) 호중구 배양상청액에서의 단백질 확인 호중구 배양상청액에서 soluble form의 Fas, Fas ligand 및 TNF-R1을 검출하기 위하여 Western blot- ting을 시행하였다. 배양조건을 유지시키면서 검출 률을 높이기 위해 배양상청액을 농축하여 분석하였 다. 그 결과 자극군 배양상청액에서 soluble form의 Fas, Fas ligand 및 TNF-R1이 대조군에 비하여 현저 히 증가되었다(Fig. 11).
5. 호중구 표면에서의 F a s , F a s lig a n d 및 T N F - R1 발현
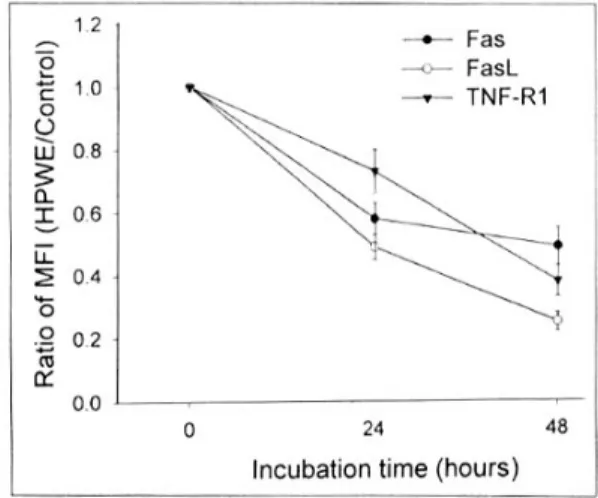
Flow cytometry를 이용하여 호중구 표면에서의 Fas, Fas ligand 및 TNF-R1 발현 정도를 측정하였을 때, 자극군에서의 세포표면 발현이 하향 조절되었으 며 특히 FasL의 감소가 현저하였다(Fig. 12). 그러나 H. pylori와 유사한 세균인 C. jejuni, C. fetus subsp.
fetus 및 E. coli DH5α 수용성 추출물을 호중구에 투여하여 배양한 후 호중구 표면에서의 Fas, Fas ligand 및 TNF-R1 발현 정도를 측정한 결과, 대조군 과 차이가 없었다(Table 2).
고 찰
인체 호중구는 최종 분화된 혈액세포로 면역체계 에서 특이적 세포방어를 담당하여 세균 감염시 제1 단계 방어기구의 중심적 역할을 수행한다. 골수에서 말초혈액으로 나오면서 호중구는 완전히 성숙하여 조직으로 이동하면서 기능을 수행하게 된다. 성숙된 Fig. 8. Reverse transcription-polymerase chain reaction
(RT-PCR) analysis of Fas, Fas ligand (FasL) and tumor necrosis factor receptor 1 (TNF-R1). After neutrophils were co-cultured with H. pylori water extract (HPWE) for 12, 24 and 48 h, total cellular RNA was extracted by the guanidinium thiocyanate-phenol-chloroform method. Mes- senger RNA from Fas, FasL and TNF-R1 was demons- trated by RT-PCR using specific primers. Representative Polaroid films of at least three separate experiments are shown. (+), positive control; (-), negative control; C, neutrophils cultured with medium only (control); S, neutrophils co-cultured with HPWE.
698 The Korean Journal of Gastroenterology : Vol. 35, No. 6, 2000
Fig. 9. RNA blot analysis of Fas, Fas ligand (FasL) and tumor necrosis factor receptor 1 (TNF-R1). After neutrophils were co-cultured with H. pylori water extract (HPWE) for 24 h, total cellular RNA was extracted by the guanidinium thiocyanate-phenol-chloroform method. RNA from Fas, FasL and TNF-R1 was demonstrated by ribonuclease protection assay and Northern blot analysis. Results shown are representative of three separate experiments: (A), ribonuclease protection assay for Fas, FasL and TNF-R1; (B), Northern blot analysis for FasL. M, marker; P, peripheral blood mononuclear cells activated by phytohemagglutinin; C, neutrophils cultured with medium only (control); S, neutrophils co-cultured with HPWE.
Table 2. Ratio of the Mean Fluorescent Intensity of Fas, Fas Ligand and Tumor Necrosis Factor Receptor 1 on the Surface of Neutrophils After Treated with Water Extracts of the H. pylori-Related Bacteria
Fas Fas ligand TNF-R1
24 h 48 h 24 h 48 h 24 h 48 h
CJWE/Control CFWE/Control ECWE/Control
0.98±0.05 0.91±0.09 1.04±0.04
0.81±0.07 0.79±0.11 0.76±0.09
0.89±0.11 0.94±0.12 0.87±0.08
0.75±0.13 0.72±0.15 0.72±0.11
0.87±0.08 0.90±0.11 0.92±0.06
0.83±0.07 0.77±0.10 0.76±0.12 After neutrophils were co-cultured with water extracts of C. jejuni (CJWE), C. fetus subsp. fetus (CFWE), and E. coli DH5α (ECWE) or medium only (control) for 24 h and 48 h, cells were fixed with paraformal- dehyde, and then incubated with each of the primary monoclonal antibody. After washing, cells were incubated with FITC-conjugated secondary antibody, and analyzed by flow cytometry. The results were expressed as the ratio of the mean fluorescence intensity of the H. pylori-related bacteria group to the control.
Values represent means±SE of three separate experiments; TNF-R1, tumor necrosis factor receptor 1.
Kim, et al. Inhibition of Neutrophil Apoptosis by H. pylori 699
호중구는 시간이 경과함에 따라 apoptosis 과정을 거쳐 vitronectin 수용체를 매개로 대식세포에 탐식 된다.19 호중구에서의 apoptosis 프로그램은 감염 및 면역의 국소적 미세환경에서 발현되는 여러 인자에 대하여 매우 민감하게 반응한다. 즉, 호중구 apop- tosis는 세균 LPS 혹은 IL-1β, IL-2, IL-8, GM-CSF, G-CSF, interferon-γ 등의 친염증성 cytokine, 그리 고 glucocorticosteroid에 의하여 억제된다.15,20-22
본 연구에서 H. pylori 수용성 표면단백질이 호중 구 apoptosis 및 세포독성을 억제하였음을 최초로 규명하였다. 그러나 H. pylori와 유사한 세균인 C.
jejuni, C. fetus subsp. fetus 및 비병원성 E. coli DH5 α 수용성 추출물을 투여하였을 때 호중구 apoptosis 에 영향을 미치지 못하였다. 이와 같은 결과는 H.
pylori 수용성 표면단백질 중 다른 비침습성 세균에 없는 단백질이 호중구 apoptosis를 억제하였을 것이 라는 점을 제시해 준다. 그런데 그람음성균이 공통 으로 갖는 LPS에 의한 apoptosis 억제효과에 의할 Fig. 12. Flow cytometry of the surface expression of Fas, Fas ligand (FasL) and tumor necrosis factor receptor 1 (TNF-R1) on neutrophils. After neutrophils were co- cultured with H. pylori water extract (HPWE) for 12, 24 and 48 h, cells were fixed with paraformaldehyde, and then incubated with primary monoclonal antibody. After washing, cells were incubated with FITC-conjugated secondary antibody, and analyzed by flow cytometry. The results were expressed as the ratio of the mean fluores- cence intensity (MFI) of the HPWE-treated group to the control. Values represent means±SE of three separate experiments.
Fig. 10. Western blot analysis of Fas, Fas ligand (FasL) and tumor necrosis factor receptor 1 (TNF-R1). After neutrophils were co-cultured with H. pylori water extract (HPWE) for 12, 24 and 48 h, cell lysates were electro- phoresed in sodium dodecyl sulfate-polyacrylamide 10%
gradient gel and electroblotted on nitrocellulose filters.
Blots were incubated with primary and horseradish peroxi- dase-conjugated secondary antibodies, and then developed using an enhanced chemiluminescence detection kit.
Representative Western blots of three separate experiments are shown. C, neutrophils cultured with medium only (control); S, neutrophils co-cultured with HPWE.
Fig. 11. Western blot analysis of the soluble form of Fas (sFas), Fas ligand (sFasL) and tumor necrosis factor receptor 1 (sTNF-R1). After neutrophils were co-cultured with H. pylori water extract (HPWE) for 24 and 48 h, cell culture supernatants were concentrated by means of ultrafiltration membranes. Samples were electrophoresed in the sodium dodecyl sulfate-polyacrylamide 10% gradient gel and electroblotted on nitrocellulose filters. Blots were incubated with primary and horseradish peroxidase- conjugated secondary antibodies, and then developed using an enhanced chemiluminescence detection kit. Representa- tive Western blots of at least two separate experiments are shown. C, neutrophils cultured with medium only (cont- rol); S, neutrophils co-cultured with HPWE.
700 대한소화기학회지 : 제 35 권 제 6 호 2000
가능성이 있다. 이런 가능성을 배제하기 위하여 본 연구에서 사용된 H. pylori 수용성 추출물에서 LPS 활성도를 측정한 결과 무시할 정도로 낮게 나타났 다. 따라서 본 연구의 결과는 LPS 효과에 의한 것이 아니라고 판단된다. 이와 같이 수용성 추출물 제조 시 LPS를 최소한으로 함유시키는 것이 그람음성균 이 공통으로 갖는 LPS에 의한 apoptosis 억제효과를 제거할 수 있으므로 중요한 실험 과정으로 여겨진 다. 또한, H. pylori 분비물질이 위점막에 흡수되어 호중구에 영향을 미치는 점을 고려하면 LPS를 제거 하는 것이 호중구 활성화 유도 및 apoptosis 조절 평 가에 중요할 것이다.
H. pylori 수용성 표면단백질 중 호중구 apoptosis 억제인자로서 가장 유력한 물질은 urease이다. H.
pylori 표면에 존재하는 urease는 위점막 정착 및 상 피세포 손상에 중요한 역할을 담당한다. 즉, 암모니 아와 물이 평형을 이루어 생성된 ammonium hy- droxide는 위점막세포에 직접적 독성을 일으키며,23 점액층 내에 높은 암모니아 농도는 수소이온 투과 성을 증가시켜 위궤양 형성을 유도할 수 있다.24 또 한, urease는 인체 백혈구에 대한 강력한 화학주성 인자로서 호중구 및 단핵구를 모집하고 활성화시켜 서 위점막 손상을 유발하는 것으로 알려졌다.25,26 본 실험에서 사용된 H. pylori 수용성 추출물에서 urease 활성도가 매우 높게 측정되었으므로 호중구 apop- tosis 억제의 주요 인자로 추정되며, 향후 단백질 순 수분리 작업을 통하여 새로운 단백질이 규명될 것 이다.
본 연구결과 호중구에서 Fas, FasL 및 TNF-R1이 기본적으로 발현하였음을 확인하였는데, 이는 호중 구 생존기간이 짧음을 설명하여 주는 것이라 판단 된다. 호중구 apoptosis 유도는 다음 두 가지 방법으 로 이루어질 것으로 생각된다. 즉, 세포표면의 Fas 및 TNF-R1에 인접세포에서 발현된 FasL 및 TNFα 가 결합되어 나타나는 방법과 한 세포 내에서 수용 체 결합에 의한 자살경로(suicidal pathway)를 들 수 있다. 본 저자들은 H. pylori 수용성 추출물을 투여 한 호중구에서 FasL 발현이 하향 조절되었음을 RT- PCR, Northern blotting, Western blotting 및 flow cytometry로 확인하였다. Fas 및 TNF-R1의 경우는
유전자 발현 및 단백질 생성에는 차이가 없었으나 세포표면에서의 발현이 하향 조절되었다. 그런데 호 중구 배양상청액 검사 결과 위의 soluble death fac- tor 분비가 증가하었다. 이와 같은 결과는 Fas 및 TNF-R1의 세포표면에서의 발현 감소가 이들 인자 들이 세포막으로부터 shedding되었기 때문이라는 점을 제시해 준다. 본 저자들의 설명을 뒷받침해 줄 수 있는 보고로서 soluble FasL가 세포막의 FasL에 서 분리되었고,27 metalloproteinase가 그 역할을 담 당한다는 것을 들 수 있다.28
Soluble FasL가 apoptosis 유도 기능이 있다고 하 더라도29 그 정도가 미약할 뿐만 아니라 세포막에 결합된 FasL의 apoptosis 기능을 차단하게 된다.30-32 그리고, Fas-매개 apoptosis 경로에서 가장 초기에 활성화되는 caspase-8은 세포막에 결합된 FasL에 의 해서 유도된 death-inducing signaling complex에 의 해서만 활성화되므로33 soluble FasL는 호중구 apop- tosis 유도 기능보다는 차단하는 방향으로 작용할 가 능성이 높다. 최근 시험관적 실험 및 생체실험 결과 soluble FasL는 호중구에 대하여 강력한 화학주성 활성도를 나타낸다는 보고가 있는데,34,35 이는 Fas가 apoptosis 경로 매개 이외에 새로운 신호전달을 수 행하는 역할이 있는 것으로 추정된다. 그러므로 H.
pylori 수용성 물질에 의하여 호중구로부터 위점막 고유층으로 분비된 soluble FasL는 호중구 apoptosis 억제 및 호중구 화학주성 기능에 의하여 호중구의 지속적 침윤을 유도한다고 추정된다. 한편 soluble form의 Fas 및 TNF-R1도 metalloproteinase-매개 과 정에 의해 분비되어 apoptosis를 억제함이 보고되었 으므로36-39 본 실험에서도 적용시킬 수 있을 것으로 생각된다. 종합하면, H. pylori 수용성 표면단백질에 의한 호중구 apoptosis 억제는 FasL의 발현 억제 및 Fas, TNF-R1의 세포표면 발현 억제에 기인할 것으 로 생각된다.
H. pylori 감염은 시험관이나 생체 내에서 위상피 세포 apoptosis를 유도한다.40-42 H. pylori에 감염된 위점막에서는 Fas/FasL 발현이 위상피세포 및 고유 층의 림프구에서 증가되어 있으므로 이들의 작용으 로 apoptosis가 유도되는 것으로 보고되었다.41 H.
pylori urease의 작용으로 생성된 ammonia는 주세포
김주성 외 5인. H. pylori에 의한 호중구 세포사멸 억제 701
(chief cell)의 apoptosis를 촉진시키는 것으로 알려졌 으며,43 ammonia 존재하에서 hypochlorous acid로 부 터 생성된 monochloramine은 위상피세포 apoptosis 를 증가시켰다.44 호중구가 위상피세포와 접촉하면 서 transepithelial migration하는 점을 고려하면 호중 구가 위상피세포 apoptosis에 관여할 수 있음을 예 견하게 된다. 즉, 호중구가 위상피세포와 접촉할 때 호중구에서 발현되는 FasL가 위상피세포의 Fas에 결합하면 apoptosis로 진행하는 것이다.45,46 그러므 로 H. pylori에 감염된 위점막에서 호중구 apoptosis 가 억제되면서 호중구 침윤이 지속되어 염증반응이 증폭될 뿐만 아니라 위상피세포 apoptosis를 촉진시켜 위・십이지장질환을 야기할 수 있으리라 생각된다.
결론적으로 H. pylori 수용성 표면단백질은 인체 호중구 apoptosis를 억제시켰으며, 그 조절은 호중구 에서의 FasL 발현 억제 및 Fas, TNF-R1의 세포표면 에서의 발현 억제에 기인할 것으로 생각된다. 향후 호중구 내 apoptosis 신호전달 체계에 관여하는 apoptosis 촉진물질 및 억제물질의 발현에 대하여 연구가 진행될 것이다.
요 약
목적: Helicobacter pylori는 비침습성 세균임에 도 불구하고 감염 후 위점막에는 다양한 염증세포 가 침윤하는데, 특히 호중구의 침윤이 특징적이다.
조직에 침윤한 호중구가 시간이 경과하면 세포사멸 (apoptosis)로 진행하여 대식구에 의해 탐식되어 분 해된다. 그러므로 호중구 apoptosis는 염증성 조직 손상의 조절에 중요한 현상으로 인정되고 있다. H.
pylori에 의한 호중구 apoptosis 조절에 대해서는 아 직까지 보고된 바 없었다. 본 연구에서는 H. pylori 에 감염된 위점막에 침윤된 호중구 apoptosis가 억 제되어 염증반응이 지속될 것이라는 가설을 세우고 이를 규명하고자 H. pylori 수용성 표면단백질에 의 한 호중구 apoptosis 및 세포사 조절을 확인하였다.
대상 및 방법: cagA+/cytotoxin+ H. pylori를 증류수 에 부유하여 수용성 추출물을 제조하였다. 호중구는 건강한 공혈자의 buffy coat에서 density gradient separation 방법으로 분리하였다. H. pylori 수용성
추출물을 호중구에 투여한 후, 호중구 apoptosis 정 도를 확인하기 위하여 Hoechst 33342 염색 후 형광 현미경 관찰, 투과 전자현미경 관찰, TUNEL assay 및 cytosolic oligonucleosome-bound DNA ELISA를 시행하였다. 세포독성을 측정하는 방법으로 trypan blue exclusion test 및 LDH assay를 이용하였다. 호 중구에서의 Fas, FasL 및 TNF-R1 유전자 및 단백질 발현을 RT-PCR, ribonuclease protection assay, Nor- thern blotting 및 Western blotting으로 확인하였으 며, 세포표면에서의 발현을 flow cytometry로 측정 하였다. 결과: H. pylori 수용성 추출물을 투여하였 을 때 호중구 apoptosis가 대조군에 비해 억제되었 으며, 세포생존율이 높게 나타났다. 호중구에서의 Fas, FasL 및 TNF-R1 유전자 및 단백질이 기본적으 로 발현함을 확인하였다. H. pylori 수용성 추출물군 에서 FasL 유전자 및 단백질 발현이 억제되었으며, 세포표면에서의 Fas, FasL 및 TNF-R1 발현이 억제 되었다. 호중구 배양상청액에서 Western blotting을 시행하였을 때 soluble form의 Fas, FasL 및 TNF-R1 이 증가되어 세포표면에서의 발현 감소가 shedding 에 기인함을 확인하였다. 결론: H. pylori 수용성 표 면단백질은 인체 호중구 apoptosis를 억제시켰으며, 그 조절은 호중구에서의 FasL 발현 억제 및 Fas, TNF-R1의 세포표면에서의 발현 억제에 기인할 것 으로 생각된다.
색인단어: Helicobacter pylori, 호중구, Apoptosis, Fas, Fas ligand
참 고 문 헌
1. Warren JR, Marshall BJ. Unidentified curved bacilli on gastric epithelium in active chronic gastritis.
Lancet 1983;1:1273-1275.
2. Marshall BJ. Helicobacter pylori: the etiologic agent for peptic ulcer. JAMA 1995;274:1064-1066.
3. Hopkins RJ, Girardi LS, Turney EA. Relationship between Helicobacter pylori eradication and reduced duodenal and gastric ulcer recurrence: a review. Gastroenterology 1996;110:1244-1252.
702 The Korean Journal of Gastroenterology : Vol. 35, No. 6, 2000
4. Parsonnet J, Friedman GD, Vandersteen DP, et al.
Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991;325:1127-1131.
5. Wotherspoon AC, Ortiz-Hidalgo C, Falzon MR, Isaacson PG. Helicobacter pylori-associated gastritis and primary B-cell gastric lymphoma. Lancet 1991;
338:1175-1176.
6. Sobala GM, Crabtree JE, Dixon MF, et al. Acute Helicobacter pylori infection: clinical features, local and systemic immune response, gastric mucosal histology, and gastric juice ascorbic acid concent- rations. Gut 1991;32:1415-1418.
7. Baggiolini M, Dewald B, Moser B. Interleukin-8 and related chemotactic cytokines-CXC and CC chemokines. Adv Immunol 1994;55:97-179.
8. Jung HC, Kim JM, Song IS, Kim CY. Helicobacter pylori induces an array of proinflammatory cyto- kines in human gastric epithelial cells: quantifica- tion of mRNA for interleukin-8, -1α/β, granulo- cyte-macrophage colony-stimulating factor, monocyte chemoattractant protein-1 and tumor necrosis factor- α. J Gastroenterol Hepatol 1997;12:473-480.
9. Sharma SA, Tummuru MKR, Miller GG, Blaser MJ. Interleukin-8 response of gastric epithelial cell lines to Helicobacter pylori stimulation in vitro.
Infect Immun 1995;63:1681-1687.
10. Loach LA, Bosma NB, Jansen J, Hoek FJ, van Deventer SJ, Tytgat GN. Mucosal tumor necrosis factor-α, interleukin-1β, and interleukin-8 produc- tion in patients with Helicobacter pylori. Scand J Gastroenterol 1994;29:425-429.
11. Kim JS, Jung HC, Kim JM, Song IS, Kim CY.
Interleukin-8 expression by human neutrophils activated by Helicobacter pylori soluble proteins.
Scand J Gastroenterol 1998;33:1249-1255.
12. Kim JS, Jung HC, Kim JM, Song IS, Kim CY.
Helicobacter pylori water-soluble surface proteins activate human neutrophils and upregulate the ex- pression of CXC chemokines. Dig Dis Sci 2000;45:
83-92.
13. Williams GT, Smith CA. Molecular regulation of apoptosis: genetic controls on cell death. Cell 1993;
74:777-779.
14. Nagata S. Apoptosis by death factor. Cell 1997;
88:355-365.
15. Colotta F, Re F, Polentarutti N, Sozzani S, Man- tovani A. Modulation of granulocyte survival and programmed cell death by cytokines and bacterial products. Blood 1992;80:2012-2020.
16. Kurose I, Granger DN, Evans DJ Jr, et al. Helico- bacter pylori-induced microvascular protein leakage in rats: role of neutrophils, mast cells, and platelets.
Gastroenterology 1994;107:70-79.
17. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ.
Protein measurement with the folin phenol reagent.
J Biol Chem 1951;193:265-275.
18. Dunn BE, Campbell G, Perez-Perez GI, Blaser MJ.
Purification and characterization of Helicobacter pylori urease. J Biol Chem 1990;265:9464-9469.
19. Savill J, Dransfield I, Hogg N, Haslett C. Vitro- nectin receptor-mediated phagocytosis of cells un- dergoing apoptosis. Nature 1990;343:170-173.
20. Cox G. Glucocorticoid treatment inhibits apoptosis in human neutrophils. Separation of survival and activation outcomes. J Immunol 1995;154:4719- 4753.
21. Kettritz R, Gaido ML, Haller H, Luft FC, Jennette CJ, Falk RJ. Interleukin-8 delays spontaneous and tumor necrosis factor-α-mediated apoptosis of human neutrophils. Kidney Int 1998;53:84-91.
22. Pericle F, Liu JH, Diaz JI, et al. Interleukin-2 prevention of apoptosis in human neutrophils. Eur J Immunol 1994;24:440-444.
23. Smoot DT, Mobley HLT, Chippendale GR, Lewison JF, Resau JH. Helicobacter pylori urease activity is toxic to human gastric epithelial cells.
Infect Immun 1990;58:1992-1994.
24. Desai MA, Vadgama PM. An in vitro study of enhanced H+ diffusion by urease action on urea.
Implication for Helicobacter pylori-associated peptic ulceration. Scand J Gastroenterol 1993;28:915-919.
25. Craig PM, Territo MC, Karnes WE, Walsh JH.
Helicobacter pylori secrete a chemotactic factor for monocytes and neutrophils. Gut 1992;33:1020-1023.
Kim, et al. Inhibition of Neutrophil Apoptosis by H. pylori 703
26. Harris PR, Mobley HLT, Perez-Perez GI, Blaser MJ, Smith PD. Helicobacter pylori urease is a potent stimulus of mononuclear phagocyte activa- tion and inflammatory cytokine production. Gastro- enterology 1996;111:419-425.
27. Tanaka M, Suda T, Takahashi T, Nagata S.
Expression of the funtional soluble form of human fas ligand in activated lymphocytes EMBO J 1995;14:1129-1135.
28. Tanaka M, Suda T, Haze K, et al. Fas ligand in human serum. Nat Med 1996;2:317-322.
29. Perez C, Albert I, DeFay K, Zachariades N, Gooding L, Kriegler M. A nonsecretable cell sur- face mutant of tumor necrosis factor (TNF) kill by cell-to-cell contact. Cell 1990;63:251-258.
30. Schneider P, Holler N, Bodmer JL, et al. Conver- sion of membrane-bound Fas (CD95) ligand to its soluble form is associated with downregulation of its proapoptotic activity and loss of liver toxicity. J Exp Med 1998;187:1205-1213.
31. Suda T, Hashimoto H, Tanaka M, Ochi T, Nagata S. Membrane Fas ligand kills human peripheral blood T lymphocytes, and soluble Fas ligand blocks the killing. J Exp Med 1997;186:2045-2050.
32. Tanaka M, Itai T, Adachi M, Nagata S. Down- regulation of Fas ligand by shedding. Nat Med 1998;4:31-36.
33. Medema JP, Scaffidi C, Kischkel FC, et al. FLICE is activated by association with the CD95 death- inducing signaling complex (DISC). EMBO J 1997;
16:2794-2804.
34. Chen JJ, Sun Y, Nabel GJ. Regulation of the proinflammatory effects of Fas ligand (CD95L).
Science 1998;282:1714-1717.
35. Seino K, Iwabuchi K, Kayagaki N, et al. Chemo- tactic activity of soluble Fas ligand against phago- cytes. J Immunol 1998;161:4484-4488.
36. Cheng J, Zhou T, Liu C, et al. Protection from Fas-mediated apoptosis by a soluble form of the Fas molecule. Science 1994;263:1759-1762.
37. Hino T, Nakamura H, Abe S, et al. Hydrogen peroxide enhances shedding of type 1 soluble tumor
necrosis factor receptor from pulmonary epithelial cells. Am J Respir Cell Mol Biol 1999;20:122-128.
38. Papoff G, Cascino I, Eramo A, Starace G, Lynch DH, Ruberti G. An N-terminal domain shared by Fas/Apo-1 (CD95) soluble variants prevents cell death in vitro. J Immunol 1996;156:4622-4630.
39. Selinsky CL, Boroughs KL, Halsey Jr WA, Howell MD. Multifaceted inhibition of anti-tumour immune mechanisms by soluble tumour necrosis factor re- ceptor type I. Immunology 1998;94:88-93.
40. Fan X, Crowe SE, Behar S, et al. The effect of class II major histocompatibility complex expres- sion on adherence of Helicobacter pylori and induction of apoptosis in gastric epithelial cells: a mechanism for T helper cell type 1-mediated damage. J Exp Med 1998;187:1659-1669.
41. Rudi J, Kuck D, Strand S, et al. Involvement of the CD95 (APO-1/Fas) receptor and ligand system in Helicobacter pylori-induced gastric epithelial apop- tosis. J Clin Invest 1998;102:1506-1514.
42. Wagner S, Beil W, Westermann J, et al. Regulation of gastric epithelial cell growth by Helicobacter pylori: evidence for major role of apoptosis. Gastro- enterology 1997;113:1836-1847.
43. Hagen SJ, Takahashi S, Jansons R. Role of vacuolation in the death of gastric epithelial cells.
Am J Physiol 1997;272:C48-C58.
44. Suzuki M, Seto K, Mori M, Suzuki M, Miura S, Ishii H. Monochloramine induced DNA fragmen- tation in gastric epithelial cell line MKN45. Am J Physiol 1998;275:G564-G571.
45. Kim JM, Kim JS, Jung HC, Song IS, Kim CY.
Apoptosis of human gastric epithelial cells via caspase-3 activation in response to Helicobacter pylori infection: Possible involvement of neutrophils through tumor necrosis factor-alpha and soluble Fas ligands. Scand J Gastroenterol 2000;35:40-48.
46. 김정목, 김주성, 정현채, 송인성, 김정룡. Helico- bacter pylori 감염 후 Caspase-3 활성을 통한 인체 위상피세포의 Apoptosis. 대한소화기학회지 1999;33:
765-775.