산과 염기
7
7.1 산과 염기 : 실험적 정의 7.2 산 , 염기 , 염
7.3 산성과 염기성 무수물
7.4 강산 , 강염기 , 약산 , 약염기 7.5 중화
7.6 pH 척도
7.7 완충용액과 짝산 - 짝염기 쌍
7.8 산업과 일상생활에서 쓰이는 산과 염기
양성자를 전달해 줘
일상생활에서의 산 : 레몬이나 자몽 ( 시트르산 ), 식초 ( 아세트산 ), 축전지 산 ( 황 산 ),
비타민 C( 아스코르브산 ),
일상생활에서의 염기 : 오븐 청소용 세제나 배수구 청소액 ( 수산화나트륨 ), 베이킹 소다 ( 중탄산나트륨 ), 암모니아
그림 7.1 산 ( 왼쪽 ), 염기 ( 가운데 ), 염 ( 오른쪽 ) 은 많은 음식물과 낯익은 소비재의 성분들이 다 .
7.1 산과 염기 : 실험적 정의
산의 성질
- 리트머스 종이의 염료를 붉게 변화시킴 - 신맛이 남
- ( 아연이나 철 같은 ) 금속과 반응하여 수소 기체를 발생시킴 - 염기와 반응하여 물과 염이라 불리는 이온성 화합물을 만듦
염기의 성질
- 리트머스 종이의 염료를 푸르게 변화시킴 - 쓴맛이 남
- 피부에 닿으면 미끈거리는 느낌이 남 - 산과 반응하여 물과 염을 생성
그림 7.2 리트머스 염료가 스며든 종이가 산과 염기 구별 위해
산 - 염기 지시약 - 리트머스 종이
: 중성 ( 보라색 ), 산 ( 붉은색으로 변색 ), 염기 ( 푸른색으로 변색 )
- 자연적인 염료 : 포도주스 , 붉은 양배추 , 블루베리 등
그림 수국은 심어진 토양의 산도에 따라 다 른 색의 꽃을 가지는 많은 식물들 중의 하나이다 . 수국은 약산성 토양에서 푸 른색 (위 그림 )을 약염기성 토양에서 붉은색 (아래 그림 )을 띤다 .
그림 여러분만의 지시약을 만들어 보자 .
붉은 양배추 2컵을 자르고 더운물을 붓는다 . 10분 후에 고체를 커피 필터로 걸러낸다 . 이 액체 50mL로 다양한 가정용 화학물질 ( 식초 , 베이킹소다 , 암모니아 등 )의 pH를 검사해 보자 .
이 지시약은 pH 2에서 붉은색 , pH 4에서 자주색 , pH 6에서 보라색 , pH 8에서 푸른색 , pH 10에서 푸른 녹색 , pH 12에서 녹황색을 만든
다 .
7.2 산 , 염기 , 염
아레니우스 이론
1887 년 아레니우스 (Svante Arrhenius) 에 의한 산 - 염기 정 의
- 산 (acid) : 수용액에서 수소 이온 (H+) 과 음이온으로 분해되는 분자화합물
ex) 질산의 물에서 이온화
ex) 몇 가지 일반적인 산
그림 스웨덴 과학자 아레니우스 (1859~1927) 는 물에 있 는 산 , 염기 , 염이 이온 으로 구성되어 있다는 이 론을 제안하였다 . 그는 처 음으로 대기 중의 이산화 탄소와 온실효과를 연과 지은 사람이었다 .
3
( ) ( )
3( )
HNO aq H aq
NO aq
- 염기 (base) : 수용액에서 수산화 이온 (OH-) 을 방출하는 물질 ex) 수산화나트륨의 물에서 이온화
산과 염기의 반응
산 + 염기 → 염 + 물
⇒ 본질적인 반응 H+ + OH- H→ 2O ( 중화반응 )
( )
H O2( ) ( )
NaOH s Na aq
OH aq
예제 7.1 산과 염기의 이온화
(a) 질산 (HNO3) 이 물에서 이온화하는 반응을 써라 .
(b) 수산화칼륨 (KOH) 이 물에서 이온화하는 반응을 써라 . 풀 이
a.
b.
) ( )
( )
( 3
3 aq 2 H aq NO aq
HNO H O ) ( )
( )
(aq 2 K aq OH aq KOH H O
아레니우스 이론의 한계
1. 물에서는 단순히 자유로운 양성자가 존재하지 않음
⇒ H+ 이온은 물과 결합하여 히드로늄 이온 (H3O+) 생성
2. 아레니우스 이론은 암모니아나 이와 관련된 화합물의 염기성을 설명하지 못함 3. 아레니우스 이론은 수용액에만 적용됨
H H O H H
H O H
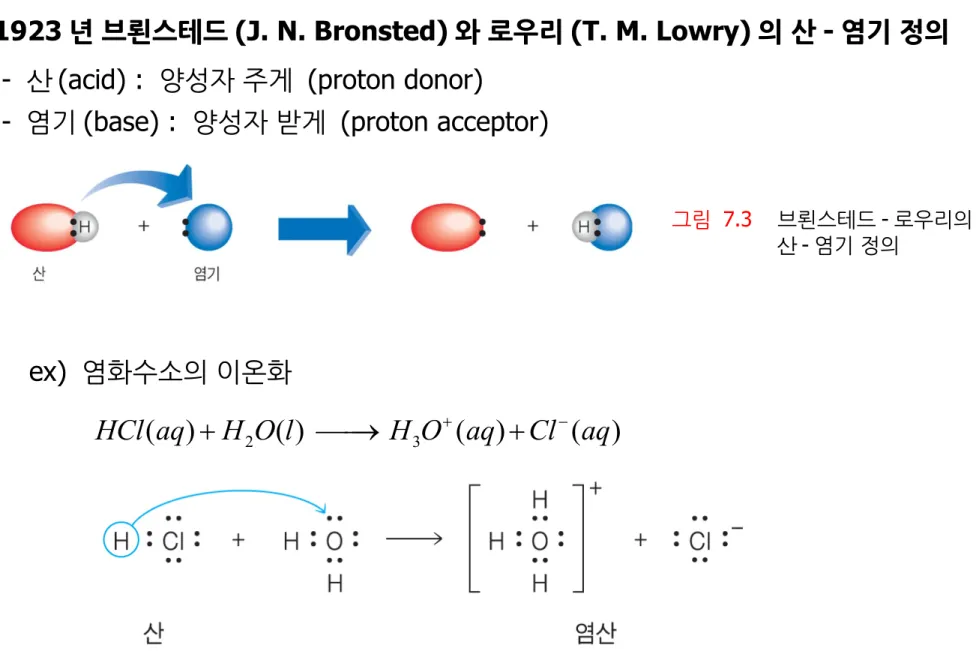
브뢴스테드 - 로우리 산 - 염기 이론
1923 년 브뢴스테드 (J. N. Bronsted) 와 로우리 (T. M. Lowry) 의 산 - 염기 정의 - 산 (acid) : 양성자 주게 (proton donor)
- 염기 (base) : 양성자 받게 (proton acceptor)
그림 7.3 브뢴스테드 - 로우리의 산 -염기 정의
ex) 염화수소의 이온화
2 3
( ) ( ) ( ) ( )
HCl aq H O l H O aq Cl aq
일반식 : HA 가 어떤 산을 나타내면
HA(aq) + H2O(l) H→ 3O+(aq) + A-(aq)
예제 7.2 브뢴스테드 - 로우리 산
HNO3 가 물에서 브뢴스테드 - 로우리 산으로 작용하는 반응식을 써라 .
풀 이 HNO3(aq) H2O H3O(aq)NO3(aq)
염
- 산과 염기의 중화반응으로부터 생성되는 염 : 양이온과 음이온으로 구성되는 이온화합물 - 전해질 : 물에 녹았을 때 전기를 통하는 염
- 사용 용도 : 염화나트륨과 염화칼슘 – 겨울에 도로의 얼음을 녹이는데 사용 황산구리 ( ) – Ⅱ 하수관의 나무뿌리를 제거하는데 사용
7.3 산성과 염기성 무수물
비금속 산화물 : 산 무수물 비금속 산화물 + 물 → 산
ex) SO3 + H2O H→ 2SO4 CO2 + H2O H→ 2CO3 예제 7.3 산성 무수물
이산화황이 물과 반응하여 생성되는 산의 화학식을 써라 .
풀 이 SO2 + H2O H→ 2SO3
금속 산화물 : 염기성 무수물 금속 산화물 + 물 → 염기 ex) CaO + H2O Ca(OH)→ 2
Li2O + H2O 2LiOH→ 예제 7.4 염기성 무수물
산화바륨에 물을 첨가하여 생성된 염기에 대한 화학식을 써라 .
풀 이 BaO + H2O Ba(OH)→ 2
그림 7.4 산화금속은 산소이온과 물과 반응하 여 2 개의 수산화이온을 생성하기 때문에 염 기성이다
7.4 강산 , 강염기 , 약산 , 약염
강산 (strong acid) : 물과 완전히 반응하는 산
기
ex) 염산
약산 (weak acid) : 물과 조금만 반응하는 산
ex) 시안산
; 40,000 의 HCN 분자 중 1 개만이 H+ 생성 강염기 (strong base) : 물에서 완전히 이온화
ex) 수산화나트륨
약염기 (weak base) : 물에서 조금만 이온화 ex) 암모니아
양쪽성 물질
: 산으로도 작용하고 염기로도 작용하는 물질 (ex. 물 )
) ( )
( )
(aq H aq Cl aq HCl
) ( )
( )
(aq H aq CN aq HCN
) ( )
( )
(aq Na aq OH aq NaOH
) ( )
( )
( )
( 2 4
3 aq H O l NH aq OH aq
NH
그림 7.5 암모니아는 물로부터 양성자를 받음 ( 염기 성 )
2 3
( ) ( ) ( ) ( )
HCl aq H O l H O aq Cl aq
) ( )
( )
( )
( 2 4
3 aq H O l NH aq OH aq
NH
물의 양쪽성 (amphiprotic)
: 산으로도 작용하고 염기로도 작용 산 ( 양성자 주게 )
염기 ( 양성자 받게 )
7.5 중화
중화 (neutralization) 반응 : 산과 염기의 반응 (동량의 수소이온과 수산화이온 반응 )
H+ + OH- H→ 2O
ex) 수산화나트륨과 염산의 중화반응
그림 7.6 산 ( 식초 ) 을 염기 (NaOH) 로 적정실험 , 지시약은 페놀프탈레인 사용
예제 7.5 중화반응
화약이나 비료의 성분인 질산칼륨은 중세부터 19 세기까지 소변에서 질산칼륨을 얻었다 . 초석이라고 불리는 이 침전물은 질산과 수산화칼륨을 반응시켜 얻을 수 있다 . 이 반응의 중화반응을 써라 .
풀 이
KOH(aq) + HNO3(aq) KNO→ 3(aq) + H2O(l)
7.6 pH 척도
pH 척도 : 1909 년 쇠렌센에 의해 산도나 염기도를 나타내는데 사용
- 정의 : : 몰농도
pH < 7 : 산성 pH = 7 : 중성 pH > 7 : 염기성
H
pH log
H그림 7.7 pH 척도 .
pH 가 1 만큼 변하면 히드로늄 이온의 농도는 10 배가 변한다는 뜻임
예제 7.6 수소 이온 농도로부터 pH
수소 이온농도가 1×10-5 M 인 용액의 pH 는 무엇인가 ? 풀 이
예제 7.7 pH 로부터 수소 이온 농도 계산
pH 가 4 인 용액의 수소 이온 농도를 구하라 . 풀 이
예제 7.8 수소 이온 농도로부터 pH 계산 H+ 의 농도가 8×10-4 M 인 용액의 pH 는 ? (a) 2.9 (b) 3.1 (c) 4.2 (d) 4.8 풀 이
log(1 10 ) 5log 5
H
pH
H 10pH 104 M
log(8 10 ) 3.1log 4
H
pH
예제 7.9 산과 염기에 있는 수소 이온과 수산화 이온
다음 수용액을 산성 , 염기성 , 중성으로 분류하라 . ( 물 분자는 생략하였다 .)
풀 이
- 비이커 Ⅰ : H+ 와 OH- 수가 각각 6 개로 같음 ⇒ 중성 - 비이커 Ⅱ : OH- 수 7 개 , H+ 수 1 개 ⇒ 염기성
- 비이커 Ⅲ : H+ 수 6 개 , OH- 수 1 개 ⇒ 산성
7.7 완충용액과 짝산 - 짝염기 쌍
짝산 - 짝염기 쌍 – 양성자 하나 (H+) 가 다른 화합물과 이온의 쌍을 말한다
예 ) HF 와 F- 는 짝산 - 짝염기 쌍이고 NH3 와 NH4+ 는 짝염기 - 짝산 쌍이다 H2O + HCl ↔ H3O+ + Cl-
정반응: HCl 에서 H2O 로 양성자 이동 . 즉 , HCl 은 산 , H2O 은 염기 역반응 : H3O+ 에서 Cl- 로 양성자 이동 . 즉 , H3O+ 는 산 , Cl- 은 염기 짝산 - 짝염기 : 양성자 하나 이동에 의해 산과 염기로 되는 한쌍의 물질 HCl 과 Cl-: 짝산 - 짝염기
H3O+ 와 H2O: 짝산 - 짝염기
예제 7.10 짝산 - 짝염기 쌍
(a) HBr 과 (b) HNO3 의 짝염기는 무엇인가 ? (c) OH- 와 (d) HSO4- 의 짝산은 무엇인가 ? 풀 이
(a) Br- (b) NO3-
(c) H2O (d) H2SO4
완충용액 (buffer solution)
- 정의 : 적은 양의 강산이나 강염기를 첨가해도 거의 일정한 pH 를 유지한다 . - 약산과 그 짝염기 (ex. HC 2H3O2 와 C2H3O2-) 또는
약염기와 그 짝산 (ex. NH 3 와 NH4+) 으로 구성됨
- ex) 아세트산의 이온화 반응
아세트산 / 아세트산나트륨 완충용액에 강염기를 첨가하면
아세트산 / 아세트산나트륨 완충용액에 강산을 첨가하면
2 3 2
( ) ( )
2 3 2( )
HC H O aq H aq
C H O aq
2 3 2 2 2 3 2
( ) ( ) ( ) ( )
OH aq
HC H O aq H O l C H O aq
2 3 2 2 3 2
( ) ( ) ( )
H aq
C H O aq
HC H O aq
pH 거의 일정함
7.8 산업과 일상생활에서 쓰이는 산과 염기
산성비
이산화탄소로 포화된 빗물의 pH = 5.6
산성비 (acid rain) : pH 가 5.6 보다 낮은 비 , 금속과 석조 건축물 부식 산성비의 원인물질
- 인위적인 오염물질
• 석탄을 태울 때 발생하는 SO2
• 자동차 배출가스에서 나오는 NO2, NO 등 - 자연적인 오염물질
• 화산폭발시 발생하는 황산화물과 황산
• 번개 발생시 질소산화물과 질산
제산제 : 염기성 치료제
(1) 탄산수소나트륨 (NaHCO3) - 가장 오래된 제산제
- 속쓰림을 덜어주는 알카 - 셀처의 주성분임
- 탄산수소 이온이 산과 반응하면 탄산을 만들고 , 탄산은 물과 이산화탄소로 분해
- 탄산수소를 함유한 제산제를 사용하고 난 뒤에 생기는 트림은 CO2(g) 때문임 - 과다하게 사용시
: 혈액이 과다하게 알칼리성이 됨 ⇒ 알칼리혈증
) ( )
( )
( 2 3
3 aq H aq H CO aq
HCO
2 3( ) 2( ) 2 ( )
H CO aq CO g H O l
그림 7.8 ‘ 이 제산제는 빠르게 작용한다’ 라는 광고문 구는 모든 산 - 염기 반응이 거의 즉시 일어나기 때 문에 의미가 없다 . 어떤 알약은 다른 것보다 더 느 리게 녹을지 모른다 . 약의 작용을 빠르게 하려면 씹어먹으면 된다 .
(2) 탄산칼슘 (CaCO3)
- 적은 양은 괜찮지만 상습적인 사용은 변비를 일으킴
- 텀스 (Tumsⓡ) 와 많은 약국 상표 제산제들이 탄산칼슘을 유일한 활성성분으로 가짐
(3) 수산화알루미늄 (Al(OH)3) - 변비를 일으킬 수 있음
- 암포젤 (Amphojelⓡ) 의 활성성분 (4) 수산화마그네슘 (Mg(OH)2)
- 물에 풀은 현탁액은 ‘마그네시아 우유’로 판매 - 소량을 사용하면 제산제로 작용하지만
다량을 복용하면 설사를 일으킴
산업과 가정에서의 산과 염기 산이 사용되는 대표적인 예
1) 황산 : 비료나 공업용 화학약품 제조에 사용 , 자동차 축전지와 배수구 청소에 사용
2) 염산 : 금속의 녹 제거에 사용 , 욕실설비와 변기로부터 석회석 제거에 사용 염기가 사용되는 대표적인 예
1) 석회 (CaO) : 가장 널리 사용 ,
2) 소석회 (Ca(OH)2) : 회반죽과 시멘트를 만드는데 사용 , 토지의 산성을 완화하는데 사용
3) 수산화나트륨 : 오븐 청소제 , 배수구를 뚫는 세제
건강과 질병에서 산과 염기
- 진한 강산과 강염기 : 심각한 화학 화상을 일으키는 부식성 독성물질 - 황산 : 강력한 탈수제라 세포 안의 물과 반응
- 묽은 강산과 강염기 : 세포 안의 단백질을 분해하고 변성 시킴