Phytoestrogens과 골대사
인제대학교 의과대학 해운대백병원 산부인과1, 울산대학교 의과대학 서울아산병원 산부인과학교실2
전균호1․강병문2
Phytoestrogens and Bone Metabolism
Gyun-Ho Jeon1, Byung-Moon Kang2
1Department of Obstetrics and Gynecology, Haeundae Paik Hosiptal, Inje University College of Medicine, Busan,
2Department of Obstetrics and Gynecology, College of Medicine, University of Ulsan, Asan Medical Center, Seoul, Korea
Although most gynecologists had prescribed estrogen with or without progestin for their menopausal patients before the publication of Women’s health Initiative (WHI) trial findings, only 35 to 40% of women ever started hormone therapy (HT) and many discontinued it, because of perceived side effects and discomfort. HT will not likely to be regularly prescribed in the future given the recommendations by several groups against long-term use for chronic diseases after the release of the findings of the WHI.
Consequently, many postmenopausal women have turned to botanical dietary supplements containing phytoestrogen as an alternative to HT. Although there are numerous studies in the literature over the last decade trying to address the efficacy of phytoestrogens on bone health in animal models and in humans, the efficacy of phytoestrogens as bone-protective agents in vivo remains unclear. Differences in the bioactivities of individual phytoestrogens, differences in bioavailability and metabolism of phytoestrogens within different study populations, and imprecise reporting of the form and dose of phytoestrogens provided in intervention studies may have leaded to the disparity in study results.
However, the preventive effect of phytoestrogens for bone loss is promising. This review discusses the effects of phytoestrogens on bone metabolism and their roles on the prevention and treatment of postmenopausal osteoporosis.
Key Words: Osteoporosis, Phytoestrogens, Postmenopause
Received: October 31, 2013 Revised: December 24, 2013 Accepted: December 30, 2013
Corresponding Author: Byung Moon Kang, Department of Obstetrics and Gynecology, University of Ulsan, College of Medicine, Asan Medical Center, 88, Olympic Road 43-gil, Sonpa-gu, Seoul 138-736, Korea
Tel: +82-2-3010-3635, Fax: +82-2-476-7331, E-mail: bmkang@amc.seoul.kr
WHI 연구 발표 이후 폐경 여성들은 에스트로겐의 골과 폐경 증상에 대한 이로운 효과는 가지면서 유 방, 자궁, 심혈관계에 대한 부작용의 우려가 없는 보 충제를 호르몬 치료의 대안으로 찾고자 관심을 가지 게 되었다. 그 대표적인 식물성 식이보충제인 phyto- estrogens은 많은 주목을 받고 있고, 쉽게 구할 수 있 어 흔히 사용되고 있다. Phytoestrogen은 식물의 비스
테로이드성 화합물로서 에스트로겐 수용체(estrogen receptor, ER)에 대하여 에스트로겐과 경쟁적으로 결 합을 하여 선택적 에스트로겐 수용체 조정체(selec- tive estrogen receptor modulator, SERM)와 같이 효능 제 혹은 길항제 효과를 나타내는 물질이다.1 Phyto- estrogens은 주로 콩류에서 얻어지는 isoflavones (geni- stein, daidzein), 아마씨나 지방종자, 해조류에서 얻어
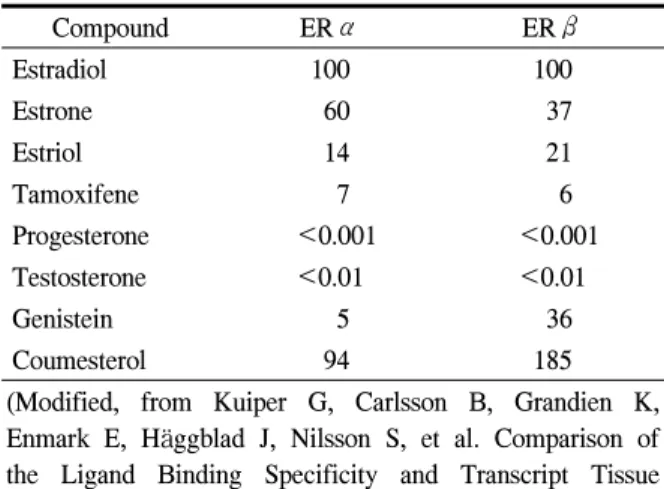
Table 1. Binding affinity for ERα and β in rat
Compound ERα ERβ
Estradiol 100 100
Estrone 60 37
Estriol 14 21
Tamoxifene 7 6
Progesterone <0.001 <0.001
Testosterone <0.01 <0.01
Genistein 5 36
Coumesterol 94 185
(Modified, from Kuiper G, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, et al. Comparison of the Ligand Binding Specificity and Transcript Tissue Distribution of Estrogen Receptors α and β. Endocri- nology 1997;138:867)
Fig. 1. Effects of soy on osteoblast proliferation, alka- line phosphatase activity and collagen synthesis (Modified, from Lee Y, Chen X, Anderson J.
Physiological concentrations of genistein stimu- late the proliferation and protect against free radical-induced oxidative damage of MC3T3-E1 osteoblast-like cells. Nutr Res 2001;21:1287-93.) 지는 lignans, 그리고 쿠마린 식물 등에서 얻어지는
coumestans (coumestrol) 세 가지 종류로 구분되고 체 내에서 다양한 형태의 대사물로 변환되어 생물학적 활성을 가지게 된다.2 폐경 여성의 골밀도 및 골대사 에 대한 phytoestrogens 제제의 효과를 알아보고자 한 이전 연구들은 일관성이 없고 매우 다양한 결과를 보이는데 그 이유는 1) 그 아형이 매우 많고(예:
isoflavone (IF), lignan…), 2) 체내에서 생체내 변환을 일으키고, 3) 조직 특이적인 작용이 있으며, 4) 수용 체 결합이 다양하고(Table 1),3 5) 개별 대사의 차이 가 있으며(예: IF의 배설은 장관 내 정상 균무리의 구성, 장관 내 이행 시간 등의 차이에 의해 개인에 따라 1,000배 이상 차이를 보임), 6) 농도에 따라 작 용기전이 다르기 때문이다. 한 예로 유방암 세포주 인 MCF-7 cancer cell line은 dongquai나 인삼에 의해 자라지만 black cohosh(승마)나 licorice root(감초)에 의해서는 변화가 없다.
IN VITRO STUDY
1. 조골세포에 대한 영향
IF은 조골세포의 증식과 분화를 유도하고, 콜라겐 합성을 증가시키며, 조골세포의 세포자멸사를 억제 한다(Fig. 1).4 Genistein과 daidzein은 간세포(proge- nitor cells)로부터 조골세포로의 분화에 관여하는 전 사인자인 Core binding factor-1 (Cbfa-1)와 bone mor-
phogenic proptein-2 (BMP-2)의 합성을 촉진하고5,6 peroxisome proliferator activator receptors (PPARs)의 활성을 통해 골형성을 자극하는 것으로 보고되었 다.7,8 또한 osteoprotogerin (OPG)의 생성을 촉진하고,
IL-6의 분비를 억제하여 골흡수를 억제한다.9 다른 phytoestrogen으로 coumestrol, diosgenin도 alkaline phosphatase (ALP) 활성, osteopontin 발현 등을 증가 시켜 조골세포의 분화 촉진, 골 형성을 강화시키는 것으로 보고되었다.10,11 그 외 승마제제인 Cimicifuga racemoa extract BNO 1055도 조골세포의 산물인 IGF-1 유전자의 발현을 증가시킨다.12 반면 붉은 포 도주에 있는 phytoestrogen인 reveratrol은 골 형성 효 소를 억제하고 골조직의 칼슘함량도 감소시킨다. 그 러나 glycytein, quercetin, catechin은 골대사에 특별한 영향을 주지 않아 phytoestrogens의 종류에 따라 효과 가 다양함을 알 수 있다.13
2. 파골세포에 대한 영향
파골세포형성(osteoclastogenesis)에는 파골세포로 부터 발현되는 receptor activator of nuclear factor kappa B (RANK)와 조골세포로부터 발현되는 RANK ligand (RANKL), osteoprotegrin (OPG)이 관여되는데 RANKL과 RANK의 결합은 파골세포 형성을 촉진하 는 반면 RANKL과 OPG와의 결합은 RANKL과 RANK의 결합을 방해함으로써 간접적으로 파골세 포 형성을 억제한다.13,14 IF은 RANKL과 OPG의 mRNA의 발현을 증가시켜 파골세포의 생성과 기능 을 억제하고, 파골세포의 세포자멸사를 유도하는 것 으로 알려졌고,15 interleukin-1 (IL-1), tumor necrosis factor-α (TNF-α), IL-1β, IL-6, prostaglandin E2 (PGE2) 등의 전염증성 cytokine합성을 억제함으로써 역시 파골세포 형성을 억제한다.17-21 또한 파골세포 의 K+통로 유입을 방해, 세포내 Ca2+유입의 기전으 로 파골세포의 골흡수를 방해함으로써 파골세포의 활성에도 영향을 미치는 것으로 나타났다.22 Cimici- fuga racemoa extract BNO 1055도 파골세포의 산물인 TRAP (tartrate-resistant acid phosphatase) 유전자의 발 현을 감소시킨다.
3. 칼슘 흡수에 대한 영향
에스트로겐이 존재하는 환경에서 genistein과 dai- dzein은 human intestinal-like Caco-2 cell line에서 칼 슘의 상피 흡수를 감소시켰으나 에스트로겐이 없는 환경에서는 칼슘 흡수에 대한 영향이 없는 것으로
나타났다.23 이후의 동물과 인간을 대상으로 한 연구 결과를 살펴보면 난소를 제거한 쥐를 대상으로 한 연구에서는 IF를 포함한 soy protein이 장내 칼슘 이 동 감소를 예방하는 효과가 있었으나, 요중 칼슘 배 설 혹은 혈중 칼슘 농도에 대한 효과는 없었고, 백인 폐경 여성을 대상으로 한 연구에서도 칼슘 흡수, 배 설 등에 대한 효과가 없는 것으로 나타나 IF의 장내 칼슘흡수에 대한 효과는 미미한 정도라고 생각된 다.24,25
ANIMAL STUDY
난소가 제거된 쥐는 폐경 여성의 골소실의 모델로 서 널리 사용되어 연구되어 왔고, IF 등의 phyto- estrogens의 골에 대한 효과와 관련하여 난소가 있는 쥐와 제거된 쥐, 난소가 제거된 그 외 다른 동물들에 서 수많은 연구가 발표되었다. 난소가 있는 쥐에서 IF는 골밀도를 상승시킨다는 연구들,26,27 효과가 없 거나 경미한 감소를 보인다는 연구들도 있어 그 결 과는 다양하였는데28,29 이는 각 연구들에서 IF의 용 량, 투여 형태, 종류 등의 차이로 인한 것으로 생각 된다. 한편 난소가 제거된 쥐에서는 6주간 매일 약 30~50 mg/kg, 13주간 20, 40, 80 mg/kg의 IF 경구 투 여로 골함량 및 골밀도가 증가되는 주로 긍정적인 결과들이 발표되었다.30,31 하지만, 난소 제거 12주이 후 투여가 시작되었을 때는 이러한 효과가 나타나지 않았는데 이는 IF가 골밀도 소실을 예방하는 효과는 있지만, 난소 제거로 인해 생긴 골소실을 반전시켜 회복할 수는 없는 것으로 생각될 수 있다.32 또한 최 근에는 난소가 제거된 쥐와 13개월 이상의 노화된 쥐에서 두유(soy milk)와 같은 IF의 투여 실험에서 노화 혹은 에스트로겐 부족으로 인한 골소실을 약화 시켜 골밀도를 유지하는데 효과가 있는 것으로 밝혀
졌다.33-35 이와 같이 동물을 이용한 연구들 일부는
사용된 IF의 구성요소, 용량 등이 명확하게 제시되 지 않았음에도 불구하고 쥐를 이용한 실험에서 IF은 골밀도나 뼈의 강도를 유지하는데 매우 중요한 역할 을 하는 것으로 증명되고 있다.36 그러나 원숭이나 돼지를 이용한 실험에서는 효과가 없는 것으로 나타 나 동물의 종에 따른 차이가 있는 것이 아닌가 하는
견해도 있다.
EPIDEMIOLOGY AND DIET BASED STUDY
주로 아시아 인구를 대상으로 한 이전의 역학 연 구들은 phytoestrogens 섭취와 골밀도에 관해 전반적 으로 긍정적인 연관성이 있음을 시사하고 있다. 650
명의 폐경기 중국 여성을 대상으로 한 연구에서는37
IF이, 한국 폐경 여성 75명의 연구에서는38 enterolac- tone이, 그리고 일본 폐경 여성 85명의 연구에서는39 soy protein이 골소실 예방 효과가 있었다. 한국 폐경 여성의 연구에서 골밀도와 요중 lignan enterolactone 배설 간에는 양의 상관관계가 있었으나, 요중 IF (genistein, daidzein, equol) 배설과의 관계에서는 연관 성이 없는 것으로 나타났는데, 이는 대부분의 IF가 48시간이내 배출되어 요중 IF배설은 단기간의 급성 상태를 반영하고 그 대사에 개인차가 커서 요중 IF 배설차이가 개인 간의 IF 섭취차이를 신뢰성있게 반 영하지 못하기 때문으로 생각된다. 또한 IF의 대사 에 있어 백인 여성과 비교해서 한국 여성에서 daid- zein의 대사물인 equol의 생성 농도가 높고 o-DMA 생성은 낮은 것으로 나타나 인종들 간의 IF 대사 차 이로 인해 골에 대한 효과도 인종에 따라 달라질 수 있을 것으로 추정된다.40 한편 phytoestrogen과 frac- ture와의 직접적인 관련성에 관해서는 아직 명확치 않은 상태인데 에스트로겐 결핍은 골회전율(bone turnover)증가, 골소실의 가속화를 통해 골절에 취약 해지는 것으로 알려져 있고, equol은 다른 IF에 비해 에스트로겐 유사 활성도가 높으므로 골절을 예방할 수 있을 것으로 예측할 수 있으나 명확한 근거는 없 는 상태이다.
42~52세의 미국 여성 1927명을 참여시켜 시행한 SWAN (Study of Women’s Health Across the Nation) 에서는 1) 골소실 예방을 위해서는 phytoestrogen의 역치 용량(threshold dose)이 필요한 것으로 보이며 2) 뼈의 에스트로겐 수용체에 인종적인 차이가 있는 것 같고 3) soy product의 흡수도 제제에 따라 다른 것 같다고 보고하였다.41 또한 남가주 지역의 폐경 여성 208명을 대상으로 한 SHE (Soy Health Effect) study 에서는 IF의 소비량과 요추 골밀도 사이에 의미 있
는 연관성이 있다고 하여 IF의 골소실 예방효과를 주장하였다.42
RANDOMIZED CLINICAL TRIAL
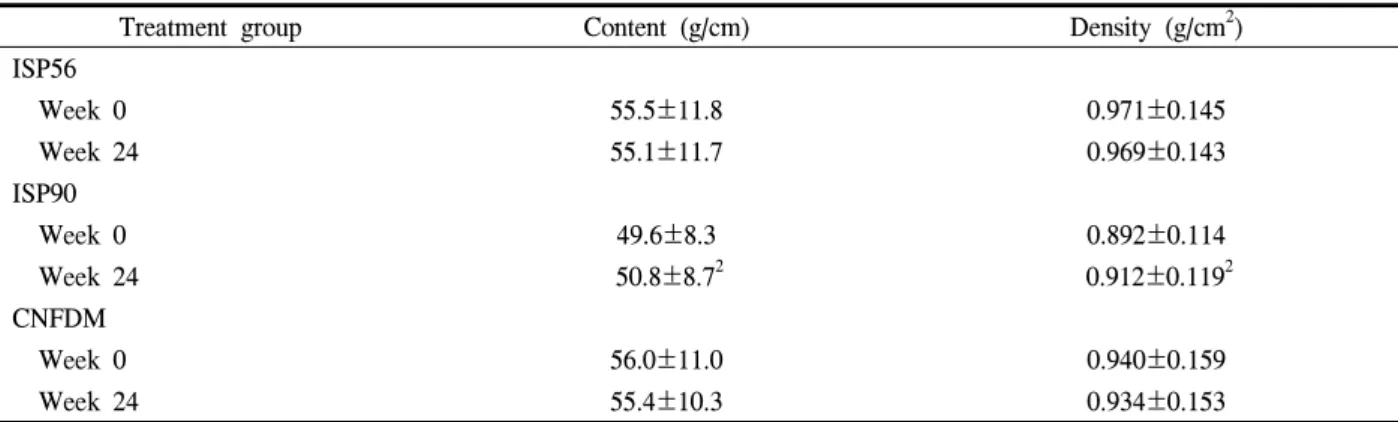
Phytoestrogens의 골밀도에 대한 영향을 평가하기 위한 이전 중재적 연구들의 결과들도 phytoestrogens 의 생체이용률, 대사 및 생리적 효과에 영향을 미칠 수 있는 여러 가지 변수들로 인해 불일치된 결과들 을 보여주고 있으나 여러 연구에서 골밀도에 긍정적 인 효과를 가진다고 평가하고 있다. Potter 등43의 보 고는 phytoestrogen의 골소실 예방효과를 증명한 매 우 중요한 연구로서 많이 인용된다. 이들은 66명의 폐경 여성을 세군으로 나누어 6개월 간 각각 casein과 우유로부터 얻어진 단백질(CNFDM), 1.39 mg IF/g protein (ISP56), 2.25 mg IF/g protein (ISP90)을 투여 한 결과 높은 농도의 IF를 포함한 ISP90군에서는 요 추부 골량과 골밀도가 의미있게 증가하였음을 보여 주었다(Table 2). Atkinson 등은 49~65세 205명 여성 을 대상으로 한 double-blind, randomized, placebo- controlled trial에서 IF 43.5 mg을 정제형태로 12개월 간 투여한 군에서 요추부 골량 및 골밀도의 감소가 둔화되었다고 보고하였다.44 하지만, 이와 유사한 용 량의 IF를 8주에서 6개월간의 비교적 짧은 기간 동 안 투여한 다른 연구들에서는 이와 같은 IF의 골밀 도에 관련된 효과가 없었고, 보다 높은 용량(80~
110 mg/day)의 IF는 6개월의 투여만으로도 골밀도에 유의한 효과가 있는 것으로 나타나 각 연구들에서 투여되는 phytoestrogen의 용량과 기간은 IF의 골밀 도 효과에 영향을 주는 중요한 요소들로 생각된
다.43,45 그 외에도 phytoestrogens 제제 형태(정제, 음
식, 가공류 등)와 사용되는 인구 집단에 따라 phyto- estrogens의 생체이용률이 다르고, 특히 나이, 인종, 평소 식이 습관에 따른 장내 세균의 구성에 차이로 phytoestrogens의 대사능(–daidzein의 대사물인 equol 과 genistein의 대사물인 4-ethylphenol은 daidzein과 genistein보다 더욱 강력한 에스트로겐 효과 및 항산 화력, prostaglandin 합성을 조정하는 능력을 가진다) 또한 다르므로 이들 역시 골에 대한 효과에 영향을 주는 것으로 알려져 있다.46-49
Table 2. Lumbar spine (L1-L4) bone mineral content and density of subjects consuming isolated soy protein with moderate/high isoflavones and casein and nonfat dry milk
Treatment group Content (g/cm) Density (g/cm2)
ISP56
Week 0 55.5±11.8 0.971±0.145
Week 24 55.1±11.7 0.969±0.143
ISP90
Week 0 49.6±8.3 0.892±0.114
Week 24 50.8±8.72 0.912±0.1192
CNFDM
Week 0 56.0±11.0 0.940±0.159
Week 24 55.4±10.3 0.934±0.153
1 x±SD. n=66, ISP56, isolated soy protein with moderate isoflavones; ISP90, isolated soy protein with higherisoflavones;
CNFDM, casein and nonfat dry milk.
2 Significantly different from CNFDM subjects at the end of the 24-wk treatment period, P<0.05
(Modified, from Potter S, Baum J, Teng H, Stillman RJ, Shay NF, Erdman JW Jr. Soy protein and isoflavones: their effects on blood lipids and bone density in postmenopausal women. Am J Clin Nutr 1998;68:1375S-79S)
Fig. 2. Effect of Isoflavones on bone formation marker:
Serum levels of bone-specific alkaline phospha- tase were significantly increased after 12 weeks of treatment with C. racemosa BNO055. (Modi- fied, from Wuttke W, Seidlová-Wuttke D, Gorkow C. The Cimicifuga preparation BNO 1055 vs.
conjugated estrogens in a double-blind placebo- controlled study: effects on menopause symp- toms and bone markers. Maturitas 2003;44:
S67-77.)
Fig. 3. Effect of genistein and hormone replacement therapy on bone mineral density (Plac: placebo, HRT: hormone replacement therapy, Gen: geni- stein, BMD: bone mineral density. Modified figure from Morabito N, Crisafulli A, Vergara C, Gaudio A, Lasco A, Frisina N, et al. Effect of genistein and hormone replacement therapy on bone loss in early postmenopausal women:
A randomized double-blind placebo-controlled study. J Bone Miner Res 2002;17:1904-12.)
Phytoestrogens의 골 표지자에 대한 과거의 연구는 다른 골흡수 억제제와 같이 골형성 표지자나 골흡수 표지자 모두 낮추는 것으로 보고되어 왔으나,45,50 근 래 일부 골흡수 표지자는 낮추어 골흡수를 억제하나 골형성 표지자는 높여 골형성을 촉진하는 것으로 주
장하는 연구 결과도 있다(Fig. 2).51,52 Morabito 등53이 2002년에 발표한 결과는 이 분야에서 매우 중요하게 평가되는데 이들은 90명의 폐경여성을 genistein 56 mg 투여군, 호르몬(1 mg Estradiol 2 mg with norethin- drone acetate) 투여군, 그리고 위약군의 세 군으로 나
누어 비교하였다. 12개월 투여 후 골흡수 표지자인 PD와 DPD는 호르몬 투여군과 genistein 투여군에서 모두 35~42% 감소하였으며, 골형성 표지자인 BAP 와 OC는 호르몬 투여군서는 17~22% 감소하였으나 genistein 투여군에서는 23~37% 증가하였다. 골밀도 에 대한 효과는 호르몬 투여군과 genistein 투여군이 비슷하였다(Fig. 3). 또한 2년 이상 장기간 IF을 투여 한 다른 연구에서도 골소실 예방의 효과가 보고되었 는데, 이들은 특히 치료 1년 후에는 골밀도의 증가 가 유의하지 않아 최소한 2년 이상 투여하는 장기간 연구의 당위성을 강조하였다.54 이와 같이 폐경 여성 을 대상으로 한 randomized controlled trial이 많지 않 고, 연구결과가 정도의 차이는 있으나 대부분 phyto- estrogens의 골소실 예방효과를 인정하는 것으로 보 인다.
한편 합성 phytoestrogen인 ipriflavone은 과거의 연 구에서 골소실 예방에 효과가 있는 것으로 많이 보 고되었으나 최근 4년간 시행된 한 연구에서 효과가 없는 것으로 발표되어 골다공증 예방효과가 의문시 되고 있다.55
결 론
Phytoestrogens에 관한 연구는, 동물실험이 정착된 것이 1996년일 정도로 그 역사가 일천하며, 참고할 만한 임상연구는 더욱 적은 실정이다. 그러나 현재 까지의 동물과 인간을 대상으로 한 중재적 연구들, 약동학적 연구들에서 phytoestrogens은 폐경 후 골소 실을 예방하는 보호 효과를 보여주었고, 실험 기계 론적인 연구에서 파골 세포의 TRAP 발현, 분화 및 활성을 의미있게 감소시키며 조골세포의 골세포, 골 내층 세포(bone lining cells)로의 분화 및 골밀도, ALP, osteocalcin, osteopontin, α1(I) collagen을 증가 시키는 것으로 보고되었다. 이러한 측면에서 phyto- estrogens은 골다공증의 예방과 치료에 긍정적인 효 과가 있을 가능성이 높을 것으로 사료되나 연구 결 과들이 모두 일치하지는 않아 현재까지는 phytoestro- gens의 골다공증에 대한 효과에 대해서 명확한 결론 을 내릴 수 없고, 앞으로 phytoestrogens의 제제, 용 량, 사용 기간, 투여 형태, 인구 집단 등 생체이용률
과 대사에 영향을 주는 여러 변수들이 잘 통제되어 계획된 장기간의 무작위 통제 연구가 필요할 것으로 사료된다.
참 고 문 헌
1. Lagari VS, Levis S. Phytoestrogens and bone health. Curr Opin Endocrinol Diabetes Obes 2010;
17:546-53.
2. Chiang SS, Pan TM. Benificial effects of phyto- estrogens and their metabolites produced by intes- tinal microflora on bone health. Appl Microbiol Biotechnol 2013;97:1489-500.
3. Kuiper G, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, et al. Comparison of the Ligand Binding Specificity and Transcript Tissue Distribution of Estrogen Receptors α and β.
Endocrinology 1997;138:863-70.
4. Lee Y, Chen X, Anderson J. Physiological concen- trations of genistein stimulate the proliferation and protect against free radical-induced oxidative damage of MC3T3-E1 osteoblast-like cells. Nutr Res 2001;21:1287-93.
5. Pan W, Quarles LD, Song LH, Yu YH, Jiao C, Tang HB, et al. Genistein stimulates the osteo- blastic differentiation via NO/cGMP in bone marrowculture. J Cell Biochem 2005;94:307-16.
6. Federici E, Garrett R, Quintin A, Touche A, Courtois D, Mundy E, et al. Soybean extract and its isoflavones, genistein and daidzein, stimulate BMP-2 expression and bone formation by inhi- biting the mevalonate pathway in osteoblast cells.
Bone 2004;34(Suppl):S4-S4.
7. Dang ZC, Audinot V, Papapoulos SE, Boutin JA, Lowik C. Peroxisome proliferator-activated receptor gamma (PPAR gamma) as a molecular target for the soy phytoestrogen genistein. J Biol Chem 2003;
278:962-7.
8. Dang ZC, Lowik C. The balance between concu- rrent activation of ERs and PPARs determines
daidzein-induced osteogenesis and adipogenesis. J Bone Miner Res 2004;19:853-61.
9. Chen X, Garner SC, Quarles LD, Anderson JJ.
Effects of genistein on expression of bone markers during MC3T3-E1 osteoblastic cell differentiation. J Nutr Biochem 2003;14:342-49.
10. Wu XT, Wang B, Wei JN. Coumestrol promotes proliferation and osteoblastic differentiation in rat bone marrow stromal cells. J Biomed Mater Res B Appl Biomater 2009;90:621-28.
11. Alcantara EH, Shin MY, Sohn HY, Park YM, Kim T, Lim JH, et al. Diosgenin stimulates osteogenic activity by increasing bone matrix protein synthesis and bonespecific transcription factor Runx2 in osteo- blastic MC3T3-E1 cells. J Nutr Biochem 2011;22:
1055-63.
12. Seidlova-Wuttke D, Hesse O, Jarry H, Christoffel V, Spengler B, Becker T, et al. Evidence for selective estrogen receptor modulator activity in a black cohosh (Cimicifuga racemosa) extract: com- parison with estradiol-17beta. Eur J Endocrinol 2003;149:351-62.
13. Yamaguchi M, Jie Z. Effect of polyphenols on calcium content and alkaline phosphatase activity in rat femoral tissues in vitro. Biol Pharm Bull 2001;
24:1437-9.
14. Fuller K, Wong B, Fox S, Choi Y, Chambers TJ.
TRANCE is necessary and sufficient for osteoblast- mediated activation of bone resorption in osteo- clasts. J Exp Med 1998;188:997-1001.
15. Theoleyre S, Wittrant Y, Tat SK, Fortun Y, Redini F, Heymann D. The molecular triad OPG/RANK/
RANKL: involvement in the orchestration of patho- physiological bone remodeling. Cytokine Growth Factor Rev 2004;15:457-75.
16. Rassi CM, Lieberherr M, Chaumaz G, Pointillart A, Cournot G. Down-regulation of osteoclast diffe- rentiation by daidzein via caspase 3. J Bone Miner Res 2002;17:630-38.
17. Huang YF, Cao SM, Nagamani M, Anderson KE,
Grady JJ, Lu LJW. Decreased circulating levels of tumor necrosis factor-alpha in postmenopausal women during consumption of soy-containing iso- flavones. J Clin Endocr Metab 2005;90:3956-62.
18. Li BB, Yu SF. Genistein prevents bone resorption diseases by inhibiting bone resorption and stimu- lating bone formation. Biol Pharm Bull 2003;26:
780-6.
19. Chen XW, Garner SC, Quarles LD, Anderson JJB.
Effects of genistein on expression cell of bone markers during MC3T3-E1 osteoblastic differen- tiation. J Nutr Biochem 2003;14:342-9.
20. Chen XW, Garner SC, Anderson JJB. Isoflavones regulate interleukin-6 and osteoprotegerin synthesis during osteoblast cell differentiation via an estrogen- receptordependent pathway. Biochem Biophys Res Comm 2002;295:417-22.
21. Suh KS, Koh G, Park CY, Woo JT, Kim SW, Kim JW, et al. Soybean isoflavones inhibit tumor necrosis factor-alpha-induced apoptosis and the production of interleukin-6 and prostaglandin E-2 in osteo- blastic cells. Phytochemistry 2003;63:209-15.
22. Okamoto F, Okabe K, Kajiya H. Genistein, a soybean isoflavone, inhibits inward rectifier K+ channels in rat osteoclasts (Abstract). Jap J Physiol 2001;51:501-9.
23. Cotter AA, Jewell C, Cashman KD. The effect of oestrogen and dietary phyto-oestrogens on transe- pithelial calcium transport in human intestinal-like Caco-2 cells. Br J Nutr 2003;89:755-65.
24. Arjmandi BH, Khalil DA, Hollis BW. Soy protein:
its effects on intestinal calcium transport, serum vitamin D, and insulinlike growth factor-I in ovariec- tomized rats. Calcif Tissue Int 2002;70:483-7.
25. Spence LA, Lipscomb ER, Cadogan J, Martin B, Wastney ME, Peacock M, et al. The effect of soy protein and soy isoflavones on calcium metabolism in postmenopausal women: a randomized crossover study. Am J Clin Nutr 2005;81: 916-22.
26. Fanti P, Monier-Faugere MC, Geng Z, Schmidt J,
Morris PE, Cohen D, et al. The phytoestrogen genistein reduces bone loss in short-term ovariecto- mised rats. Osteoporosis Int 1998;8:274-81.
27. Nakai M, Black M, Jeffery EH, Bahr JM. Dietary soy protein and isoflavones: no effect on the reproductive tract and minimal positive effect on bone resorption in the intact female Fischer 344 rat. Food Chem Toxicol 2005;43:945-49.
28. James P, Sabatier JP, Bureau F, Laroche D, Jauzac P, Arhan P, et al. Influence of dietary protein and phyto-oestrogens on bone mineralization in the young rat. Nutr Res 2002;22:385-92.
29. Hotchkiss CE, Weis C, Blaydes B, Newbold R, Delclos KB. Multigenerational exposure to genis- tein does not increase bone mineral density in rats.
Bone 2005;37:720-7.
30. Arjmandi BH, Getlinger MJ, Goyal NV, Alekel L, Hasler CM, Juma S, et al. Role of soy protein with normal or reduced isoflavone content in reversing bone loss induced by ovarian hormone deficiency in rats. Am J Clin Nutr 1998;68(6 Suppl):1358S- 1363S.
31. Picherit C, Chanteranne B, Bennetau-Pelissero C, Davicco MJ, Lebecque P, Barlet JP, et al.
Dose-dependent bone-sparing effects of dietary isoflavones in the ovariectomised rat. Br J Nutr 2001;85:307-16.
32. Picherit C, Bennetau-Pelissero C, Chanteranne B, Lebecque P, Davicco MJ, Barlet JP, et al. Soybean isoflavones dose-dependently reduce bone turnover but do not reverse established osteopenia in adult ovariectomised rats. J Nutr 2001;131: 723-8.
33. Kim DW, Yoo KY, Lee YB, Lee KH, Sohn HS, Lee SJ, et al. Soy isoflavones mitigate long-term femoral and lumbar vertebral bone loss in middle- aged ovariectomized mice. J Med Food 2009;12:
536-41.
34. Chiang SS, Pan TM. Antiosteoporotic effects of Lactobacillus fermented soy skim milk on bone mineral density and the microstructure of femoral
bone in ovariectomized mice. J Agric Food Chem 2011;59:7734-42.
35. Chiang SS, Liao JW, Pan TM. Effect of bioactive compounds in lactobacilli-fermented soy skim milk on femoral bone microstructure of aging mice. J Sci Food Agric 2012;92:328-35.
36. Uesugi T, Toda T, Tsuji K, Ishida H. Comparative study on reduction of bone loss and lipid metabolism, abnormality in ovariectomized rat by soy isoflavone, daidzein, genistein, and glycytin.
Biol Pharm Bull 2001;24:368-72.
37. Mei J, Yeung S, Kung W. High Dietary Phyto- estrogen Intake Is Associated with Higher Bone Mineral Density in Postmenopausal but Not Pre- menopausal Women. J Clin Endocrinol Metab 2001;86:5217-21.
38. Kim MK, Chung BC, Yu VY, Nam JH, Lee HC, Huh KB, et al. Relationships of urinary phyto- oestrogen excretion to BMD in postmenopausal women. Clin Endocrinol 2002;56:321-8.
39. Horiuchi T, Onouchi T, Takahashi M, Ito H, Orimo H. Effect of Soy Protein on Bone Metabolism in Postmenopausal Japanese Women. Osteoporosis Int 2000;11:721-4.
40. Song KB, Atkinson C, Frankenfeld CL, Jokela T, Wähälä K, Thomas WK, et al. Prevalence of daidzein- metabolizing phenotypes differs between Caucasian and Korean American women and girls.
J Nutr 2006;136:1347-51.
41. Greendale G, FitzGerald G, Huang M, Sternfeld B, Gold E, Seeman T, et al. Dietary Soy Isoflavones and Bone Mineral Density: Results from the Study of Women's Health Across the Nation. Am J Epidemiol 2002;155:746-51.
42. Kritz-Silverstein, Goodman-Gruen DL. Usual dietary isoflavone intake, bone mineral density, and bone metabolism in postmenopausal women. J Womens Health Gend based Med 2002;11:69-78.
43. Potter S, Baum J, Teng H, Stillman RJ, Shay NF, Erdman JW Jr. Soy protein and isoflavones: their
effects on blood lipids and bone density in post- menopausal women. Am J Clin Nutr 1998;68:
1375S-79S.
44. Atkinson C, Compston JE, Day NE, Dowsett M, Bingham SA. The effects of phytoestrogen isofla- vones on bone density in women: a double-blind, randomized, placebo-controlled trial. Am J Clin Nutr 2004;79:326-33.
45. Harkness L, Fiedler K, Sehgal A, Oravec D, Lerner E. Decreased bone resorption with soy isoflavone supplementation in postmenopausal women. J Womens Health 2004;13:1000-7.
46. Brink E, Coxam V, Robins S, Wahala K, Cassidy A, Branca F. PHYTOS Investigators. Long-term consumption of isoflavone-enriched foods does not affect bone mineral density, bone metabolism, or hormonal status in early postmenopausal women: a randomized, double-blind, placebo controlled study.
Am J Clin Nutr 2008;87:761-70.
47. Frankenfeld CL, Atkinson C, Thomas WK, Goode EL, Gonzalez A, Jokela T, et al. Familial corre- lations, segregation analysis and nongenetic correlates of soy isoflavone-metabolising phenotypes. Exp Biol Med 2004;229:902-13.
48. Ibarreta D, Daxenberger A, Meyer HHD. Possible health impact of phytoestrogens and xenoestrogens in food. APMIS 2001;109:161-84.
49. Nettleton JA, Greany KA, Thomas W, Wangen KE, Adlercreutz H, Kurzer MS. Plasma phyt- oestrogens are not altered by probiotic consumption in postmenopausal women with and without a history of breast cancer. J Nutr 2004;134:1998- 2003.
50. Wangen KE, Duncan AM, Merz-Demlow BE, Xu X, Marcus R, Phipps WR, et al. Effects of soy isoflavones on markers of bone turnover in premenopausal and postmenopausal women. J Clin Endocr Metab 2000;85:3043-8.
51. Koyama I, Shimanuki S, Tezuka M, Kawasaki Y, Shimizu M, Arai I, et al. Effects of natto (fer- mented soybean; made from isoflavone- rich soybean) supplemented with zinc and calcium on bone density and bone metabolic markers of postmenopausal women. J Nutr 2004;134(Suppl):
S1288-9.
52. Wuttke W, Seidlová-Wuttke D, Gorkow C. The Cimicifuga preparation BNO 1055 vs. conjugated estrogens in a double-blind placebo-controlled study:
effects on menopause symptoms and bone markers.
Maturitas 2003;44:S67-77.
53. Morabito N, Crisafulli A, Vergara C, Gaudio A, Lasco A, Frisina N, et al. Effect of genistein and Hormone replacement therapy on bone loss in early postmenopausal women: A randomized double- blind placebo-controlled study. J Bone Miner Res 2002;17:1904-12.
54. Lydeking-Olsen E, Jensen J, Setchell K. Isoflavone- Rich Soymilk Prevents Bone Loss in the Lumbar Spine of Postmenopausal Women: A Two-Year Study. J Nutr 2002;132:582S(abstr).
55. Alexandersen P, Toussaint A, Christiansen C, Devogelaer JP, Roux C, Fechtenbaum J, et al.
Ipriflavone in the Treatment of Postmenopausal Osteoporosis: A Randomized Controlled Trial for the Ipriflavone Multicenter European Fracture Study.
JAMA 2001;285:1482-8.