임상에서 분리된 Acinetobacter baumannii의 항생제 내성 패턴과 유전학적 특징
김민지·이시원·이도경·박재은*·강주연*·박일호·신혜순*·하남주# 삼육대학교 약학과, *덕성여자대학교 약학과
(Received March 21, 2013; Revised March 29, 2013; Accepted April 1, 2013)
Antibiotic Resistant Patterns and DNA Fingerprint Analysis of Acinetobacter baumannii from Clinical Isolates
Min-Ji Kim, Si-Won Lee, Do-Kyung Lee, Jae-Eun Park*, Joo-Yeon Kang*, Il-Ho Park, Hae-Soon Shin* and Nam-Joo Ha#
Department of Pharmacy, Sahmyook University, Seoul 139-742, Korea
*Department of Pharmacy, Duksung Women’s University, Seoul 132-714, Korea
Abstract — Acinetobacter baumannii is gram-negative bacilli that can be widely found in environments. Recently, A. bau- mannii emerged as a serious nosocomial infection. A total of 92 A. baumannii were isolated from hospitalized patients in Seoul, Korea, between December 2010 and April 2011. Antimicrobial susceptibility testing was investigated using CLSI agar dilution methods. Tigecycline non-susceptible A. baumannii isolates were investigated by repetitive extragenic palindromic sequence-based PCR (rep-PCR). Pulsed-field gel electrophoresis was performed to determine the epidemiological rela- tionships. All clinical isolates showed high-level resistance to the most commonly used antibiotics: Ciprofloxacin (87.0%), Ampicillin/sulbactam (82.6%), Cefotaxime (81.5%), Ceftazidime (80.4%). Moreover, 50.0% of these isolates were non-sus- ceptible to tigecycline. When evaluated by RAPD analysis, generated distinct band ranging in size from 1kb to 8k band vary- ing from 4 to 10 bands. Stricter surveillance and more rapid detection are essential to prevent the spread of multi drug resistant A. baumannii.
Keywords □ Acinetobacter baumannii, Antibiotic resistance, rep-PCR, RAPD analysis
Acinetobacter균은 호기성, 포도당 비 발효, 그람 음성 간균으로 자연계에서 분리되는 균이며, 건강한 사람의 피부 상재 균으로 존 재 한다.6)그러나 90년대 이후 급격히 증가하고 있는 Pseudomonas aeruginosa와 더불어 특히 Acinetobacter baumannii는 원내 감염 의 주요 원인 균이다.1,11,13,14)일반적으로 그람 음성 세균은 그람 양성 세균에 비해 건조한 환경에서 생존력이 약하지만, A.
baumannii는 그람 음성 세균임에도 불구하고 병원환경에서 오랜 시간 서식하다가 주로 면역력이 약한 환자에게 폐렴, 패혈증, 요로 감염, 심내막염 및 창상감염과 같은 다양한 감염증을 유발 한다.8,15) A. baumannii에 의한 감염증 치료에는 imipenem, meropenem 과 같은 비교적 β-lactamase에 안정한 carbapenem 계열의 항생
제들이 사용되어 왔다.4)그러나 최근 다양한 항생제에 내성을 나 타내는 다제 내성 A. baumannii균들의 증가로 인하여 감염증의 치료가 어려워져14)임상적으로 중대한 문제가 되고 있으며 이에 대한 내성연구의 중요성이 부각되고 있다.2,6) 이러한 이유로 최 근 새로운 항생제들이 다제 내성 균주의 극복을 위해 개발되고 있는 실정이다. 2005년에 미국 FDA의 승인을 받은 tigecycline 은 glycylcycline이라는 새로운 계열의 항생제로서 매우 넓은 범 위의 항균력을 가지며,3,10)아직 국내에서는 많이 사용되고 있지 않아 내성균에 효과가 있을 것으로 기대되고 있다.5,16)
따라서 본 연구에서는 임상 검체로부터 분리된 A. baumannii 에 대하여 항생제 감수성 검사 후, tigecycline에 대하여 내성을 나타내는 균주를 선별하였다. 그리고 BOX-, (GTG)5, TAP-primer 를 가지고 세균 분류에 사용하는 rep-PCR을 거쳐 randomaly amplified polymorphic DNA(RAPD)-fingerprinting을 수행하여 균주들 간의 유연관계를 조사하고자 하였다.
#본 논문에 관한 문의는 저자에게로
(전화) 02-3399-1607 (팩스) 02-3399-1617 (E-mail) hanj@syu.ac.kr
종설
실험재료 및 방법
검체의 채취
본 실험에서는 국내의 한 2차 진료기관에서 환자들의 검체로 부터 분리, 동정된 A. baumannii 균주 92주를 제공받아 사용하 였다. 총 92주의 샘플은 2010년 12월부터 2011년 4월까지 다섯 달 동안 수집되었고, 환자의 나이, 성별, 검체의 origin을 기록하 였다. 연구에 사용된 균주 샘플의 내용은 Table I에 나타내었다.
항생제 감수성 검사
본 실험은 Clinical Laboratory and Standards Institute (CLSI, 2003)의 방법에 따라 고체배지 희석법으로 Mueller Hinton(DIFCO) 배지를 사용하여 실시하였으며, 사용된 항생제는 Ampicillin/sulbactam(pfizer), Cefotaxime(Handok), Ceftazidime (Glaxosmithkline), Ciprofloxacin(Ildong), Gentamicin(Sigma), Meropenem(Yuhan), Tigecycline(Wyeth pharmaceuticals) 및 Tobramycin(Daewoong)으로 8종에 대한 감수성을 확인하였다.
사용 균 액은 Mueller Hinton 배지에서 37oC의 온도조건에서 하룻밤 동안 전 배양하였으며, 항생제의 최소 억제 농도(minimum inhibitory concentration, MIC)의 측정은 고체배지 희석법에 의하 여 실시하였다. 항생제를 함유한 배지는 최고 농도를 128 µg/ml로 하여 12단계 농도로 2배씩 연속적으로 희석하여 만들었다. 106cfu/
Table I− Prevalence of Acinetobacter baumannii isolated from clinical samples
Characteristic Total n (%)
Male n (%)
Female n (%) Number 92 (100.0) 51 (55.4) 41 (44.6) Age (year)
<60 14 (15.2)0 1 (1.1) 13 (14.1)
≥60 78 (84.8)0 50 (54.3) 28 (30.4)
Specimen
Blood 1 (1.1)0 0 (0.0) 1 (1.1)
Bronchial wash fluid 1 (1.1)0 1 (1.1) 0 (0.0)
Intubation 1 (1.1)0 1 (1.1) 0 (0.0)
Sputum 83 (90.2)0 44 (47.8) 39 (42.4)
Urine 3 (3.3)0 2 (2.2) 1 (1.1)
Wound 3 (3.3)0 3 (3.3) 0 (0.0)
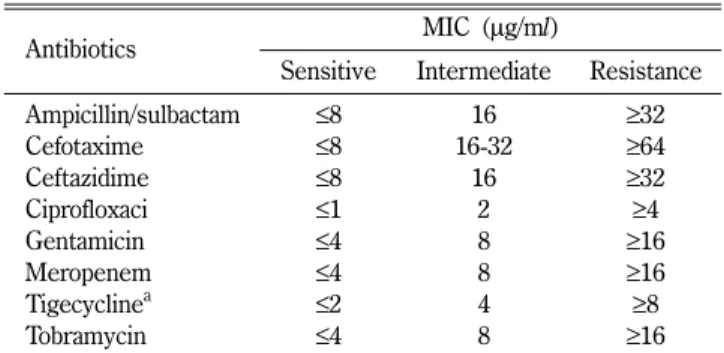
Table II− MIC interpretive standards (µg/ml) of Clinical Laboratory and Standards Institute (CLSI)
Antibiotics MIC (µg/ml)
Sensitive Intermediate Resistance
Ampicillin/sulbactam ≤8 16 ≥32
Cefotaxime ≤8 16-32 ≥64
Ceftazidime ≤8 16 ≥32
Ciprofloxaci ≤1 2 ≥4
Gentamicin ≤4 8 ≥16
Meropenem ≤4 8 ≥16
Tigecyclinea ≤2 4 ≥8
Tobramycin ≤4 8 ≥16
aTigecycline MICs were defined based on the United States Food and Drug Administration break point criteria.
Table III− PCR cycle
BOXA2R (GTG)5 TAP1, TAP2
95oC 3 min 95oC 7 min 92oC 2 min
30 cycles
95oC 45 s
30 cycles
94oC 1 min
40 cycles
92oC 30
35oC 1 min 52oC 1 min 38oC 1 min
65oC 2 min 65oC 8 min 68oC 1 min 30 s
65oC 5 min 65oC 16 min 68oC 10 min
4oC ∞ 4oC ∞ 4oC ∞
ml 농도가 되도록 희석한 균을 항생제를 함유한 고체배지에 5 µl 접종하여 18시간 배양 후, 항생제 농도에 따른 colony의 증식 양 상을 관찰하였다. 항생제 감수성 검사의 정도 관리를 위하여 Escherichia coli ATCC 25922를 표준 균주로 사용하였다(Table II).
유전학적 특징 분석
DNA 분리 − Tigecycline에서 중간 내성 이상의 결과를 나타낸 A. baumannii 균주를 대상으로 NA 배지에서 37oC의 온도조건 에서 하룻밤 동안 전 배양한 후에, 이를 원심 분리하여 균을 수 확하였다. 그리고 수확한 균을 QIAamp DNA Mini Kit(Qiagen inc.)를 사용하여 DNA를 분리하였다.
중합 효소 연쇄반응 − 실험에 사용된 A. baumannii 균주들의 유전적인 관계를 조사하기 위해 추출한 DNA를 대상으로 polymerase chain reaction(PCR)-RAPD 분석을 수행하였다. 사 용한 primer(Bioneer)는 BOXA2R(5'-ACG TGG TTT GAA GAG ATT TTC G-3'), (GTG)5(5'-GTG GTG GTG GTG GTG-3'), TAP1(5'-CAG CAG CCG CGG TAA TAC-3'), TAP2 (5'-CAG CAG CCG CGG TAA TTC-3')이다. PCR 반응은 5 unit Taq DNA polymerase(250 U, TaKaRarTaq, Tokyo), 25 mM MgCl2, 2.5 mM dNTPs, 20 mM Tris-HCl(pH 8.0), 100 mM KCl, 10 pmol primer와 200 ng template genomic DNA를 포함 하는 50 µl 부피에서 수행하였다. PCR 증폭반응은 TaKaRa PCR Thermal Cycler(TaKaRa, Tokyo)에서 수행하였다. Primer 별 반
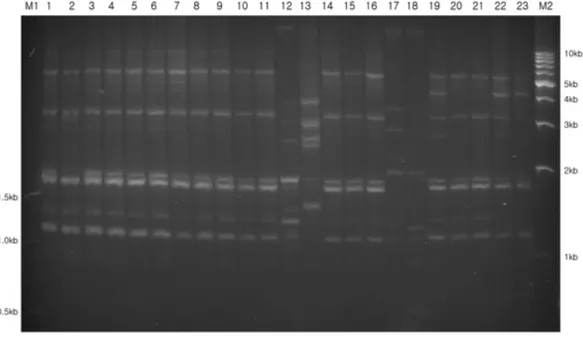
Fig. 1− Genomic fingerprinting patterns of Acinetobacter baumannii isolates using BOXA2R primers. Lane: M1,100 bp ladder size marker;
lanes 1-46, clinical isolates of A. baumannii; M2, 1 kb ladder size marker.
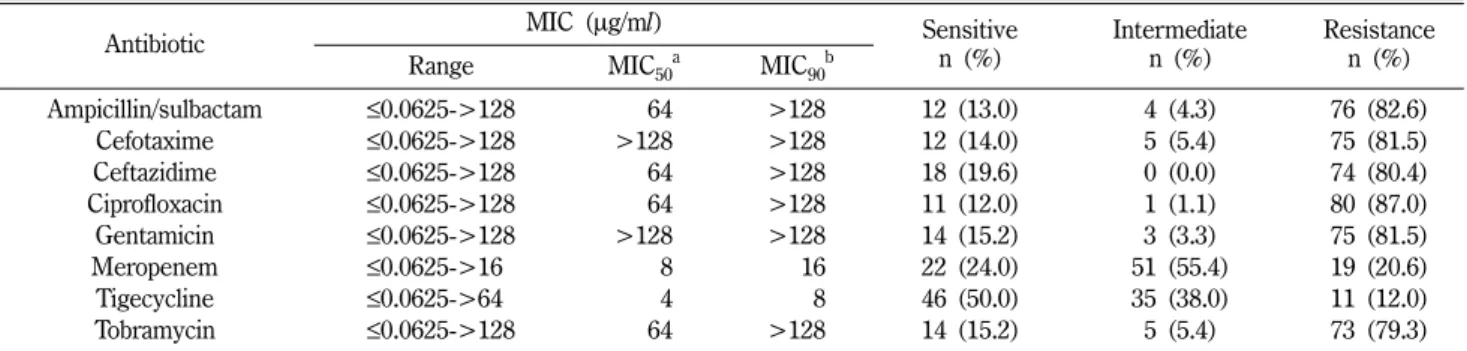
Table IV− MIC distributions for eight antibiotics Acinetobacter baumannii isolated from patients in Korea
Antibiotic MIC (µg/ml) Sensitive
n (%)
Intermediate n (%)
Resistance n (%)
Range MIC50a MIC90b
Ampicillin/sulbactam ≤0.0625->128 64 >128 12 (13.0) 4 (4.3) 76 (82.6)
Cefotaxime ≤0.0625->128 >128 >128 12 (14.0) 5 (5.4) 75 (81.5)
Ceftazidime ≤0.0625->128 64 >128 18 (19.6) 0 (0.0) 74 (80.4)
Ciprofloxacin ≤0.0625->128 64 >128 11 (12.0) 1 (1.1) 80 (87.0)
Gentamicin ≤0.0625->128 >128 >128 14 (15.2) 3 (3.3) 75 (81.5)
Meropenem ≤0.0625->160 8 16 22 (24.0) 51 (55.4) 19 (20.6)
Tigecycline ≤0.0625->640 4 8 46 (50.0) 35 (38.0) 11 (12.0)
Tobramycin ≤0.0625->128 64 >128 14 (15.2) 5 (5.4) 73 (79.3)
aMIC50, minimum inhibitory concentration for 50% of isolates.
bMIC90, minimum inhibitory concentration for 90% of isolates.
응조건은 Table III에 나타내었다.
Fingerprinting− PCR 증폭이 끝난 후, 증폭된 PCR 산물들 을 1.5% agarose gel에서 6시간 30분 동안 100 V의 전압으로 전 기영동 법을 이용하여 분리하였고, SYBR Green(Invitrogen) 염 색법으로 결과를 판독하였다.
결과 및 고찰
최소 저지 농도의 측정
8개의 항생제를 사용하여 항생제 감수성 검사를 한 결과는
Table IV와 같다. 본 연구의 대상인 92개의 균주 중에서 5개의 균주를 제외하고 모든 균주에서 한 가지 이상의 항생제에 내성 을 나타내었고(94.6%), 그 중 2가지 이상의 항생제 내성을 나타 내는 다제 내성균이 90.2%에 달하였다. 대부분의 항생제 ciprofloxacin(87.0%), ampicillin/sulbactam(82.6%), Cefotaxime (81.5%), Ceftazidime(80.4%)에서는 높은 내성 비율을 보였다.
carbapenem계 항생제인 meropenem에서도 76%의 내성을 나타 내었고, 특히 앞에 언급했던 tigecycline에 대해서는 실험에 사용 한 다른 항생제와 비교하여 가장 높은 비율의 감수성을 보였지 만, 46주(50.0%)에서 중간내성 이상의 결과를 보여 감수성과 내
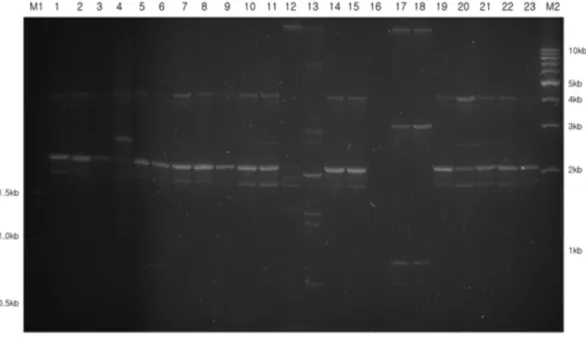
Fig. 2− Genomic fingerprinting patterns of Acinetobacter baumannii isolates using (GTG)5 primers. Lane: M1, 100 bp ladder size marker; lanes 1-46, clinical isolates of A. baumannii; M2, 1 kb ladder size marker.
성의 비율이 같은 것으로 분석되었다.
유전학적 특징 분석
4종류의 primer를 이용하여 tigecycline에 내성을 보이는 46균 주에 대한 유전자특징을 분석한 결과, 다양한 유전적 구성 양상 을 관찰할 수 있었다. 같은 속명과 종명을 가졌다 할지라도 strain 이 다르면 그 특이성이 달라지기 때문이다. 서로 다른 primer를 사용한 RAPD-fingerprinting 결과를 관찰하였을 때, 4종류의 primer 모두에서 DNA가 증폭된 것이 확인할 수 있었으며, 1 kb 부터 8 kb까지의 범위에서 4개에서 10개의 다양한 수의 DNA
band가 분포되어 있었다.
결 론
본 연구에서는 임상 검체에서 분리된 A. baumannii 균주의 항 생제에 대한 내성 양상과 유전학적 특징을 비교하여 분리 균주 의 다양성을 조사 하고자 하였다.
A. baumannii는 세계적으로 급증하고 있는 원내 감염균이며, 기회감염성 세균으로 면역 저하자에게 주로 감염된다. 다양한 항 생제에 대한 내성 기전 또한 쉽게 획득하여 치료가 어렵기 때문 Fig. 3− Genomic fingerprinting patterns of Acinetobacter baumannii isolates using TAP1 primers. Lane: M1, 100 bp ladder size marker; lanes
1-46, clinical isolates of A. baumannii; M2, 1 kb ladder size marker.
에 심각한 사회적 문제가 되고 있다.
총 92주의 임상 검체 중 60세 이상 남성 고령자의 객담에서 가장 흔히 발견되었다. 항생제의 감수성 검사 결과로, 한 가지 이 상의 항생제에 내성을 나타내는 균주가 전체 샘플 수의 94.6%
에 달하였고, 그 중 90.2%는 다제 내성균으로 나타났다. 많은 연 구가 이루어지고 있는 carbapenem계 항생제에서는 물론이며 신 항생제인 tigecycline에서도 50.0%의 내성률을 보였다. RAPD- fingerprinting 양상에서는 다수의 균주 들이 동일한 특성을 띠는 부분이 나타났다.
최근 각종 질병의 치료에 항생제가 광범위하게 사용되면서 이
에 따른 내성균들이 나타나게 되었다. 우리나라의 항생제 내성 관리를 위해 우선적으로 항생제의 오남용을 줄이고 사용량을 지 키는 것이 대책의 첫 걸음이라 할 수 있겠다. 뿐만 아니라 원내 감염으로 인한 급속한 전파를 방지하기 위하여 지속적인 관리가 매우 필요할 것으로 사료된다.
감사의 글
임상검체로부터 Sample 수집 및 동정에 도움을 주신 진료기 관과 삼육대학교 및 모든 분들께 감사를 드립니다.
Fig. 4− Genomic fingerprinting patterns of Acinetobacter baumannii isolates using TAP2 primers. Lane: M1, 100 bp ladder size marker; lanes 1-46, clinical isolates of A. baumannii; M2, 1 kb ladder size marker.
참고문헌
1) Bergogne-Berein, E. and Towner, K. J. : Acinetobacter spp.
as nosocomial pathogens: microbiological, clinical, and epidemiological features. Clin. Microbiol. Rev. 9, 148 (1996).
2) Corbella, X., Montero, A., Pujol, M., Domiguez, M. A., Ayats, J. and Argerich, M. J. : emergence and rapid spread of carbapenem resistance during a large and sustained hospital outbreak of multi resistant Acinetobacter baumannii. J. Clin.
Microbiol. 38, 4086 (2000).
3) Giamarellou, H., Antoniadou, A. and Kanellakopoulou, K. : Acinetobacter baumannii: a universal threat to public health?
Int. J. Antimicrob. Agents 32, 106 (2008).
4) Jeong, S. H., Bae, I. K., Park, K. O., An, Y. J., Sohn, S. G., Jang, S. J., Sung, K. H., Yang, K. S., Lee, K. W., Young, D. G. and Lee, S. H. : Outbreaks of imipenem-resistant Acinetobacter baumannii producing carbapenemases in Korea. J. Microbiol.
44, 423 (2006).
5) Karageorgopoulos, D. E., Kelesidis, T., Kelesidis, I. and Falagas, M. E. : Tigecycline for the treatment of multidrug- resistant (including carbapenem-resistant) acinetobacter infections: a review of the sdientific evidence. J. Antimicrob.
Chemother. 62, 45 (2008).
6) Kim, S. H., Choi, J. H., Park, E.J., Suh, I. W. and Son, S. Y. : Analysis of integron-associated multi-drug resistance of Acinetobacter baumannii isolated in Korea. Korean J. Microbiol.
46, 303 (2010).
7) Lee, K. W., Lim, C. H., Cho, J. H., Lee, W. G., Uh, Y., Kim, H. J., Yong, D. G., Chong, Y. S. and the KONSAR group. High prevalence of ceftazidime-resistant Klebsiella pneumoniae and increase of imipenem-resistant Pseudomonas aeruginosa and Acinetobacter spp. in Korea : a KONSAR program in 2004.
Yonsei Med. J. 47, 634 (2006).
8) Lim, Y. M., Choi T. S. and Kim, J. M. : Determination of genomospecies and characterization of antimicrobial resistance of multi-drug resistant Acinetobacter spp. isolates. J. Bacteriol.
Virol. 36, 21 (2006).
9) Liu, J. W., Wang, L. S., Cheng, Y. J., Hsu, G. J., Lu, P. L., Liu, Y. C., Chen, C. M., Lee, C. M., Sun, W., Jang, T. N., Chiang, P. C., Chuang, Y. C., Lin, H. C., Shin, Z. Y., Kung, H. C., Huang, C. H., Tsao, S. M., Lu, C. T., Liao, C. H. and Hsueh, P. R. : In- vitro activity of tigecycline against clinical isolates of Acinetobacter baumannii in Taiwan. Int. J. Antimicrobi. Agents 32, S188 (2008).
10) Navon-Venezia, S., Leavitt, A. and Carmeli, Y. : High tigecycline resistance in multidrug-resistant Acinetobacter baumannii. J. Antimicrob. Chemother. 59, 772 (2007).
11) Oh, J. Y., Cho, J. W., Park, J. C. and Lee, J. C. : Moleculartyping of Acinetobacter baumannii strains by randomly amplified polymorphic DNA (RAPD) analysis. J. Korean Soc. Microbiol.
35, 129 (2000).
12) Oh, H. R., Jang, S. J., Yu, F. N., Park, G., Li, X. M., Shin, S. H., Kim, W. Y., Moon, D. S. and Park, Y. J. : Prevalence of carbapenemaseand integrase genes in imipenem-resistant Acinetobacter baumannii and Pseudomonas aeruginosa collected over several years in a University Hospital. Korean J. Clin. Microbiol. 10, 128 (2007).
13) Oh, S. J., Lee, S. U., Hwang, H. Y., Bae, I. K., Jo, H. S., Lee, B. H. and Jeong, S. H. : Prevalence of class A extended- spectrum-lactamases in clinical isolates of Acinetobacter baumannii and Pseudomonas aeruginosa. Korean J. Lab. Med.
26, 14 (2006).
14) Park, K. O., Son, H. C., Bae, I. K. and Jeong, S. H. : Molecular epidemiology of infection caused by OXA-23 or IMP-1 β- lactamase-producing Acinetobacter baumannii. Korean J. Clin.
Microbiol. 8, 121 (2005).
15) Roh, K. H., Kim, C. K., Yum, J. H., Yong, D. G., Jeong, S. H., Lim, C. S., Lee, C. K., Cho, Y. J., Lee, K. W. and Chong, Y. S. : Carbapenem resistance mechanisms and molecular epidemiology of Acinetobacter spp. from four hospitals in Seoul and Gyeonggi Province in 2006. Korean J. Clin. Microbiol. 13, 27 (2010).
16) Song, J. H. : Current status and future strategies of antimicrobial resistance in Korea. Korean J. Med. 77, 143 (2009).