Appl. Chem. Eng., Vol. 23, No. 3, June 2012, 320-325
고체산 촉매를 이용한 폐윤활유의 촉매 분해
황인혜⋅양현선⋅이종집*⋅최고열**⋅이창용
†
공주대학교 환경공학과, *공주대학교 화학공학부, **서울과학기술대학교 화학공학과 (2012년 3월 1일 접수, 2012년 3월 12일 심사, 2012년 3월 16일 채택)
-
Catalytic Cracking of Waste Lubricant Oil over Solid Acid Catalysts
In Hye Hwang, Hyeon Sun Yang, Jong-Jib Lee*, Ko-Yeol Choi**, and Chang-Yong Lee
†
Department of Environmental Engineering Kongju National University, Cheonan 330-717, Korea
*Division of Chemical Engineering, Kongju National University, Cheonan 330-717, Korea
**Department of Chemical Engineering, Seoul National University of Science and Technology, Seoul 139-743, Korea (Received March 1, 2012; Revised March 12, 2012; Accepted March 16, 2012)
SiO 2 /Al 2 O 3 비가 10.5인 실리카‐알루미나(SA), 10인 수소형 모더나이트(HM), 12.5인 탈알루미늄 모더나이트(DM) 등을 이용하여 폐윤활유의 촉매분해를 수행하였다. 촉매의 분해능은 SA > DM > HM 시료 순으로 높았다. SA 시료 상에서 얻어진 분해오일은 휘발유의 탄소수 분포와 가까웠고 반면 DM 시료의 경우에는 경유의 탄소수 분포와 가까웠다. HM 시료 상에서 얻어진 분해오일의 탄소수 분포는 휘발유와 경유의 중간 정도였다. 산량은 SA ≈ HM > DM 시료 순으로 많았다. 10 Å 이하의 균일 세공을 가지는 HM과 DM 시료와는 달리, SA 시료의 세공은 10∼50 Å 범위의 분포를 나타 내었다. 이러한 결과들은 촉매의 산량과 세공 크기가 분해오일의 탄소수 분포와 관계가 있음을 보여준다. 촉매 표면에 탄소 및 불순물의 침적에 의한 표면적 감소는 SA > HM > DM 시료 순으로 컸다.
The catalytic cracking of waste lubricant oil was carried out on silica-alumina (SA), hydrogen-type mordenite (HM), and deal- uminated mordenite (DM) with the silica/alumina ratio of 10.5, 10, and 12.5, respectively. Activity in the catalytic cracking was found to be in the order of SA > DM > HM. Carbon number distribution of the oil obtained over SA was similar to that of gasoline while that of the oil obtained over DM was similar to that of diesel. Carbon number distribution of the oil obtained over HM was similar to that between gasoline and diesel. Acid amounts of three kinds of catalysts were found to be in the order of SA ≈ HM > DM. Unlike HM and DM with pores of an uniform diameter below 10 Å, SA had a pore size distribution within the range of 10 to 50 Å. These results indicate that the acid amount and pore size of the catalysts may be related to the carbon number distribution of the cracked oil. The decrement of surface area by the accumulation of carbon and impurities on the surface of the catalyst was found to be in the order of SA > DM > HM.
Keywords: catalytic cracking, waste lubricant oil, silica-alumina, H-type modernite, dealuminated modernite
1. 서 론
1)
급격한 차량 증가와 산업의 발달과 함께 윤활유의 사용량이 크게 증가함에 따라 폐유의 발생량도 동시에 급증하고 있다. 가솔린엔진유, 디젤엔진유, 터어빈유, 기어유, 절삭유, 압연유, 절연유 등 다양한 윤 활유를 교환 시 발생하는 폐윤활유는 유해성 지정폐기물이다. 이러한 폐윤활유 중 일부가 연료유로 사용되거나 무단 폐기되어 환경을 오염 시키고 있다. 윤활유는 기유에 여러 가지 첨가제를 배합한 제조유로서, 사용 도중 성분 물질이 열화되거나 분해 또는 오염물질이 섞여 물성이 저하되면서 폐윤활유로 변질된다. 폐윤활유는 자연상태에서 분해가 어려운 특성 때문에 환경 및 에너지 측면에서 처리기술의 개발은 매우 중요하다.
† 교신저자 (e-mail: cylee@kongju.ac.kr)
현재 폐윤활유의 처리기술 가운데 대표적인 것은 이온정제, 박막증류, 열분해 등이 있고 초임계 추출도 활발히 연구되고 있다[1-5]. 하지만 이온정제는 이차 오염을 유발하고, 박막증류와 초임계 추출은 설치비가 비싸며 열분해는 에너지의 소모가 크다. 최근 들어 선진국에서 적용 하려는 정유 공장의 열분해 공정은 원유에 폐윤활유를 혼합하고 상압 증류, 감압 증류, 촉매 분해, 상압 증류 과정을 통해 휘발유를 생산한 다. 촉매분해는 열분해와 비교하여 반응온도가 낮고 분해 생성물의 탄소수 분포 범위가 좁다[6]. 한편, 폐윤활유의 분해에 적용하는 고체 산 촉매는 산의 세기가 크고 분해오일의 확산이 용이한 세공 구조가 유리하다. 고체산 촉매로써 HY, USY, HZSM-5, HBEA, HM 등의 제올라이트와 실리카-알루미나, 알루미나 등이 연구되고 있다[7-10].
선진국에서는 폐윤활유 처리기술 개발에 상당한 발전을 이루고 있고
상용화도 이루어지고 있는 반면, 국내의 경우 폐유 처리기술은 화학
약품처리, 원심분리, 감압증류 등의 방법으로 단순분리하여 재활용하
Figure 1. Yield of oil as a function of reaction time for SA, HM, and DM. Solid keys : space velocity = 1.31 hr -1 at 400 ℃; open keys : 5.25 hr -1 at 450 ℃.
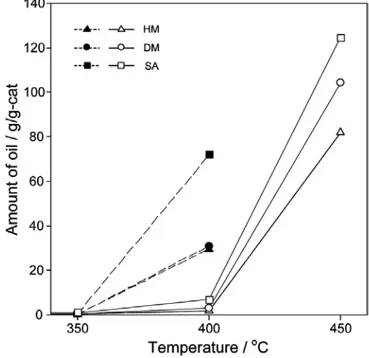
Figure 2. Amount of oil obtained on SA, HM, and DM with reaction temperature. Solid keys : space velocity = 1.31 hr -1 ; open keys : 5.25 hr -1 .
는 수준에 머물러 있다[11]. 또한 촉매 개발을 통하여 부가가치가 높 은 오일을 생산하는 실질적인 연구는 아직까지 거의 전무한 상태이다.
본 연구에서는 상용 실리카-알루미나와 나트륨형 모더나이트로부터 제조한 수소형 모더나이트와 탈알루미늄 모더나이트를 이용하여 폐 윤활유의 촉매분해를 실시하였다. 제조한 촉매는 NH 3 -TPD 와 질소흡 착을 통하여 산 특성과 세공 특성을 고찰하였다. 분해오일에서 =<C 9 , C 10 -C 13 , C 14 -C 17 , C 18 -C 22 , C 23 -C 26 성분의 분율을 측정하여 촉매의 산 특성과 세공 특성이 미치는 영향을 고찰하였다.
2. 실 험
2.1. 촉매 제조
본 실험에 사용한 실리카-알루미나는 Nikki사 제품으로서 SiO 2 /Al 2 O 3
비가 10.5이다. 출발 모더나이트는 Norton사 제품으로서 SiO 2 /Al 2 O 3
비가 10인 나트륨형 모더나이트(NaM)를 1 M NH 4 Cl 용액으로 80 ℃ 에서 이온교환하고 세척한 후 120 ℃에서 건조하여 암모늄형 모더나 이트(NH 4 M) 를 만들었다. 제조된 NH 4 M 을 500 ℃의 건조공기 중에서 5 h 소성하여 수소형 모더나이트(HM) 시료를 제조하였다. HM 시료를 6M HCl 용액에 넣고 3 h 가열한 다음 충분히 수세하고 150 ℃에서 건조 공기로 소성하여 SiO 2 /Al 2 O 3 비가 12.5인 탈알루미늄 모더나이트 (DM) 시료를 제조하였다.
2.2. 특성 분석
2.2.1. NH 3 -Temperature Programmed Desorption (TPD)
100/120 mesh 크기의 시료 200 mg을 300 ℃에서 헬륨 기류 하에서 1 h 동안 전처리하고 냉각하여 상온에서 암모니아를 2 h 동안 흡착 시킨 후 1 h 동안 헬륨 가스를 통과시켰다. 승온 조건은 10 ℃/min과 상온(∼820 ℃)이며 운반가스 유속은 30 mL/min였다. 탈착 암모니아 는 TCD로 검출하였다.
2.2.2. 질소 흡착
Micromeritics 사의 ASAP 2010을 사용하여 시료를 350 ℃에서 12 h 탈기처리한 후 액체질소 온도에서 흡탈착 등온선을 얻고 이로부터 비 표면적과 세공분포를 구하였다.
2.3. 분해 실험
60∼80 mesh 크기의 시료 250∼2000 mg을 고정층 연속흐름반응기에 넣고 50 mL/min의 질소 유량에서 반응온도를 300∼450 ℃까지 올린 후 여과지로 두 번 거른 디젤엔진용 폐윤활유를 주사기펌프를 이용하여 0.025 ∼0.15 mL/min 유량으로 반응기에 주입하여 촉매분해를 수행하 였다. 반응기 출구에 냉각트랩을 연결한 다음 일정한 시간 간격으로 분해오일 시료를 채취하였으며, 반응기의 출구로부터 검은색의 폐윤 활유가 유출되는 순간 분해 실험을 중지하였다. 폐윤활유의 분해로부 터 얻어진 오일의 수율은 냉각트랩에 채집된 오일 양을 공급된 폐윤 활유 양으로 나누어 구하였다. 분해오일에서 =<C 9 , C 10 -C 13 , C 14 -C 17 , C 18 -C 22 , C 23 -C 26 성분의 분율은 Shimadzu사의 GCMS-QP5050을 사용 하여 측정하였으며 컬럼은 Restek cat. #10255를 사용하였다. 성분 범 위의 구분을 위한 표준 물질은 Restek cat. #31064를 사용하였다.
3. 결과 및 고찰
3.1. 촉매활성 및 분해오일 분석
Figure 1 은 SA, HM, DM 촉매 상에서 반응시간에 따른 분해오일의
생성 수율을 나타낸 것이다. 세 시료 모두에서 반응 조건에 관계없이
수율이 급격히 증가하다가 5∼10 h 경과한 후부터 일정해지는 경향을
보여준다. 세 시료 모두에서 초기 활성이 낮게 나타나는 것은 불균일
촉매반응에서 흔히 나타나는 현상으로서, 촉매 활성점의 반응 분위기
에 대한 적응 및 안정화에 기인하는 것이다. Figure 2는 SA, HM, DM
시료 상에서 반응온도에 따른 촉매의 단위 질량당 분해오일의 생성량
을 나타낸 것이다. 반응 조건에 관계없이 촉매의 단위 질량당 분해능
322 황인혜⋅양현선⋅이종집⋅최고열⋅이창용
Figure 3. Chromatograms of oil obtained on SA, HM, and DM including gasoline and diesel. Reaction conditions : space velocity = 5.25 hr -1 at 450 ℃.
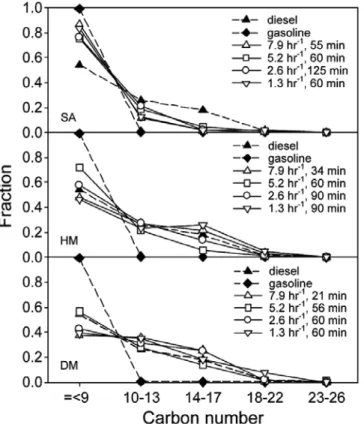
Figure 4. Carbon number distributions of oil on SA, HM, and DM including gasoline and diesel with reaction time. Reaction conditions : space velocity = 5.25 hr -1 at 450 ℃.
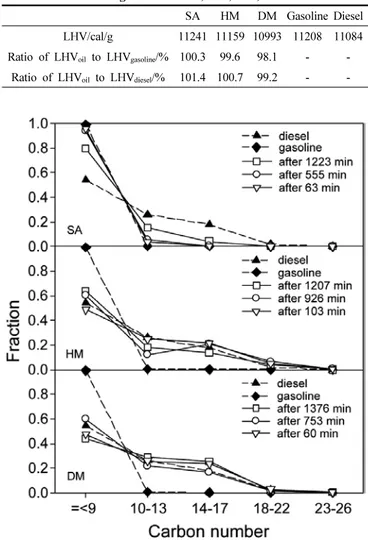
Table 1. Lower Heating Values of SA, HM, DM, Gasoline and Diesel SA HM DM Gasoline Diesel LHV/cal/g 11241 11159 10993 11208 11084 Ratio of LHV oil to LHV gasoline /% 100.3 99.6 98.1 - -
Ratio of LHV oil to LHV diesel /% 101.4 100.7 99.2 - -
은 SA 시료가 가장 우수하였다. HM과 DM 시료의 분해능은 1.31 hr -1 , 400 ℃에서는 SA 시료 대비 각각 41.3%와 43.3%로서 별 차이가 없었 지만, 5.25 hr -1 , 450 ℃에서는 각각 65.8%와 83.6%로서 DM 시료가 HM 시료보다 더 높았다.
Figure 3 은 SA, HM, DM 시료 상에서 폐윤활유로부터 얻은 분해오 일을 GC로 분석해서 얻은 크로마토그램을 휘발유와 경유에 대한 크 로마토그램과 함께 나타낸 것이다. 휘발유의 크로마토그램에서는 성 분물질의 특성피크 대부분은 보유시간 11 min 이내에 밀집되어 있지만, 경유의 경우 성분물질의 특성피크는 대부분 보유시간 4∼43 min 사이 에 넓게 분포되었음을 볼 수 있다. 일반적으로 탄소수가 큰 물질일수 록 보유시간도 길어진다. 정상비점이 40∼200 ℃인 휘발유는 탄소수 5∼12개의 탄화수소 혼합물이지만, 경유는 비점이 200∼350 ℃이고 성분의 탄소수는 12∼21개이다. Figure 3에서 SA 시료 상에서 얻어진 분해오일에 대한 크로마토그램을 보면 마치 휘발유와 경유를 혼합한 듯한 크로마토그램을 보여주는데, 이는 성분물질의 탄소수 범위가 비
교적 넓음을 의미한다. 반면 모더나이트 시료 상에서 얻어진 분해오 일에 대한 크로마토그램에서는 보유시간 10 min 이하의 특성피크가 적게 나타난다. HM과 DM 시료를 비교하면 DM 시료 상에서 얻어진 분해오일에서 보유시간 25 min 이상의 특성피크가 크게 나타난다. 이는 탄소수가 큰 성분 물질이 HM 시료에 비하여 DM 시료 상에서 얻어진 분해오일에 더 많음을 의미한다.
Figures 4∼6은 각각 반응시간, 반응온도, 공간속도에 따른 SA, HM, DM 시료 상에서 폐윤활유로부터 얻어진 분해오일을 탄소수 9개 이하, 10∼13, 14∼17, 18∼22, 23개 이상의 분율로 표시한 것이다.
분해오일 성분의 탄소수는 GC/MS로 분석하여 파라핀계, 올레핀계,
나프텐계, 아로마틱계 등의 구별은 하지 않고 단지 탄소수로만 성분
을 분류하였다. Figure 4를 보면, SA 시료 상에서 얻어진 분해오일 성
분의 탄소수 분포는 반응 시간에 관계없이 휘발유에 가까운 탄소수
분포를 나타낸다. 반면 모더나이트 시료 상에서 얻어진 분해오일 성
분의 탄소수 분포는 휘발유보다는 경유의 탄소수 분포와 비슷하며,
DM 시료의 경우 좀 더 유사하다. Figures 5와 6에서도 각각 반응온도
와 공간속도에 상관없이 SA 시료의 경우 경유보다는 휘발유에 가까
운 탄소수 분포를 나타낸다. HM 시료의 경우에는 휘발유보다는 경유
에 가까운 탄소수 분포를 보여주며, DM 시료의 경우 경유와 유사한
Figure 5. Carbon number distributions of oil on SA, HM, and DM including gasoline and diesel with reaction temperature. Reaction conditions : space velocity = 5.25 hr -1 .
Figure 6. Carbon number distributions of oil on SA, HM, and DM including gasoline and diesel with space velocity. Reaction conditions : at 400 ℃.
Figure 7. NH 3 -TPD curves of fresh SA, HM, and DM.
탄소수 분포를 보여준다. Table 1에 SA, HM, DM 시료 상에서 폐윤활 유로부터 얻어진 분해오일의 저위발열량(LHV)을 휘발유와 경유와 함 께 측정하여 나타내었다. SA 시료의 LHV는 휘발유에 가깝고 DM 시 료의 LHV는 경유에 가깝다. HM 시료는 휘발유와 경유의 중간 정도 의 LHV를 나타낸다고 볼 수 있다. 이러한 결과는 앞서 GC/MS 분석 결과와 유사하다고 볼 수 있다.
3.2. 산 및 세공 특성분석
SA, HM, DM 시료의 산 특성과 세공 특성을 알아보기 위해 NH 3 - TPD 와 질소흡착을 행하였다. Figure 7에 SA, HM, DM 시료의 NH 3 - TPD 커브를 나타내었다. SA 시료는 327 ℃와 567 ℃ 피크를 포함한 여러 개의 피크가 혼재되어 있는 커브를 보여준다. 실리카‐알루미나의 산 특성은 시료의 SiO 2 /Al 2 O 3 비가 높아질수록 시료의 산량은 줄어 드는 대신 산의 세기는 커진다[12-13]. 수소형 모더나이트는 강산점과 약산점이 뚜렷하게 구별되는데[14], Figure 7에서 HM 시료에서는 305 ℃와 670 ℃, DM 시료에서는 320 ℃와 668 ℃에서 구별되는 두 개의 피크를 볼 수 있다. NH 3 -TPD 커브로부터 산량은 SA 시료 (SiO 2 /Al 2 O 3 = 10.5) 와 HM 시료(SiO 2 /Al 2 O 3 = 10) 가 비슷하고, DM 시료 (SiO 2 /Al 2 O 3 = 12.5) 는 HM 시료 대비 약 75%를 나타낸다.
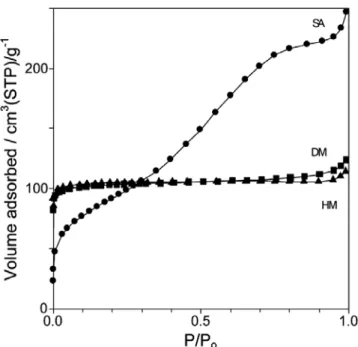
Figure 8은 SA, HM, DM 시료의 질소흡착 등온선을 표시한 것이다.
세공 구조에 따라 등온선의 형태가 다르게 나타나는데, 비정질인 SA
시료는 type II와 유사한 등온선을 보여준다. 흡탈착 등온선으로부터
구한 SA 시료의 평균 세공크기는 18.5 Å이었다. 분자 크기의 균일한
세공 구조로 이뤄져있는 제올라이트는 주로 결정체 내에서 흡착이 지
배하므로 type I 등온선을 나타내는데, Figure 8에서 HM 시료는 완벽
한 type I 등온선을 보여준다. 모더나이트의 세공 구조는 c축에 수직
한 타원형의 12환으로 이루어진 주로와 이와 연결되어 있는 b축에
수직한 8환으로 이루어진 측로로 되어 있는 2차원적 구조이며 공동은
없다. 수소형 모더나이트에서 c축에 평행한 주세공의 크기는 8.2∼8.6 Å
이다[15]. 반면 DM 시료의 경우 상대압 0.7 이상에서 흡착량이 증가
하여 type II로 약간 변형된 등온선을 보여주는데, 이는 탈알루미늄이
324 황인혜⋅양현선⋅이종집⋅최고열⋅이창용
Figure 8. Adsorption isotherms of nitrogen at 78 K on fresh SA, HM, and DM.
Table 2. Amount of Oil Obtained on SA, HM, DM, NaM, and γ-alumina at 400 ℃ and Space Velocity = 2.62 hr -1
SA HM DM NaM γ-alumina
Amount/g/g-cat 12.14 5.31 10.16 0.91 7.15 Ratio of amount 1.00 0.44 0.84 0.07 0.59
Table 3. BET Areas of SA, HM, and DM
SA HM DM
Fresh/m 2 /g 329 432 414
Used/m 2 /g 262 197 222
Decrement/% 20.4 54.4 46.4
모더나이트의 세공 입구에서부터 내부로 진행되면서 세공이 점차적 으로 확대되기[16] 때문이다.
3.3. 분해특성 고찰
탄화수소의 촉매분해는 촉매의 산 특성과 밀접한 관련을 가진다[10-12].
Table 2는 SA, HM, DM 시료와 NaM 및 γ-alumina 시료의 400 ℃에 서의 단위 질량당 분해오일의 생성량을 비교한 것이다. 산성을 가지 는 γ-alumina 시료는 SA 시료 대비 60% 정도의 분해능을 보이지만, 산성을 띠지 않는 NaM 시료는 SA 시료 대비 7%에 불과하다. 따라서 앞서 Figures 4∼6의 GC/MS 분석 결과에서 보여준 바와 같이 SA, DM, HM 시료 상에서 얻어진 분해오일이 각각 휘발유, 경유 그리고 휘발유와 경유의 중간 정도와 비슷한 탄소수 분포를 나타내는 것은 이들 시료가 가지는 산량과 관련된 것으로 판단된다. 또한 제올라이 트의 경우에는 분자 크기의 미세 기공을 가지므로 산량 이외 세공 특 성에 기인한 폐윤활유 분자의 확산이 촉매분해에 영향을 줄 수 있다.
이에 따라 세공의 영향이 비교적 크지 않으면서 산량이 많은 SA 시료 상에서는 폐윤활유의 분해가 활발히 이루어져 분해오일의 탄소수 분 포가 휘발유에 가까워진다고 볼 수 있다. 반면 HM 시료의 산량은 SA 시료와 비슷하지만, 폐윤활유 분자와 원활히 접촉할 수 있는 산점의 양은 HM 시료가 상대적으로 적기 때문에 HM 시료상에서 얻어진 분 해오일의 탄소수 분포는 휘발유에 미치지 못한다고 설명할 수 있다.
DM 시료의 경우에는 산량이 적고 아울러 세공의 영향도 받기 때문에 분해오일의 경유와 비슷한 탄소수 분포에 그친다고 볼 수 있다.
한편, Figure 2에서 보여준 SA, HM, DM 시료의 폐윤활유 분해능은 시료의 활성저하와 직접적인 관련을 갖는다. 고체산 촉매상에서 폐윤 활유가 분해될 때, 촉매 표면에 탄소 및 불순물이 침적함으로써 촉매 의 활성저하가 발생한다. 촉매분해 과정에서 침적체에 의해 촉매 세 공이 폐색되면 폐윤활유 분자와 접촉할 수 있는 산점이 감소하게 되고, 결국 촉매는 활성을 잃게 된다. Table 3에 Figure 2에서 사용된 SA, HM, DM 시료의 비표면적과 분해활성을 상실한 폐시료의 비표면적 을 비교하였다. SA 폐시료의 표면적 감소는 20% 정도인 반면 HM과
DM 폐시료의 표면적 감소는 각각 54%와 46%에 이른다. SA 시료는 10 ∼50 Å의 넓은 세공경 분포를 가지기 때문에 침적 표면이 넓고 침 적이 골고루 이루어져 폐시료의 표면적 감소는 크지 않다고 볼 수 있 다. 반면 HM과 DM 시료의 경우에는, 10 Å 이하의 균일한 세공 구조 이기 때문에 침적체는 주로 결정 외표면과 세공 입구에 쌓일 것으로 생각되며 그 결과 폐시료의 표면적 감소가 크게 나타난다고 생각된다.
이러한 시료 표면에서의 탄소 및 불순물의 침적 형태의 차이는 폐촉 매의 재생 시 우선적으로 고려해야 할 요소라고 판단된다.
4. 결 론
상용 실리카-알루미나와 Na형 모더나이트로부터 제조한 수소형 및 탈알루미늄 모더나이트를 이용하여 폐윤활유의 촉매분해를 실시하고 다음과 같은 결론을 얻었다. 촉매의 분해능은 SA 시료가 상대적으로 가장 우수하였고 DM 시료와 HM 시료 순이었다. 분해오일 성분의 탄소수 분포는 반응시간, 반응온도, 공간속도와 관계없이 SA 시료의 경우 휘발유와 비슷하였고 HM 시료의 경우 휘발유와 경유의 중간 정도 그리고 DM 시료의 경우에는 경유와 비슷하였다. 고체 산량은 SA 시료와 HM 시료는 비슷하였고 DM 시료가 상대적으로 가장 적었 다. 10 Å 이하의 균일 세공만을 가지는 HM과 DM 시료와는 달리, SA 시료는 10∼50 Å의 이하의 넓은 세공경 분포를 나타내었다. 이와 같은 시료의 산량과 세공 구조가 분해오일의 성분 차이에 직접적으로 작용 한다고 판단된다. 촉매의 활성저하의 원인인 탄소 및 불순물의 침적 에 기인한 폐촉매의 표면적 감소는 HM 시료가 54%로써 가장 크고 DM 시료는 46% 그리고 SA 시료는 20%로써 가장 적었다. SA 시료 에서는 세공 전체에 골고루 침적이 이루어지며 HM과 DM 시료에서 는 결정 외표면과 세공 입구에 침적이 이루어질 것으로 판단된다.
참 고 문 헌