427
Nuclear Factor I-C 과발현과 발현억제가 MDPC-23 상아모세포주의 상아질 기질유전자 발현에 미치는 영향
배현숙 † ·조영식
남서울대학교 치위생학과
The Effect of Over-expression and Inactivation of Nuclear Factor I-C on the Dentin Matrix Gene Expression of MDPC-23 Odontoblasts
Hyun-Sook Bae
†and Young-Sik Cho
Department of Dental Hygiene, Namseoul University, Cheonan 331-707, Korea
Abstract Nuclear factor I-C (NFI-C) null mice demonstrated aberrant odontoblast differentiation and abnormal dentin formation. In order to elucidate the mechanisms responsible for these changes, we evaluated the expression of dentin matrix gene after over-expression and inactivation of NFI-C in MDPC-23 cells by reverse transcription-polymerase chain reaction (RT-PCR) analysis. Collagen type I (Col I), osteocalcin (OC), and dentin sialophosphoprotein (DSPP) expression was decreased after inactivation of NFI-C. However, bone sialoprotein (BSP) expression was dramatically increased after inactivation of NFI-C. ALP and DMP4 expression was not changed after inactivation of NFI-C. The expression of alkaline phosphatase (ALP) and dentin matrix protein 4 (DMP4) was increased after over-expression of NFI-C, while Col I, OC, DSPP, and BSP expression was decreased. These findings suggest that odontoblasts after loss of NFI-C lost the phenotype of odontoblasts and acquired those of osteoblasts.
Key words NFI-C, Odontoblast, Over-expression, Inactivation, Gene expression
서 론
치아는 많은부분을차지하는상아질
,
치관부위의상아 질을 덮는 법랑질,
치근부위의 상아질을 덮고 있는 무기물질과
,
소성결합조직으로이루어진치수복합체로구성되 어있다.
치아의발생은치아상피(dental epithelium)
와신 경능선(neural crest)
유래의 외배엽성간엽세포(ectomesen- chymal cell)
사이의 상호작용을 통해 이루어지는 복잡하 지만 잘 조화를 이루어야 하는 과정이다1-4).
치아상피는외치아상피
(outer dental epithelium)
와 내치아상피(inner dental epithelium)
로나뉜 후 내치아상피가법랑모세포로분화하는 반면에
,
외배엽성간엽세포는 치아유두(dental papilla)
를 형성한 후 전상아모세포(preodontoblast)
단계를거쳐상아모세포로분화한다5)
.
상아모세포와법랑모세포에의한치관의형성이끝난직후내치아상피와외치아 상피 두층으로 이루어진
Hertwig
상피근초(Hertwig’s epithelial root sheath)
가 치근을 따라서 미분화 외배엽성간엽세포인 치아유두 세포로부터 상아모세포의 분화를 유도하여치근상아질을형성한다6)
.
상아모세포는유기기질을합성분비하고이어서무기질 을 침착하는 방법으로 상아질을 형성하며
,
이 과정에서세포질돌기를포함하는상아세관이만들어진다7)
.
상아질 의유기기질은대부분이I
형아교질(type I collagen)
로구 성되어 있으며,
이 아교질들 사이의 공간을 소량의 비아교질성 기질단백질
(noncollagenous matrix protein)
이 채 우고 있다.
비아교질성 기질단백질은 그 양은 적으나상아질의 특성을 결정하거나 상아모세포의 분화를 조절하 는 등의 중요한 역할을 하는 것으로 알려지고 있다8)
.
상아모세포 분화과정에서 전상아모세포는비아교질성 기질 단백질인
I
형 아교질과알칼리성인산분해효소(ALP)
및osteocalcin (OC)
을발현한다.
반면에,
분화한상아모세포는 전상아모세포가 발현하는 것들 이외에
dentin- sialophosphoprotein (DSPP), dentin matrix protein 1 (DMP1), DMP2, DMP4, bone sialoprotein (BSP), matrix extracellular phosphorylated protein (MEPE)
및osteopontin (OPN)
을 합성 분비한다9,10).
그러나 아직까지 상아모세포 의 분화과정이나 상아질 기질단백질의 발현을 조절하는†
Corresponding author Tel: 010-3616-5374 Fax: 041-580-2927
E-mail: clearbae@paran.com
인자에관하여는잘알려져있지않다
.
Nuclear factor I (NFI)
계 전사인자들은 처음에는 시험 관에서adenovirus
의DNA
복제에필요한단백질로 발견되었으나
,
최근에는 이들이다양한기관들의발생에필수적인 인자들로 작용하는 것으로 알려지고 있다11-14)
. NFI
유전자계는 척추동물에서는
NFI-A, NFI-B, NFI-C
및NFI-X
의네가지유전자들로이루어져있으나, Drosophila melanoster와 Caenorhabditis elegans
에서는 하나의 NFI
유전자로 구성되어 있다15-17)
.
반면에 단세포 기관에서는NFI
유전자가 없다18).
생쥐에서NFI-A
유전자가 없으면뇌의발생에이상이생기며19)
, NFI-B
유전자가없으면폐 의성숙과뇌발생의이상이초래된다20). NFI-X
유전자가없는생쥐는뇌와골격계의발생의이상이초래된다21)
. Steele-Perkins
등22)은NFI-C
유전자가 없으면 구치는 치관부는 정상이지만 치근이 짧거나 비정상적으로 형성 되고,
전치부도부러지기쉽게변형되거나이상이발생한다고하여
NFI-C
가치근 상아질형성과정 즉상아모세포의분화과정에서중요한역할을함을시사하였다
.
최근에Lee
등23)은NFI-C
결손생쥐의비정상적인상아모세포는뼈의 특성을나타내는
BSP promoter
의 활성이 증가한다고하여
NFI-C
에 의한상아질기질단백질의발현조절 가능성을시사하였다
.
본 연구는 상아모세포의 분화와 상아질 형성과정에서
필수적인 인자로 알려진
NFI-C
에 의한 상아모세포 기질단백질의발현조절을알아보기위하여
, MDPC-23
상아모세포주24)에
NFI-C
유전자를 주입하여 과발현시키거나RNA interference
기법으로NFI-C
의 발현을 억제시킨 후 상아질기질단백질유전자들의발현을reverse transcription- polymerase chain reaction (RT-PCR)
기법으로 분석하였 다.
재료 및 방법
1. 세포배양 및 Transfection
상아모세포주인
MDPC-23
을60 mm dish
에2.5×
10
5cells
의 밀도로seeding, 10% Fetal Bovine Serum (FBS, Gibco BRL, Rockville, MD, USA)
과 항생제(Penicillin 100 U/ml, Streptomycin 100
µg/ml, Gentamycin 50
µg/ml
및fungizone 2.5
µg/ml)
가 함유된Dulbecco’s Modified Eagles Medium(DMEM, Gibco BRL, Rockville, MD, USA)
에서하루동안배양하였다.
세포가세포배양기 에서60~70%
정도증식한 것을확인한 후Lipofectamine reagent
와plus reagent (Gibco BRL, Rockville, MD, USA)
에control vector (pLKO.1 control)
와RNAi NFIC plasmid (pLKO.1-NFIC shRNA)
그리고NFIC over (pCH-NFI-C)
을 각각 혼합한 다음Opti-MEM (Gibco BRL, Rockville, MD, USA)
을 넣고5% CO
2, 37
oC,
100%
습도 상태의 세포 배양기에서5~6
시간 동안 배양한 후
10% FBS,
항생제가 포함된DMEM
배양액에서3
일간배양하였다
.
2. Confocal Microscopy
MDPC-23
세포를cover slip
에서50~60%
세포증식 상 태가 되도록 배양한 후Lipofectamine reagent
와plus reagent (Gibco BRL, Rockville, USA)
에control vector (pLKO.1 control)
와RNAi NFIC plasmid (pLKO.1-NFIC shRNA)
그리고NFIC over (pCH-NFI-C)
유전자를transfection
하였다. 72
시간후배양액을제거하고phosphate buffered saline (PBS)
으로3
회 세척한 다음4% parafor- maldehyde
로20
분간고정하고다시PBS
로10
분간3
회세척하였다
.
일차항체는rabbit polyclonal anti-NFIC (1:100 dilution)
항체를 사용하여 실온에서1
시간동안 처리하였 다. PBS
로10
분간3
회 세척후이차항체로서goat anti- rabbit IgG-FITC (Invitrogen, Rockville, MD, USA)
를실 온에서45
분 동안 처리하고PBS
로10
분간3
회 세척하였다
. 4',6-Diamidino-2-phenylindole (DAPI, Sigma-Aldrich, St. Louis, MO, USA)
를사용하여대조염색하였다. PBS
로10
분간3
회 세척 후 형광성 봉입제로 봉입하여confocal microscope (F300, Olympus, Japan)
으로관찰하였다. 3. Total RNA 추출 및 RT-PCR 분석
Total RNA
는 각각의 유전자를transfection
한MDPC- 23
세포에서Trizol reagent (Gibco BRL, Rockville, MD, USA)
를 이용하여 추출하였다.
추출된total RNA 5
µg Superscript one-step reverse transcriptase-polymerase chain reaction (RT-PCR) (Invitrogen, Carlsbad, CA, USA)
을 이용하여cDNA
를 합성하였고,
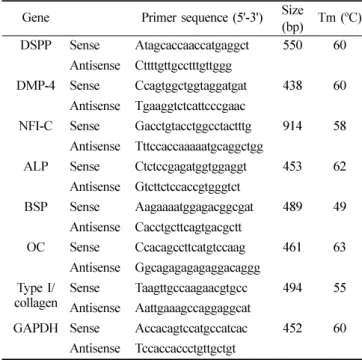
유전자 특이적Table 1. Nucleotide sequences of the primers used for RT-PCR Gene Primer sequence (5'-3') Size (bp) Tm (
oC) DSPP Sense Atagcaccaaccatgaggct 550 60
Antisense Cttttgttgcctttgttggg
DMP-4 Sense Ccagtggctggtaggatgat 438 60 Antisense Tgaaggtctcattcccgaac
NFI-C Sense Gacctgtacctggcctactttg 914 58 Antisense Tttccaccaaaaatgcaggctgg
ALP Sense Ctctccgagatggtggaggt 453 62 Antisense Gtcttctccaccgtgggtct
BSP Sense Aagaaaatggagacggcgat 489 49 Antisense Cacctgcttcagtgacgctt
OC Sense Ccacagccttcatgtccaag 461 63 Antisense Ggcagagagagaggacaggg
Type I/
collagen Sense Taagttgccaagaacgtgcc 494 55 Antisense Aattgaaagccaggaggcat
GAPDH Sense Accacagtccatgccatcac 452 60
Antisense Tccaccaccctgttgctgt
primer (Table 1)
를이용하여94
oC:30s, 58
oC:30s, 72
oC:45s
에서
32 cycle
의 조건으로PCR
을수행하였다. PCR
생성물은
1.2%
아가로스 겔에 전기 영동하여 유전자발현을확인하였다
.
4. Densitometery 분석
RT-PCR
을 수행한 각 유전자의densitometry
분석은Gel-Doc system (Bio-rad laboratory, Inc. CA, USA)
의differential analysis
프로그램을 사용하여각 분석하였고,
그결과는
GAPDH
로표준화하였다.
결 과
1. NFI-C 발현억제와 과발현에 따른 MDPC-23 세
포의 형태학적 변화와 NFI-C 단백질의 발현 변화
대조군의
MDPC-23
상아모세포는confluence
상태에서 다각형 모양으로 섬유모세포와 유사한 형태학적 소견을 보였다(Fig. 1A). NFI-C
발현이억제된MDPC-23
세포 는 대조군에 비하여둥근 형태를나타냈다(Fig. 1B).
반면에
, NFI-C
가 과발현된MDPC-23
세포는 세포의 모양 이원주형형태로변화하였으며,
세포질에수지상돌기를나타내는세포도상당수관찰되었다
(Fig. 1C).
대조군의
MDPC-23
세포는세포의핵과세포질에과립모양의
NFI-C
단백질의 발현되었으나(Fig. 1D), NFI-C
발현이억제된
MDPC-23
세포에서는NFI-C
단백질의발 현이 현저히 감소되었다(Fig. 1E). NFI-C
가 과발현된MDPC-23
세포는NFI-C
단백질이 세포질에서 전체적으 로관찰되었으며,
핵에서도대조군에비하여NFI-C
단백질의발현이더욱뚜렷이관찰되었다
(Fig. 1F).
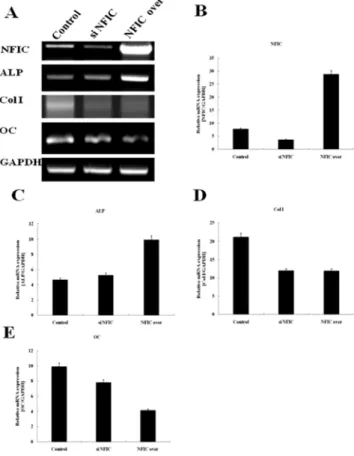
2. NFI-C 발현억제와 과발현에 따른 제 I 형교원질 , ALP, 및 OC 상아질 기질 유전자의 발현
MDPC-23
세포에RNAi NFI-C plasmid (pLKO.1- NFI-C shRNA)
와NFI-C over plasmid (pCH-NFI-C)
를transfection
한 후control vector (pLKO.1 control)
를transfection
한 대조군과NFI-C mRNA
의 발현을비교관찰한 결과
, NFI-C
발현 억제 후에는 대조군에 비하여NFI-C mRNA
의 발현이현저히 감소하였으나, NFI-C
과발현 후에는
NFI-C mRNA
의 발현이현저히증가하였다(Fig 2A, 2B). ALP mRNA
의 발현은NFI-C
발현 억제후에는대조군과비교하여별다른차이가없었으나
, NFI-
C
과발현한후에는현저히증가하였다(Figs. 2A, 2C).
반면에
, I
형collagen mRNA
는NFI-C
발현 억제와 과발현Fig. 1. Morphology and NFI-C protein localization after overexpression or inactivation of NFI-C.
The MDPC-23 cells cultured on coverslip were transfected with control vector, NFI-C over, and NFI-C RNAi plasmid.
(A, B, C) Photographs were taken with a light microscope. Bars
100 µ m.
(D, E, F) NFI-C protein localization was detected by immu- nostaining with confocal microscope after NFI-C overex- pression (NFI-C over) or inactivation (si NFI-C). Bars 20 µ m.
Fig. 2. Expression of dentin matrix genes representing differentiating odontoblasts analyzed by RT-PCR.
The MDPC-23 cells cultured plated on 60 mm culture dishes at a density of 2.5×10
5cells, and were transfected with control vector, NFI-C over (NFIC over), and NFI-C RNAi plasmid (si NFIC). The cells were allowed to grow in the appropriate medium for 3 days, and RT-PCR analysis was performed.
(A) Electrophoresis of RT-PCR products.
(B) Expression of NFI-C mRNA expression after overexpression or inactivation of NFI-C.
(C) Expression of ALP mRNA expression after overexpression or inactivation of NFI-C.
(D) Expression of type I collagen (Col I) mRNA expression after overexpression or inactivation of NFI-C.
(E) Expression of OC mRNA expression after overexpression
or inactivation of NFI-C.
후에대조군에비하여현저히감소하였다
(Figs. 2A, 2D).
OC mRNA
는NFI-C
발현억제와 과발현 후에 대조군에비하여 감소하였는데
,
발현억제보다 과발현후에 그 발 현이훨씬더감소하였다(Figs. 2A, 2E).
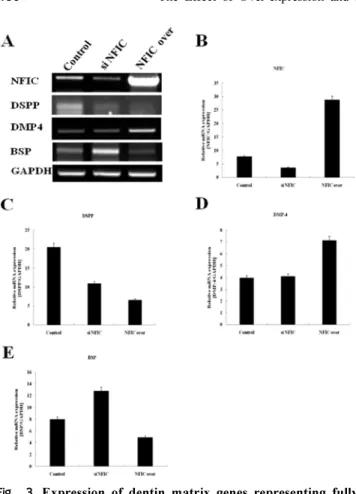
3. NFI-C 발현억제와 과발현에 따른 DSPP, DMP-4,
및 BSP 상아질 기질 유전자의 발현
NFI-C mRNA
의 발현은NFI-C
발현억제 후에는 대조군에비하여감소하였으나
, NFI-C
과발현후에는현저히 증가하였다(Figs. 3A, 3B). DSPP mRNA
는대조군에비 하여NFI-C
발현억제와과발현 후에감소하였는데,
과발현후에그 발현이더감소하였다
(Figs. 3A, 3C). DMP- 4 mRNA
의발현은NFI-C
발현억제후에는대조군과비교하여차이가 없었으나
, NFI-C
과발현에 의하여현저히증가하였다
(Figs. 3A, 3D). BSP mRNA
는 대조군에 비하여
NFI-C
발현 억제 후에는 현저히 증가하였으나,
NFI-C
과발현후에는다소감소하였다(Figs. 3A, 3E).
고 찰
외배엽성간엽세포로부터 전상아모세포
(preodontoblast)
를거쳐상아모세포가분화하는데에는전법랑모세포
(preame- loblast)
의 존재가 필수적이다3).
외배엽성간엽세포가 전상아모세포로 분화하면 세포가 길어지고
,
세포가 기저부에 위치하며,
극성을 띄게 되고,
골지체(Golgi complex)
가핵 위에 위치하며
,
조면내형질세망(rER)
이 세포의 가장 자리에 위치하게 된다.
전상아모세포가 상아모세포로 분 화하면 상아모세포의 원심측에 부착 결합(adherent junction)
이나 치밀 결합(tight junction)
과 같은 세포간 결합장치(intercellular junctional complex)
가 발달하게된다25)
.
본 실험에서 사용한MDPC-23
세포주는Hank
등24)이
CD-1
흰쥐대구치의치아유두세포를불멸화하여만든세포주로
, Sun
26)등은분화배지에서배양하면세포들 이분화하여상아모세포의특성을나타낸다고하였다.
상아모세포의 분화 관련인자인
NFI-C
의 결손은 생쥐상아질 형성과정에서 상아모세포를 비정상적으로 분화시 키고뼈의특성이강한골양상아질을형성을통하여치근
형성의 장애를초래하는 것으로알려지고 있다27,28)
. Park
등29)은
NFI-C
결손 생쥐의 상아모세포는 형태학적으로세포극성과방향성을상실한비정상적인세포로그결과 비정상적인 상아질을 형성한다고 하였으며
, Lee
등30)은NFI-C
결손생쥐구치의치근과전치부설측면에서 극성이 상실되고둥근 형태의 비정상적인 상아모세포들이세 포사이 결합장치가 상실되면서 결과적으로 상아모세포 돌기와 상아세관이 없는 비정상적인 상아질을 형성한다 고 하였다
.
이러한 결과는NFI-C
의 결손에 의하여 상아모세포의 표현형에 변화가생기는 것을 의미하는 것이어
서
, NFI-C
와 상아질의 특성을결정하는상아질기질단백질의연관성에대한연구가필요하다
.
Dentin sialophosphoprotein (DSPP)
은 비교원질성 단백질에속하는대표적인상아질
-
특이 단백질로하나의유전 자로부터dentin sialoprotein (DSP)
과dentin phosphoprotein (DPP)
그리고dentin glycoprotein (DGP)
의 세가지 단백 질을 합성하며 상아질의 석회화 과정에서중요한 역할을하는것으로알려져있다31,32)
. DPP
는DSPP
의C-terminal
단백분해산물이며
, DSP
는N-terminal
단백분해산물이고DGP
는 이 분자의 가운데에존재한다. Bone sialoprotein
(BSP)
유전자는 기본적으로 석회화결합조직에 제한적으로 발현되며
,
이는골,
치아,
백악질형성초기에높게나타난다
. BSP
는 세포부착을 중재할 수 있는 단백질로서세포의 기질에 축적되며
,
수산화인회석 결정을 유핵화한Fig. 3. Expression of dentin matrix genes representing fully differentiated odontoblasts analyzed by RT-PCR.
The MDPC-23 cells cultured plated on 60 mm culture dishes at a density of 2.5×10
5cells, and were transfected with control vector, NFI-C over (NFIC over), and NFI-C RNAi plasmid (si NFIC). The cells were allowed to grow in the appropriate medium for 3 days, and RT-PCR analysis was performed.
(A) Electrophoresis of RT-PCR products.
(B) Expression of NFI-C mRNA expression after overexpression or inactivation of NFI-C.
(C) Expression of DSPP mRNA expression after overexpression or inactivation of NFI-C.
(D) Expression of DMP-4 mRNA expression after overex- pression or inactivation of NFI-C.
(E) Expression of BSP mRNA expression after overexpression
or inactivation of NFI-C.
다32,33)
. DSPP
와 다르게BSP
는 골의석회화 과정에관여하는인자로알려져있어34)
, BSP
와DSPP
가상아질과 골 을 구분하는 실험에 많이 이용된다.
최근에Lee
등23)은MDPC-23
세포에서NFI-C
가 발현억제 되거나 과발현되 면DSPP promoter
활성이감소하는데,
그감소는과발현 때에 더욱 현저하다고 하였다.
반면에, BSP promoter
의활성은
NFI-C
가 발현억제 되면 증가하였지만, NFI-C
가 과발현되면감소한다고하였다.
본연구에서는상아질과뼈의특이인자들로알려진
DSPP
와BSP
유전자의promoter
활성이
NFI-C
에 의하여 조절되는 것, mRNA
발현과의상관성및상아질에존재하는 다른다양한기질유전자발
현의
NFI-C
의 조절 등을 알아보고자 하였다. DSPP
mRNA
의 발현은NFI-C
의 발현이억제되거나 과발현 되면감소하였고
, BSP mRNA
의발현은NFI-C
가 발현억제 되면증가하였지만NFI-C
가 과발현되면감소하였다.
이는
Jung
등35)의DSPP
와BSP promoter
활성도 및mRNA
발현연구 결과와 일치한다. Bae
등36)도MDPC- 23
세포에NFI-C
를 발현억제 시킨3
일 후에는BSP mRNA
의 발현이 확인된다고 하였다.
이와 같은 연구 결과들은 흰쥐
BSP
유전자의promoter
에NFI-C binding site
와TGF-
βresponsive element
가 동일한 부위에 존재해서서로중첩
(overlap)
되어있다는사실과도관련이있다33,37)
.
결과적으로NFI-C
가 존재할 때는NFI-C
가BSP
promoter
에 결합하여TGF-
β 의한BSP promoter
의 활성 을 억제하지만, NFI-C
가 없을 때에는TGF-
β, BSP
promoter
의 활성을 촉진하는 것으로 볼 수 있다.
Thyagarajan
등38)은TGF-
β1
을과발현시킨형질전환생쥐 는상아모세포가세포극성이상실되며,
골양상아질과유사한 비정상적인 상아질에 세포가 함입되고
, DSPP mRNA
가 발현되지 않는다고 하였다.
이는NFI-C
결손 생쥐의 상아모세포의 변화와 형태학적으로 유사한 것으 로, TGF-
β1
과발현생쥐와NFI-C
결손 생쥐의상아모세 포들이골모세포와 유사한 세포로표현형의 변환이나타 날수있음을의미한다.
또한이연구결과는NFI-C
결손 으로초래된상아모세포의분화이상이다른유전자들즉TGF-
β1
과같은인자들에대한간접작용의결과에서기인 할수있음을시사한다.
그러나, NFI-C
발현억제와과발현에서
DSPP promoter
의활성이대조군에비하여감소한것 은BSP promoter
의NFI-C
와TGF-
β반응영역이 중첩된 것처럼DSPP promoter
도NFI-C
와TGF-
β 반응영역이 중첩된다는논리로는설명할 수없다.
따라서이에대하 여는 상아모세포의분화시기를 구분하여DSPP
와NFI-C
의 상호작용을 면밀히연구하는
NFI-C
에 의한DSPP
의 조절기전의보완연구가필요하다.
상아모세포의 분화과정에서
I
형 아교질과ALP
및OC
은 전상아모세포 단계에서발현되는초기 분화 표지자이 다5)
.
일반적으로비아교성기질단백질은촉진자나억제제 혹은안정제로서무기질침착을조절하는데,
분포에따라각기 기능이 다르다
. I
형 아교질은 원섬유(fibrils)
사이의작은 구멍속에무기질의 많은부분
(
약56%)
을수용하는 뼈대로서 작용한다9).
알칼리성인산분해효소(ALP)
의 활성은 모든 무기질 침착 조직의 형성과 관련이 있다
.
이 효소는 모든 경조직에서 분포 양상이 유사하여,
혈관과 경조직 형성 세포의 세포막에 분포하며,
알칼리성pH
에서 유기기로부터 인산이온을 가수분해하는 기능을 갖고 있는것으로잘알려져있지만무기질침착에서구체적으 로 어떤 역할을 하는지에 관하여는확실치 않다8)
. OC
은 골모세포,
상아모세포,
백악모세포의 성숙도,
분화정도에대한지표가되며
,
무기질침착의정도를조절하는유전자 이다39).
본연구에서는I
형 아교질과OC
의발현은NFI-C
발현억제나 과발현에의하여모두감소하였다
.
이와 관련 하여Miyazaki
등40)은Runx2
과발현형질전환생쥐는상 아모세포의 분화에 이상이 초래되어 상아모세포가 골모 세포와 유사한 형태로 바뀌고 골양상아질을 형성한다고 하였으며,
이 과정에서I
형 아교질과OC
의 발현은 현저히 감소한다고하였다
.
이와같은기질단백질유전자들의 발현 변화는NFI-C
의 결손과Runx2
과발현이 상아모세포의 표현형을 상아모세포에서 골모세포와 유사한 세포 로 변화 시키면서나타난결과에서 기인한것으로볼 수 있다
.
DMP-4
는DSPP
와상아모세포분화과정에서 분화한상아모세포에서 발현되는 인자로 알려져 있다
. DMP-4
는 칼슘결합영역을 포함하고 있는 상아질 기질단백질로 법 랑모세포나 골모세포에서는 약하게 발현되지만 상아모세 포에서는 강하게 발현되며,
미분화간엽세포를 상아모세 포양 세포로 분화 시킬 수 있는 중요한 인자로 알려져 있다41).
본 연구에서NFI-C
과발현에 의하여DMP-4 mRNA
의 발현이 현저히 증가하였는데,
이는 앞으로 두 인자의 상호작용의 규명이 상아모세포의 분화와 상아질 형성 기전을이해하는 중요한연구 분야가될 수 있음을 시사한다.
본연구에서 상아모세포의분화과정에서
NFI-C
의 발현 억제나 과발현은 상아질에 특이적인 기질단백질 유전자 들의 발현을억제하고 골모세포의 특성을나타내는 기질 단백질유전자들의 발현을증진하였다.
이결과는NFI-C
전사인자의 이상이 생기면 상아모세포가 골모세포양 세
포로그표현형이 바뀌는것으로보아
NFI-C
가상아모세포의 분화와생리적인 상아질형성에 필수적인요소임을 나타내며
,
따라서 이 결과는 상아모세포의 분화유도인자 를동정하기위한연구에도응용될수있을것으로사료 된다.
요 약
본 연구는 상아모세포의 분화와 상아질 형성과정에서
필수적인 인자로알려진
NFI-C
가상아모세포기질단백질의발현에미치는영향을알아보기 위하여
, MDPC-23
상아모세포에
NFI-C
유전자를과발현시키거나발현억제시 킨 후 상아질 기질단백질 유전자들의 발현을RT-PCR
로분석한결과다음과같은결론을얻었다
.
1. MDPC-23
세포에서NFI-C mRNA
는NFI-C
과발현 후에 현저히 증가하였으며, NFI-C
발현억제 후에는감소하였다
.
2. NFI-C
가 과발현된MDPC-23
세포는NFI-C
단백질이핵과세포질에서뚜렷이관찰되었으나
, NFI-C
발 현이억제된MDPC-23
세포에서는NFI-C
단백질의발현이대조군에비하여현저히감소하였다
. 3. NFI-C
발현이억제된MDPC-23
세포는대조군에비하여
I
형 아교질, OC,
및DSPP mRNA
의발현은감 소하였으나BSP
의발현은증가하였다. ALP
와DMP4
의발현은
NFI-C
발현억제후에도변화가없었다. 4. NFI-C
가 과발현된MDPC-23
세포에서는ALP
와DMP4 mRNA
의발현은대조군에비하여증가하였으며
I
형 아교질, OC, DSPP,
및BSP
의 발현은 감소하 였다.
감사의 글
이 논문은
2008
년도 남서울대학교 연구비지원을 받아연구되었습니다