585
의의
Significance of Neuroendocrine Cell Differentiation in Specimens from Patients with Prostate Cancer
Chang Hoo Park, Chang Myeon Park, Han Kwon Kim, Kil Hyeon Gang1, Jae Seok Song2, Jong Yeon Park
From the Departments of Urology and 1Pathology, Gangneung Asan Hospital, College of Medicine, Ulsan University, 2Department of Preventive Medicine, College of Medicine, Kwandong University, Gangneung, Korea
Purpose: The neuroendocrine cell (NEC) is one of the constitutional cells found in the prostate gland; these cells secret neurotransmitters. These neuroendocrine products have been associated with prostate cancer progression. We evaluated the significance of neuroendocrine differentia- tion (NED) in radical prostatectomy specimens.
Materials and Methods: We studied 45 patients who underwent bilateral pelvic lymphadenectomy and radical prostatectomy. The patients were classified into three groups according to their pathological stage. Group A included cases with organ confined tumors, Group B local advanced tumors and Group C cases had any T stage and lymph node metastasis.
The cellular expression of chromogranin A in matched samples from the same patients was evaluated by immunohistochemical staining using commercially available monoclonal antibodies.
Results: Sixteen (35.6%) tumors had chromogranin A stained cells. Chro- mogranin A immunoreactivity was greatest in cases with lymph node involvement (75.0%) compared to those with primary prostate cancer (5.9%
in group A and 37.5% in group B). Pathologically advanced tumors or tumors with the highest histological grades were associated with increased NED. The median staining score was 0 in Group A, 0 in Group B and 1 in Group C. The logistic regression analysis the odds ratio for group C cases showed a relative risk of 32.07 (95% CI: 2.783-369.416) for NED compared to Group A. An increased prostate-specific antigen (PSA) and Gleason score were also associated with the NED.
Conclusions: The degree of NEC immunohistochemical staining using the chromogranin A monoclonal antibody was marginally useful for pre- dicting the outcome in prostate cancer patients after radical prostatectomy, especially in node positive patients. However, it is important to determine a therapeutic plan for patients with low PSA and internal organ metastasis.
(Korean J Urol 2008;49:585-591)
Key Words: Prostate cancer, Neuroendocrine differentiation, Prognosis
대한비뇨기과학회지 제 49 권 제 7 호 2008
울산대학교 의과대학 강릉아산병원
비뇨기과학교실, 1진단병리학교실,
2관동대학교 의과대학 예방학교실
박창후ㆍ박창면ㆍ김한권
강길현1ㆍ송재석2ㆍ박종연
접수일자:2008년 4월 7일 채택일자:2008년 5월 29일
교신저자: 박종연
울산대학교 의과대학 강릉아산병원 비뇨기과 강원도 강릉시 사천면 방동리 415
210-711
TEL: 033-610-3357 FAX: 033-641-8070 E-mail: jypark@gnah.co.kr 본 연구는 2007년 울산대학교 의과대학 교 수연구비지원에 의하여 작성되었음.
서 론
전립선특이항원 (prostate-specific antigen; PSA)은 전립선 암의 진단에 유용하게 이용되고 있지만 전립선암에 특이하
지는 않아 병의 진행, 호르몬요법 등 치료에 대한 효과 판 정, 치료 후 재발 등의 평가에 대해서는 유용하게 쓰이고 있다. 하지만 이것의 가치는 D2 병기나 종양의 용적에 비례 해서 PSA를 생산하지 않는 분화도가 나쁜 전립선암에서는 떨어진다. 현재 이들 환자의 질병 정도와 치료에 대한 반응
을 판단하고 또한 예후를 예측할 수 있는 적절한 종양 표지 자가 없는 실정이다. 또한 전립선암 자체의 생물학적 특성 이 다양한데, 그들 암의 특성에 대한 정보를 미리 알면 치료 계획을 정하고 예후를 알 수 있어 전립선암 치료에 매우 중요하다고 생각한다.
이에 전립선의 신경내분비세포 (neuroendocrine cell; NEC) 는 최근 예후와 치료적 의미에서 많은 관심이 증가하는 추 세에 있다. 이것은 상피세포와 기저세포 이외의 제3의 세포 로 명명하고 있으며 신체에 흩어져서 존재하는 amine pre- cursor uptake and decarboxylation (APUD) system으로 알려진 신경내분비 조절계의 일부분이다. 이 APUD system은 신체 의 어느 곳에나 있으며, 특히 소화기계, 폐, 갑상선, 췌장 등 에 많이 분포되어 있으며, chromogranin A, B, serotonin, secretogranin (chromogranin C), neuron-specific enolase (NSE), thyroid-stimulating hormone-like peptide, calcitonin, katacalcin, calcitonin gene-related peptide, parathyroid hormone-related protein, bombesin-like peptide, beta-human chrionic gonadotro- pin-like peptide 등 수많은 조절 물질들이 분비되어 lumec- rine, endocrine, paracrine, autocrine 등의 기전으로 성장인자 활성을 나타내는 것으로 알려져 있다.1 하지만 전립선암에 서 신경내분비세포의 분화 (neuroendocrine cell differentia- tion; NED)가 있는 경우 이들의 정확한 생물학적 특성 및 역할은 아직 규명되지 않았다.
NED는 거의 모든 전립선 선암의 경우에 부분적으로 존 재하는 것으로 알려져 있으나 세포의 수는 조직의 고정방 법, 사용된 항체의 종류와 사용방법, 검사한 조직 검체의 수 등의 요인에 의하여 다양하게 보고되어 실제 24-92%까지 보고되고 있다.2
전립선비대증과 전립선암에서의 NEC의 예후적 가치에 대해 상충되는 결과들이 보고되고 있다. Cohen 등3은 전립 선암에서 NED 정도가 독립적 예후인자이며 Gleason score 보다 더 정확하게 환자의 생존율을 예측할 수 있다고 보고 하였다. Krijnen 등4은 NED가 조기 호르몬 치료 실패와 연 관이 있고 이들 세포는 안드로젠에 비의존적이라고 하였 다. Ahlgren 등5은 술 전 신보조요법으로 호르몬 치료를 3개 월 시행한 군에서 NED가 증가하나 호르몬 치료의 효과와 는 상관이 없다고 하였다. Bostwick 등6은 림프절 양성인 환 자의 검체에서 양성전립선 상피나 초기 전립선암에서 보다 NED가 적어 이들 환자에서 예후를 예측하는 데에 유용하 지 못하다고 하였다.
이러한 상반된 보고들을 바탕으로, 본 연구에서는 술 전 진단 시 임상적으로 전립선에 국한되어 있을 것으로 판단 된 전립선암 환자에서 근치적 전립선적출술을 시행한 후 전립선 검체에서 chromogranin A 항체를 이용하여 NEC의
발현 정도를 정량화하여 이를 Gleason score, 진단 시 PSA, 병리적 병기, 생존율 등의 요인들과 비교하여 NED 정도가 이들 요인들과의 관계와 예후적 표지자로서의 의미를 규명 하고자 하였다.
대상 및 방법 1. 대상
1997년 1월 1일부터 2006년 12월 31일까지 본원에서 임 상적 병기가 전립선에 국한된 것으로 판단하여 근치적 전 립선적출술을 시행한 전립선암 검체 45개를 이용하였고 술 전 호르몬 치료를 받은 환자는 대상에서 제외하였다.
병리적 병기는 2002년 TNM 분류에 따랐고, 세포의 등급 은 1988년 WHO 등급체계를 따랐다. 혈청 PSA는 Tandem-R assay (Hybritech Beckman-Coulter Corp., San Diego, USA)를 이용하여 측정하였다.
모든 환자에서 병기 결정을 위한 검사를 시행하였고 수 술 시 림프절절제는 외장골정맥과 폐쇄신경 사이만을 시행 하는 제한적 골반림프절 절제술을 시행하였다. 동결 절편 에서 림프절 양성이라도 전립선적출술을 시행하고, 술 후 luteinizing hormone-releasing hormone (LHRH) agonist와 anti- androgen 복합요법을 시행하였다.
환자는 첫 2년까지는 3개월마다, 다음 2년은 6개월마다, 그 후는 1년마다 추적 관찰을 하였다. 추적 검사로는 신체 검사, 혈청 PSA 측정, 흉부 X-선 사진, 복부와 골반의 컴퓨 터단층촬영 등을 시행하였고, 골주사 스캔 검사는 1년마다 혹은 임상적으로 의심이 될 때 시행하였다. 병의 진행은 술 후 PSA 수치가 2주 간격으로 두 번 이상 연속으로 0.4ng/ml 이상인 경우인 경우, 조직검사에서 양성으로 판정된 경우, X-선 검사나 컴퓨터단층촬영, 골 주사 검사에서 새로운 병 변이 나타날 경우 등으로 정의하였다.
환자의 그룹은 다음과 같다.
1) Group A: 종양세포가 전립선에 국한된 경우, pT2a, b, cN0M0
2) Group B: 종양세포가 전립선 피막이나 정낭을 침범한 경우, pT3a, bN0M0
3) Group C: 골반 림프절 전이가 있는 경우, pT2-4N1-3M0 2. 검체
4μm 두께로 잘라서 슬라이드를 만들어 판독하였고 양성 전립선 상피 조직도 포함시켰다.
조직학적 등급의 구분은 다음과 같다.
1) well differentiation (Gleason score≤6) 2) moderate differentiation (Gleason score=7)
Table 1. Patient characteristics
Group A Group B Group C
No. of patients 17 16 12
Age (mean±SD) 67.29±9.61 66.81±3.37 67.00±6.16 Follow up
Duration
(Months) 24.82±22.35 45.40±40.31 21.17±15.46 (mean±SD)
Initial PSA
6.07±3.37 15.71±11.52 76.00±158.48 (mean±SD)
Death 0 1 (NED score; 3) 2 (NED score; 3)
PSA at Death 24.9ng/ml 1;13.9ng/ml
1;3.6ng/ml Group A: pathologic stage (T2 a, b, c NoMo), Group B: pathologic stage (T3 a, b NoMo), Group C: pathologic stage (T2-4N1-3Mo), PSA: prostate-specific antigen, NED: neuroendocrine differen- tiation
3) poor differentiation (Gleason score≥8) 3. 면역조직화학검사
적출하여 얻은 전립선 검체는 10% buffered formalin 용액 에 고정한 후 전체를 5mm 간격으로 수직으로 잘라서 파라 핀에 봉입하였다. 출혈이나 괴사가 적은 대표적인 파라핀 블록을 선택한 뒤, 4μm 두께로 박절하여 5% poly-L-lysine 으로 처리한 슬라이드에 부착시키고 파라핀을 제거하였다.
감추어진 항원을 노출시키기 위해 pH 6.0 citrate buffer에 담 가 microwave 처리를 하였다. 내인성 과산화효소를 억제하 기 위해 실온에서 3% 과산화수소수에 10분간 처리하였다.
pH 7.6 TBS buffer에서 10분간 세척을 한 후, 비특이 단백의 결합을 제거하기 위해 10% bovine serum albumin에 37oC에 서 20분간 반응시켰다.
일차 항체로 monoclonal mouse anti-human chromogranin-A (DAKO, Carpinteria, USA)를 1:50으로 희석하여 조직 위에 떨어뜨린 후 실온에서 30분 반응시켰다. TBS buffer에 10분 간 수세 후, 2차 항체 (DAKO REAL EnVision kit)에 30분간 반응 후 증류수로 씻어냈다. Diaminbenzidine (DAB)으로 발 색하고 핵은 hematoxylin으로 대조 염색을 하였다. 슬라이 드는 탈수화시켜서 crystal mount를 사용하여 봉입 후 검경 하였다. Positive control은 양성비대증조직에 있는 NEC를 이용하였다.
슬라이드는 1명의 병리학자에 의해 판독되었다. 200x 확 대 시야에서 gridded eyepiece를 이용하여 chromogranin A 발 현이 가장 높은 부위에서 NED 정도를 결정하였다. 종양에 서 NEC 염색정도는 0=면역반응 NE 세포 없음, 1=면역반응 NE 세포 <10%, 2=10-20% 면역반응종양세포, 3=>20% 면 역반응 NEC로 점수화하였다. 또한 NEC의 숫자는 10을 기 준으로 이상은 high, 이하는 low로 구분하여 보았고, NEC의 분포 형태에 따라 cluster와 solitary로 구분하여 분석하였다.
4. 통계학적 분석
각 집단에서 NED 정도와 외과적 절제면 양성의 정도와 병의 진행 여부를 chi-square test를 통하여 분석하였고, 변수 들의 정규 분포성을 Shapiro-Wilcoxon test를 이용하여 검정 하였다. 면역반응세포의 발현 정도를 점수화한 등급과 분 화세포의 많고 적음으로 구분한 정도나 세포의 분포 정도 그리고 PSA, Gleason score 등의 변수를 이용하여 집단 A에 비해 집단 B, C가 될 위험성을 다중회기분석을 통해 병기에 대한 예측도를 분석하였다. 또한 전립선암의 병리적병기, Gleason score와 NED 정도 사이의 연관성을 알아보기 위해 ANOVA test와 Student's t-test를 이용하여 분석하였으며, p 값이 0.05 미만을 통계적으로 의미 있는 것으로 간주하였고
통계 프로그램은 SAS 9.1을 이용하였다.
결 과
전체 환자 수는 45명으로 그룹 A가 17명, 그룹 B가 16명, 그룹 C가 12명이었다. 환자의 평균 나이는 그룹 A가 67.3 세, 그룹 B가 66.8세, 그룹 C가 67.0세로 차이가 없었다. 평 균 추적 기간은 그룹 A가 24.82개월, 그룹 B가 45.40개월, 그룹 C가 21.17개월로 그룹 B에서 상대적으로 길었다. 평균 PSA는 그룹 A가 6.07ng/ml, 그룹 B가 15.71ng/ml, 그룹 C가 76.00ng/ml로 병기가 증가할수록 PSA 수치는 증가하였다.
그룹 A에서는 사망자가 없었고 그룹 B에서는 1명에서 사망 하였으며 NED 점수는 3점이었고 사망 시 PSA 수치는 24.9ng/ml였으며, 그룹 C에서는 사망자가 2명이었고 이들 모두 NED 점수는 3점이었고 사망 시 PSA 수치는 각각 13.9ng/ml, 3.6ng/ml였다 (Table 1).
외과적 절제면 양성률은 그룹 A에서 7/17 (41.9%), 그룹 B에서 13/16 (81.6%), 그룹 C에서 10/11 (90.9%)로 병기가 높 아질수록 의미 있게 증가하였다 (p=0.0083). 병의 진행은 그 룹 A에서 2/17 (11.7%), 그룹 B에서 4/16 (25.0%), 그룹 C에 서 3/12 (25.0%)로 그룹 A에 비해 그룹 B, C에서 두 배 정도 증가하였으나 통계적 의의는 없었다 (p=0.5228). NED 정도 는 점수화로 하든, 많고 적음으로 나누든 간에 결과는 같이 나와 그룹 A에서는 분화점수가 1인 경우만 1명으로 나와 총 1/17 (5.88%), 그룹 B에서는 분화점수가 1이 4명, 3이 2명 으로 총 6/16 (37.5%), 그룹 C에서는 분화점수가 1이 6명, 3 이 3명으로 총 9/12 (75.0%)로 병기의 진행에 따라 의미 있 게 높아졌고 전체에서 분화점수 2는 없었다 (p=0.0040) (Table
Table 2. The characteristics among the group of patients with regard to NED
Group A Group B Group C p-value*
PSM (%) 7/17 (41.9) 13/16 (81.6) 10/11 (90.9) 0.0083 Progression
2/17 (11.7) 4/16 (25.0) 3/12 (25.0) 0.5228 (%)
NED score
1 (%) 1/17 (5.88) 4/16 (25.0) 6/12 (50.0) 0.0050 2 (%) 0 (0.0) 0 (0.0) 0 (0.0)
3 (%) 0 (0.0) 2/16 (12.5) 3/12 (25.0) Total (%) 1/17 (5.88) 6/16 (37.5) 9/12 (75.0) NED amount
Low (%) 0 (0.0) 3/16 (18.75) 3/12 (25.0) 0.0040 High (%) 1/17 (5.88) 3/16 (18.75) 6/12 (50.0)
Total (%) 1/17 (5.88) 6/16 (37.5) 9/132 (75.0)
PPSM: positive surgical margin, NED: neuroendocrine differen- tiation, *by chi-square test
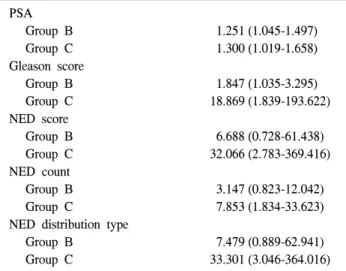
Table 3. The results of the logistic regression analysis (odds ratio of each stage according to each of the parameters)
PSA
Group B 1.251 (1.045-1.497)
Group C 1.300 (1.019-1.658)
Gleason score
Group B 1.847 (1.035-3.295)
Group C 18.869 (1.839-193.622)
NED score
Group B 6.688 (0.728-61.438)
Group C 32.066 (2.783-369.416)
NED count
Group B 3.147 (0.823-12.042)
Group C 7.853 (1.834-33.623)
NED distribution type
Group B 7.479 (0.889-62.941)
Group C 33.301 (3.046-364.016)
All odds ratio was obtained by reference group as group A. PSA:
prostate-specific antigen, NED: neuroendocrine differentiation
Fig. 1. (A) The findings with a neuroendocrine differentiation score of 1 (stained cells <10%). Immunoreactive neoplastic cells are scattered (x100). (B) The findings with a neuroendocrine differentiation score of 3 (stained cell >20%). Numerous cancer cells with immunoreactivity were identified.
2) (Fig. 1).
그룹 A를 기준으로 그룹 B, C가 될 위험성을 다중회귀분 석한 결과 PSA와 Gleason score는 그룹 B, C에 모두 통계적 으로 의의 있는 위험성을 보였고 NED는 어떠한 형태로 구 분하든 모두 그룹 C에 대해서는 의미 있는 위험성을 보였 으나 그룹 B에 대해서는 의미 있는 위험성을 보이지 못했 다 (Table 3).
NEC의 염색은 NED와 병리적 병기 사이의 연관성 분석에 서 전립선에 국한된 그룹 A, B에서 분화점수 중앙값은 0이
었고, 그룹 C에서는 1로 chromogranin A에 대한 분화세포 염색점수는 림프절 전이가 있는 그룹 C에서 의미 있게 높 았다 (p=0.003) (Fig. 2A). NED 점수와 Gleason score 사이의 연관성 분석에서, Gleason score 7 이하인 경우에서는 분화 점수 중앙값이 0, Gleason score가 8 이상인 경우에서는 1로 chromogranin A에 염색되는 분화점수는 Gleason score가 가 장 높은, 분화도가 나쁜 전립선암에서 의미 있게 높았다 (p=0.03) (Fig. 2B).
Fig. 2. (A) Relationship between neuroendocrine differentiation and clinical stage (by ANOVA test). (B) Relationship between neuroendocrine differentiation and histological grade (by Student's t-test).
고 찰
PSA는 전립선암의 진단과 치료에 가장 많이 이용되는 표 지자이나 전립선암에 특이적이지 않아 진단이나 병기 결정 에 문제점이 많으며 특정 치료 후에 추적 관찰로 이용되고 있다. 특히 호르몬불응성 전립선암이나 소세포암의 형태에 서는 이의 유용성이 훨씬 떨어지는 점이 실제 환자를 치료 하는 임상의사들에게 큰 문제점으로 생각되고 있으나 현실 적으로 이를 보완하거나 대체할 만한 다른 표지자가 없는 것이 현실이다. 또한 전립선암은 다양한 생물학적 특성으 로 자연경과가 다양하고 예후를 예측하기가 어렵다. 만일 각 전립선암 환자에서 임상적, 그리고 생물학적 특성을 보 다 정확하게 규명한다면 치료의 계획을 수립하고 예후를 예측할 수 있어 매우 바람직할 것이다.
1999년 미국 병리학자 회의에서 전립선암 환자의 예후를 예측하는 인자를 3가지 그룹으로 분류하여 그룹 I은 예후적 중요성이 인정되어 실제 임상에서 사용되고 있는 것으로 술 전 PSA수치, Gleason score, 외과적 절제면 상태 등을 포 함하였고, 그룹 II는 생물학적, 임상적으로 많이 연구되었으 나 아직 통계적으로는 입증이 안된 것으로 종양 용적, 조직 학적 형태, DNA ploidy 등을 포함하였으며, 그룹 III는 예후 적 가치를 증명하기에는 아직 충분치 않은 것으로 신경주 위침범, NED, 미세혈관 밀도, 핵의 둥근 정도, 염색질의 형 태, 증식 표시자, 종양유발유전자, 종양억제유전자, 세포소 멸유전자 등을 거론하였으며 이 중에서도 최근 관심이 집 중되고 있는 것이 NEC의 분화이다.7,8
NEC의 기원은 확실치 않으며, Bankhoff 등1의 보고에 의 하면 정상 전립선에서의 NEC는 유사분열 후기 상태로 마
지막까지 분화된 세포로 국소 줄기세포에서 유래된 것으로 추측하고 있다. 전립선 내의 상피세포와는 달리 안드로젠 수용체는 존재하지 않으며, 비뇨생식동에서 기원하는 전립 선의 분비세포나 기저세포와는 구별된다.
Chromogranin과 serotonin은 Bouin으로 고정된 전립선조 직에서 NEC의 존재를 알리는 최선의 표지자로 알려져 있 다.9 이에 저자들은 NEC의 대표적 생산물인 chromogranin A 항체를 이용하여 병리학적 표현 정도를 연구한 결과 35.6%에서 면역반응세포를 확인하여 이는 Theodorescu 등2 의 24%보다는 높으나 다른 여러 보고자들의 결과인 52- 92%보다는 낮은 결과를 보였다.9 이러한 차이는 조직 표본 채취의 방법, 사용된 NEC에 대한 biomarker의 수 등에 의한 것으로 판단된다.
NED의 정도가 전립선암에 있어서 나쁜 예후와 연관이 있고 호르몬 불응성 전립선암으로의 전환과 관계가 있다는 보고들이 있는 반면 이와는 상반된 보고들도 있어 아직 이 에 대해서는 논란이 많은 실정이다. Weinstein 등10은 임상 적으로 전립선에 국한된 환자에서 NED의 정도와 환자의 생존율 사이에 연관이 있다고 하였으나 이들은 Gleason score가 5-6인 환자에서 연구한 것으로 객관적이지 못하다 는 한계가 있다. Krijnen 등4은 NED는 호르몬요법의 조기 실패와 연관이 있으며 이것은 NEC가 안드로겐 비의존적임 을 의미한다고 하였다. Kim 등11은 NED를 보인 전립선암이 NED를 보이지 않는 전립선암에 비해 분화도가 나쁘고 진 행성 특징을 보이고 NED 세포수 및 군집형태가 증가할수 록 Ki-67 증식지표수에 의해 표현되는 세포 증식이 증가하 게 되어 NED가 있는 전립선암은 파라크린 (paracrine) 과정 을 통해 불량한 병리학적 특성을 보인다고 하였다. 또한 Speights 등12은 NED는 높은 병기와 높은 Gleason score와 비
례하여 증가한다고 하였다.
이와 반대로 Aprikian 등13은 NED 정도와 병리적 병기나 전이 여부와는 관계가 없다고 하였다. Allen 등14은 NED 정 도와 환자의 예후에는 연관성이 없다고 하였다. Bostwick 등6은 chromogranin과 serotonin에 대한 면역반응세포를 연 구한 결과 림프절 전이 전립선암보다 정상전립선이나 초기 전립선암에서 면역반응세포의 수치가 훨씬 높게 측정되었 으며, NEC 표지자의 감소된 표현이 암의 진행과 관여한다 고 하였다. Pruneri 등15은 NED가 임상적 병기와 연관이 없 지만 높은 Gleason score와 연관이 있다고 하였다. 본 연구 에서 chromogranin A에 염색되는 NEC가 많을수록 병리적 병기가 진행하고 Gleason 점수도 증가하며 병의 진행과 연 관이 있는 것으로 보여, NEC가 증가할수록 환자의 예후는 좋지 않을 것으로 추정되며, 이는 Speights 등12의 결과와 비 슷하였다. 그러나 다중회귀분석을 통한 상대적 위험도를 분석해 볼 때, PSA와 Gleason score는 그룹 A에 비해 그룹 B나 C가 될 위험도는 통계적인 의미가 있는 것으로 나타났 으나, NED 정도는 그룹 B에 대해서는 통계적 의미가 없었 고 그룹 C에 대해서는 상대적 위험도가 의미 있는 것으로 나타나, PSA와 Gleason score보다 우수한 독립적인 예후인 자로 보기는 어려웠다. 이것은 NED가 전립선암의 진행이 나 전이에 관여한다는 일부의 보고3,8,16를 뒷받침해 주는 결 과라고 볼 수 있으나 이에 대해서는 더 많은 검체 수를 대 상으로 하는 연구가 필요하리라 생각한다.
Weinstein 등10은 조직학적 등급과 NED 정도는 병의 진행 에 대한 예후적 가치가 있으며 특히 조직학적 등급이 중간 정도인 Gleason score가 5-6인 환자에서 예후를 예측하는 데 더 유용하다고 하였으나 본 연구에서는 의미가 없었다.
Theodorescu 등2은 T1-T2로 전립선에 국한된 전립선적출 술 검체에서 chromogranin A와 cathepsin D에 대한 면역반응 성의 결과와 Gleason socre, 피막침범, 정낭침범, 종양의 용 적 등의 병리적 변수들과 비교하여 분석한 결과, chromo- granin A에 염색되어 측정되는 NED 정도는 전립선암의 진 행과 환자의 생존율을 예측하는 데 유용하다고 하였다. 본 연구에서는 전립선에 국한된 환자의 수가 적었으며 초기 전립선 적출술에 대한 술기의 미성숙으로 병리적 변수들을 비교하기에는 무리가 있어서 이러한 변수들에 대해서는 더 세밀하게 비교분석을 하지 않았다.
현재 미국 National Comprehensive Cancer Network (NCCN) guidline에서 주장하는 바에 의하면, 전이성 전립선암에서 낮은 PSA 수치를 보이며 내부장기 혹은 골용해성 전이를 보이는 경우나, 빠르게 진행하는 연화조직 (soft tissue) 종괴 를 보이는 경우에는 조직검사를 하여 소세포의 존재 유무 에 관계없이 NEC의 존재가 확인되면 호르몬 치료 등의 다
른 치료보다는 cisplatin/etoposide 항암약물요법을 시행하기 를 권유하고 있다. 전립선암 검체에서 NED의 의미에 대한 논란은, 본 연구 결과에 비추어 볼 때 진행성암에서 NED이 높아진다고 볼 수 있으나 NEC 자체는 핵 내 안드로겐 수용 체가 없어4 호르몬 치료에 반응을 보이지 않기도 하지만, 마지막까지 분화된 세포로 증식능력이 없어17 특이세포주 기 (cell cycle-specific)에 관여하는 항암화학약물치료에도 효과가 없으며 bcl-2, survivin 등에 의해 악성상피세포의 사 멸도 어려울 것으로 판단되어18 전립선암의 진행에서 NED 의 역할과 이들의 치료에 대해서는 더 많은 연구가 이루어 져야 할 것으로 생각한다.
본 연구는 몇 가지 연구의 한계점을 가지고 있다. 첫째, 대상 검체수가 적고, 선택된 환자집단과 수의 차이에 따라 서도 다른 결과가 도출될 가능성을 배제할 수 없다. 둘째, 본 연구에서 림프절 양성인 경우 보조 호르몬 요법을 시행 하였는데 이것이 생화학적 재발이나 진행에 영향을 줄 수 있었으나 이들을 포함시켰다. 셋째, 아직 NED 정도를 정하 는 방법에서 일치된 견해가 없어 본 저자를 포함하여 연구 자들의 방법과 면역조직화학염색의 결과를 해석하는데 있 어서의 다양성이 존재하여 이에 대한 표준화 작업이 필요 하다. 넷째, 본 저자는 근치적 전립선적출술을 시행한 전체 전립선 조직을 대상으로 하여 NED가 가장 많은 부위를 선 택하여 조사를 하였지만, 실제 대부분의 전립선암에서 NEC의 분포는 전체 조직에서 골고루 분포되어 있는 것이 아니기 때문에 연구자가 취급하는 조직에 따라서도 다른 결과가 나올 가능성이 있다. 다섯째, 본 연구에서는 NED 정도를 가장 흔하고 안정적인 chromogranin A에 대한 항체 만을 사용함으로써 전립선암에서 NEC의 기능을 다 밝혀내 지 못한 면이 있으나, 추후 NED 전체를 밝히는 새로운 방법 이 개발된다면 진정한 NED와 전립선암과의 여러 가지 의 문점들이 해결될 것으로 기대한다. 또한 진단 당시 비슷한 PSA 수치와 Gleason score를 보이는 전립선암도 각각의 진 행 양상은 판이하게 다른 경우가 임상에서 종종 볼 수 있는 데, 이에는 NEC에서 분비하는 여러 조절인자들이 분명히 개입되어 있을 것으로 추정되며 이에 대해서는 보다 세밀 한 향후 연구가 이루어져야 할 것으로 생각한다.
결 론
전립선암의 검체에서 NED의 정도는 PSA, Gleason score 보다 병기나 진행을 예측하는 데 더 우수하다고 할 수는 없지만 림프절 전이가 있는 경우에는 이들 인자들과 같이 고려할 때 도움이 될 것으로 생각한다. 특히 사망한 3명 모 두 NED 점수는 3으로, 림프절 양성인 환자에서 적출한 검
체에서 NED 점수가 높은 경우 세심한 추적 관찰이 필요할 것으로 생각한다.
REFERENCES
1. Bonkhoff H, Stein U, Remberger K. Multidirectional differen- tiation in the normal, hyperplastic, and neoplastic human prostate: simultaneous demonstration of cell-specific epithelial markers. Hum Pathol 1994;25:42-6
2. Theodorescu D, Broder SR, Boyd JC, Mills SE, Frierson HF Jr. Cathepsin D and chromogranin A as predictors of long term disease specific survival after radical prostatectomy for localized carcinoma of the prostate. Cancer 1997;80:2109-19 3. Cohen RJ, Glezerson G, Haffejee Z. Neuro-endocrine cells-a
new prognostic parameter in prostate cancer. Br J Urol 1991;
68:258-62
4. Krijnen JL, Janssen PJ, Ruizeveld de Winter JA, van Krimpen H, Schroder FH, van der Kwast TH. Do neuroendocrine cells in human prostate cancer express androgen receptor? Histo- chemistry 1993;100:393-8
5. Ahlgren G, Pedersen K, Lundberg S, Aus G, Hugosson J, Abrahamsson PA. Regressive changes and neuroendocrine differentiation in prostate cancer after neoadjuvant hormonal treatment. Prostate 2000;42:274-9
6. Bostwick DG, Qian J, Pacelli A, Zincke H, Blute M, Ber- gstralh EJ, et al. Neuroendocrine expression in node positive prostate cancer: correlation with systemic progression and patient survival. J Urol 2002;168:1204-11
7. Bostwick DG, Grignon DJ, Hammond ME, Amin MB, Cohen M, Crawford D, et al. Prognostic factors in prostate cancer.
College of American Pathologists Consensus Statement 1999.
Arch Pathol Lab Med 2000;124:995-1000
8. Shariff AH, Ather MH. Neuroendocrine differentiation in prostate cancer. Urology 2006;68:2-8
9. Abrahamsson PA, Wadstrom LB, Alumets J, Falkmer S, Grimelius L. Peptide-hormone and serotonin-immunoreactive
tumour cells in carcinoma of the prostate. Pathol Res Pract 1987;182:298-307
10. Weinstein MH, Partin AW, Veltri RW, Epstein JI. Neuro- endocrine differentiation in prostate cancer: enhanced predic- tion of progression after radical prostatectomy. Hum Pathol 1996;27:683-7
11. Kim YJ, Choe G, Hong SK, Byun SS, Lee SE, Lee NK.
Pathological characteristics of neuroendocrine cell differen- tiation in prostate cancer. Korean J Urol 2007;48:143-51 12. Speights VO Jr, Cohen MK, Riggs MW, Coffield KS, Keegan
G, Arber DA. Neuroendocrine stains and proliferative indices of prostatic adenocarcinomas in transurethral resection sam- ples. Br J Urol 1997;80:281-6
13. Aprikian AG, Cordon-Cardo C, Fair WR, Reuter VE. Charac- terization of neuroendocrine differentiation in human benign prostate and prostatic adenocarcinoma. Cancer 1993;71:3952- 65
14. Allen FJ, Van Velden DJ, Heyns CF. Are neuroendocrine cells of practical value as an independent prognostic parameter in prostate cancer? Br J Urol 1995;75:751-4
15. Pruneri G, Galli S, Rassi RS, Roncalli M, Coggi G, Ferrari A, et al. Chromogranin A and B secrerogranin II in prostatic adenocarcinomas: neuroendocrine expression in patients un- treated and treated with androgen deprivation therapy. Prostate 1998;34:113-20
16. Talpin ME, George DJ, Halabi S, Sanford B, Febbo PG, Hennessy KT, et al. Prognostic significance of plasma chro- mogeanin A levels in patients with hormone-refractory prostate cancer treated in Cancer and Leukemia Group B 9480 study.
Urology 2005;66:386-91
17. Bonkhoff H, Wernert N, Dhom G, Remberger K. Relation of endocrine-paracrine cells to cell proliferation in normal, hyper- plastic, and neoplastic human prostate. Prostate 1991;19:91-8 18. Ambrosini G, Adida C, Altieri DC. A novel antiapoptosis
gene, surviving, expressed in cancer lymphoma. Nat Med 1997;3:917-21