Yeungnam Univ J Med 2016;33(2):125-129
범뇌하수체저하증의 호르몬 대체요법 중단 후 발생한 스트레스 심근병증
남승완, 이준원, 심정한, 백현성, 임창조, 임정수, 안성균 연세대학교 원주의과대학 내과학교실
A patient with stress induced cardiomyopathy that occurred after cessation of hormone replacement therapy for panhypopituitarism
Seoung Wan Nam, Jun-Won Lee, Jeong Han Sim, Hyun Sung Pack, Changjo Im, Jung Soo Lim, Sung Gyun Ahn
Department of Internal Medicine, Yonsei University Wonju College of Medicine, Wonju, Korea
Stress induced cardiomyopathy (SC) is characterized by transient left ventricular (LV) dysfunction in the absence of coronary artery disease. We report on a patient with panhypopituitarism who developed SC resulting from withdrawal of hormonal replacement therapy (HRT). A 52-year-old male visited our hospital for progressively worsening dyspnea. The patient had discontinued HRT 7 days ago, which had been admini- stered for 18 months after transsphenoidal adenomectomy for pituitary macroadenoma. Initial electrocardio- gram showed marked sinus bradycardia. Transthoracic echocardiography showed apical ballooning with an LV ejection fraction of 25%. No significant obstructive lesions were observed on coronary angiography.
With a clinical diagnosis of SC associated with panhypopituitarism, HRT was restarted, including glucocorti- coid and thyroxine, along with standard heart failure management. His LV function had normalized at 2-month follow-up. He remains asymptomatic and administration of beta-blocker and angiotensin converting enzyme inhibitor were discontinued He currently only requires HRT.
Keywords: Takotsubo cardiomyopathy; Stress cardiomyopathy; Hypopituitarism
Received: March 05, 2015, Revised: May 26, 2015 Accepted: June 01, 2015
Corresponding Author: Jun-Won Lee, Department of Internal Medicine, Yonsei University Wonju College of Medicine, 20 Ilsan-ro, Wonju 26426, Korea
Tel: +82-33-741-0920, Fax: +82-33-741-1219 E-mail: ljwcardio@yonsei.ac.kr
Copyright ©2016 Yeungnam University College of Medicine
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creative- commons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
서 론
스트레스 심근병증은 일시적인 좌심실기능부전을 특징으 로 하는 심근병증이다. 일반적으로, 관상동맥 영역과 관계 없이 좌심실 중간부에서 첨부에 걸쳐 전반적인 수축기능 장
애를 보이며, 동시에 기저부의 과운동으로 인한 심첨부의 풍선형 팽창(apical ballooning) 소견이 보여 Takotsubo 심근 병증이라 불리기도 한다[1,2]. 스트레스 심근병증이 중증의 비심장(non-cardiac) 질환, 혹은 그 밖의 중한 상태와 동반된 보고는 국내에도 여러 차례 있었지만 범뇌하수체저하증(pan- hypopituitarism)과 수반되어 발생한 경우는 매우 드물며 저자 들은 이를 교정하여 호전시킨 증례를 보고하는 바이다.
증 례
환 자: 남자, 52세
Fig. 1. (A) T1-weighted sagittal brain MRI showed an approxi- mately 3.0×2.4×2.0 cm sized hemorrhagic pituitary macroade- noma (arrow). (B) A follow-up brain MRI 15 months after trans- sphenoidal adenomectomy for pituitary macroadenoma, showed no definite residual tumor within the pituitary fossa. MRI, magnetic resonance imaging
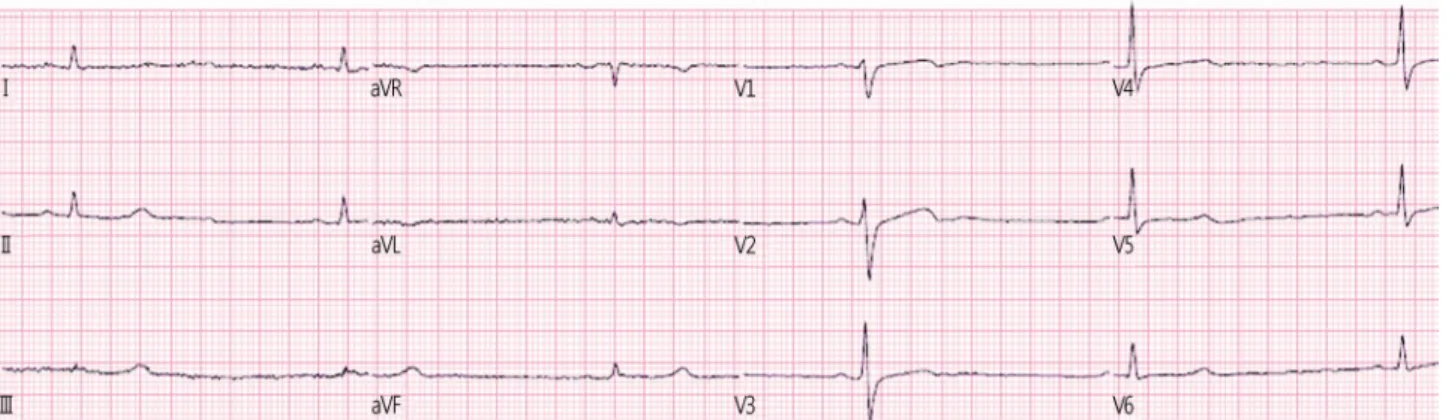
Fig. 2. Electrocardiography on arrival, showed marked sinus bradycardia (30 beats per minute).
주 소: 호흡곤란
현병력: 일주일 전부터 임의로 호르몬제 복용을 중단한 후, 내원 2시간 전부터 발생한 호흡곤란을 주소로 응급실을 방문하였다.
과거력: 18개월 전 직경 30 mm의 비기능성 뇌하수체 대선 종(nonfunctioning pituitary macroadenoma)을 진단받고 접형 골 경유 뇌하수체 절제술(transsphenoidal adenomectomy)을 시행받았다. 이후 시행한 혈중 호르몬 검사 결과 부신곁질 자극호르몬 <1.00 pg/mL, 갑상샘자극호르몬 <0.03 μIU/mL, 황체형성호르몬 <0.07 mIU/mL (range, 1.3-7.8 mIU/mL), 난포 자극호르몬 0.61 mIU/mL (range, 1.4-15.4 mIU/mL), 프로락틴 1.31 ng/mL (range, 3.0-14.7 ng/mL)로 모든 뇌하수체 전엽 호 르몬 농도가 감소되어 있었고, 자기공명영상 및 컴퓨터단층 촬영 뇌 검사에서 뇌하수체가 잔여 종양 없이 제거된 소견이 여러 차례 확인되었다(Fig. 1). 환자는 범뇌하수체저하증에 대해 경구 히드로코르티손(hydrocortisone) 1일 20 mg, 경구 레보티록신(levothyroxine) 1일 100 μg과 3주 간격으로 근육
내주사 테스토스테론 250 mg의 호르몬 대체 요법(hormone replacement therapy)을 받고 있었다.
가족력: 특이사항 없었다.
진찰소견: 혈압 130/70 mmHg, 맥박 33회/분, 호흡수 18회 /분, 체온 35.0℃였다. 환자의 의식 상태는 명료하였으나 급성 병색을 보였다. 심박동은 규칙적이었고, 심잡음은 들리지 않 았다. 폐호흡음은 정상이었고, 수포음은 들리지 않았다.
검사실 소견: 말초 혈액검사에서 혈색소 13.8 g/dL, 헤마토 크리트 39.8%, 백혈구 3,930/mm3, 혈소판 254,000/mm3였 다. 일반화학검사에서 나트륨 129 mmol/L, 칼륨 5.7 mmol/L, 혈당 90 mg/dL, 칼슘 9.0 mg/dL, 인(phosphorus) 4.3 mg/dL, 혈 액요소질소(blood urea nitrogen) 11.0 mg/dL, 크레아티닌 1.3 mg/dL (range, <1.4 mg/dL), 아스파르테이트아미노전달효소 163U/L(range, <40U/L), 알라닌아미노전달효소 49U/L(range,
<40 U/L), 알칼리인산분해효소 152 U/L (range, <120 U/L), 감마-글루타밀전이효소 68 U/L (range, <60 U/L), 총 빌리루빈 1.6 mg/dL(range, <1.3 mg/dL), 직접 빌리루빈 0.6mg/dL(range,
<0.3mg/dL), 알부민 4.6g/dL, C-반응단백질 0.63mg/dL (range,
<1.0 mg/dL), 적혈구침강속도 15 mm/h (range, <16 mm/h)였 다. Creatine kinase-MB (CK-MB) 4.82 ng/mL, troponin I 0.010 ng/mL로 심근효소 수치는 정상이었으나, B-type natri- uretic peptide는 1,766 pg/mL로 증가하였다.
심전도 및 방사선학적 소견: 심전도는 분당 33회의 동성 서맥, 비특이적 심실내 전도 장애와 저전압(low voltage) 소견 을 보였다(Fig. 2). 단순 흉부 X-선 검사는 특이소견 없었다.
치료 및 경과: 응급실 내원 후 호흡곤란과 저산소증이 점점 악화되었고, 손가락단자 무작위 혈당수치(finger prick random blood glucose level) 59 mg/dL로 저혈당 소견이 관찰되었다.
내원 2시간이 경과되었을 무렵 무맥박전기활동(pulseless electrical activity)이 관찰되어 심폐소생술을 약 2분간 시행
Fig. 3. Transthoracic echocardiography (apical 4 chamber view) on arrival (A-B) and after 2 months (C-D). End-diastole (A, C). End- systole (B, D). Left ventricular apex (arrow).
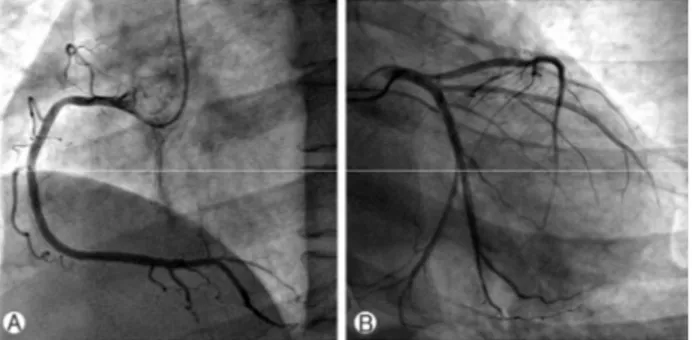
Fig. 4. Coronary angiography. (A) right coronary artery, (B) left circumflex artery and left anterior descending artery.
Fig. 5. Left ventricular thrombus (arrow). (A) transthoracic echo- cardiography, apical 3 chamber view; (B) contrast echocardiogra- phy, apical 3 chamber view.
하여 자발순환이 회복되었다. 노르에피네프린, 도파민을 투 여하면서 기계환기를 시행하며 집중감시하였다. 심정지 발 생 약 30분 전에 다시 시행한 혈액화학 검사에서 나트륨 119 mmol/L, 칼륨 7.3 mmol/L로 전해질 불균형이 더욱 악화되었 고, 크레아티닌 1.4 mg/dL로 증가된 소견을 보였다. 또한, 흡 입산소농도(FiO2) 40% 상태에서 시행한 동맥혈가스분석에 서 pH 7.324, 산소농도(pO2) 148.5 mmHg, 이산화탄소농도 (pCO2) 36.6 mmHg (range, 35-48 mmHg), 중탄산염(HCO3-) 18.6 mmol/L (range, 22-26 mmol/L)로 측정되었다. 고칼륨혈 증 교정을 위해 염화칼슘, 인슐린, 중탄산염나트륨을 정맥 내로 투여하였다. 또한 환자가 최근 호르몬제 복용을 중단한 점을 고려하였을 때, 급성부신기능부전(acute adrenal insuffi-
ciency)이 동반되었을 것으로 판단하여 혈중 호르몬 검사를 시행한 후 즉시 메틸프레드니솔론(methylprednisolone) 125 mg을 정맥 내 주사하였다.
응급실에서 시행한 경흉부 심초음파 검사에서 측정된 좌 심실 구혈률은 약 25%였고, 좌심실 기저부의 운동능력은 비교적 유지되었으나, 중간부에서 심첨부까지 심한 저운동 (hypokinesia)과 풍선형 팽창 소견이 관찰되었다. 우심실의 수축기능은 유지되어 있었고, 우심실 수축기압(right ventri- cular systolic pressure)은 27 mmHg로 유의하게 높지 않았다 (Fig. 3).
혈중 호르몬 검사 결과 혈청 코티솔 1.65 μg/dL (range, 4.3-22.4 μg/dL), 부신곁질자극호르몬 31.7 pg/mL (range, 12.0- 60.0 pg/mL), 유리 티록신(free thyroxine) 0.15 ng/dL (range, 0.83-1.76 ng/dL), 삼요드티로닌(triiodothyronine) 0.31 ng/mL (range, 0.60-1.81 ng/mL), 갑상샘자극호르몬 1.09 μIU/mL (range, 0.35-5.50 μIU/mL)로 저코티솔혈증, 갑상선기능저하 증 소견을 보였다. 메틸프레드니솔론 투여 4시간 후에 히드 로코티손 200 mg을 정맥 내 투여하였고, 4일간 히드로코티손 100 mg을 12시간 간격으로 정주한 후, 경구 프레드니솔론 (prednisolone)으로 변경하여 1일 15 mg (아침 10 mg, 저녁 5 mg)과 경구 레보티록신 1일 200 μg을 재투여하였다.
내원 시 심근효소 수치는 정상이었으나, 14시간 후 재측정 한 심근효소 수치는 CK-MB 20.66 ng/mL, troponin I 6.666 ng/mL으로 상승하였다. 관상동맥질환을 배제하기 위해 심혈 관 조영술을 시행하였으며, 관상동맥은 정상 소견을 보였다 (Fig. 4). 스트레스 심근병증으로 진단하고, 심부전에 대해 이 뇨제를 투여하며 경과 관찰하였다. 내원 9일째 호르몬 검사 에서 오후 4시 혈청 코티솔 15.33 μg/dL, 유리 티록신 0.97 ng/dL로 정상 범위를 회복했으나 환자는 여전히 호흡곤란과 가슴불편감을 호소하여 심초음파 검사를 다시 시행하였다.
좌심실구혈률은 27%로 이전과 변화 없었으며, 좌심실 첨부
에 3.2×3.8 cm 크기의 혈전(thrombus)이 새로 관찰되었다 (Fig. 5). 심장 내 혈전에 대해 저분자량헤파린(enoxaparin) 피하 주사 항응고요법을 시작하였고, 이후 경구 쿠마딘으로 대 체하여 프로트롬빈시간(prothrombin time) 국제표준화비율 (international normalized ratio)을 2-3 사이로 유지하였다.
심부전 치료를 위해 경구 베타차단제 카베딜롤 3.125 mg, 안 지오텐신수용체 길항제 칸데살탄 4 mg, 스피로놀락톤 12.5 mg을 추가하였다.
내원 15일째 호흡곤란과 가슴불편감은 크게 호전되었고, 좌심실구혈률은 58%로 회복되었다. 좌심실 심첨부에는 여 전히 저운동성 소견을 보였으나 중간부는 이전에 비해 운동 성이 호전되었고, 좌심실 내 혈전은 더 이상 관찰되지 않았 다. 내원 18일째 특별한 증상호소 없이 양호한 상태로 퇴원 하였다. 경구 쿠마딘은 퇴원 1주일 후 아스피린 1일 100 mg 으로 변경하였다.
2개월 후 재시행한 심초음파 검사는 정상 좌심실구혈률 (66%)과 정상 심근벽운동 소견을 보였다(Fig. 2). 퇴원 5개월 후 호르몬 검사는 혈청 코티솔 21.96 μg/dL, 유리 티록신 1.65 ng/dL로 정상 호르몬 범위를 유지하였다. 호르몬 대체요법은 경구 히드로코티손 1일 15 mg (아침 10 mg, 저녁 5 mg), 경구 레보티록신 1일 75 μg, 테스토스테론 250 mg 3주 간격 근육 내 주사를 유지 중이며, 아스피린 및 심부전 약물은 퇴원 후 약 9개월 간 복용 후 현재는 복용 없이 외래 경과 관찰 중이다.
고 찰
스트레스 심근병증은 강도 높은 정서적 혹은 육체적 스트 레스 또는 급성 병증에 의해 유발되는 것으로 알려져 있다 [1,2]. 발병 기전은 심장 미세혈관 연축이나 관상동맥 기능의 이상, 카테콜라민의 심장에 대한 직접적인 작용 등 다양한 원인이 제시되고 있으나, 교감신경계 항진에 의한 카테콜라 민의 과도한 상승이 주된 원인으로 생각되고 있다[3-5].
이 증례의 환자는 비기능성 뇌하수체 대선종 수술 후 호르 몬 대체요법을 받다가 1주일간 약제 복용을 중단한 후 범뇌 하수체저하증이 악화되었고, 급성 부신기능부전, 갑상선기 능저하증 등 복합적 상황이 동반되면서 스트레스 심근병증 이 발생하였다. 범뇌하수체저하증에 스트레스 심근병증이 동반된 증례 보고가 1예 있었으나[6], 약제 중단 후 발생한 예는 보고된 바가 없었다.
범뇌하수체저하증은 2차성 부신기능부전을 일으키는데,
이로 인한 코티솔 결핍이 항이뇨 호르몬의 부적절한 분비를 유발하여 저나트륨혈증이 발생한다[7]. 또한 범뇌하수체저 하증으로 인해 갑상선기능저하증이 함께 동반될 수 있는데, 이로 인해 맥박수가 느려지고 심근 수축력이 떨어져 결과적 으로 심박출량이 감소하게 된다. 심박출량 감소로 수액 제거 능력이 감소하면서 이차적으로 저나트륨혈증이 악화될 수 있다. 중증 저나트륨혈증은 심근세포막의 나트륨-칼슘 교환 체(Na+/Ca2+ exchanger)에 기능적 이상을 일으켜 심근세포 내에 칼슘을 축적시키며, 이는 심근 수축력의 이상으로 이어 져 심부전과 부정맥을 일으킬 수 있다[8,9]. 저나트륨혈증은 최근 스트레스 심근병증의 위험인자로 점차 강조되고 있으 며, 본 환자에서도 스트레스 심근병증의 진행에 기여하였을 것이다[10]. 코티솔과 같은 글루코코르티코이드(glucocorti- coid)는 심근세포를 보호하고 심근 수축력을 유지하는데 중 요한 역할을 한다[11,12]. 글루코코르티코이드는 근세포 및 심근세포 내의 칼슘 농도에 영향을 끼치며 심장에서 근세포 질세망(sarcoplasmic reticulum)에 작용하여 칼슘-순환(Ca2+- cycling) 및 심근 수축에 영향을 끼친다[13-15]. 따라서 저코 티솔혈증은 심근을 손상에 취약하게 만들며 수축능을 떨어 뜨려 심부전 상태를 야기할 수 있다. 이 환자의 경우 갑상선 기능저하증으로 인한 서맥 악화와 열거된 원인들에 의한 심 기능의 감소, 더불어 저코티솔혈증에 의한 혈관긴장도(vas- cular tone) 감소로 저혈압이 발생하였을 것으로 생각된다.
이로 인해 대사성 산증과 고칼륨혈증이 동반되면서 심정지 가 유발된 것으로 판단된다. 심정지 상태는 이를 구조(rescue) 하기 위해 카테콜아민 발작(catecholamine storm) 혹은 교감 신경성 서지(sympathetic surge)를 일으킬 수 있으며, 이 또한 스트레스 심근병증의 원인이 될 수 있다. 그러나 저자들은 환자의 심장마비 상태가 2분 이내로 짧았음에 비해 이후의 수축기 심부전 상태의 회복이 2주 이상 지연되었고, 특히 완 전한 회복에 약 2개월이 소요되었던 점을 고려하였을 때 본 환자에서 스트레스 심근병증의 원인을 단순히 일시적인 심 장마비로 국한하기에는 무리가 있다고 판단하였다[16,17].
증례의 환자는 내원 이후 저혈당이 진행되는 소견을 보였으 며, 저혈당 역시 교감신경계를 활성화시킨다. 결론적으로 환 자는 교감신경계의 과활성화에 의한 심근손상, 글루코코르 티코이드 결핍 및 이와 연관된 저혈당, 저나트륨혈증의 진행 등으로 인해 스트레스성 심근병증이 진행되었다. 각각의 원 인들은 서로 어느 정도의 연관성을 가지고 발생하였으며, 공 통적으로는 환자의 호르몬 대체요법 중단에 의해 유발된 보 다 상위 단계인 범뇌하수체저하증이라는 뇌 기능 이상에 의
해 일시적 심정지를 포함한 독특한 임상적 상황이 야기되었 다는 점이 본 증례의 특이점이다. 한편, 본 증례에서는 환자 가 심정지에서 회복된 이후에만 심초음파를 시행하였기 때 문에 심정지 이전의 심기능 상태를 확인하지 못한 제한점이 있다. 스트레스 심근병증은 일반적으로 1주일 이내에 좌심 실기능이 회복되지 않으면 사망률과 유의한 연관관계가 있 는 것으로 알려져 있다. 또한, 좌심실 내 혈전의 경우 전체 스트레스 심근병증 환자의 약 2.5%에서 발생한다고 알려져 있다[18]. 이 환자의 경우 좌심실 수축기능이 완전히 회복되 는 데 2개월이 걸렸고 좌심실 내 혈전도 관찰되었으나, 적절 한 치료와 집중 감시를 통해 뇌경색과 같은 합병증 없이 회복 될 수 있었다.
스트레스 심근병증과 동반된 특정 질환 및 임상 상황에 대한 다양한 증례가 보고되고 있지만, 이 증례와 같이 범뇌하 수체저하증 환자에서 약제 복용 중단으로 인해 적절한 호르 몬 치료가 이루어지지 않아 스트레스 심근병증이 유발된 증 례는 없어 이를 보고하는 바이다.
CONFLICT OF INTEREST
The authors have no financial conflicts of interest to report.