The Application of Single Nucleotide Polymorphism Markers for Discrimination of Sweet Persimmon Cultivars
Yeo Ok Park1,3*, Seong-Tae Choi1, Ji-Young Son1, Eun-Gyeong Kim1, Gwang-Hwan Ahn1, Ji Hae Park1, Wan-Kyu Joung1, Young Ho Jang2 and Dong Wan Kim3
1Sweet Persimmon Research Institute, 30 Hagye-ro 138beon-gil, Jinyeong, Gimhae 50871, Korea
2Gyeongnam Agricultural Research & Extension Services, Jinju 52733, Korea
3Department of Biohealth Science, Changwon National University, Changwon 51140, Korea
Received May 12, 2020 /Revised July 10, 2020 /Accepted July 13, 2020
The recent development of next-generation sequencing technology has enabled increased genomic analysis, but very few single nucleotide polymorphism (SNP) markers applicable to sweet persimmon (Diospyros kaki Thunb.) cultivars have been identified. In this study, SNP primers developed from five pollination-constant astringent (PCA) persimmons native to Korea were applied to discriminate be- tween cultivars and verify their usability. The polymerase chain reactions of 19 SNP primers devel- oped by Jung et al. were checked, with 11 primers finally selected. The other eight were very difficult to analyze in the agarose gel electrophoresis and QIAxcel Advanced System used in this experiment and were therefore excluded. The 11 SNP primers were applied through first and second verification to 76 cultivars and collection lines including 20 pollination-variant non-astringent (PVNA), 30 pollina- tion-constant non-astringent (PCNA), 20 PCA, and six pollination-variant astringent (PVA). Of these, 38 were indistinguishable (eight PVNA, 18 PCNA, nine PCA, and three PVA). However, the results of applying the 11 SNP primers to new sweet persimmon cultivars, namely Gamnuri, Dannuri, Hongchoo, Jamisi, and Migamjosaeng, showed that they have the potential to be used as a unique marker for simultaneously determining between them.
Key words : Cultivars, discrimination, persimmon, single nucleotide polymorphism (SNP)
*Corresponding author
*Tel : +82-55-254-1563, Fax : +82-55-254-1559
*E-mail : cjsw98@korea.kr
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
서 론
감(Diospyros kaki Thunb.)은 중국에서 기원하여 동아시아 지역에서 주로 재배되었지만 지난 수 세기 동안 전 세계적으 로 재배가 확대되어 왔다. 감은 과실이 성숙함에 따라 나무 위에서 떫은맛이 없어지는 non-astringent type과 그렇지 않은 astringent type으로 크게 구분할 수 있지만, 과실의 종자형성 유무와 과육색의 갈변 정도에 따라 pollination-constant와 pol- lination-variant 두 그룹으로도 분류한다. 따라서 감은 갈반의 형성 정도와 떫은맛 유무에 따라 완전단감(pollination-con- stant non-astringent, PCNA)과 불완전단감(pollination-var- iant non-astringent, PVNA), 불완전떫은감(pollination-var- iant astringent, PVA) 및 완전떫은감(pollination-constant as- tringent, PCA) 등 4가지 그룹으로 나뉜다[5, 10].
특히 감은 영년생 목본류 식물로서 품종특성을 뚜렷하게 확인하기까지 장기간이 소요되며, 자원의 증식 과정에서 혼종 되는 경우 과실을 확인하기 전까지는 정확한 품종 판별이 불 가능할 때도 있다. 특히, 아조변이로 발견된 자원과 이미 알려 진 주요 품종과의 차별성을 명확히 제시하기에는 한계가 있어 이를 극복하기 위해 DNA 마커를 활용한 유전적 차이에 의한 판별이 활발하게 이루어지고 있다[1, 6, 15, 16, 18-22]. 국내에 서 과수 중에서는 사과, 배, 포도, 감, 블루베리 등에 대한 품종 식별 기술이 보고된 바 있다[2-4, 7, 8, 11]. 국제적으로 신품종 에 대한 권리보호가 강화되고 침해분쟁 발생 시 이를 중재하 기 위한 수단으로서 분자마커를 활용하여 품종보호 출원 품종 에 대한 대조 품종 선정에 유전자 분석 결과 활용 사례가 증가 하는 추세이다[13].
DNA 마커 중 random amplified polymorphic DNA (RAPD) 마커가 감 품종 간 유전적 관련성 분석과 품종 판별에 효율적 으로 사용될 수 있다고 보고 되었고[6], Simple sequence re- peats (SSR) primer 들은 유럽 감 품종인 ‘Rojo Brillante’의 DNA 염기서열분석을 통해 개발되어[18], 유럽 품종뿐만 아니 라 일본 및 국내 품종의 유연관계 분석, 품종판별에도 사용이 가능하다고 한다[14-16]. 최근 next generation sequencing (NGS) technology의 발달로 유전체 분석 사례는 증가하고 있 으나, 단감에 있어 적용 가능한 Single Nucleotide Polymor-
Table 1. Information of 76 persimmon cultivars and collection lines (Diospyros kaki Thunb.) tested in this study
No. Cultivars & lines Typez Origin No. Cultivars & lines Type Origin
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38
Akagaki Amahyakume
Baojiaozi Hachiuri Jamisi Johongsi
Koharu Kyara Migamjosaeng Migatanigosho Mizushima
Niitsugaki Nishimurawase
Sae-Fuji Sanggokuitsy
Shougatsu Tenrubou Toyoga Toyouichi Zenjimaru Daeandangam
Dannuri Danyeon104 Fujiwaragosho
Fuyu Gosho Hanagosho
Hongchoo Ichikikeijiro
IsaHaya Izu Jiro Kastusa
Kinshu Maekawajiro Male collection line
Mammoth Matsumotowase Fuyu
PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PVNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA
Japan Japan China Japan Korea Korea Japan Japan Korea Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Korea Korea Korea Japan Japan Japan Japan Korea Japan Japan Japan Japan Japan Japan Japan Korea Japan Japan
39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76
Midai Ro-19 Shinsyu Sunami Suruga Taishu Tanrei Tenjingosho Wakakisjiro Wakasugikeijiro
Yaizuwasejiro Youhou
Atago Cheongdo-Bansi
Damopan Gamnuri Goesan-Durigam Gogseong-Tabaegam
Gyeongsan-Bansi Haman-Bansi Haman-Mulgam
Miryang Muan Myeongju-Kojongsi
O-miyawase Saijo Sancheong-Danseongsi
Sancheong-Kojongsi Sanggam-Dungsi
Sangjudungsi Suhong Wasesaijo Yeongdong-Weolhasi
Hiratanenashi O-tanenashi
Sugitawase Superhiratanenashi
Tonewase Wasezizya
PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCNA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PCA PVA PVA PVA PVA PVA PVA
Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Japan Korea China Korea Korea Korea Korea Korea Korea Korea Korea Japan Japan Korea Korea Korea Korea Korea Japan Korea Japan Japan Japan Japan Japan Japan
z)PCNA, pollination-constant non-astringent; PVNA, pollination-variant non-astringent; PVA, pollination-variant astringent; PCA, pollination-constant astringent. Plant materials were collected from the orchard of Sweet Persimmon Research Institute, Gyeongnam Agricultural Research & Extension Services, Gimhae.
phism (SNP) 마커 및 적용 결과는 거의 없는 실정이다. 이에 본 연구에서는 우리나라 고유 떫은감 5품종, ‘산청고종시’
(Sancheong-Kojongsi, PCA), ‘산청단성시’(Sancheong-Dan- seongsi, PCA), ‘함안수시’(Haman Su-si, PCA), ‘영동월하 시’(Yeongdong-Weolhasi, PCA), ‘상주둥시’(Sangjudungsi, PCA)로부터 개발된 SNP primer [8]들을 단감 품종 판별에 적용하여 사용 가능성을 검증하고자 수행하였다.
재료 및 방법
식물재료 및 DNA 추출
경상남도농업기술원 단감연구소 시험포장에 재식되어 있 는 주요 재배품종 및 계통 76종(PCNA 30종, PVNA 20종, PVA 6종, PCA 20종)을 식물재료로 사용하였다(Table 1). 이중 단감연구소에서 육성한 신품종 ‘감누리’(Gamnuri, PCA)는 1997년에 ‘스나미’(Sunami, PCNA)에 ‘조홍시’(Johongsi, PVNA)
를 교배하여 얻은 실생으로부터 장기적인 계통선발 및 검증을 통해 2018년도에 품종등록된 말랭이 가공용 품종이다[12]. 이 품종은 대과종으로 과육과 과피가 깨끗한 완전떫은감이며, 성 숙기 이후에도 나무에서 약 1개월간 과실의 경도가 높게 유지 되는 특성이 있다. ‘단누리’(Dannuri, PCNA)는 2010년에 ‘단 연104’(Danyeon104, PCNA)에 ‘태추’(Taishu, PCNA)를 교배 하여 선발되었으며, 중생종이면서 320 g 정도의 대과종으로 과형과 식미가 우수하고 종자수가 적다. ‘홍추’(Hongchoo, PCNA)는 2006년도에 ‘Taishu’에 ‘금수’(Kinshu, PCNA)를 교 배하여 선발된 품종이며, 중생종에 외관이 우수하고, 식미가 양호하며 재배가 쉬운 이점이 있다. 현재 ‘Dannuri’와 ‘Hong- choo’는 품종보호 출원 후 재배심사 중에 있다.
이들 식물재료들을 대상으로 전엽 이후인 4월 하순부터 개 화 전 5월 사이 2~3엽이 전개된 시기에 어린잎을 채집하였다.
수집한 잎은 즉시 -70℃ 냉동고에 보존하였으며, 필요할 때마 다 액체질소로 마쇄하여 사용하였다. DNA는 액체질소로 마 쇄한 잎 1 g으로부터 Plant Genomic DNA isolation kit (Davinch-K, Seoul, Korea)를 사용하여 추출하였고 Pico200 (Picodrop, Hinxton, England)으로 정량, 정성 분석한 후 20 ng·μl-1가 되도록 희석하여 이용하였다.
SNP 마커 분석
Jung 등[8]이 개발한 SNP primer 19종을 사용하여 마커형 과 품종 연관성을 분석하였다. PCR mixture는 dNTPs 0.2 mM, Taq DNA polymerase 1 units, 10 × reaction buffer 2 μl 가 포함된 AccuPower PCR PreMix (Bioneer, Daejeon, Korea) 와 10 pmole의 Forward, Reverse primer 각 4 μl를 총 20 μl로 혼합하여 사용하였다. PCR 조건은 PCR 기기(Biometra, Got- tingen, Germany)를 이용하여 94℃에서 15분간 1회, 94℃에서 30초, 50~58℃에서 30초, 72℃에서 30초간 30회 반복하였으며, 최종적으로 72℃에서 4분간 extension을 수행하였다.
PCR 증폭산물은 RedSafeTM (Intron, Seongnam, Korea)를 넣어 제조한 3% Super Fine Resolution (SFR) agarose gel (Amresco, USA)에 전기영동(1 × Tris-borate-EDTA buffer) 후 Gel Documentation System (Bio-rad, California, USA)을 이 용하여 반복 확인하였다. 76품종 및 계통의 PCR 증폭산물은 QIAxcel Advenced System (Qiagen, Germany)을 이용하여 확인하였다.
유연관계 분석
각각의 SNP primer에 대한 상기의 PCR 과정을 primer 별 로 2회 반복 실험하여 재현성이 확인된 primer를 이용하였다.
시험품종 및 계통의 유연관계 분석을 위해 다형성을 보이는 밴드를 하나의 유전자좌(locus)로 취급하여 밴드의 유무에 따 라 밴드가 있는 경우는 ‘1’, 밴드가 없는 경우는 ‘0’으로 하여 유전자형분석과 data matrix를 작성하였다. 품종 및 계통 간
유전적 유사도 분석은 R program (v.3.6.3, R Foundation for Statistical Computing, Viennea, Austria)의 cluster package를 이용하여 감의 유전형 데이터를 표준화하고 Hierarchical clus- tering[17]을 통해 분석하였다.
결과 및 고찰
SNP 마커 PCR조건 확인
총 19개의 SNP primer 들을 이용한 마커 분석을 통해 떫은 감뿐만 아니라 단감 품종에 적용하여 SNP primer 들의 사용 가능성을 검토하고자 하였다. 불완전단감 품종으로는 단감연 구소에서 육성한 ‘자미시’(Jamisi, PVNA)와 ‘미감조생’(Mig- amjosaeng, PVNA), 대표적인 조생종 품종인 ‘서촌조생’(Ni- shimurawase, PVNA) 및 수분수로 재배되는 ‘선사환’(Zenji- maru, PVNA) 등을 포함한 20품종, 완전단감 품종으로는 신품 종 ‘Dannuri’, ‘Hongchoo’를 포함한 30품종 및 계통, 완전떫은 감 품종으로는 신품종 ‘Gamnuri’, 떫은감 대표 품종 ‘Sangju- dungsi’, ‘Cheongdo-Bansi’를 포함한 20품종, 불완전떫은감으 로는 ‘도근조생’(Tonewase, PVA)을 포함한 6품종을 선택하였 다(Table 1).
우리나라 고유 완전떫은감 품종으로부터 개발된 SNP pri- mer 들[8]의 PCR 조건을 확인하고자 ‘Sangjudungsi’의 DNA 를 이용하여 annealing 온도를 53℃, 53.3℃, 54.2℃, 55.4℃, 56.8℃, 58.2℃, 59.8℃, 61.2℃, 62.6℃, 63.8℃, 64.7℃, 65℃로 설정하여 1차 gradient PCR로 증폭 유무를 확인하였다. 그 결 과, 총 6개의 SNP primer (PerDaLK 5, PerDaLK 11, PerDaLK 13, PerDaLK 14, PerDaLK 21, PerDaLK 25)에서는 증폭이 되 지 않았다(Fig. 1). Jung 등[8]이 보고한 SNP primer 들의 결합 온도는 60℃이며, 생성물의 크기는 193 bp 내지 496 bp가 되도 록 제작되었다. Tm값이란 double strand DNA의 50%가 sin- gle strand DNA로 해리되는 온도(melting temperature)이다.
Primer가 주형 DNA에 annealing하여 신장반응을 시작하기 위해서는 annealing 온도를 primer의 Tm값 이하로 설정할 필 요가 있다. 그러나 온도를 너무 낮추면 비특이적인 annealing 이 일어나, 특이적인 증폭 효율이 저하된다[9]. 그러므로 일반 적으로 PCR 산물을 전혀 얻지 못할 경우는 annealing 온도를 낮춰서 PCR 반응을 하기에 ‘Sangjudungsi’의 DNA를 이용하 여 annealing 온도를 45℃, 45.3℃, 46.2℃, 47.4℃, 48.8℃, 50.2
℃, 51.8℃, 53.2℃, 54.6℃, 55.8℃, 56.7℃, 57℃로 설정하여 2차 gradient PCR로 증폭 유무를 확인하였다. 이 결과에서도 총 6개의 SNP primer (PerDaLK 5, PerDaLK 11, PerDaLK 13, PerDaLK 14, PerDaLK 21, PerDaLK 25)에서 증폭이 되지 않 았다(Fig. 2).
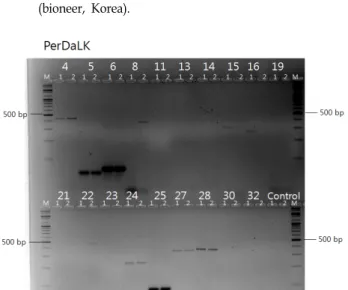
보다 정확한 검증을 위해 ‘부유’(Fuyu, PCNA)와 ‘Sangju- dungsi’의 DNA을 각 primer 별로 Jung 등[8]이 보고한 PCR 반응 조건인 annealing 온도를 60℃로 실제 적용하여 검토하
Fig. 1. Agarose gel images showing gradient PCR products amplified by SNP primer set ; PerDaLK 4, PerDaLK 5, PerDaLK 6, PerDaLK 8, PerDaLK 11, PerDaLK 13, PerDaLK 14, PerDaLK 15, PerDaLK 16, PerDaLK 19, PerDaLK 21, PerDaLK 22, PerDaLK 23, PerDaLK 24, PerDaLK 25, PerDaLK 27, PerDaLK 28, PerDaLK 30 and PerDaLK 32. The temperatures for each lane are 1 : 53℃, 2 : 53.3℃, 3 : 54.2℃, 4 : 55.4℃, 5 : 56.8℃, 6 : 58.2℃, 7 : 59.8℃, 8 : 61.2℃, 9 : 62.6℃, 10 : 63.8℃, 11 : 64.7℃, 12 : 65℃, M : 100 bp DNA plus ladder (bioneer, Korea).
였다. 그 결과에서도 총 6개의 SNP primer (PerDaLK 5, Per- DaLK 11, PerDaLK 13, PerDaLK 14, PerDaLK 21, PerDaLK 25)에서 밴드가 증폭되지 않았다(Fig. 3). Jung 등[8]에 의해 개발된 19종의 SNP primer 들은 대립유전자 특이적 중합효소 연쇄반응(Allele-specific PCR: AS-PCR)에 적합하도록 디자인 되었다. Allele-specific PCR은 유전자 증폭을 위하여 사용되는 primer 말단에 SNP가 위치하며, primer 말단에 인위적인 돌 연변이를 디자인하여 primer 끝(3’ end) 부분의 단일 염기가 결합되거나 또는 결합되지 못하는 특징을 이용함으로써 유전
자 증폭 산물의 형성 유무를 통해 개체별 SNP형을 확인하는 방법이다[8]. 물론 개발자가 제시한 PCR 조건을 정확히 재현 했을 때 의도한 결과가 도출되겠지만, gel based genotyping 방법에 의한 최적의 조건으로 PCR 반응 생성물의 유무를 확 인함으로써 SNP primer 들의 사용 가능성을 확인하기에는 충분할 것으로 판단하였다(Fig. 4).
선발 SNP 마커의 품종 적용 및 Hierarchical clustering 분석
Fig. 2. Agarose gel images showing gradient PCR products am- plified by SNP primer set ; PerDaLK 5, PerDaLK 8, PerDaLK 11, PerDaLK 13, PerDaLK 14 and PerDaLK 21 (PerDaLK 25 data not shown). The temperatures for each lane are 1 : 45℃, 2 : 45.3℃, 3 : 46.2℃, 4 : 47.4℃, 5 : 48.8
℃, 6 : 50.2℃, 7 : 51.8℃, 8 : 53.2℃, 9 : 54.6℃, 10 : 55.8℃, 11 : 56.7℃, 12 : 57℃, M : 100 bp DNA plus ladder (bioneer, Korea).
Fig. 3. Agarose gel image showing PCR products amplified by 19 SNP primer set. M: 100 bp DNA plus ladder (bioneer, Korea).
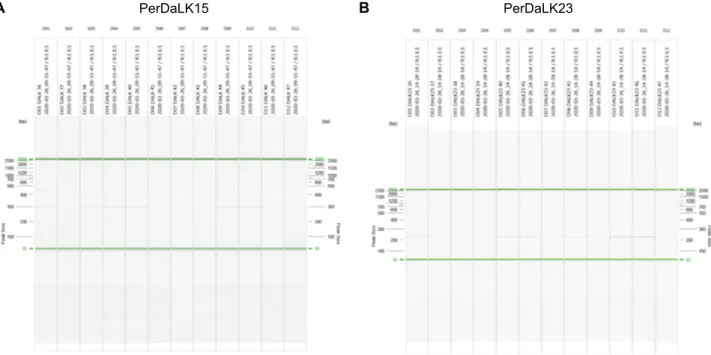
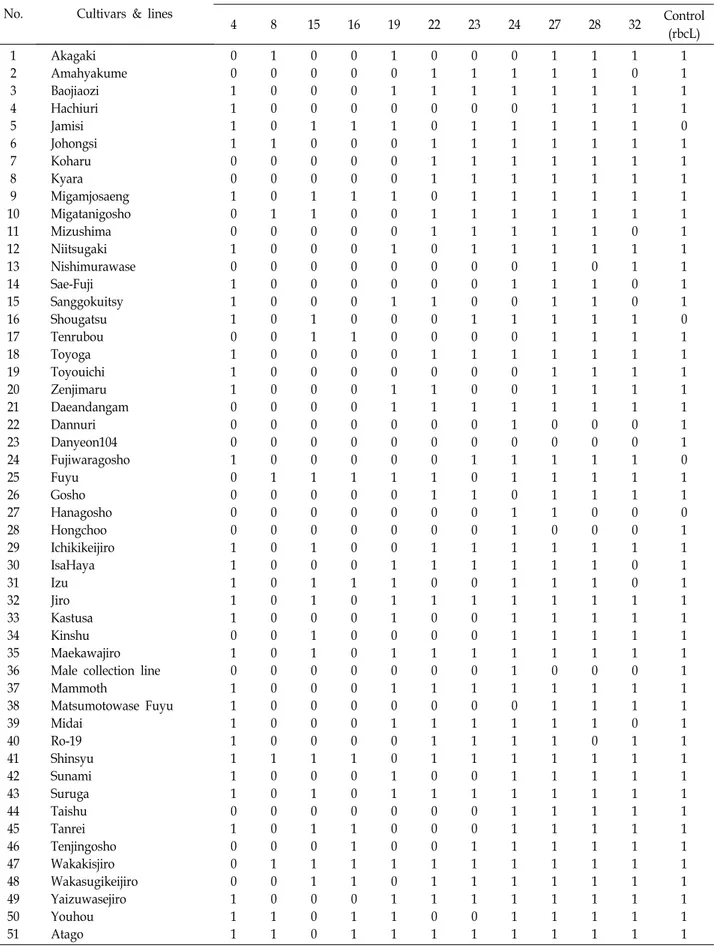
1, 2차 선발한 13개의 SNP primer 들을 76품종 및 계통에 적용하여 QIAxcel Advenced System (Qiagen, Germany)으로 자동전기영동 하였다(Fig. 5). 자동전기영동 분석 결과, SNP primer PerDaLK 6과 PerDaLK 30은 모든 품종 및 계통에서
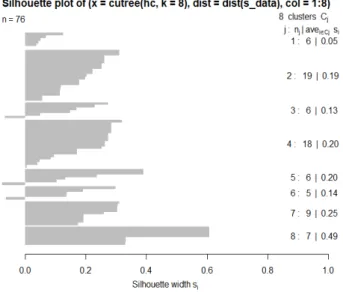
다형성이 확인되지 않아(data not shown) 제외하여 11개의 SNP primer 들을 최종 선발하였다. 본 실험의 전기영동 방식 으로는 분석이 매우 어려웠던 8개의 primer 를 제외한 11개의 SNP primer, 각각의 증폭되는 annealing temperature 및 생성 물 사이즈는 Table 2에 정리하였다. 밴드 형성 유무에 따라 밴드가 있으면 ‘1’, 없으면 ‘0’으로 표시하여 데이터를 정리하 였다(Table 3). 대립유전자의 유무를 R program (v.3.4.3, R Foundation for Statistical Computing, Viennea, Austria) 프 로그램에 입력하고 Ward. D2 방법에 준하여 유전적 유사도 값을 계산하였다[17]. 감의 유전형 데이터를 표준화하고 Hier- archical clustering을 통해 분석하였고, clustering의 품질 체크 는 R program에서 cluster packages 및 silhouette 함수를 사용 하여 분석하였다(Fig. 7). 최적의 실루엣 값을 갖는 클러스터 개수는 8개로 clustering 분석 시 반영하여 분석하였다.
총 441개의 PCR 밴드를 대상으로 품종 및 계통 간 유연관계 를 분석한 결과, 총 8개의 그룹으로 clustering 되었다. 최종 선발된 11개의 SNP primer 들을 76품종 및 계통에 적용하였 을 때, 9품종 및 계통이 포함된 7그룹(cluster)에서 ‘Dany- eon104’와 ‘대궁조생’(O-miyawase, PCA), PCNA type으로 수 꽃이 착생하는 ‘Male collection line’과 ‘Sangjudungsi’를 구분 할 수 없었고, 6품종이 포함된 1그룹(cluster)에서는 ‘괴산두리 감’(Goesan-Durigam, PCA)과 ‘고성따베감’(Gogseong-Taba- egam, PCA)을 구분할 수 없었다. 18품종이 포함된 4그룹 (cluster)에서는 ‘조생사사’(Wasezizya, PVA)와 ‘평핵무’(Hira- tanenashi, PVA), ‘하찌우리’(Hachiuri, PVNA), ‘동양일’
(Toyouichi, PVNA), 신품종 ‘Dannuri’와 ‘Haman-Bansi’, 신품 종 ‘Gamnuri’와 ‘사에후지’(Sae-Fuji, PVNA), ‘Taishu’, ‘Sun- ami’와 ‘양풍’(Youhou, PCNA)을 구분 할 수 없었다. 19품종이 포함된 2그룹(cluster)에서는 ‘대마반’(Damopan, PCA)과 ‘서 조’(Saijo, PCA), ‘감백목’(Amahyakume, PVNA)와 ‘수도’
(Mizushima, PVNA), ‘이사하야’(IsaHaya, PCNA)와 ‘어대 (Midai, PCNA)’, ‘천신어소’(Tenjingosho, PCNA)와 ‘San- cheong-Danseongsi’, ‘대안단감(Daeandangam, PCNA)’과 ‘소 진조생차랑(Yaizuwasejiro, PCNA)’, ‘풍강(Toyga, PVNA)’과
‘어부(Koharu, PVNA)’, ‘가라(Kyara, PVNA)’, ‘등원어소(Fuji- waragosho, PCNA)’와 ‘대핵무(O-tanenashi, PVA)’를 구분할 수 없었다. 또한 7품종이 포함된 8그룹(cluster)에서는 ‘약목차 랑’(Wakakisjiro, PCNA)와 ‘준하’(Suruga, PCNA), ‘차랑’(Jiro, PCNA), ‘전천차랑’(Maekawajiro, PCNA)를 구분 할 수 없었 다(Fig. 6). 결과적으로 최종 선발한 11개의 SNP primer 들을 76품종 및 계통에 적용했을 때 38품종 및 계통은 구분 할 수가 없었고, 탈삽형질로 분류하면 PVNA 8품종, PCNA 18품종 및 계통, PCA 9품종, PVA 3품종이었다. Clustering의 품질 체크 를 위해 76품종 및 계통에 대한 cluster 각각의 S(i)값을 확인하 였고, 전체 평균 S값만 보면 0.5 미만이므로 어느 정도 잘못된 clustering을 했다고 해석된다(Fig. 7). 이는 최종 선발된 11개
A PerDaLK15 B PerDaLK23
Fig. 4. Agarose gel images showing the single nucleotide polymorphism (SNP) markers, PerDaLK 15 (A) and PerDaLK 23 (B) in cultivars and lines. M, 100 bp DNA plus ladder (bioneer, Korea).
A PerDaLK15 B PerDaLK23
Fig. 5. QIAxcel Advenced System gel images showing the single nucleotide polymorphism (SNP) markers, PerDaLK 15 (A) and PerDaLK 23 (B) in cultivars and lines.
의 SNP primer들을 76품종 및 계통에 적용했을 때 50%에 해 당하는 38품종 및 계통을 구분할 수가 없었던 결과로 인해 도출된 결과로 판단된다.
유럽, 일본 및 국내 감 품종을 대상으로 품종 판별에 유용하 게 사용될 수 있는 것을 확인한 20개의 SSR primer [14]를 48품 종에 적용한 결과 ‘Cheongdo-Bansi’와 ‘Gyeongsan-Bansi’만 구분이 불가능하였다. 또한, 감 수집 계통과 표현형질이 유사 한 주요 재배품종과의 차별성을 확인 결과[16]에서도 ‘Jiro’과
‘Jiro’의 아조변이지로 발견된 ‘Maekawajiro’만 구분이 불가능 하였다. 품종보호를 위한 품종 특이적 마커로 효율적으로 사 용될 수 있음을 확인한 SSR primer 들을 신품종 ‘Gamnuri’,
‘Dannuri’, ‘Hongchoo’에 적용하여 검토하였을 때 ‘Gamnuri’,
‘Dannuri’, ‘Hongchoo’는 각각 구분되는 것을 확인하였다 (data not shown). SSR primer 적용 결과와 마찬가지로 최종 선발된 11개의 SNP primer 들을 76품종 및 계통에 적용한 결과에서도 ‘Jiro’와 ‘Maekawajiro’는 구분이 불가능하였지만,
Table 2. Observed Tm value among 76 accessions revealed by 11 SNP primer sets Primer namez Primer sequence (5‘-3’) Expected size
(bp)
Expected Tm
Observed size (bp)
Observed Tm PerDaLK 4 F : tatttaaagcttcattggccctc
R : tcactactgatgactagatcaatcgatc 441 60 443-463 58
PerDaLK 8 F : gctgtcccacacgctaagagtc
R : agtttacaagtgattgcaaagcagg 374 60 361-393 58
PerDaLK 15 F : ataatgttgagaaatttgcgttttg
R : acacactcgagtacacgggtgac 307 60 296-301 53
PerDaLK 16 F : aagcaattattccatgcaaccac
R : ttgctagaatttatcacatctaccacc 275 60 272-278 58
PerDaLK 19 F : atagaagacttgcaaggcacttgac
R : atgaaaggaaaaatagagaaaatggag 458 60 454-470 54
PerDaLK 22 F : tgatcttcccctttcatgcg
R : tagacgaacagacagacagaacagac 468 60 461-487 54
PerDaLK 23 F : accatcagaacagtagtgccagatatg
R : tagacgaacagacagacagaacagac 226 60 227-235 53
PerDaLK 24 F : tggttgcattattaaatcggcatg
R : tggatgagaaagcaattttggg 225 60 227-233 56
PerDaLK 27 F : aatcacctccaaatccggc
R : acggcagtttatgtggttttttc 341 60 344-353 55
PerDaLK 28 F : gctttccaggggcgatagtc
R : agccaaaaacactctactccttgaag 351 60 354-370 56
PerDaLK 32 F : tcatataaatctgtccatgtatacgaaagac
R : tgcccagatttagcagctttc 193 60 197-203 50
Control (rbcL) F : tcttcatatccaccgtgcaa
R : agcagctaattcaggactcc 500 60 473-518 53
z)Source: Jung et al. (2018)
7 1 4 2 6 8 3 5
Fig. 6. Hierarchical Clustering of 76 persimmon cultivars and collection lines (D. kaki Thunb.) based on 11 SNPs.
‘Cheongdo-Bansi’와 ‘Gyeongsan-Bansi’는 구분이 가능 하였 다. SNP primer 들의 단감 신품종 적용 결과만을 보면, ‘Gam- nuri’, ‘Dannuri’, ‘Hongchoo’ 뿐만 아니라 ‘Jamisi’와 ‘Migam-
josaeng’ 품종을 동시에 구분할 수 있어, 단감 신품종 판별에도 충분히 활용 가능할 것으로 판단된다. 본 연구에 최종 선발된 11개의 SNP primer들은 76품종 및 계통에 적용했을 때 50%에
Table 3. Results of electrophoresis using 11 SNP primers by QIAxcel Advenced System (Qiagen, Germany)
No. Cultivars & lines
Primer PerDaLK
4 8 15 16 19 22 23 24 27 28 32 Control
(rbcL) 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51
Akagaki Amahyakume Baojiaozi Hachiuri Jamisi Johongsi Koharu Kyara Migamjosaeng Migatanigosho Mizushima Niitsugaki Nishimurawase Sae-Fuji Sanggokuitsy Shougatsu Tenrubou Toyoga Toyouichi Zenjimaru Daeandangam Dannuri Danyeon104 Fujiwaragosho Fuyu
Gosho Hanagosho Hongchoo Ichikikeijiro IsaHaya Izu Jiro Kastusa Kinshu Maekawajiro Male collection line Mammoth
Matsumotowase Fuyu Midai
Ro-19 Shinsyu Sunami Suruga Taishu Tanrei Tenjingosho Wakakisjiro Wakasugikeijiro Yaizuwasejiro Youhou Atago
0 0 1 1 1 1 0 0 1 0 0 1 0 1 1 1 0 1 1 1 0 0 0 1 0 0 0 0 1 1 1 1 1 0 1 0 1 1 1 1 1 1 1 0 1 0 0 0 1 1 1
1 0 0 0 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 1 1
0 0 0 0 1 0 0 0 1 1 0 0 0 0 0 1 1 0 0 0 0 0 0 0 1 0 0 0 1 0 1 1 0 1 1 0 0 0 0 0 1 0 1 0 1 0 1 1 0 0 0
0 0 0 0 1 0 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 1 0 0 0 1 1 1 1 0 1 1
1 0 1 0 1 0 0 0 1 0 0 1 0 0 1 0 0 0 0 1 1 0 0 0 1 0 0 0 0 1 1 1 1 0 1 0 1 0 1 0 0 1 1 0 0 0 1 0 1 1 1
0 1 1 0 0 1 1 1 0 1 1 0 0 0 1 0 0 1 0 1 1 0 0 0 1 1 0 0 1 1 0 1 0 0 1 0 1 0 1 1 1 0 1 0 0 0 1 1 1 0 1
0 1 1 0 1 1 1 1 1 1 1 1 0 0 0 1 0 1 0 0 1 0 0 1 0 1 0 0 1 1 0 1 0 0 1 0 1 0 1 1 1 0 1 0 0 1 1 1 1 0 1
0 1 1 0 1 1 1 1 1 1 1 1 0 1 0 1 0 1 0 0 1 1 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1
1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 1 1 1 1 0 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 0 0 1 1 1 0 0 1 1 1 1 1 1 1 0 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1
1 0 1 1 1 1 1 1 1 1 0 1 1 0 0 1 1 1 1 1 1 0 0 1 1 1 0 0 1 0 0 1 1 1 1 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1
1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
Table 3. Continued
No. Cultivars & lines
Primer PerDaLK
4 8 15 16 19 22 23 24 27 28 32 Control
(rbcL) 52
53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76
Cheongdo-Bansi Damopan Gamnuri Goesan-Durigam Goseong-Tabaegam Gyeongsan-Bansi Haman-Bansi Haman-Mulgam Miryang Muan Myeongju-Kojongsi O-miyawase Saijo
Sancheong-Danseongsi Sancheong-Kojongsi Sanggam-Dungsi Sangjudungsi Suhong Wasesaijo
Yeongdong-Weolhasi Hiratanenashi O-tanenashi Sugitawase Superhiratanenashi Tonewase Wasezizya
1 0 0 0 1 1 0 0 1 0 1 1 1 1 1 0 0 1 1 0 1 1 1 1 0
0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 1 1 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0
1 0 0 0 0 0 0 0 1 1 0 0 1 1 1 0 1 0 0 0 0 0 0 0 0
0 1 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0
0 1 0 0 0 0 0 0 1 1 0 1 0 0 0 0 1 0 0 0 0 1 0 1 0
1 1 0 1 1 1 0 0 1 1 0 1 1 1 0 0 0 1 0 0 1 1 0 1 0
1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 0 1 1 1 0 1 1 0 0 0
0 1 0 1 1 0 1 1 1 0 0 1 1 0 1 0 1 1 0 1 1 1 1 1 1
0 0 1 1 1 0 1 1 1 0 0 0 1 0 1 0 0 1 0 1 1 1 0 1 1
0 0 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
1 1 1 0 0 1 1 1 1 1 0 1 1 1 1 0 1 1 1 1 1 1 0 1 1
Fig. 7. Silhouette plot of 76 persimmon cultivars and collection lines (D. kaki Thunb.) based on 11 SNPs.
해당하는 38품종 및 계통을 구분할 수가 없었고, 불완전단감 과 완전단감을 포함한 단감 50품종 및 계통 중 26품종 및 계통
을 구분할 수가 없었다. 76품종 및 계통을 구분하기 위해 적용 한 SNP primer의 수가 적은 것은 분명하다. 앞으로 단감 품종 을 구분하기 위해서는 더 많은 SNP primer들의 개발이 필요 하며, 마커 개발에 필수적인 6배체인 단감의 유전체 연구 또한 지속적으로 이루어져야 할 것이다.
The Conflict of Interest Statement
The authors declare that they have no conflicts of interest with the contents of this article.
References
1. Cho, D. H., Chun, I. J., Kwon, S. T., Song, Y. S. and Chou, Y. D. 2007. Genetic relationships of Korean astringent per- simmon varieties using AFLP analysis. Kor. J. Hort. Sci.
Technol. 25, 114-118.
2. Cho, K. H., Cho, K. S., Han, J. H., Kim, H. R., Shin, I. S., Kim, S. H., Chun, J. A. and Hwang, H. S. 2013. Development of sequence characterized amplified region markers for cul- tivar identification in Persimmon. Kor. J. Hort. Sci. 31, 798- 806.
3. Heo, Y. Y., Jung, S. M., Kim, J. H., Nam J. C., Park, J. K., Kim, S. J. and Kim, H. I. 2018. SNP markers for determi- nation of grape cultivars and use thereof. Korea patent 10-2016-0153804.
4. Hong, J. H., Shim, E. J., Yoon, M. K. and So, E. H. 2016.
A method for identifying pear varieties using microsatellites markers. Korea patent 10-2016-0060384.
5. Hume, H. H. 1914. A kaki classification. J. Hered. 5, 400-406.
6. Je, H. J., Park, Y. O., Kim, S. C., Hwang, J. H., Lee, Y. J., Son, B. G. and Park, Y. H. 2009. Evaluation of genetic rela- tionships among persimmon cultivars introduced and in- digenous in Korea using RAPD. Kor. J. Hort. Technol. 27, 448-455.
7. Jung, J. K. and Lee, S. I. 2018. Methods and kit for identify- ing variety of blueberry using single nucleotide polymor- phism markers. Korea patent 10-2016-0163906.
8. Jung, J. K. and Lee, S. I. 2018. Methods and kit for identify- ing variety of persimmon using single nucleotide poly- morphism markers. Korea patent 10-2017-0018959.
9. Karl, H. H. and Kenneth, H. R. 1996, High and low anneal- ing temperatures increase both specificity and yield in Touchdown and Stepdown PCR. BioTechniques 20, 478-485.
10. Kikuchi, A. 1948. Pomology-Part Ⅰ. (in Japanese), pp 34- 400, Yokendo, Tokyo.
11. Kim, D. I., Lee, M. K., Han, H. D., Kim, G. S., Oh, S. W., Hwang, K. D., Ahn, S. J., Kim, J. Y., Oh, Y. J., Oh, S. I., Park, S. Y., Oh, M. M. and Shin, H. S. 2018. CAPS markers for discriminating of apple cultivars and uses thereof. Korea patent 10-2017-0065990.
12. Kim, E. G., Choi, S. T., Son, J. Y., Ahn, G. H., Kim, S. C.
and Hong, K. P. 2018. Breeding of the Gamnuri (Diospyros kaki Thunb.) cultivars for astringent persimmon with large- sized quality fruits. Kor. J. Breed. Sci. 50, 340-343.
13. Korea Seed & Variety Service. 2020. http://www.seed.go.kr 14. Naval, M., Zuriaga, E., Pecchioli, S., Llacer, G., Giordani,
E. and Badenes, M. L. 2010. Analysis of genetic diversity among persimmon cultivars using microsatellite markers.
Tree Genet. Genomes 6, 677-687.
15. Park, Y. H., Hwang, J. H., Park, Y. O., Kim, S. C., Lee, Y.
J., Kang, J. S., Choi, Y. W. and Son, B. G. 2010. Evaluation of genetic diversity among persimmon cultivars (Diospyros kaki Thunb.) using microsatellite markers. J. Life Sci. 20, 632-638.
16. Park, Y. O., Park, D. S., Son, J. Y., Choi, S. T., Kim, S. C., Hong, G. P. and Park, Y. H. 2012. Evaluation of genetic di- versity among persimmon (Diospyros kaki Thunb.) collection lines and cultivars using simple sequence repeat markers.
Kor. J. Breed. Sci. 44, 127-135.
17. R Project for Statistical Computing. 2020. http://www.r- project.org
18. Soriano, J. M., Pecchioli, S., Romero, C., Vilanova, S., Llacer, G., Giordani, E. and Badenes, M. L. 2006. Development of microsatellite markers in polyploidy persimmon (Diospyros kaki L) from an enriched genomic library. Mol. Ecol. Notes 6, 368-370.
19. Yamagishi, M., Matsumoto, S., Nakatsuka, A. and Itamura, H. 2005. Identification of persimmon (Diospyros kaki) culti- vars and phenetic relationships between Diospyros species by more effective RAPD analysis. HortScience 105, 283-290.
20. Yonemori, K., Kanzaki, S., Honsho, C., Akagi, T. and Parfitt, DE. 2008a. Phylogeny and cultivar development of Dio- spyros kaki: a survey based on molecular analyses. Adv.
Hortic. Sci. 22, 261-268.
21. Yonemori, K., Honsho, C., Kitajima, A., Aradhya, M., Gior- dani, E., Bellini, E. and Parfitt, D. E. 2008b. Relationship of European persimmon (Diospyros kaki Thunb.) cultivars to Asian cultivars characterized using AFLPs. Genet. Resour.
Crop Ev. 55, 81-89.
22. Yonemori, K., Honsho, C., Kanzaki, S., Ino, H., Ikegami, A., Kitajima, A., Sugiura, A. and Parfitt, D. E. 2008c. Sequence analyses of the ITS regions and the matK gene for determin- ing phylogenetic relationships of Diospyros kaki (persimmon) with other wild Diospyros (Ebenaceae) species. Tree Genet.
Genomes 4, 149-158.
초록:단감 품종 판별을 위한 single nucleotide polymorphism 마커 적용 검정
박여옥1,3*․최성태1․손지영1․김은경1․안광환1․박지혜1․정완규1․장영호2․김동완3
(1경상남도농업기술원 단감연구소, 2경상남도농업기술원, 3창원대학교 생명보건학부)
최근 next-generation sequencing technology의 발달로 유전체 분석 사례는 증가하고 있으나, 단감에 있어 적용 가능한 Single Nucleotide Polymorphism (SNP) 마커 및 적용 결과는 거의 없는 실정이다. 이에 우리나라 고유 떫은감 5품종으로부터 개발된 SNP primer 들을 단감 품종에 적용하여 사용 가능성을 검증하고자 수행하였다.
Jung 등에 의해 개발된 19개 SNP primer들의 PCR 조건을 확인 한 후 본 실험의 전기영동 방식으로는 분석이 매우 어려웠던 8개의 primer를 제외한 11개의 SNP primer들을 최종 선발하였다. 1, 2차 검증을 통해 최종 선발된 11개의 SNP primer 들을 76품종 및 계통(불완전단감 20, 완전단감 30, 완전떫은감 20, 불완전떫은감 6)에 적용한 결과 38품종 및 계통(불완전단감 8, 완전단감 18, 완전떫은감 9, 불완전떫은감 3품종)은 각 품종 및 계통 간 구분을 할 수가 없었다. 그러나 최종 선발된 11개의 SNP primer 들을 신품종에 적용한 결과만를 보면 ‘감누리’, ‘단누리’,
‘홍추’와 ‘자미시’, ‘미감조생’을 동시에 구분할 수 있어 단감 신품종 판별을 위한 특이적 마커로 사용될 수 있을 것으로 판단된다.