Correspondence to:Hack-Ki Kim, M.D.
Department of Pediatrics, College of Medicine, The Catholic University of Korea
62, Yeouido-dong, Yeongdeungpo-gu, Seoul 150-713, Korea Tel: +82-2-3779-1025, Fax: +82-2-783-2589
E-mail: kimhk@catholic.ac.kr
접수:2006년 7월 3일, 수정:2006년 8월 7일 승인:2006년 9월 13일
교신저자:김학기, 서울시 영등포구 여의도동 62
150-713, 가톨릭대학교 의과대학 성모병원 소 아과
Tel: 02-3779-1025, Fax: 02-783-2589 E-mail: kimhk@catholic.ac.kr
주조직적합항원 불일치 마우스 조혈모세포이식에서 중간엽줄기세포주가 이식편대 숙주병과 생존율에 미치는 영향
가톨릭대학교 의과대학 소아과학교실, 1내과학교실
최상림․이대형․정대철․황희승․정낙균․조 빈․한치화1․김학기
Survival and Graft versus Host Disease in Murine MHC Mismatched Hematopoietic Stem Cell Transplantation with Co-injection of
Mesenchymal Stem Cells
Sangrhim Choi, M.D., Dae Hyeoung Lee, M.D., Dae-Chul Jeong, M.D., Hui-Sung Hwang, M.D., Nack-Gyun Chung, M.D.,Bin Cho, M.D., Chi-Wha Han, M.D.1 and Hack-Ki Kim, M.D.
Departments of Pediatrics, 1Internal Medicine, College of Medicine, The Catholic University of Korea, Seoul, Korea
Background: Intravenous injection of mesenchymal and hematopoietic stem cells (MSCs, HSCs) has the disadvantages of low delivery rate to bone marrow and sequestration of cells in the lung and liver.
This study was designed to determine whether there is a relationship between the administration route and dosage of stem cells and GVHD and survival.
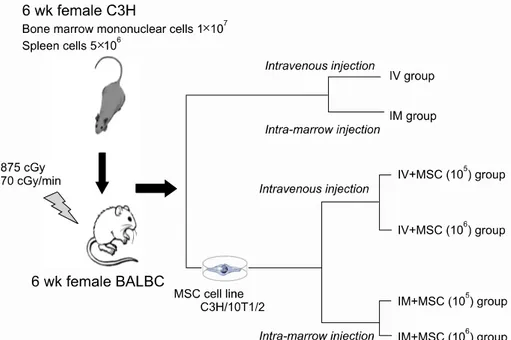
Methods: MSCs were retrieved from five subcultured C3H/10T1/2, cell lines from C3H/He mice. HSCs were transplanted by injecting 1×107 of bone marrow mononuclear cells and 5×106 of spleen cells from six to eight week old female C3H/He mice into six week old irradiated female BALB/c mice. The groups were divided into intravenous injection (IV) and intra-marrow (IM) injection groups. IV and IM+MSC groups consisted of mice transplanted with the same bone marrow mononuclear cells and SP, IV and IM groups, with the additional co-injection of 1×106 MSCs.
Results: Evaluation of all mice, in both groups, showed no difference in GVHD and survival. However, high dose injection with 1×106 MSCs led to a decreased incidence of GVHD (P<0.05) and improved survival (P<0.01) in both groups.
Conclusion: The results of this study showed that the positive effects of MSC on GVHD and survival were primarily dependent on the number of injected cells. (Korean J Hematol 2006;41:250-258.)
Key Words: Graft versus host disease, Mesenchymal stem cell, Route, Dosage
250 서 론
조혈모세포이식(hematopoietic stem cell transplanta- tion)의 궁극적인 목표는 거부반응이나 이식편대숙주
병(graft versus host disease, GVHD)이 없이 조혈모세 포의 생착을 극대화시켜 조기에 완전한 공여자 chi- merism을 형성하고 생존율을 향상시키는 것이다. 이와 같은 목표를 성취하고 조혈모세포이식 과정에서 나타 나는 여러 합병증을 감소시키기 위해서 현재까지 다양
한 방법이 시도되었으며 많은 발전이 이루어지고 있으 나, 거부반응과 이식편대숙주병의 발생은 여전히 이식 후의 이환율과 사망률을 증가시키는 주된 면역학적 합 병증이다.
이식된 조혈모세포가 생착되어 조혈작용을 시작하 기 위해서는 조혈모세포가 증식하고 분화하기 전에 먼 저 적절한 골수 내 미세환경으로 이주하여야 한다.1) 이를 촉진하기 위해서 중간엽줄기세포(mesenchymal stem cell)와 조혈모세포를 함께 수혜자에게 이식하는 방법이 시도되었다. 이 방법을 사용한 후 기존의 조혈 모세포를 단독 이식한 경우보다 조혈모세포의 골수 내 생착이 촉진되어 조기에 조혈작용이 나타났다.2-4) 이 러한 효과는 기존의 여러 화학제의 병용투여와 방사선 치료로 손상받은 골수 내 미세환경에 이식된 공여자의 중간엽줄기세포가 골수 내 미세환경을 형성하는 기질 세포(stromal cell)로 분화하고, 이 기질세포가 조혈모 세포의 증식과 분화를 촉진하여 이식 후 조혈기능의 회복을 촉진시키며, 여러 가지 싸이토카인을 분비하여 골수에 남아있던 수혜자 T세포의 증식을 가역적으로 억제함으로써 발생하는 면역학적 관용 등에 기인한다 고 추측되고 있다.
중간엽줄기세포는 주조직적합항원 class I 분자를 표 현하지만 공동자극분자(costimulatory molecule)를 표 현하지 않는 면역학적 특징으로 인하여 동종 T세포의 무반응(anergy)을 유도한다.5) 그러나 골수단핵세포를 혈관 내로 주입하면 중간엽줄기세포의 대부분이 폐에 포획되어 실제로 골수로 생착되는 수가 적었으며, 공 여자의 조혈모세포도 대부분 간에서 포획되어 골수에 도달하는 세포수가 감소하기 때문에, 고식적인 혈관 내 주입의 경우 많은 수의 중간엽줄기세포와 조혈모세 포가 폐와 간에 포획되는 문제점이 있다.6,7) 또한 체외 배양된 중간엽줄기세포는 골수로의 이주 능력이 결여 되어 있어 효과가 제한받을 가능성이 크다.8) 이러한 한계점을 극복하기 위하여 손상된 각 기관으로 직접 줄기세포를 주사하는 방법이 시도되고 있으며,9,10) 조 혈모세포이식에서도 골수 내로 직접 골수단핵세포를 주입함으로써 중간엽줄기세포와 조혈모세포의 손실을 최소화하여 이식편의 조기생착을 성공적으로 유도하 였다는 보고들이 있었다.11,12) 저자는 조혈모세포의 주 입경로와 중간엽줄기세포의 혼합주입이 급성 이식편 대숙주병과 단기간의 생존율에 미치는 영향을 평가하 고자 급성 이식편대숙주병의 발생이 뚜렷하며 이것이 직접적으로 단기간의 생존에 영향을 미치는 주조직적 합불일치 마우스 모델을 사용하였다. 골수단핵세포를
골수 내로 직접 주사하면 골수단핵세포에 포함되어 있 는 소수의 중간엽줄기세포가 수혜자의 골수에 머무르 며 T세포를 억제하고 결과적으로 혈관 내 조혈모세포 이식 방법보다 이식편대숙주병을 감소시키고 생존율 을 증가시킬 수 있는가를 알아보고, 중간엽줄기세포의 투여와 주입된 세포 수에 따른 효과도 확인하고자 본 연구를 시행하였다.
대상 및 방법
1. 실험동물
생후 6주의 암컷 C3H/He (H-2k, donor)마우스와 암 컷 BALB/c (H-2d, recipient) 마우스(The Jackson La- boratory, Bar Harbor, ME)를 무균 사육기에서 멸균된 사료와 물을 주면서 사육하였고 실험하기 최소 1주일 전부터 적응시켰다.
2. 중간엽줄기세포주의 확인
C3H/He 마우스 중간엽줄기세포주인 C3H/10T1/2를 ATCC (Rockville, MD, USA)에서 구입하여 사용하였 다. 세포를 10% fetal bovine serum을 첨가한 RPMI 1640 배양액(GIBCO Invitrogen, Carlsbad, CA)으로 75cm2 flasks (Costar, Cambridge, MA)에서 배양하였 다. 1~2일 후에 세포 수를 확인하고 flask 바닥에 부착 된 세포들을 0.25% trypsin (GIBCO Invitrogen)으로 37oC에서 3분간 처리하여 수확한 후 75cm2 flask에 재 부양시켰으며 배지를 바꾸어 37oC, 5% CO2의 조건에 서 세포배양기에서 배양했다. 다섯 차례의 계대배양 후에 부착된 기질세포를 trypsin으로 처리하여 중간엽 줄기세포를 수집하였다. 수집된 중간엽줄기세포를 B220, CD3, Sca-1, CD56과 MAC-3 (BD PharMingen Co., Mountain View, California)에 대한 FITC와 PE가 부착된 항체를 이용하여 염색하였으며, 염색된 세포는 FACScan laser flow cytometry system (Becton Dic- kinson, Mountain View, CA), Macintosh PowerMac G3 personal computer (Apple Computer, Cupertion, CA)와 Cell Quest (Becton Dickinson) software를 이용하여 분 석하였다.
3. 마우스 비장세포와 골수단핵세포의 채취 마우스의 비장세포와 골수단핵세포를 채취하기 위 해 C3H/He 마우스를 경추 탈골법으로 도살한 후 무균 적으로 비장, 대퇴골과 경골을 분리하여 기존에 알려 진 방법대로 비장세포와 골수단핵세포를 채취하여
Fig. 1. The schematic diagram of MHC mismatched murine hematopoietic stem cell trans- plantation experimental model (MSC, mesenchymal stem cell;
IV, intravenous injection; IM, int- ra-marrow injection).
trypan blue로 염색하여 세포의 수와 생존율을 확인하 였다.13,14)
4. 마우스 조혈모세포이식과 골수 내 주사방법 선형가속기(VarianⓇ, Clinac 6 MV/100, Palo Alto, CA)를 사용하여 암컷 BALB/c마우스(H-2d, 수혜자) 전 신에 70cGy/min의 조사속도로 875cGy의 방사선을 조 사하였다. 방사선 조사 4시간 이내에 6주 연령의 암컷 BALB/c 마우스에게 암컷 C3H/He 마우스(H-2k, 공여 자)로부터 얻은 1×107개의 골수단핵세포와 5×106개 의 비장세포를 꼬리 정맥 내 주입군(IV군, n=6)과 골 수 내 주입군(IM군, n=8)으로 나누어 주사하였다. 골 수 내 주사 방법은 기존에 알려진 방법대로, 마우스의 우측 슬관절을 완전히 굴곡시키고 슬관절 부위의 대퇴 골을 통해 26게이지 바늘로 골수강 내로 주입하였 다.12)
C3H/He 마우스 중간엽줄기세포주를 이용한 실험방 법에 따라, IV+MSC (105)군(n=7)은 C3H/He 마우스의 1×107개의 골수단핵세포와 5×106개의 비장세포 그 리고 1×105개의 중간엽줄기세포를 함께 정맥 내 주사 하였다. IV+MSC (106)군(n=6)은 동일한 골수단핵세 포, 비장세포와 함께 1×106개의 중간엽줄기세포를 정 맥 내로 주사하였다. IM+MSC (105)군(n=7)은 1×107 개의 골수단핵세포와 5×106개의 비장세포 그리고 1×105개의 중간엽줄기세포를 골수 내로 주사하였고, IM+MSC (106)군(n=6)은 동일한 골수단핵세포, 비장 세포와 함께 1×106개의 중간엽줄기세포를 골수 내 주
사하였다(Fig. 1).
5. 이식편대숙주병의 중증도 평가
이식편대숙주병의 진행 정도는 매일 마우스를 관찰 하여 체중 감소, 털의 상태, 자세, 활동 정도, 발이나 꼬리 부위의 피부 변화에 대한 각각의 점수를 매기는 임상점수체계를 사용하여 평가하였고, 각 항목마다 0~2점씩 점수를 기록하였다.15) 일부의 마우스의 피부 와 소장 조직을 이식 후 4일과 8일에 채취하여 10% 완 충 포르말린에 보관 후 파라핀에 고정하여 5μm 두께 로 잘라 hematoxylin과 eosin으로 염색하여 병리 조직 을 광학현미경으로 확인하였다.
6. 통계분석
Kaplan과 Meier 방법을 이용하여 생존율을 평가하 고, 생존 곡선의 비교는 log-rank test로 하였다. 이식편 대숙주병의 범위와 중등도는 General repeated mea- sured ANOVA를 이용하여 분석하였다. 각 군 사이의 값의 차이를 평가하기 위해서 paired date (2-tail) stu- dent t-test를 이용하였다.
결 과
1. 중간엽줄기세포주의 특성
실험에 이용된 C3H/10T1/2 세포주는 광학현미경에 서 형태학적으로 섬유아세포처럼 보였으며, 유세포검 사에서 Sca-1-PE와 H-2k-PE의 염색에서 양성을 보였
Fig. 2. The severity and pattern of GVHD progression in the experimental group (BALB/c mouse, donor; C3H/He mouse, recipient) using GVHD scoring system of Cooke’s. There is no severe GVHD in all groups and no statistical significance (P>0.05). (IV group, 1×107 bone marrow mononuclear cells and 3×107 spleen cells intravenously co-injection; IV+MSC group, IV group+1×106 MSC intravenously co-injection; IM group, 1×107 bone marrow mononuclear cells and 3×107 spleen cells intra-marrow co-injection; IM+MSC group, IM group+1×106 MSC intra-marrow co-injection). MSC, mesenchymal stem cell.
Fig. 3. Skin and small intestine pathology in BALB/c mouse on 4 days and 8 days after allogenic hematopoietic stem cell transplantation (H&E stain). Skin and small intestine were harvested and prepared for microscopic analysis as described in materials and methods. Interstitial inflammation is observed involving epithelium, mucosae, vessels, parenchyma, and luminal structures on the post transplantation 8 day comparing to the 4th day. Predominantly mononuclear infiltrates and destructions of mucosae and epithelium are also observed.
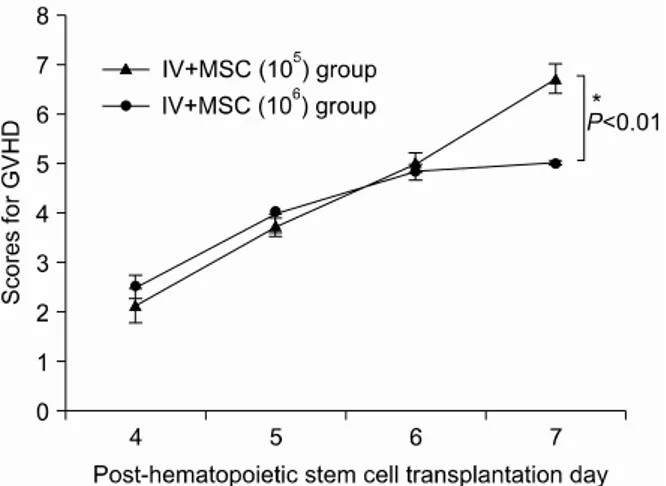
Fig. 4. The severity and pattern of GVHD progression in the intravenous mesenchymal stem cell co-injection hema- topoietic stem cell transplantation experimental group. High dose MSC group shows a statistically significant lower GVHD scores from post-hematopoietic stem cell trans- plantation day 7 onwards compared with the other group (*P<0.05). All data were shown mean±SD. (IV+MSC (105) group (n=7), 1×107 bone marrow mononuclear ce- lls+5×106 spleen cells+1×105 MSC; IV+MSC (106) group (n=6), 1×107 bone marrow mononuclear cells+5×106 spleen cells+1×106 MSC).
Fig. 5. Survival in BALB/c mice in intravenous mesenchy- mal stem cell co-injection hematopoietic stem cell trans- plantation experimental group. Whilst all mice in IV+MSC (105) group died in post-transplantation day 8, 4 mice in high dose MSC group survived until post-transplantation day 14, showing improved survival compared with the other group (P<0.01). (IV+MSC (105) group (n=7), 1×107 bone marrow mononuclear cells+5×106 spleen cells+
1×105 MSC; IV+MSC (106) group (n=6), 1×107 bone mar- row mononuclear cells+5×106 spleen cells+1×106 MSC).
고 B220, CD3와 CD56, Mac-3를 표현하지 않았다.
2. 조혈모세포이식에서 배양된 BALB/c 마우스(공여 자)의 중간엽줄기세포를 C3H/He 마우스(수혜자) 에 혼합 주입한 후의 이식편대숙주병과 생존율 BALB/c 마우스의 골수단핵세포와 비장세포를 정맥 내로 주사한 IV군과 중간엽줄기세포와 함께 정맥 내로 주사한 IV+MSC군, 그리고 경로를 달리하여 골수 내로 직접 주사한 IM군과 IM+MSC군으로 나누어 실험하였 다. 네 군 간의 이식편대숙주병은 이식 후 6일까지 점 수의 차이가 없었고(P>0.05), 점수 7 이상의 중증 이 식편대숙주병도 발생하지 않았다. 생존율에서도 차이 가 없어(P>0.05) 중간엽줄기세포의 효과를 평가할 수 없었다. 따라서 급성 이식편대숙주병을 뚜렷하게 발생 시키기 위하여 공여자와 수혜자 마우스를 바꾸어 다시 실험하였다(Fig. 2).
3. C3H/He 마우스를 공여자로 BALB/c 마우스를 수 혜자로 조혈모세포이식을 시행한 경우
1) 주입경로에 따른 차이: C3H/He 마우스의 골수단 핵세포와 비장세포를 BALB/c 마우스의 꼬리 정맥 내로 투여한 IV군과 골수 내로 직접 주입한 IM군의 모든 마우스에서 25% 이상의 체중감소를 동반한 중
증 이식편대숙주병이 발생하였으나, 각 군 간의 이식 후 7일의 이식편대숙주병 점수의 평균은 6.0과 7.1 로 통계적으로 유의한 차이가 없었다(P>0.05). 두 군의 마우스 모두 조혈모세포 이식 후 8일 내에 이 식편대숙주병으로 사망하였으며 생존율도 두 군 간 에 차이를 보이지 않았다(P>0.05). 조혈모세포이식 후 4일과 8일에 일부의 마우스에서 시행한 피부와 소장의 조직 병리 소견에서는 이식 후 8일에서 이 식 후 4일에 비해서 각 장기로의 증가된 림프구의 침윤과 상피와 점막층의 파괴를 보여 이식편대숙주 병에 합당한 소견을 보였다(Fig. 3).
1×105개의 중간엽줄기세포를 골수단핵세포, 비장 세포와 함께 정맥 내로 혼합 주사한 IV+MSC (105)군 과 경로를 달리하여 골수 내로 혼합 주사한 IM+MSC (105)군 간의 이식 후 7일의 이식편대숙주병 점수의 평 균은 6.7과 7.3으로 차이가 없었다(P>0.05). 두 군의 마우스 모두 조혈모세포 이식 후 8일 내에 이식편대숙 주병으로 사망하였고 생존율도 두 군 간에 차이를 보 이지 않았다(P>0.05). 따라서 주입경로에 따른 급성 이식편대숙주병 점수와 생존율의 차이는 보이지 않았 다.
2) 중간엽줄기세포 혼합 주입에 따른 차이: C3H/He 마우스의 골수단핵세포와 비장세포를 BALB/c 마우
Fig. 6. The severity and pattern of GVHD progression in the intra-marrow mesenchymal stem cell co-injection hema- topoietic stem cell transplantation experimental group. High dose MSC group shows a statistically significant lower GVHD scores (P<0.01) from post-hematopoietic stem cell transplantation Day 7 onwards compared with the other group (*P<0.01). All data were shown mean±SD. (IM+
MSC (105) group (n=7), 1×107 bone marrow mononuclear cells+5×106 spleen cells+1×105 MSC; IM+MSC (106) group (n=6), 1×107 bone marrow mononuclear cells+5×
106 spleen cells+1×106 MSC).
Fig. 7. Survival in BALB/c mice in intra-marrow mesenchy- mal stem cell co-injection hematopoietic stem cell trans- plantation experimental group. Whilst all mice in IM group died in post-transplantation day 8, mouse in high dose MSC group survived until post-transplantation day 11, showing improved survival compared with the other group (P<0.01). (IM+MSC (105) group (n=7), 1×107 bone mar- row mononuclear cells+5×106 spleen cells+1×105 MSC;
IM+MSC (106) group (n=6), 1×107 bone marrow mononu- clear cells+5×106 spleen cells+1×106 MSC).
스의 꼬리 정맥 내로 투여한 IV군과, 1×105개의 중 간엽줄기세포를 혼합 주사한 IV+MSC(105)군 간의 이식 후 7일의 이식편대숙주병 점수의 평균은 6.0과 6.7로 통계적으로 유의한 차이가 없었다(P>0.05).
두 군의 마우스 모두 조혈모세포 이식 후 8일 내에 이식편대숙주병으로 사망하였으며 생존율도 두 군 간 에 차이를 보이지 않았다(P>0.05).
골수단핵세포와 비장세포를 골수 내로 직접 주사한 IM군과, 1×105개의 중간엽줄기세포를 혼합 주사한 IM+MSC (105)군 간의 이식 후 7일의 이식편대숙주병 점수의 평균은 7.1과 7.3으로 통계적으로 유의한 차이 가 없었으며(P>0.05), 두 군의 마우스 모두 조혈모세 포 이식 후 8일 내에 이식편대숙주병으로 사망하여 생 존율도 두 군 간에 차이를 보이지 않았다(P>0.05). 결 과적으로, 혼합 주사된 1×105개의 중간엽줄기세포는 급성 이식편대숙주병을 감소시키지 못하였고 생존율 을 향상시키지 못하였다.
3) 주사된 중간엽줄기세포의 양이 이식편대숙주병과 생존율에 미치는 영향: 골수단핵세포, 비장세포와 함 께 1×105개의 중간엽줄기세포를 마우스의 꼬리 정 맥 내로 혼합 주사한 IV+MSC (105)군과 세포 수를 10배로 증가시켜 1×106개의 중간엽줄기세포를 혼합 주사한 IV+MSC (106)군의 이식 후 7일의 이식편대
숙주병 점수의 평균은 6.7과 5.0으로 1×106개의 중 간엽줄기세포를 혼합 주사한 군에서 통계적으로 유 의하게 이식편대숙주병이 호전되었다(Fig. 4, P<0.05).
IV+MSC (105)군의 마우스는 이식 후 8일 내에 모 두 사망하였으나 IV+MSC (106)군의 마우스는 이식 후 14일 이후까지 생존하여 IV+MSC (106)군에서 향상된 생존율을 보여주었다(Fig. 5, P<0.01).
경로를 달리하여 골수단핵세포, 비장세포와 함께 1×105개의 중간엽줄기세포를 골수 내로 혼합 주사한 IM+MSC (105)군과 1×106개의 중간엽줄기세포를 혼 합 주사한 IM+MSC (106)군의 이식 후 7일의 이식편대 숙주병 점수의 평균은 7.3과 5.1로 1×106개의 중간엽 줄기세포를 혼합 주사한 군에서 통계적으로 유의하게 이식편대숙주병이 호전되었다(Fig. 6, P<0.01). IM+
MSC (105)군의 마우스는 이식 후 8일 내에 모두 사망 하였으나 IM+MSC (106)군의 마우스는 이식 후 10일 까지 생존하여 IM+MSC (106)군에서 향상된 생존율을 보여주었다(Fig. 7, P<0.01). 결과적으로 1×105개의 중간엽줄기세포를 혼합 주입한 군보다 1×106개의 중 간엽줄기세포를 혼합 주입한 군에서 이식편대숙주병 이 감소하였으며 생존율이 향상되었다.
또한, MSC (106)군을 투여한 실험에서 투여 경로에 따라 생존율의 차이를 보였다. IV로 투여한 군이 IM으
로 투여한 군보다 유의하게 생존율이 높았으며 낮은 이식편대숙주병의 결과를 보였다(P<0.01).
고 찰
자가복제와 각기 다른 자손세포로 분화하는 능력을 가진 중간엽줄기세포는 1982년 처음 배양되고 기술된 후에 지금까지 많은 연구가 되고 있다.16) 중간엽줄기 세포 연구의 가장 근본적인 문제는 현재까지도 이 세 포를 모든 실험실에서 항상 명확하고 일정하게 특정 지을 수 없다는 점과 조작을 가하지 않은 생체 내에서 이 세포의 생물학적인 성질을 관찰할 수 없다는 것이 다.17) 또한 중간엽줄기세포를 이용한 실험은 같은 시 스템을 통하여도 각 종마다, 중간엽줄기세포의 배양 방법에 따라서 그리고 중간엽줄기세포를 계대 배양한 횟수에 따라서 일치하지 않는 실험결과를 보이고 있 다. 중간엽줄기세포는 T세포의 증식을 억제하여 면역 반응을 조절하는 것으로 알려져 있다.5,18) 이러한 중간 엽줄기세포의 면역학적 특성은 주조직적합항원 불일 치 마우스 조혈모세포이식 모델에서 관찰되었으며, 중 간엽줄기세포를 조혈모세포와 공동으로 이식 후에 이 식편대숙주병이 감소되었고 생존율이 증가되었다.13,19) 중간엽줄기세포가 T세포를 억제하기 위해서는 세포 수에 의존하게 되며, 중간엽줄기세포와 비장세포의 비 율이 1:10 이상이 되어야 하는 것으로 알려져있
다.19-21) C3H/He 마우스를 수혜자로 하고 BALB/c 마우
스를 공여자로 한 처음의 실험에서는 모든 군의 마우 스에서 유의한 이식편대숙주병이 발생하지 않아 중간 엽줄기세포에 의한 이식편대숙주병의 억제 효과와 생 존율 향상 효과를 확인할 수 없었다. 공여자와 수혜자 의 마우스를 바꾸어 다시 실험하였고 모든 군의 마우 스에서 몸무게의 감소를 동반한 유의한 급성 이식편대 숙주병이 발생하였다. 그러나 기존에 알려진 것과는 달리 정맥 내 골수단핵세포 주입군과 골수 내 직접 주 입군 간의 이식편대숙주병과 생존율은 차이가 없었다.
본 실험의 주조직적합항원 불일치 마우스 실험 모델은 조혈모세포이식 후 7~8일경에 중증의 급성 이식편대 숙주병이 발생하여 모든 마우스가 사망하였다.14) 이러 한 급성 이식편대숙주병에서는 조혈모세포이식 초기 에 IL-2와 같은 싸이토카인이 급격하게 증가하여 이식 편대숙주병이 유발된다.22) 이식편대숙주병은 조혈모 세포이식 후에 생존율을 저하시키는 주된 원인으로 세 단계로 분류된다. 첫 단계로 수혜자가 전처지로 받은 방사선 혹은 화학요법 치료로 인해 상피와 내피세포의
조직손상이 발생하고,23) 두 번째 단계로 전처치 후 2~
3일에 림프조직에서 공여 T세포의 확장이 일어나며, 세 번째 단계로 3일과 7일 사이에 공여 T세포는 골수, 소화기, 간, 폐, 피부 등 표적장기의 손상을 야기한 다.24) 급성 이식편대숙주병의 발생에서 초기에 중요한 역할을 하는 공여자의 동종반응 T세포를 중간엽줄기 세포로 억제하기 위해서 공여 T세포가 표적 장기에 손 상을 일으키는 이식 후 5일에 중간엽줄기세포를 주사 하였으나, 이식 후의 이식편대숙주병과 생존율을 향상 시키지는 못하였다(P>0.05, 실험결과는 제시되지 않 음). 임상적으로는 기존에 발생한 이식편대숙주병을 중간엽줄기세포를 통해서 성공적으로 치료한 보고가 있었으나,25) 본 실험에서는 증명하지 못하였다. 이러 한 결과에 따라 중간엽줄기세포의 주입은 골수단핵세 포, 비장세포와 함께 혼합 주사되어야만 효과적인 T세 포 억제 기능을 보인다고 생각하였다. 그러나 골수 내 직접 주입으로 기대한 중간엽줄기세포의 이식편대숙 주병과 생존율을 개선시키는 효과는 관찰되지 않았다.
또한 본 연구에서는 주입된 중간엽줄기세포의 수에 따른 면역반응 조절의 차이를 알아보기 위하여 중간엽 줄기세포의 수를 증가시켜 골수단핵세포, 비장세포와 함께 혼합 주사하였다. 고용량의 중간엽줄기세포를 정 맥 내로 주입한 군과 골수 내로 주입한 군에서는 다른 군에 비해서 의미 있게 생존율이 향상되었으며, 지속 적으로 저하된 이식편대숙주병 점수를 보여주었다. 결 과적으로 고용량의 중간엽줄기세포는 이식편대숙주병 을 호전시키고 생존율을 향상시켰다. 본 실험에서 나 타난 특이한 점은 고용량의 중간엽줄기세포를 정맥 내 로 혼합 주사한 경우에 골수 내로 혼합 주사한 경우보 다 감소된 이식편대숙주반응과 향상된 생존율을 보였 다는 점이다.11) 이는 기존의 골수 내 직접 이식이 정맥 내 이식 방법보다 우수하다는 보고와는 상반된 결과이 다. 이러한 이유를 정확히 설명할 수는 없으나, 중간엽 줄기세포가 효과 T세포를 억제하기 위해서는 세포 간 직접 접촉이 중요한데,5) 골수 내로 직접 주입한 중간 엽줄기세포는 골수 내에 머무르며 미세환경을 개선시 키고 이식편의 조기생착을 유도하지만,2) 중간엽줄기 세포가 주입된 골수 이외의 장소에 산재해 있는 T세포 들과 효율적인 접촉이 이루어지지 않아 T세포 억제 기 능을 효과적으로 나타내지 못하여 결과적으로 이식편 대숙주병을 억제하고 생존율을 증가시키는 효과는 보 이지 않은 것으로 생각된다.
본 실험을 통하여 저자는 면역조절능력을 가진 중간 엽줄기세포의 투여 경로, 주입 시기에 따른 효과와 세
포 수에 따른 이식 성적을 비교하였다. 그 결과, 중간엽 줄기세포는 세포 수에 의존하여 면역억제능력을 보여 주었으며, 최근 우수한 조혈모세포이식 방법으로 제시 된 골수 내 이식방법은 기존의 정맥 내 이식방법의 이 식 성적과 차이를 보이지 않았다. 주조직적합항원 불 일치 마우스 조혈모세포이식에서 발생하는 이식편대 숙주병을 억제하는 중간엽줄기세포의 효과에 대해서 는 중간엽줄기세포가 작용하는 기전에 대한 연구와 함 께 임상적 연구가 더 필요할 것으로 생각된다.
요 약
배경: 본 연구에서는 첫째, 조혈모세포와 중간엽줄 기세포의 주입 경로에 따른 이식 성적의 차이와 둘째, 고농도로 주입된 중간엽줄기세포가 이식편대숙주병을 감소시키고 생존율을 향상시킬 수 있는지를 알아보고 자 하였다.
방법: C3H/He 마우스의 중간엽줄기 세포주인 C3H/
10T1/2을 5차례 계대배양을 하여 중간엽줄기세포를 얻었다. 조혈모세포이식은 치사량의 방사선을 조사한 6주 연령의 암컷 BALB/c 마우스에 6~8주 연령의 암 컷 C3H/He 마우스로부터 얻은 1×107개의 골수단핵세 포(bone marrow mononuclear cell)와 5×106개의 비장 세포를 주입하였으며, 정맥 내 주입군(intravenous, IV 군)과 골수 내 주입군(intra-marrow, IM군)으로 나누어 각 군에서 조혈모세포와 중간엽줄기세포의 투여에 따 른 이식 성적을 알아보았다. IV군(n=6)은 C3H/He 마 우스의 골수단핵세포와 비장세포를 BALB/c 마우스의 꼬리 정맥 내 주사하였고, IM군(n=8)은 IV군과 동일한 골수단핵세포와 비장세포를 골수 내 직접 주사하였다.
IV+MSC (105)군(n=7)은 IV군과 동일한 골수단핵세 포, 비장세포와 함께 1×105개의 중간엽줄기세포를 정 맥내로 혼합 주사하였다. IV+MSC (106)군(n=6)은 IV 군과 동일한 골수단핵세포와 비장세포에 1×106개의 중간엽줄기세포를 함께 정맥 내 주사하였다. 골수 내 주입 군인IM+MSC (105)군(n=7)과 IM+MSC (106)군 (n=6)은 정맥 내 주입군과 동일한 세포를 경로를 달리 하여 골수 내 직접 주사하였다. 이식받은 모든 마우스 를 매일 몸무게를 비롯한 이식편대숙주병에 대한 양상 을 점수화하여 추적 관찰하였다.
결과: 정맥 내 주입군과 골수 내 주입군의 마우스는 이식 후 8일 내에 모두 사망하여 조혈모세포의 주입 경로에 따른 이식편대숙주병과 생존율의 차이는 없었 다(P>0.05). 골수단핵세포, 비장세포와 함께 주입된
1×105개의 중간엽줄기세포는 두 경로 모두에서 이식 편대숙주병을 감소시키거나 생존율을 향상시키지 못 하였다(P>0.05). 그러나, 1×106개의 고용량의 중간엽 줄기세포는 정맥 내 주입군과 골수 내 주입군에서 모 두 이식편대숙주병을 감소시켰으며(P<0.05), 향상된 생존율을 보였다(P<0.01).
결론: 조혈모세포이식에서 조혈모세포의 주입경로 에 따른 이식 성적의 차이는 없었으나, 중간엽줄기세 포가 많이 주입될수록 조혈모세포이식 후의 이식편대 숙주병이 감소하였으며 생존율이 향상되었다.
감사의 글
이 논문이 나올 수 있도록 사랑과 관심으로 끝까지 지도하고 격려해 주신 김학기 교수님께 깊은 감사와 존경을 표합니다. 실험을 함께 하고 지도해 주신 정대 철 교수님과 조빈 교수님께도 깊은 감사를 드립니다.
마우스 방사선 조사를 해주신 최병옥 교수님, 실험에 함께 참여해주신 성모자애병원 임상의학연구소 이희 철 연구원, 염미영 연구원, 손유미 연구원 모두에게 깊 은 감사를 드립니다.
참 고 문 헌
1) Torok-Storb B, Holmberg L. Role of marrow micro- environment in engraftment and maintenance of allogeneic hematopoietic stem cells. Bone Marrow Transplant 1994;14:S71-3.
2) Fouillard L, Bensidhoum M, Bories D, et al. En- graftment of allogeneic mesenchymal stem cells in the bone marrow of a patient with severe idiopathic aplastic anemia improves stroma. Leukemia 2003;17:
474-6.
3) Koc ON, Gerson SN, Cooper BW, et al. Rapid he- matopoietic recovery after coinfusion of autolo- gous-blood stem cells and culture-expanded marrow mesenchymal stem cells in advanced breast cancer patients receiving high-dose chemotherapy. J Clin Oncol 2000;18:307-16.
4) Noort WA, Kruisselbrink AB, in't Anker PS, et al.
Mesenchymal stem cells promote engraftment of human umbilical cord blood-derived CD34(+) cells in NOD/SCID mice. Exp Hematol 2002;30:870-8.
5) Tse WT, Pendleton JD, Beyer WM, Egalka MC, Guinan EC. Suppression of allogeneic T-cell proli- feration by human marrow stromal cells: implica-
tions in transplantation. Transplantation 2003;75:
389-97.
6) Gao J, Dennis JE, Muzic RF, Lundberg M, Caplan AI. The dynamic in vivo distribution of bone mar- row-derived mesenchymal stem cells after infusion.
Cells Tissues Organs 2001;169:12-20.
7) Zhang Y, Yasumizu R, Sugiura K, et al. Fate of allo- geneic or syngeneic cells in intravenous or portal vein injection: possible explanation for the mechan- ism of tolerance induction by portal vein injection.
Eur J Immunol 1994;24:1558-65.
8) Rombouts WJ, Ploemacher RE. Primary murine MSC show highly efficient homing to the bone mar- row but lose homing ability following culture. Leu- kemia 2003;17:160-70.
9) Kim JH, Auerbach JM, Rodriguez-Gomez JA, et al.
Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson’s disease. Nature 2002;418:50-6.
10) Stamm C, Westphal B, Kleine HD, et al. Autologous bone-marrow stem-cell transplantation for myocar- dial regeneration. Lancet 2003;361:45-6.
11) Ikehara S. A novel strategy for allogeneic stem cell transplantation: perfusion method plus intra-bone marrow injection of stem cells. Exp Hematol 2003;
31:1142-6.
12) Mazurier F, Doedens M, Gan OI, Dick JE. Rapid myeloerythroid repopulation after intrafemoral tran- splantation of NOD-SCID mice reveals a new class of human stem cells. Nat Med 2003;9:959-63.
13) Chung NG, Jeong DC, Park SJ, et al. Cotransplan- tation of marrow stromal cells may prevent lethal graft-versus-host disease in major histocompatibility complex mismatched murine hematopoietic stem cell transplantation. Int J Hematol 2004;80:370-6.
14) Jeong DC, Han CW, Jin JY, et al. Effectiveness of rotor off fraction in allogeneic murine bone marrow transplantation with complete disparity of major histocompatibility. Exp Hamatol 1999;27:1219-25.
15) Cooke KR, Kobzik L, Martin TR, et al. An experi
mental model of idiopathic pneumonia syndrome after bone marrow transplantation: I. The roles of minor H antigens and endotoxin. Blood 1996;88:
3230-9.
16) Fridenshtein AIa. Stromal bone marrow cells and the hematopoietic microenvironment. Arkh Patol 1982;44:3-11.
17) Javazon EH, Beggs KJ, Flake AW. Mesenchymal stem cells: paradoxes of passaging. Exp Hematol 2004;32:414-25.
18) Krampera M, Glennie S, Dyson J, et al. Bone mar- row mesenchymal stem cells inhibit the response of naive and memory antigen-specific T cells to their cognate peptide. Blood 2003;101:3722-9.
19) Bartholomew A, Sturgeon C, Siatskas M, et al.
Mesenchymal stem cells suppress lymphocyte proli- feration in vitro and prolong skin graft survival in vivo. Exp Hematol 2002;30:42-8.
20) Di Nicola M, Carlo-Stella C, Magni M, et al. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mito- genic stimuli. Blood 2002;99:3838-43.
21) Meisel R, Zibert A, Laryea M, Gobel U, Daubener W, Dilloo D. Human bone marrow stromal cells in- hibit allogeneic T-cell responses by indoleamine 2,3- dioxygenase-mediated tryptophan degradation. Blood 2004;103:4619-21.
22) Goker H, Haznedaroglu IC, Chao NJ. Acute graft- vs-host disease: pathobiology and management. Exp Hematol 2001;29:259-77.
23) Ferrara JL, Cooke KR, Pan L, Krenger W. The im- munopathophysiology of acute graft-versus-host-dis- ease. Stem Cells 1996;14:473-89.
24) Wysocki CA, Panoskaltsis-Mortari A, Blazar BR, Serody JS. Leukocyte migration and graft-versus- host disease. Blood 2005;105:4191-9.
25) Le Blanc K, Rasmusson I, Sundberg B, et al. Treat- ment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells.
Lancet 2004;363:1439-41.