서론
방광암은 비뇨기에 두 번째로 흔히 발생하는 암으로 전 세 계적으로 1,200만 명이 매해 방광암으로 새롭게 진단되며 모 든 암을 통틀어 아홉 번째로 흔하게 발병하고 있다(1). 남성에 서 여성보다 그 발병 빈도가 3~4배 가량 높으며 2011년 국내 남성 암 조사 자료에서도 조발생률 11.4명으로 7위를 기록하 고 있다(2). 방광암은 화학적 자극제, 물리적 자극 또는 병원체 에 의해 유발되는 것으로 생각된다. 방광암은 95% 방광에서 암이 발현되나 암은 신배(renal calyx)에서 방광까지 모든 요 로기계에 발생할 수 있다(field change disease). 여러 다른 위 치에서의 재발이 흔하여 방광암 환자의 경우 생애 전반에 걸 친 추적관찰이 필요하다. 방광암은 조직학적으로 요로상피암 (urothelial carcinoma, transitional cell carcinoma)이 대부분 을 차지하고 그 외에 편평세포암(squamous cell carcinoma) 이나 선암(adenocarcinoma)도 방광에 발생한다. 방광암으 로 처음 내원할 시에 75% 정도의 환자들은 점막에 국한된 비근침윤성 방광암(Non-muscle invasive bladder cancer, NMIBC)으로 진단된다. 이들의 대부분은 내시경적 치료를 받게 되며 비교적 높은 재발에도 불구하고 장기간 생존율은 양 호하다. 반면 남은 25%를 차지하는 근침윤성 방광암(Muscle invasive bladder cancer, MIBC) 환자들의 경우 방광 전체를 제거하는 근치적 수술을 받거나 경우에 따라 전신 약물 치료 를 받게 된다(6,7).
본론
1. 방광암 유발 인자 방광암 발생의 위험 인자로는 유전적인 요인 외에 흡연이 가장 중요한 원인으로 방광암 발병 원인의 상당 부분을 차 지한다. 그 외에 직업적으로 방향족 아민화합물(aromatic amines)이나 다환방향족 탄화수소(polycyclic aromatic hydrocarbons)에 노출되는 것도 방광암 발생의 위험 인자이 다(8). 일반적으로 선진국에서 방광암의 발생 빈도가 높게 나 타나는데 통계 방법의 차이도 있겠지만 흡연 등에 대한 노출 의 차이로 인한 부분이 있으며 특히 유럽에서는 흡연으로 인 한 방광암의 발생이 절반 가까이를 차지하는 것으로 알려져 있다(4,5). 흡연자의 경우 비흡연자에 비하여 방광암 발생률은 4배 가까이 증가하는 것으로 보고되고 있다(9). 접수 : 2014년 12월 20일 게재승인 : 2014년 12월 30일 교신저자 : 유현욱(khdoct29@gmail.com)방광암의 이해
한화생명보험유현욱, MD
Review of Bladder cancer
Hanwha Life Insurance, Seoul.
Hyun Wook You,
MD
■ ABSTRACT
Bladder cancer is one of the most common cancers affecting men and women and thus has a profound impact on health care. The majority of patients (75%) with newly diagnosed urothelial tumors have non-muscle invasive disease confined to the bladder mucosa or the lamina propria. The most important risk factors for the development of bladder cancer are smoking and occupational exposure to toxic chemicals. Painless visible hematuria is the most common presenting symptom of bladder cancer. Cystoscopy and urine cytology are currently the recommended tools for diagnosis of bladder cancer. Excluding muscle invasion is an important diagnostic step, as outcomes for patients with muscle invasive bladder cancer (MIBC) are less favorable. For non-muscle invasive bladder cancer (NMIBC), the high rate and frequency of recurrence and the concern for disease progression ㅡ especially in patients with high-risk tumors ㅡ mandate careful strategies for tumor surveillance. The surveillance strategies should be based on available prognostic factors and in particular data from the EORTC risk tables.
2. 증상
가장 흔한 증상은 혈뇨이다. 혈뇨의 양상은 현미경적 혈뇨에 서 피떡을 배출할 정도의 육안적 혈뇨까지 매우 다양하다(10). 급박뇨(Urgency), 빈뇨(Frequency) 혹은 배뇨통(dysuria)과 같은 하부 요로 증상(low urinary tract symptoms, LUTS)이 흔하게 동반되어 요로 감염과의 감별진단이 필요하다. 만일 요로 감염이 배제된 상황에서 하부요로증상은 근침습성 방광 암(MIBC)이나 상피내암종(carcinoma in situ, CIS) 혹은 high grade tumor를 시사하는 소견이다. 특히 상피내 암종의 경우 점막 병소로 발생하는 경우가 많아 간질성 방광염(interstitial cystitis, IC)와 감별이 필요하다(11). 3. 진단 방광암이 의심되는 혈뇨나 하부요로 증상을 가진 환자는 방 광경 검사, 요세포 검사 및 영상의학적 검사 등을 시행하여야 한다. 1) 방광경(cystoscopy) 방광경 검사는 내시경으로 방광과 요도를 직접 관찰하는 것 으로 방광암의 진단에 가장 중요하다. 종양이 발견되면 종양 의 모양, 형태, 크기, 범위 및 다발성 여부를 관찰한다. 유두 상 종양(papillary)은 비침습암 가능성이 높으나 편평형(flat) 이나 무경성(sessile)종양의 경우 근육을 침범한 침습암의 가 능성이 높다. 그러나 초기 암병변 및 상피내암종의 경우 일반 방광경으로 진단이 쉽지 않은 경우가 많아 형광물질을 이용 한 방광경 검사가 시도되고 있다. 2) 요세포 검사(cytology) 악성요로상피세포가 탈락되어 요검체에서 현미경적으로 관찰이 가능하다. 요세포 검사의 경우 방광암의 진단뿐 만 아 니라 추적 관찰에도 유요한 검사이다(12). 요세포 검사는 무엇 보다 비침습적이며, high grade tumor거나 상피내암종(CIS) 이 동반된 경우 특이도(specificity)가 98.3%에 이른다. 반면, low grade tumor의 경우 민감도는 높지 않고 위음성률(false positive)이 20% 이상을 보일 수 있다(13). 임상에서 자주 접할 수 있는“비정형적(atypical)”검사 결과는 방광염 등의 경우 에 많이 보일 수 있으나 방광경 및 영상 의학 검사에서 정상 소견이라면 추가적인 검사나 방광 조직 검사는 필요하지 않 다.“의심스러운(suspicious)”요세포 검사 결과는 추가적인 검사가 필요하며, suspicious cytology 환자의 35%가 6개월 내에 방광암이 발생하였다는 보고가 있다(11). 3) 종양표지자검사(Biomakers) 방광암의 조기 진단, 수술 후 추적 검사 및 예후 관찰을 위 해 종양표지자 검사가 사용되고 있다. 일반적으로 이러한 검 사법은 민감도는 높으나 특이도가 낮은 경우가 많아서 종양 표지자 검사의 경우 단독으로 사용되기 보다 요세포 검사와 함께 사용된다(11). 4) 영상의학검사 영상진단은 증상에 대한 평가를 위해 진단 목적으로 시행하 는 것과 방광암의 진단 후 병기결정 목적으로 시행되는 것이 있다.
① 배설성 요로 조영술(Intravenous pyelogram, IVP)
신배(renal calyx)에서 방광까지의 요로를 관찰하여 혈뇨의 원인을 찾는 검사이다. 배설성 방광사진에서 충만결손(filling defect)이 보이는 경우 진단할 수 있으나 종양의 크기가 작은 경우 도움이 되지 않는다. 최근에는 반드시 필수 검사로 시행 하지 않는다(14). ② 복부 초음파 신기능이 좋지 않거나 조영제에 부작용이 있는 경우 상부요 로 및 방광 상태를 제한적으로 평가할 수 있다. ③ 컴퓨터단층촬영(CT) 컴퓨터단층촬영은 방광암의 유무, 위치, 크기 등을 확인할 수 있고 침습암에서 암의 범위를 평가하고 골반 또는 대동 맥주위 림프절 비대 및 주변으로의 전이를 평가하는데 유용 한 평가이다. 방광암의 진단에서 컴퓨터 단층 촬영의 민감도 는 79%이고 현미경적전이는 평가가 불가능하지만 특이도는 94%로 높다(15). ④ 자기공명영상(MRI) 자기공명장치의 경우 연조직의 상태를 CT보다 정확하게 평 가가 가능하지만 CT에 비해 진단적 가치가 높지 않다. ⑤ 뼈스캔(Bone scan) 침습암에서 근치적 방광절제술 전에 시행하는데 뼈통증이 나 ALP 증가가 없는 환자에서는 뼈스캔에서 양성소견이 드물 다. 따라서 뼈스캔의 유용성에 대해서는 이견이 있지만 수술 후 환자의 추적관찰의 기초자료로 사용된다. 5) 조직검사 암의 최종 진단은 병리적인 확진이 이루어져야 한다. 방광 경 검사 도중 조직 일부를 채취하는 경우도 있으나 정확한 조 직검사를 위해 전신마취를 하고 종양이 의심되는 부분을 경 요도 방광절제술(Transurethral resection of bladder tumor, TURBT)로 완벽하게 절제하여 병리검사를 시행해야 한다. TURBT는 방광 내 모든 종양을 제거해야 하며, 종양이 있는 부위의 근육층까지 절제하여야 암침범의 범위를 확인해야 한 다. 작은 크기의 저분화도 암의 경우 근육층을 포함하여 절제 하는 것이 필수적은 아니지만 방광 근육층이 조직에 포함되 지 않을 경우 잔존암이 존재하거나 조기에 재발할 가능성이 높아질 수 있다(16). 방광암의 TURBT는 조직을 채취하기 위한 조직검사이기도 하지만 비침습성 방광암(NMIBC)의 경우 종 양을 절제하는 치료과정이기도 하다. 6) 병리 방광에서 발생하는 암의 약 98%는 요로상피암종(urothelial carcinoma, transitional cell carcinoma)이다. 조직학적 등급
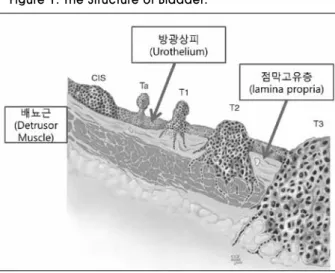
며 요로상피암종을 3등급(grade 1,2,3)으로 분류했던 1973 년 WHO 체계가 가장 많이 사용되어 왔으나 2004년 새로운 WHO/ISUP 분류가 채택되었다(17). 이 분류에 따르면 저악성 유두상 요로상피암종(papillary urothelial neoplasm of low malignant potential ;PUNLMP), 저등급 유두상 요로상피암종 (Low-grade papillary urothelial neoplasm)과 고등급 유두상 요로상피암종(high grade papillary urotherial carcinoma)으 로 분류하였다. 저악성 유두상요로 상피암종의 재발률은 27-36%정도로 저등급, 고등급 암에 비하여 유의하게 낮으며 진 행률 또한 3.7%로 매우 낮다. 저등급암은 평균 50%의 재발률 을 보이며 진행률은 10%정도이다. 고등급암의 경우 침습암 으로 15~40% 진행할 위험성이 있으며 발견 당시 근육을 침범 한 방광암과 공존할 가능성이 높다(18). 4. 병기결정 방광암의 병기는 경요도 절제술, 컴퓨터 단층 촬영, 뼈스캔 등의 결과를 종합하여 이루어진다. 방광암 병기 결정에 가장 중요한 것은 경요도 절제술을 통해 방광암의 배뇨근 침범 여 부를 확인하는 것이다(Figure 1). 비침습성 방광암의 경우 전 이의 가능성이 낮아 추가적인 검사가 필요하지 않으나 근육 층을 침범한 침습성 방광암인 경우 암이 국소적인지 원격 전 이가 있는지 확인하는 것이 치료방침 결정 및 예후에 중요하 다. 현재 사용되고 있는 병기체계는 2009년 TNM 병기체계로 Table 1과 같다(19). 방광암 진단과 치료 과정의 개념은 Figure 2로 요약하였다.
Figure 1. The Structure of Bladder.
Table 1. 2009 TNM classification of Bladder Cancer
T - Primary tumour
TX Primary tumor cannot be assessed T0 No evidence of primary tumor Ta Non-invasive papillary carcinoma Tis Carcinoma in situ: ‘flat tumor’
T1 Tumor invades subepithelial connective tissue T2 Tumor invades muscle
T2a Tumor invades superficial muscle (inner half) T2b Tumor invades deep muscle (outer half) T3 Tumor invades perivesical tissue
T3a Microscopically
T3b Macroscopically (extravesical mass)
T4 Tumor invades any of the following: prostate, uterus, vagina, pelvic wall, abdominal wall
T4a Tumor invades prostate, uterus or vagina T4b Tumor invades pelvic wall or abdominal wall N - Lymph nodes
NX Regional lymph nodes cannot be assessed N0 No regional lymph node metastasis
N1 Metastasis in a single lymph node in the true pelvis (hypogastric, obturator, external iliac, or presacral)
N2 Metastasis in multiple lymph nodes in the true pelvis (hypogastric, obturator, external iliac, or presacral)
N3 Metastasis in common iliac lymph node(s) M - Distant metastasis
MX Distant metastasis cannot be assessed M0 No distant metastasis M1 Distant metastasis 5.방광암의 예후 비근침습성 방광암은 상피내암종(CIS), Ta, T1에 해당하며, 방광암의 약 70~80%는 진단 당시 비근침습성 방광암이다. 비 침습암은 진단 당시 70%는 단발성으로 발견되나 30%는 다 발성으로 나타난다. 상피내암종(CIS)은 근침습성 방광암으 로 진행될 가능성이 매우 높다(20). 비근침습성 방광암은 경요 도 절제술만으로 치료할 경우 60~70%에서 재발하며 재발한 암의 20~30%는 보다 고병기나 고등급의 암으로 진행한다. 암 의 진행은 조직학적 등급과도 관련이 있어 저악성 유두상 요 로상피암종(papillary urothelial neoplasm of low malignant potential,PUNLMP)경우 암이 진행하지 않지만 저등급 유두 상 요로상피암종(Low-grade papillary urothelial neoplasm) 은 2-12%, 고등급 유두상 요로상피암종(high grade papillary urotherial carcinoma)은 27-61%에서 고병기로 진행한다. 방 광암의 20~30%를 이루는 근침습 방광암의 경우 타장기 및 주 변 림프절로의 전이가 많아 예후가 불량하다(21).
6.방광암의 치료
1) 비근침윤성 방광암의 치료
비근침윤성 방광암이란 방광의 점막 혹은 점막고유층 (lamina propria)에 국한된 경우를 의미한다(Fig. 1). 방광암 TNM 병기에 따라 점막에 국한된 경우는 Ta로 분류되고, 점막 고유층까지 침범한 경우는 T1으로 분류된다(22). Ta, T1 병기 의 방광암은 기본적으로 요도를 통한 내시경적 경요도 방광 절제술(transurethral resection of bladder tumor,TUR-BT)로 제거하여 치료하게 된다. 상피내암(carcinoma in situ,CIS)은 고등급암으로 점막에 국한되어 평평하게 퍼져서 분포하고, Tis병기로 분류되며 비근침윤 방광암에 속하게 된다. 비근침 윤성 방광암 환자의 70%는 진단 당시 Ta병기로 나타나지만, T1과 Tis도 각각 20% 와 10% 정도 차지하고 있다(23). 여러 분 자 생물학적 분석이나 임상 경과 등을 살펴볼 때 방광의 상피 내암은 잠재적인 악성도가 매우 높아 추적 과정에서 근침윤 성 방광암으로 진행할 가능성이 매우 높다. 따라서 비근침윤 성 방광암이라도 병기 및 개인에 따라 치료 방법이 달라지게 된다. (1) 내시경적 방광종양 절제술 비근침윤성 방광암에서 경요도 방광 절제술(transurethral resection of bladder tumor, TUR-BT)의 기본적인 목적은 눈에 보이는 종양을 모두 제거하여 치료하는 목적과 동시 에 제거된 종양 조직의 병리학적 검사를 통하여 종양의 병기 나 분화도 등을 정확히 진단하기 위함이다. 수술은 전신 혹 은 척추 마취 하에 이루어지게 되며 요도를 통하여 절제경 (resectoscope)을 삽입하고 종양을 절제하게 된다. 수술 시에 는 방광종양의 절제뿐 만 아니라 방광벽의 근육층 조직도 함 께 절제해야 한다. 만일 조직에 근육층이 포함되지 않았거나 (저분화도의 Ta 병기 혹은 원발성 상피내암은 제외), T1 병기 혹은 고분화도 방광암일 경우 이차적 절제술을 시행할 것이 권고되며 이차적 절제술을 통하여 재발률을 유의하게 감소시 킬 수 있다(24,25). 이차적 절제술은 첫 번째 수술 후 2~6주 후에 시행하는 것이 가장 바람직하다(6). (2) 내시경적 방광종양 절제술 후 보조치료 비근침윤성 방광암에서 장기간의 종양학적 결과는 매우 좋 지만 5년 이내에 30~80%의 환자는 방광 내에 재발을 하게 되 며 1~45%의 환자는 근침윤성 방광암으로 진행하게 된다(26). 따라서 내시경적 방광종양 절제술 이후에 재발이나 진행을 막기 위하여 보조치료를 진행하게 되는데 일반적으로 방광 내로 약물을 주입하는 방법을 사용하며 대표적으로 방광 내 항암요법과 방광 내 면역요법이 있다. ① 방광 내 항암요법 내시경적 방광종양 절제술 즉시 방광 내 항암 화학약물 (intra-vesical chemotherapy)을 주입하게 될 경우 방광 내 떠도 는 암세포를 파괴하는 효과를 기대할 수 있다. 세포가 방광 내 seeding이 되고 몇 시간이 지나면 암세포는 세포 외 기질 에 의하여 단단히 덮히게 된다. 따라서 내시경적 종양 절제술 이후 가능한 빨리 약물을 주입하는 것이 효과적이며 일반적으 로 수술 후 24시간 이내에 시행하는 것이 바람직하다(6). 하지만 방광 내 출혈이 있거나 복강 내 등으로 천공이 의심될 때는 심각한 합병증의 우려가 있기 때문에 시행하여서는 안 된다. 추가적인 항암요법은 저위험도 환자군에서는 시행할 필요가 없으나 그 외에서는 환자의 재발 위험도를 고려하여 선택적 으로 시행할 수 있다. 효과가 증명된 약물로는 mitomycin C, epirubicin, doxorubicin 등이 있으며 약물들 사이에 효과에 대한 비교가 이루어지지 않았다(27). ② 방광 내 BCG 면역요법 여러 메타분석이나 최근에 시행된 전향적 무작위 대조연 구 등에서 방광 내 Bacillus Calmette-Guerin (BCG) 면역요법 (intra-vesical BCG immunotherapy)을 시행할 경우 내시경 적 방광종양 절제술 단독치료나 방광 내 항암요법을 한 경우 보다 재발율을 낮추는데 있어 우수함이 증명되었다(28). 뿐만 아니라 BCG 면역요법은 방광암의 진행률을 의미있게 낮추는 것으로 보고되었고 최근의 한 장기간 추적관찰 결과에서는 질병 특이 사망률이나 전체 사망률까지 낮출 수 있다는 보고 도 있었다(29). 특히 방광 내 상피내암의 경우 내시경적 절제술 로 완벽히 제거될 수 없기 때문에 BCG 면역요법의 치료 대상 이 되며 항암요법보다 치료효과가 더 우수하다. BCG 면역요 법은 기본적으로 주 당 1회씩 6주간 치료를 받는 유도 치료가 기본이 되지만 적절한 치료 효과를 위해서는 유지 요법 스케 줄을 따르는 것이 필요하다. 하지만 BCG 면역 요법은 항암요 법보다 더 많은 부작용이 발생하기 때문에 장기간 사용할 경 우 비용뿐만 아니라 부작용의 위험 또한 반드시 고려되어야 한다(6). 배뇨 시 통증이나 자극 증상, 방광염, 전립선염 등 과 같은 부작용이 주로 발생하지만 경우에 따라서는 BCG패혈증, 알러지 반응과 같은 심각한 부작용이 발생할 수 있다. 2) 근침윤성 방광암의 치료 근치적 방광절제술(radical cystectomy) 근치적 방광절제술(radical cystectomy)은 근침윤 방광암 의 표준 치료이며 우수한 치료 성적을 보인다(30). 근치적 방 광절제술은 요로 전환술과 함께 시행되며 비뇨기과 영역에 서 가장 복잡하고 어려운 술기이다. 남성에서는 방광과 함께 전립선, 정낭과 말단부 요관을 함께 제거하며 여성에서는 방 광과 함께 인접한 질의 일부 및 자궁을 포함한 전 골반적출 술(anterior pelvic exenteration)을 시행하게 된다. 여성에서 는 일반적으로 요도도 함께 제거하나 신방광(neobladder) 조 형술을 시행할 경우 요도를 보존하게 된다. 양측 골반림프절 절제술(pelvic lymph node dissection) 또한 근치적 방광절 제술에서 중요한 부분을 차지하며 골반림프절절제술의 범위 는 외장골(external iliac), 내장골(internal iliac), 폐쇄 신경 (obturator nerve) 주변 및 천골전방 (presacral) 부위를 포함 하고 필요에 따라 총장골(common iliac)혈관이나 대동맥의
하장간동맥(inferior mesenteric artery) 기시부까지 그 범위를 넓힐 수 있다. 골반림프절절제술의 범위가 늘어날수록 림프 절 전이와 관련된 병기 설정을 더 정확히 할 수 있을 뿐만 아 니라 종양학적인 결과도 향상시키는 것이 여러 연구에서 확 인되고 있다(31,32). 하지만 골반림프절절제술을 어떤 범위까지 하는 것이 가장 적절한지에 대해서는 아직까지 논란이 있다.
7. Risk group classification
비침습성 방광암의 예후 및 암의 진행에 대한 예측을 위해 European Organization for Research and Treatment of Cancer (EORTC) 연구진은 방광경과 병리학적 소견을 바탕으로 위험 도 table을 통해 위험도를 점수화하였다. Scoring system은 Ta, T1 tumor로 진단받은 2,596명을 대상으로 방광암의 재발 과 암의 진행에 관여된 다음 6가지 요인을 바탕을 두고 만들 어졌다(11).
·number of tumours; ·tumour size; ·prior recurrence rate; ·T category;
·presence of concurrent CIS; ·tumour grade.
Scoring system은 Table 2와 같으며 이를 이용하여 환자군 을 4군으로 분류하였을 때 1년, 5년 시점에서 방광암의 재발 및 진행은 Table 3과 같았다(33).
8. Recommendation to stratify patients into risk groups
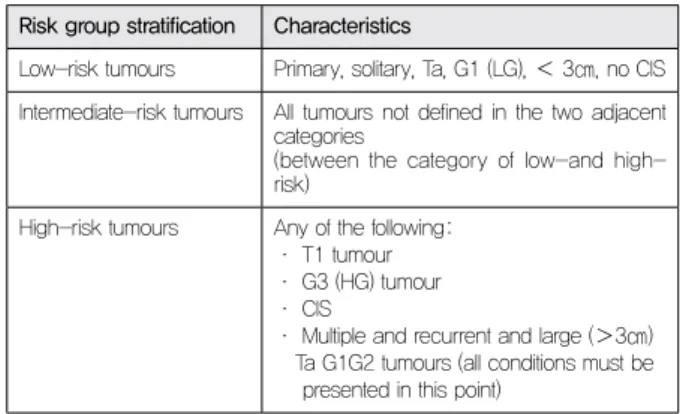
EORCT 위험요인과 EORTC risk table을 바탕으로 3개의 위 험군으로 나누었다. Table 4는 암의 재발과 진행의 가능성에 대한 EORTC risk table을 고려하여 만들어진 각 위험군 정의 이다(34). 임상에서 위 표를 바탕으로 환자 개개인에 대한 맞춤 형 추적관찰의 적용이 권장되고 있다.
Table 2. Predictors of Recurrence and Progression for Blabber cancer.
Factors Recurrence Progression Number of Tumors Single 2 to 7 ≥ 8 0 3 6 0 3 3 Tumor Diameter < 3 ㎝ ≥ 3 ㎝ 03 03
Prior Recurrence Rate Primary ≤ 1/yr > 1/yr 0 2 4 0 2 2 Category Ta T1 01 04 Concomitant CIS No Yes 01 06 Grade (1973 WHO) G1 G2 G3 0 1 2 0 0 5 Total Score 0-17 0-23
From Babjuk M, Oosterlinck W, Sylvester R, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol. 2008;54(2):303-314. Table 4. Risk group stratification of Non-Muscle Invasive
Bladder Cancers.
Risk group stratification Characteristics
Low-risk tumours Primary, solitary, Ta, G1 (LG), < 3㎝, no CIS Intermediate-risk tumours All tumours not defined in the two adjacent
categories
(between the category of low-and high-risk)
High-risk tumours Any of the following: · T1 tumour · G3 (HG) tumour · CIS
· Multiple and recurrent and large (>3㎝) Ta G1G2 tumours (all conditions must be presented in this point)
Table 3. Recurrence and Progression Risk for Non-Muscle Invasive Bladder Cancers.
Recurrence Score Probability of Recurrence at 1 Yr Probability of Recurrence at 5 Yrs Recurrent Risk Group % (95% CI) % (95% CI)
0 15 (10-19) 31 (24-37) Low risk
1-4 24 (21-26) 46 (42-49) Intermediate risk 5-9 38 (35-41) 62 (58-65) Intermediate risk 10-17 61 (55-67) 78 (73-84) High risk Progression Score Probability of Progression at 1 Yr Probability of Progression at 5 Yrs Progression Risk Group
% (95% CI) % (95% CI)
0 0.2 (0-0.7) 0.8 (0-1.7) Low risk
2-6 1 (0.4-1.6) 6 (5-8) Intermediate risk 7-13 5 (4-7) 17 (14-20) High risk 14-23 17 (10-24) 45 (35-55) High risk From Babjuk M, Oosterlinck W, Sylvester R, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol. 2008;54(2):303-314.
결론
방광암의 유병률은 점차 증가하는 추세이다. 이에 따라 방 광암에 대한 관심이 커지고 있는 상황이다. 방광암은 배뇨근 침범여부에 따라 비침윤성 방광암과 침윤성 방광암으로 구 분되며 이 구분에 따라 치료법 및 예후가 상이하다. 비근침 윤성 방광암에서는 내시경적 방광종양 절제술이 치료 의 기 본이며, 재발이나 진행의 위험에 따라 방광 내 항암요법 혹은 BCG를 이용한 면역요법을 시행하게 된다. 고위험군 비근침 윤성 방광암의 경우 내시경적 방광종양 절제술에 의한 병기 가 낮게 설정되거나 일부에서는 근침윤성으로 진행하는 경우 도 있기 때문에 이른 시기에 근치적 방광절제술을 시행할 수 도 있지만, 근침윤성으로 진행한 후에 근치적 방광절제술을 시행하는 경우보다 환자의 예후가 좋다. 근침윤성 방광암의 기본치료는 근치적 방광절제술이며 요로 전환술을 함께 시행 하게 된다. 비침윤성 방광암의 경우 방광암 진단 환자의 3/4를 차지하며 침습성 방광암에 비하여 예후는 매우 우수한 편다. 그러나 비침습방광암의 경우 재발이 흔하여 이에 대한 위험 도 층화(risk stratification)를 통해 고위험군과 저위험군을 나 눌 수 있다. 따라서 저위험도 환자의 경우 침습방광암으로의 병기 진행이나 재발은 고위험군에 비하여 낮은 특성이 있기 때문에 비침습 저위험도 환자의 경우 보험 위험도에 따른 접 근이 필요할 것으로 사료된다.REFERENCES
(1) Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010;127:2893-2917. (2) National Cancer Information Center, Available from: http://
www.cancer.go.kr/mbs/cancer/
(3) Burger M, Catto JW, Dalbagni G, Grossman HB, Herr H, Karakiewicz P, et al. Epidemiology and risk factors of urothelial bladder cancer. Eur Urol 2013;63:234-241. (4) Ploeg M, Aben KK, Kiemeney LA. The present and future
burden of urinary bladder cancer in the world. World J Urol 2009;27:289-293.
(5) Zeegers MP, Tan FE, Dorant E, van Den Brandt PA. The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies. Cancer 2000;89:630- 639.
(6) Babjuk M, Burger M, Zigeuner R, Shariat SF, van Rhijn BW, Comperat E, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder: update 2013. Eur Urol 2013;64:639- 653.
(7) Stenzl A, Cowan NC, De Santis M, Kuczyk MA,
invasive and metastatic bladder cancer: update of the EAU guidelines. Eur Urol 2011;59:1009-1018.
(8) Vlaovic P, Jewett MA. Cyclophosphamide-induced bladder cancer. Can J Urol. 1999;6(2):745-748.
(9) Freedman ND, Silverman DT, Hollenbeck AR, Schatzkin A, Abnet CC. Association between smoking and risk of bladder cancer among men and women. JAMA 2011; 306: 737-45. (10) Stenzl A, Witjes JA, Cowan NC, et al. European Association
of Urology Guidelines on muscle invasive and metastatic bladder cancer 2011.
(11) Sexton WJ, Wiegand LR, Correa JJ, Politis C, Dickinson SI, Kang LC. Bladder cancer: a review of non-muscle invasive disease Cancer Control. 2010 Oct;17(4):256-68. Review (12) Bastacky S, Ibrahim S, Wilczynski SP, et al. The accuracy of
urinary cytology in daily practice. Cancer. 1999;87(3):118-128.
(13) Planz B, Jochims E, Deix T, et al. The role of urinary cytology for detection of bladder cancer. Eur J Surg Oncol. 2005;31(3):304-308.
(14) Goessl C, Knispel HH, Millar K, et al. Is routine excretory urography necessary at first diagnosis of bladder cancer? J Urol 1997 Feb;157(2):480-1.
(15) Blick CG1, Nazir SA, Mallett S, Turney BW, Onwu NN, Roberts IS, Crew JP, Cowan NC. Evaluation of diagnostic strategies for bladder cancer using computed tomography (CT) urography, flexible cystoscopy and voided urine cytology: results for 778 patients from a hospital haematuria clinic. BJU Int. 2012 Jul;110(1):84-94. doi: 10.1111/j.1464-410X.2011.10664.x. Epub 2011 Nov 28.
(16) Mariappan P, Zachou A, Grigor KM; Edinburgh Uro-Oncology Group. Detrusor muscle in the first, apparently complete transurethral resection of bladder tumour specimen is a surrogate marker of resection quality, predicts risk of early recurrence, and is dependent on operator experience.
Eur Urol 2010;57:843-849.
(17) Epstein JI, Amin MB, Reuter VR, Mostofi FK: The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Am J Surg Pathol 1998, 22:1435-48.
(18) 대한비뇨기과학회. 비뇨기과학. 제5판. 일조각; 2014.
(19) Sobin LH, Gospodariwicz M, Wittekind C. TNM classification of malignant tumors. UICC International Union Against Cancer. 7th ed. Wiley-Blackwell; 2009. (20) Lamm DL. Carcinoma in situ. Urol Clin North Am 1992
(21) Alan J. Wein .Campbell-Walsh Urology. 10th ed. Saunders; 2012.
(22) Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010;17:1471-1474. (23) Kirkali Z, Chan T, Manoharan M, Algaba F, Busch C,
Cheng L, et al. Bladder cancer: epidemiology, staging and grading, and diagnosis. Urology 2005;66:4-34.
(24) Divrik RT, Yildirim U, Zorlu F, Ozen H. The effect of repeat transurethral resection on recurrence and progression rates in patients with T1 tumors of the bladder who received intravesical mitomycin: a prospective, randomized clinical trial. J Urol 2006;175:1641-1644.
(25) Dalbagni G, Vora K, Kaag M, Cronin A, Bochner B, Donat SM, et al. Clinical outcome in a contemporary series of restaged patients with clinical T1 bladder cancer. Eur Urol 2009;56:903-910.
(26) van Rhijn BW, Burger M, Lotan Y, Solsona E, Stief CG, Sylvester RJ, et al. Recurrence and progression of disease in non-muscle-invasive bladder cancer: from epidemiology to treatment strategy. Eur Urol 2009;56:430-442.
(27) Sylvester RJ, Oosterlinck W, van der Meijden AP. A single immediate postoperative instillation of chemotherapy decreases the risk of recurrence in patients with stage Ta T1 bladder cancer: a meta-analysis of published results of randomized clinical trials. J Urol 2004;171:2186-2190. (28) Malmström PU, Sylvester RJ, Crawford DE, Friedrich
M, Krege S, Rintala E, et al. An individual patient data meta-analysis of the long-term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Guérin for non-muscle-invasive bladder cancer.
Eur Urol 2009;56:247-256.
(29) Sylvester RJ, Brausi MA, Kirkels WJ, Hoeltl W, Calais Da Silva F, Powell PH, et al. Long-term efficacy results of EORTC genito-urinary group randomized phase 3 study 30911 comparing intravesical instillations of epirubicin, bacillus Calmette-Guérin, and bacillus Calmette-Guérin plus isoniazid in patients with intermediate- and high-risk stage Ta T1 urothelial carcinoma of the bladder. Eur Urol 2010;57:766-773.
(30) Stein JP, Lieskovsky G, Cote R, Groshen S, Feng AC, Boyd S, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin
Oncol 2001;19:666-675.
(31) Karl A, Carroll PR, Gschwend JE, Knuchel R, Montorsi F, Stief CG, et al. The impact of lymphadenectomy and lymph
node metastasis on the outcomes of radical cystectomy for bladder cancer. Eur Urol 2009;55:826-835.
(32) Leissner J, Ghoneim MA, Abol-Enein H, Thuroff JW, Franzaring L, Fisch M, et al. Extended radical lymphadenectomy in patients with urothelial bladder cancer: results of a prospective multicenter study. J Urol 2004;171:139-144.
(33) Sylvester RJ, van der Meijden AP, Oosterlinck W, et al. Predicting recurrence and progression in individual patients with stage Ta, T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006 Mar;49(3):466-5.
(34) Brausi M, Witjes JA, Lamm D, et al. A review of current guidelines and best practice recommendations for the management of nonmuscle invasive bladder cancer by the International Bladder Cancer Group. J Urol 2011 Dec;186(6):2158-67.