골밀도가 낮은 폐경 전 여성에서 알렌드로네이트 1년간 투여 후 골밀도 변화
조선대학교 의학대학원 산부인과학교실
김수아․유현주․정 혁
Change of Bone Mineral Density after One-year Alendronate Treatment in Premenopausal Women with Low Bone Density
Soo Ah Kim, Hyun Ju Liu, Hyuk Jung
Department of Obstetrics and Gynecology, Medical School, Chosun University, Gwangju, Korea
Objectives: To evaluate the efficacy of alendronate for premenopausal women with low bone density not resulted from secondary causes.
Materials and Methods: Forty thee women who was diagnosed low bone mineral density (BMD) before menopause were included. All patients were evaluated by history taking, physical examination, and laboratory investigation to rule out underlying secondary causes of osteoporosis. They were randomized into two groups: Group I was administered oral alendronate 70 mg per week and Group II was not. All the participants received calcium carbonate 1,250 mg and cholecalciferol 1,000 IU daily. Bone mineral density by dual energy X-ray absorptiometry was measured before and after 1 year of treatment.
Results: At baseline, there were no significant differences among the two groups in patient’s age, body mass index (BMI), and BMD. After 1 year of treatment, Group I showed significant increase in BMD.
Conclusions: In premenopausal women with low BMD in the absence of secondary causes for osteo- porosis, alendronate treatment for 1 year may increase BMD. We suggest that management of low bone density in the premenopausal women without secondary causes should be considered.
Key Words: Bone mineral density, Bisphosphonate, Premenopause
Received: November 9, 2012 Revised: December 20, 2012 Accepted: February 6, 2013
Corresponding Author: Hyuk Jung, Department of Obstetrics and Gynecology, Medical School, Chosun University, 588 Seoseok-dong, Dong-gu, Gwangju 501-717, Korea
Tel: +82-62-231-8831, Fax: +82-62-232-2310, E-mail: bimilo@hanmail.net
* 이 논문은 2012학년도 조선대학교 학술연구비의 지원을 받아 연구되었음.
골다공증은 여성들의 골절 위험을 크게 증가시키 는 질병으로 그 유병률은 40대 9.5%, 50대 23.0%, 60 대 46.9%, 70대 71.1%로1 중년 이후 여성들에서 흔 히 발생하며, 여성의 경우 평생 동안 골다공증으로 인한 골절이 발생할 확률은 40%에 이른다.2
골다공증에 대한 병인에 대해서는 확실히 알려져 있지 않지만, 연령 증가, 여성, 저체중, 내분비 인자 로서 미경산부, 조기 폐경, 난소 절제 등과 식이 인 자로서는 저칼슘 섭취, 고단백 섭취, 카페인, 흡연 및 만성 알코올 섭취 등이 있고, 스테로이드나 항경
련제 등의 약물 사용이나 운동량이 적은 경우 등이 골다공증의 위험인자로서 보고되고 있다.3 우리나라 도 서구식 생활습관이 점차 보편화되면서 젊은 여성 에서 카페인이나 흡연, 알코올 섭취 등이 점차 늘어 나는 추세이며, 다이어트에 대한 관심이 높아짐에 따라 저체중이나 저칼로리 식이를 하고 있는 여성이 현저히 많아져 폐경 전 젊은 여성에서 골감소증 또 는 골다공증이 적지 않을 것으로 사료된다. 최근 국 내에서 시행한 연구에 의하면 건강한 젊은 여성에서 Z-score≤-2.0인 경우가 10%가 넘는다는 보고도 있 다.4
골다공증의 WHO 진단 기준은 T-score≤-2.5이며, 골감소증은 -2.5<T-score<-1, 그리고 T-score≥-1.0 을 정상으로 정의하였다.6 하지만, 이는 폐경 후 여 성을 대상으로 정의한 것으로, 남성이나 폐경 전 여 성에게 적용할 수 있는 기준이 명확히 없었다. 이에 2003년 ISCD (International Society for Clinical Densi- tometry)에서, 20세 이상의 폐경 전 여성에서 골다공 증의 기준은 T-score가 아닌 Z-score≤-2.0이면서, 골 다공증을 유발할 수 있는 2차적 원인이 있거나, 골 절의 위험도가 높은 경우라고 정의하였다.5,6
하지만 골다공증을 일으키는 이차적 원인은 매우 다양하며,7 기저 질환이 밝혀지지 않은 폐경전 여성 에서 발생한 골감소의 원인을 찾기 위해서는 자세한 문진과 더불어 많은 검사가 요구되고, 검사를 시행 하더라도 모든 원인질환을 완전히 배제하기는 힘든 경우가 많다.
현재 임상적으로 사용이 허가된 골다공증의 치료 제에는 여성호르몬, 선택적 에스트로겐 수용체 조절 제(selective estrogen receptor modulator: SERM), 칼시 토닌, 비스포스포네이트, 부갑상선호르몬 등을 들 수 있다. 선택적 에스트로겐 수용체 조절제인 랄록 시펜은 폐경여성에서는 골밀도의 증가를 보이지만, 폐경 전 여성에서는 골밀도의 감소를 가져오고, 칼 시토닌과 부갑상선호르몬은 경구 투여가 불가능하 다. 그러나 비스포스포네이트(bisphosphonate) 계열의 알렌드로네이트(alendronate)는 무기인의 유사체로서 인체에 흡수된 후 파골세포 내에서 파골세포의 분화 를 억제하고 세포자연사(apoptosis)를 유발하여 골흡
수를 억제하는 약제로 경구 투여가 가능하다.8 현재 이러한 비스포스포네이트 계열의 약물은 일반적으 로 폐경 후 골다공증 치료 및 gluco-corticoid 유발성 골다공증 치료에 사용되고 있다. 하지만 많은 연구 들이 폐경 후 여성을 대상으로 하였으며 폐경 전 낮 은 골밀도를 나타내는 여성에서의 알렌드로네이트 투여에 대한 보고는 거의 없는 편이다. 이에 저자들 은 본원에 내원한 폐경전 40대 여성을 대상으로 골 밀도 검사를 시행하여, Z-score≤-2.0 또는 T-score
<-1.0이면서 낮은 골밀도를 일으킬 수 있는 이차적 인 기저질환이 없고, 향후 임신을 원하지 않는 여성 들 중 본 연구의 목적을 설명하고 동의한 경우에 대 상에 포함시켜 1년 간 알렌드로네이트를 투여하고 골밀도를 측정하여 폐경전 골밀도가 낮은 여성에서 알렌드로네이트의 효과를 비교하고자 하였다.
대상 및 방법
2008년 1월부터 2010년 12월까지 조선대학교 병 원 산부인과에 내원한 폐경전 40대 여성을 대상으로 골밀도 검사를 시행하였다. 연구시작 전에 모든 대 상자는 부인과적 이학적 검사, 질식 초음파검사, 자 궁경부암 세포검사, 유방암검사, 갑상선 및 부갑상 선 호르몬 검사를 시행하였으며 문진 및 검사 결과 암과 같은 중증질환자와 약물에 의한 속발성 골다공 증 환자, 대사성 골질환을 앓고 있는 환자, 갑상선 또는 부갑상선 호르몬 검사에서 이상이 있거나 약물 을 복용 중인 환자들은 연구대상에서 제외하였다.
폐경전 골밀도 검사 결과 Z score -2.0 이하이거 나 T score -1.0 미만인 골감소증을 보이는 여성 중 본 연구에 동의한 50명을 무작위로 분류하여 각각 25명씩 두 그룹으로 나누어 연구를 시행하였다.
골밀도 검사는 Lunar (General Electric; Chicago, IL) 사의 이중에너지 엑스레이 흡수 계측법(dual-energy X-ray absorptiometry)을 이용하여 측정하였으며, 정 밀도는 BMC-CV 0.29%였다. 골밀도 기준은 2-4번 요추를 기준으로 하여 g/cm2로 기록하였다.
최소 1년간 추적검사가 이루어지지 않은 7명을 제 외한 43명을 대상으로 하였다. 실험군(Group I)은 21
Table 1. Clinical characteristics between two groups Group I
(n=21)
Group II
(n=22) P-value
Age (years) 45.571±2.730 44.682±2.338 0.257
BMI (kg/m2) 22.319±2.253 23.123±2.717 0.298
BMD (g/cm2) 0.951±0.106 0.928±0.104 0.478
T-score -2.886±0.598 -2.690±0.449 0.229
Z-score -2.538±0.644 -2.571±0.468 0.847
Group I = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day+alendronate 70 mg/week Group II = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day
BMI; body mass index, BMD; bone mineral density Values are expressed in Mean±SD
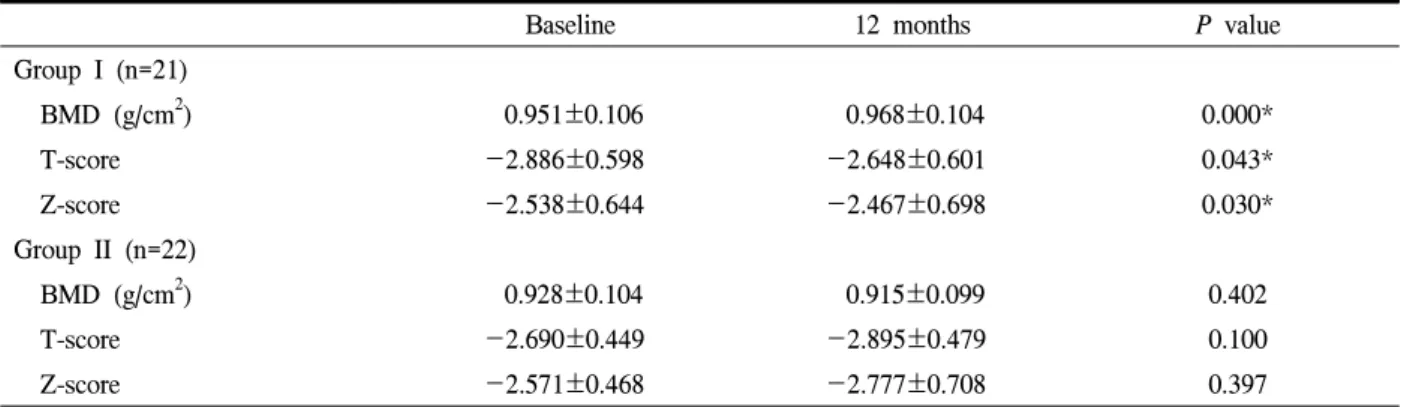
Table 2. Bone mineral density at 12 months between two groups
Baseline 12 months P value
Group I (n=21)
BMD (g/cm2) 0.951±0.106 0.968±0.104 0.000*
T-score -2.886±0.598 -2.648±0.601 0.043*
Z-score -2.538±0.644 -2.467±0.698 0.030*
Group II (n=22)
BMD (g/cm2) 0.928±0.104 0.915±0.099 0.402
T-score -2.690±0.449 -2.895±0.479 0.100
Z-score -2.571±0.468 -2.777±0.708 0.397
Group I = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day+alendronate 70 mg/week Group II = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day
BMD; bone mineral density
*P<0.05 (statistical significance was evaluated by paired t-test) Values are expressed in Mean±SD
명으로 1년간 매주 알렌드로네이트와 칼슘 및 비타 민 D를 경구 복용하였고, 대조군(Group II)은 22명으 로 칼슘과 비타민 D만 경구 복용하였다. 사용된 비 스포스포네이트 제제는 alendronic acid 70 mg/week p.o (AlentⓇ, ReYon Pharm)였고, 모든 환자에게 calcium carbonate 1,250 mg+cholecalciferol 1,000 IU/day p.o (DicamaxⓇ, Dalim Biotech)를 1년 동안 투여 후 골밀 도 검사를 시행하여 투여 전과 그 변화를 비교 분석 하였다.
통계는 SPSS (12.0 for window) 프로그램을 이용하 였고, 평균값은 평균±표준편차(mean±SD)로 표기하 였다. 각 군의 평균 비교는 독립표본 t검정(inde-
pendent t-test)을 이용하였으며, P<0.05를 통계적으 로 유의한 것으로 정의하였다.
결 과
알렌드로네이트를 복용한 21명의 실험군(Group I) 과 복용하지 않은 22명의 대조군(Group II)의 평균 나이는 각각 45.571±2.730세, 44.682±2.338세였으며, 신체질량지수(BMI)는 각각 22.319±2.253 kg/m2, 23.123±2.717 kg/m2로 두 군 간의 차이는 없었다. 치 료전 골밀도(BMD)는 Group I에서는 0.951±0.106 g/cm2, Group II에서는 0.928±0.104 g/cm2였고, T-score
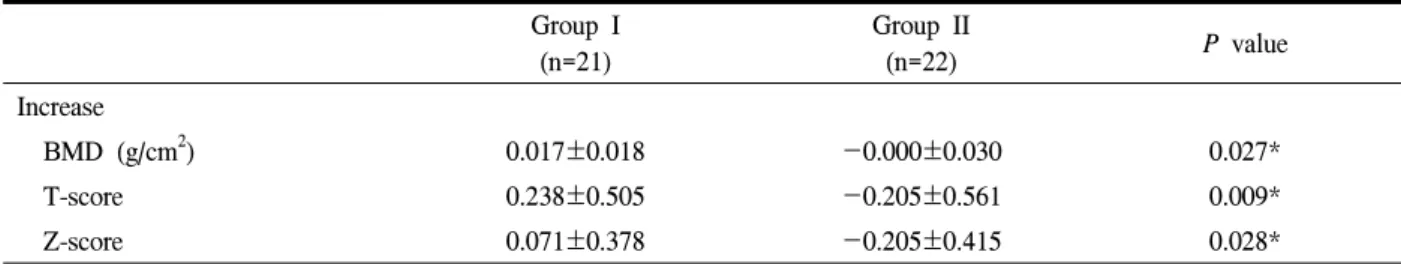
Table 3. Increase in bone mineral density at 12 months between two groups Group I
(n=21)
Group II
(n=22) P value
Increase
BMD (g/cm2) 0.017±0.018 -0.000±0.030 0.027*
T-score 0.238±0.505 -0.205±0.561 0.009*
Z-score 0.071±0.378 -0.205±0.415 0.028*
Group I = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day+alendronate 70 mg/week Group II = (calcium carbonate 1,250 mg+cholecalciferol 1,000 IU)/day
BMD; bone mineral density
*P<0.05
Values are expressed in Mean±SD
는 Group I에서는 -2.886±0.598, Group II에서는 -2.690±0.449, Z-score는 Group I에서는 -2.538±
0.644, Group II에서는 -2.571±0.468으로 두 군 간의 차이는 없었다(P>0.05)(Table 1).
Group I에서 매주 alendronate 70 mg과 calcium carbonate 1,250 mg+cholecalciferol 1,000 IU/day를 12 개월간 복용한 후 시행한 골밀도 결과는 0.968±
0.104 g/cm2였으며, T-score는 -2.648±0.601, Z-score 는 -2.467±0.698이었다. Group II에서 calcium carbo- nate 1,250 mg+cholecalciferol 1,000 IU/day를 12개월 간 복용한 후 시행한 골밀도 결과는 0.915±0.099 g/cm2, T-score는 -2.895±0.479, Z-score는 -2.777±0.708이 었다(Table 2).
1년 후 시행한 골밀도검사 결과 Group I에서는 0.017±0.018 g/cm2의 골밀도 증가 소견을 보였고, Group II에서는 -0.000±0.030 g/cm2의 소견을 보였 으며 통계적으로 두 군 간의 유의한 차이가 있었다 (P=0.027). 1년 후 T-score의 증가는 Group I에서는 0.238±0.505, Group II에서는 -0.205±0.561로 두 군 간의 유의한 차이가 있었다(P=0.009). 1년 후 Z-score 의 증가는 Group I에서는 0.071±0.378, Group II에서 는 -0.205±0.415로 두 군 간의 차이가 있었다(P=
0.028)(Table 3).
고 찰
골다공증은 원인 질환이 비교적 명확한 이차성 골
다공증과 원인이 불명확한 일차성 골다공증으로 분 류할 수 있다. 이차성 골다공증의 원인으로는 특발 성 고칼슘뇨증, 안드로겐 결핍, 섭식 장애, 무월경, 쿠싱 증후군, 부신 부전, 류마티스 질환, 염증성 장 질환, 혈액질환, 만성 심부전, Vit D 결핍, 칼슘 결핍, 마그네슘 결핍 등이 있으며, 원인 약물에는 항경련 제, 헤파린, 항암제, 면역억제제, 항안드로겐약물, GnRH agonist, aromatase inhibitor 등이 있다.9,10 젊은 성인에서 골밀도를 낮게 하는 원인은 다양하 고, 때로 성별에 따라 다르게 나타나는데, 젊은 남성 에서는 주로 알콜 섭취, 글루코코르티코이드 치료가 가장 흔하고,11,12 젊은 여성에서는 쿠싱병, 임신과 관 련된 골다공증, 골형성 부전증이 흔한 원인으로 알 려져 있다.13
골다공증의 진단기준은 T-score≤-2.5이며, 소아, 청소년, 폐경전 여성과 50세 이전 남성에서는 T- score보다는 Z-score≤-2.0를 적용하도록 하고 있다.5 폐경 전 여성에서는 골 소실이나 골다공증을 일으키 는 질환이 있는 경우 골밀도 검사를 하도록 ISCD는 권장하고 있으나, 현실적으로 골 소실을 일으키는 질환을 인지하지 못한 상태에서 골다공증이 진행되 는 경우들도 적지 않을 것이므로 Z-score≤-2.0인 경우에는 골다공증의 이차적 원인을 찾는 노력이 필 요하다.14-16
Kanis 등에 의하면 건강한 젊은 여성의 경우에도 T-score≤-1인 경우가 15%, ≤-2.5인 경우가 0.5%
로 나타났고, 최근 국내에서 시행한 연구에서 40~
49세의 젊은 여성의 골감소증 및 골다공증 유병률이 각각 23.6%, 26.8%에 이른다는 보고가 있어 젊은 폐 경 전 여성에서 골밀도가 낮은 경우가 적지 않은 것 으로 보고되고 있다.17,18 하지만 아직까지 젊은 여성 에서는 이차적 원인 질환 치료를 제외한 약물치료가 이루어지는 경우는 매우 드물다.
골밀도가 낮은 폐경 전 여성에서 이차적 원인이 없는 경우 고려할 수 있는 약물 치료로는 골흡수 억 제제로 칼슘, 에스트로겐, 안드로겐, 칼시토닌, 비스 포스포네이트, 활성형 비타민 D 등과 골형성 자극제 인 불화나트륨(sodium fluoride), 부갑상선 호르몬 (PTH) 등이 있다. 하지만 선택적 에스트로겐 수용체 조절제(SERMs)는 뼈에서 에스트로겐 작용을 차단하 여 골 소실을 촉진시킬 수 있어 폐경 전 여성에서는 금기 되고 있다.19
이 중 최근 가장 많이 사용되고 있는 알렌드로네 이트는 파골세포에 의한 골흡수를 강력히 억제하는 비스포스포네이트 제제로서 1세대인 에티드로네이 트보다 500~1000배 정도 약효가 강한 것으로 알려 져 있으며 지질대사에서는 콜레스테롤을 낮추고 HDL을 증가시키는 효과가 있다.20 하지만 알렌드로 네이트는 폐경 전 여성에서는 글루코코르티코이드 치료를 받는 경우에만 Food and Drug Administration (FDA)의 승인을 받았으며 임신 중 사용에 대해서는 쥐를 모델로 한 동물실험에서 알렌드로네이트가 태 반을 건너 뼈에 축적된다는 사실이 밝혀져 US FDA category C에 해당하는 약물이다.21 그러나 일부 연구 에서는 모체나 태아에 어떠한 해도 없었다는 보고도
있었다.22,23 하지만 알렌드로네이트가 뼈에 수년간
남아 있을 수 있고 중단 후에도 부작용이 있을 수 있으므로 향후 임신 계획이 있는 여성에게는 사용에 주의를 요한다.
현재의 골밀도 검사 대상 및 약물치료는 주로 폐 경 후 여성에게 초점이 맞추어져 있으나 폐경 전 여 성에서도 골다공증 이환율이 낮지 않음을 감안할 때, 적극적인 골밀도 검사 및 약물치료의 필요성이 있다고 생각된다. 이에 저자들은 폐경전 40대 여성 에게 골밀도 검사를 시행하고 골감소증 및 골다공증 을 보이는 환자들을 대상으로 알렌드로네이트를 1
년간 투여 하였다. 모든 대상 환자들에게는 칼슘과 비타민 D를 복용하게 하였다. 그 결과 알렌드로네이 트를 복용하지 않은 군(Group II)에 비해 Group I에 서 의의있게 골밀도의 증가를 보였으며, 합병증의 예는 없었다. 아직까지 폐경전 여성에게 비스포스포 네이트 제제 투여 여부 및 효과에 대한 연구 보고들 이 거의 없는 실정이다. 하지만 40대 이후 낮은 골밀 도를 보이는 폐경전 여성들에게 폐경기가 될 때까지 골흡수 억제제 투여를 지연시키는 것보다 향후 임신 계획이 없고, 다른 기저 질환이 없는 경우라면 폐경 전이라 하더라도 골흡수 억제제를 투여하는 게 향후 골밀도에 더 좋은 영향을 미칠 것으로 생각되어 본 연구를 시행하게 되었다. 여성에서는 특히 폐경이 되면서 에스트로겐 결핍으로 급격한 골소실이 나타 나지만, 골밀도의 감소는 나이가 들어감에 따라 계 속 진행되는 것이기 때문에 폐경전 여성에서 낮은 골밀도를 보인다면 이에 대한 치료가 먼저 시행되는 것이 좋을 것으로 사료된다.
또한 폐경 전 여성에서 낮은 골밀도를 보이는 경 우 2차적 원인을 찾기 위해 많은 검사가 요구되나, 모든 검사를 한다 하더라도 2차성 골다공증을 완전 히 배제하기는 힘든 면이 있으므로 이러한 상황에도 적극적인 약물치료가 효과적이라 볼 수 있다. 본 연 구는 연구 대상자의 수가 적고, 골밀도 변화에 영향 을 줄 수 있다고 알려진 운동량, 흡연, 음주 등에 대 한 자료 수집이 충분하지 않아 제한점들이 있다. 그 러나 여성의 경우 폐경 이후 에스트로겐 감소로 인 한 급격한 골소실이 진행되며, 폐경 자체가 골다공 증의 큰 위험인자가 되므로 저자들은 폐경 전 여성 에서의 골밀도 검사 및 골다공증 예방이 중요할 것 으로 생각된다. 향후 임상적 의의에 대한 더 많은 환 자를 대상으로 장기간의 추적검사들을 통한 많은 연 구가 필요할 것으로 생각된다.
참 고 문 헌
1. Bjarnason NH, Alexansersen P, Christiansen C.
Number of years since menopause: spontaneous bone loss is dependent but response to hormone
replacement therapy is independent. Bone 2002;30:
637-42.
2. Christiansen C, Lindsay R. Estrogens, bone loss and preservation. Osteoporos Int 1990;1:7-13.
3. Shin JC, Lee SH, Lee NW, Lee C, Rha JY. A Statistical Analysis of Risk Factors for Osteo- porosis in Menopausal Women. Korean J Obstet Gynecol 1998;41;798-806.
4. Kim SK, Kim SA, Jung H. Bone Mineral Density by Age in Gwangju Women. Osteoporosis 2010;8:
203-10.
5. Writing Group for the ISCD Position Development Conference. Diagnosis of osteoporosis in men, pre- menopausal women, and children. J Clin Densitom 2004;7:17-26.
6. Lewieecki EM, Kendler DL. Kiebzak GM, Schmeer P. Prince RL, E1-Hajj Fuleihan G, et al.
Special report on the official positions of the International Society for Clinical Densitometry.
Osteoporos Int 2004;15:779-84.
7. Kelman A, Lane NE. The management of secon- dary osteoporosis. Best Pract Res Clin Rheumatol 2005;19:1021-37.
8. Fleisch N, Russel RG, Straumann F: Effect of pyrophosphonate on hydroxyapatitie and its impli- cations in calcium homeostasis. Nature 1966;212:
901-3.
9. Haeney RP, Gallagher JC, Johnston CC, Neer R, Parfitt AM, Whedon GD. Calcium nutrition and bone health in the eldery. Am J Clin Nurt 1982;
36:986-1013.
10. WHO study group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO Technical Report Series 1994;
843. Geneva, Switzland.
11. Peris P, Guañabes N, Monegal A, Suris X, Álvares L, Martínez de Osaba MJ, et al. Aetiology and presenting symptoms in male osteoporis. Br J Rhematol 1995;34:936-41.
12. Peris P, Martínez-Ferrer A, Monegal A, Suris X, Álvares L, Pons F, et al. Clinical characteristics and etiologic factors of premenopausal steoporosis in a group of Spanish women. Semin Arthritis Rheum 2002;32:64-70.
13. Peris P, Guañabes N, Monegal A, Martínez de Osaba MJ, Álvares L, Ros I, et al. Aetiology and clinical characteristics of male osteoporosis. Have they changed in the last few years? Clin Exp Rheumatol 2008;26:582-8.
14. Khosla S, Lufkin EG, Hodgson SF, Fitzpatrick LA, Melton LJ 3rd. Epidemiology and clinical features of osteoporosis in young individuals. Bone 1994;
15:551-5.
15. Cohen A, Fleisher J, Freeby MJ, McMahon DJ, Irani D, Shane E. Clinical characteristics and medication use among premenopausal women with osteoporosis and low BMD:the experience of an osteoporosis referral center. J Womens Health (Larchmt) 2009;18:79-84.
16. Peris P, Guaňabens N, Martinez de Osaba MJ, Monegal A, Alvarez L, Pons F, et al. Clinical characteristics and etiologic factors of premeno- pausal osteoporosis in a group of Spanish women.
Semin Arthritis Rheum 2002;32:64-70.
17. Kanis JA, Melton LJ 3rd, Christiansen C, Johnston CC, Khalataev N. The diagnosis of osteoporosis. J Bone Miner Res 1994;9:1137-41.
18. Kim SJ, Lim KS, Ching YS, Song MS, Lee SY. A Study on the establishment of reference range of osteoporosis at distal radius: A community-based study. Osteoporosis 2006;4:98-106.
19. Bhalla AK. Management of osteoporosis in pre- menopausal woman. Best Pract Res Clin Rheu- matol 2010;24:313-27.
20. Joo IW, Oh HJ. Lipid Profile Changes in Post- menopausal Korean Women Treated with Alendro- nate (10 mg) for 2 Years -Comparing with Control Group-. Endocrinol Metab 2007;22:19-25.
21. Minsker DH, Manson JM, Peter CP. Effects of the bisphosphonate, alendronate on parturition in the rat. Toxicol Appl Pharmacol 1993;121:217-23.
22. Levy S, Fayez I, Taguchi N, Han JY, Aiello J, Matsui D, et al. Pregnancy outcome following in utero exposure to bisphosphonate. Bone 2009;44:
428-30.
23. Ornoy A. Wajngerg R, Diav-Citrin O. The outcome of pregnancy following pre-pregnancy or early pregnancy alendorante treatment. Reprod Toxicol 2006;22:578-9.