서 론
대사증후군은 고혈압, 비만, 고지혈증, 고혈당과 같은 심 혈관계 질환 위험인자의 군집체로서 그 발생에 인슐린 저항
성이 중요한 역할을 한다.1,2) 대사증후군이 심혈관계 질환의 발생 위험을 거의 두 배로 높이기 때문에 심혈관계 질환의 예방에 대사증후군의 진단 및 적절한 관리의 중요성이 강조
호모시스테인과 대사증후군의 상관관계
부산대학교 의학전문대학원 가정의학교실(1), 양산부산대학교병원 가정의학클리닉(2), 부산대학교 의학전문대학원 의학교육실(3), 부산대학교병원 가정의학과(4), 부산대학교 간호대학(5)
신경필(1)․이상엽(2),(3)․김윤진(1),(4)․이정규(1),(4)*․김동희(5) 정동욱(2)․이유현(4)․박선기(2)․조영혜(2)
The Association of Homocysteine and Metabolic Syndrome
Kyoung Pil Shin(1), Sang-Yeoup Lee(2),(3), Yun Jin Kim(1),(4), Jeong Gyu Lee(1),(4)*, Dong-Hee Kim(5), Dong-Wook Jung(2), Yu-Hyeon Yi(4), Seon Ki Park(2), Young-Hye Cho(2)
Department of Family Medicine, Pusan National University School of Medicine(1); Family Medicine Clinic, Pusan National University Yangsan Hospital(2); Medical Education Unit, Pusan National University School of Medicine(3);
Department of Family Medicine, Pusan National University Hospital(4); and College of Nursing, Pusan National University(5)
요 약
연구배경: 대사증후군은 심혈관질환의 위험인자가 군집되어 나타나는 것으로 인슐린 저항성이 대사증후군의 주 요한 병인으로 인식되고 있다. 호모시스테인은 methionine 대사과정에서 생성되는 아미노산으로 최근 인슐린 저항 성과의 연관성이 보고되고 있다. 하지만 둘 사이의 직접적인 연관성에 관하여는 아직 논란의 여지가 많아, 본 연구 에서 대사증후군과 호모시스테인 사이의 연관성을 살펴보고자 하였다.
방법: 2007년 1월 1일부터 2007년 12월 31일까지 일개 대학병원 건강증진센터를 방문한 수진자 중 20세 이상 의 성인 4,488명을 최종 연구대상으로 하였다. 대사증후군의 진단기준은 modified ATPIII definition을 사용하였고, 그 중 허리둘레 기준은 한국인의 기준에 따랐다. 대사증후군 유무에 따른 호모시스테인 농도의 차이, 호모시스테인 의 농도 차이에 따른 대사증후군 환자 비율을 조사하여, 대사증후군과 호모시스테인의 연관성을 보고자 하였다.
결과: 혈중 호모시스테인은 대사증후군을 가진 군이 대사증후군을 가지지 않은 군에 비하여 통계적으로 유의하 게 높은 값을 보여주었다(9.10 vs 7.97, P < 0.001). 호모시스테인의 농도차이에 따른 대사증후군 유병률은 호모시 스테인의 농도가 가장 낮은 4분위수와 비교하였을 때, 상위 4분위수 모두 교차비가 1.28, 1.48, 1.41로 유의하게 증가하는 것으로 나타났다(P < 0.05).
결론: 대사증후군과 호모시스테인은 통계적으로 유의한 연관성을 보이며, 이러한 기전을 확인하기 위한 전향적 연구가 필요하다.
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ 중심단어: 호모시스테인, 대사증후군, 예방, 인슐린 저항성
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
접수일자: 2010년 10월 7일, 심사일자: 2010년 11월 26일, 게재승인일자: 2010년 12월 30일 교신저자: 이정규, (602-739) 부산광역시 서구 아미동 1-10 부산대학교병원 가정의학과
Tel: 051-240-7833, Fax: 051-242-8671, E-mail: eltidine@hanmail.net, Mobile: 010-4552-1787
* 본 연구는 2010학년도 부산대학교 신임교수연구 정착금 지원으로 이루어졌음.
되고 있다.3) 이를 위하여 2001년 National Cholesterol Education Program (이하 NCEP)의 Adult Treatment Panel III (이하 ATP III) 지침에서는 임상에서 유용하게 사용할 수 있는 새로운 진단기준을 발표하였다.4)
최근 혈중 호모시스테인 농도와 인슐린 저항성 간의 관 련성이 몇몇 연구에서 제시되고 있다. 최근의 연구에서 인 슐린 저항성의 발생과 혈중 호모시스테인 사이의 연관성5) 이 제시되었으며 다른 연구에서는 혈중 호모시스테인이 혈 중 인슐린 농도와 관련이 있고, 다낭난소 증후군과 같이 인 슐린 저항성을 가진 사람에게서 혈중 호모시스테인 수치가 증가되어 있음이 보고되었다.6)
호모시스테인은 methionine 대사과정에서 생성되는 황 함유 아미노산 이며7), 증가된 혈중 호모시스테인은 죽상동 맥경화성 질환의 위험인자이다.8~11) 증가된 혈중 호모시스테 인은 혈관 내피 세포의 기능적 결함과 저밀도지단백콜레스 테롤의 산화, 혈관 평활근의 증식을 유발하고 혈관 세포에 다양한 작용을 하며, 혈관 응고 인자를 활성화시켜 혈전증 을 일으킨다.7,12,13)
혈중 호모시스테인 농도와 대사증후군 모두 인슐린 저항 성과 관련성이 제시되고 있지만, 아직까지 둘 사이의 직접 적인 연관성에 관해서는 명확하게 밝혀진 바가 없다. 따라 서 본 연구에서는 혈중 호모시스테인농도에 따른 대사증후 군의 유병률을 비교함으로서 둘 사이의 연관성 유무를 알아 보려고 한다.
방 법 1. 연구대상
2007년 1월부터 12월까지 부산에 소재한 일개 대학병원 건강증진센터를 방문한 수진자 중 면담과 검진을 모두 시행 받고, 호모시스테인 농도가 측정된 20세 이상의 성인을 대 상으로 하였다. 혈중 호모시스테인의 농도에 직접적인 영향 을 주는 것으로 알려진 신장 기능 이상자(serum Creatinine
≥ 1.5 mg/dL)14,15), 악성빈혈로 현재 치료 중인 자16), 갑상 선 기능 이상자(갑상선자극호르몬 > 5.0) 혹은 갑상선 기능 저하증으로 현재 치료중인 자17), 그리고 악성종양으로 현재 치료 중이거나 과거력을 지닌 자18)를 제외하였다. 또한 심 혈관계 질환의 과거력이 있는 자들을 제외한 4,488명을 최 종 연구 대상자로 선정하였다.
2. 연구방법 1) 신체계측
체중 및 신장은 직립 자세로 신발을 벗은 상태에서 0.1 kg, 0.1 cm까지 측정하였고, 체질량지수(Body mass index) 는 체중(kg)을 키의 제곱값(m2)으로 나누어 계산하였다. 허 리둘레는 기립자세에서 늑골 하단과 장골능 상부의 중간부
위19)로 하여 0.1 cm까지 측정하였다. 혈압은 약 10분간 안 정을 취한 뒤 앉은 자세에서 자동혈압기(BP-203RV II, Colin Corp., Aichi, Japan)를 사용하여 측정하였다.
2) 실험실 검사
12시간 이상 금식을 한 후 혈청 포도당 농도, 인슐린 농 도, 총콜레스테롤, 중성지방(triglyceride), 고밀도 지단백 콜 레스테롤(high density lipoprotein cholesterol), 저밀도 지단 백 콜레스테롤(low density lipoprotein cholesterol), 호모시 스테인 등을 오전에 검사하였다. 채취한 혈액 중 지질검사 항목은 혈액 자동분석기(Hitachi 7600-110 chemical analyzer, Hitachi co., Ltd, Tokyo Japan)를 사용하여 분석 하였는데, 총콜레스테롤, 고밀도 지단백 콜레스테롤, 저밀도 지단백 콜레스테롤은 enzymatic colorimetry를 이용하여 측 정하였고, 중성지방은 lipase, GK, GPO, POD with glycerol blank를 이용하여 측정하였다. Modular E-module 검사기기를 사용하여 혈청 포도당 농도를 HK, G6PD 및 UV법으로 측정하였다. 고민감도 C 반응성 단백(high sensitive C-reactive protein, 이하 hsCRP)과 혈청 creatinine은 Modular E-module을 사용하여 선택용해직접 법으로 측정하였고, 혈중 호모시스테인은 Modular Analytics E170 (Roche Diagnostics, Zurich, Switzerland)을 사용하여 enzymatic spectrophotometric method (HBI Co., Ltd., Anyang, Korea)로 측정하였다. 혈청 인슐린 농도는 Coat-A-Count® Insulin을 사용하여 solid-phase 125I radioimmunoassay 방법을 통해서 측정하였고, 인슐린 저항 성 지표로 알려진 Homeostasis model assessment index-insulin resistance [이하 HOMA-IR; fasting plasma insulin (U/mL) × fasting plasma glucose (mg/dL) / 22.5 × 18.182]20)를 산출하였다.
3. 대사증후군의 정의
본문의 대사증후군의 진단은 2001년 NCEP-ATP III에서 정한 기준4)을 바탕으로, 2005년 American Heart Association 와 National Heart, Lung, and Blood Institute에서 새 가이 드라인으로 제시한 modified ATP III definition을 사용하였 다.21) 복부 비만 항목은 한국인의 허리둘레 기준에 따라 남 자 ≥ 90 cm, 여자 ≥ 85 cm를 적용하였다.22)
다음의 5가지 항목 중 3가지 이상을 만족하는 경우를 대 사증후군으로 정의하였다.
(1) 허리둘레 ≥ 90 cm (남자), ≥ 85 cm (여자) (2) 혈압 ≥ 130/85 mmHg 또는 항고혈압약제 복용 중인 자 (3) 공복혈당 ≥ 100 mg/dL 또는 당뇨병 치료 중인 자 (4) 중성지방 ≥ 150 mg/dL 또는 치료 중인 자 (5) HDL 콜레스테롤 < 40 mg/dL (남자), < 50 mg/dL
(여자) 또는 치료 중인 자
4. 통계분석
대사증후군 유무에 따른 일반적 특성 및 심혈관계 위험 인자 지표들의 평균을 비교하기 위하여 two sample t-test와 chi-squared test를 사용하였다. 호모시스테인과 체질량지수, 총콜레스테롤, 저밀도지단백콜레스테롤, HOMA-IR, hsCRP 등의 심혈관계 위험인자들의 상관관계는 성별 및 연령을 보 정한 부분상관계수(partial correlation coefficients)를 구하 였다. 혈중 호모시스테인의 4분위수에 따른 대사증후군의 유병률을 보기 위하여 chi-squared test를 사용하였고, 연령, 성별, 음주량 및 흡연력 등을 보정한 후 혈중 호모시스테인 의 농도와 대사증후군의 위험과의 연관성을 알아보기 위해 다중 로지스틱 회귀분석을 사용하였다. 통계분석은 SPSS 12.0 for windows를 이용하였고 P value가 0.05 미만인 경 우를 통계학적 유의수준으로 하였다.
결 과 1. 대상자의 일반적인 특성
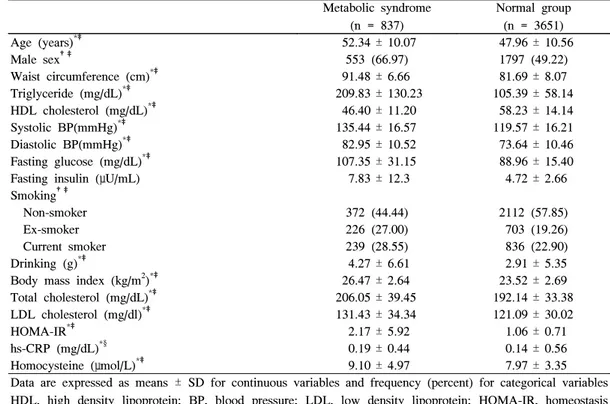
연구 대상자들을 대사증후군의 유무에 따라 나누어 일반 적인 특성 및 심혈관질환 위험인자 지표들을 비교하였다 (Table 1). 총 연구 대상자 4,488명중 대사증후군을 가진 사
람은 837명으로 18.7%의 유병률을 보였다. 연령, 남성의 비 율, 체질량지수, 총콜레스테롤, 저밀도지단백콜레스테롤, HOMA-IR, hsCRP 등이 대사증후군이 있는 군에서 통계적 으로 유의하게 높았다(P < 0.05). 혈중 호모시스테인 역시 대사증후군이 있는 군이 통계적으로 유의하게 높은 값을 보 여주었다(9.10 vs 7.97, P < 0.001).
2. 호모시스테인과 심혈관계 위험인자 사이의 상관관계
호모시스테인과 심혈관계 위험인자 사이의 상관관계를 분석한 결과, 총콜레스테롤, 체질량지수 및 저밀도지단백콜 레스테롤 등은 호모시스테인과 유의한 상관관계가 관찰되 지 되지 않았으며, 중성지방(P < 0.001), 고밀도지단백콜레 스테롤(P < 0.05), 허리둘레(P < 0.01), HOMA- IR (P <
0.05), hsCRP (P < 0.05) 등의 다른 지표들은 통계적으로 유의한 상관관계를 보여주었다(Table 2).
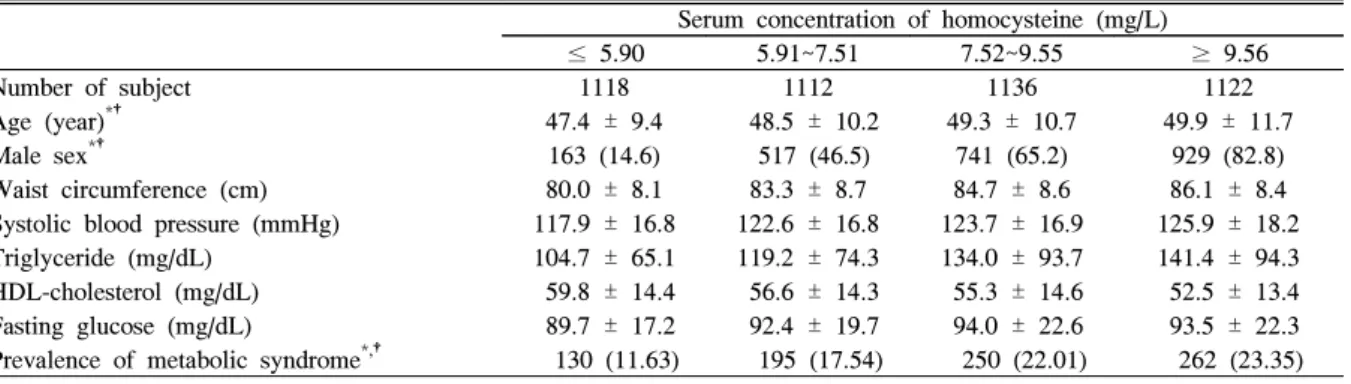
3. 호모시스테인 4분위수에 따른 대사증후군의 유병률
호모시스테인을 4분위수 분류에 따라 4개의 군으로 나누 고 각각의 대사증후군의 환자수를 관찰하였다(Table 3). 호
Table 1. Demographic and clinical characteristics of study group Metabolic syndrome
(n = 837)
Normal group (n = 3651)
Age (years)*‡ 52.34 ± 10.07 47.96 ± 10.56
Male sex†‡ 553 (66.97) 1797 (49.22)
Waist circumference (cm)*‡ 91.48 ± 6.66 81.69 ± 8.07
Triglyceride (mg/dL)*‡ 209.83 ± 130.23 105.39 ± 58.14
HDL cholesterol (mg/dL)*‡ 46.40 ± 11.20 58.23 ± 14.14
Systolic BP(mmHg)*‡ 135.44 ± 16.57 119.57 ± 16.21
Diastolic BP(mmHg)*‡ 82.95 ± 10.52 73.64 ± 10.46
Fasting glucose (mg/dL)*‡ 107.35 ± 31.15 88.96 ± 15.40
Fasting insulin (μU/mL) 7.83 ± 12.3 4.72 ± 2.66
Smoking†‡
Non-smoker 372 (44.44) 2112 (57.85)
Ex-smoker 226 (27.00) 703 (19.26)
Current smoker 239 (28.55) 836 (22.90)
Drinking (g)*‡ 4.27 ± 6.61 2.91 ± 5.35
Body mass index (kg/m2)*‡ 26.47 ± 2.64 23.52 ± 2.69
Total cholesterol (mg/dL)*‡ 206.05 ± 39.45 192.14 ± 33.38
LDL cholesterol (mg/dl)*‡ 131.43 ± 34.34 121.09 ± 30.02
HOMA-IR*‡ 2.17 ± 5.92 1.06 ± 0.71
hs-CRP (mg/dL)*§ 0.19 ± 0.44 0.14 ± 0.56
Homocysteine (μmol/L)*‡ 9.10 ± 4.97 7.97 ± 3.35
Data are expressed as means ± SD for continuous variables and frequency (percent) for categorical variables HDL, high density lipoprotein; BP, blood pressure; LDL, low density lipoprotein; HOMA-IR, homeostasis model assessment index-insulin resistance; hs-CRP, high-sensitivity C-reactive protein.
*P obtained by two sample t-test.
†P obtained by chi-squared test.
‡P < 0.001.
§ P < 0.05.
모시스테인의 농도가 높은 4분위수로 갈수록 대사증후군의 유병률이 유의하게 증가하였으나 연령 및 남성의 비율 또한 높았다(P < 0.001).
4. 대사증후군과 호모시스테인에 대한 로지스틱 회귀분석
혈중 호모시스테인의 농도가 높을수록 대사증후군의 위
험이 증가하는지를 확인하기 위해, 호모시스테인을 4개의 군으로 나눈 후 대사증후군의 발생에 영향을 줄 수 있는 인 자인 성별, 나이, 음주상태 및 흡연력 등을 보정하여 로지스 틱 회귀분석을 시행하였다(Table 4). 그 결과 호모시스테인 의 농도가 가장 낮은 4분위수와 비교하였을 때, 상위 4분위 수 모두 교차비가 1.28, 1.48, 1.41로 유의하게 증가하는 것 Table 4. Logistic regression analysis for metabolic syndrome
Dependent Variable Odds ratio 95% Confidence interval P
Homocysteine (mg/L)
≤ 5.90 1.00
5.91~7.51 1.28 1.004~1.660 0.046
7.52~9.55 1.48 1.166~1.932 0.002
≥ 9.56 1.41 1.118~1.897 0.005
Smoking status
Non-smoker 1.00
Ex-smoker 1.13 0.883~1.438 0.338
Smoker 1.17 0.915~1.494 0.211
Sex
Women 1.00
Men 1.42 1.118~1.806 0.004
Age 1.04 1.035~1.051 < 0.001
Drinking 1.03 1.013~1.041 < 0.001
Table 2. Correlation of serum homocysteine level and markers of cardiovascular risk Markers of cardiovascular risk Partial correlation coefficient P*
Total cholesterol 0.021 0.170
Triglycerides 0.089 < 0.001
HDL cholesterol -0.035 0.021
LDL cholesterol 0.013 0.368
Body mass index 0.025 0.096
Waist circumference 0.039 0.009
Fasting glucose 0.015 0.330
HOMA-IR 0.033 0.026
hs-CRP 0.042 0.030
HDL, high density lipoprotein; LDL, low density lipoprotein; HOMA-IR, homeostasis model assessment index-insulin resistance; hs-CRP, high-sensitivity C-reactive protein.
* adjusted by age and sex.
Table 3. Prevalence of metabolic syndrome according to quartiles of serum homocysteine
mean ± SD Serum concentration of homocysteine (mg/L)
≤ 5.90 5.91~7.51 7.52~9.55 ≥ 9.56
Number of subject 1118 1112 1136 1122
Age (year)*† 47.4 ± 9.4 48.5 ± 10.2 49.3 ± 10.7 49.9 ± 11.7
Male sex*† 163 (14.6) 517 (46.5) 741 (65.2) 929 (82.8)
Waist circumference (cm) 80.0 ± 8.1 83.3 ± 8.7 84.7 ± 8.6 86.1 ± 8.4 Systolic blood pressure (mmHg) 117.9 ± 16.8 122.6 ± 16.8 123.7 ± 16.9 125.9 ± 18.2 Triglyceride (mg/dL) 104.7 ± 65.1 119.2 ± 74.3 134.0 ± 93.7 141.4 ± 94.3 HDL-cholesterol (mg/dL) 59.8 ± 14.4 56.6 ± 14.3 55.3 ± 14.6 52.5 ± 13.4 Fasting glucose (mg/dL) 89.7 ± 17.2 92.4 ± 19.7 94.0 ± 22.6 93.5 ± 22.3 Prevalence of metabolic syndrome*,† 130 (11.63) 195 (17.54) 250 (22.01) 262 (23.35)
* P < 0.001 obtained by chi-square test for trend.
†Data are expressed as frequency (percent).
으로 나타났다(P < 0.05).
고 찰
최근 식생활의 서구화와 비만의 증가 등으로 인하여 심 혈관질환의 유병률 및 사망률이 급속하게 증가하고 있다.23) 따라서 심혈관질환에 대한 예방 및 적절한 관리가 의학적 관심으로 대두되고 있다. 이에 본 연구는, 죽상경화성 질환 의 예측 지표로서 제시되고 있는 호모시스테인과 심혈관질 환의 주요 위험인자인 대사증후군 사이의 연관성을 알아보 기 위하여 연구를 실시하였다.
본 연구에서의 대사증후군의 유병률은 NCEP-ATP III 기준을 적용하였을 때 18.7%로, 다른 연구에서 조사된 NCEP-ATP III 기준 한국 성인의 대사증후군 유병률인 11~19%와 유사한 값을 나타내었다.24,25) 호모시스테인의 4 분위수에 따른 대사증후군의 유병률은 각각 11.6%, 17.5%, 22.01%, 23.35%로 호모시스테인의 농도가 높은 군으로 갈 수록 유병률이 증가하였다. 대사증후군 유병률에 영향을 주 는 인자로 알려진 나이, 성별, 음주량, 흡연여부 등을 보정 했을 때에도 호모시스테인이 낮은 군에 비하여 높은 군의 대사증후군 발생 위험이 증가하였다.
기존의 연구에 의하면 고호모시스테혈증은 죽상경화성 혈관질환, 심부정맥혈전증 및 심근경색증의 독립적인 위험 인자로 보고되었다.7-11) 본 연구에서는 호모시스테인은 죽상 경화성 혈관질환의 독립적인 위험인자로 알려진 중성지방, 허리둘레, HOMA- IR, hsCRP 등의 지표와 유의한 상관관 계를 보여주어 기존의 연구와 유사한 결과를 나타내었다.
스웨덴 인구를 대상으로 시행한 the Skaraborg project26)에 서는 대사증후군과 고호모시스테인혈증 간의 관련성을 제 시한 바 있다. 본 연구에서도 호모시스테인 농도와 대사증 후군의 유병률 사이에 유의한 관련성이 관찰되며, 이러한 관련성은 증가된 인슐린 저항성에 기인한 것으로 생각된다.
증가된 혈중 호모시스테인은 혈관 내피세포에 손상을 주
며,7,12,13) 손상 받은 혈관 내피세포는 인슐린 저항성을 증가
시킬 가능성이 있으며 이는 대사증후군 발생과 관련될 것으 로 추정된다.27) 증가된 인슐린 저항성으로 인하여 혈중 인 슐린 농도가 증가하고, 이러한 인슐린 농도의 증가가 대사 증후군의 발생에 영향을 줄 수 있다.28)
대사증후군과 호모시스테인사이의 관련성은 대사증후군 예방 측면에서 의의를 가질 수 있다. 규칙적인 운동과 같은 대사증후군 및 심혈관계 질환의 예방에 효과적인 생활습관 교정 이외에도 엽산, vitamin B12, vitamin B6의 부족이나 흡연, 대사이상과 같은 혈중 호모시스테인의 농도에 영향을 주는 것으로 알려진 요소들을 개선함으로써 호모시스테인 을 낮출 수 있고, 이는 인슐린 저항성 개선, 대사증후군의 예방 및 관리에도 유용할 것으로 생각된다.7)
본 연구의 제한점으로는 대사증후군 발생과 호모시스테 인 농도에 영향을 줄 수 있는 약물 사용력이나 식이습관 및 운동량에 관한 조사가 부족하였으며, 단면연구라는 제한점 이 있다. 이러한 제한점에도 불구하고 본 연구는 현재 호모 시스테인과 대사증후군과의 관련성에 대한 연구가 부족한 실정에서 둘 사이의 관련성을 확인하고, 호모시스테인이 높 은 사람들의 대사증후군의 예방 및 적절한 관리 전략을 세 우기 위한 앞으로의 연구에 기초자료를 제시했다는데 그 의 미가 있다.
대사증후군과 호모시스테인 사이의 관련성 및 인과관계 를 정확하게 분석하기 위해서는 본 연구의 제한점을 보완한 대규모의 전향적 연구가 필요할 것으로 생각된다.
ABSTRACT
The Association of Homocysteine and Metabolic Syndrome
Background: Metabolic syndrome is a cluster of all the risk factors of cardiovascular diseases, in which insulin resistance plays a key role as the pathogenesis.
Homocysteine is an amino acid that is generated during methionine metabolism. It is associated with insulin resistance. However, there is a controversy concerning the corelation between homocysteine and metabolic syndrome.
This study is designed to further investigate this subject.
Methods: A total of 4488 patients who were older than 20 years of age and visited the Health Promotion Center of a university affiliated hospital from Jan 1, 2007 to Dec 31, 2007 were assigned to this study. Modified ATP III definition was used for diagnosis of metabolic syndrome while Korean standard for waist circumference was used.
This study tried to prove the correlation of homocysteine concentration and metabolic syndrome by using two statistical tools. The first was the comparison of homocysteine concentration between the group with and without metabolic syndrome. The second was the prevalence ratio of metabolic syndrome according to the level of homocysteine concentration.
Results: The group with metabolic syndrome showed a significantly higher level of homocysteine compared to the other groups (9.10 vs 7.97, P < 0.001). In comparison to the group with the lowest (< 5.90 mg/L, Q1) homocysteine level, the prevalence of metabolic syndrome among the other groups (Q2.Q3 and Q4) were significantly higher with odds ratio being 1.28, 1.48 and
1.41 for groups Q2, Q3, and Q4, respectively.
Conclusion: Metabolic syndrome was shown to have a significant correlation with a high level of homocysteine.
Therefore, lowering homocysteine level may help prevent metabolic syndrome.
Key words: Homocysteine, Metabolic syndrome, Prevention of metabolic syndrome, Insulin resistance
참 고 문 헌
1. Isomaa B, Almgren P, Tuomi T, Forsen B, Lathi K, Nissen M, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome.
Diabetes Care 2001;24:683-9.
2. Bjorntorp P. Abdominal obesity and the metabolic syndrome. Ann Med 1992;24:465-8.
3. Gami AS, Witt BJ, Howard DE, Erwin PJ, Gami LA, Somers VK, et al. Metabolic syndrome and risk of incident cardiovascular events and death: a systematic review and meta-analysis of longitudinal studies. J Am Coll Cardiol 2007;49:403-14.
4. Expert Panel on Detection Evaluation and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults(Adult Treatment Panel
Ⅲ). JAMA 2001;285:2486-97.
5. Fonseca V, Dicker-Brown A, Ranganathan S, Song W, Barnard RJ, Fink L, et al. Effects of a high fat sucrose diet in enzymes in homocysteine metabolism in the rat. Metabolism 2000;49:736-41.
6. Loverro G, Korusso F, Mei L, Depalo R, Cormio G, Selvaggi L. The plasma homocysteine levels are increased in polycystic ovary syndrome. Gynecol Obstet Invest 2002;53:157-62.
7. George N Welch, Joseph L Oscalzo, PH D. Homocysteine and atherothrombosis. N Engl J Med 1998;338:1042-50.
8. Clarke R, Daly L, Robinson K, Naughten E, Cahalane S, Fowler B, et al. Hyperhomocysteinemia: an independent risk factor for vascular disease. N Engl J Med 1991;324:1149-55.
9. Stampfer MJ, Malinow MR, Willett WC, Newcomer LM, Upson B, Ullmann D, et al. A prospective study of plasma homocysteine and risk of myocardial
infarction in US physicians. JAMA 1992;268:877-81.
10. Graham IM, Daly LE, Refsum HM, Robinson K, Brattstrom LE, Ueland PM, et al. Plasma homocysteine as a risk factor for vascular disease: the European Concerted Action Project. JAMA 1997;277:1775-81.
11. den Heijer M, Kostor T, Blom HJ, Bos GM, Briet E, Reitsma PH, et al. Hyperhomocysteinemia as a risk factor for deep-vein thrombosis. N Engl J Med 1996;334:759-62.
12. Lentz SR. Homocysteine and vascular dysfunction.
Life Sci 1997;61:1205-15.
13. Cattaneo M. Hyperhomocysteinemia and thrombosis.
Lipids 2001;36 suppl:S13-26.
14. Wilcken DE, Gupta VJ. Sulphur containing amino acids in chronic renal failure with particular reference to homocystine and cysteine-homocysteine mixed disulphide. Eur J Clin Invest 1979;9:301-7.
15. Chauveau P, Chadefaux B, Coude M, Aupetit J, Hannedouche T, Kamoun P, et al. Hyperhomocysteinemia, a risk factor for atherosclerosis in chronic uremic patients. Kidney Int suppl 1993;41:S72-7.
16. Savage DG, Lindenbaum J, Stabler SP, Allen RH.
Sensitivity of serum methylmalonic acid and total homocysteine determinants for diagnosing cobalamin and folate deficiencies. Am J Med 1994;96:239-46.
17. McCully KS. Homocysteine and vascular disease. Nat Med 1996;2:386-9.
18. Mayer EL, Jacobsen DW, Robinson K. Homocysteine and coronary atherosclerosis. J Am Coll Cardiol 1996;27:517-27.
19. WHO. Obesity: Preventing and Managing the Global Epidemic: Report of a WHO Consultation. Geneva, Switzerland: World Health Organization; 2000.
20. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Teacher DF, Turner RC. Homeostasis model assessment:
insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man.
Diabetologia 1985;28:412-9.
21. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al. Diagnosis and management of the metabolic syndrome. An American Heart Association/National Heart, Lung, and Blood Institute scientific statement. Circulation 2005;112:2735-52.
22. Lee SY, Park HS, Kim DJ, Han JH, Kim SM, Cho GJ, et al. Appropriate waist circumference cutoff points for central obesity in Korean adults. Diabetes
Res Clin Pract 2007;75:72-80.
23. Important cause of death in Korea; 2005. Seoul:
Korea National Statistical Office 2005.
24. Park JS, Park HD, Yun JW, Jung CH, Lee WY, Kim SW. Prevalence of the metabolic syndrome as defined by NCEP-ATPⅢ among the urban Korean population.
The Korean Journal of Medicine 2002;63:290-8.
25. Park SH, Lee WY, Kim SW. The relative risks of the metabolic syndrome defined by adult treatment panel 3 according to insulin resistance in Korean population.
The Korean Journal of Medicine 2003;64:552-60.
26. Bjorck J, Hellgren M, Rastam L, Lindblad U.
Associations between serum insulin and homocysteine in a Swedish population-a potential link between the metabolic syndrome and hyperhomocysteinemia: the Skaraborg project. Metabolism 2006;55:1007-13.
27. Pinkney JH, Stehouwer CD, Coppack SW, Yudkin JS.
Endothelial dysfunction: cause of the insulin resistance syndrome. Diabetes 1997;46 Suppl 2:S9-13.
28. Meigs JB, Jacques PF, Selhub J, Singer DE, Nathan DM, Rifai N, et al. Fasting plasma homocysteine levels in the insulin resistance syndrome: the Framingham offspring study. Diabetes Care 2001;24:1403-10.