서 론
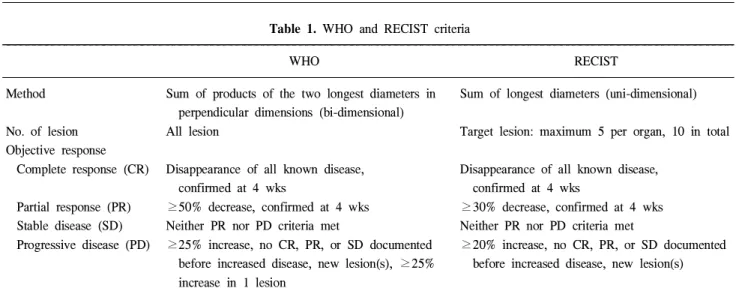
유방암 치료에 있어 술 전 항암화학 요법은 초기에는 주 로 수술이 불가능한 국소 진행성 유방암을 대상으로 시행 되었으나 최근에는 국소 진행성 유방암뿐만 아니라 모든 유방암에서 치료의 한 가지 선택으로 고려되고 있다. 유방 암 환자에서 술 전 항암화학 요법은 유방암 종괴의 크기를 감소시켜 유방 보존술을 가능하게 한다는 장점이 있다.(1,2) 현재까지 어떠한 약물이 유방암 환자에 있어 술 전 항암 화학 요법에 가장 이상적인지 알려진 바는 없으나 anthracy- cline 계열의 약물이 많이 사용되고 있으며 최근에는 taxane 계열의 약물도 점차 널리 사용되고 있다. 이와 같이 술 전 항암화학 요법에 사용되는 새로운 약물들에 대한 연구가 진행됨에 따라 투여되는 약물에 의한 임상적인 반응을 평 가하는 것이 중요하게 되었고 이를 정확하게 평가하려는 노력이 시도되었다.(3-5) 이 중 1981년에 발표된 World Health Organization (WHO)에 의한 기준이 널리 사용되어왔다.(4) WHO 기준에 의하면, 반응 정도에 따라 완전관해(complete response), 부분관해(partial response), 병의 진행(progressive disease), 병의 안정상태(stable disease)로 정의하였으며 각 종양의 크기는 이차원(bidimension)적으로 표시하고, 병변 이 여러 개일 경우, 각각의 병변에 대한 치수의 곱을 구하여 그것을 합한 값을 사용하여 최종 반응성 평가에 사용한다.
그러나 WHO 기준에 의한 분류가 실제 임상적으로 사용하 기에 복잡하고 어려운 면이 있어 새로운 종양의 반응성 평 가 방법이 대두되었고 이에 따라 새로운 반응성 평가 방법 인 RECIST (response evaluation criteria in solid tumors) 기준 이 발표되었다.(6) 이는 일차원(unidimension)적인 표시 방법
술 전 화학요법을 받은 유방암 환자에서 WHO와 RECIST 기준에 따른 반응성
가톨릭대학교 의과대학 외과학교실
이재청·배자성·김미라·박우찬·송병주·김정수·정상설
RECIST Criteria for Tumor Response in the Pa- tients with Breast Cancer Who Had Neoadju- vant Chemotherapy
Jae-Cheong Lee, M.D., Ja-Seong Bae, M.D., Mi-Ra Kim, M.D., Woo Chan Park, M.D., Byong-Ju Song, M.D., Jeong Soo Kim, M.D. and Sang-Seol Jung, M.D.
Purpose: This study compared the response evaluation using the WHO (World Health Organization) criteria for patients with breast cancer with that of the RECIST (Res- ponse Evaluation Criteria In Solid Tumor) criteria in order to determine the significance of the RECIST criteria in breast cancer.
Methods: Between 2001 and 2005, 42 patients with measurable lesions radiologically receiving neoadjuvant che- motherapy for a breast carcinoma were enrolled in this study. The results were compared using a kappa test as a concordance measure between the two response criteria.
Results: With the WHO criteria, the overall response and progression rate were 35.7% (CR 0, PR 15) and 16.6% (PD 7) respectively. On the other hand, the overall response and progression rate using the RECIST criteria were 38.0% (CR 0, PR 16) and 7% (PD 3) respectively. The kappa value as a concordance measure between two response criteria was 0.718.
Conclusion: The RECIST criteria are comparable to the WHO criteria in evaluating the response of breast cancer patients who have undergone neoadjuvant chemotherapy. A comparison of these results with other studies of more common tumor types supports the implementation of RECIST as the standard criteria for evaluating the treatment response but also for monitoring progression. (J Korean Surg Soc 2007;72:89-93)
Key Words: WHO criteria, RECIST criteria, Breast cancer, Neoadjuvant chemotherapy
중심 단어: WHO 분류, RECIST 분류, 유방암, 술 전 항암요법
Department of Surgery, College of Medicine, The Catholic University of Korea, Seoul, Korea
책임저자:정상설, 서울시 서초구 반포4동 505번지 ꂕ 137-807, 강남성모병원 외과 Tel: 02-590-1346, Fax: 02-595-2991 E-mail: ssjung@catholic.ac.kr
접수일:2006년 9월 12일, 게재승인일:2006년 10월 2일
89
으로 각 병변의 최대 직경의 합을 구하여 치료 전후의 항암 화학요법의 반응성 평가를 WHO 기준과 같이 4가지 기준, 즉 완전관해, 부분관해, 병의 진행, 병의 안정상태 중 하나 로 표시하도록 하였다. 본 연구는 유방암 환자의 술 전 항암 화학요법의 반응성을 평가하기 위해 사용된 WHO 기준과 새로 개발된 RECIST 기준의 차이를 정확히 이해하고 각각 의 반응정도의 차이를 측정함으로써 향후 치료방침을 결정 하는 데 있어 도움을 받고자 하였다.
방 법
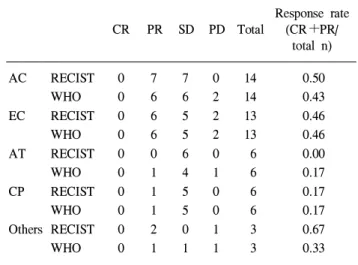
2001년 1월부터 2005년 12월까지 가톨릭대학교 강남성모 병원 외과에서 유방암으로 술 전 항암화학요법을 받은 72 명의 환자를 대상으로 후향적으로 조사하였다. 모든 환자 는 항암화학요법 전 세침흡인세포검사법이나 핵생검으로 모두 조직학적으로 유방암으로 진단받았다. 72명의 환자중 항암 치료 전후간에 동일한 방사선학적인 방법으로 반응성 평가가 이루어진 환자는 42명이었다. 이 중, 35명(83.3%)은 항암화학요법 전후에 유방 초음파를 이용하여 평가되었으 며, 4명(9.5%)은 MRI, 2명(4.7%)은 CT, 1명(2.3%)은 단순유방 촬영으로 평가되었다. 술 전 항암화학요법에 쓰인 약물은 AC (doxorubicin 60 mg/m2, cyclophosphamide 600 mg/m2)가 14명(33.3%), EC (epirubicin 60 mg/m2, cyclophosphamide 60 mg/m2)가 13명(30.9%), AT (doxorubicin 50 mg/m2, docetaxel 75 mg/m2)가 6명(14.2%), CP (cyclophosphamide 600 mg/ m2, pirarubicin 60 mg/m2)가 6명(14.2%), 그리고 기타 3명(7.1%) 이었으며 모든 환자에서 3주기 항암화학요법 시행후에 반 응성 평가를 실시하였다.
종양의 항암화학 요법의 반응성은 WHO와 RECIST의 각각의 기준에 따라 평가되었다(Table 1). 각 기준에 따른
반응성의 일치도를 검정하기 위해 통계학적으로 카파값 (kappa value)을 사용하였으며, 각 기준에 따른 반응도의 차 이는 카이제곱 검정(Chi-square test)을 실시하였다.
결 과
모두 42명의 환자가 이 연구에 기록되었으며 환자의 평균 나이는 47.9세였다. 유방암의 조직학적 분류에서는 41명이
Table 1. WHO and RECIST criteria
WHO RECIST
Method Sum of products of the two longest diameters in Sum of longest diameters (uni-dimensional) perpendicular dimensions (bi-dimensional)
No. of lesion All lesion Target lesion: maximum 5 per organ, 10 in total
Objective response
Complete response (CR) Disappearance of all known disease, Disappearance of all known disease,
confirmed at 4 wks confirmed at 4 wks
Partial response (PR) ≥50% decrease, confirmed at 4 wks ≥30% decrease, confirmed at 4 wks Stable disease (SD) Neither PR nor PD criteria met Neither PR nor PD criteria met
Progressive disease (PD) ≥25% increase, no CR, PR, or SD documented ≥20% increase, no CR, PR, or SD documented before increased disease, new lesion(s), ≥25% before increased disease, new lesion(s) increase in 1 lesion
WHO = World Health Organization; RECIST = response evaluation criteria in solid tumors; CR = complete remission; PR = partial remi- ssion; SD = stable disease; PD = progressive disease.
Table 2. Patient and tumor characteristics after neoadjuvant chemotherapy
Characteristics n
Mean age 47.9 (27∼79)
Tumor histology
Invasive ductal carcinoma 41
Apocrine carcinoma 1
Stage
I 11
II 16
III 15
Estrogen receptor
Positive 17
Negative 22
Progesterone receptor
Positive 16
Negative 23
Surgery
Mastectomy 38
Wide excision 4
침윤성 유방암이었으며 1명만이 아포크린암종(apocrine car- cinoma)이었다. 술 전 항암요법 후 평균 종양의 크기는 3.06 cm이며 에스트로젠 수용제 양성은 17명이었고 프로게스테 론 수용체 양성은 16명이었으며 c-erbB2 수용체 양성은 16 명이었다(Table 2). WHO 기준에 의한 전체 반응도(overall response rate)는 15명(35.7%)이었고 진행도(progression rate) 는 7명(16.6%), RECIST 기준에 의한 전체 반응도는 16명 (38.0%)이었고 진행도는 3명(7%)이었다. 두 반응성 평가 기 준 간의 통계학적으로 유의한 차이점은 없었다. WHO기준 과 RECIST 기준에 의한 42명 각 환자의 반응성 평가에 대 한 일치도 검정에서 카파 값(kappa value)은 0.718이었다.
WHO 기준의 반응성 평가에서 총 7명이 RECIST 기준에 선 재평가되었다(Table 3, Fig. 1). 1명은 WHO 기준의 PR에 서 RECIST 기준의 SD로 재평가되었고, 2명은 각각 SD에서 PR로, 그리고 4명이 PD에서 SD로 재평가되었다. RECIST 기준으로 볼 때, WHO 기준보다 PR과 SD의 수가 더 많았고 PD의 수가 더 적었다. 술 전 항암 화학요법에 따른 반응도 는 AC와 EC 항암 화학요법이 다른 항암 화학요법보다 상 대적으로 더 높은 반응도를 볼 수 있고, 두 반응성 평가 기
준 간의 유의한 차이는 없었다(Table 4).
고 찰
유방암 환자에서 술 전 항암화학요법의 적용은 점차 증 가하고 있으며 이는 유방암에서 암의 병기를 낮추고 종양 의 크기를 감소시켜, 절제율을 높이며 이에 따라 유방보존 술의 빈도가 증가하고 있으며(1,2) 술 전 항암화학요법에 의한 조직학적인 반응이 진행성 유방암에서 중요한 예후인 자로 여겨지고 있다.(7-9)
새로운 항암약물의 개발과 함께 술 전 항암화학요법에 쓰이는 약물의 개수와 종류가 증가하고 있고 이에 따라 항 암약물에 의한 종양의 반응성을 정확히 평가하는 것이 수 술방법을 결정하는 데 도움을 주고 또한 예후를 예측하는 데 도움을 줄 것이라고 생각된다.
이러한 이유로 많은 연구자들이 항암화학요법의 반응성 평가를 위한 기준을 마련하기 위해 노력해왔다. 1981년에 Miller 등(4)은 반응성 평가를 표준화하는 결과를 보고하였 고 이것이 WHO 기준의 기초가 되었다. WHO 기준은 이차 원적인 방법으로 가장 긴 직경과 이에 수직인 직경을 곱하 여 그 값을 계산하여 반응성을 평가하는 방법이다. 이러한 표준화된 방법을 제시함으로써 새로운 약제를 평가하거나 약의 효과를 비교하는 데 도움이 되었다. 그러나 많은 연구 자들은 WHO 기준이 이차원적인 반응을 평가함으로써 아 주 많은 시간이 소비되고 복잡하다는 문제점을 제시하였고 WHO 기준을 변형시키려는 노력이 계속되었다. 최근 제시 된 RECIST 기준은 일차원적인 측정으로 반응성을 평가하 는 방법이다. RECIST 기준의 이론적인 배경은, 개개의 종 양의 가장 긴 직경의 합은 이차원적 값의 곱의 합보다도
Table 3. Concordance between WHO and RECIST criteria
RECIST WHO
CR PR SD PD Total
CR 0 0 0 0 0
PR 0 14 1 0 15
SD 0 2 18 0 20
PD 0 0 4 3 7
Total 0 16 23 3 42
CR = complete remission; PR = partial remission; SD = stable disease; PD = progressive disease.
Fig. 1. Change of response between WHO and RECIST criteria.
CR = complete remission; PR = partial remission; SD = stable disease; PD = progressive disease.
Table 4. Response rate according to chemotherapeutic agents Response rate
CR PR SD PD Total (CR+PR/
total n)
AC RECIST 0 7 7 0 14 0.50
WHO 0 6 6 2 14 0.43
EC RECIST 0 6 5 2 13 0.46
WHO 0 6 5 2 13 0.46
AT RECIST 0 0 6 0 6 0.00
WHO 0 1 4 1 6 0.17
CP RECIST 0 1 5 0 6 0.17
WHO 0 1 5 0 6 0.17
Others RECIST 0 2 0 1 3 0.67
WHO 0 1 1 1 3 0.33
AC = adriamycin+cyclophosphamide; EC = epirubicin+cyclo-
phosphamide; AT = adriamycin+taxotere; CP = cyclophospha-
mide+pirarubicin.
종양의 세포죽음과의 관련성과 좀 더 선형적인 관계를 가 진다고 볼 수 있다는 것이다.(10) James 등(10)은 14개의 다 른 연구 과제들을 후향적으로 조사하여 이차원적인 기준에 의한 반응도와 일차원적인 기준에 의한 반응도가 차이가 없다는 보고를 하였다. 그 이후에 위암, 대장암, 폐암 등에 서 위와 같은 연구가 진행 되었고 모두 WHO 와 RECIST 기준 사이에 반응률의 차이가 없다는 결론을 내렸다.(11- 13) 본 연구에서는 WHO 기준과 RECIST 기준 사이의 카파 일치도를 사용하여 0.718의 비교적 좋은 일치율을 보였다.
유방암에서 사용하는 항암화학요법제 가운데 Doxorubicine 과 Docetaxel의 병합 요법은 치료 반응률이 높아 현재 가장 주목받고 있는 약제이지만(14) 본 연구에서는 치료 반응률 이 낮게 나와 이와 일치하지 않았는데, 이는 대상 환자의 수가 너무 적기 때문으로 생각된다.
유방암 환자에서 항암화학요법 후 종양의 반응성을 평가 하는 도구는 이학적검사, 유방 촬영술, 초음파, 자기공명영 상 등이 있다. 본 연구에서는 대부분 초음파를 이용하였다.
초음파는 다른 검사에 비해 비교적 비용이 적게 들고 손쉽 게 할 수 있다는 장점이 있으나 항암요법 후에 나타나는 종양주변의 섬유화를 종양과 확실하게 구별할 수 없다는 단점이 있다.(15) 최근에는 위와 같은 이유로 자기공명영상 장치(MRI)나 양전자 방출 단층촬영기(PET-CT)를 이용하여 항암치료 후 반응성을 측정하여 좋은 결과를 보고하였 다.(16,17) 저자들도 임상에서 술 전 항암화학요법 후에 반 응성을 측정하는 도구로 MRI 사용빈도가 증가하고 있다.
RECIST 기준이 발표된 이후로 WHO 기준에 의한 문제점이 많이 개선되었으나 아직 보안해야 할 문제점이 있어 변형 된 RECIST 기준을 적용하고자 하는 노력도 있다.(18) 임상 연구에서 측정값이 차이에 의한 반응성의 변화가 결과에 중대한 영향을 미칠 수 있기 때문에 종양의 크기를 측정하 기 위한 방법론적인 것들이 좀 더 향상되고 명확하게 정의 되어야 하겠다.
결 론
유방암 환자의 술 전 항암화학요법 반응성의 평가로 WHO 기준과 RECIST 기준을 비교하여 평가하였다. WHO 기준과 RECIST 기준의 각각의 결과는 유의한 차이점은 없 었다. 기존에 사용되었던 WHO 기준보다는 RECIST 기준이 좀 더 유방암 반응 평가에 있어 사용하기에 편리할 것으로 생각되며, 정확한 반응도 측정을 위해 향후 좀 더 많은 환자 수로 전향적인 연구가 이루어져야 할 것으로 생각된다.