소아청소년기의 두개 외 생식세포종양
임연정
충남대학교 의학전문대학원 소아과학교실
Overview of Pediatric Extracranial Germ Cell Tumors
Yeon Jung Lim, M.D.
Department of Pediatrics, College of Medicine, Chungnam National University, Daejeon, Korea
Germ cell tumors the designation given to neoplasm arising from the cells of the germ- line, the cells that are destined to become either the egg or the sperm. These tumors have a number of unique features that includes bimodal and wide age distribution, re- markable phenotypic diversity, and varying biologic behavior. During infancy, sacro- coccygeal locations predominate with either teratomas in neonates or endodermal sinus tumors in infants above three months. After puberty, non-germinomatous germ cell tu- mors predominate with gonadal, mediastinal or intracranial tumor. Specific subtypes of germ cell tumors secrete proteins as tumor markers. Surgical resection of the tumor is necessary to establish the diagnosis and for staging of the extent of tumor spread. Except for teratoma, germ cell tumors are highly sensitive to chemotherapy in particular cisplatin. The most commonly used chemotherapy regimen for malignant germ cell tu- mors is PEB (cisplatin, etoposide and bleomycin). Prognosis is good even in metastatic diseases. Patients with relapsed or recurrent disease may be candidates for high dose chemotherapy and autologous hematopoietic stem cell transplantation.
pISSN 2233-5250 / eISSN 2233-4580 http://dx.doi.org/10.15264/cpho.2015.22.1.30 Clin Pediatr Hematol Oncol 2015;22:30∼37
Received on April 7, 2015 Revised on April 15, 2015 Accepted on April 21, 2015
Corresponding Author: Yeon Jung Lim Department of Pediatrics, College of Medicine, Chungnam National University, 282, Munhwa-ro, Jung-gu, Daejeon 301-721, Korea
Tel: +82-42-280-7252 Fax: +82-42-255-3158 E-mail: pedonco@cnuh.co.kr
Key Words: Pediatrics, Germinoma, Teratoma, Endodermal sinus tumor, Choriocarcinoma
서 론
소아 청소년기의 생식세포종양(germ cell tumor)은 전체 소아 종양의 약 3%를 차지하는 드문 종양이다. 다양한 조직학 적 아형으로 나뉘며 생식세포가 위치하는 난소와 고환 이외에 몸의 중심의 여러 부위에서 발병한다. 배아(embryo)의 난황 주머니에서 발생하는 원시종자세포는 후복벽의 생식샘 능선 으로 이동하여 골반강과 음낭으로 내려온다. 난소와 고환 외 생식샘 위치가 아닌 곳에서 발생하는 생식세포종양은 이 과정 에서 정체된 원시종자세포에서 발생하는 것으로 생각된다. 이 에 생식샘 외 생식세포종양은 뇌, 종격, 천미부 등 몸의 정중 앙선에 호발한다. 나이에 따라 호발 부위와 조직학적 아형의
빈도가 다르며 영유아기와 사춘기 전후 두 번의 쌍봉 분포 발생률을 보인다.
조직병리학적 분류
생식세포종양은 악성도가 낮은 것에서 높은 순서로 기형종
(teratoma), 종자세포종(germinoma), 배아암종(embryonal car-
cinoma), 내배엽동종양(endodermal sinus tumor) 또는 난황
낭난종(yolk sac tumor), 융모막암종(choriocarcinoma)으로 나
뉜다. 기형종은 양성인 성숙기형종(mature teratoma)와 악성
인 미성숙기형종(immature teratoma)이 있다(Fig. 1). 하나의
신생물에 서로 다른 조직형, 또는 악성과 양성 조직이 섞여
있는 혼합 생식세포종양이 있다.
Fig. 1. Schematic representation of
germ cell tumors.1) 기형종
전형적인 성숙기형종은 낭성이며 배아의 내배엽(endoderm), 중배엽(mesoderm), 외배엽(ectoderm)의 세 엽에서 분화된 성인형 조직을 포함하는 것이 특징이다. 털, 피지샘, 치아 등 분화된 세포들로만 구성되면 피부모양기형낭종(dermoid cyst)이라 한다. 미성숙기형종은 원시신경상피 로제트와 세관 이 성숙 조직과 섞여있으며 높은 세포충실도와 증가된 유사분 열지수, 핵의 비정형성을 보인다. 원시신경상피가 포함된 정 도에 따라 등급을 나눈다[1].
사춘기 이전에 발생하는 고환의 기형종은 고환에서 발생하 는 생식세포종양의 약 35%를 차지하며 두 번째로 흔하다[2].
사춘기 이전에는 85%가 성숙기형종, 15%가 미성숙기형종이 다. 난소의 기형종과 달리 진단 시 전이와 수술적 절제 후 재 발이 없다. 사춘기 이후에 발생하는 경우에는 순수한 기형종 은 드물고 절반 이상에서 비종자세포종성 생식세포종과 혼합 된 악성 종양이다. 영유아기 및 소아기의 고환 기형종과 달리 조직소견이 잘 분화되어 보이더라도 악성이며 전이와 재발을 할 수 있다[3]. 사춘기 이후의 기형종은 합포체세포영양막거대 세포(syncytiotrophoblastic giant cell)가 포함된 소견을 보일 수 있으며 환자에서 거대유방증이나 혈청 인간 융모생식샘자 극호르몬(beta subunit of human chorionic gonadotropin,
-HCG) 또는 알파-태아단백(alpha-fetoprotein, AFP) 상승이 나타나기도 한다.
난소에서 발생하는 생식세포종의 95%는 기형종이며 이 중 대부분은 피부모양기형낭종이거나 성숙낭성기형종이다[4]. 고 환의 기형종과 달리 나이에 따른 차이가 없이 주로 양성 성숙 기형종이다. 악성 기형종인 경우 대부분은 미성숙 기형종이 다. 원시 신경상피조직이 포함된 정도에 따라 완전히 분화된
조직으로만 이루어진 성숙기형종을 0등급, 미성숙 신경상피 가 10% 미만으로 포함된 경우 1등급, 50% 이상이 미성숙 신 경상피조직이면 3등급으로 나누고 등급이 높을수록 악성도가 높다[1]. 성인의 경우 2-3등급의 미성숙기형종은 전이의 빈도 가 높고 예후가 불량한 것으로 알려져 있으나 소아에는 확실 하지 않다[5]. 소아청소년기에 발생한 1기의 난소 미성숙기형 종은 2-3등급이라 하더라도 수술적 절제만 하고 항암화학요법 은 재발한 경우에만 한다. 미성숙기형종은 복막에 신경아교세 포조직이 자라는 복막신경아교종증이 동반되기도 하는데 복 막의 조직이 성숙 세포인 경우라면 예후는 양호하다. 난소의 성숙기형종 중 약 1%는 악성전환이 되는 것으로 알려져 있다.
가장 흔한 형태는 편평세포암종이지만 흑색종, 샘암종, 육종 도 나타날 수 있다.
2) 종자세포종
송과체, 종격, 생식샘에 생기며 난소에서 발생하면 미분화 세포종(dysgerminoma), 고환에서 발생하면 고환종(semino- ma)이라고 한다. 미분화된 원시 생식세포에서 발생하며 OCT3/4, NANOG, STELLAR와 같은 분화다능성(pluripotency) 유전자 가 발현된다[6,7]. 현미경적으로 큰 세포의 균일한 증식이 관 찰되며 큰 중심핵과 뚜렷한 핵소체가 보인다. 글리코겐이 풍 부하여 periodic acid-Schiff (PAS) 양성 소견을 보이며 phos- phatase placental alkaline (PLAP)와 c-kit이 양성으로 나온다[4].
고환종은 소아기에는 매우 드물고 사춘기 이후에 주로 발 생하여 34세-45세에 가장 많이 진단된다[8]. 전형적인 고환종 에서도 합포체세포영양막세포를 포함한 경우가 7-25% 정도 되며 혈청 -hCG가 상승할 수 있으나 현저히 높은 혈청
-hCG 농도 또는 수술 후에도 지속적으로 높은 경우에는 융
모막암종이 섞여 있음을 의심해야 한다.
미분화세포종은 어느 연령에서나 발생할 수 있으나 15-19 세가 가장 호발하는 연령이며 소아 청소년기의 악성 난소생식 세포종양 중 가장 흔하다[9].
3) 내배엽동종양 또는 난황낭난종양
내배엽동종양은 15세 미만에서 발생하는 생식세포종양 중 가장 흔한 악성 종양이다[4]. 육안으로 봤을 때 노란 빛이나며 여러 개의 낭종과 출혈, 괴사, 액화된 부분이 혼재한다. 현미 경적으로는 그물모양의 미세낭종을 보이는 성긴 점액모양 간 질이 특징이다. 낭종은 PAS 양성, diastadiase에는 내성인 상 피로 둘러싸여 있다. 내배엽종종양 중 20% 정도에서는 작은 혈관을 중심 세포들이 모여있는 Schiller-Duval body가 관찰 된다. 70-100%의 내배엽동종양에서 면역조직화학검사에서 AFP 가 발현된다.
사춘기 전 고환의 생식세포종양의 약 65%를 차지하는 내배 엽동종양은 0-2세 사이에 가장 호발하며 기형종과 혼합되어 나타나기도 한다[2].
4) 배아암종
배아암종은 영유아기에는 드물고 주로 사춘기 전 여자, 성 인에서는 남, 여 모두에서 발생한다. 혼합 생식세포종양의 일 부로 진단되는 경우가 많다. 경계가 불분명한 크고 불규칙적 인 상피양 세포로 이루어져 있으며 세포각질(cytokeratin)과 CD30이 양성이면서 상피막항원(epithelial membrane anti- gen, EMA), 암배아항원(carcinoembryonic antigen), vimentin 은 음성이다[4]. 종양에 존재하는 합포체세포영양막 세포가
-HCG를 분비하여 조발 사춘기, 무월경, 남성형다모증을 유 발하기도 한다.
5) 융모막암종
융모막암종은 세포영양막, 합포체세포영양막, 융모외 영양 막으로 이루어진 드문 종양이다. 종양세포에서 -HCG를 발 현하기 때문에 조발사춘기와 같은 증상을 나타내며 미세 출혈 로 인하여 빈혈이 동반되기도 한다[10]. 순수한 융모막암종보 다는 혼합생식세포종양의 일부로 나타나는 경우가 더 많다.
영아기에는 폐, 간, 뇌, 콩팥 등 여러 부위에서 원발 종양으로 진단되기도 한다.
소아의 악성 생식세포종양의 역학
생식세포종양은 15세 미만 소아에서는 전체 소아암 중 3%
전후를 차지하나 15세에서 19세 사이의 연령에는 전체 종양 의 16%에 이른다. 기형종은 신생아에서 가장 흔한 악성 종양 이다[11,12]. 남자와 여자에서 생식세포종양의 발생빈도는 비 슷하거나 여자에서 조금 더 높다. 소아기 초기에는 기형종과 내배엽동종양이, 청소년기에는 대부분 혼합생식세포종양이거 나 고환종이 진단된다. 나이에 따라 호발 부위도 차이가 나는 데 영유아, 어린 소아에서는 천미부와 골반에 발생하며 사춘 기 전후에는 생식샘과 종격동, 두개 내에 발생한다. 우리나라 의 국가암등록사업 연례보고서에 따르면 2012년 생식세포종 양으로 진단된 환자수는 102명이었으며 남자와 여자의 비율 은 같았다[13]. 0-4세와 10-14세 사이의 발생률이 높았다. 특 히 악성생식선 생식세포종양의 경우 10-14세의 발생률은 여 자가 남자의 두 배였으나 15세 이후의 동향은 우리나라 암등 록사업의 특성상 15세 이상의 생식세포종양은 소아암으로 분 류되지 않아 파악하기 어렵다.
생식세포종양 발생의 위험인자
잠복고환은 고환의 생식세포종양의 위험인자이므로 만 2세 이전에 수술을 하도록 권하고 있다. 클라인펠터증후군(Kline- felter syndrome, 47, XXY) 환자의 약 20%에서 종격동의 생식 세포종양이 발생한다. 터너증후군(Turner syndrome, 45, XO) 와 Swyer증후군(46, XY with SRY mutation)의 경우 생식샘모 세포종 또는 종자세포종이 발생할 수 있다. 생식세포종양이 진단된 환자에서 특징적인 외모나 생식샘발달장애가 동반된 경우에는 역으로 염색체검사를 시행해야 한다[14].
종양 세포유전학
생식세포종양의 유전체 연구는 소아기와 청소년 이후의 조
직세포가 서로 달라 발병기전에 차이가있음을 보여 준다. 청
소년기와 성인에서 발생하는 고환의 생식세포종양은 대부분
홀배수체(aneuploid)이며 청소년기 이후 생식세포종양의 약
80%에서 나타나는 12번 단완의 등위염색체(isochromosome
12p, i12p)는 소아기에서는 그 빈도가 낮다[15]. 사춘기 이전
기형종은 대부분 유전체 검사에서 정상을 보이는데 비하여 혼
합세포종의 비율이 높은 사춘기 이후에는 기형종이라 하더라
도 비정상 세포유전결과를 보인다. 소아기 내배엽동종양은 이
배수체(diploid), 네배수체(tetraploid)가 종종 나타나고 6q24
의 반복적인 소실, 1q와 20q의 1p의 소실이 보인다.
Table 1. Histologic subtype and tumor marker levels
Histologic subtype AFP -hCG
Germinoma - ±
Immature teratoma ± -
Embryonal carcinoma +++ +++
Endodermal sinus tumor +++ -
Choriocarcinoma - +++
AFP, alpha fetoprotein; -hCG, beta subunit of human chorionic gonadotropin.
진 단
1) 임상증상
종양이 발생하는 부위에 따라 다르지만 압통이 없는 종괴 로 주로 나타난다. 고환은 음낭 수종이 함께 있을 경우 진단이 늦어질 수 있다. 고환의 무통성 종괴는 초음파 검사 상에서 고환 내부에 미세 석회화 병변을 확인함으로서 림프종이나 횡 문근육종과 감별할 수 있다. 성인의 35%만이 고환 내부에 국 한되는 1기 종양으로 진단되는 것에 비하여 4세 미만의 소아 에서는 85%가 1기로 진단된다[3,4]. 난소의 종양도 어느 정도 진행되어야 통증, 복부 팽만, 복수, 질출혈을 보인다. 10-25%
의 환자에서 종양의 파열, 출혈, 염전이 발생할 수 있다[16].
종양에서 분비되는 -HCG로 인하여 드물게 조발사춘기가 나 타난다. 난소의 미분화세포종은 소아기에서는 대부분 1기로 진단되며 10-15%에서 양측성으로 나타나므로 수술적 절제 시 반대쪽 난소의 생검이 필요하다.
천미부 생식세포종양은 여아에서 더 자주 발생한다. 근골 격계, 신, 심혈관, 중추신경계의 선천 기형이 18%의 환자에서 동반된다. 절반 이상에서 출생 첫 날 진단되며 10% 미만의 환자만이 1세 이후 진단된다. 천미부 생식세포종양은 골반강 내부의 종양의 비율에 따라 분류한 Altman의 분류법이 가장 많이 사용된다[4]. Altman 1형은 대부분의 종양이 천미부 외 부에 위치하는 경우이며 Altman 4형은 종양 전체가 골반강 내부에 존재하는 것이다. 생후 2개월 이내에 진단되는 경우 여아의 7%, 남아의 10%만이 악성이지만 그 이후 진단되는 경 우에는 여아의 48%, 남아의 67%가 악성이다. 신생아기에 진 단되는 천미부 생식세포종양은 대부분 Altman 1형 또는 2형 으로 90% 이상에서 성숙 또는 미성숙기형종이다. 수술로 완 전절제가 되면 더 이상의 치료가 필요 없지만 4-21%에서 재발 하며 이 경우 50-70%가 악성이다[17,18].
종격동의 생식세포종양은 기침, 호흡곤란과 같은 호흡기 증상이나 가슴 통증을 호소할 수 있다. 1세 이전은 주로 기형 종, 사춘기 이전은 내배엽동종양, 만 10세 이후는 배아암종이 나 종자세포종이 발생한다[19].
생식샘외 생식세포종의 발생 위치로는 천미부(40%)가 가 장 흔하지만 신생아기에는 목(30%), 입인두와 코인두(8%), 심 (7.5%), 위(2.6%), 눈(2.4%), 얼굴(1.5%), 종격동(2.6%), 태반 (1.5%)에서 발생한다[2].
2) 종양표지자
생식세포종양에서 혈청 내 종양표지자는 진단과 치료 효
과, 재발을 판단하는데 있어 매우 유용하다. AFP는 내배엽동 종양에서 상승되고 -HCG는 융모막암종에서 현저히 상승된 다. 배아암종은 두 표지자가 일정하지 않으나 약간 상승되고 순수한 기형종은 둘 다 상승이 없다(Table 1). AFP는 태아의 간과 난황에서 만들어지는 당단백질이다. 미성숙기형종에서 조금이라도 올라가면 종양 내에 내배엽동종양의 조직이 포함 되어 있음을 시사한다. 종자세포종과 배아암종에서도 약간 상 승될 수 있다. 생식세포종양 외에 간종양, 갑상선기능저하증, 엽산결핍, 자가면역질환, 선천심기형 등에서도 상승될 수 있 다. -HCG는 임신 중 수정 직후 배아에서, 이후에는 태반의 합포체세포영양막에서 생산하는 펩티드(peptide) 호르몬이 다. 임신을 유지하는데 필요한 호르몬이며 종양에서는 융모막 암종과 같은 배아 외 조직에서 유래되어 현저히 상승하며 종 자세포종에서도 미세하게 상승할 수 있다. AFP는 태아의 간 에서 생산되어 모든 신생아는 혈청 AFP가 상승되어 있고 만 두 돌이 지나야 성인 범위까지 낮아지므로 진단에 이용 시 연령별 정상 범위를 주의해야 한다[4]. AFP와 -HCG의 반감 기는 각각 5.1일과 24-36시간이다.
수술 전 종양표지자가 상승되어있는 생식세포종양의 경우 완전한 수술적 제거가 병리학적, 영상의학적으로 되었다 하더 라도 반감기에 따른 종양표지자의 적절한 감소가 없으면 잔존 암이 있음을 시사한다. 항암화학요법 중 종양표지자의 감소는 예후를 예측할 수 있는 인자이다. AFP가 10,000 IU/L이상 상 승된 경우 나쁜 예후와 관련이 있다는 보고도 있다[20,21]. 그 러나 첫 번째 항암화학요법 중 종양표지자가 일시적으로 상승 되었다가 두 번째 항암화학요법 시작 시점에는 떨어지기도 한다.
3) 영상의학적 진단
생식세포종양 환자에서 종양의 침범 범위를 확인하기 위하
여 원발 부위의 초음파, 컴퓨터단층촬영(computed tomog-
raphy, CT), 또는 자기공명영상(magnetic resonance imag-
ing, MRI)를 시행한다. 생식샘에서 발생할 경우 복강 내 전이
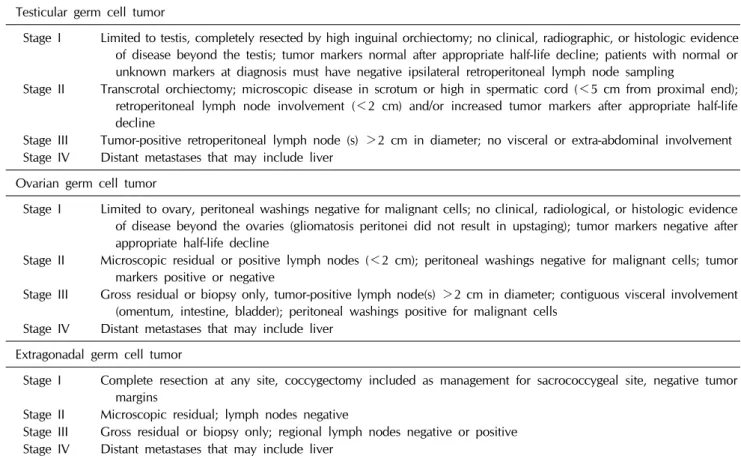
Table 2. Staging of Testicular, ovarian and extragonadal germ cell tumors
Testicular germ cell tumorStage I Limited to testis, completely resected by high inguinal orchiectomy; no clinical, radiographic, or histologic evidence of disease beyond the testis; tumor markers normal after appropriate half-life decline; patients with normal or unknown markers at diagnosis must have negative ipsilateral retroperitoneal lymph node sampling
Stage II Transcrotal orchiectomy; microscopic disease in scrotum or high in spermatic cord (<5 cm from proximal end);
retroperitoneal lymph node involvement (<2 cm) and/or increased tumor markers after appropriate half-life decline
Stage III Tumor-positive retroperitoneal lymph node (s) >2 cm in diameter; no visceral or extra-abdominal involvement Stage IV Distant metastases that may include liver
Ovarian germ cell tumor
Stage I Limited to ovary, peritoneal washings negative for malignant cells; no clinical, radiological, or histologic evidence of disease beyond the ovaries (gliomatosis peritonei did not result in upstaging); tumor markers negative after appropriate half-life decline
Stage II Microscopic residual or positive lymph nodes (<2 cm); peritoneal washings negative for malignant cells; tumor markers positive or negative
Stage III Gross residual or biopsy only, tumor-positive lymph node(s) >2 cm in diameter; contiguous visceral involvement (omentum, intestine, bladder); peritoneal washings positive for malignant cells
Stage IV Distant metastases that may include liver Extragonadal germ cell tumor
Stage I Complete resection at any site, coccygectomy included as management for sacrococcygeal site, negative tumor margins
Stage II Microscopic residual; lymph nodes negative
Stage III Gross residual or biopsy only; regional lymph nodes negative or positive Stage IV Distant metastases that may include liver
를 확인하기 위해 복부 영상을 촬영하며 가장 흔한 전이 부위 는 폐로 주로 폐 CT를 촬영하여 확인한다. 그 외 드물게 간, 뼈, 뇌에 전이 될 수 있다. 병기는 영상검사결과와 종양표지자 검사, 수술 소견을 바탕으로 정한다(Table 2) [4]. 조직병리 분 류에 따라 영상 검사 소견의 차이가 나타난다. CT 소견에서 성숙기형종은 낭성이며 석회화를 포함한 지방조직들이 보이 는 것에 비하여 미성숙기형종은 미성숙 신경조직으로 인하여 주로 고형조직으로 이루어져 있고 조영 증강이 잘되는 특징이 있다. 석회화된 부분은 드문드문하게 분포하며 지방 조직 비 율이 낮다. 종자세포종은 석회화가 드물고 균일한 조영 증강 을 보이며 주변 림프절의 침범 여부를 주의하여야 한다. 악성 생식세포종은 경계가 불분명하며 주변 기관으로 침범하는 듯 한 양상이고 괴사, 내부 출혈, 낭성인 부분이 비균질적으로 분포한다. 천미부에 발생한 종양은 척추 전이를 확인하기 위 하여 척추 MRI와 뼈스캔을 시행한다. 양전자방출단층촬영 (
18F-fluorodeoxyglucose positron emission tomography, PET) 은 성인 생식세포종양 환자에서는 잔존암을 확인하는 데 널리 이용되고 있으나 소아에서는 아직 연구가 많지 않다.
치 료
생식세포종양의 치료는 조직병리 소견과 원발 부위, 병기 에 따라 차이가 있다. 대부분의 종양에서 수술적 절제는 필수 적이다. 순수한 기형종은 수술적 절제만으로 치료가 되며 종 자세포종과 악성생식세포종양은 항암화학요법에 잘 반응한다.
생식샘의 종양은 일차적으로 수술적 절제가 치료의 기본이 되며 특히 고환의 종양은 주변 림프절의 침범여부를 조직병리 로 확인해야 한다. 반면 생식샘 외 종양은 완전절제가 어려운 경우가 많아 항암화학요법으로 종양의 크기를 줄인 후 수술을 시행할 수 있다. 수술로 완전절제가 되었다면 추가 항암화학 요법 없이 영상 검사와 종양표지자를 정기적으로 검사하며 지 켜볼 수 있다. 일반적으로 치료 종결 후 첫 해에는 매달 종양 표지자를 검사하고 3개월마다 원발부위의 영상검사를 한다.
두 번째 해에는 2-3개월마다 종양표지자를 검사, 6개월마다
영상검사를 시행한다. 재발하면 재수술 이전에 항암화학요법
을 시행할 수 있다. 진단 시 일부 절제만 가능하거나 전이된
경우에는 조직검사만 시행하고 항암화학요법을 먼저 한다. 수
술 후 잔존암이 남은 경우 항암화학요법을 더 시행한다. 천미 부 종양의 꼬리뼈, 종양이 발생한 생식샘과 같은 원발기관은 수술로 제거해야 한다.
1) 수술
생식세포종양에서 수술은 어느 경우에서든 완전절제를 목 적으로 한다.
신생아기에 진단되는 천미부의 종양은 대부분 외부에 튀어 나온 종양으로 수술적 완전절제가 가능하며 90% 이상이 양성 이므로 추가적인 치료가 필요 없다. 골반강 내부에 종괴가 있 다면 완전 절제 가능성에 대하여 정밀한 검사가 필요하다. 종 양이 직장이나 엉치뼈를 침범한 경우 또는 전이된 병변이 있 으면 조직검사를 먼저 시행한다. 조직검사결과가 양성이라 하 더라도 종양표지자의 상승이 있으면 조직검사의 채집이 잘 못 된 것으로 간주한다.
고환의 생식세포종양은 후복강의 림프절 전이가 가장 흔하 므로 반드시 수술 전 복부 CT를 확인한다. 간혹 후복강의 림 프절 전이 없이 왼쪽 빗장위림프절이나 폐결절이 관찰될 수 있다. 수술 전 CT에 4 cm 이상의 림프절은 전이가 있은 것으 로 보며, 2-4 cm 사이의 림프절은 조직검사를 통하여 확인한 다. 림프절의 크기가 2 cm 미만인 경우 조직검사를 하지 않으 나 수술 후 종양표지자 검사를 하여 반감기에 따라 정상 범위 까지 감소하는 것을 확인한다.
난소의 생식세포종양은 수술 시 종양주머니를 천자해서는 안 된다. 만약 수술 중 종양주머니가 파열되거나 조직병리검 사에서 주머니의 종양세포 침윤이 있다면 병기를 2기로 올린 다. 복수가 없더라도 반드시 복막 세척을 하여 세포검사를 한 다. 수술 전 혈청의 AFP와 -hCG를 시행하고 상승된 경우 수술 후 반감기에 따른 감소를 확인한다.
종격동의 종양은 심장, 큰 혈관과 접해 있어 완전절제가 어 려운 경우가 많다. 수술 전 항암화학요법을 시행하여 완전절 제의 기회를 높이는 것이 좋은 예후와 연결된다[19].
2) 항암화학요법
1970년대 시스플라틴(cisplatin)을 포함한 항암화학요법이 도입된 이후 생식세포종양의 생존율은 현저히 향상되었다. 이 후 항암화학요법의 후기 합병증을 줄이기 위한 노력이 계속되 어 생식세포종양 1기의 경우 수술 후 항암화학요법 없이 경과 관찰을 하는 것을 원칙으로 하고 있다. 그러나 일부 환자에서 는 시스플라틴을 포함한 일반적인 항암화학요법 외에 좀더 강 력한 치료가 필요하다.
시스플라틴의 신독성과 이독성을 줄이고자 시행한 성인 대
상의 연구를 통하여 같은 플래티넘계열의 항암제라도 시스플 라틴이 카보플라틴보다 치료 효과가 우수한 것으로 밝혀졌다.
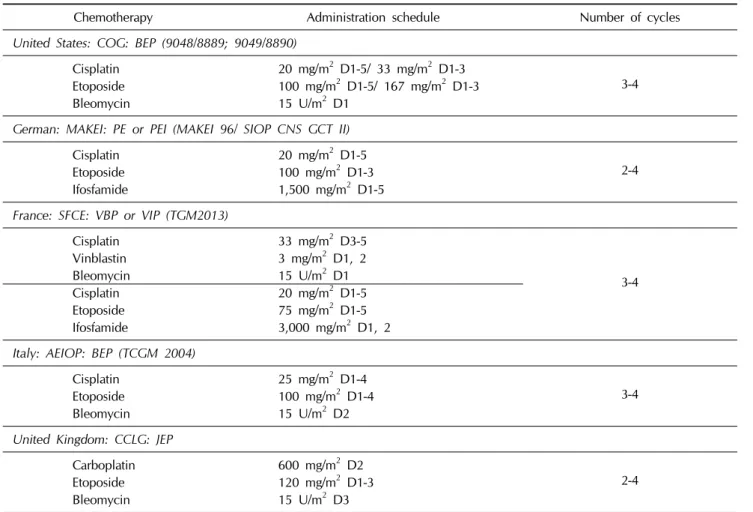
블레오마이신, 에토포사이드, 시스플라틴 병합요법(BEP)과 빈블라스틴, 아이포스파마이드, 시스플라틴 병합요법(VIP)를 비교하였을 때 생존률과 무진행생존률은 의미있는 차이가 없 었으나 VIP에서 혈액학적 독성이 더 심한 것으로 나타났다 [22]. 이에 중등도 이상의 재발 위험을 갖는 생식세포종양에서 는 2-4차의 BEP이 표준치료로 알려져 있으나 소아에서는 연 구 그룹에 따라 약간의 차이가 있다(Table 3) [23].
Children’s Cancer Group (CCG)와 Pediatric Oncology Group (POG)은 intergroup study를 통하여 2기의 고환 생식 세포종양, 1-2기의 난소 생식세포종양에서 4차의 BEP 치료 후 6년 무사건생존률은 94.5%, 6년 전체생존률은 95.7%를 보고 하였다[24]. 더 나아가 Children’s Oncology Group (COG)의 AGCT0132는 불필요한 항암화학요법을 줄이고자 난소의 생 식세포종 저위험군 환자에서는 항암화학요법을 하지 않고 검 사만 하였고 이후 재발하거나 중간위험군환자에서는 3차의 BEP만 시행하였는데 수술만 시행한 환자들 중 48%에서 재발 하였으나 이후 항암화학요법을 통하여 4년 전체생존률은 96%
에 달하였다[25]. 고위험군은 표준용량 BEP (총 시스플라틴 요량 100 mg/m
2)과 고용량 BEP (총 시스플라틴 용량 200 mg/m
2)을 비교하였는데 6년 전체생존률과 무사건생존률에서 고용량 BEP가 약간 우세한 경향을 보고하였다(89.6%±3.6%
vs 80.5%±4.8%) [26]. 그러나 고용량 BEP 환자군에서 보청기 가 필요한 환자들이 67%에 달하였고 치명적인 감염으로 인하 여 사망한 환자 7명 중 6명이 고용량 BEP을 받은 환자들이었다.
United Kingdom Children’s Cancer Study Group (UKCCSG) 는 카보플라틴이 시스플라틴보다 치료효과가 떨어진다는 여 러 연구에도 불구하고 저위험군, 중등도 위험군에서 카보플라 틴, 에토포사이드, 블레오마이신(JEB)을 1차 약제로 사용하고 있다[23].
독일의 MAKEI 프로토콜은 모든 1기 종양은 수술 후 경과 관찰을 원칙으로 하며 항암화학요법은 블레오마이신을 빼고 시스플라틴과 에토포사이드, 아이포스파마이드(PEI)를 1차 약제로 사용하며 생후 4개월 미만의 천미부 생식세포종양 환 자에서는 PE를 투여한다.
3) 재발한 환자의 치료
대부분의 재발은 치료 종결 6개월 이내에 발생한다[27]. 재
발한 종양의 완전절제를 시도하는 것이 생존율 향상에 도움이
도움이 되며 2차 관해를 위해 대부분의 경우 항암화학요법이
필요하다. 구제치료로 여러 다양한 항암화학요법이 사용된 보
Table 3. Protocols used by the various pediatric cooperative groups
Chemotherapy Administration schedule Number of cycles
United States: COG: BEP (9048/8889; 9049/8890)
Cisplatin 20 mg/m2 D1-5/ 33 mg/m2 D1-3 Etoposide 100 mg/m2 D1-5/ 167 mg/m2 D1-3 3-4
Bleomycin 15 U/m2 D1
German: MAKEI: PE or PEI (MAKEI 96/ SIOP CNS GCT II)
Cisplatin 20 mg/m2 D1-5
Etoposide 100 mg/m2 D1-3 2-4
Ifosfamide 1,500 mg/m2 D1-5
France: SFCE: VBP or VIP (TGM2013)
Cisplatin 33 mg/m2 D3-5
3-4
Vinblastin 3 mg/m2 D1, 2
Bleomycin 15 U/m2 D1
Cisplatin 20 mg/m2 D1-5
Etoposide 75 mg/m2 D1-5
Ifosfamide 3,000 mg/m2 D1, 2
Italy: AEIOP: BEP (TCGM 2004)
Cisplatin 25 mg/m2 D1-4
Etoposide 100 mg/m2 D1-4 3-4
Bleomycin 15 U/m2 D2
United Kingdom: CCLG: JEP
Carboplatin 600 mg/m2 D2
Etoposide 120 mg/m2 D1-3 2-4
Bleomycin 15 U/m2 D3
고가 있다. 빈블라스틴, 시스플라틴, 아이포스파마이드(VeIP) 조합이나 파클리탁셀, 빈블라스틴, 아이포스파마이드(TIP), 젬시타빈, 옥살리플라틴 등의 사용이 보고되었으나 효과는 제 한적이다[28,29]. 이후 고용량항암화학요법 후 자가조혈모세 포이식을 통하여 약 50% 전후에서 장기 관해를 유지한 보고 도 있다[30]. 또한 국소 재발인 경우 방사선치료를 시행할 수 있으나 후기 합병증에 대한 우려가 있다.
결 론
생식세포종양은 매우 다양한 조직병리학적 특성을 갖는 종 양들로 나뉘며 연령에 따라 호발하는 종양의 종류와 위치가 서로 다르다. 종양표지자인 AFP와 -HCG를 이용하여 진단과 치료 반응을 평가하고 재발을 조기에 진단하는데 도움이 된 다. 악성이라 하더라도 cisplatin, carboplatin, etoposide, bleo- mycine, ifosfamide를 포함하는 항암화학요법에 민감하여 2-4 회의 BEP 또는 JEP regimen으로 높은 생존율을 기대할 수
있다. 그러나 항암화학요법의 독성과 후유증이 문제가 되며 재발 위험에 대한 생물학적, 유전학적 특징에 대한 연구를 통 하여 불필요한 항암치료를 줄이려는 노력이 지속되고 있다.
우리나라에서도 다기관 임상연구를 통하여 우리나라 아이들 에 맞는 프로토콜에 대한 개발이 필요하겠다. 또한 일부 항암 제에 반응이 없거나 재발한 환자에서 2차 약제 및 조혈모세포 이식에 대한 더 많은 연구가 필요하다.
References