J. of Korean Orthopaedic Research Society Volume 4, Number 2, October, 2001
In vitro 전처리시 TGF-β 3 첨가가 토끼 중간엽 줄기세포의 in vivo 분화에 미치는 영향
아주대학교 분자과학기술학과, 아주대학교 의과대학 정형외과학교실*
인하대학교 의과대학 생리학교실**
박형근・박소라**・임한조・민병현*
= Abstract =
Effects of TGF- β 3 pretreatment in vitro on the differentiation of rabbit mesenchymal stem cells in vivo.
Hyeong-Geun Park, So Ra Park, M.D.**, Han Jo Lim, Ph.D., Byoung-Hyun Min, M.D.*
Department of Molecular Science and Technology, Ajou University, Suwon, Korea Department of Orthopedic Surgery, Ajou University, Suwon, Korea*
Department of Physiology, Inha University, Inchon, Korea**
P u r p o s e : Bone and cartilage were manufactured by using tissue engineering of mesenchymal stem cell(MSC) which can differentiate into variety of cell types.
Material and Method : MSC was isolated and cultured from the rabbit weighing 500g, and it was seeded into PGA mesh and pre-cultured for 1 week with different TGF-β3 treated conditions. It was implanted into nude mice and tissues generated were recovered from 1, 2, 3, 4, 8 ,and 12 weeks respectively. Degree of bone and cartilage formation was analyzed with histology and immunohistochemistry assay.
Result : Pre-culture condition with TGF-β3 treatment showed early start of chondrogenic differentiation, and degree of bone and cartilage formation was promoted as time passed. But both of the cases differentiated into complete bone after 12 weeks.
Conclusion : The results show that pretreatment of TGF-β3 promotes the differentiation process in vivo con- dition under the in vivo system where MSC differentiate into bone via cartilage formation.
Key Words : Chondrogenic differentiation, Rabbit mesenchymal stem cell, Osteogenic differentiation, PGA, Tissue engineering, TGF-β3
※ 통신저자 : 민 병 현
경기도 수원시 팔달구 원천동 산 5번지 아주대학교 의과대학 정형외과학교실
Tel : 031) 219-5225, Fax : 031) 219-5229 E-mail : bhmin@madang.ajou.ac.kr
서 론
무릎 관절연골 조직은 경골과 대퇴골 사이에 붙 어있어 관절표면의 마찰을 감소시켜 원활한 활주 운동을 가능하게 하고, 완충작용으로 관절 하골에 전달되는 하중이나 충격을 분산시키는 역할을 하 는 매우 잘 분화된 조직이지만, 혈관조직이나 신 경조직이 분포되어 있지 않아 손상이 되었을 때 손상조직 주위의 연골세포에 의한 재생이 매우 제 한된 조직이다.
수세기동안 관절연골 손상을 수복 혹은 재생시 키기 위하여 많은 연구가 진행되었지만 만족할 만 한 결과는 얻지 못하고 있는 상황이다. 그러나 최 근 십여 년 동안 급속도로 발전한 생물학적 기술 은 관절연골 재생에 획기적인 발전을 가져올 것으 로 기대되고 있다1 1 , 1 6 )
. 이 중 자가 연골세포를 이 식하는 방법(autologous chondrocyte trans- p l a n t a t i o n )은 현재 관절 연골의 재생을 유발할 수 있는 효과적인 치료법으로 주목받고 있다7 ). 그 러나 자가 연골세포 이식술은 이식할 연골세포를 얻기 위하여 또 다른 수술이 필요하므로 환자에게 경제적, 육체적 부담이 있고, 골조직의 손상이 동 반된 경우에는 사용하기 어려운 점이 있으며, 결 손부위가 크거나, 나이가 많은 환자의 연골세포로 는 조직재생에 한계를 보여주고 있다. 따라서 이 러한 한계를 극복하기 위한 방법으로 생분해성 고 분자지지체에 연골세포를 접종하여 특정한 환경 내에서 배양하여 인공연골 조직으로 제작하는 생 체조직공학기법이 활발하게 연구되어지고 있다.
그런데 연골세포는 필요한 세포수를 위해 장기간 단층배양 시 연골세포 고유의 표현형을 잃어버리 는 단점이 있다2 , 5 , 1 0 , 1 2 ).
골수 내에 존재하는 중간엽 줄기세포는 특별한 분화 환경에서 뼈, 연골, 근육, 지방, 건, 인대 그리고 신경 등의 다양한 조직으로 분화할 수 있 는 잠재력을 지니고 있으며3 , 6 , 9 , 1 5 , 1 7 , 2 6 , 2 8 , 3 4 )
연골세포 또는 골아세포 등의 분화된 세포에 비해 단층배양 에서 증식속도가 빠르고, 나이가 많은 사람의 골 수로부터 얻어진 줄기세포에서도 나이가 어린 사 람의 줄기세포와 비슷한 유사분열 능력과 생합성 활성을 지니고 있을 뿐만 아니라, 국부 마취를 통
해 비교적 쉽게 세포를 얻을 수 있는 장점과 하나 의 고분자 지지체에서 뼈와 연골을 함께 분화시킬 수 있어서 중간엽 줄기세포는 뼈와 연골 조직공학 에 이상적인 세포라 할 수 있겠다8 , 1 8 ).
그러나 목적하고자하는 조직을 성공적으로 형성 하기 위해서는 중간엽 줄기세포를 특정조직으로 분화시키는 직접적인 분화법 개발이 필수적이다.
중간엽 줄기세포로부터 연골세포나 골아세포로 분 화시킬 수 있는 직접적인 방법은 아직 알려져 있 지 않지만 T G F -β3는 연골형성을 유도하는 대표 적인 성장인자로 잘 알려져 있다4 , 2 2 , 2 8 )
.
이에 본 연구에서는 토끼 중간엽 줄기세포를 i n v i t r o에서 전처리배양 시 T G F -β3 첨가 여부가 in vivo에서 중간엽 줄기세포가 뼈와 연골조직으 로 분화되는데 어떤 영향을 주는 지에 관하여 관 찰하였다.
연구대상 및 방법
1. 실험동물
본 연구에서는 중간엽 줄기세포를 획득하기 위 해 건강하고 풍부한 골수를 얻는데 유리한 5 0 0 g 의 New Zealand white rabbit(중앙 실험동물 센터)을 사용하였다.
2. 세포분리 및 배양
희생시킨 지 3 0분 이내에 토끼 뒷다리의 털을 제거하고 소독 후 피부를 절개하여 경골과 대퇴골 을 무균적으로 절단하였다. 무균실에서 항생제가 포함된 phosphate buffered saline(Gibco)용액 4 0㎖이 들어있는 주사기로 경골과 대퇴골 내에 있 는 골수를 밀어내어 수차례 pipetting 해주어 뭉 쳐있는 골수를 완전히 풀어준 후 cell strainer ( F a l c o n )에 걸러주고 1 7 0 0 r p m에 1 5분 동안 원 심분리하여 중간엽 줄기세포를 얻었다. 얻어진 중 간엽 줄기세포는 5% acetic acid로 적혈구를 용 혈시킨 후 혈구계수판( h e m o c y t o m e t e r )을 이용 하여 유핵 세포(nucleated cell)를 세어 1 0 % newborn calf serum(Gibco)과 1% 항생제가 포함된 α-minimum essential medium ( S i g m a )에 1 . 5×1 07 c e l l s / 7 5 T - f l a s k의 농도로 심어서 항온 배양기( 3 7℃, 5% CO2)에서 2 ~ 3주
동안 단층 배양하였다.
3. 생분해성 고분자지지체의 준비
생분해성 고분자지지체는 P o l y g l y c o l i c acid(PGA) non-woven mesh로서 A l b a n y International. INC.(Mansfield, MA)에서 구 입하였다.
본 연구에서는 PGA mesh를 가로, 세로, 두께 의 크기가 6×6×3㎣인 직육면체의 동일한 형태 로 절편하고 멸균하여 사용하였으며 멸균 후에는 D u l b e c c o’s modified eagle medium(Gibco) 에 침수시켜 항온 배양기( 3 7℃, 5% CO2)에서 1 2시간을 유지시켰다. 그 후 배양액을 제거하고 고분자지지체를 무균실 안에서 적당히 건조시킨 다음 세포 접종에 이용하였다.
4. 생분해성 고분자지지체에 세포 접종
단층배양한 중간엽 줄기세포를 P B S로 2회 수 세하고 trypsin-EDTA(Gibco) 용액으로 1 0분간 처리하여 회수한 후 D M E M과 잘 알려진 c h o n- drogenic defined medium(DMEM- H G ( G i b c o ) + I T S ( S i g m a ) + 5 0㎍/㎖ a s c o r b a t e 2-phosphate+100nM dexamethasone ( S i g m a ) + 4 0㎎/㎖ p r o l i n e ( S i g m a ) + 1 . 2 5㎎/㎖
Bovine serum albumin(Gibco)+10%
NCS(newborn calf serum))2 1 , 2 2 )에 혼합하여 PGA mesh에 5×1 06c e l l s / P G A ( 6×6×3㎣)의 농도로 정적접종(static seeding) 후 1주일간 전 처리 배양하였다. 이때 필요한 조건에서는 접종과 전처리배양 시 1 0 n g /㎖ T G F -μ3(Peprotech EC L t d )를 넣어주었다.
5. In vivo 이식
생후 5주령, 수컷의 누드마우스(SLC) 30마리 를 마취시킨 후 등 부위를 소독하고 2㎝정도 절개 하였다. PGA mesh에 세포를 접종하여 전 처리 배양한 이식물을 절개된 누드마우스 등 피하에 각 조건별로 이식하고 흡수성 봉합사로 봉합하였다.
이식 후 누드마우스의 먹이, 물, 그리고 c a g e를 멸균하여 주 2회씩 교환해주고 1 2주 동안 b r e e d- ing 후 1 ~ 4주는 6마리씩, 8주와 1 2주는 3마리씩 희생시켜 생성된 조직을 취하여 육안적 소견을 관
찰하고 4% formaldehyde로 고정하였다.
6. 분석( A n a l y s i s )
조 직 학 적 분 석 은 hematoxylin and eosin(H&E) 염색법으로 핵과 세포질을 염색하 여 조직의 형성정도를 확인하였고, 연골세포가 합 성하여 분비한 세포외 기질 속에 단백당( p r o t e o- g l y c a n )의 정도를 Safranin-O 염색법으로 확인 하였으며, 뼈 형성 여부를 확인하기 위해 V o n Kossa 염색법을 이용하였다. 또한 연골조직의 특 이한 단백질인 제2형 교원질(collagen type Ⅱ ( C h e m i c o n ) )의 생성여부를 확인하기위해 제2형 교원질 항체를 이용한 면역 조직화학적 분석을 병 행하였다.
6.1. 조직학적 검사( H i s t o l o g y )
시료 채취 직후 4% formaldehyde에서 시료 를 2 4시간 이상 충분히 고정시킨 후 탈수, 투명, paraffin 침투과정을 수행하였다. paraffin 침 투가 끝난 시료는 paraffin block으로 제작하는 포매(embedding) 작업을 하였다. 포매 후 만들 어진 paraffin block은 4㎛ 두께로 박절( s e c- t i o n )하여 s l i d e에 부착시키고 6 0℃ o v e n에서 1 시간 동안 p a r a f f i n을 녹여 시료가 s l i d e에 더욱 견고하게 부착되게 하였다. 이렇게 건조시킨 s l i d e를 x y l e n e에 처리하여 조직 내부와 외부에 포매된 p a r a f f i n을 제거하고 a l c o h o l에서 함수과 정을 실시하였다.
6.1.1. H&E 염색
P r o c e s s i n g이 끝난 s l i d e를 hematoxylin 용액 ( G i l l’s hematoxylin)에 약 1 0분간 처리 후 흐 르는 물에서 hematoxylin 여액을 세척하였고, 핵 이외의 부분에 묻은 hematoxylin 용액을 제 거하기 위해 0.5% alcoholic HCl로 탈색한 후 중화과정으로 0.7% ammonia를 처리하였다. 그 다음 세포질의 염색을 위해 eosin 용액에서 1분간 처리하였으며 수세 후 탈수와 투명과정을 거쳤다.
6.1.2. Safranin-O 염색
P r o c e s s i n g이 끝난 s l i d e에 hematoxylin 용액 (Weigert hematoxylin)을 6분간 처리 후 수세
과정을 거쳐 0.02% fast green 용액에서 3분간 염색하였다. 1% acetic acid에서 반응 후 0 . 0 1 % safranin-O 용액에서 5분간 염색 후 수세, 건조, xylene 처리를 거쳐 염색과정을 마무리하였다.
6.1.3. Von Kossa 염색
P r o c e s s i n g이 끝난 s l i d e에 백열등을 1 5㎝ 거 리에서 비추면서 5% silver nitrate 용액을 6 0 분간 처리 후 증류수로 수세하고 sodium car- bonate/19% formaldehyde 용액으로 1분 처리 하였다. 증류수로 수세 후 반응용액( 5 0㎖의 2 5 % sodium thiosulfate+1.5㎖의 10% potassium f e r r i c y a n i d e )에 한번 휘젓고 다시 증류수로 수 세하였다. 이때 반응용액은 사용 직전에 제조하여 사용하였다. 그 다음 nuclear fast red로 3분간 대조염색을 하였다.
6.2. 면역조직화학적 검사( I m m u n o h i s t o- c h e m i s t r y )
P r o c e s s i n g이 끝난 s l i d e에 3% 과산화수소를 사용하여 endogenous peroxidase를 차단시켜 주 고, 조직내부로 항원 용액이 잘 흡수되도록 P B S에 0.15% Triton X-100을 첨가한 용액을 사용하여 투과성을 높여주었다. PBS에 1% BSA가 포함된 용액(blocking solution)으로 실온에서 3 0분 이상 비특이적 반응을 차단한 후 1차 항체로 사람의 제 I, II형 교원질을 사용하여 4℃에서 1 2시간 처리하 였다. Biotin이 부착된 2차 항체( b i o t i n y l a t e d secondary antibody)로 1차 항체를 인식시키고, avidin and biotinylated horseradish peroxi- dase macromolecular complex(ABC solution) 를 처리하여 그 양을 증폭시켰다. 그 후 2차 항체
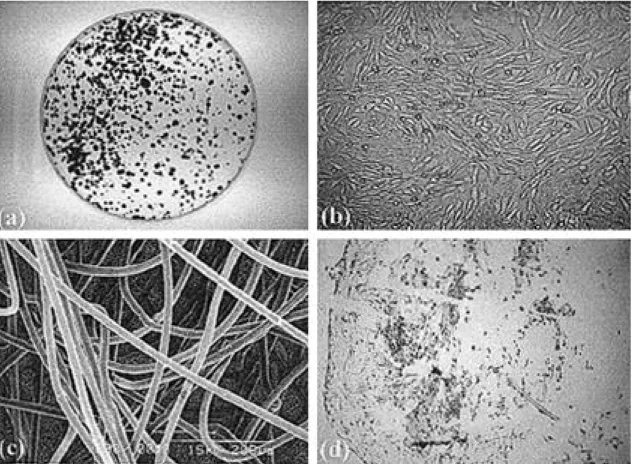
Fig. 1. Morphology of mesenchymal stem cell. (A) Colony forming unit-fibroblastics (CFU-Fs), (B) Mesenchymal stem cells of a healthy rabbit (×100), ( C) SEM of PGA mesh (×200), (D) H&E staining of MSC seeded evenly into PGA(×100).
에 부착되어있는 효소의 활성(peroxidase activi- t y )으로 AEC 기질을 침착하게 하여 갈색의 염색 물을 보이게 함으로써 1차 항원이 위치하는 곳과 발현되는 정도를 검별 할 수 있었다.
6.3. Image analysis
모든 조직학적 관찰은 광학현미경( N i k o n )하에서 시행하였으며, Image analyzer 프로그램 I m a g e - Pro Plus를 이용하여 생성된 조직에서 전체 중에 뼈와 연골조직이 차지하는 면적을 계산하였다.
결 과
1. 중간엽 줄기세포의 단층배양 시 형태학적 특징 토끼 중간엽 줄기세포는 골수로부터 분리하여 세 포 배양 접시에 접종 후 최소 3일 이상 지나야 세포 가 바닥에 붙어서 자라기 시작하였고, 2주정도 지나 면 특징적인 섬유아세포유사 집락단위( c o l o n y forming unit-fibroblastic ; CFU-F)가 관찰되었 다(Fig 1(a)). 형성된 각각의 C F U - F들은 세포 밀 도가 아주 높기 때문에 방치하면 골아세포로 분화할 가능성이 높아서 계대배양을 해주면 초대배양 때와 마찬가지로 섬유아세포와 유사한 형태학적 특징을 보였다(Fig 1(b)). 한편 세포 부착양상을 알아보기 위해 이식 전 일부를 f o r m a l d e h y d e로 고정하고 H&E 염색을 통하여 알아본 결과 건강한 세포들이 PGA 섬유가닥(Fig 1(c))과 어우러져 균일하게 분 포되어 있음을 확인할 수 있다(Fig 1(d)).
Fig. 2. Gross observation of tissue formed in vivo.
(A) , (B) 4weeks, (C) , (D) 8weeks, (E) , (F) 12weeks, ( A),(C),(E) defined media, (B),(D),(F) defined media+TGF-β3.
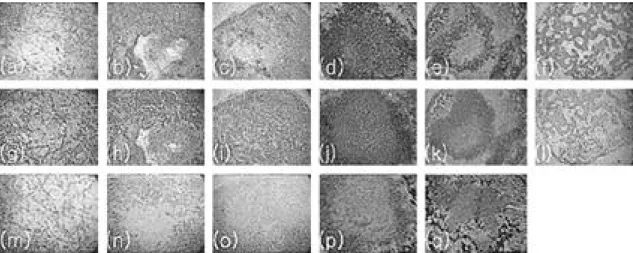
Fig. 3. Histology of tissues formed in vivo after preculturing in defined media (×40). (A) ~ (F) H&E, (G) ~ (L) Safranin-O, (M) ~ (Q) Von Kossa, (A) , (G) , (M) 1week, (B) , (H) , (N) 2weeks, (C) , (I) , (O) 3weeks, (D) , (J) , (P) 4weeks, (E),(K),(Q) 8weeks, (F),(L) 12weeks.
2. In vivo에서 생성된 조직의 육안적 소견 Fig 2는 in vitro에서 각 조건별로 1주일간 전 처리배양 후 누드마우스에서 4주, 8주, 그리고 1 2 주 동안에 생성된 조직의 외형을 관찰한 결과이다.
4주에서는 이식 전의 이식물 형태의 사각형 모양 을 비교적 그대로 유지하고 있었고, 집게로 집었을 때 탄성을 느낄 수 있었으며 반짝거리는 모습이 초 자연골과 비슷한 모양을 하고 있는 것을 확인할 수 있다(Fig 2(a),(b)). 시간이 지남에 따라 조직들 의 크기가 약간 증가하였고 8주에서는 모양이 사 각형에서 원형에 가깝게 변하였다(Fig 2(c),(d)).
1 2주에서는 모양이 불규칙적으로 변하였고, T G F -β3를 첨가한 조건에서 첨가하지 않은 조건에 비해 크기가 커졌음을 알 수 있다(Fig 2(e),(f)).
특히 1 2주후 회수한 조직은 집게로 집었을 때 전 혀 탄성을 느낄 수 없었고 아주 단단하였다.
3. In vivo에서 생성된 조직의 조직학적 결과 Fig 3, 4는 연골과 뼈 조직으로의 분화여부와 생성정도를 알기위해 여러 가지 염색을 통하여 나 타내보았다. 특히 연골조직의 세포외 기질에 특징 적으로 다량 분포되어있는 g l y c o s a m i n o g l y- c a n ( G A G )을 특이적으로 염색하여 나타내는
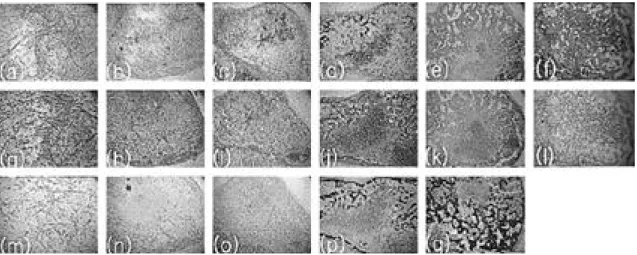
Fig. 4. Histology of tissues formed in vivo after preculturing in defined media+TGF-β3 (×40). (A) ~ (F) H&E, (G) ~ (L) Safranin-O, (M) ~ (Q) Von Kossa, (A) , (G) , (M) 1week, (B) , (H) , (N) 2weeks, (C) , (I) , (O) 3weeks, (D),(J),(P) 4weeks, (E),(K),(Q) 8weeks, (F),(I) 12weeks.
Fig. 5. Immunohistochemistry of tissues formed in vivo for 4 weeks (×100). (A)~(D) type I collagen, (E)~(H) type II collagen, (A),(B),(E),(F) defined media, (C),(D),(G),(H) defined media+TGF- β3.
safranin-O 염색법을 통하여 연골화 분화를 확인 하였고, Ca2+의 침착을 나타내는 m i n e r a l i z a t i o n 을 보기위해 von kossa 염색법을 통하여 골화 분 화정도를 알아보았다. 체내에서 1주 까지는 모든 조건에서 어떤 분화도 일어나지 않았고, 대부분의 PGA fiber도 남아있었다. 2주 후에는 T G F -β3를 첨가한 조건에서만 연골조직으로 분화하기 시작하 였고(Fig 4(b),(h)), 3주 후에는 모든 조건에서 연골조직이 형성되기 시작하였지만 T G F -β3를 첨 가한 조건에서 더 넓게, 더 많이 연골조직으로 분 화하였으며 고분자지지체도 분해되어 대부분 사라 졌다(Fig 4(c),(i)). 4주 후에는 T G F -β3를 첨가 하지 않은 조건에서는 6 0 ~ 8 0 %의 연골조직과 1 0 %내외의 뼈 조직이 형성(Fig 3(d),(j),(p))된 데 비해 T G F -β3를 첨가한 조건에서는 2 0 ~ 4 0 % 의 연골조직과 5 0 ~ 7 0 %의 뼈 조직이 형성되었다 (Fig 4(d),(j),(p)). 8주 후에는 모든 조건에서 연 골조직보다 뼈 조직이 더 많이 형성되었고, 특히 T G F -β3를 첨가한 조건에서는 60~80% 정도가 뼈 조직으로 분화되었다(Fig 4(e),(k),(q)). 12주 후에는 모든 조건에서 완전한 뼈 조직으로 분화되 었음을 확인하였다(Fig 3(f),(l), 4(f),(l)).
4. In vivo에서 생성된 조직의 면역조직화학적 검사
Fig 5는 in vivo에서 4주후 생성된 조직을 면 역조직화학적 염색을 통하여 뼈에 많이 포함되어 있는 제I형 교원질과 연골조직의 특이적인 m a r k- e r로서 세포외 기질에 주로 존재하는 제I I형 교원
질의 발현양상을 본 결과이다. TGF-β3를 처리하 지 않은 조건(Fig 5(a),(b),(e),(f))에서는 연골 조직으로 보이는 부분이 제I형 교원질의 경우 거 의 발현되지 않았고(Fig 5(a),(b)), 제I I형 교원 질의 경우 다량 발현(Fig 5(e),(f))되어 앞의 조 직학적 결과와 일치함을 보여주고 있다. 또한 T G F -β3를 처리한 조건(Fig 5(c),(d),(g),(h))에 서는 연골조직으로 보이는 부분은 제I I형 교원질 이 줄어들고(Fig 5(h)), 뼈 조직으로 보이는 부분 에서는 제I형교원질의 발현이 증가하는 것을 볼 수 있다(Fig 5(c)).
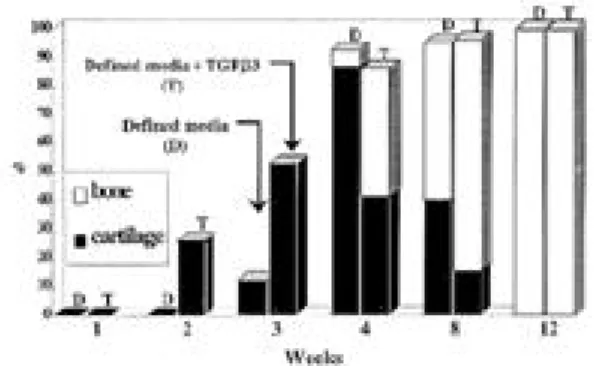
5. In vivo에서 생성된 조직의 뼈와 연골이 차 지하는 비율
Fig 6은 앞의 결과를 Image-Pro Plus로 i n v i v o에서 생성된 조직 전체에서 뼈와 연골조직이 차지하는 영역을 퍼센트로 수치화하여 그래프로 나타낸 결과이다. TGF-β3를 첨가한 조건에서는 2주부터 연골조직으로 분화하기 시작하였고 3주 에서는 절반이상 연골로 분화되었으며 뼈로는 거 의 분화되지 않았지만, 4주 후에는 연골보다 뼈로 더 많이 분화되어 감을 알 수 있다. 또한 8주에는 20% 미만 정도만 연골로 분화했을 뿐 80% 이상 이 뼈로 분화되었고, 12주에서는 완전한 뼈 조직 을 형성하였다. 이에 반에 T G F -β3를 첨가하지 않은 조건에서는 3주가 되서야 연골조직으로 분화 하기 시작하였지만 4주에서는 80% 이상이 연골 로 분화되었고, 5% 정도만이 뼈로 분화되었음을 확인하였다. 8주에는 연골에 비해 뼈로 약간 더 많이 분화되었으며 1 2주가 되면 마찬가지로 완전 한 뼈 조직을 형성하였다.
고 찰
생체조직공학기법을 이용하여 인공 연골의 제작 을 선행했던 이전의 결과들 중 여러 가지 생분해 성 고분자지지체를 이용하였지만 PGA mesh를 이용한 선례가 많았고, 또한 좋은 결과를 나타내 었다1 3 , 1 4 , 1 9 , 2 7 , 3 2 , 3 3 )
. 그래서 본 연구자도 PGA mesh 에 중간엽 줄기세포를 접종하여 누드마우스에 이 식하여 조직을 제작하여 보았다. 조직 재생에 있 어 고분자지지체에 접종하는 적정 세포 수와 균일 Fig. 6. Graph of bone and cartilage proportion in tissues
formed in vivo using Image-Pro Plus.
한 세포 접착이 중요하다고 할 수 있다. 본 연구 에서는 연골세포의 경우 가로, 세로가 6㎜, 두께 가 3㎜인 PGA mesh당 4×1 06c e l l s의 세포 밀도 가 적절하다는 보고1 )에 따라 손실되는 세포 수를 감안하여 5×1 06c e l l s / P G A의 고밀도로 세포접종 을 수행하였다. 이때 PGA mesh내에 들어갈 수 있는 배지 부피( 1 0 0㎕)로 배지에 포함된 세포를 PGA mesh에 조금씩 스며들게 접종하였다. 접 종 후 항온배양기( 3 7℃, 5% CO2)에서 4시간동 안 유지시킨 다음 배지를 채워서 배양함으로써 세 포가 PGA fiber에 붙을 수 있는 시간과 공간을 충분히 제공하였다. 정적배양보다 동적배양이 조 직형성에 있어 좀더 효과적이라는 보고가 많으나
3 0 , 3 1 )1주간 전처리배양 시 들어가는 T G F -β3의 양
과 빨리 d e g r a d a t i o n되는 P G A의 특징을 고려 해볼 때 상대적으로 적은 양을 필요로 하는 정적 배양을 선택하였다. 조직학적 검사를 보았을 때 정적접종과 배양에서도 균일한 세포 부착( F i g 1 ( d ) )과 우수한 조직형성의 결과를 얻을 수 있었 다(Fig 3, 4).
생성된 조직들의 육안적 관찰에서는 in vivo 배양이 길어질수록 생성된 조직들의 모양이 초기 의 사각형에서 구형에 가까운 형태로 변하는 것을 볼 수 있는데 이식물이 누드마우스 등 피하에 이 식된 후 누드마우스가 움직임에 따라 피하 주위로 부터 물리적 자극을 받게 되는데 특히 사각형의 모서리 부분에 자극이 집중되어 점점 구형으로 변 하게 된다2 0 ). 시간이 지날수록 T G F -β3를 첨가한 조건일수록 다소 크기가 커졌음을 확인할 수 있는 데 이는 in vivo내에서 세포와 세포외 기질들이 증식했기 때문이며 T G F -β3가 증식에도 영향을 미친다고 할 수 있다2 4 , 2 9 ).
중간엽 줄기세포를 이용하여 뼈세포나 지방세포 로의 분화를 유도할 때는 단층배양이2 5 ), 또한 연 골화 분화를 유도할 때는 pellet 배양 등의 삼차 원적 배양이4 , 2 2 , 2 3 , 2 8 )많이 보고되고 있으며, 이때 각각의 분화 방향에 따라 제공되는 배지성분이 다 른데 특히 연골 분화에서는 T G F -β가 결정적인 역할을 하고 T G F -β1보다는 T G F -β3가 더 효과 적이라는 보고가 있다2 2 ). 그래서 본 연구에서도 연골화 분화를 유도하기 위해 PGA mesh를 이 용하여 삼차원적인 환경을 제공하여 주었고,
T G F -β3를 첨가하여 전처리배양의 효과를 알아보 았다. 중간엽 줄기세포는 in vitro에서 T G F -β등 의 성장인자나 싸이토카인을 이용하지 않고는 연 골화 분화를 유도할 수 없었지만 누드마우스의 i n v i v o에서는 T G F -β등이 없어도 연골로 분화가 일 어나고 결국은 뼈 조직으로 분화되는 것을 확인하 였다. 그런데 T G F -β3를 첨가하여 전처리배양한 조건에서는 그렇지 않은 조건에 비해 더 빨리 연 골로 분화가 시작되고, 더 빨리 뼈 조직으로 분화 됨을 확인하였다. 이것은 in vivo내에 존재하는 우리가 아직 모르는 연골화 유도물질이 이식물에 영향을 주어 T G F -β3의 영향이 없어도 연골로 분 화되고 a n g i o g e n e s i s와 뼈 형성 유도물질 또한 이식물에 작용하여 결국은 뼈 조직으로 분화된다 고 볼 수 있겠다. 이식 전에 T G F -β3를 첨가하여 전처리배양을 해주면 T G F -β3가 in vivo내의 다 른 f a c t o r들과 함께 작용하여 연골화 분화와 골화 분화를 촉진시킨다고 말할 수 있겠다.
중간엽 줄기세포는 이미 특정 부분으로 분화된 세포들에 비해 많은 장점을 가지고 있다. 하지만 우리는 이 연구 결과를 통하여 중간엽 줄기세포를 생체조직공학기법을 이용하여 뼈와 연골조직으로 분화시켜 이용하는데 가능성을 확인하였지만 연골 조직으로 이용하는데 있어 in vivo 환경에서 중 간엽 줄기세포는 결국은 뼈 조직으로 분화되는 한 계를 경험하였다. 이와 같은 실험결과들은 중간엽 줄기세포를 이식하기 전 in vitro에서의 전처리 과정이 in vivo에서의 분화 양상에 중요하게 작 용할 것이라는 근거를 제시하고 있으며, 그러므로 in vitro 전처리 과정에 대한 연구가 중간엽 줄기 세포의 조직공학적 사용에 매우 중요할 것이라는 것을 제시한다고 할 수 있다. 중간엽 줄기세포로 부터 연골조직으로의 분화작용이 널리 알려져 있 는 T G F -β의 경우 본 실험결과에서는 연골조직 뿐 아니라 뼈 조직으로의 분화도 촉진된다는 결과 는 의외의 결과로서 그 원인에 관한 보다 자세한 연구가 필요할 것으로 생각된다. 추후 전처리 기 간의 변화, TGF-β의 농도에 따른 변화, 다른 성 장인자들의 전처리 등을 통한 보다 다양한 전처리 배양에 관한 실험을 통해 중간엽 줄기세포를 보다 예측가능한 골 및 연골조직 재생에 사용될 수 있 을 것으로 기대된다.
결 론
이 실험에서 본 연구자들이 내린 결론은 i n vivo 환경에서 중간엽 줄기세포는 초기에는 연골 로 분화하지만 최종적으로는 뼈로 분화하며 T G F - β3의 전처리는 in vivo 배양 초기에 연골세포로의 분화를 촉진하고, in vivo 배양 후기에는 뼈 조직 으로의 분화도 증가시키는 것으로 사료된다.
R E F E R E N C E S
01) 박태순, 다중접종법이 고분자 중합체에서 연골세 포의 기질 생성에 미치는 영향, 아주대학교 석사논 문, 2001.
02) Archer CW, McDowell J, Bayliss MT, Stephen MD and Bentley G : Phenotypic mod- ulation in subpopulation of human articular chondrocytes in vitro. J Cell Sci, 97:361-371, 1990.
03) Bab I, Ashton BA and Gazit D : Kinetics and differentiation of marrow stromal cells in diffu- sion chambers in vivo. J Cell Sci, 84:139-151, 1986.
04) Barry F, Raymond E, Boynton, Beishan Liu and Murphy M : Chondrogenic differentiation of mesenchymal stem cells from bone marrow : Differentiation-dependent gene expression of matrix components. Exper Cell Res, 268:189- 200, 2001.
05) Bassleer C, Gysen P, Foidart JM, Bassleer R and Franchimont P : Human chondrocytes in tridimensional culture. In vitro Cell & Develop Biol, 22:113-119, 1986.
06) Beresford N : Osteogenic stem cells and the stromal system of bone and marrow. Clin Orthop Res Soc, 22:228, 1997.
07) Brittberg M, Lindahl A, Nilsson A, Ohlsson C, Isaksson O and Peterson L : Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. The New England J of Med, 331:889-895, 1994.
08) Bruder SP, Jaiswal N : The osteogenic potential of human mesenchymal stem cells is not dimin- ished after one billion-fold expansion in vitro.
Trans Orthop Res Soc, 21:580, 1996.
09) Caplan AI : Mesenchymal stem cells. J Orthop Res, 9:641-650, 1991.
10) Chacko SJ, Abbott J, Holtzer S and Holtzer H : The loss of phenotypic traits by differentiated cells. VI. Behavior of the progeny of a single chondrocyte. J Exp Med, 130:417-442, 1969.
11) Chesterman PJ, Smith AU : Homotransplanta - tion of articular cartilage and isolated chondro- cytes: an experimental study in rabbits. J Bone Joint Surg Br, 50: 184-197, 1968.
12) Francois Lemare, Nathalie Steimberg, Caro- line Le Griel, Sylvie Demignot and Monique A d o l p h e : Dedifferentiated chondrocytes cul- tured in alginate beads: Restoration of the differ- entiated phenotype and of the metabolic respons- es to interleukin-1β. J Cell Physio, 176:303-313, 1998.
13) Freed LE, Hollander AP, Martin I, Barry JR, Langer R and Vunjak-Novakovic G : Chon- drogenesis in a cell-polymer-bioreactor system.
Exper Cell Res, 240:58-65, 1998.
14) Freed LE, Marquis JC, Nohria A, Emmanual J, Mikos AG and Langer R : Neocartilage for- mation in vitro and in vivo using cells cultured on synthetic biodegradable polymers. J Biomed Mater Res, 27:11-23, 1993.
15) Friedenstein AJ : Osteogenic stem cells in the bone marrow. Bone Miner Res, 7:243-272, 1990.
16) Goldberg VM, Caplan AI : Biological resurfac- ing: an alternative to total joint arthroplasty.
Orthopedics, 17:819-821, 1994.
17) Grigoriadis AE, Heersche JN and Aubin JE : Differentiation of muscle, fat, cartilage, and bone from progenitor cells present in a bone-derived clonal cell population : effect of dexamethasone.
J Cell Biol, 106:2139-2151, 1988.
18) Haynesworth SE, Goldberg VM and Caplan AI : Diminution of the number of mesenchymal
stem cells as a cause for skeletal aging. In: Mus- culoskeletal soft-tissue aging: Impact on mobili- ty, pp 80-86. Ed by JA Buckwalter, VM Gold- berg, and SL-Y Woo. Rosemont, Illinois, 1993.
19) Il-Woo Lee, Vacanti JP, Taylor GA and Mad- sen JR : The living shunt: A tissue engineering approach in the treatment of hydrocephalus. Neu - rological Research, 22:105-110, 2000.
20) Jizong Gao, Dennis JE, Solchaga LA, Awadal - lah AS, Goldberg VM and Caplan AI : Tissue- engineered fabrication of an osteochondral com- posite graft using rat bone marrow-derived mes- enchymal stem cells. Tissue Engineering, 7:363- 371, 2001.
21) Johnstone B, Yoo J and Barry FP : In vitro chondrogenesis of bone marrow-derived mes- enchymal cells. Trans Orthop Res Soc, 21:65, 1996.
22) Mackay AM, Beck SC, Murphy JM, Barry FP, Chichester CO and Pittenger MF : Chon- drogenic differentiation of cultured human mes- enchymal stem cells from marrow. Tissue Engi - neering, 4:415-428, 1998.
23) Martin I, Padera RF, Vunjak-Novakovic G and Freed LE : In vitro differentiation of chick embryo bone marrow stromal cells into cartilagi- nous and bone-like tissues. J Orthop Res , 16:181-189, 1998.
24) Massague J, Cheifetz S, Laitlo M, Ralph DA, Weis FM and Zentella A : Transforming growth factor-β. Cancer Surveys, 12:81-103, 1992.
25) Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S and Marshak DR : Multilineage potential of adult human mesenchy - mal stem cells. Science, 284:143-147, 1999.
26) Prockop DJ : Marrow stromal cells as stem cells for nonhematopoietic tissues. S c i e n c e, 276:71- 74, 1997.
27) Puelacher WC, Moony D, Langer R, Upton J, Vacanti JP and Vacanti CA : Design of nasoseptal cartilage replacements synthesized from biodegradable polymers and chondrocytes.
Biomaterials, 15:774-778, 1994.
28) Quarto R, Campanile G, Cancedda R and Dozin B : Modulation of commitment, prolifera- tion and differentiation of chondrogenic cells in defined culture medium. E n d o c r i n o l o g y, 138:4966-4976, 1997.
29) Roberts AB, Anzano MA, Wakefield LM, Roche NS, Sterm DF and Spon MB : Type β transforming growth factor : A bifunctional regu - lator of cellular growth. Proc Natl Acad Sci , 82:119-123, 1985.
30) Vunjak-Novakovic G, Martin I, Obradovic R, Bursac PM, Langer R and Freed LE : Dynam- ic cell seeding of polymer scaffolds for cartilage tissue engineering. biotechnology progress , 14:193-202, 1998.
31) Vunjak-Novakovic G., Martin I., Obradovic B, Treppo S, Gredzinsky AJ, Langer R and Freed LE : Bioreactor cultivation condition modulate the composition and mechanical prop- erties of tissue-engineered cartilage. J Orthop Res, 17:130-138, 1999.
32) Yilin Cao, Vacanti JP, Paige KT, Upton J and Vacanti CA : Transplantation of chondrocytes utilizing a polymer-cell construct to produce tis- sue-engineered cartilage in the shape of a human ear. Plast Reconstr Surg, 100:297-304, 1997.
33) Yoo JJ, Il-Woo Lee and Atala A : Cartilage rods as a potential material for penile reconstruc- tion. J Urol, 160:1164-1168, 1998.
34) Young RG, Butler DL, Weber W, Caplan AI, Gordon SL and Fink DJ : The use of mes- enchymal stem cells in a collagen matrix for achille’s tendon repair. J Orthop Res, 16:406, 1998.