SOP number: 대전청의료제품실사과-2015-1 Version : 1.0
Date : 2015.09
한약재 제조 및 품질관리기준 (GMP) 적합성 평가
2015. 09
개정내역
연번 시행일 번호 버전 개정사유 작성자
1 2015.
9.30.
대전청의료제품실사과
-2015-1 1.0 신규 제정 이사임
원아진
구분 소속 직급(직위) 성명
작성자 의료제품실사과 주무관 이사임, 원아진
확인자 의료제품실사과 과 장 김영림
승인자 대전지방식약청 청 장 김광호
< 목 차 >
1. 목 적 ··· 3
2. 업무범위 ···3
3. 관련법규 및 문서 ···3
4. 관련부서 ···4
5. 절차 ···4
6. 참고자료(Q & A) ···12
[붙임1-1] 한약재 제조소에 대한 GMP평가 업무 절차 ···15
[붙임1-2] 한약재 제조품목에 대한 GMP평가 업무 절차 ···16
[붙임2-1] 한약재제조및품질관리기준실시상황평가(유형별 GMP) 신청방법 및 제출자료 ···17
[붙임2-2] 한약재제조품목허가․신고 신청방법 및 제출자료 ··· 20
[붙임2-3] 구비서류 상세 요건 ···27
[붙임3] 한약재 GMP 서류 제출 점검표 ···34
[양식1] 실사일정 협의 공문 ···35
[양식2] 실태조사 실시 알림 공문 ···37
[양식3-1] 한약재 제조및품질관리기준 민원처리기간 연장 통보 ··· 39
[양식3-2] 협의기한 연장 협조 요청 ···40
[양식4] 현장실태조사서(Draft) ···41
[양식5] GMP실태조사 결과보고서 ···42
[양식6] 한약재 제조 및 품질관리기준 현장실태조사 결과보고 ···48 [양식7-1] 한약재 GMP 실시상황 평가 결과 통보 문서 양식(적합) 49
[양식8-1] 자료보완 재요구 ···56 [양식8-2] 자료보완 재요구 ···58 [양식9] 보완기간 연장승인 ···60
1. 목적
▸ 이 업무수행편람은 대전지방식품의약품안전청(대전청) 의료제품실사과에서 수행하고 있는 한약재 제조 및 품질관리기준(GMP) 적합성 평가업무와 관련한 민원사항 세부 처리절차 등을 문서화함으로써 그 업무의 정확성, 일관성 및 투명성을 확보하기 위 한 것이다.
2. 업무범위
▸ 대전청 의료제품실사과는 대전청 관할지역 업체에서 신청한 제조품목 및 대전청 관할지역 한약재 제조소에 대하여 「의약품 등의 안전에 관한 규칙」 별표2 한약 재 제조 및 품질관리기준 실시상황평가에 필요한 서류 검토 및 현장실태조사 업무 를 담당한다.
3. 관련법규 및 문서
▸ 약사법 제31조(제조업 허가 등)
▸ 의약품 등의 제조업 및 수입자의 시설기준령(대통령령) 및 같은령 시행규칙(총리령)
▸ 의약품 등의 안전에 관한 규칙(총리령) 및 [별표2]
▸ 한약(생약)제제 등의 품목허가․신고에 관한 규정(식약처 고시)
▸ 한약재 안전 및 품질관리 규정(식약처 고시)
▸ 한약재 제조 및 품질관리 기준(GMP) 실시상황 평가 가이드라인('13.5.)
▸ 한약재 GMP 해설서[한약재 제조 및 품질관리기준] 및 한약재 GMP 기준서 양식 ('13.12.)
▸ 한약재 제조 및 품질관리기준(GMP) 안내서('14.7.)
▸ 한약재 품목 허가․신고 안내서('15.5.)
4. 관련부서
▸ 대전지방식품의약품안전청 의료제품안전과
▸ 식품의약품안전처 바이오생약국 한약정책과
▸ 식품의약품안전평가원 바이오생약심사부 생약제제과
▸ 기타 (다른 지방청 GMP 평가부서)
5. 절차
▸ 한약재 제조 및 품질관리기준(GMP) 적합성 평가 업무의 전체적인 흐름은 [붙임1]
과 같으며, 그 구체적인 내용과 절차는 다음과 같다.
• [붙임1-1] 한약재 제조소에 대한 GMP평가 업무 표준운영절차
• [붙임1-2] 한약재 제조품목에 대한 GMP평가 업무 표준운영절차
5.1. 신청서 접수 및 신청자료 검토
5.1.1. 담당자 배정
▸ 민원배정업무 담당자는 매일 「의약품 행정포털」을 통해 의료제품실사과에 접수 된 한약재제조및품질관리기준실시상황평가(유형별 GMP) 신청서 및 수수료, 의료 제품안전과/생약제제과를 통해 GMP평가 협의의뢰된 한약재제조품목허가․신고 신청서를 확인한다. 오납의 경우 수수료 전부 또는 일부를 민원인에게 반환할 수 있다. (「의약품 등의 허가 등에 관한 수수료 규정」제6조 참조)
• [붙임2-1] 한약재제조및품질관리기준실시상황평가(유형별 GMP) 신청방법 및 제출자료
• [붙임2-2] 한약재제조품목허가․신고 신청방법 및 제출자료
• [붙임2-3] 구비서류 상세 요건
▸ 민원배정업무 담당자는 기존 평가이력과 담당자별 현재 업무 진행상황을 고려하 여 민원처리담당자를 지정한다.
▸ 민원배정업무 담당자는 제조업소의 실사이력 등을 검토하여 실사대상/서류검토 대상 여부를 일차적으로 확인하고 민원처리담당자를 지정한다.
5.1.2. 신청자료 검토
▸ 민원처리담당자는 [붙임2]에서 정하는 자료를 포함한 신청서가 제출되었는지 확
• [붙임3] 한약재 GMP 서류 제출 점검표
▸ 민원처리담당자는 점검표에 따라 민원인이 제출한 자료가 해당 자료 요건을 충족 하지 아니하였을 때 신청일로부터 7일 이내에 해당 자료를 요청할 수 있다.
▸ 민원처리담당자는 신청자료를 검토하는 동안 「한약재 제조 및 품질관리기준 (GMP) 실시상황 평가 가이드라인」에 따라 실태조사 대상 여부, 실태조사 구성 등 평가방향을 7일 이내에 결정한 후 민원인과 실사 일정 협의를 자료검토와 병 행하여 진행한다.
□ 실태조사 대상
• 최초 평가 대상인 제조소
• 실태조사 유예기간이 경과한 제조소
• 기타(유예기간 이내 포함) 현장 실태조사가 필요한 상당한 이유가 있는 경우 ex. 부적합, 취하(부적합 예상), 실사이력 대비 시설 등에 큰 변경이 있는 경우, 품목
허가심사 단계에서 제조원에 대한 제조 및 품질관리 실태 확인이 필요하다고 판단되는 경우 등
□ 실태조사 구성
• 실태조사팀 구성: 2인 1조
- 구성: 지방청 GMP 조사관(품목특성을 고려하여 업무 소관부서에서 조사팀을 구성, 운영)
• 실태조사 일정: 제조소 당 2일간(필요 시 변경 가능)
□ 실태조사 유예기간
구분 기준 유예기간
한약재 품목(변경) 신고․허가 제조소(시설․설비) 2년
※ 실태조사 유예기간 중에는 서류평가를 원칙으로 함(단, 기타 현장 실태조사가 필 요한 상당한 이유가 있는 경우는 실태조사 할 수 있음)
※ 유예기간 산정: 실사 최종일에서 품목허가(신고) 신청일(접수일자 기준)까지
□ 실태조사 업무개요
• 제조소 현황 소개 청취 및 실사 진행 세부일정 설명
• 도면, 기준서 등 현장 점검시 필요 사항 사전 확인
• 제조시설 등 현장 점검
• 점검 자료 세부 검토(기준서, SOP, 기록서 등) 5.2.1. 한약재 제조소 GMP평가 절차
1) 실사일정 협의 및 실태조사 실시
▸ 신청 민원의 실태조사가 필요한 경우에는 실사일정 협의 공문을 발송하여 해당 민원의 신청사와 실사 일정을 협의한다. 통상 실사일정은 3개 정도를 요청한다.
• [양식1] 실사일정 협의 공문
▸ 실사 일정 협의기간은 10일로 하며 신청사에서 사유를 제시하는 경우에는 10일 이후에 제출 가능하다.
▸ 실사팀 구성은 「한약재 제조 및 품질관리기준(GMP) 실시상황 평가 가이드라 인」에 따라 GMP조사관 2인으로 구성하되, 필요한 경우에는 제조소 및 품목 특 성을 고려하여 조사팀의 구성 및 운영을 달리할 수 있다.
▸ 실사일정 및 실사팀 구성이 확정되면 해당 신청사에 실태조사 실시 알림 공문을 보낸다.
• [양식2] 실태조사 실시 알림 공문
▸ 민원처리담당자는 「민원사무처리에 관한 법률」 시행령 제17조의 규정에 따라 제조소와 협의된 실태조사 일정 등으로 민원처리기간 연장이 필요한 경우 연장 할 수 있다. 이 경우 처리기간의 연장 사유와 처리예정기한을 민원인에게 통지 하여야 한다.
• [양식3-1] 한약재 제조및품질관리기준(GMP) 민원처리기간 연장 통보
▸ 민원처리담당자는 실사팀에게 공람(행정포털시스템 공람 메뉴 활용)하여 실태조 사가 원활히 진행될 수 있도록 인계한다.
▸ 실사팀은 실사 전 실사업무를 충실하게 수행할 수 있도록 GMP 평가 자료 및 해당 업체의 품목 보유 현황을 충분히 검토한다.
▸ 「의약품 등의 안전에 관한 규칙 [별표2]」, 「한약재 제조 및 품질관리 기준 (GMP) 실시상황 평가 가이드라인」, 「한약재 GMP 해설서」 등을 참고하여 실 태조사를 진행한다.
• 실사결과 종합정리 및 마무리 회의
□ 결과 처리 기준
• 제출서류와 현장 실태조사 결과를 종합하여 판정하며, 보완이 있을 시 제출한 보완자료를 포함하여 심사 후 결과 판정
• 평가결과 처리 기준
구 분 지 적 사 항 처리(원칙)
중 대
○ 사람에게 위해한(harmful)제품을 생산했거나 생산할 상당한 위험 성(risk)이 있는 사안 또는 이에 준하는 사항 등
○ 문서 허위 작성(데이터 조작 등)
부적합
중 요
〇 품목허가/신고 사항과 다르게 제품을 생산하였거나 생산할 가능 성이 있는 사항
○ GMP 기준 또는 제조 허가 조건에 중요 일탈(deviation)이 있는 사항
〇 제조단위 출하 절차에 문제가 있거나, 담당자가 맡은 이루를 수 행하지 아니한 사안
○ 단독으로는 ‘중요’가 아니지만 ‘기타’ 몇 가지가 복합되면 중요 지 적사항이 될 수 있는 사안 등
보완
• 해당 품목의 실사기간과 현장조사 대상 건물의 위치, 현장에서 확인할 서류 등을 고려하여 주실사자의 주도하에 업무를 분담하여 실사를 진행한다.
• 실사 종료 후 지적사항 등을 정리하여 해당 제조소의 책임자 및 담당자에게 알리고 의견을 청취한 후 실사를 마무리한다.
▸ 현장실태조사서(Draft)를 작성하여 제조소에 제공하며, 공식적인 실사결과는 내 부 보고 후 공문으로 통보할 예정임을 제조소 관계자에게 밝힌다.
• [양식4] 현장실태조사서(Draft)
2) 실태조사 결과 보고 및 후속조치
▸ 주실사자는 부실사자와 협의하여 실사일로부터 30일 이내에 GMP실태조사 결과 보고서를 작성한다.
• [양식5] GMP실태조사 결과보고서
▸ 주실사자는 작성된 실태조사 결과보고서를 부실사자의 협조결재를 받아 의료제 품실사과장의 온나라 결재를 득한다.
• [양식6] 한약재 제조 및 품질관리기준 현장실태조사 결과보고
▸ 실사결과 적합, 보완자료 요청 등 실사 결과를 행정포털시스템을 통하여 지정된 기일 내에 민원인에게 통보한다. 이때 GMP실태조사 결과보고서를 행정포털 해 당민원의 ‘문서등록’ 탭을 이용하여 반드시 업로드한다. 보완조치가 필요한 경우 보완 기간은 통상 60일로 설정한다.
• [양식7-1] 한약재 GMP 실시상황 평가 결과 통보 문서 양식(적합인 경우)
• [양식7-2] 한약재 GMP 실시상황 평가 결과 통보 문서 양식(보완자료 요구인 경우)
▸ 보완 요청한 내용이 접수되면 민원처리담당자는 보완 요청한 사항의 이행 여부 를 검토한다. 민원처리담당자는 보완 기간 중 보완요구 자료 전부가 제출되지 아니할 때에는 10일을 보완기간으로 하여 재보완(2차 보완)요청한다.
• [양식8-1] 자료보완 재요구
▸ 민원인이 보완요구를 받은 기간 내에 보완을 할 수 없음을 이유로 보완에 필요 한 기간을 연장 요청하는 경우에는 2회에 한하여 「민원사무처리에 관한 법률」
에 따라 기간을 연장해 줄 수 있으며, 행정포털시스템으로 기간 연장 승인 공문 을 기안한다.
• [양식9] 보완기간 연장승인
5.2.2. 한약재 제조품목 GMP평가 절차
▸ 신규업체의 품목허가․신고건에 해당하는 경우에는 실태조사 및 서류평가를 병행 하는 반면, 기존의 한약재 GMP 적합 인증업체의 품목허가․신고건의 경우에는 필요시 실태조사를 실시한다.
• 예시: 실사이력 대비 시설 등에 큰 변경이 있거나, 평가 신청한 품목의 제조 공정을 고려하였을 때 추가적인 시설 및 설비의 확인이 필요한 경우 실태조 사를 실시한다.
5.2.2.1. 실태조사를 실시할 경우
▸ 상단에 언급한 5.2.1.의 1) 및 2)의 과정에 따라 업무를 수행한다.
연장 사유와 처리예정기한을 명확히 기재하여 협의 의뢰부서에 민원 협의처리 기한 연장을 요청한다.
• [양식3-2] 협의기한 연장 협조 요청
▸ 실사결과 적합인 경우에는 최종 결과를 행정포털시스템으로 검토 의뢰한 부서에 알린다.
• [양식7-3] 품목별 사전 GMP 평가 결과 통보 문서 양식(적합인 경우)
▸ 실사결과 보완자료를 요청해야 할 경우에는 다음의 양식을 참조하여 지정된 기 일 내에 민원인에게 통보한다.
• [양식7-4] 품목별 사전 GMP 평가 결과 통보 문서 양식(보완자료 요구인 경 우)
▸ 재보완(2차 보완)을 요청할 경우 다음의 양식을 참조한다.
• [양식8-2] 자료보완 재요구
5.2.2.2. 서류평가 대상으로 분류할 경우
▸ 제출된 서류는 「의약품 등의 안전에 관한 규칙 [별표2]」, 「한약재 제조 및 품 질관리 기준(GMP) 실시상황 평가 가이드라인」, 「한약재 GMP 해설서」 등에 따라 검토한다.
• 검토 완료 후 GMP실태조사 결과보고서([양식5])를 작성한다.(보고서 세부 항 목 중 11-1 및 11-2, 12번 항목만을 작성)
• GMP실태조사 결과보고서는 행정포털 해당민원의 ‘문서등록’ 탭을 이용하여 반드시 업로드한다.
▸ 실사결과 적합인 경우에는 최종 결과를 행정포털시스템으로 검토 의뢰한 부서에 알린다.
• [양식7-3] 품목별 사전 GMP 평가 결과 통보 문서 양식(적합인 경우)
▸ 실사결과 보완자료를 요청해야 할 경우에는 다음의 양식을 참조하여 지정된 기 일 내에 민원인에게 통보한다.
• [양식7-4] 품목별 사전 GMP 평가 결과 통보 문서 양식(보완자료 요구인 경 우)
▸ 재보완(2차 보완)을 요청할 경우 다음의 양식을 참조한다.
Q. 작업소 바닥은 에폭시 재질이어야 하는지?
Q. 제조소의 면적이 200m2이하인 경우도 가능한지?
A. 한약재 GMP를 득하기 위한 제조시설은「의약품 등의 제조업 및 수입자의 시설 기준령」 및 동 시행규칙 「의약품 등의 제조업 및 수입자의 시설기준령 시행규 칙」, 「의약품 등의 안전에 관한 규칙」별표2에 적합하면 됩니다. 제조소의 지 하·지상 여부, 면적, 다층건물 등 제한은 없으나 제조면적은 제조하는 품목수량, 필요 시설 등을 고려하여 작업 및 보관에 필요한 충분한 공간이어야 합니다. 또 한 작업소 바닥 재질은 분진 발생 등에 의한 2차 오염 및 품질에 영향을 미치지 않아야 하므로 에폭시, 폴리우레탄 재질 또는 2차 코팅 등이 권고됩니다.
Q. 식품, 건강기능식품 제조업 등을 위한 설비와 한약재 제조업을 위한 설비 를 공용으로 사용할 수 있는지?
A. 「의약품 등의 제조업 및 수입자의 시설기준령」제5조에 따라 식품·식품첨가물, 건강기능식품과 한약재 상호 간에 오염될 우려가 없는 경우 제조시설 및 기구 를 공용으로 이용할 수 있습니다. 다만, 상호간 교차오염이 발생하지 않도록 적 절한 방안을 마련하고 관리를 하여야 합니다.
Q. 저온보관소를 구비해야 하는지?
Q. 원료약품, 자재, 반제품 및 완제품의 보관소는 각각 별도로 두어야 하는 지?
A. 「의약품 등의 안전에 관한 규칙」[별표2] 9.2에서 ‘원료약품, 자재, 반제품 및 완제품은 품질에 나쁜 영향을 미치지 않는 조건에서 보관하여야 한다.’고 규정 하고 있고, ‘원료약품, 자재, 완제품, 부적합품 및 반품된 제품은 각각 구획된 장소에 종류별로 보관하여야 한다. 다만, 원료약품, 자재 및 완제품이 혼동을 일으킬 우 려가 없는 시스템에 의하여 보관되는 경우에는 그렇지 않다.’고 규정하고 있습
시스템으로 기간 연장 승인 공문을 기안한다.
• [양식9] 보완기간 연장승인
6. 참고자료(Q & A)
품질 변패 및 변질 등이 우려될 경우 자사에서 적절한 온도 및 습도를 유지하 여 보관관리를 하여야 하며, 원료약품, 자재, 반제품 및 완제품은 혼동되지 않 도록 구획 구별하여 저장하도록 합니다.
※ 참고로, 한약재GMP해설서는 “분리”란 다른 건물이거나, 같은 건물 안의 공간 이 벽에 의하여 구분되어 작업원의 출입구역이나 공기 조절장치가 따로 되어 있는 상태를 말하고, “구획”이란 칸막이 등으로 나누어져 의약품이 교차오염 이 일어나거나 섞이지 아니하도록 관리할 수 있는 상태를 말하며, “구분”이란 선이나 간격을 두어서 의약품이 혼동되지 아니하도록 구별하여 관리할 수 있 는 상태라고 정의하고 있습니다.
Q. 독성주의한약재 보관소는 분리해야 하는지?
A. 독성주의한약재의 보관소 분리는 따로 규정하고 있지 않으나 다른 한약재와 혼 동되지 않도록 주의하여 관리하는 것이 바람직합니다.
Q. 작업소나 보관소에 전실(前室) 등을 설치해야 하는지?
A. 「의약품 등의 제조업 및 수입자의 시설기준령」 및 동 시행규칙 「의약품 등 의 제조업 및 수입자의 시설기준령 시행규칙」, 「의약품 등의 안전에 관한 규 칙」별표2에 따라 한약재 제조업소의 전실 등의 설치 의무가 규정되어 있지 않 습니다. 다만 한약재GMP해설서에는 곤충이나 쥐의 침입을 차단하기 위하여 외 부와 직접 통하지 않도록 설계하는 것이 바람직하며, 그렇지 않은 경우 방충·방 서를 철저히 하여 곤충이나 쥐의 침입을 차단하도록 권고하고 있습니다.
Q. 품목의 일부 시험항목을 한약재 품질검사기관이 아닌 다른 시험검사 기관(예; 의료기기 시험검사기관)에 위탁할 수 있는지?
A. 「약사법」 제73조에 따라 식품의약품안전처장이 의약품등의 품질검사를 위하 여 지정하는 기관에 시험을 위탁할 수 있으며, 한약재의 경우 한약재 품질검사
해예방 → 시험검사기관”에서 확인 가능합니다.
Q. 개방형시험실 신청은 어떻게 하는지?
Q. 개방형시험실 이용을 위한 요건이나 제한이 있는지?
A. (사)한국한약산업협회 또는 서울식약청(개방형시험실 시험관리자)에 별지 제1 호서식을 작성하여 E-mail, 팩스 등으로 접수하시면 됩니다.
개방형시험실의 사용대상(시험실시자)은 한약재 제조업체에 소속된 직원으로 1) 「고등교육법」에 따라 대학 또는 전문대학 이상의 식품, 의약품, 한약재 검
사와 관련이 있는 분야의 학과 또는 학부를 이수하여 졸업한 자로서 당해 검사 업무에 대하여 3개월 이상의 경력이 있는 자
2) 장비 사용 등에 관한 전문교육 또는 식약처가 인정하는 교육기관의 시험 관 련 전문교육을 연간 21시간 수료한 자로서, 잔류농약․중금속․벤조피렌․곰팡이 독소․정량시험 관련 분석장비 이용자는 해당 분석장비별 운용교육을 이수한 자(관련 교육수료증 제출)
입니다. 다만, 자가 시험실을 갖춘 제조업체 및 가이드라인에 명시된 준수사항 을 따르지 않은 자 등은 사용이 제한됩니다. 자세한 사항은 “식품의약품안전처 홈페이지www.mfds.go.kr → 정보자료 → 법령자료 → 지침,가이드라인,해설서”
의 <식품의약품안전처 개방형 시험실 운영 가이드라인>에서 확인 가능합니다.
[붙임1-1] 한약재 제조소에 대한 GMP평가 업무 절차 (기존업체의 기존품목)
신청자
처리부서
대전청 의료제품실사과 식약처 고객지원담당관
(고객지원담당관.
의료제품실사과)
신 청 접수
실태조사 일정협의 요청
신청자료 검토
통보(공문)
(의료제품실사과)
(의료제품실사과) 보완요청
(필요시) 재보완요청
(필요시)
판정결과 등록 (적합/부적합) 보완자료
실태조사 일정협의 회신
(의료제품실사과)
한약재 GMP 적합승인 (판정결과 적합시)
추가자료
실사자 및 실사일정 통보(공문)
제조소 실태조사 (의료제품실사과)
[붙임1-2] 한약재 제조품목에 대한 GMP평가 업무 절차 (기존․신규업체의 신규품목)
신청자
처리부서 협조부서
대전청 의료제품안전과
평가원 생약제제과 대전청 의료제품실사과
신 청 GMP 평가의뢰
신청자료 검토
실태조사 일정협의 회신
실태조사 일정협의 요청
실태조사/서류검토
보완자료
실사대상
서류검토 대상
추가자료
접수
실사대상/서류검토 결정
실사자 및 실사일정 통보(공문)
보완요청 (필요시) 재보완요청
(필요시) 제조소
판정결과 회신 (적합/부적합) 통보(공문)
확인 및 검토 민원처리
최종결과 알림
[붙임2-1] 한약재제조및품질관리기준실시상황평가(유형별 GMP) 신청방법 및 제출자료
□ 민원신청
○ 개요
- 기존 허가(신고)된 전체 품목에 대한 GMP관련 문서 및 시설 평가로, 민원신청 시 대표품목(1품목)에 대한 3개 제조단위 이상의 제조실적 및 GMP서류를 구비
○ 신청부서 : 대전지방식품의약품안전청 의료제품실사과
○ 전자민원수수료(우편/방문) : 207,000원(230,000원) - 「의약품 등의 허가 등에 관한 수수료 규정」
○ 신청방법
- 이지드럭(http://ezdrug.mfds.go.kr)접속 → 로그인(공인인증서 필요) → 민원서식 기 다운로드 및 설치 → 상단 민원신청 중 “전자민원안내 및 신청” → 의약품 등제조및품질관리기준실시상황평가(유형별GMP)신청(그림1) → 한약재제조및품 질관리기준실시상황평가신청(그림2)
그림 1. 전자민원안내 및 신청 시 민원사무명
그림 2. 한약재제조및품질관리기준실시상황평가신청
그림 3. 신청서 양식
□ 제출자료
○ 평가 대표품목에 대한 10종 서류 및 평가제품 목록
※ 제출자료 세부설명은 [붙임2-3] 구비서류 상세 요건 참고
□ 의약품 등의 안전에 관한 규칙 [별지 제4호 서식]
1. 제조소 평면도: 각 작업소, 시험실, 보관소 및 기타 제조공정에 필요한 부대시설이 표시된 제조소 평면도
2. 신청품목과 관련된 작업소 시설 관련 자료
가) 청정등급, 작업실 간의 차압 및 인적ㆍ물적 동선이 표시된 작업소 평면도 나) 제조ㆍ시험에 사용되는 기계ㆍ설비 내역 및 기계배치도
다) 공조시설, 압축공기 및 용수처리 계통도 (해당사항 있을 경우) 3. 신청품목과 관련된 시설 및 환경 관리 관련 자료
가) 제조용수 관리현황 (해당사항 있을 경우) 나) 자동화장치 등 관리현황 (해당사항 있을 경우) 다) 청정도 관리현황 (해당사항 있을 경우)
4. GMP 조직도 및 품질관리(보증)체계 관련 자료 5. 문서관리규정 및 문서 목록
6. 신청품목과 관련된 제품표준서 및 제조ㆍ품질관리기록서 사본
[붙임2-2] 한약재제조품목허가․신고 신청방법 및 제출자료
□ 민원신청 가. 개요
- 품목 허가 및 신고 대상을 구분하여 신청하며, 2품목 이상 신청 시 동시평가를 신청할 수 있음
- 공정서에 등재되지 않은 한약재의 경우 기준 및 시험방법 심사를 추가로 진행 하여야 함
- 기존업체 중 GMP 미인증 업체가 기허가(신고)품목에 대한 GMP평가와 신규품 목에 대한 품목허가(신고)를 동시에 준비하는 경우, 신규품목에 대한 품목허가 (신고) 신청과 함께 ‘한약재 제조 및 품질관리기준 실시상황 평가’를 중복하여 신청하지 않도록 주의(수수료 이중 납부 등)
○ 품목 신고 대상
- 「의약품 등의 안전에 관한 규칙」 제5조(제조판매․수입 품목의 신고) 제1항에 따 라 「대한민국약전」(KP) 의약품각조 제2부 1)생약 및 생약제제 또는 「대한민국 약전외한약(생약)규격집」(KHP) 의약품각조 제1부에 등재된 한약재(단, 국내에서 허가되지 아니한 품목은 제외)
- KP 또는 KHP에 등재되어 있지 않으나, ‘한약재’로 이미 허가된 품목
○ 품목 허가 대상
- 품목 신고 대상을 제외한 한약재
나. 품목신고대상 1) 공정서 등재품목
○ 신청부서 : 대전지방식품의약품안전청 의료제품안전과
○ 전자민원수수료
구분 전자민원사무명 품목 전자민원 수수료 (우편/방문) 1품목
신청시 한약재 품목신고 - GMP 신청품목 27,000원+207,000원 (30,000원+230,000원)
2품목 이상 신청시
한약재 품목신고 - GMP 대표품목 27,000원+207,000원
(30,000원+230,000원) 합산 한약재 품목신고 - GMP(동시평가) 대표품목 외 금액
동시신청품목
27,000원×품목수 (30,000원×품목수)
○ 신청방법
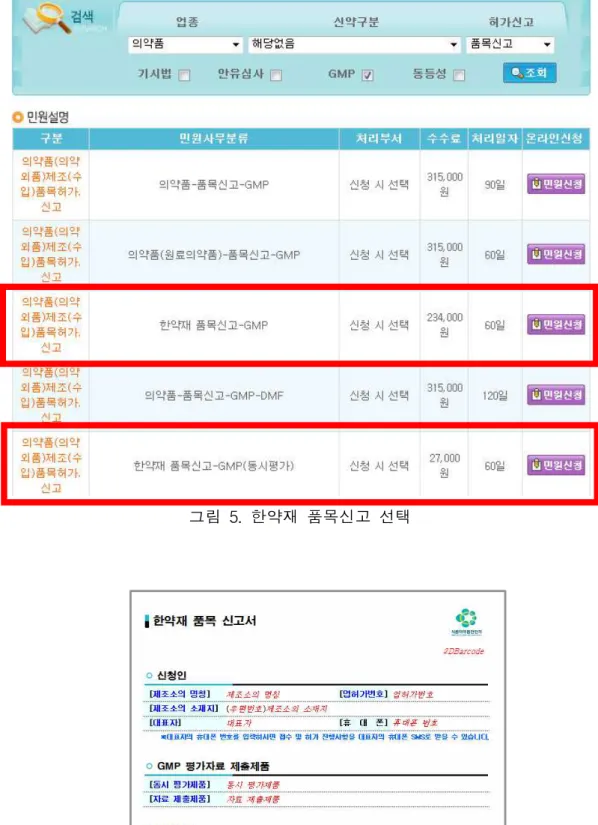
- 이지드럭(http://ezdrug.mfds.go.kr)접속 → 로그인(공인인증서 필요) → 민원서 식기 다운로드 및 설치 → 상단 민원신청 중 “전자민원안내 및 신청” → 의 약품(의약외품)제조(수입)품목허가.신고(그림4) → 검색창에 업종:의약품, 신약 구분:해당없음, 허가신고:품목신고 선택 및 "GMP" 체크 후 조회 → 한약재 품 목신고-GMP 또는 한약재 품목신고-GMP(동시평가)(그림5)
그림 4. 전자민원안내 및 신청 시 민원사무명
그림 5. 한약재 품목신고 선택
2) 공정서 미등재품목
○ 신청부서 : 대전지방식품의약품안전청 의료제품안전과
○ 전자민원수수료
구분 전자민원사무명 품목 전자민원 수수료
(우편/방문) 1품목
신청시 한약재 품목신고 - 기시, GMP 신청품목 333,000원+207,000원 (370,000원+230,000원)
2품목 이상 신청시
한약재 품목신고 - 기시, GMP 대표품목 333,000원+207,000원
(370,000원+230,000원) 합산 한약재 품목신고 - 기시, 금액
GMP(동시평가)
대표품목 외 동시신청품목
333,000원×품목수 (370,000원×품목수)
○ 신청방법
- 이지드럭(http://ezdrug.mfds.go.kr)접속 → 로그인(공인인증서 필요) → 민원서 식기 다운로드 및 설치 → 상단 민원신청 중 “전자민원안내 및 신청” → 의 약품(의약외품)제조(수입)품목허가.신고(그림4) → 검색창에 업종:의약품, 신약 구분:해당없음, 허가신고:품목신고 선택 및 "기시법", "GMP" 체크 후 조회 → 한약재 품목신고-기시-GMP 또는 한약재 품목신고-기시-GMP(동시평가)(그림7)
다. 품목허가대상
○ 신청부서 : 식품의약품안전평가원 생약제제과
○ 전자민원수수료
구분 전자민원사무명 품목 전자민원 수수료
(우편/방문) 1품목
신청시 한약재 품목허가 - 기시, GMP 신청품목 333,000원+207,000원 (370,000원+230,000원)
2품목 이상 신청시
한약재 품목허가 - 기시, GMP 대표품목 333,000원+207,000원
(370,000원+230,000원) 합산 한약재 품목허가 - 기시, 금액
GMP(동시평가)
대표품목 외 동시신청품목
333,000원×품목수 (370,000원×품목수)
○ 신청방법
- 이지드럭(http://ezdrug.mfds.go.kr)접속 → 로그인(공인인증서 필요) → 민원서 식기 다운로드 및 설치 → 상단 민원신청 중 “전자민원안내 및 신청” → 의 약품(의약외품)제조(수입)품목허가.신고(그림4) → 검색창에 업종:의약품, 신약 구분:해당없음, 허가신고:품목허가 선택 및 "기시법", "GMP" 체크 후 조회 → 한약재 품목허가-기시-GMP 또는 한약재 품목허가-기시-GMP(동시평가)(그림8)
※ 단, 신청서 양식은 ‘한약재 품목 신고서’ 양식으로 작성(그림6)
□ 제출자료
○ 1품목 신청시 또는 2품목 이상 신청시 대표품목인 경우 - 신청품목(대표품목) 10종* 서류 및 동시신청 품목 목록
※ ‘한약재 제조 및 품질관리기준 실시상황 평가’ 제출자료와 동일하며 세부설명 은 [붙임2-3] 구비서류 상세요건 참고
- 한약재 GMP 인증 업소의 경우 일부 자료 제출 생략가능
대 상 제출자료
1 가 나 다 가 나 다2 3 4 5 6 한약재 GMP
비인증 업소 ○
1)
○ ○ △ △ △ △ ○ ○ 1품목 3개 제조단위 이상
한약재 GMP 인증 업소 (제조소 동일)
기평가 품목과 제조공정, 설비
등이 다를 경우 × ○ ○ △ △ △ △ ○ × 3개 제조단위 이상 기평가 품목과
제조공정, 설비
등이 같을 경우2) × ○ ○ △ △ △ △ × × 1개 제조단위 이상 1)
“○”
:제출하여야 하는 자료“×”
:면제되는 자료“△”
:해당사항이 있을 경우 제출2) 상기 제출자료 대신 기 평가 품목과 제조공정(설비 등)이 동일함을 입증하는 자료(동일 공정의 기 평가 품목의 제품표준서 등) 및 한약재 GMP 평가받은 내용 등 근거 자료(변 경사항이 있는 경우 포함 변경 또는 추가사항에 대한 별도 제출)를 제출할 수 있다.
○ 2품목 이상 신청시 동시신청품목인 경우
- 신청서(필수) 외 GMP평가 관련 제출자료는 생략할 수 있음
[붙임2-3] 구비서류 상세 요건
1 개요
항 목 비 고
1. 제조소 평면도
: 각 작업소, 시험실, 보관소 및 기타 제조공정에 필요한 부대시설이 표시된 제조소 평면도
2. 신청품목과 관련된 작업소 시설 관련 자료
가) 청정등급, 작업실 간의 차압 및 인적ㆍ물적 동선이 표시된 작업소 평면도
나) 제조ㆍ시험에 사용되는 기계ㆍ설비 내역 및 기계배치도
다) 공조시설, 압축공기 및 용수처리 계통도 해당사항 있을 경우 제출 3. 신청품목과 관련된 시설 및 환경 관리 관련 자료
가) 제조용수 관리현황 해당사항 있을 경우 제출
나) 자동화장치 등 관리현황 해당사항 있을 경우 제출
다) 청정도 관리현황 해당사항 있을 경우 제출
4. GMP 조직도 및 품질관리(보증)체계 관련 자료 30쪽 참고 5. 문서관리규정 및 문서 목록
6. 신청품목과 관련된 제품표준서 및 제조ㆍ품질관리기록서 사본 1품목 3개 제조단위 이상 제출
2 평면도
1. 제조소 평면도
○ 각 작업소, 시험실, 보관소 및 기타 제조공정에 필요한 부대시설이 표시된 제조소 평 면도
- 각 작업소 : 작업실 명칭, 번호 등
- 시험실 : 이화학실험실 등(해당사항 있을 경우) - 보관소 : 방충,방서 시설 등
- 기타 제조공정에 필요한 부대시설 : 공조시설, 용수시설, 압축공기 등(해당사항 있을 경우)
<예시>
※
상기 자료는 예시로서 참고자료일 뿐이니 작업실 및 해당 설비·구조등은 자사의 제조 소에 맞게 설정하시면 됩니다.2-가) 청정등급, 작업실 간의 차압 및 인적ㆍ물적 동선이 표시된 작업소 평면도
○ 인동선(입실 및 퇴실 포함) 및 물동선(입고, 출고 및 폐기) 방향
<예시>
※ 상기 자료는 예시로서 참고자료일 뿐이니 작업실 및 해당 설비·구조등은 자사의 제조 소에 맞게 설정하시면 됩니다.
목록(관리번호, 기계명, 전용 사용여부 등) 및 배치도(평면도 상 해당 작업실 표시 또 는 이에 준하는 자료)
○ 신청 품목 시험(원료, 자재, 반제품 및 완제품 시험 등)에 사용되는 주요 설비에 대한 목록(관리번호, 기계명, 해당시험 항목) 및 배치도
<예시>
※ 상기 자료는 예시로서 참고자료일 뿐이니 작업실 및 해당 설비·구조등은 자사의 제조 소에 맞게 설정하시면 됩니다.
3 제조용수 관리현황(시설 및 환경 관리 관련 자료)
□
「의약품 등의 안전에 관한 규칙」 별표2 한약재 제조 및 품질관리기준에 따라 한 약재의 제조용수 및 세척용수는 상수- 상수는 대한민국약전에 정하는 ‘상수’ 기준에 적합하여야 하며(먹는물관리기준에 적합), 수도수 또는 지하수로서 음용수는 연 1회 이상 품질검사를 실시
4 GMP조직도 및 품질관리(보증)체계 관련 자료
○ 당해 제조소 GMP 조직도
제 조 관 리 자
제조부서책임자 품질부서책임자
제조공정관리 제조위생관리 보관관리
원료, 자재, 반제품 및 완제품
품질관리
제조관리자는 「약사법」 제36조(의약 품등의 제조관리자)에 따라 약사 또는 제조부서 및 품질부서를 총괄함
제조부서와 품질부서는 서로 독립되어 야 하며, 제조부서책임자와 품질부서 책임자는 겸직하여서는 아니됨
○ 최근 기 실사 이력에 관한 자료(해당 사항 있는 경우)
○ 변경관리 기준서 및 운영 실적(품목 관련 최근 2년)
○ 일탈(Deviation) 관리기준서 및 운영실적(품목 관련 최근 2년)
○ 기준일탈(Out of Specification) 관리기준서 및 운영실적(품목 관련 최근 2년)
○ 주요 원자재(주성분, 1차 포장자재) 제조업자 평가 기준 및 실적(품목 관련 최근 2년): 원생약 공급자에 대한 공급자평가 결과 보고서 포함
○ 원자재 제품관리(입고, 보관, 출고) 기준서: 원료공급처와 포장상태를 확인할 수 있는 자료(사진 등)
○ 연간품질평가 기준서 및 운영 실적(품목 관련 최근 1년)
○ 안정성시험 관련 계획서·기준서·시험결과(해당사항 있는 경우)
○ 제조·시험의 위·수탁에 관한 자료(해당 사항 있는 경우)
- 위·수탁 계약범위, 수탁업체 평가 자료 등 계약을 내용과 수탁업체 관리에 관한 사 항을 확인 할 수 있는 자료
○ 교육 및 훈련에 관한 기준서 및 연간 교육 계획서
○ 불만처리 및 제품회수 기준서와 운영 실적(품목 관련 최근 2년)
○ 반품 및 재포장 관련 기준서 및 운영 실적(해당 사항 있는 경우)
○ 보관소 관리(온․습도, 방충․방서 등) 기준서
○ 작업원 위생관리(갱의, 수세 등), 작업소 및 제조설비(청소, 소독, 작동) 기준서(품 목 관련)
5 제품표준서
□ 제품표준서는 품목의 제조 및 품질관리에 관한 전반적인 내용을 표준화한 문서로서 품목별로 작성
□ 품목허가(신고)의 내용(허가증 상 기재된 내용)과 일치하도록 작성하며 해당 제품에 대한 정보 및 다음 ‘가’부터 ‘타’까지 사항을 모두 포함해야 함
가. 제품명
나. 허가(신고) 연월일 및 허가(신고)사항 변경 연월일 다. 효능ㆍ효과, 용법ㆍ용량 및 사용상의 주의사항
<해설> ‘가’목부터 ‘다’목까지는 허가증에 기재된 내용과 동일하게 작성한다.
라. 기원(사용 부위 및 성상)
<해설> 대한민국약전(KP), 대한민국약전외한약(생약)규격집(KHP) 등에 수록된 기원 을 바탕으로 작성
마. 육안 또는 현미경 감별기준(사진자료 등 포함) 및 평가방법
<예시> 갈근
바. 품질규격 및 위해물질 기준
<해설> 허가증의 ‘기준 및 시험방법’ 항목과 동일하게 작성
사. 허가받은(신고한) 원료약품 및 그 분량, 제조단위당 기준량
<해설> 해당사항 없을 시 ‘사’항목 작성 생략 가능
아. 제조공정 흐름도, 상세한 공정별 제조방법 및 수율
<해설>
○ 제조공정 흐름도: 실제 제조공정과 일치하도록 작성
○ 초기 3개 시험생산을 통해 수율을 산출 수율= 이론생산량
실생산량
×
1) 이론생산량: 원료약품의 투입량으로부터 이론적으로 계산된 반제품 또는 완제품의 양 작업 중 장비 표면 손실이나 실수가 없이 이론적으로 정상 가동된 경우의 생산량으로서 대부분 제조지시된 양(제조단위, 목표생산량)을 그 값으로 함
2) 실생산량: 제조공정에서 실제로 얻은 양
※ 수율계산 실례
원료한약재 당귀 1200kg 입고 → 2014년 ○월 ○일 제조번호 DG2001(제조단위: 600kg) 설정하여 당귀 제조지시 → 선별 공정 후 당귀 무게 측정 결과 582kg → 당귀 자사포장 단위(600g)로 포장 중 일부 손실되어 개별포장 결과 968개 포장
1) 선별공정 수율= 입고된당귀수 선별후당귀수
× =
× =97%
2) 포장공정 수율= 선별후당귀 포장수 최종포장수
×=
× =
× =99.8%
3) 전체 수율= 입고된당귀 포장수 최종포장수
× =
× =
× =96.8%
<예시>
자. 작업 중 주의할 사항
차. 제조관리 및 품질관리에 필요한 시설 및 기기
<해설>
○ 제조관리 및 품질관리에 필요한 시설 및 기기는 제조소에 있는 모든 시설 및 기기 중 해당품목의 제조 및 품질관리에 필요한 기기를 의미하므로 불필요한 장비나 기구는 기재하지 않는다
○ 품질검사 등 위탁하는 경우 수탁처에 관련 자료를 받아 함께 첨부
카. 사용기한 타. 제조지시서
[붙임3] 한약재 GMP 서류 제출 점검표
한약재 GMP 서류 제출 점검표
신청사 (주) 품목명
민원접수일 '15.01.01. 부서접수일 '15.01.01. 민원배정일 '15.01.01. 검토담당자 홍길동 제조소 별 공정 제조사 [(주)○○제약, 충북 진천군 ○○면]
□ 자가 품질시험 ■ 시험위탁 [(주)○○제약, 충북 진천군 ○○면]
분류 ■ 한약재, □ 기타( )
실태조사 분류 ■ 서류평가 (실사일: '12.01.01.~03., 대전청실사과)
□ 실태조사 (2년 경과/시설변경, 실사일: '12.01.01.~03., 대전청실사과)
제출 서류 항목 제출 비고
1. 제조소 평면도 작업소, 시험실, 보관소
등의 제조소 평면도 ○✕
생략
2. 작업소 시설 자료 인적·물적 동선도 ○✕ 제조·시험설비
내역 ○✕ 제조·시험설비
배치도 ○✕
4. 품질(보증)체계 자료
GMP 조직도 ○✕
생략 교육·훈련 규정 ○✕
생략
보관소 관리(온습도, 방충)
○✕
생략
실사이력표 ○✕
생략 연간교육계획서 ○✕
생략 작업소(청소,소독,작동) ○✕
생략
일탈관리 ○✕
생략 불만처리 ○✕
생략 제조설비(청소,소독,작동) ○✕
생략
기준일탈관리 ○✕
생략 제품회수 ○✕
생략 품질관리협약서(시험위탁) ○✕
생략 공급자평가 규정 ○✕
생략 반품 및 재포장 규정 ○✕
생략 위수탁 계약서(시험위탁) ○✕
생략 공급자평가 실적 ○✕
생략 작업원 위생관리 ○✕
생략 제품관리(입출고,보관) ○✕
생략 5. 문서 자료 문서관리규정 ○✕
생략
문서목록 ○✕
생략
6. 제품표준서 및 제조·품질관리 기록서 사본
제품표준서 ○✕
제조·지시기록서
■ 최초 GMP 평가 시 3lot
○✕
□ 기평가 품목과
공정·설비 다를 경우 3lot
□ 기평가 품목과
공정·설비 같을 경우 1lot
품질관리기록서
■ 최초 GMP 평가 시 3lot
○✕
□ 기평가 품목과
공정·설비 다를 경우 3lot
□ 기평가 품목과
공정·설비 같을 경우 1lot 7. 추가 제출 자료
(해당하는 경우) 청정도, 작업실 간의 차압도, 공조·용수·압축공기 계통도, 시설 및 환경 관리자료(제조용수, 자동화장치, 청정도 관리현황)
[양식1] 실사일정 협의 공문
위대한 여정 새로운 도약
대전지방식품의약품안전청
수신 ○○제약 대표 ○○○귀하 (우○, 주소) (경유)
제목 한약재 제조 및 품질관리기준 실시상황 평가를 위한 실사일정협의[업체명-품목 명 등]
1. 귀하가 대전지방식품의약품안전청(의료제품실사과/의료제품안전과)/식품의약 품안전평가원(생약제제과)에 제출하신 다음의 「한약재 제조 및 품질관리기준」실시상 황 평가 신청 건/한약재 품목 허가/신고 건 관련입니다.
연번 평가품목 제조소명 및 소재지 접수번호 접수일자 비고
1 제품명 등
○○품목
- 업체명 - 주소
2. 한약재 제조 및 품질관리기준 실시상황의 적합 여부를 판정하기 위하여
「의약품 등의 안전에 관한 규칙」제48조제5호 및 [별표2] 제13호에 의한 현장실태조 사를 ○○년 ○월 ~ ○월 중에 실시할 계획입니다.
3. 현장 실태 조사에 앞서 해당 제조소와 일정 등을 사전 파악․협의하여 실사업 무에 적정을 기하고자 하니, 해당 제조소의 실사 가능 일정 3개 정도(월별 1개, 상기 기간 내 실사가 불가능한 경우 사유포함)를 대전청 의료제품실사과에 ○○. ○○. ○
○.까지 알려주시기 바랍니다. 끝.
대전지방식품의약품안전청장
주무관 (심사관)
의 료 제 품 실사과장
시행 의료제품실사과- 접수
[양식2] 실태조사 실시 알림 공문
위대한 여정 새로운 도약
대전지방식품의약품안전청
수신 ○○제약 대표 ○○○귀하 (우○, 주소) (경유)
제목 한약재 제조 및 품질관리기준 실시상황 평가를 위한 현장실태조사 알림[업체명-품 목명 등]
1. 귀 사가 대전지방식품의약품안전청(의료제품실사과/의료제품안전과)/식품의약품안 전평가원(생약제제과)에 제출하신 다음의 「한약재 제조 및 품질관리기준」실시상황 평가 신 청 건/한약재 품목 허가/신고 건 관련입니다.
연번 평가품목 제조소명 및 소재지 접수번호 접수일자 비고
1 제품명 등
○○품목
- 업체명 - 주소
2. 한약재 제조 및 품질관리기준 적합 여부에 대한 평가를 위하여 다음과 같이 현장 실태조사를 실시하고자 하오니 원활한 조사가 이루어질 수 있도록 협조하여 주시기 바랍니다.
가. 조사대상 및 소재지 - 업체명, 주소
나. 조사일자:
다. 조 사 자: ○○○, ○○○
(실사일정 등에 따라 담당자 변경가능) 라. 조사내용
- 의약품 등의 안전에 관한 규칙 제48조제5호 및 [별표2] 한약재 제조 및 품질 관리기준 적합 여부. 끝.
대전지방식품의약품안전청장
주무관 (심사관)
의 료 제 품 실사과장
시행 의료제품실사과- 접수
[양식3-1] 한약재 제조및품질관리기준(GMP) 민원처리기간 연장 통보 식·의약품종합정보서비스
대 전 지 방 식 품 의 약 품 안 전 청
수신자 ○○제약 대표 ○○○ 귀하(우○, 주소) (경유)
제목 한약재 제조및품질관리기준(GMP) 민원처리기간 연장 통보
[업체명-품 목명 등]귀하께서
○○.○○.○○.자 대전지방식품의약품안전청(의료제품실사과)에 제출한 ‘한약재 제조 및 품질관리기준 실시상황평가 신청(접수번호
○)’건 관 련하여, GMP 평가 관련 현장실태조사 일정을
○○.○○.○○.로 요청함에 따라,
“민원사무처리에 관한법률 시행령” 제17조에 의거 당초 처리기한
○○.○○.○○.
에서
○○.○○.○○.까지 처리기간이 연장되었음을 알려드립니다. 끝.
대 전 지 방 식 품 의 약 품 안 전 청 장
주무관
(심사관) 대전청
의료제품실사과장 전결
시행 대전청의료제품실사과- (결재일) 접수 접수번호 (접수일)
우 35209 대전광역시 서구 청사로 166 / http://daejeon.mfds.go.kr 전화 042-480- 전송 042-480-3841 / 0000@korea.kr / 비공개
[양식3-2] 협의기한 연장 협조 요청
식·의약품종합정보서비스
대 전 지 방 식 품 의 약 품 안 전 청
수신자 의료제품안전과장(또는 생약제제과장) (경유)
제목
협의기한 연장 협조 요청[업체명-품목명 등]1. 귀 과에서 우리 과에 협의 의뢰하신 의약품 제조판매 품목 " 품목명 "
허가신청/신고 (접수번호 ○)건 관련입니다.
2.『민원사무처리에관한법률 시행령』 제17조에 따라 아래와 같은 사 유로 품목별 사전 GMP 실시상황 평가의 완료기한을
○○.○○.○○.까지 연장하 고자 하오니, 민원인에게 처리기한 연장통보 등 필요한 조치를 하여 주시기 바랍 니다.
GMP 평가 완료기한 처리예정기한 연장 사유 비고
(당초) (예정)
신청 품목의 GMP 평가 관련 현장실태 조사 일정을 ○○년○○월○○일~○○
일 (공문: 의료제품실사과-호)로 요청함 에 따라 GMP 평가 기간의 추가 소요로 인함
끝.
의 료 제 품 실 사 과 장 (또는 대 전 지 방 식 품 의 약 품 안 전 청 장)
주무관
(심사관) 대전청
의료제품실사과장 (전결)
한약재 GMP 평가를 위한 현장실태조사서
○ 신청사 : ○○제약
○ 제품명 : ○○등 ○○품목 ○ 제조소명 및 소재지
- ○○제약, 주소
○ 실태조사자 : 대전식약청 의료제품실사과 ○○○ (서명)
○○○ (서명)
○ 확인자 : 제조관리자 ○○○ (서명) 제조부서책임자 ○○○ (서명) 품질부서책임자 ○○○ (서명)
○ 조사일 : ○ 확인일 :
이 문서는 실태조사자들이 조사기간 동안 본 것을 기록한 것으로 최종 조치에 관한 결정은 포함하고 있지 않다.
<지적(미비)사항>
가.
1.
2.
나.
1.
2.
다.
라.
동 실태조사와 관련하여 문의사항이 있는 경우, 아래의 주소 또는 전화번호로 연락 바랍 니다.
조사기관 : 대전지방식품의약품안전청 의료제품실사과
주소 : 대전광역시 서구 청사로 166 대전지방식품의약품안전청
[양식4] 현장실태조사서(Draft)
11-1. 조사내용(요약)
○ 실태조사 대상 요약
- ○○제약에서 신청한 “한약재 제조 및 품질관리기준 실시상황 평가신청” 관련, 1. 보고서 번호 : 2015-한약재-○○
2. 실사유형 : ☑기허가 업체 ☐품목허가 前 ☐정기실사 ☐품목변경신고 3. 대상업체 : ○○제약, 주소
4. 품목 및 제형 : ○○ 외 ○○품목 (총 ○○품목) 5. 제조소 수행작업 : 해당란에 ☑ 표시
제조
선별/포장 세척/건조/절단 포제
☑
□
□ QC Testing
자가 품질검사 품질검사 위탁
□
☑
기타 □
6. 실사기간 :
7. 조사관 : 소 속 성 명
대전청 의료제품실사과 ○○○, ○○○
8. 실사이력 : 없음
9. 실사목적 : 한약재 제조업체 GMP 실시상황 실태조사 10. 실사기간 접촉
주요인원 :
제조관리자 ○○○
제조부서책임자 ○○○
품질부서책임자 ○○○
11. 조사내용 결과 : 붙임 참조 [양식5] GMP실태조사 결과보고서
GMP실태조사 결과보고서
현장 실태조사 수행
- ○○을 평가대표품목으로 총 ○○품목에 대한 동시평가 실시
○ 평가 받을 품목 개요
- 제품명 : ○○ 등 ○○품목 - 효능·효과 :
- 제조방법 :
○ 조사결과 지적사항 요약
< 보완 사항(Observation) >
가. 제조소의 시설 및 환경관리와 관련하여 다음 사항을 보완하고 그 결과를 제출할 것 1.
<사유>
2.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 2.1 시설관리, 2.3 환경관리
나. 제품표준서, 기록문서와 관련하여 다음 사항을 보완하고 그 자료를 제출할 것 1.
<사유>
2.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 4.1 제품표준서
다. 시험관리와 관련된 다음 사항을 보완하고 그 증빙자료를 제출할 것 1.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 6.1 시험관리
11-2. 세부 조사내용
○ 제조소 연혁, 개요, 면적 및 특이사항 등 -
○ 제조소의 대표자, 제조관리책임자, 품질관리책임자 등 부서별 인력구성 현황 -
○ 제조소의 건물별 용도, 실사대상 품목과 관련된 건물명칭 등 -
○ 현재 동 제조소에서 제조되는 제형(제제), 품목수 등 -
□ 시설 및 장비관리
○ 제조소 개요 -
○ 보관소 관리 <원료보관실>
-
<완제품보관실>
-
<자재보관실>
-
<반품 및 부적합품 보관소>
-
<표본 및 보관검체>
- -
○ 작업소 관리 <선별실>
-
□ 제조 및 공정관리
점검 항목 결과
제품명
허가(신고)연월일 및 허가(신고)사항 변경 연월일 효능효과, 용법용량, 사용상의 주의사항
기원(사용 부위 및 성상)
육안 또는 현미경 감별기준(사진자료 등 포함) 및 평가방법
품질규격 및 위해물질 기준
허가받은(신고한) 원료약품 및 그 분량, 제조단 위당 기준량
제조공정 흐름도, 상세한 공정별 제조방법 및 수율
작업 중 주의할 사항
제조관리 및 품질관리에 필요한 시설 및 기기 사용기한
그 밖의 필요한 사항
다음 사항이 포함된 제조지시서 1) 제품표준서번호
2) 제품명
3) 제조번호, 제조 연월일 및 사용기한 4) 제조단위
5) 사용된 원료약품의 관리번호 및 시험번호, 허 가받은 원료약품의 분량 및 제조단위당 기준량
○ ○○ 등 보유품목 제품표준서 확인
- ○○제약의 기 신고 품목은 전체 ○○품목이며, 제품표준서를 확인하였음 -
○ 제조공정에 관한 규정 -
○ 제조시설 및 기구관리 규정 -
○ 제조위생관리
- 작업원 위생관리 규정, 작업소 위생관리 규정 및 방충방서 관리 규정 - 환경관리규정
-
○ 원자재 및 제품관리
- 원료약품 및 원료한약재 관리규정과 자재관리규정, 완제품 관리규정 -
○ 제조관리 및 제조기록서 확인
<품목명>
- 제품표준서:
6) 상세한 제조방법 및 작업 중 주의할 사항 7) 공정별 수율관리기준
8) 제조지시자 및 지시 연원일
- 규격:
-
<품목명>
- 제품표준서:
- 제조공정:
- 제조지시 및 기록서:
- 규격:
-
□ 시험관리
○ 품질검사 위·수탁 관리 규정 및 시험의뢰 및 통보에 관한 규정 -
○ 검체채취 규정 -
○ 시험결과 판정과 재시험에 관한 규정 -
○ 원료한약재 표본·완제품 보관검체 관리 규정 -
○ 시험지시 및 성적서
<품목명>
- 시험항목:
- 원료한약재 입고시험성적서:
- 완제품시험성적서:
<품목명>
- 시험항목:
- 원료한약재 입고시험성적서:
- 완제품시험성적서:
□ 문서 관리
-
○ 문서 관리 규정 -
□ 품질보증
○ 조직 및 직무규정 -
○ 기준일탈 및 부적합품 처리규정 -
○ 불만처리 및 제품회수 처리 규정 -
○ 자율점검 관리규정 -
□ 교육관리
○ 교육.훈련에 관한 규정 -
12. 종합의견
○ 조사관의 금번 실사에 대한 전반적 의견 -
○ 지적된 주요 사항에 대한 처리 의견 등
- 주요 보완사항은 업체 관계자에게 설명하고 확인하였으며, 보완완료 후 제출 된 조치결과를 검토하여 적합여부를 최종 판정하고자 함
- 권고사항은 구두로 의견 전달하였음
□ 실사품목 (○○품목)
(품목명)
주무관 (심사관)
의 료 제 품 실사과장 협조자 주무관
(심사관)
시행 의료제품실사과- 접수
[양식6] 한약재 제조 및 품질관리기준 현장실태조사 결과보고
위대한 여정 새로운 도약
대전지방식품의약품안전청
수신 내부결재 (경유)
제목 한약재 제조 및 품질관리기준 현장실태조사 결과보고[업체명]
[ 업체명 ]에서 ○○.○○.○○. 신청한 “한약재 제조 및 품질관리기준 실시 상황 평가” 건/한약재 품목 “○○” 허가/신고 건 (접수번호 ○)과 관련하여, 다음 과 같이 현장 실태조사를 실시하고 그 결과를 붙임과 같이 보고합니다.
가. 실태조사일:
나. 실태조사자: ○○○, ○○○
다. 제조소의 명칭 및 소재지 - 업체명, 주소
라. 실사결과 : 적합/보완 (상세 내용 보고서 참조)
붙임 : 한약재 GMP 실태조사 보고서(업체명
). 끝.
[양식7-1] 한약재 GMP 실시상황 평가 결과 통보 문서 양식(적합인 경우) 식·의약품종합정보서비스
대 전 지 방 식 품 의 약 품 안 전 청
수신자 ○○제약 대표 ○○○ 귀하(우○, 주소) (경유)
제목 한약재 제조및품질관리기준 실시상황 평가신청에 따른 판정결과 통 보[ 업체명-품목명 등 ]
1. 귀하가 ○○.○○.○○.자 대전지방식품의약품안전청(의료제품실사과) 에 제출하신 ‘한약재 제조 및 품질관리기준 실시상황 평가’ 신청 건(접수번호
○)과 관련하여,「의약품 등의 안전에 관한 규칙」[별표2] 제13호에 따라 평가 한 결과,
2.「의약품 등의 안전에 관한 규칙」제48조제5호 및 [별표2] 제13호에 의거한 한약재 제조 및 품질관리기준 실시상황이 적합함을 알려드립니다.
제조업소명
(대표자) 소재지 적합내용
업체명
(○○○) 주소 - 대표품목: ○○
* 적합품목(○○품목) 하단 참조
※ GMP 적합품목:
끝.
대 전 지 방 식 품 의 약 품 안 전 청 장
주무관
(심사관) 대전청
의료제품실사과장 전결
시행 대전청의료제품실사과- (결재일) 접수 접수번호 (접수일)
우 35209 대전광역시 서구 청사로 166번지 / http://www.mfds.go.kr/daejeon 전화 042-480- 전송 042-480-3841 / 0000@korea.kr / 비공개
대 전 지 방 식 품 의 약 품 안 전 청
[양식7-2] 한약재 GMP 실시상황 평가 결과 통보 문서 양식(보완자료 요구인 경우) 식·의약품종합정보서비스
수신자 ○○제약 대표 ○○○ 귀하(우○, 주소) (경유)
제목 한약재 제조및품질관리기준 실시상황 평가 결과 보완자료 요청[ 업 체명-품목명 등 ]
1. 귀하께서 ○○.○○.○○.자 대전지방식품의약품안전청(의료제품실사과)에 제 출하신 ‘한약재 제조 및 품질관리기준 실시상황 평가’ 신청 건(접수번호 ○) 관련하여,
「의약품 등의 안전에 관한 규칙」제48조제5호와 [별표2] 제13호에 따라 한약재 제조 및 품질관리기준(GMP) 실시상황을 평가한 결과,
2. 아래와 같이 미비사항이 확인되어 「민원사무처리에관한법률」제13조제1항 에 의거 다음 사항에 대하여 보완을 요청하니, ○○.○○.○○.까지 보완결과 및 입증 자료를 식품의약품안전처 홈페이지(ezdrug.mfds.go.kr) 또는 우리청 의료제품실사과에 제출하여 주시기 바랍니다.
가. 제조소의 시설 및 환경관리와 관련하여 다음 사항을 보완하고 그 결과를 제출할 것 1.
<사유>
2.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 2.1 시설관리, 2.3 환경관리
나. 제품표준서, 기록문서와 관련하여 다음 사항을 보완하고 그 자료를 제출할 것 1.
<사유>
2.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 4.1 제품표준서
주무관
(심사관) 대전청
의료제품실사과장 전결
다. 시험관리와 관련된 다음 사항을 보완하고 그 증빙자료를 제출할 것 1.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 6.1 시험관리
※ 보완사항 작성요령
- 식품의약품안전처에서 2013.9.16.자로 배포한 “「의약품 등 품목별 사전 GMP 평가」 관련 보완자료 제출 시 유의사항 및 처리방침 안내 협조요청 (문서번호: 의약품품질과-2418호)”에 따라 작성 및 제출할 것[동 문서는 식품의약품안전처홈페이지(www.mfds.go.kr) - 정보자료 - 분야별정보 - 의약품 - GMP 정보방에서 확인하실 수 있습니다]. 끝.
대 전 지 방 식 품 의 약 품 안 전 청 장
시행 대전청의료제품실사과- (결재일) 접수 접수번호 (접수일)
우 35209 대전광역시 서구 청사로 166번지 / http://www.mfds.go.kr/daejeon 전화 042-480- 전송 042-480-3841 / 0000@korea.kr / 비공개
[양식7-3] 품목별 사전 GMP 평가 결과 통보 문서 양식(적합인 경우) 식·의약품종합정보서비스
대 전 지 방 식 품 의 약 품 안 전 청
수신자 의료제품안전과장(또는 생약제제과장) (경유)
제목 품목별 사전 GMP 실시상황 평가 결과 회신[ 업체명-품목명 등 ] 1. [ 업체명 ]에서
○○.○○.○○.자 대전지방식품의약품안전청(의료제품안 전과)/식품의약품안전평가원(생약제제과) 에 제출한 한약재 제조판매 품목 " 품목 명 " 품목 허가/신고 건(접수번호
○)과 관련하여,「의약품 등의 안전에 관한 규 칙」[별표2] 제13호에 따라 GMP 실시상황을 평가한 결과,
2.「의약품 등의 안전에 관한 규칙」제4조제1항제6호 및 [별표2] 제13호에 의 거 동 품목의 의약품 제조 및 품질관리기준(GMP) 실시상황이 적합함을 회신합 니다.
연번 제품명 제조소 및 소재지 검토결과 비고
1 - 업체명
- 주소 적합 -
끝.
의 료 제 품 실 사 과 장 (또는 대 전 지 방 식 품 의 약 품 안 전 청 장)
주무관
(심사관) 대전청
의료제품실사과장 (전결)
시행 대전청의료제품실사과- (결재일) 접수 접수번호 (접수일)
우 35209 대전광역시 서구 청사로 166번지 / http://www.mfds.go.kr/daejeon
[양식7-4] 품목별 사전 GMP 평가 결과 통보 문서 양식(보완자료 요구인 경우) 식·의약품종합정보서비스
대 전 지 방 식 품 의 약 품 안 전 청
수신자 ○○제약 대표 ○○○ 귀하(우○, 주소) (경유)
제목 품목별 사전 GMP 실시상황 평가 결과 보완자료 요청[ 업체명-품목 명 등 ]
1. 귀하께서 ○○.○○.○○.자 우리청(의료제품안전과)/식품의약품안전평가원 (생약제제과)에 제출하신 한약재 품목 “품목명” 허가/신고 건(접수번호 ○) 관련하여,
「의약품 등의 안전에 관한 규칙」제4조제1항제6호와 [별표2] 제13호에 따라 한약재 제조 및 품질관리기준(GMP) 실시상황을 평가한 결과,
2. 아래와 같이 미비사항이 확인되어 「민원사무처리에관한법률」제13조제1항 에 의거 다음 사항에 대하여 보완을 요청하니, ○○.○○.○○.까지 보완결과 및 입증 자료를 식품의약품안전처 홈페이지(ezdrug.mfds.go.kr) 또는 우리청 의료제품실사과에 제출하여 주시기 바랍니다.
가. 제조소의 시설 및 환경관리와 관련하여 다음 사항을 보완하고 그 결과를 제출할 것 1.
<사유>
2.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 2.1 시설관리, 2.3 환경관리
나. 제품표준서, 기록문서와 관련하여 다음 사항을 보완하고 그 자료를 제출할 것 1.
<사유>
2.
다. 시험관리와 관련된 다음 사항을 보완하고 그 증빙자료를 제출할 것 1.
<사유>
※ 의약품 등의 안전에 관한 규칙[별표2] 6.1 시험관리
※ 보완사항 작성요령
- 식품의약품안전처에서 2013.9.16.자로 배포한 “「의약품 등 품목별 사전 GMP 평가」 관련 보완자료 제출 시 유의사항 및 처리방침 안내 협조요청 (문서번호: 의약품품질과-2418호)”에 따라 작성 및 제출할 것[동 문서는 식품의약품안전처홈페이지(www.mfds.go.kr) - 정보자료 - 분야별정보 - 의약품 - GMP 정보방에서 확인하실 수 있습니다]. 끝.
대 전 지 방 식 품 의 약 품 안 전 청 장
주무관
(심사관) 대전청
의료제품실사과장 전결
시행 대전청의료제품실사과- (결재일) 접수 접수번호 (접수일)
우 35209 대전광역시 서구 청사로 166번지 / http://www.mfds.go.kr/daejeon 전화 042-480- 전송 042-480-3841 / 0000@korea.kr / 비공개