86 책임저자:김현영
}660-758, 경남 진주시 칠암동 150번지 경남과학기술대학교 식품과학부 Tel: 055-751-3277, Fax: 055-751-3279 E-mail: hykim@gntech.ac.kr
조은주
}609-735, 부산시 금정구 장전동 산 30번지 부산대학교 식품영양학과 및 노인생활 환경연구소 Tel: 051-510-2837, Fax: 051-583-3648
E-mail: ejcho@pusan.ac.kr
접수일:2011년 3월 4일, 1차 수정일:2011년 3월 9일, 2차 수정일:2011년 3월 11일, 게재승인일:2011년 3월 15일
Correspondence to:Hyun-Young Kim
Department of Food Science, Gyeongnam National University of Science and Technology, 150, Chiram-dong, Jinju 660-758, Korea
Tel: +82-55-751-3277, Fax: +82-55-751-3279 E-mail: hykim@gntech.ac.kr
Co-Corresponding author:Eun Ju Cho
Department of Food Science and Nutrition & Research Institute of Ecology for the Elderly, Pusan National University, San 30, Jangjeon-dong, Geumjeong-gu, Busan 609-735, Korea
Tel: +82-51-510-2837, Fax: +82-51-583-3648 E-mail: ejcho@pusan.ac.kr
여주(
Momordica charantia
)의 산화적 스트레스 개선 효과1부산대학교 식품영양학과 및 노인생활환경연구소, 2중앙대학교 식물시스템과학과,
3경남과학기술대학교 식품과학부
신승미1ㆍ목소연2ㆍ이상현2ㆍ조계만3ㆍ조은주1ㆍ김현영3
Protective Effect of Bitter Melon (Momordica charantia) against Oxidative Stress
Seung Mi Sin1, So-Youn Mok2, Sanghyun Lee2, Kye Man Cho3, Eun Ju Cho1 and Hyun-Young Kim3
1Department of Food Science and Nutrition & Research Institute of Ecology for the Elderly, Pusan National University, Busan 609-735, 2Department of Integrative Plant Science, Chung-Ang University, Anseong 456-756,
3Department of Food Science, Gyeongnam National University of Science and Technology, Jinju 660-758, Korea
This study was focused on the evaluation of antioxidative effect of bitter melon (Momordica charantia L.). Bitter melon was extracted with methanol and then fractionated into 4 fractions (hexane, methylene chloride, ethyl acetate, and butanol fractions). The protective effect of bitter melon against oxidative stress was investigated under in vitro and cellular system. The extract and fractions from bitter melon exerted strong scavenging activity of 1,1-diphenyl-2-picrylhydrazyl and hydroxyl radical. Protective effects of bitter melon from nitric oxide (NO), and peroxynitrite under cellular oxidative stress model using LLC-PK1
cell were observed. The induction of oxidative stress by treatments of free radical generators led to the decrease in cell viability and elevation in NO formation. However, the treatment of fractions from bitter melon alleviated the oxidative stress by free radicals through increase in cell viability and inhibition in NO formation. The present study indicates that bitter melon alleviates oxidative stress and it plays as antioxidant. In particular, among the extract and fractions, the butanol fraction showed the highest protective effect from oxidative stress, suggesting that the butanol fraction from bitter melon includes the promising protective compounds from oxidative stress. (Cancer Prev Res 16, 86-92, 2011) Key Words: Bitter melon (Momordica charantia L.), DPPH, ㆍOH, Oxidative stress, LLC-PK1, 3-
Morpholinosydnonimine, Sodium nitroprusside
서 론
Peroxyl radical (ROOㆍ), hydroxyl radical (ㆍOH), super- oxide anion (O2−
) 등과 같은 반응성이 큰 reactive oxygen species (ROS)와 nitric oxide (NO), peroxynitrite (ONOO−)와 같은 reactive nitrogen species (RNS)는 생체 내에서의 만성 퇴행성 질환 및 노화의 원인물질로 알려져 있다.1,2) ROS 와 RNS는 환경적 요인이나 생활습관 또는 스트레스로 인해 유발되어지며 축적이 계속되면 세포 내의 환경조 건이 변화하게 됨으로써 지질산화 유도, 단백질의 산화 및 DNA 변성 등을 유발시켜 세포의 정상적인 기능을 억제시키고, 여러 가지 질병을 일으키는 것으로 알려져 있다.3∼5) 특히 ROOㆍ은 체내에서 과잉 생산되면 세포막 과 핵산의 주성분인 당질, 지질, 단백질 및 DNA와 같은 분자들을 과산화시키며, apoptosis와 같은 세포 손상을 초 래하게 된다. 또한 이에 의한 산화적 스트레스는 간 섬유 화, 신장염, 피부질환, 당뇨병 등의 여러 가지 질환의 원 인이 될 수 있으며, 특히, 노화, 염증, 발암, 동맥경화와 관련이 있는 것으로 알려져 있다.6∼9)
ROS와 RNS에 의한 손상을 개선시키기 위한 항산화 방어 시스템에는 superoxide dismutase (SOD), glutathione peroxidase, catalase 같은 생체 내의 활성산소 제거 효소에 의해 조절되는 항산화시스템10)과 주로 음식을 통해 섭취 하는 β-carotene, 비타민 C, 비타민 E 등의 비효소적인 항 산화 시스템이 존재한다.11,12) 최근 들어 산화적 스트레스 가 다양한 질환의 원인이 되고 있음이 밝혀져 이를 개선 시킬 수 있는 항산화제에 대한 연구가 다양하게 이루어 지고 있는데 특히 식품을 통해 섭취하는 천연 항산화제 가 유해성은 적으면서 효과적인 것으로 여겨지고 있 다.13,14)
여주(Momordica charantia L.)는 박과의 덩굴성 한해살이 풀로 아시아 열대산이며 어린 열매와 홍색 종피를 식용 으로 하고 종자를 약용으로 사용한다.15) 우리나라에서는 덩굴성 작물로 심어 주로 관상용으로 이용해 왔으나 중 국과 일본에서는 영양가가 높은 기호성 음료로서 또는 약용식물로서 외상 치료 및 궤양의 치료에 사용되고 있 으며,16) 인도네시아, 인도 및 동남아시아의 말레이시아, 필리핀, 대만 등지에서는 중요한 기능성 채소로 사용되 고 있다.17) 여주는 glucoside, saponin, alkaloid, oil, terpene, protein, 스테로이드계, 비타민 C, β-carotene, Fe, K 등을 함유한다.18) 미성숙과는 비타민 C, 비타민 A와 철 등의 주요한 공급원이 되고 있으며,19) 여주의 쓴맛에는 식물 스테롤 배당체들과 많은 종류의 amino acid, galacturonic
acid, citruline, pectin 등의 성분이 들어있다. 여주의 과실 과 종자에는 포도당의 연소를 돕고 포도당이 체내에서 재합성되지 않게 하는 식물성 인슐린과 인슐린을 분비 하는 췌장의 기능을 활발하게 하여 인슐린 분비를 촉진 함으로써 혈당을 낮춰주는 지용성 성분인 charantin이 있 다.20) 여주는 다양한 생리ㆍ약리적 효능을 지니고 있는 것으로 알려져 있으나 국내에서는 여주 추출물의 항균 및 항암 효과에 관한 연구21)와 항당뇨 효과에 관한 연구
22)만 있을 뿐, 산화적 스트레스 개선 효과에 대한 연구는 거의 전무한 실정이다. 이에 본 연구에서는 여주의 추출 물과 분획물을 이용하여 free radical에 의한 산화적 스트 레스 개선효과를 in vitro 라디칼 소거능과 LLC-PK1 renal epithelial cell을 이용하여 검토하였다.
재료 및 방법 1. 시약
LLC-PK1 pocrine renal epithelical cell은 ATCC (Solon, Ohio, USA)에서 분양받았고, 세포배양을 위한 Dulbecco’s modi- fied Eagle medium (DMEM)과 fetal bovine serum (FBS)는 Invitrogen Co. (Grand Island, NY, USA)에서 구입하여 사용 하였다. 산화적 스트레스를 유도하기 위해 사용한 so- dium nitroprusside (SNP)는 Wako (Tokyo, Japan)사 제품을, 3-morpholinosydononimine (SIN-1), 3-(4,5-dimethyl-2-thia- zolyl)-2,5-diphenyl-2H tetrazolium (MTT)는 Sigma chemical co. (St Louis, Mo, USA) 제품을 사용하였다.
2. 시료의 제조
본 실험에 사용한 여주(Momordica charantia L.)는 2010년 에 경상남도 함양군에서 생산된 것을 함양군 영농조합 법인으로부터 공급받아 동결건조한 다음, 분말화하여
−80oC의 냉동고에 보관하여 사용하였다. 동결 건조시킨 여주(1 kg)를 7,000 ml의 methanol (MeOH)로 12시간 동안 3회 반복하여 추출하여 얻어진 추출물을 모은 후, 회전 식 진공농축기를 이용하여 농축하여 MeOH 추출물 (305.5 g)을 얻었다. 농축한 MeOH 추출물을 물에 현탁시 킨 후 hexane으로 추출하여 hexane (10.3 g)분획을 얻고 남 은 수층을 methylene chloride (MC)로 추출하여 MC (9.5 g) 분획을 얻었다. 또한, 남은 수층을 ethyl acetate (EtOAc)로 추출하여 EtOAc (5.4 g)분획을 얻고 butanol (BuOH)로 추 출하여 BuOH (9.2 g) 분획을 각각 얻었다.
Table 1. IC50 values of DPPH radicals of the extract and fractions from bitter melon
Fractions IC50 (μg/ml)
MeOH 199.78±1.27b
Hexane 354.62±1.57a
MC 181.63±0.84c
EtOAC 68.40±1.31e
BuOH 143.58±3.88d
Ascorbic acid 1.96±0.00f
Values are mean±SD.
a∼fMeans with the different letters are significantly different (p
<0.05) by Duncan's multiple range test.
Ascorbic acid is positive control.
3. 1,1-Diphenyl-2-picrylhydrazy (DPPH) 라디칼 소거능 측정
Ethanol에 녹인 각 농도별 시료 100 μl와 60 μM DPPH 100 μl를 96-well plate에 주입하여 혼합한 다음 20분간 실온에 방치한 후, 540 nm에서 흡광도를 측정하였다. 시 료를 첨가하지 않은 대조군과 비교하여 라디칼의 소거 효과를 백분율(%)과 IC50으로 나타내었다. 대조약물로는 ascorbic acid를 이용하였다.23)
4. Hydroxyl radical (·OH) 소거능
Fenton 반응에 따라 10 mM FeSO4ㆍ7H20-EDTA에 10 mM의 2-deoxyribose solution과 농도에 따른 sample solution 을 혼합한 다음, 10 mM의 hydrogen peroxide (H2O2)를 첨 가하여 37oC에서 4시간 동안 배양한 후 이 혼합액에 2.8% trichlroacetic acid와 1.0% thiobarbituric acid solution을 각각 첨가한 후 10분간 boiling한 후 cooling하여 520 nm에 서 흡광도를 측정하였다. 대조약물로는 ascorbic acid를 이 용하였다.24)
5. 세포 배양
LLC-PK1 cell은 100 units/ml의 penicilin-streptomycin과 5%의 FBS가 함유된 DMEM을 이용하여 37oC, 5% CO2 in- cubator에서 배양하였다. 배양된 세포는 일주일에 2~3회 refeeding하고 배양 6∼7일경 phosphate buffered saline (FBS) 으로 1차 세척한 후 0.05% trypsin-0.02% EDTA로 부착된 세포를 분리한 후 원심분리해서 집적된 세포를 배지에 넣고 피펫으로 세포가 골고루 분산되도록 잘 혼합하여 6∼7일마다 계대 배양하면서 실험에 사용하였다. 계대 배양 시 각각의 passage number를 기록하여 passage num- ber가 10회 이상일 때는 새로운 세포를 배양하여 실험하 였다.
6. Cell viability 측정
세포가 confluence 상태가 되면 96-well plate에 well당 1×104 cells/ml로 seeding하여 2시간 배양한 후 산화적 스 트레스를 유발하기 위하여 ONOO−, NO의 generator인 SNP (500 μM) 및 SIN-1 (500 μM)을 첨가하여 24시간 배양하였다. 산화적 스트레스 유발 후, 시료를 농도별로 처리하여 24시간 배양한 뒤 5 mg/ml의 MTT solution을 각 well에 주입하여 37oC에서 4시간 동안 재배양한 후 생성 된 formazan 결정을 dimethyl sulfoxide (DMSO)에 녹여 540 nm에서 흡광도를 측정하였다.25)
7. NO 생성 억제 측정
NO 측정은 LLC-PK1 cell을 24-well plate에 well당 1×105 cells/ml로 seeding하여 2시간 배양한 후 SNP 및 SIN-1과 시료를 농도별로 반응시켜, 24시간 동안 37oC에서 산화 시켰다. 이 혼합액을 모아 96-well plate에 넣고 150 μM 의 Griess reagent를 첨가하여 실온에서 10분간 배양한 후 540 nm에서 흡광도를 측정하였다.26∼28)
8. 통계분석
대조군과 각 시료들로부터 얻은 실험 결과들은 평균±
표준편차로 나타내었고, 각 실험 결과로부터 ANOVA (analysis of variance)를 구한 후 Duncan’s multiple test를 이 용하여 각 군의 평균 간의 유의성을 검정하였다.
결과 및 고찰
본 연구에서는 여주 추출물과 분획물을 이용하여 산 화적 스트레스 유도 세포 모델에서 항산화 효과를 검토 하였다. DPPH radical은 시료의 free radical 소거 능력이나 수소 공여능력을 평가하는 방법으로서 안정적이고 간단 하며, 재현성이 높아 널리 사용되는 radical 소거능 측정 방법으로 알려져 있다.23,29) 이에 여주 추출물과 분획물의 DPPH 소거효과를 IC50로 비교해 본 결과 BuOH 분획물 은 143.58 μg/ml, EtOAc 분획물 68.40 μg/ml, hexane 분 획물 354.62 μg/ml, MC 분획물 181.63 μg/ml, MeOH 분 획물 199.78 μg/ml로 천연 항산화제인 ascorbic acid (1.96 μg/ml)와 비교해 볼 때 MeOH의 DPPH radical 소거효과 가 뛰어난 것으로 나타났다(Table 1, Fig. 1). ㆍOH 라디칼 은 활성산소종으로 ROS 중에서 가장 독성이 강하고 반 응성이 높으며 지질산화와 많은 생리적 손상을 일으켜
Fig. 1. DPPH scavenging activity of the extract and fractions from bitter melon. Values are mean±SD. a∼oMeans with the different letters are significantly different (p<0.05) by Duncan's multiple range test. Ascorbic acid is positive control.
Table 2. Protective effect of the extract and fractions from bitter melon against LLC-PK1 cells treated with SNP
Treatment (500 μg/ml) Cell viability (%)
Normal 100.0±10.46
Control 52.49±1.92bc
MeOH fraction 45.40±5.85c
Hexane fraction 99.48±10.34a
MC fraction 31.21±2.72d
EtOAc fraction 58.66±4.55b
BuOH fraction 58.57±3.89b
Values are mean±SD.
a∼dMeans with the different letters are significantly different (p
<0.05) by Duncan's multiple range test.
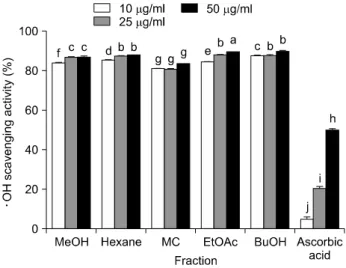
Fig. 2. Hydroxyl radical (ㆍOH) scavenging activity of the extract and fractions from bitter melon. Values are mean±SD.
a∼jMeans with the different letters are significantly different (p
<0.05) by Duncan's multiple range test. Ascorbic acid is positive control.
많은 질병의 원인이 된다.30,31) 또한 OH는 OH−와 H2O2
로부터 Fenton 반응에 의해 생성되며, 활성산소종인 ONOO−의 분해에 의해 생성된다.24) 여주 추출물과 분획 물의 ㆍOH에 대한 소거능을 측정해 보았다. 그 결과, Fig.
2에서 보는 바와 같이 여주의 추출물과 분획물의 ㆍOH 에 대한 소거효과가 농도의존적으로 증가함을 알 수 있 었다. 또한 10, 25, 50 μg/ml의 농도에서 모두 80% 이상 으로 ㆍOH에 대한 소거 효과가 높은 것으로 알 수 있으 며, 50 μg/ml의 농도에서 여주 추출물과 ascorbic acid를
비교해 보았을 때도 여주 추출물의 경우 80% 이상의 ㆍOH 에 대한 소거능을 보였지만 ascorbic acid는 50%에 그쳐 여주의 추출물이 ㆍOH 라디칼에 대한 소거능이 뛰어남 을 확인할 수 있었다.
LLC-PK1 cell을 포함한 renal proximal tubule cell은 free radicals에 매우 민감한 세포로 잘 알려져 있다. LLC-PK1
신장 상피 세포는 네프론에서 유도된 MDCK cell보다 산 화적 스트레스에 더 민감하며, 산화제에 의한 sodium-de- pendent glucose와 phosphate transport의 간섭으로 인해 ion gradient를 붕괴시키고 이로 인해 ATP 결핍과 Na+-K+- ATPase의 불활성화를 유도하며 세포 손상을 초래하게 된다.32) 따라서 LLC-PK1 cell에 free radical을 처리하여 산 화적 손상을 일으킨 후 이에 대한 개선 효과를 살펴봄으 로써 세포 손상에 보호 효과를 나타내는 물질을 확인하 는데 유용한 모델이 될 수 있다.33)
Table 2은 LLC-PK1 cell에 SNP를 처리하여 NO에 의한 산화적 스트레스를 유발 시킨 후 세포 생존율에 미치는 효과를 검토한 결과이다. NO는 생체 내에서 L-arginine이 nitric oxide synthase의 작용으로 인해 citrulline과 함께 생 성된다. 생체 내에서 과량으로 생성된 NO는 생체 방어 와 활성산소에 의해 유발된 조직 손상에 기여한다. NO 에 의해 유발된 산화제들은 Mn, SOD, ascorbate, gluta- thione과 urate 등과 같은 항산화 방어 기전을 소모시킬 수 있으며 주요한 지질과 단백질을 구조적으로 변화시 킬 수 있다.34,35) NO를 유발시키는데 이용되는 SNP만을 처리한 control군은 세포 생존율이 52.49%로 감소하여 산 화적 스트레스에 의한 세포 손상을 확인할 수 있었고, 반면 여주 추출물과 분획물을 처리하였을 경우, BuOH의 분획물은 58.57%, EtOAc 분획물 58.66%, hexane 분획물 99.48%, MC 분획물 31.21%, MeOH 45.40%로 나타나 BuOH, EtOAc, hexane 분획물에서 NO에 의한 산화적 스
Table 3. NO scavenging activity of the extract and fractions from bitter melon treated with SNP in LLC-PK1 cell
Treatment (500 μg/ml) NO formation (%)
Normal 42.78±1.19e
Control 100.00±2.20
MeOH fraction 110.42±1.19c
Hexane fraction 130.16±1.04a
MC fraction 121.57±1.29b
EtOAc fraction 87.93±0.76d
BuOH fraction 87.39±0.50d
Values are mean±SD.
a∼eMeans with the different letters are significantly different (p
<0.05) by Duncan's multiple range test.
Table 4. Protective effect of the extract and fractions from bitter melon against LLC-PK1 cells treated with SIN-1
Treatment (500 μg/ml) Cell viability (%)
Normal 100.00±2.99
Control 48.12±1.41d
MeOH fraction 73.29±0.80b
Hexane fraction 35.91±1.02e
MC fraction 5.37±0.12f
EtOAc fraction 61.99±6.86c
BuOH fraction 86.20±2.53a
Values are mean±SD.
a∼fMeans with the different letters are significantly different (p
<0.05) by Duncan's multiple range test.
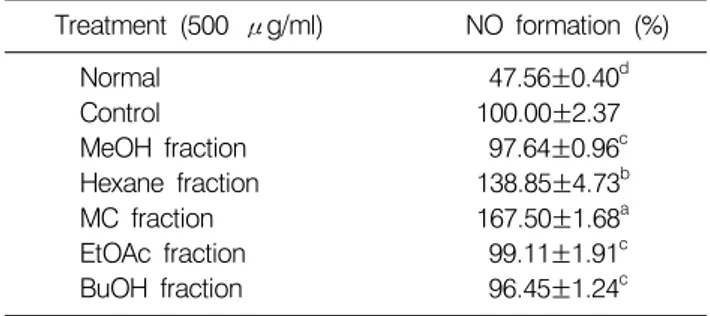
Table 5. NO scavenging activity of the extract and fractions from bitter melon treated with SIN-1 in LLC-PK1 cell
Treatment (500 μg/ml) NO formation (%)
Normal 47.56±0.40d
Control 100.00±2.37
MeOH fraction 97.64±0.96c
Hexane fraction 138.85±4.73b
MC fraction 167.50±1.68a
EtOAc fraction 99.11±1.91c
BuOH fraction 96.45±1.24c
Values are mean±SD.
a∼dMeans with the different letters are significantly different (p<0.05) by Duncan's multiple range test.
트레스를 개선하여 세포의 생존율을 증가시킴을 확인할 수 있었다(Table 2). Table 3에서는 LLC-PK1 cell에 SNP를 처리하여 활성산소종의 일종인 NO에 대한 효과를 검토 하였다. SNP만을 투여한 군에 비해 BuOH 분획물 87.39%, EtOAc 분획물 87.93%로 NO의 생성량이 감소함 을 알 수 있었다. 따라서 여주의 분획물 중 BuOH, EtOAc 분획물은 우수한 NO생성 억제 효과를 나타냄을 확인할 수 있었다.
ONOO−는 생체 내에서 NO와 O2−
의 반응에 의해 생 성될 수 있으며, 이는 세포 내 표적물과 반응해서 산화 및 질화를 유도하고 세포 신호전달체계의 혼란을 야기 하며, 지질, 단백질, DNA의 손상을 일으키므로 관절염, 동맥경화, 피부 염증 등 여러 질환과 관련되는 것으로 보고되고 있다.36,37) SIN-1은 NO와 O2−
를 생성하고 이들 은 급속히 반응하여 ONOO−를 형성하며, 이는 강력한 cytotoxic oxidant로 분해되기 때문에 독성 효과를 나타내 게 된다. ONOO−의 독성에 대해 LLC-PK1 cell의 세포 생 존율을 살펴본 결과(Table 4), SIN-1만을 처리하여 산화적
스트레스를 받은 control군은 48.12%의 생존율을 나타냈 으나 SIN-1을 처리한 후 여주 추출물과 분획물의 시료 처리군의 경우 생존율이 증가함을 알 수 있었다. 특히 BuOH 분획물 86.20%, EtOAc 분획물 61.99%, MeOH 분 획물 73.29%으로 나타나 ONOO−에 대한 직접적인 소거 능을 통해 산화적 스트레스 개선 효과를 보이는 것으로 사료된다. 활성산소의 일종인 NO에 대한 여주의 생성 억제 효과를 알아보기 위해 LLC-PK1 cell에 SIN-1을 처리 하여 NO를 생성시키고 이에 대한 효과를 확인하였다.
그 결과, SIN-1만을 처리한 control군에 비해 여주의 분획 물을 처리했을 때 BuOH, EtOAc, MeOH의 분획물에서 NO생성 억제효과를 확인 할 수 있었다(Table 5).
이상, 여주의 추출물과 분획물을 이용하여 DPPH radi- cal와 ㆍOH 라디칼 소거능을 측정한 결과, 여주의 추출 물과 분획물 모두 높은 항산화능을 나타내는 것을 확인 할 수 있었다. 또한 LLC-PK1 돼지 신장 상피세포에서 free radical에 의한 산화적 스트레스 개선 효과를 살펴본 결과 여주 추출물과 분획물에서 우수한 free radical 소거능을 확인하였다. 특히 SNP을 처리한 경우 hexane 분획물에서 우수한 소거능을 보였으며 SIN-1을 처리한 경우 BuOH 분획물의 free radical 소거능이 뛰어났다.
감사의 글
이 논문은 2010년도 정부(교육과학기술부)의 재원으 로 한국연구재단의 기초연구사업 지원을 받아 수행된 것임(2010-0005480).
참 고 문 헌
1) Oberley TD, Schultz JL, Li N, Oberley LW. Antioxidant
enzyme levels as a function of growth state in cell culture.
Free Radic Biol Med 19, 53-65, 1995.
2) Stratton SP, Liebler DC. Determination of singlet oxygen- specific versus radical-mediated lipid peroxidation in photo- sensitized oxidation of lipid bilayers: effect of beta- carotene and alpha-tocopherol. Biochemistry 36, 12911-12920, 1997.
3) Schneider JE, Price S, Maidt L, Gutteridge JM, Floyd RA.
Methylene blue plus light mediates 8-hydroxy-2'-deoxy- guanosine formation in DNA preferentially over strand breakage. Nucleic Acids Res 18, 631-635, 1990.
4) Rice-Evans C, Burdon R. Free radical-lipid interaction and their pathological consequences. Prog Lipid Res 32, 71-110, 1993.
5) Wright AW, Bubb A, Hawkins CL, Davies MJ. Singlet oxygen-mediated protein oxidation: evidence for the formation of reactive side chain peroxides on tyrosine residues. Photochem Photobilo 76, 35-46, 2002.
6) Rush GF, Gorski JP, Ripple MG, Sowinski J, Bugelski P, Hewitt WR. Organic hydroperoxide-induced lipid peroxi- dation and cell death in isolated hepatocytes. Toxicol Appl Pharmacol 78, 473-483, 1985.
7) Altman SA, Zastawny TH, Randers L, Lin Z, Lumpkin JA, Remacle J, Dizdaroglu M, Rao G. tert-Butyl hydroperoxide- mediated DNA base damage in cultured mediated DNA base damage in cultured mammalian cells. Mutat Res 306, 35-44, 1994.
8) Bauer G. Reactive oxygen and nitrogen species: efficient, selective and interactive signals during intercellular induction of apoptosis. Anticancer Res 20, 4115-4139, 2000.
9) Brune B, Zhou J, Von KA. Nitric oxide, oxidative stress and apoptosis. Kidney Int Suppl 84, 22-24, 2003.
10) Andersen HR, Nielsen JB, Nielsen F, Grandjean P.
Antioxidative enzyme activities in human erythrocytes. Clin Chem 43, 562-568, 1997.
11) Nuttall SL, Kendall MJ, Martin U. Antioxidant therapy for the prevention of cardiovascular disease. QJM 92, 239-244, 1999.
12) Peng J, Jones GL, Watson K. Stress proteins as biomakers of oxidative stress: effects of antioxidant supplements. Free Radic Biol Med 28, 1598-1606, 2000.
13) Kuhn M. Oxygen free radicals and antioxidants. Am J Nutr 103, 58-62, 2003.
14) Warnholtz A, Munzel T. Why do antioxidants fail to provide clinical benefit? Curr Control Trials Cardiovasc Med 1, 38-40, 2000.
15) Raman A, Lau C. Anti-diabetic properties and phytochemistry Momordica charantia L. (Cucurbitaceae). Phytomedicine 2, 349- 362, 1996.
16) Gürbüz I, Akyüz C, Yesilada E, Sener B. Anti-ulcerogenic effect of Momordica charantia L. fruits on various ulcer models in rats. J Ethnopharmacol 71, 77-82, 2000.
17) Girón LM, Freire V, Alonzo A, Cáceres A. Ethnobotanical survey of the medicinal flora used by the Caribs of Guatemala.
J Ethnopharmacol 34, 173-187, 1991.
18) Oyedapo OO, Araba BG. Stimulation of protein biosynthesis in rat hepatocytes by extracts of Momordica charantia. Research Article 15, 95-98, 2001.
19) Grover JK, Yadav SP. Pharmacological actions and potential uses of Momordica charantia: a review. J Ethnopharmacol 93, 123-132, 2004.
20) Schmourloa G, Mendonça-Filhob RR, Alvianob CS, Costa SS.
Screening of antifungal agents using ethanol precipitation and bioautography of medicinal and food plants. J Ethnopharmacol 96, 563-568, 2005.
21) Bourinbaiar AS, Lee-Huang S. Acrosin inhibitor, 4'- aceta- midophenyl 4-guanidinobenzoate, and experimental vaginal contraceptive with anti-HIV activity. Contraception 51, 319- 322, 1995.
22) Jeong JH, Lee SH, Hue JJ, Lee KN, Nam SY, Yun YW, Jeong SW, Lee YH, Lee BJ. Effect of bitter melon (Momordica Charantia) on anti-diabetic activity in C57BLI6J db/db mice.
Korean Soc Vet Sei 48, 327-336, 2008.
23) Hatano T, Edamatsu R, Hiramatsu M, Mori A, Fujita Y, Yasuhara T, Yoshida T, Okuda T. Effects of the interaction of tannins with co-existing substances, Ⅵ. Effects of tannins and related polyphenols on superoxide anion radical, and on 1,1-diphenyl-2-picrylhydrazyl radical. Chem Pharm Bull 37, 2016-2021, 1989.
24) Chung SK, Osawa T, Kawakishi S. Hydroxyl radical- scavenging effects of spices and scavengers from brown mustard (Brassica nigra). J Biosci Biotech Biochem 61, 118-123, 1997.
25) Mosmann T. Rapid colormetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Innunol Meth 65, 55-63, 1983.
26) Rockett KA, Awburn MM, Cowden WB, Clerk IA. Killng of Plasmodium faciparum in vitro by nitric oxide derivatives.
Infect Immun 59, 3280-3283, 1991.
27) Murakami A, Gao G, Kim OK, Omura M, Yano M, Ito C, Furukawa H, Jiwjinda S, Koshimizu K, Ohigash H.
Idenification of coumarins from the fruit of Citrus hystrix DC as inhibitors of nitric oxide generation in mousemacrophage Raw 264.7 cells. J Agric Food Chem 47, 333-339, 1999.
28) Choi SP, Kang MY, Nam SH. Inhibitory activity of the extracts from the pigmented rice brans on inflammatory reactions. J Korean Soc Appl Biol Chem 47, 222-227, 2004.
29) Koleva II, Van Beek TA, Linssen JPH, de Groot A, Evestatieva LN. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phyto- chem Anal 13, 8-17, 2002.
30) Aurand LW, Boonme NH, Gidding GG. Superoxide and singlet oxygen in milk lipid peroxidation. J Dairy Sci 60, 363-369, 1977.
31) Ahsan H, Ali A, Ali R. Oxygen free radicals and systemic autoimmunity. Clin Exp Immunol 131, 398-404, 2003.
32) Andreoli SP, McAteer JA, Seifert SA, Kempson SA.
Oxidant-induced alterations in glucose and phosphate transport in LLC-PK1 cells: mechanisms of injury. Am J Physiol 265, F377-F384, 1993.
33) Yokozawa T, Satoh A, Cho EJ, Kashiwada Y, Ikeshiro Y.
Protective role of coptidis rhizoma alkaloids against peroxynitrite-induced damage to renal tubular epithelial cells.
J Pharm Pharmacol 57, 367-374, 2005.
34) Cui FJ, Li TZ, Lee SJ, Park SJ, Lim Y, Kim KA, Chang BJ, Lee JH, Lee MH, Choe NH. The effects of air-borne particulate matters on the alveolar macrophages for the iNOS expression and nitric oxide with nitrotyrosilated-proteins
formation. Tuberc Respir Dis 60, 426-436, 2006.
35) Kim YM, Lee BR, Hong KE. Antioxidative effects of electro- acupuncture at KI6 on rats treated with AAPH. JKAMS 25, 107-120, 2008.
36) Radi R, Beckman JS, Bush KM, Freeman BA. Peroxynitrite- induced membrane lipid peroxidation: the cytotoxic potential of superoxide and nitric oxide. Arch Biochem Biophys 288, 481-487, 1991.
37) Haenen GR, Paquay JBG, Korthouwer REM, Bast A. Peroxy- nitrite scavenging by flavonoids. Biochem Biophy Res Commun 236, 591-596, 1997.