인유두종 바이러스 아형 검출용 HPV DNA chip 검사의 정도관리 운영 경험
강태희․강지민
가톨릭대학교 의과대학 성가병원 진단검사의학과
Operational Experience of a Quality Assurance System for HPV DNA Chip Tests
Tae-Hee Kang and Jimin Kahng
Department of Laboratory Medicine, Catholic University Holy Family Hospital, Bucheon, Korea
Background: A new HPV DNA chip test for the infection of 22 HPV genotypes was recently developed in Korea. This test using PCR and hybridization is inherently vulnerable to contamination, and to subjective qualitative test judgment. Hence, it warrants rigorous quality assurance measures. The authors would like to share operational experiences of the guidelines developed at Catholic University Holy Family Hospital.
Methods: Our quality assurance system of HPV DNA chip test comprised external quality controls, inter-laboratory proficiency tests, and internal quality controls. For the external quality controls, we analyzed the results of four years of participation in the quality assurance program by the Korean Laboratory Medicine Quality Assurance Association. The inter-laboratory proficiency tests with BioMedLab were done by single blind tests using patients’ samples showing negative, single and multiple infections. The internal quality control dealt with methods to prevent contamination, and with reproduction tests.
Results: The results from the external quality control revealed consistency with HPV-16 in 7 trials during 4 years. The inter-laboratory proficiency tests showed a 82% consistency rate, 10 cases of inconsistency showing positive or negative mismatches, and 8 cases of genotypic mismatches. The 10 mismatches were due to the weak laser power of the scanner used in BioMedLab. The genotypic contamination rate found in the internal quality control was 3.3%, and the contamination by HPV-35 with low incidence rate was often observed. The contamination was not easily eliminated by re-tests from hybridization, but 80% of it was removed when re-tested with the remaining samples. The fluorescence intensity was not reproducible nor provide quantitative or semi-quantitative information.
Conclusions: For quality assurance regarding HPV DNA chip tests, we suggest the following be implemented: technical quality control to rule out the false-negative and false-positive during PCR and hybridization; scanner quality control to prevent reading errors; and inter-laboratory proficiency tests.
Key Words:HPV DNA chip test, Quality assurance system, Proficiency tests
교신저자:강지민
우) 420-717 경기도 부천시 원미구 소사동 2번지 가톨릭대학교 성가병원 진단검사의학과
전화:032)340-2208, FAX:032)340-2219 E-mail:jmkahng@catholic.ac.kr
서 론
인유두종 바이러스(Human Papillomavirus, HPV) 감
염이 자궁경부 종양과 필수적인 관련이 있음이 보고된 후
[1-3], HPV검사가 선별검사로 주목 받게 되면서 다양한
검사법이 소개되어왔다. 현재까지 널리 사용되고 있는 검사
법은 크게 HPV DNA 직접확인법 hybrid capture
assay, Southern blot 및 dot blot, filter in situ
hybridization과 중합효소연쇄반응(polymerase chain
reaction; PCR)을 통해 HPV DNA의 증폭을 이용하는
방법, HPV DNA chip 검사법으로 분류할 수 있다[4-6].
HPV DNA chip 검사는 세계최초로 개발되어 2004년 7 월 한국 식품의약품안전청(Korea Food and Drug Administration, KFDA) 공인을 받은 방법으로서 하나의 슬라이드에서 HPV의 여러 아형에 대하여 감염 유무를 검 사할 수 있어, 선별검사에 적합하면서도 아형 정보를 얻을 수 있는 장점이 있다[7]. 한편 검사 과정에 PCR과 교잡반 응(hybridization)이 모두 포함되어있어 오염에 의한 위양 성 결과 보고의 위험성이 있으며, 스캐너로 자동 판독된 시 그널을 최종확인자가 육안으로 확인하는 정성검사이므로 주 관적 판독에 의한 판정의 차이를 보일 가능성이 있다[8, 9]. 그러나 현재까지 DNA chip을 이용한 HPV 아형 검사 의 정도관리 경험에 대한 보고가 없어, 가톨릭대학교 성가 병원 진단검사의학과에서 자체적으로 운영해온 정도관리 경 험을 소개하고자 하였다.
대상 및 방법
가톨릭대학교 성가병원 진단검사의학과 분자진단검사실 에 2004년 8월 HPV DNA chip 검사(HPVDNAChip–
Omni 100 kit, BioMedLab Co., Seoul, Korea)를 도입한 이 래 자체적으로 운영해온 정도관리체계와 결과를 대상으로 하였다. 정도관리체계는 외부정도관리, 검사실간 비교, 내 부정도관리의 세 부분으로 운영하였다. 외부정도관리는 대 한임상검사 정도관리협회에서 실시하는 정도관리프로그램에 참여하였으며, 검사실간 비교검사는 환자 검체를 이용하여 동일 장비를 사용하는 다른 기관과 월별로 실시하였다. 내 부정도관리는 주기적으로 양성과 음성 대조 검체를 사용하 여 실시하였고, DNA chip 슬라이드 내의 민감도 대조의 강도를 분류하여 분석하였다.
1. 외부정도관리
2004년부터 2007년까지 4년간 대한임상검사 정도관리 협회에서 주관한 진단유전학분과 정도관리 프로그램에 7회 참여하였다. 정도관리협회에서 각 기관으로 발송한 검체를 1X PBS 완충액으로 2~3회 세척하여 고정액알코올을 제 거한 뒤 검사하였다.
바이오메드랩사에서 제조한 HPV DNA chip kit을 사 용하였고, 검체 처리를 비롯한 검사의 모든 조작과정은 바 이오메드랩사에서 제공한 지침서에 따라 진행하였다. 외부 정도관리 검체는 환자 검체와 동일한 방법으로 2명의 임상 병리사가 맹검 시행하여 확인된 결과를 보고하였다.
2. 검사실간 비교검사
본 기관에서 2006년 5월부터 2007년 6월까지 HPV 검 사를 실시한 환자의 검체 1006예는 검사 후 DNA 추출상 태로 -70℃ 냉동고에 보관하였다. 보관된 검체들 중에서 월 별로 단일감염, 복합감염, 음성으로 결과가 확인된 검체
7~8개를 선정하여 20~30 μL 분주하여 4℃로 유지되도 록 아이스박스에 포장하여 운반하였으며, 비교기관에서는 이송된 검체로 당일에 검사를 시행하였다. 총 100개의 검 체에 대해 동일한 시약(HPVDNAChipOmni100 kit, BioMedLab Co., Korea)과 동일한 장비인 Thermocy- cler (Biometra, Whatman Co., Goettingen, Germany) 및 Confocal laser scanner (GenePix 4000B, Axon Instrument Inc, CA, USA)를 사용하는 바이오메드랩사 에 단일맹검 의뢰하여 비교검사를 시행하였다. 스캐너의 파 장은 Cy5 판독을 위해 637 nm로 지정하였다.
3. 내부정도관리
1) 오염방지를 위한 정도관리
HPV 검사는 평균 주 1회 7~8건씩 시행되었고, 매 검 사시마다 양성 및 음성대조로 정도관리를 실시하는 것을 원 칙으로 하였다. 단, 검사 시행 초기 검사건수가 부족하여 주 1회 실시가 어려운 경우 최소 월 2회 이상 일정주기로 시행되도록 하였다. 양성 대조로는 이전에 양성으로 결과 보고된 검체의 PCR 산물을 여러 개의 자검체로 나누어 -70℃에 보관하였다가 사용하였으며, 음성 대조는 3차 멸 균증류수를 사용하였다.
2) 재현성 정도관리
형광 강도의 감수성을 확인하기 위해 슬라이드에 내장된 cyanine-5-labeled BG (β-globulin)의 시그널 강도에 따라, 흐린녹색(1+), 녹색(2+), 노란색(3+), 적색(4+) 의 4단계[4]로 설정하였다. 시그널 강도의 재현성을 검사하 고 시그널로부터 정량 또는 반정량 정보를 얻을 수 있는지 확인하기 위해, 2006년 5월부터 2007년 6월까지 HPV DNA chip 검사 의뢰된 검체 1006건의 검사 후 DNA 추 출상태로 -70℃ 냉동고에 보관해두었던 검체 중에서, 시그 널 강도의 각 단계별로 7개씩 PCR 검체를 선별하였다. 각 검체를 재검하여 4단계로 β-globulin (BG) 시그널 강도의 재현성을 검사하였으며, 전기영동으로 BG band의 넓이를 측정하여 평균 넓이를 산정하였다. DNA 추출물의 DNA 양 은 Spectrophotometer (SmartSpec
TM3000, Bio-RAD Co.
CA, USA)를 이용하여 측정한 후, 시그널 강도에 따른 전기 영동 평균 BG band의 넓이와 평균 DNA 양과의 상관관 계를 조사하였다.
결 과
1. 외부정도관리
2004년부터 2007년까지 4년간 대한임상검사 정도관리
협회 주관 정도관리 진단유전학 분과 프로그램에 참여하여
분석한 정도관리 물질의 아형은 7회 모두 16형으로 동일하
였고, 7회 모두 일치한 결과를 보였다.
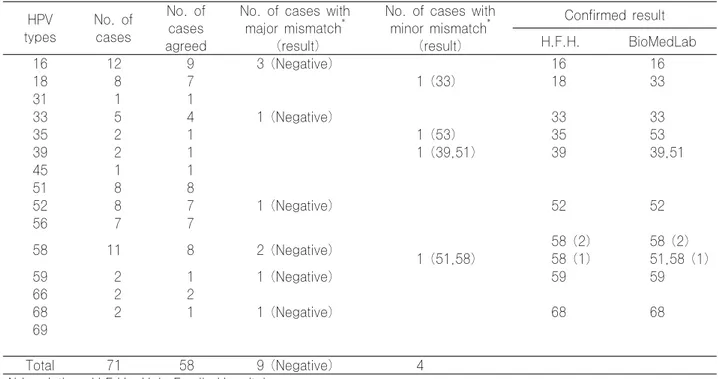
Table 1-1. Inter-laboratory proficiency tests of HPV DNA chip test (high risk type) HPV
types
No. of cases
No. of cases agreed
No. of cases with major mismatch
*(result)
No. of cases with minor mismatch
*(result)
Confirmed result H.F.H. BioMedLab
16 12 9 3 (Negative) 16 16
18 8 7 1 (33) 18 33
31 1 1
33 5 4 1 (Negative) 33 33
35 2 1 1 (53) 35 53
39 2 1 1 (39,51) 39 39,51
45 1 1
51 8 8
52 8 7 1 (Negative) 52 52
56 7 7
58 11 8 2 (Negative) 58 (2) 58 (2)
1 (51,58) 58 (1) 51,58 (1)
59 2 1 1 (Negative) 59 59
66 2 2
68 2 1 1 (Negative) 68 68
69
Total 71 58 9 (Negative) 4
Abbreviation: H.F.H., Holy Family Hospital.
*
Major mismatch and minor mismatch designate the inconsistency showing positive or negative mismatches and genotypic mismatches each.
Table 1-2. Inter-laboratory proficiency tests of HPV DNA chip test (low risk type)
HPV types
No. of cases
No. of cases agreed
No. of cases with major mismatch
*(result)
No. of cases with minor mismatch
*(result)
Confirmed result H.F.H. BioMedLab
6 1 1
11 1 1
34
40 3 3
43 1 1
44
Negative 6 5 1 (35) Negative 35
Total 12 11 1
Abbreviation: H.F.H., Holy Family Hospital.
*
Major mismatch and minor mismatch designate the inconsistency showing positive or negative mismatches and genotypic mismatches each.
2. 검사실간 비교검사
바이오메드랩사와 시행한 검사실간 비교검사의 결과는 다음과 같았다. 매월 시행한 총 100개의 검체 중 두 검사 실의 결과가 모두 일치한 경우가 82건(82%), 양성과 음성 의 불일치(major mismatch)가 10건(10%), 양성 판정이 면서 아형이 다르게 판독되었거나 복합감염에서 일부 아형 이 다르게 판독된 불일치(minor mismatch)가 8건(8%)
이었다. Major mismatch 10건 중 본 검사실의 결과는
양성, 비교기관은 음성으로 판정된 경우가 9건(9%), 반대
의 경우가 1건(1%)이었다. Minor mismatch 8건 중 단
일감염으로 아형이 서로 다른 경우 4건(4%), 복합감염에서
일부 아형이 다르게 판독된 경우가 4건(4%)이었다(Table
1). 불일치 예에 대해서는 염기서열을 분석하고, 재검하여
검정한 결과를 토대로 재검정하였다. 염기서열 결과를 얻을
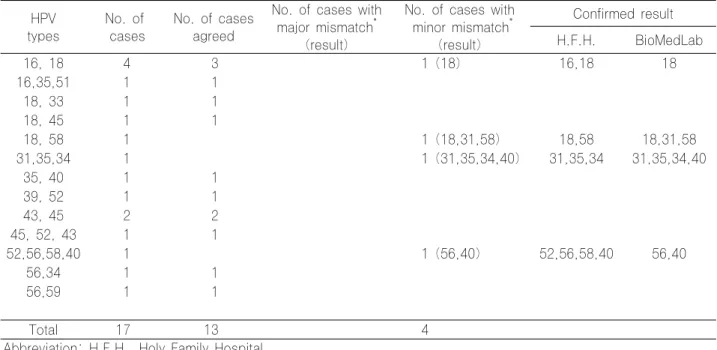
Table 1-3. Inter-laboratory proficiency tests of HPV DNA chip test (mixed type) HPV
types
No. of cases
No. of cases agreed
No. of cases with major mismatch
*(result)
No. of cases with minor mismatch
*(result)
Confirmed result H.F.H. BioMedLab
16, 18 4 3 1 (18) 16,18 18
16,35,51 1 1
18, 33 1 1
18, 45 1 1
18, 58 1 1 (18,31,58) 18,58 18,31,58
31,35,34 1 1 (31,35,34,40) 31,35,34 31,35,34,40
35, 40 1 1
39, 52 1 1
43, 45 2 2
45, 52, 43 1 1
52,56,58,40 1 1 (56,40) 52,56,58,40 56,40
56,34 1 1
56,59 1 1
Total 17 13 4
Abbreviation: H.F.H., Holy Family Hospital.
*
Major mismatch and minor mismatch designate the inconsistency showing positive or negative mismatches and genotypic mismatches each.
수 있었던 major mismatch 10건 중 9건과 minor mismatch 중 복합감염 2건은 비교기관에서 발생한 오류로 확인되었으나, 나머지 7건은 검체량 부족으로 염기서열 결 과를 얻을 수 없었고 오류원인을 확인할 수 없었다. 비교기 관의 오류였던 11건의 가능한 원인으로 DNA 변성이 잘 되지 않아 교잡반응이 일어나지 않았거나, 판독과정의 문제 점이 대두되었다. 이에 비교기관은 스캐너의 PMT gain (PMT Voltage / Calibration constant)을 점검하고 레 이저 강도를 확인한 결과, 레이저의 유효기간을 초과하여 사용한 사실이 확인되었다. 레이저 교체 이후 재검한 결과 희미한 양성결과를 얻을 수 있어, 비교기관 스캐너의 레이 저 강도가 낮았기 때문으로 판단되었다. 나머지 7건은 재조 정된 스캐너로 기존 슬라이드를 다시 판독하여도 동일한 양 상을 나타내었으며, DNA 추출과 PCR 및 교잡반응 과정 의 오류일 가능성이 있을 것으로 생각되었다. 검사실간 비 교검사의 일치율은 82%(100건 중 82건 일치), 비교기관 의 스캐너 조정 이후 재검정 결과 포함시 93%(100건 중 93건 일치)이었다.
3. 내부정도관리
1) 오염방지를 위한 정도관리
2006년 5월부터 2007년 6월까지 HPV 검사 1006건을 153회 검사하는 동안 양성 및 음성 대조 검사는 총 73회 실시되었으며, 오염은 5회(3.3%) 발생하였고, 여러 아형이 동시에 오염을 일으킨 경우가 3회(60%), 단일 아형에 의
한 오염이 2회(40%)로 나타났다. 오염을 일으킨 아형은 고위험군 아형 중 16형, 18형, 35형과 저위험군 아형 중 6형, 34형, 40형이었다.
통상적으로 오염방지를 위해 다음의 방법을 검사수칙에 포함하였다. Clean bench 내와 실험실 천정에 설치된 자 외선을 실험 후와 실험 전에 2시간 이상 조사하고, Clean bench 내에서는 검체가 든 튜브나 파이펫 조작시 발생하는 바이러스 미립에 의한 공기오염을 방지하기 위해 알코올램 프를 켜고 작업을 하였다[10, 11]. 자동 파이펫은 DNA 추출, PCR 증폭, 교잡반응의 각 단계마다 따로 구분하여 전용 파이펫을 사용하고, 다른 종류의 바이러스에 의한 오 염을 방지하기 위해 RNAse를 이용하여 소독하는 등 일반 적으로 권장되는 오염 제거 방법을 사용하였다[10]. 또한 필터내장형 팁(tip)을 사용하고 검사단계별로 소독된 latex 장갑을 새로 착용하였으며, 70% 알코올로 작업대를 소독하 고 정제수와 PCR에 사용되는 완충액 및 시약들은 항상 분 주하여 보관하였다. 실험이 끝난 후 쓰레기 처리도 오염방 지를 위해 반드시 자외선 소독 후 폐기하였다[12].
2006년 이전에는 검사건수가 적어 오염의 빈도수가 적 었으나, 점차 검사건수가 증가하면서 오염의 횟수도 증가하 여, 오염의 판정과 제거를 위한 자체 기준을 추가하였다.
오염의 판정은 첫째, 음성 대조가 양성의 결과를 보이거나, 둘째, 음성 대조가 음성이더라도 당일 검사한 검체의 60%
이상이 동일한 HPV 아형의 양성 결과를 보이는 경우는
carryover에 의한 오염으로 판단하고 오염제거를 실시하였
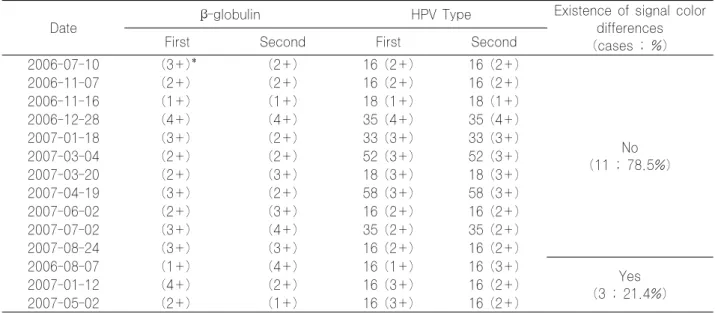
Table 2. Color variations of β-globulin and genotypic signals of HPV DNA chip test
Date β-globulin HPV Type Existence of signal color
differences (cases ; %)
First Second First Second
2006-07-10 (3+)* (2+) 16 (2+) 16 (2+)
No (11 ; 78.5%)
2006-11-07 (2+) (2+) 16 (2+) 16 (2+)
2006-11-16 (1+) (1+) 18 (1+) 18 (1+)
2006-12-28 (4+) (4+) 35 (4+) 35 (4+)
2007-01-18 (3+) (2+) 33 (3+) 33 (3+)
2007-03-04 (2+) (2+) 52 (3+) 52 (3+)
2007-03-20 (2+) (3+) 18 (3+) 18 (3+)
2007-04-19 (3+) (2+) 58 (3+) 58 (3+)
2007-06-02 (2+) (3+) 16 (2+) 16 (2+)
2007-07-02 (3+) (4+) 35 (2+) 35 (2+)
2007-08-24 (3+) (3+) 16 (2+) 16 (2+)
2006-08-07 (1+) (4+) 16 (1+) 16 (3+)
Yes (3 ; 21.4%)
2007-01-12 (4+) (2+) 16 (3+) 16 (2+)
2007-05-02 (2+) (1+) 16 (3+) 16 (2+)
*The figures in the parentheses represent the color variations of β-globulin and genotypic signals: 1+, Light Green; 2+, Dark green; 3+, Yellow; 4+, Red.
Table 3. The relationships among β-globulin signal colors, average band sizes from electrophoresis, and the DNA volumes
BG color Average band size from
electrophoresis (mm) Average DNA volume (ng) No. of Tests (n=153)
Light green 0.8 19 38
Dark green 0.8 18.5 52
Yellow 1 22.3 44
Red 1.1 22.7 19
Abbreviation: BG, β-globulin.
다. DNA 추출과정, PCR 과정과 교잡반응에 사용되는 모 든 시약을 교체한 후, 1) 교잡반응 단계부터 재검을 실시하 고, 2) 추출된 DNA로 PCR 단계부터 재검하였고, 3) 남 은 검체로 검사를 처음부터 다시 실시하였다. 1)의 방법으 로는 carryover에 의한 오염이 제거되지 않았고(0%), 2) 의 방법으로 제거된 경우가 1회(20%), 3)의 방법으로는 4 회(80%) 오염이 제거되었다.
2) 재현성 정도관리
총 153회의 검사에서 BG 시그널 강도를 관찰하여 4단 계로 구분한 결과는 흐린녹색(1+) 37건, 녹색(2+) 51건, 노란색(3+) 44건, 적색(4+) 19건이었다. DNA chip 형 광 강도의 재현성을 검사하기 위해, 본원의 결과를 기준으 로 HPV 아형들 중 빈도순이 높은 HPV 16형, 58형, 52 형, 33형, 35형을 선택하였다. 상기 결과를 보인 검체들 중 녹색(2+) 또는 노란색(3+)의 시그널로 판독 된 PCR 산물 14개를 선택하고 2회 이상 연속적으로 재검하여 이전 검사 결과와 비교하였다. HPV 아형 결과는 이전 결과와
동일하였고 시그널의 강도는 DNA chip 슬라이드 Lot 제 조번호에 따라 상당수 차이를 보였다. 형광강도의 차이가 1 이거나 차이가 없는 예를 일치(11예)로 하고, 차이가 2이 상인 예를 불일치로(3예) 하여 비교한 결과 일치율은 78.2%이었다(Table 2).
시그널 강도로부터 정량 또는 반정량의 정보를 얻을 수
있는지 확인하기 위해 단계별로 7개씩의 PCR product를
무작위 선택하여 겔 전기영동으로 BG band를 확인하고,
DNA 추출물로부터 DNA 양을 측정한 결과는 Table 3과
같았다. 본 결과만을 가지고 흐린 녹색과 녹색을 하나의 시
그널 강도로 처리하고, 노란색과 적색을 또 하나의 시그널
강도로 하여, 시그널 강도를 2단계로 대별하면 반정량의 정
보를 얻을 수 있었다. 그러나 Table 2에 제시된 바와 같이
DNA chip 슬라이드 Lot 제조번호에 따른 차이가 이렇게
설정한 반정량 기준을 초과하기 때문에, 실질적으로 시그널
강도로부터 반정량 정보를 얻을 수 없는 것으로 판정하였
다.
H.F.H Type 58
BioMediLab Negative
H.F.H Type 52,56,58,40
BioMediLab Type 56, 40 Fig. 3. Examples of disagreed results of inter-laboratory proficiency tests of HPV DNA chip test.
light green(1+)
green (2+)
yellow (3+)
red (4+) Fig. 1. Grades of β-globulin and genotypic signals of HPV DNA chip test.
1
sttest(2+) 2
ndtest(1+) 1
sttest(2+) 2
ndtest(3+)
Fig. 2. Examples of signal variations for the same samples in HPV DNA chip test.
고 찰
HPV DNA Chip 검사는 국내에서 세계 최초로 개발되 어 2004년 7월 KFDA 공인을 받았고 22개의 아형 각각의 감염여부를 한번에 검사할 수 있다. 검사과정은 PCR 증폭 후 특정 유형별 염기서열에 특이적인 oligo-DNA probe가 장착된 chip 슬라이드 위에서 교잡반응을 거친 다음, cyanine 5 형광물질을 이용하여 스캐너로 판독한다. 이와 같이 검사의 술식이 현재 시장점유율이 높은 hybrid capture 법에 비해 복잡한 편이며 PCR과 교잡반응을 모 두 포함하는 검사특성상 숙련된 검사자를 요구한다.
결과의 판독에 있어서도 형광물질을 이용하여 스캐너로 자동판독된 시그널을 육안 확인하는 정성 검사이므로, 기준 에 따른 판정의 차이를 보일 수 있고 사용되는 스캐너의 레 이저 강도에 따라서도 다른 결과로 판독될 수 있다[13, 14]. 본원에서 시행한 검사실간 비교 검사 결과에서도 비교 기관이 양성을 음성으로 잘못 판정한 원인이 스캐너의 문제 였던 것으로 판단되었으며, 레이저 강도의 주기적 점검을 포함하여 반드시 스캐너의 정도관리를 시행하여야 함을 알 수 있었다. 검사실간 비교검사에서 부적절한 방법으로 검체 를 이송함으로써 오류가 발생할 가능성을 배제하기 위해 검 체 이송 전 보관 및 이송과정, 그리고 이송 후 검사 시까지 의 검체 보관 등을 포함하는 각 단계에 걸쳐 철저한 관리가 필요하다[7].
검사실간 비교검사를 위해 총 100개의 검체가 사용되었 는데, 아형 정보의 오류 가능성을 배제하고자 아형별 양성 검체를 선택하는 데에 주력하여 음성 검체를 거의 포함시키 지 않다가 비교적 정도관리체계가 정착된 2007년부터 양성 과 음성 검체를 4:1의 비율로 선택하여 사용한 결과, 음성 검체는 총 6예만이 포함되었다. 비교검사결과의 분석에서, 음성 검체가 비교기관에서 양성으로 판독된 경우가 1예 있 었으므로 6예에 대한 비율로 본다면 16.7%에 해당하고, 이는 양성 검체가 음성으로 판독된 9.6%(양성 검체 94예 중 9예)보다 월등히 높다고 할 수 있다. 그러나 양성과 음 성 검체를 4:1의 비율로 선택하여 비교검사를 시행한 기간 동안에는 음성 검체가 비교기관에서 양성으로 판독된 경우 가 없었다. 추후 음성 및 양성 검체의 비교검사 결과를 보 다 누적하여 음성 검체가 양성으로 뒤바뀌는 경우에 대한 분석도 추가되어야 할 것으로 생각되었다. 지속적인 불일치 의 결과를 보이는 경우 어느 기관의 검사결과를 정답으로 간주할 것인가 하는 부분에 대해서는 염기서열 분석이 정답 을 찾을 수 있는 방법의 하나이며, 세포 및 조직검사 결과 를 참조할 수도 있으나, 반드시 후향적인 참고자료로만 사 용되어야 한다. 각 검사실의 여건에 따라 오류의 가능성은 여러 단계에 걸쳐 다양하게 존재할 수 있으므로 검사실간 비교검사를 반드시 시행할 것을 권장한다.
HPV DNA chip 검사는 PCR을 기본으로 하는 검사이
므로 반드시 양성 및 음성 대조로 정도관리를 시행하여 검 사의 오류로 인한 위음성 및 오염에 의한 위양성의 가능성 을 배제하여야 하며, 위음성 및 위양성이 의심되는 경우 반 드시 재검사를 시행하여 확인함으로써 검사의 정확도를 높 여야 한다. 본 결과에서 교잡반응부터 재검하여서는 오염이 교정된 경우가 한번도 없었고, 잔여검체로 재검을 시행하여 80%의 오염이 제거되었던 것으로 미루어, 오염이 의심되는 경우에는 환자의 잔여 검체로 재검하거나 가능하다면 검체 를 다시 채취하여 재검사를 시행하는 것이 정확도를 높이는 방법임을 알 수 있었다.
HPV 유병율에 관한 보고들에서 침윤성 자궁경부암 환자 의 HPV 양성율은 검사법에 따라 다소 차이가 있으나 93~99%로 매우 높다. 아형들 중에서는 대체로 16형이 약 42~65%를 차지하며, 그 다음은 구미에서는 18형이 14~18%, 45형 8~12%, 31형 3~7%의 빈도로 보고되어 있다 [14,15]. 그러나 아시아나 한국의 감염율은 보고자들에 따라 정도의 차이는 있으나 18형이 구미보다 낮게 나타나고 58형 이나 52형, 51형 등의 감염율이 상대적으로 높은 것으로 보 고된다[16,17]. 본 연구의 기간 내에 시행된 1006건의 결과 에서도 고위험군 양성 512건 중 가장 흔한 아형은 16형 (22.4%)으로 동일하였으나 그 다음은 58형(12.3%), 52(10.7%), 56(9.4%), 51형(9.2%), 18 (7.6%)의 빈도를 보여 58형과 52형의 빈도가 높게 나타났다. 한편 지난 4년간 HPV 검사를 위한 외부정도관리 물질은 16형으로 동일하였 다. 따라서 HPV DNA chip 를 이용하여 각 아형을 분석하 는 기관에서는 내부정도관리시 국내의 감염양상을 반영하여 58형과 52형 등 HPV의 다양한 아형을 포함해야 정확한 정 도관리의 목적을 달성하는데 도움이 될 것으로 생각한다.
전체 153회의 검사 중 오염이 일어났던 5회에서, 오염을 일으킨 아형들 중, 일반적으로 양성 빈도수가 낮은 아형인 35형이 2회(40%) 연속 오염을 일으킨 것은 검사과정 이 외에 DNA chip 제조상의 문제일 가능성을 배제 할 수 없 었으며, 본원에서 양성 정도관리 물질로 사용한 환자 검체 (clinical sample)가 교차교잡반응(cross hybridization) 을 일으켰을 가능성도 있다고 판단되었다. 교차교잡반응이 의심되는 경우에는 후향적으로 동일 Lot 번호의 킷트가 공 급된 검사실의 결과들을 조회하고 검증하는 방법이 추천되 며, 이는 제조사에서 제품의 질을 향상하고 유지관리를 철 저히 하도록 고무시킴으로써 근본적인 정도관리에도 도움이 된다. 또한 양성 정도관리 물질로는 임상검체보다 세포주에 서 얻은 HPV DNA 아형이나 plasmid DNA를 사용할 것 이 권장된다. 현재 SiHa (HPV-16), HeLa (HPV-18), C33a (Negative)이 널리 사용되며 객관적인 결과를 위해서 는 이들을 이용한 주기적인 정도관리가 필요하다[18-20].
상술한 바와 같이 HPV DNA chip 검사의 정도관리체
계에는 오염방지를 위한 지속적인 유지관리와, PCR과 교
잡반응 과정 중의 위음성과 위양성을 배제하기 위한 정도관
리, 검사 판독 과정의 오류를 막기 위한 스캐너의 정도관 리, 그리고 검사실간 비교검사가 반드시 포함되어야 하며, 누적된 자료의 분석을 통해 검사실이 속한 지역 및 환자군 등 각 검사실 특성에 맞는 관리체계를 정착해나가야 할 것 으로 생각한다.
요 약
배 경: 인유두종 바이러스(HPV) 아형 22종 각각의 감 염 여부를 검사할 수 있는 HPV DNA chip 검사법이 최근 국내에서 개발되었다. PCR과 교잡반응을 포함하는 검사특 성상 오염의 위험성이 높고 주관적 판독에 의한 정성검사이 므로 반드시 정도관리가 필요하다. 가톨릭대학교 성가병원 진단검사의학과에서 자체적으로 설정하여 운영해온 정도관 리 경험을 소개하고자 하였다.
방 법: HPV 정도관리는 외부정도관리와 검사실간 비교, 내부정도관리의 세 부분으로 시행하였다. 외부정도관리로는 대한임상검사 정도관리협회에서 실시하는 정도관리프로그램 에 4년간 참여한 결과를 분석하였다. 검사실간 비교검사는 바이오메드랩사와 음성과 단일감염 및 복합감염의 환자 검 체를 매월 맹검으로 검사하였다. 내부정도관리는 오염을 방 지하기 위한 정도관리와 재현성 검사를 시행하였다.
결 과: 외부정도관리 결과는 4년간 7회 모두 16형의 정 답과 일치하였다. 검사실간 비교검사에서는 일치율 82%이 었고, 양성이 음성으로 바뀐 불일치가 10건, 아형의 차이를 보인 불일치가 8건이었다. 불일치의 원인이 확인된 10건은 비교기관의 스캐너의 레이저 강도의 문제로 확인되었다. 내 부정도관리 결과 오염율은 3.3%였으며 양성 빈도가 낮은 아형인 35형에 의한 오염도 자주 관찰되었다. 오염시 교잡 반응부터 재검하여서는 오염이 제거되지 않았고, 잔여검체 로 재검하여 80%의 오염이 제거되었다. 형광강도는 재현성 이 낮았고 DNA 정량 또는 반정량의 정보를 얻을 수 없었 다.
결 론: HPV DNA chip 검사의 정도관리체계를 운영함 에 있어, PCR과 교잡반응 과정 중의 위음성과 위양성을 배제하기 위한 기술상의 정도관리와, 검사 판독 과정의 오 류를 막기 위한 스캐너의 정도관리, 그리고 검사실간 비교 검사가 반드시 포함되어야 할 것으로 생각된다.
참 고 문 헌