61
서 론
췌장암의 역학 및 원인 인자를 연구하는 데 있어 몇 가지 어려운 점이 있다. 가장 큰 문제점은 진단의 불확실성으로1 췌장암은 간, 담도계암과 함께 병리조직학적 검사로 인한 진단이 매우 낮아 확진율이 50% 이하로 다른 암종의 평균 (71∼100%)에 훨씬 못 미친다(2002년 45.8%로 10여 년 전과 별 차이가 없음, 2002년 한국 중앙암등록사업 연례 보고서).
간세포암은 병리조직학적 진단 없이도 확진이 가능하고 의 료 건강보험에서도 인정되므로 췌장암의 병리조직학적 확 진율이 가장 낮다. 이렇게 병리조직학적 진단이 적은 이유 로는 췌장은 복막 후강에 위치하고 있어 접근이 어려운 것 이외에 많은 환자에서 고령에서 발생하고 이미 진행된 상 태로 발견되어 병리조직학적 확진이 없이 그냥 보존적 치 료를 받는 경우가 많은 것이 원인으로 생각된다(2002년 치 료를 안 받거나 모르는 경우가 약 60%에 이름, 2002년 한국 중앙암등록사업 연례 보고서). 이러한 조직 검사 확진율은 구미 여러 나라에 비해서도(약 60∼80%) 낮은 편으로 부검 예가 매우 적은 것도 원인의 하나로 생각된다. 췌장에 생기 는 암종 중 선암종이 90% 이상을 차지한다고 생각되므로 선암종만을 일반적으로 췌장암이라고 한다면 약간의 오차 가 있을 수 있다(이후 본 논문에서는 선암종만을 다룸). 췌 장암은 절제 수술 조직이 아닌 경우 췌장염, 팽대부 주위암, 림프종, 췌관내 유두상 점액성 종양 및 전이암 등과 감별 진단이 어려운 경우가 있고(2002년 수술받은 예는 약 20%, 2002년 한국 중앙암등록사업 연례 보고서), 조직생검 부위 가 간이나 폐 등의 전이 병소에서 얻어지는 경우도 많으므 로 진단이 틀렸을 가능성이 있겠다(우리나라 통계에는 보 통 췌장암이라고 일컫는 췌관 상피에서 기원하는 췌관 선 암종 이외에 일부에서 점액성 낭선암종, 도세포 암종 등이 포함되어 있음, 2002년 한국 중앙암등록사업 연례 보고서).
실제로 핀란드에서 5년 이상 장기 생존자들을 후향적으로 검토한 결과 대부분 환자에서 조직학적 확진을 못 받았거 나 처음 진단이 틀렸다는 보고가 있다.2 선암종과 치료가 다르고 예후가 좋은 림프종이나 도세포 암종 등을 감별하 기 위해 병리 조직학적 진단을 위한 보다 더 많은 노력이 필요하다. 반면에 원발성 암을 못 찾은 경우 췌장암이 원발 책임저자:이우진, 경기도 고양시 일산구 마두1동 809
ꂕ 411-769, 국립암센터 간암센터 Tel: 031-920-1612, Fax: 031-920-1138 E-mail: lwj@ncc.re.kr
Epidemiology and Risk Factors in Pancreatic Cancer
Woo Jin Lee, M.D.Center for Liver Cancer, National Cancer Center, Gyeonggi-do, Korea
Pancreatic cancer, although an uncommon tumor, is one of the most lethal tumors. The incidence of pancreatic cancer in Korea has increased over the past 15 years, with about 3,000 cases annually. It appears to correlate with increasing age, and it is slightly more common among men. Because of high mortality rate, pancreatic cancer now rank fourth as a cause of death from cancer in Korea. Some diseases and medical conditions such as diabetes, chronic pancreatitis, as well as environmental and lifestyle risk factors, and occupational and genetic conditions. may play important role in the etiology of pancreatic cancer. The most consistently identified environmental risk factor is smoking, but there is less certainty concerning dietary factors. Studies have sug- gested a positive association with high energy intake, cho- lesterol and meat, while vegetable and fruit intakes are probably protective. Patients with chronic pancreatitis and new onset of diabetes mellitus have a low but increasing risk of having or developing pancreatic cancer. A family history of pancreatic cancer is an important risk factor, but only a small proportion can be linked with known familial cancer syndromes. Until the development of new methods for early diagnosis and better modalities for therapeutic intervention, primary prevention is the most effective approach to reduce the incidence of pancreatic cancer. (Korean J HBP Surg
2004;8:61-68)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Key Words:
Carcinoma, Pancreatic DuctalEpidemiology Risk Factors
중심 단어: 췌장암, 역학, 위험인자
췌장암의 역학 및 원인
국립암센터 간암센터 이 우 진
부위인 경우가 25∼40% 정도로 생각되어 이들을 포함하면 췌장암이 더 많을 가능성이 있다.
또 다른 문제점으로는 많은 췌장암 환자들은 진단 후에 도 생존기간이 짧아 연구 시점에는 본인들보다는 대리인에 게 간접적으로 정보를 얻는 경우가 많아 원인 인자나 음식 같은 환경적 요인을 규명하는 데 오차가 있을 수 있다.
본 론
1. 우리나라 데이터 1) 발생률
우리나라에서 췌장암은 소화기 암종 중 위암, 간암, 대장 암 다음으로 흔한 암이다.
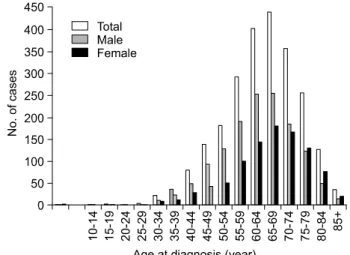
보건복지부 한국 중앙암등록본부 주관으로 시행되고 있 는 2002년 한국 중앙암등록사업 연례 보고서(병원암등록사 업으로 139개 등록병원에서 2002년 새로이 진단받은 암환 자를 등록받아 집계한 보고로, 우리나라 암발생자의 약 90%가 등록된다고 추정됨)에 의하면 췌장암은 악성 종양 등록건수 총 99,025건 중 2,397예(남자 1411, 여자 986)로 전 체 암종 중 발생등록분율 2.4%로 9위(남자 2.5%로 9위, 여 자 2.3%로 10위)를 차지하고 있으며 등록건수 및 등록분율 이 남녀 공히 꾸준히 증가하고 있다(Fig. 1). 연령별로는 40 세 이전에는 매우 드물고(3% 이하) 40대 이후 급격히 증가 하여 40대 9.2%, 50대 19.8%, 60대 37.2%, 70대 25.8%로 60 대에 최고를 이루며 60대 이후가 총 67.9%를 차지한다(Fig.
2). 노령인구의 증가와 함께 60대 이상의 노령 인구에서 발 생분율이 점차 증가하고 있다. 성별로는 남성에서 약 1.4배 많이 발생하며 젊은 연령에서는 남자에서 더 많이 발생하 고 노령에서는 남녀 비슷하게 발생한다.
췌장암 발생의 증가는 진단 방법이 더욱 정확해졌다는 것으로 일부 설명될 수 있으며, 일부는 흡연의 증가로 설명 된다. 흡연 20년 후에 폐암이 증가하는 것으로 미루어 보면 향후 더욱 증가하리라 생각되며 또한 수명 연장 및 노령인 구의 증가와 암종 발생 증가로 지속적으로 증가하리라고 예상된다.
2) 사망률
전체 암종 중 사망분율 4.6%로 5위(남자 5위, 여자 6위)를 차지하고 있으며(2002년 한국 중앙암등록사업 연례 보고 서), 통계청 자료에 의하면 2002년 사망자수 2,881명(남자 1,690명, 여자 1,191명)으로 사망률은 인구 10만 명당 6.0(남 자 7, 여자 5)으로 남녀 공히 꾸준히 증가하고 있다. 또한 연령별로 보면 고령에서 10만 명당 사망자 수(사망률)가 급 격히 증가한다. 우리나라에서 췌장암의 정확한 발생률은 모르지만 생존율이 매우 낮은 암종이므로 발생률은 사망률 과 거의 같다고 할 수 있다.
3) 생존율
1995년부터 2000년까지 자료를 모은 2002년 한국 중앙암 등록사업 연례 보고서에 의하면 췌장암 발생자의 5년 관찰 생존율은 7.7% (남자 6.7%, 여자 9.1%), 상대 생존율(관찰한 암환자와 동일한 연령층의 인구집단이 같은 관찰 기간에 살아있을 정도를 관찰생존율에 나누어 구한 것으로 암발생 에 기인한 생존율을 의미하며 생존율 변동양상 비교나 다 른 인구집단의 생존율 비교에 사용함)은 8.4% (남자 7.5%, 여자 9.7%)로 10대 암 중 남녀 모두에서 최하위를 차지하고 있다(전체암 평균 5년 관찰생존율은 38.1%, 상대 생존율 41.4%). 또한 1년 관찰생존율은 20.2%, 2년 관찰생존율은
Fig. 1. The time trends of the number and proportion of enrolled pancreatic cancer cases. The enrolled pancreatic cancer cases in Korea have increased over the past 15 years (data from 2002 annual report of the Korea Central Cancer Registry, which is based on registered data from 139 hospitals).
Fig. 2. The distribution of enrolled pancreatic cancer cases by age and sex. The number of enrolled pancreatic cancer cases appear to correlate with increasing age with peak at seventh decade, and they are slightly more common among men (data from 2002 annual report of the Korea Central Cancer Registry).
11.1%에 불과하다. 더욱이 예후가 훨씬 좋은 점액성 낭선암 종, 도세포 암종이나 췌관내 유두상 점액분비 종양 등이 포 함되어 있으므로 이들을 제외하면 이보다 훨씬 낮으리라 생각된다.
2. 외국 데이터
췌장암은 세계적으로 매년 약 20만 명 이상이 발생하며 전체 암의 2.1%, 전체 암종 중 13위를 차지하고 사망률이 98%에 이르며 2000년도 통계에 의하면 매년 전 세계적으로 20만 명 이상(전체 암종 중 8∼9위)이 췌장암으로 사망하였 으며 최근 40년 간 점차 증가하고 있다(WHO의 International Agency for Research on Cancer (IARC), Globocan 2000). 원발 성 암을 못 찾은 경우(전체암 800만 명 중 2%인 20만 명의 25∼40%인 5만∼8만 명이 췌장암으로 추정)도 합하면 더 많을 것으로 생각된다. 80∼90%에서 절제 불가능하며 5년 생존율은 2∼4%로 주요 암종 중 가장 낮고 수십 년 전과 큰 변화가 없거나 약간 상승하였으며 사망률을 발생률의 대체 지표로 사용할 정도로 발생률은 사망률과 거의 같다 고 할 수 있다(증례 발생/사망 비(case/fatality ratio) 0.99).3 선진국에서 10만 명당 9∼10명으로 후진국보다 발생률이 더 많은 것으로 보고되나 위암, 대장암, 간세포암, 식도암 같은 다른 소화기 암종보다 지역적 요인이 큰 것 같지는 않으며(대개 2배 이내) 개발 도상국이나 저개발국들에서 진 단을 못 하거나 통계에 포함되지 않아 실제보다 적었을 가 능성이 있다. 북미나 뉴질랜드 마오리 족, 하와이 원주민, 미국 흑인, 호주, 서구 유럽, 스칸디나비아에서 발생이 높고 아프리카, 멕시코, 중남미, 중동, 인도, 나이지리아는 낮 다.4-6 일본 남성, 남동부 유럽에서 지속적으로 증가하는 추 세이다. 적도에서 멀수록, 추울수록 대체적으로 높다는 보 고도 있다.
연령별로는 60∼70대에 호발하며 60대 이후가 약 80%를 차지한다. 65세 이상이 65세 미만보다 17배 많다.
성별로는 남성에서 1.3∼1.7배 정도 많이 발생하여 흡연 이 관여하리라 생각되며 일부 여성 호르몬의 역할에 대한 보고도 있으나 불확실하다. 대부분의 외국통계에서도 젊은 연령에서는 남자에서 더 많이 발생하고 노령에서는 남녀 비슷하게 발생한다.
거주지별로는 도시주민이 시골 주민보다 발생률이 약간 높아 직업이나 음식 습관 등의 환경적 요인의 중요성을 시 사하지만 최근에는 주거환경의 급격한 변화로 중요시되지 는 않는다. 사회경제적 여건에 따른 차이도 불확실하며 이 민자들을 대상으로 한 연구들도 논란이 있다.7
미국에서는 전체 암종의 2%, 10위, 사망분율이 전체 암종 의 5%, 남녀 5위를 차지하며 2002년 약 3만 300명이 새로 발생하였고 2만 9,700명이 사망하였다고 추정된다(NCI의 The Surveillance, Epidemiology, and End Results (SEER) Pro- gram).8 발생률이 10만 명당 10.9명(연령 교정 발생률, 남자
에서는 10만 명당 12.4, 여자 9.8), 사망률이 10만 명당 10.6 명(연령 교정 사망률, 남자에서는 10만 명당 12.2, 여자 9.3, 1995∼1999년, SEER)으로 최근 정체하거나 매년 0.6% 정도 약간 감소하였다. 60대 후반과 70대가 많고 진단 당시 평균 연령(중앙값)은 72세(남자 70세, 여자 74세), 사망 당시 평균 연령(중앙값)은 73세(남자 71세, 여자 75세)이며 일생 동안 누적 발생률은 약 1.2%로 알려져 있다(1995∼1999년, SEER). 5년 상대 생존율은 1950년대 1%에서 1990년대 4.3%
로 약간 상승하였으며 인종별로는 원인은 모르지만 흡연인 자를 교정해도 흑인이 백인보다 30∼50% 정도 높게 발생한 다(흑인에서는 10만 명당 15.9(남자 17.2, 여자 14.7), 백인에 서는 10만 명당 10.6(남자 12.1, 여자 9.4), 연령 교정 발생률, 1995∼1999년, SEER). 1970년대 이후 백인 남성에서는 점 차 감소하나 흑인 여성에서는 점차 증가하여 여성 흡연증 가가 원인의 일부로 생각된다.
일본에서도 발생률이 10만 명당 남자 12.8, 여자 7.4 (연령 교정 발생률, 1998년, 일본 국립 암센터), 사망률이 10만 명 당 9.4명(연령 교정 사망률, 남자 12.2, 여자 7.2, 2001년, 일 본 국립암센터)으로 전체 암종 중 사망분율 6.5%, 5위(남자 5.8% 5위, 여자 7.5% 6위)를 차지하고 있으며(2001년, 일본 국립암센터) 사망률이 현저히 증가하여 특히 남성에서는 세계에서도 상위에 속한다. 1935년에 비해 1980년대에 10 만 명당 0.3에서 4.2로 14배 증가하였는데 이는 진단 기술의 발전, 흡연 및 서구화된 음식 등 생활 습관 같은 환경적 요 인을 시사한다.9,10 또한 20년 전에 비한 사망률의 증가는 노 령 인구의 증가에 기인한 것으로 생각된다.
유럽에서는 매년 30,000명이 발생하고 전체 암종 사망원 인의 4위를 차지한다. 북부 유럽에서 남부 유럽보다 빈도가 높으나 최근에는 정체 또는 감소 상태인 데 비해 남동부 유럽에서는 지속적으로 증가하는 것으로 알려지고 있 다.11-13
3. 췌장암 발생의 고위험군(Table 1)14
현재까지 췌장암의 가장 효과적인 치료는 수술적 절제이 나 전술한 바와 같이 절제율이 20% 이하로 생존율은 10대 암 중 최하위를 차지하고 있다. 췌장암의 생존율을 높이려 면 영상진단의 향상과 분자생물학적 연구의 발전으로 인한 조기진단과 새 치료법의 개발이 중요하다. 최근 이 분야의 많은 발전이 있으면서 조기진단과 치료를 위해 고위험군을 정의하고 연구하는 것이 매우 중요하다고 생각된다. 만약 어느 집단에서 단기간에 현저한 변화가 있다면 특정 환경 적 요인이 관여함을 시사하고 원인을 제거하여 생존율을 향상시킬 수 있다.
1) 고령
가장 중요한 위험인자로 30세 이전에는 극히 드물어 가 족력을 의심하여야 하며, 50세 이전에는 많지 않다가 급격 히 증가하며 평균 연령이 65∼70세이다. 또한 노인 환자에
서는 동반된 다른 질환으로 수술이 불가능한 경우가 상대 적으로 많다. 만성 췌장염에서는 10∼20세 일찍 발생한다.
췌장암은 치명적인 암이지만 전체 인구에서 유병률이 높지 않아 선별검사를 위해서는 매우 높은 예민도와 특이도가 요구된다. 예를 들면 95%의 예민도와 특이도를 가진 선별 검사 방법을 이용하여 65세 이상의 미국인 3,500만 명 중 췌장암 환자 2만 8,000명을 진단하려면 2만 6,600명을 진단 할 수 있으나 174만 8,600예의 위양성 검사의 결과를 낳게 되고 위양성 수/참양성 수 비는 65에 이른다.
2) 질병
(1) 만성 췌장염: 만성 췌장염과 췌장암과의 연관성은 많 은 역학 연구에서 규명되어 왔는데 두 질환은 빈번하게 같 이 존재한다.15-18 감별진단이 어려우며 췌장암으로 인해 췌 장염이 올 수 있어 특발성 췌장염의 경우 췌장암이 원인일 가능성도 염두에 두어야 한다. 암종으로 인한 주췌관의 폐 색으로 상부에 섬유화가 야기되며, 암종 주위의 비특이적 인 염증으로 인해 흡인 세포검사에서 자주 암세포가 음성 으로 나온다. 2년 이상 추적 관찰한 경우 췌장암의 위험도 는 16∼26배, 5년 이상 추적 관찰한 경우 13∼14배이며, 10 년마다 약 2%의 누적위험도로 보고되며 20년 간 4∼5%의 보고도 있다.19 성별이나 췌장염의 원인과는 독립적인 위험
인자이다. 또한 심한 정도나 기간과도 무관한 것으로 여겨 진다. 하지만 전체 만성 췌장염의 약 3∼5%에서만 췌장암 이 발생한다.
유전성 췌장염(hereditary pancreatitis)은 상염색체우성으 로 유전하며 80%의 투과도를 보인다. 혈연관계를 가진 가 족 중에서 2대 또는 그 이상에서 20대 이전(평균 13.9세)에 반복적인 췌장염이 나타난다. 이 중 약 70%에서 7q35염색 체의 cationic trypsinogen 유전자(PRSS1) 변이가 나타난다고 밝혀져 있으며 trpysinogen의 조기 미성숙 활성화와 관련이 있다. 이들에서 췌장암의 위험도는 대조군 연령보다 53∼
70배에 이르며 40세 이후 급격히 증가한다.20 일생 동안 약 40%까지 췌장암이 발병하는 것으로 알려져 있고(평균 56.9 세) 췌장암 발생에 만성 췌장염의 기간(40년 이상)과 정도 가 중요하며 현재 알려진 췌장암의 가장 고위험군 중 하나 이다. 아직 우리나라에는 보고가 없으나 가까운 일본에서 는 보고된 바가 있다.21
열대성 췌장염(tropical pancreatitis)은 복통, 췌관내 큰 결 석, 소아나 청년기의 당뇨병을 특징으로 하고 가족력이 없 는 남부인도나 사하라 아프리카지역에서 발생하는 원인 모 르는 췌장염으로 이들에서 췌장암의 위험도는 5∼100배에 이른다.22
Table 1. Risk factors for pancreatic cancer14
ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ
Disorder Risk (fold) Remarks
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Age 20 Exponential increase in risk with age
Risk for persons >50 year about 20 times greater than for persons <50 year
Sex 1.3 Male-to-female ratio 1.3:1
Race 1.5 Black-to-white ratio 1.5:1
Diet High-fat, high-caloric diets increase risk
Fresh fruits, vegetables, and fiber lower the risk Alcohol, coffee not generally considered to be a risk Smoking 2 Smokers have at least a 2-fold increased risk
Offers best opportunity for preventive strategies Pancreatitis All types of pancreatitis increase risk
But pancreatitis explains only about 3∼5% of all cases -Hereditary 53∼70 Lifetime risk 30∼40%
-Tropical 5∼100 Biopsy-proven or all suggestive cases -Chronic 13∼26 Patients followed-up >2 year; 16∼26 fold
Patients followed-up >5 year; 13∼14 fold Cumulative risk 2% for decade
Family history 3∼5 Lifetime risk 5% for first-degree relatives of PC* cases 18∼57 ≥2 or 3 first degree relatives
Diabetes Causal relationship not proven
Diabetes can be an early manifestation of PC*
-Long-standing 2 Diabetes >5 year
-Recent-onset 10 >50 year of age within 3 years of onset of diabetes
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
*PC = Pancreatic cancer.
(2) 당뇨병: 당뇨병은 오래 전부터 췌장암과의 관련성이 알려져 왔으나 췌장암의 초기 소견인지 또는 췌장암의 위 험인자인지는 확실치 않다.23-28 당뇨병에서 생기는 암종 중 췌장암은 5∼20%를 차지한다. 다기관 연구에서 5년 이상 오래 지속된 2형 당뇨병에서 2.0배(95% 신뢰구간 1.2∼2.2) 정도의 위험도를 보고하였으나29 흡연, 체중 등의 변수를 배 제할 수 없어 현재로는 오래된 당뇨병과 췌장암은 연관성 이 있다기보다는 동반되는 것으로 여겨지며 연관성이 있다 고 해도 약하다고 여겨진다. 따라서 모든 오래된 당뇨병 환 자에서 선별검사는 적절치 못하다.14 50세 이상의 당뇨병 환 자는 일반인보다 위험도가 10배 높다는 보고도 있어, 고령 에서 발병하고 비교적 일찍 insulin을 요하거나 당뇨병 가족 력이 없거나 비교적 마른 체형 등의 비전형적인 임상상을 보이는 경우 췌장암을 의심할 수 있으나30 이러한 임상상만 으로 분명하게 췌장암과 구분할 수 없다.14 췌장암의 50∼
80%에서 당불내성과 당뇨병이 발생하는데 대개의 경우 췌 장암 진단 2년 내에 당뇨병이 진단되어 시기적으로 연관성 이 있다. 이들에서 인슐린 저항성과 고인슐린 혈증이 관찰 된다. 췌장암은 두부 및 체부에 빈번하나 베타세포는 미부 에 많이 분포하므로 췌장암에 의한 직접적인 파괴보다는 인슐린에 대한 민감성 저하와 당뇨유발 인자분비 같은 2차 적인 내분비기능 장애로 당뇨병이 발생되는 것으로 생각된 다. 많은 경우에서 수술 후 개선된다. 2형 당뇨병과 췌장암 에 의해 유발된 당뇨병을 감별할 혈액 표지자가 없으므로 췌장암에 기인한 당뇨병은 대개 췌장암 진단 후에 발견된 다.31
(3) 기타 질환들: 낭성 섬유증은 열성 유전 질환으로 90%
에서 소아 때부터 췌장부전 증상이 나타난다. 치료의 발달 로 오래 살게 되면서 췌장암 발생이 늘어나고 있으며 위험 인자로 생각된다.
담석이 관련 있다는 보고도 있으나 최근에는 담석이나 담낭절제술이 관련 없다는 보고들이 많으며 췌장암과 담석 질환의 증상이 비슷하고 고령이나 비만인에서 담석 환자가 많아 연관성이 있다기보다는 동반되는 것으로 여겨진다.
소화성 궤양이나 위절제 수술과 관련 있다는 보고도 있 으나 최근에는 관련 없다는 보고들이 많으며 흡연이 소화 성 궤양에도 위험인자이므로 불확실하다.27,32
Salmonella, Helicobacter pylori 등도 보고가 있으나 역시 불확실하다.
Cytochrome P-450이나 N-acetyltransferase, UDP Glucuro- nosyltransferase (UGT1A7) 효소의 유전자 다형성(polymor- phism)과의 관련보고도 있다.33-35
3) 환경적 요소들
(1) 흡연: 흡연은 거의 모든 보고에서 일정하게 관찰되는 췌장암 발생의 잘 알려진 독립적 위험인자이다.36 1985년 International Agency for Research on Cancer (IARC)에서 흡연 은 췌장암의 중요한 원인인자라고 규정하였다. 췌장암의
20∼30%가 흡연과 관련이 있으며 흡연자에 있어 췌장암 상 대적 발생 위험도는 비흡연자에 비해 1.6∼3.1배이고 그 위 험성은 흡연량에 비례한다고 한다. 폐암처럼 흡연 20년 후 에 췌장암이 증가하며 금연 후 10∼15년이 지나야 췌장암 발생위험도가 점차 감소하여 비흡연자와 동일해진다고 한 다.37 유전성 췌장염환자에서 흡연하는 경우에 2∼150배에 이르며 비흡연자에 비해 20년 일찍 발생한다.38 또한 가족력 이 있는 췌장암환자에서 3∼8배 더 위험도를 증가시킨다.39 흡연이 췌장암을 발생시키는 기전으로는 담배 내의 발암물 질 중의 하나인 nitrosamine이 혈액 또는 담즙에 의해 췌장 으로 운반되어 발생하는 것이 아닌가 추측된다.40 (2) 알코올: 과도한 음주가 만성 췌장염의 중요한 원인이 므로 이론적으로는 위험인자일 수 있으나 음주자의 경우 대부분 흡연도 많이 하기 때문에 음주만의 효과를 밝히기 어렵다. 최근에는 관련없다는 보고들이 많아 현재로는 연 관성이 불확실하며, 연관성이 있다고 해도 약하다고 여겨
진다.41,42 일단 만성 췌장염이 발생하면 알코올 같은 췌장염
의 원인인자를 제거하여 췌장암의 위험을 예방하거나 줄이 는 증거는 없다.
(3) 커피: 1981년 커피 소비량과 췌장암의 발생 사이에 상 관관계가 있다고 보고한 이후 많은 연구들이 있었지만 최 근에는 관련없다는 보고들이 많으며 직접적인 연관성은 없 는 것으로 생각되고 있다.42 최근에는 K-ras 유전자 변이가 커피와 관련성이 있다는 보고도 있다.
(4) 음식: 여러 역학 연구들에서 과도한 열량, 지방, 탄수 화물 섭취, 높은 체질량지수가 췌장암의 위험도를 높이며 과일, 야채 등이 췌장암의 위험도를 낮추는 경향이 있으나 연구마다 일정하지 않아 단정적으로 얘기하기는 어렵다.43 연관성이 애매한 것은 아마도 섭취된 발암물질과 췌장 자 체 사이에 직접적인 접촉기회가 없는 것에 기인한다고 생 각된다.
(5) 직업 및 화학물질: 췌장암 발생의 위험성이 있다고 거 론되었던 것으로는 화학물질취급자, 코르크 제조업자, 제재 소 직원, 금속취급업자, 광부, 세탁소 업자, 전기부품 제조 업자, 고무공장 근로자, 용매제, 살충제, 휘발유 및 관련물 질, DDT와 naphthylamine, benzidine 등이 있다.33 그러나 논 란이 있으며 연관성이 있다고 해도 5% 미만으로 약하다고 여겨진다.
4) 유전적 소인
췌장암 환자의 5∼10%에서 관련된다고 생각된다.44-46 췌장암은 몇몇 유전성 질환군과 연관되어 있는데47 이는 유전성 췌장염, 유전성 비용종성 대장암, 가족성 선종성 용 종증, Gardener 증후군, Peutz-Jeghers 증후군, 린다우병, 신경 섬 유종증, 혈관확장성운동실조증, 제1형 다발성내분비종 양증 등이다. 국내에는 유전성 비용종성 대장암 환자에서 췌장암발생의 보고가 있으며48 이외에도 가족성 선종성 용 종증, Peutz-Jeghers 증후군 등은 국내에서도 경험할 수 있어
주의를 요한다(Table 2).
일등친(first degree relative)의 가족력이 있으면 3∼6배의 위험도 및 일생 동안 5%의 위험도를 갖는다.46 특이한 암증 후군이 알려지지 않으면서 췌장암발생이 높은 가족들이 있 으며 이들의 분자생물학적 병인은 다양하다. 아직 가족성 췌장암(familial pancreatic cancer)의 표준화된 정의는 없으나 염색체 4q32-34의 이상이 제기되었고49 BRCA2나 p16 유전 자 변이가 일부에서 관련됨이 보고되었다.46 하지만 대부분 에서는 아직 특별한 유전적 이상이 확인되지 않았다. 이들 에서의 췌장암의 위험도는 가족에서의 췌장암 환자수, 혈 연 정도, 발병연령 등에 따라 다르나50 first degree relative에 서 2명 또는 3명 이상의 췌장암 환자가 있는 경우(가족성 췌장암 증후군) 1명만 있는 경우보다 18배 또는 56배(10만 명당 301명)의 위험도 및 일생 동안 20%까지의 위험도를
갖는다.51,52 추후 특이적인 유전자 변이와 분자생물학적 발
전이 도움을 줄 것으로 생각된다.
4. 췌장암의 예방 및 조기검진
췌장암은 일단 진단되면 완치의 가능성이 2∼4% 이하인, 예후가 매우 불량한 암이므로 예방이 최선이라 하겠다.53 췌 장암의 발생원인 중 흡연이 가장 유력하므로 금연이 가장
중요한 췌장암 예방책이다. 적절한 체질량지수를 유지하고 기름진 육류, 커피의 섭취를 줄이고 식물성 단백질, 과일, 채소를 충분히 섭취하는 것이 다른 질환의 예방에도 도움 이 되므로 추천된다. 하지만 췌장암을 예방하는 확실한 약 제는 아직 없다.54,55
췌장은 유방, 자궁경부, 위장, 대장, 간 등과 달리 접근이 어렵고, 쉽고 정확한 비침습적 검사가 없으며 유병률이 낮 아 선별검사는 의미가 없다. 또한 유전성 췌장염 같은 고위 험군의 경우도 만성 췌장염이 동반되어 감별이 매우 어려 우며 고위험군에서 추적검사하여도 생명연장이 불과 몇 개 월이라는 보고도 있다.56 또한 1∼2 cm 이하의 소췌장암을 발견했다 하더라도 다른 조기암들보다 예후가 훨씬 좋지
않다.57,58 하지만 최근 일부 고위험군(가족성 췌장암)에서
추적검사로 전구 병변을 발견, 수술로 췌장암을 예방하였 다는 보고가 있고,59 향후 영상진단법 및 분자생물학적 발전 으로 새로운 종양표지자의 개발 및 치료법의 발전이 기대 된다.
결 론
췌장암은 우리나라에서 전체 암종 중 9위를 차지하며 점 Table 2. Inherited diseases with an increased risk of pancreatic cancer47
ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ
Disorder Genes identified Risk (fold) Mode of involvement
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ HP* PRSS1 (in ∼70%) 53∼70 Autosomal dominant, point mutations, ∼80% penetrance
(7q35)
CF† CFTR ∼5 Autosomal recessive, point mutations (both alleles),
(7q31) mutations in 5% of the population
FPC‡ Unknown Unknown Autosomal dominant, reduced penetrance, lifetime risk <5%
FAMMM§ CDKN2A (9p21) 13∼65 Autosomal dominant, point mutations, lifetime risk 15∼20%
CDK4
Peutz-Jeghers STK11/LKB1 Up to 132 Autosomal dominant, splice-site and
syndrome (19p13) intragenic-sequence mutations, lifetime risk 12%
Familial breast BRACA1/BRACA2 Unknown/ Autosomal dominant, reduced penetrance, lifetime risk 3∼10%
cancer (13q12-13) 3.5∼10
AT∥ ATM Unknown Autosomal recessive, point mutations, mutations in 0.2∼1% of population
(11q22-23) lifetime risk <5%
HNPCC¶ hMLH1, hMSH2, Unknown Autosomal dominant, point mutations, mismatch repair genes, hMSH6, hPMS1, lifetime risk <5%
hPMS2 (2p, 3p)
FAP** APC (in∼80%) 4.5 Autosomal dominant, point mutations, genomic rearrangements, lifetime risk
(5q12-21) <5%
Li-Fraumeni TP53 (in∼50%) Unknown Autosomal dominant, point mutations, lifetime risk 5%
syndrome (17p13)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
*HP = Hereditary pancreatitis; †CF = Cystic fibrosis; ‡FPC = Familial pancreatic cancer; §FAMMM = Familial atypical multiple mole melanoma; ∥AT = Ataxia-telangiectasia; ¶HNPCC = Hereditary nonpolyposis colon cancer; **FAP = Familial adenomatous polyposis.
차 지속적으로 증가하고 사망률이 전체 암종 중 5위를 차지 하여 중요하면서도 어려운 질환이다. 남자에서 더 많고 고 령에서 잘 발생한다. 췌장암 발생률의 증가는 유전적 요인 이외에도 환경적 요인이 복합적으로 관여함을 시사하며 가 장 잘 알려진 위험인자는 흡연, 만성 췌장염 및 일부 유전적 질환이다. 흡연이 20∼30%에서 관여하며 금연이 가장 중요 한 췌장암 예방책이다. 위험인자로 확실치는 않으나 과도 한 칼로리 섭취 금지 및 적정한 체중유지나 체중 감량이 추천된다. 향후 분자 생물학적 연구의 발전으로 조기진단 및 생존율의 향상이 기대된다.
참 고 문 헌
1) Soler M, Porta M, Malats N, et al. Learning from case reports:
diagnostic issues in an epidemiologic study of pancreatic cancer. J Clin Epidemiol 1998;51:1215-1221.
2) Alanen KA, Joensuu H. Long-term survival after pancreatic adenocarcinoma-often a misdiagnosis? Br J Cancer 1993;68:
1004-1005.
3) Ghadirian P, Lynch HT, Krewski D. Epidemiology of pancre- atic cancer: an overview. Cancer Detect Prev 2003;27:87-93.
4) Tominaga S, Kuroishi T. Epidemiology of pancreatic cancer.
Semin Surg Oncol 1998;15:3-7.
5) Bramhall S, Dunn JA, Neoptolemos JP. Epidemiology of pancreatic cancer. In: Berger HG, Warshaw AL, Buchler MW, Carr-Locke DL, Neoptolemos JP, Russell C, Sarr MG, editors.
The pancreas. 1st ed. Cambridge: Blackwell Science Ltd;
1998.889-906.
6) Andren-Sandberg, Backman PL. Demography and epidemio- logy of pancreatic cancer. In: Dervenis CG, Bassi C, editors.
Pancreatic tumors: Achievements and prospective. 1st ed.
Stuttgart: Georg Thieme Verlag; 2000.16-26.
7) Ahlgren JD. Epidemiology and risk factors in pancreatic can- cer. Semin Oncol 1996;23:241-250.
8) Michaud DS. The epidemiology of pancreatic, gallbladder, and other biliary tract cancers. Gastrointest Endosc 2002;56(suppl):
195S-200S.
9) Oomi K, Amano M. The epidemiology of pancreatic diseases in Japan. Pancreas 1998;16:233-237.
10) Inoue M, Tajima K, Takezaki T, et al. Epidemiology of pancreatic cancer in Japan: a nested case-control study from the Hospital-based Epidemiologic Research Program at Aichi Cancer Center (HERPACC). Int J Epidemiol 2003;32:257-262.
11) Pasquali C, Sperti C, Filipponi C, Pedrazzoli S. Epidemiology of pancreatic cancer in Northeastern Italy: incidence, resecta- bility rate, hospital stay, costs and survival (1990-1992). Dig Liver Dis 2002;34:723-731.
12) Levi F, Lucchini F, Negri E, La Vecchia C. Pancreatic cancer mortality in Europe: the leveling of an epidemic. Pancreas 2003;27:139-142.
13) Sahmoun AE, D'Agostino RA Jr, Bell RA, Schwenke DC.
International variation in pancreatic cancer mortality for the period 1955-1998. Eur J Epidemiol 2003;18:801-816.
14) Pongprasobchai S, Chari ST. Management of patients at high risk for pancreatic cancer. Curr Treat Options Gastroenterol 2003;6:349-358.
15) Talamini G, Falconi M, Bassi C, Mastromauro M, Salvia R, Pederzoli P. Chronic pancreatitis: relationship to acute pan- creatitis and pancreatic cancer. JOP 2000;1(suppl):69S-76S.
16) Maisonneuve P, Lowenfels AB. Chronic pancreatitis and pan- creatic cancer. Dig Dis 2002;20:32-37.
17) Malka D, Hammel P, Maire F, et al. Risk of pancreatic adeno- carcinoma in chronic pancreatitis. Gut 2002;51:849-852.
18) Talamini G. Chronic pancreatitis and pancreatic cancer. In:
Dervenis CG, Bassi C, editors. Pancreatic tumors: Achieve- ments and prospective. 1st ed. Stuttgart: Georg Thieme Verlag;
2000.63-78.
19) Whitcomb DC, Pogue-Geile K. Pancreatitis as a risk for pan- creatic cancer. Gastroenterol Clin North Am 2002;31:663-678.
20) Lowenfels AB, Maisonneuve P, Whitcomb DC. Risk factors for cancer in hereditary pancreatitis. Med Clin North Am 2000;84:565-573.
21) Nishimori I, Kamakura M, Fujikawa-Adachi K, et al. Muta- tions in exons 2 and 3 of the cationic trypsinogen gene in Japanese families with hereditary pancreatitis. Gut 1999;44:
259-263.
22) Chari ST, Mohan V, Pitchumoni CS, Viswanathan M, Madana- gopalan N, Lowenfels AB. Risk of pancreatic carcinoma in tropical calcifying pancreatitis: an epidemiologic study. Pan- creas 1994;9:62-66.
23) Kim TD, Oh HJ, Kim KH, et al. Clinical characteristics of pancreatic cancer according to the presence of diabetes mel- litus. Korean J Gastroenterol 2004;43:35-40.
24) Park YJ, Kim GW, Oh EY, et al. Prevalence of diabetes mellitus in pancreatic cancer patients. J Korean Diabetes Assoc 2001;25:316-322.
25) Fisher WE. Diabetes: risk factor for the development of pan- creatic cancer or manifestation of the disease? World J Surg 2001;25:503-508.
26) Saruc M, Pour PM. Diabetes and its relationship to pancreatic carcinoma. Pancreas 2003;26:381-387.
27) Talamini G, Falconi M, Bassi C, et al. Previous cholecystectomy, gastrectomy, and diabetes mellitus are not crucial risk factors for pancreatic cancer in patients with chronic pancreatitis.
Pancreas 2001;23:364-367.
28) Bonelli L, Aste H, Bovo P, et al. Exocrine pancreatic cancer, cigarette smoking, and diabetes mellitus: a case-control study in northern Italy. Pancreas 2003;27:143-149.
29) Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. A meta-analysis. JAMA 1995;273:1605- 1609.
30) Ogawa Y, Tanaka M, Inoue K, et al. A prospective pancreato- graphic study of the prevalence of pancreatic carcinoma in
patients with diabetes mellitus. Cancer 2002;94:2344-2349.
31) Chari ST, Klee GG, Miller LJ, Raimondo M, DiMagno EP.
Islet amyloid polypeptide is not a satisfactory marker for detecting pancreatic cancer. Gastroenterology 2001;121:640- 645.
32) Van Rees BP, Tascilar M, Hruban RH, Giardiello FM, Ters- mette AC, Offerhaus GJ. Remote partial gastrectomy as a risk factor for pancreatic cancer: potential for preventive strategies.
Ann Oncol 1999;10(suppl):204S-207S.
33) Lowenfels AB, Maisonneuve P. Epidemiologic and etiologic factors of pancreatic cancer. Hematol Oncol Clin North Am 2002;16:1-16.
34) Ockenga J, Vogel A, Teich N, Keim V, Manns MP, Strassburg CP. UDP glucuronosyltransferase (UGT1A7) gene polymor- phisms increase the risk of chronic pancreatitis and pancreatic cancer. Gastroenterology 2003;124:1802-1808.
35) Li D. Molecular epidemiology of pancreatic cancer. Cancer J 2001;7:259-265.
36) Lowenfels AB, Maisonneuve P. Environmental factors and risk of pancreatic cancer. Pancreatology 2003;3:1-7.
37) Silverman DT, Dunn JA, Hoover RN, et al. Cigarette smoking and pancreas cancer: a case-control study based on direct interviews. J Natl Cancer Inst 1994;86:1510-1516.
38) Lowenfels AB, Maisonneuve P, Whitcomb DC, Lerch MM, DiMagno EP. Cigarette smoking as a risk factor for pancreatic cancer in patients with hereditary pancreatitis. JAMA 2001;
286:169-170.
39) Schenk M, Schwartz AG, O'Neal E, et al. Familial risk of pancreatic cancer. J Natl Cancer Inst 2001;93:640-644.
40) Schuller HM. Mechanisms of smoking-related lung and pancreatic adenocarcinoma development. Nat Rev Cancer 2002;2:455-463.
41) Silverman DT. Risk factors for pancreatic cancer: a case- control study based on direct interviews. Teratog Carcinog Mutagen 2001;21:7-25.
42) Villeneuve PJ, Johnson KC, Hanley AJ, Mao Y. Alcohol, tobacco and coffee consumption and the risk of pancreatic cancer: results from the Canadian Enhanced Surveillance Sys- tem case-control project. Eur J Cancer Prev 2000;9:49-58.
43) Michaud DS, Giovannucci E, Willett WC, Colditz GA, Stam- pfer MJ, Fuchs CS. Physical activity, obesity, height, and the risk of pancreatic cancer. JAMA 2001;286:921-929.
44) Hruban RH, Offerhaus GJ, Kern SE. Familial pancreatic cancer. In: Steele GD Jr, Phillips TL, Chabner BA, editors.
Pancreatic cancer. 1st ed. Hamilton: BC Decker Inc; 2001.
25-36.
45) Hruban RH, Petersen GM, Goggins M, et al. Familial pancre-
atic cancer. Ann Oncol 1999;10(suppl):69S-73S.
46) Lynch HT, Brand RE, Lynch JF, Fusaro RM, Kern SE. Hered- itary factors in pancreatic cancer. J Hepatobiliary Pancreat Surg 2002;9:12-31.
47) Wong T, Howes N, Threadgold J, et al. Molecular diagnosis of early pancreatic ductal adenocarcinoma in high-risk patients.
Pancreatology 2001;1:486-509.
48) Park JG, Park YJ, Wijnen JT, Vasen HF. Gene-environment interaction in hereditary nonpolyposis colorectal cancer with implications for diagnosis and genetic testing. Int J Cancer 1999;82:516-519.
49) Eberle MA, Pfutzer R, Pogue-Geile KL, et al. A new suscepti- bility locus for autosomal dominant pancreatic cancer maps to chromosome 4q32-34. Am J Hum Genet 2002;70:1044-1048.
50) Rulyak SJ, Lowenfels AB, Maisonneuve P, Brentnall TA. Risk factors for the development of pancreatic cancer in familial pancreatic cancer kindreds. Gastroenterology 2003;124:1292- 1299.
51) Goggins M, Canto M, Hruban R. Can we screen high-risk indi- viduals to detect early pancreatic carcinoma? J Surg Oncol 2000;74:243-248.
52) Tersmette AC, Petersen GM, Offerhaus GJ, et al. Increased risk of incident pancreatic cancer among first-degree relatives of patients with familial pancreatic cancer. Clin Cancer Res 2001;7:738-744.
53) Hart AR. Pancreatic cancer: any prospects for prevention?
Postgrad Med J 1999;75:521-526.
54) Simon B, Printz H. Epidemiological trends in pancreatic neo- plasias. Dig Dis 2001;19:6-14.
55) Howe GR. Epidemiology of cancer of pancreas. In: Steele GD Jr, Phillips TL, Chabner BA, editors. Pancreatic cancer. 1st ed.
Hamilton: BC Decker Inc; 2001.1-11.
56) Kern S, Hruban R, Hollingsworth MA, et al. A white paper:
the product of a pancreas cancer think tank. Cancer Res 2001;61:4923-4932.
57) Tsunoda T, Yamamoto Y, Kimoto M, et al. Staging and treat- ment for patients with pancreatic cancer. How small is an early pancreatic cancer? J Hepatobiliary Pancreat Surg 1998;5:128- 132.
58) Ishikawa O, Ohigashi H, Imaoka S, et al. Minute carcinoma of the pancreas measuring 1 cm or less in diameter-collective review of Japanese case reports. Hepatogastroenterology 1999;
46:8-15.
59) Kimmey MB, Bronner MP, Byrd DR, Brentnall TA. Screening and surveillance for hereditary pancreatic cancer. Gastrointest Endosc 2002;56(suppl):82S-86S.