접수: 2013년 3월 5일, 승인: 2013년 6월 10일 연락처: 박병주, 110-750, 서울시 종로구 창경궁로 136
보령빌딩 5층
한국의약품안전관리원
Tel: (02) 2172-6710, Fax: (02) 2172-6701 E-mail: bjpark@drugsafe.or.kr
Correspondence to: Byung-Joo Park, MD, MPH, PhD Korea Institute of Drug Safety and Risk Management, 136 Changgyeonggung-ro, Jongno-gu, Seoul 110-750, Korea Tel: +82-2-2172-6710, Fax: +82-2-2172-6701
E-mail: bjpark@drugsafe.or.kr
미국의 위조의약품 현황 및 예방활동
한국의약품안전관리원1, 서울대학교 의과대학 예방의학교실2
김현정1ㆍ정선영1ㆍ신주영1ㆍ정수연1ㆍ박병주1,2
The Current Status and Preventive Activities of Counterfeit Medicines in the United States
Hyun-jung Kim, BS
1, Sun-Young Jung, PhD
1, Ju-Young Shin, PhD
1, Sooyoun Chung, MD
1and Byung-Joo Park, MD, MPH, PhD
1,21
Korea Institute of Drug Safety and Risk Management,
2Department of Preventive Medicine, Seoul National University College of Medicine, Seoul, Korea
Counterfeit medicine is a global problem with significant consequences for public health and patient safety, in- cluding treatment failure and deaths. The World Health Organization estimates that 6 to 10% of the global medi- cine market is counterfeit. As the world’s largest market for pharmaceutical sales, counterfeit manufacturers and sellers have targeted the United States as its most profitable market. Unfortunately, there is little information about the current status of the counterfeit medicine. Because the counterfeit activity is very difficult to identify, trace, and combate, the US government and the private sector are trying to work in various fields of activity. To combat counterfeit drugs, the Food and Drug Administration (FDA) created a Counterfeit Drug Task Force to in- forming counterfeit drug issue to the public, particularly consumers, pharmacists, other health care professionals, wholesalers, and others involved in the US drug distribution system, FDA also educates these parties on ways to identify and report suspected counterfeit medical products to FDA through MedWatch system. And pharmaceut- ical companies, health professional associations, consumer groups, and other stakeholders, such as the National Association Boards of Pharmacy (NABP) and the Center for Safe Internet Pharmacies (CSIP) are collaborating with FDA. This review aims to introduce the current status and preventive activities of counterfeit medicines in the US and to discuss the possible ways to combate the counterfeit drugs. (JPERM 2013;6:79-86)
Key Words: Counterfeit medicines; Preventive activities; Pharmacovigilance
서 론
전 세계 의약품 거래의 6-10% (유럽의 약 1%, 아시아, 아 프리카, 라틴 아메리카의 10-30%, 러시아의 20%)가 위조의 약품(counterfeit medicine)으로 추정되고 있다.
1)특히 미국은
2011년 기준 3천억 달러 규모인 전 세계적으로의 가장 큰
제약시장으로서 위조의약품 유통의 타겟이 되고 있다.
2)미
국에서는 2010년 상용량의 3배 이상 전문약 성분(sibutra-
mine)이 포함된 비만치료제 ‘알리(Alli)’ 위조약 사건, 2012
년 활성성분이 전혀 포함되어 있지 않은 고가 항암제인 ‘아
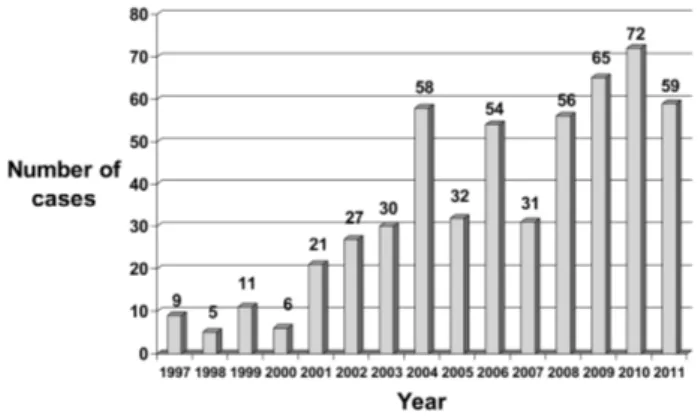
Figure 1. Counterfeit drug cases opened by FDA per fiscal year,
1997-2011. Adapted from http://www.fda.gov/ucm/groups/fdagov-pub- lic/@fdagov-afda-orgs/documents/document/ucm299777.pdf.Figure 2. Percentage of all suspects grouped by type of trade,
2003-2008. Adapted from http://www.fda.gov/downloads/Drugs/Drug- Safety/ DrugIntegrityandSupplyChainSecurity/UCM272150.pdf.바스틴(Avastin)’ 위조약 사건이 발생하여 그 심각성이 대대 적으로 알려졌는데, 이는 세계보건기구(World Health Orga- nization, WHO)에서 관심을 기울이는 개발도상국에서의 위 조의약품 문제 뿐만 아니라, 미국 등과 같은 의약선진국에 서도 위조약 문제가 심각함을 보여주고 있다.
3)미국 FDA법에서는 위조의약품을 ‘허가받지 않은 상표, 제품명, 인쇄물 등이 포함된 용기나 표기를 사용한 의약품, 또는 실제로 제조, 공정, 포장, 분배하지 않는 허가받지 않 은 제조사, 유통포장⦁분배회사를 통하여 포장 또는 배포된 의약품’으로 명시적으로 정의하고 있다.
4)의약품안전관리 측면에서 위조의약품은 상용량을 초과하는 약물 사용으로 인한 부작용 즉, 혈압상승, 뇌졸중, 심장발작 등의 심각한 문제가 발생할 소지가 있다.
5)특히 환자들은 위조의약품의 1차 피해자로서, 영구적인 장애나 생명의 위협을 받을 수도 있다.
1)위조의약품을 접하게 되는 경로는 크게 소비자 및 환자 가 낮은 가격 등의 이유로 알고도 찾아서 사용하는 경우와 유통 과정 중 유입된 위조의약품을 모르고 사용하는 경우로 나뉠 수 있다. 의사와의 상담을 원치 않거나, 낮은 가격 때 문에 위조의약품을 사용하려는 자들은 인터넷 등을 통하여 어렵지 않게 위조의약품을 접할 수 있다. 제 3국으로부터 정상적인 유통라인에 위조의약품이 유입됨으로서 노출될 수도 있다. 테러리스트 조직에서 1996년부터 2004년까지 중 국이나 동유럽 등지에서 가짜 비아그라(Viagra)를 받아서 미 국 전역에 분배했던 것이 한 예이다.
6)위조의약품 사건이 지속적인 사회적 문제로 제기됨에도 불구하고, 위조의약품의 규모나 이로 인해 발생하는 피해 현황을 파악하는 것이 쉽지 않다. 이는 위조의약품 사용으 로 인해 부작용이 발생하여도 처벌 등에 대한 두려움 때문 에 신고하는 사람이 적고, 위조의약품인지 모르고 사용하는 경우도 있기 때문이다.
위조의약품이 불법적으로 유통되는 것을 막기 위하여, 미 국 식품의약품안전청(Food and Drug Administration, FDA), 제약사, 민간단체 등에서 다각도로 활발한 예방대책을 수립 하고 있다. 우리나라에서도 불법적인 인터넷상거래, 보따리 상을 통한 위조의약품 유통이 발생하고 있다고 알려져 있으 며, 특히 위조약 문제가 범세계적인 문제임을 고려할 때
7)적절한 대응 방안을 마련할 필요가 있다. 이에, 본 고에서는 위조의약품 예방활동이 활발히 이루어지고 있는 미국 내 위 조의약품 현황과 정부 및 민간 차원의 예방활동을 소개하고 자 한다.
본 론
1. 미국의 위조의약품 현황
미국 FDA의 범죄수사국(Office of Criminal Investigations, OCI)에 의하면, 미국 위조의약품 적발건수는 1997년 9건에 불과했지만 2011년에는 59건으로 증가하는 추세를 보였으 며(그림 1),
8)2010년 위조의약품의 판매액은 2005년에 비해 92% 증가한 750억 달러에 이르고 있다.
9)또한, 2011년도에 발표된 OCI 예비보고서에 따르면, 미국 내 빈번하게 위조 및 변조되는 의약품은 Zyprexa, Viagra, Lipitor, Zoloft, Risperdal 로 신경정신과 약물이나 발기부전치료제 등이었고, 의약품 의 위조나 변조 주체는 86%가 개인이었으며, 도매업자가 27%, 약사가 13%, 의사가 9% 순으로 보고되었다(그림 2).
10)2. 미국의 위조의약품 예방활동
1) 미국연방정부 및 FDA의 위조의약품 관련제도
미국 내 위조의약품이 증가함에 따라, 치료 실패나 건강
문제 악화 등을 우려한 FDA에서는 2003년 위조의약품 태스
크포스(Task Force)팀을 결성하여 FDA와 기타 정부부처 및
민간 부문을 위한 가이드라인 및 권고사항을 개발하였으며,
Figure 3. E-pedigree system using RFID (Radio Frequency IDentifi-
cation) tags adapted from http://www.avatarpartners.com/upload/solu- tions/CounterfeitEpedigree.JPG.위조의약품 예방을 위하여 규제 강화, 유통 관리 강화, 위조 의약품 및 의약품 안전성에 대한 인식 강화를 위한 교육홍 보 등의 활동을 지속적으로 수행하고 있다.
(1) 위조의약품의 감시체계 법적 근거마련: 미국 FDA에 서는 위조의약품이 유통되는 가장 큰 원인으로 위조의약품 밀반입자들을 효과적으로 감시, 관리하지 못하는 것에 있다 고 보았다. 이에 2010년 미국 연방정부 담당관인 지식재산 집행조정관(Intellectual Property Enforcement Coordinator, IPEC)은 미국 FDA 뿐만 아니라, 세관 및 국경보호국(Customs and Border Protection, CBP), 이민관세집행국(Immigration and Customs Enforcement, ICE), 법무부(Department of Justice, DOJ), 국무부(Department of State, DOS), 미국국제개발부(US Agency for International development) 등 관련기관 전문가를 모아
‘위조의약품 전담실무단(Counterfeit Pharmaceutical Interagen- cy Committee)’을 구성하였다. 이어서 2011년 3월에 위조의 약품 전담실무단에서는 미국으로 밀반입되거나 미국 전역 에서 유통되고 있는 위조의약품을 근절하기 위해 정부가 취 해야 할 구체적인 조치를 기재한 보고서를 작성하여 연방의 회에 제출하였다.
11)위조의약품 전담실무단에서 구성한 보고서에는, 위조 및 불법 의약품의 식별, 조사, 폐기와 관련하여 직면한 사안들, 협력을 통한 불법 인터넷 약국의 확산 방지, 전 세계의 위조 의약품 문제를 다루기 위한 작업 개선 방안, 일반대중의 인 식 개선 방법, 입법적 권고사항들을 담고 있다. 특히, ‘지식재 산집행 입법권고에 대한 행정부 백서(Administration’s White Paper on Intellectual Property Enforcement Legislative Reco- mmendations)'에서 의약품 제조업체들이나 수입업자들에게 알려져 있던 위조의약품을 발견한 경우나 그러한 위조품으 로 초래될 수 있는 건강상 위험에 대해 알고 있는 경우 이 를 FDA에 공지할 의무를 부과하였으며, 의약품 관련 범죄 에 대한 형사 처벌 강화 및 민형사상의 몰수 권한 부여, 의 약품 추적조회 시스템 등을 채택할 것을 권고하였다.
12)이 에 2012년 7월 오바마 대통령은 ‘식품의약품관리안전 및 혁 신법(Food and Drug Administration Safety and Innovation Act, FDASIA)'서명을 통해, 위조의약품의 법적인 감시체계 근거 를 마련하고, 이를 공표하였다. 이 법안에 포함된 내용은 위 조의약품 밀매업자에 대한 처벌을 강화하는 것 뿐만 아니 라, 관련 지침 및 정책 강령의 마련, 미국 FDA에 2,500달러 이하의 소포장 위조의약품에 대한 파기권한 부여, 의약품 위조 및 도난 사항에 대한 사항을 제약회사가 FDA에 의무 보고하게 하는 등의 사항을 규정하였다.
13)(2) 유통관리의 강화: 의약품 유통망의 복잡성과 통합관 리체계의 부족 역시 위조의약품 유통의 문제점으로 지적되 어 왔다. 미국 내 소규모 도매업체가 증가하였고,
14)의약품 관리단위가 주(state)단위로 분산되어 있어 연방정부 차원의
통합적인 관리시스템이 부족하였다.
8)제조업자에서 1차 도 매상으로, 이를 2차 도매상 또는 재포장자를 통해 약국으로, 약국에서 소비자로 전달되는 유통과정의 전반에 걸쳐 위조 의약품의 위험에 노출되어 있었다. 의약품 보관 창고 등에 서 훔쳐진 합법적인 약이 불법적으로 보관 및 관리되다가 도매상이나 약국에 판매되는 경우, 약국에서 제약사 영업사 원으로부터 제공받는 무료샘플을 불법적으로 재포장을 거 쳐 판매하는 경우, 타국으로부터 유입되는 경우도 있다.
15)특히 인터넷약국이 합법적인 미국에서는 인터넷을 통해 제 조나 유통이 불투명한 위조의약품을 접하는 경우가 상당하 다. 위조업자들은 품질 보증을 위한 우수제조기준(Good Ma- nufacturing Practice, GMP)을 만족하지 못하는 열악하고 영 세한 환경에서 위조의약품을 제조함으로써 가격을 낮추지 만, 이에 대한 처벌 및 규제체계는 미흡한 실정이었다.
이에 미국 FDA는 1987년 제정된 ‘처방의약품의 마케팅에 관한 법률(Prescription Drug Marketing Act, PDMA)’을 근거로 미국 내 위조의약품의 유통을 방지하기 위해, 의약품이 제조 업자에서부터 환자에 이르기까지 유통 경로를 기록하도록 했다. 2004년, FDA는 ‘Combating Counterfeit Drugs’이라는 제 목의 보고서에서 2007년까지 RFID (Radio Frequency IDenti- fication) 기술을 제약산업에 적용하여 사용하는 것을 목표로 하였고, 이를 달성하기 위해 ‘RFID 연구와 파일럿 프로그램 의 적용에 대한 제약업계의 가이드라인’을 발표하였으며, RFID Workgroup을 조직하여 RFID 적용을 모니터링하고 장 기정책 개발을 위해 관련 자료를 축적하였다.
16)RFID는 무 선 전파를 이용하여 객체를 자동으로 식별하는 기술로, 이 를 활용하여 약품코드, 제조사, 도매상, 약국 등 유통과정 전반에 걸친 정보를 저장한 것이 전자계보기록(electronic pedigree, e-Pedigree)이다(그림 3). 캘리포니아 주의 경우, 2004년부터 의약품 유통시 e-Pedigree 법안을 적용하였고, 2015년부터 의약품의 50%, 2016년에 나머지 50%를 적용하 고자 계획하고 있다.
17)2007년 FDA개정법(Food and Drug Administration Amend-
ments Act, FDAAA)에서는 처방약을 확인하고 추적하는 표 준을 개발하도록 요구하였다. 이에 FDA는 2010년 처방약에 대한 표준식별자(Standardized Numerical Identification, SNI) 개발에 대한 가이드라인을 배포하였고,
18)2011년 2월에는
‘Track and Trace’라는 주제로 위조의약품으로부터 안전성을 확보하기 위한 유통추적시스템에 대한 공공 워크샵을 개최 하기도 하였다. 더 나아가 유통추적시스템의 보완을 위하여 의약품의 부패 또는 품질저하를 야기 시킬 수 있는 보관환 경조건의 변화를 반영하는 e-pedigree 기술 역시 개발할 예 정이다.
19)또한, ‘WHO/FDA 상호양해협약’을 체결하여 불 법, 위조의약품과 유통망에 대한 감시와 모니터링을 위한 국제협력체계를 마련하였다.
20)(3) 위조의약품 부작용 신고제도: 미국 FDA의 범죄수사 국(Office of Criminal Investigations, OCI)은 보건의료전문가, 소비자 및 의약품공급망 관련자들로 하여금 위조의약품 의 심사례를 자발적으로 신고하도록 하고 있다.
21)환자가 사용 하는 의약품이 위조의약품으로 의심되는 경우, 의약품을 구 입한 약국에 연락하기를 권장하고 있으며, 보건의료전문가 가 위조의약품 의심사례를 파악한 경우 MedWatch 시스템을 통하여 신고하도록 하고 있다. MedWatch 시스템은 중대한 유해사례, 의약품의 질적 문제, 투약오류, 치료실패 등 의약 품에 대한 의심사례를 신고하는 체계로서 홈페이지, 전화, 팩스 등의 방법을 통해 신고를 할 수 있다. 위조의약품 여부 에 대한 정보는, 유해사례가 보고된 의약품에 대한 위해-이 익 평가를 실시할 때 중요한 정보 중 하나로 고려된다.
22)또 한, OCI는 2003년부터 2008년까지 미국 내 위조의약품 실태 조사(위조의약품 유입경로, 다빈도 위조의약품, 위조업자 유형 등)를 실시하여 2011년에 예비보고서를 발간하였으 며,
10)뉴스레터를 통해 위조의약품 사례를 공유하고 후속조 치에 대한 내용을 대중과 의료전문인에게 알리고 있다. 뉴 스레터에는 위조의약품의 유입경로와 성분을 구체적인 예 시와 함께 전파하였다. 예를 들어 FDA와 로슈의 공조수사 를 통한 아바스틴 위조의약품 적발사례를 통하여 위조약과 진짜약을 구별할 수 있는 방법, 위조약을 유통시킨 불법 외 국 도매상, 위조약 구매시 위험성, 의심되는 위조약에 대한 신고 및 위조의약품으로 인해 발생한 유해사례를 Medwatch 에 보고하는 방법 등을 포함하고 있다.
3)2) 안전한 인터넷약국 이용을 위한 위조의약품 예방활동 미국에서는 2012년 9월 말 현재 약 10,000개 이상의 인터 넷약국이 영업 중이나, 이 중에 미국 내에서 정한 약사법 등 관련 규정을 준수하는 곳이 전체의 3%에 지나지 않는 실정 이다. 나머지 97%는 미국 내 위치하지 않거나, 처방전을 요 구하지 않거나, FDA 미승인 약을 제공하거나, 위조 또는 변 조된 의약품을 제공하는 등의 문제가 있었다.
23)또한, 불법
인터넷약국에서 의사 처방이 필요한 약 뿐만 아니라 안전성 이슈로 인해 퇴출된 약 등 잠재적으로 위험성이 높은 의약 품을 판매하고 있어, 이로 인한 안전성 문제가 생길 가능성 이 제기되기도 하였다.
24)이에 따라, FDA와 유관단체에서는 안전한 인터넷약국 이용을 도모하는 활동이 활발히 수행되 고 있다.
(1) FDA의 인터넷약국 안전사용 캠페인 ‘BeSafeRx’:
미국은 인터넷약국이 합법적으로 개설, 운영되는데, 인터넷 약국은 낮은 가격과 익명성이 보장되기 때문에 많은 사람들 이 찾게 된다. 이 경우 대부분의 사람들은 효과 부족이나 약 물유해반응을 신고하지 않으며, 따라서 실마리정보 검색이 나 적절한 조치를 취하는 어려움이 있다. 반면, 미국 내 인 터넷약국 중 불과 3%만이 합법적으로 운영되고 있으므로, 불법 인터넷약국을 통해 유통되는 위조의약품으로 인한 건 강위험과 공중보건위협에 노출될 가능성이 매우 높고, 이에 대한 대중의 인식 계몽이 필요한 실정이다. FDA는 소비자 스스로 인터넷약국의 진위를 가리는 것이 중요하다고 판단하 여, 안전한 인터넷약국 이용을 위한 대국민 캠페인인
‘BeSafeRx’를 2012년 9월부터 실시하고 있다.
25)이 캠페인에 서는 동영상이나 리플렛을 통해 위조의약품으로 인한 심각 한 유해사례 등 건강문제를 경고하고 있으며, 안전한 인터 넷약국을 쉽게 확인할 수 있는 Quick Response (QR) code 스 티커, 손바닥 카드(Palm card) 등을 배포하고, 합법적인 인터 넷약국 검색 기능을 제공하고 있다. 캠페인을 통해, 의사 처 방전 없이 전문의약품을 취급하거나, 실제보다 너무 낮은 가격에 의약품을 판매하며, 스팸 메일을 발송하고, 미국 내 위치하지 않고, 허가 받지 않았다는 것은 불법 인터넷약국 의 징조임을 알리고 있다. 반면, 안전한 인터넷약국은 의사 처방전을 항상 요구하며, 미국 내 물리적인 주소와 전화번 호를 제공하고, 해당 주 약사회 허가를 받은 곳이라고 홍보 하고 있다. 또한 전문가 홍보물을 통해 환자들의 인터넷약 국 이용 실태를 알리고, 인터넷약국을 이용하는 환자와의 상담 매뉴얼 등을 제공하며, 환자가 BeSafeRx 사이트에 방 문하도록 독려하고 있다.
(2) 안전한 인터넷약국 센터(The Center for Safe
Internet Pharmacies, CSIP): 민간단체인 CSIP는 교육
및 자발적 집행(도메인 등록 취소, 불법 인터넷약국임이 확
인될 경우 지불 시스템 철수, 불법 인터넷약국의 광고 거절
포함)을 통해 불법 인터넷약국을 근절하기 위한 목적으로
2012년 7월 설립된 비영리 조직이다.
26)CSIP는 불법 인터넷
약국에 대한 정보를 공유하고, 적절한 시기에 법제 집행을
지원하며, 안전한 인터넷약국 웹사이트 목록을 공정하게 정
비하고, 정부와 법제부, 공중 보건 및 소비자 단체와 협력하
여 안전한 인터넷약국을 어떻게 찾는지 교육하고 있다. 웹
사이트를 통해 해당 인터넷약국이 합법적인지 확인할 수 있
Table 1. Verified internet pharmacy practice sites criteria
Licensure and policy maintenance
1. Provide NABP with the information necessary to verify that the VIPPS pharmacy is licensed or registered in good standing to operate a pharmacy and/or engage in the practice of pharmacy with all applicable jurisdictions;
2. Provide NABP with the information necessary to verify that all persons affiliated with the site, including those affiliated through contractual or other responsible arrangements, that are engaging in the practice of pharmacy are appropriately licensed or registered and in good standing in all applicable jurisdictions;
3. Maintain and enforce a comprehensive policy and procedure that documents how the pharmacy's policies and procedures are organized, authorized for implementation, revised, retired and archived; and
4. Comply with all applicable statutes and regulations governing the practice of pharmacy where licensed or registered, and comply with the more stringent law or regulation as determined by conflicts of law rules. VIPPS pharmacies must maintain and enforce policies and procedures that address conflicts of law issues that may arise between individual states or between state and federal laws and regulations. Said policies and procedures must assure compliance with applicable laws including generic substitution laws and regulations, and must prohibit unauthorized therapeutic substitution from occurring without necessary patient or prescriber authorization and outside of the conditions for participation in state or federal programs such as Medicaid.
Prescriptions
5. Maintain and enforce policies and procedures that assure the integrity, legitimacy, and authenticity of the prescription drug order and seek to prevent prescription drug orders from being submitted, honored, and filled by multiple pharmacies. Maintain and enforce policies and procedures that assure that prescription medications are not prescribed or dispensed based upon telephonic, electronic, or online medical consultations without there being a pre-existing patient-prescriber relationship that has included an in-person physical examination.
Patient information
6. Maintain and enforce policies and procedures ensuring reasonable verification of the identity of the patient, prescriber, and, if appropriate, caregiver, in accordance with applicable state law;
7. Obtain and maintain in a readily accessible format, patient medication profiles and other related data in a manner that facilitates consultation with the prescriber, when applicable, and counseling of the patient or caregiver;
8. Conduct a prospective drug use review (DUR) prior to the dispensing of a medication or device in accordance with applicable state law; and
9. Maintain and enforce policies and procedures to assure patient confidentiality and the protection of patient identity and patient-specific information from inappropriate or non-essential access, use, or distribution while such information is being transmitted via the Internet and while the pharmacy possesses such information.
Communication
10. Maintain and enforce policies and procedures requiring pharmacists to offer interactive, meaningful consultation to the patient or caregiver;
11. Maintain and enforce policies and procedures establishing a mechanism for patients to report, and the VIPPS pharmacy to take appropriate action regarding, suspected adverse drug reactions and errors;
12. Maintain and enforce policies and procedures that provide a mechanism to contact the patient and, if necessary, the prescriber, if an undue delay is encountered in delivering the prescribed drug or device. Undue delay is defined as an extension of the normal delivery cycle sufficient to jeopardize or alter the patient treatment plan;
13. Maintain and enforce policies and procedures establishing mechanisms to inform patients or caregivers about drug recalls; and 14. Maintain and enforce policies and procedures establishing mechanisms to educate patients and caregivers about the appropriate
means to dispose of expired, damaged, and unusable medications.
Storage and shipment
15. Ship controlled substances to patients via a secure means that ensures proper delivery and seeks to prevent diversion; and 16. Assure that medications and devices are maintained within appropriate temperature, light, and humidity standards, as established
by the United States Pharmacopeia (USP), during storage and shipment.
Over-the-counter products
17. Comply with all applicable federal and state laws regarding the sale of Over-the-Counter Products identified as precursors to
the manufacture or compounding of illegal drugs.
Table 1. Continued
Quality improvement programs 18. Maintain a quality assurance/quality improvement program.
Reporting to NABP
19. Notify NABP within thirty (30) days of any change of information provided as part of the verification process, including change in pharmacist-in-charge, or involving data displayed on the VIPPS web site. VIPPS pharmacies shall notify NABP in writing within ten (10) days of ceasing operations. The written notification shall include the date the pharmacy will be closed, and an affirmation that all VIPPS Seals and references to the VIPPS program have been removed from the Web site and wherever else they are displayed
Adapted from http://www.nabp.net/programs/accreditation/vipps/vipps-criteria.
도록 하였으며, 불법 인터넷약국을 신고할 수 있게 하였다.
(3) 인터넷약국 인증프로그램(Verified Internet Phar- macy Practice Sites, VIPPS): 미국약사회에서는 1999 년, 주 및 연방 규제 협회, 전문가 협회, 소비자 단체와의 공 조 하에 VIPPS (Verified Internet Pharmacy Practice Sites)라고 불리는 인터넷약국 인증프로그램을 발족하였다. VIPPS의 보증을 받기 위해서는 조제하는 처방약에 대하여 해당 주의 허가절차와 검사법에 따라야 하며, 미국약사회의 요구사항 을 만족하여야 한다.
27)VIPPS 자격요건은 라이센스 및 정책 의 유지, 처방, 환자의 정보, 의사소통, 저장 및 운반, 품질 향상 프로그램, 미국약사회에 보고의무 등의 항목으로 구성 되어 있다. 특히 의약품안전관리 측면에서는, 약물유해반응과 투 약오류에 대한 적절한 조치를 취하고, 유해사례를 보고하도록 하며, 전향적인 의약품적정사용평가(prospective drug use review) 를 의무화 하고 있다(표 1).
28)인증된 약국은 VIPPS 인증마크를 웹사이트에 배치하여 인터넷약국을 이용하고자 하는 소비자가 인터넷약국에 대한 믿을만한 정보를 제공받을 수 있게 된다.
미국 내 VIPPS 인증받은 인터넷약국 사이트는 2003년에 14개에서 2013년 1월 현재 32개로 늘었으나, VIPPS의 보급률 은 기대에 못 미치는 수준이다. 또한, VIPPS 인증기관은 대부 분 대형 인터넷약국이며, 실제 불법 인터넷 약품 유통을 주도 하고 있는 중소형 업체의 참가가 매우 미미한 실정이다.
29)3) 의약전문가, 소비자단체 및 제약사의 예방활동 (1) 위조의약품 경계 네트워크(Counterfeit Alert Net- work): ‘위조의약품 경계 네트워크(Counterfeit Alert Net- work)’는 미국 내 의약 전문가와 소비자 단체로 구성된 네 트워크로, 가정의협회, 간호사협의회, 진료보조원(Physician Assistants)협의회, 의과대학 약학대학 등을 포함하여 총 17 개의 단체로 구성되어 있다. 위조의약품으로 인한 리콜 등 관련정보를 전달하고, 의사, 약사, 소비자, 도매상에서 위조 의약품을 확인, 보고, 예방할 수 있는 교육을 제공하며, 정 부기관, 소비자 단체, 산업체 등에 정보를 전파하는 방법을
개발하는 역할을 하며,
30)미국 내에서 위조의약품 사건이 발생할 경우 FDA로부터 메시지를 전달받고, 이를 빠르게 전파시키는 역할을 한다.
(2) 제약사의 위조의약품 예방활동: 위조는 브랜드이미 지 뿐 아니라 회사 이익에 지대한 영향을 미치므로, 다국적 제약사의 본사들이 밀집되어 있는 미국에서는 각 제약사별 로 위조의약품 문제를 해결하기 위한 활동이 다방면으로 진 행되고 있다. 의약품 안전사용을 위한 교육, 홍보활동으로 서 의약품에 대한 상세정보를 제공하고, 진짜약과 위조약을 구별하는 방법 및 위조약 신고방법 등을 교육하고 있다. 로 슈(Roche)는 대중 및 사법당국, 관세청, 의료 전문가 등을 대상으로 위조의약품에 대한 교육을 실시하였고, 타미플루 (tamiflu)에 대한 자세한 정보를 제공함으로써 소비자들이 위조의약품에 노출될 가능성을 줄였다.
31)머크(Merck)는 자 사 홈페이지에 인증 도매상에 대한 정보(Authorized Distri- butors of Record)를 게재하였다.
32)또한, 머크(Merck)는 2차 원 바코드(2-dimensional barcode, 2D-barcode)를 통해 위조의 약품을 쉽게 확인할 수 있는 기술을 도입하였고, 비엠에스 제약(Bristol-Myers Squibb, BMS)는 유전자코드 및 유전자 지 문(DNA codes, genetic fingerprints)를 활용하여 정품을 확인 하고 유통과정을 추적하고 있다.
33)화이자(Pfizer), 로슈 (Roche) 등은 특별한 포장과 라벨링 인쇄 기술을 활용하여, 위조가 어렵고 위조시 발견이 쉬운 기술을 도입하였다.
34)이 밖에도 정부 혹은 유관단체와의 공조수사를 통해 위조의 약품 예방활동을 수행하고 있다.
결론 및 제언
위조의약품의 문제는 비교적 체계적인 의약품공급망을
갖춘 미국에서조차 심각한 문제로 대두되고 있다.
35)미국에
서는 일찍부터 위조의약품의 유입경로 및 규모를 파악하고
피해를 예방하기 위한 정부 및 민간 차원의 활동이 진행되
고 있다. 정부에서는 유통관리 및 규제 측면에서 법적 근거
와 구체적인 실행계획을 마련하였으며, 부작용 신고체계인 MedWatch를 통하여 위조약으로 인한 문제를 신고 받도록 하고 있다. 위조의약품에 대항하기 위한 다양한 교육홍보활 동을 실시하고 있으며, 특히 인터넷약국이 합법적인 환경 하에서, 인터넷을 통한 위조의약품 피해를 최소화하기 위한 예방활동이 이루어지고 있다.
국내에서도 위조의약품 산업이 빠르게 성장하고 있고 위 조의약품 밀수방법이 대량화, 조직화, 지능화되는 추세인 것으로 알려져 있어,
36)위조의약품 현황 파악 및 예방활동 이 시급한 시점이다. 미국의 예방활동에서처럼 정부와 민간 이 협조하여 위조의약품 대응 체계를 구축하고, 정기적으로 위조의약품 예방활동을 공유하는 체계가 필요하다. 국내에 서는 온라인을 통한 의약품 거래가 불법임에도 불구하고, 주요 검색 사이트에서 쉽게 발기부전치료제 등의 구매 사이 트를 접할 수 있다. 향후 우리나라에서도 인터넷약국 등이 허가될 가능성을 고려할 때, 미국에서 시행하고 있는 인증 프로그램 및 캠페인 등을 참고로 할 수 있을 것이다. 위조의 약품으로 인한 환자안전의 위협 등에 대한 대중의 인식을 높이기 위한 교육홍보 활동 역시 필요하다. 일반 대중의 인 식 개선은 위조의약품 예방활동의 가장 중요한 핵심이 될 수 있기 때문에 대중의 위조의약품에 대한 지식 및 태도를 분석하고, 소비자 및 의료 전문가의 위조의약품 신고가 활 성화 될 수 있도록 효과적인 교육 및 홍보 방법을 개발해야 한다. 또한, 위조의약품 사용에 의한 안전성 문제에 대한 약 물감시 활성화를 비롯한 의약품 안전관리체계가 강화되어 야 할 것이다.
참고문헌
1. Rao BP. Caution! Counterfeit Medicines are on the Rise.
Amrita Journal of Medicine 2007;2:13-7.
2. Liang BA. Fade to black: Importation and counterfeit drug.
Am J Law Med 2006;32:279-323.
3. U.S. Food and Drug Administration: Drug Safety and Availa- blility. Counterfeit Version of Avastin in U.S. Distribution. [cited 2012 July 10] Available from http://www. fda.gov/Drugs/Drug- Safety/ucm291960.htm [accessed 2013 Feb 19].
4. U.S. Food and Drug Administration: Drug Safety and Availa- blility. Counterfeit Drugs Questions and Answers. [cited 2011 Sep 08]; Available from: http://www.fda.gov/Drugs/DrugSafe- ty/ucm169898.htm [accessed 2013 Feb 19].
5. U.S. Food and Drug Administration: For Consumers. War- ning: Counterfeit Alli. [cited 2012 Aug 09] Available from:
http://www.fda.gov/ForConsumers/ConsumerUpdates/ucm1985 57.htm [accessed 2013 Feb 19].
6. Pfizer. Counterfeit Pharmaceuticals. Available from: http://
www.pfizer.com/files/products/CounterfeitBrochure.pdf [acce- ssed 2013 Feb 19].
7. 헬스로그(2007.09.18.) “인터넷을 통한 불법 비아그라 판매 심각” Available from: http://www.koreahealthlog.com/186?cat- egory=1 [accessed 2013 Feb 19].
8. FDA 2nd Annual Health Professional Organizations Con- ference. Protecting Patients from Counterfeit and Other Sub- standard Drugs/Supply Chain Threats. Connie Jung, RPh, PhD, Assoc. Dir. Policy & Communications (Acting), Jean McCue, Regulatory Counsel, October 2012.
9. Heartland Institue. Pitts P. Counterfeit drug sales to reach $75 billion by 2010, report says.[cited 2005 Nov 1]; Available from: http://www.heartland.org/publications/ health%20care/ar- ticle/17948/Counterfeit_Drug_Sales_to_Reach_75_Billion_
by_2010_Report_Says.html [accessed 2013 Feb 19].
10. U.S. Food and Drug Administration. FDA Conducts Prelimi- nary Review of Agency’s Diversion and Counterfeit Criminal Case Information September 2011. Available from: http://
www.fda.gov/downloads/Drugs/DrugSafety/DrugInte- grityandSupplyChainSecurity/UCM272150.pdf [accessed 2013 Feb 19].
11. Executive Office of the President of the United States. Coun- terfeit Pharmaceutical Inter-Agency Working Group Report to the Vice President of the United States and to Congress, Available from: http://www.whitehouse.gov/sites/default/files/
omb/IPEC/Pharma_Report_Final.pdf [accessed 2013 Feb 19].
12. Executive Office of the President of the United States.
Administration’s White Paper on Intellectual Property Enforce- ment Legislative Recommendations, Available from: http://
www.whitehouse.gov/sites/default/files/ip_white_paper.pdf [accessed 2013 Feb 19].
13. Office of the U.S. Intellectual Property Enforcement Coor- dinator. Intellectual Property Spotlight (July/August 2012 Edition) [2012 Sep 28] Available from: http://www.whitehous- e.gov/sites/default/files/omb/IPEC/spotlight/ipec_july_august_spot- light_2012.pdf [accessed 2013 Feb 19].
14. Marucheck A, Greis N, Mena C, Cai L. Product safety and security in the global supply chain: Issues, challenges and re- search opportunities. JOM 2011;29:707-720
15. U.S. Food and Drug Administration. FDA Conducts Prelimin- ary Review of Agency’s Diversion and Counterfeit Criminal Case Information September 2011. Available from: http://
www.fda.gov/downloads/Drugs/DrugSafety/DrugIntegrityand- SupplyChainSecurity/UCM272150.pdf [accessed 2013 Feb 19].
16. U.S. Food and Drug Administration. CPG Sec. 400.210, Radiofrequency Identification Feasibility Studies and Pilot
Programs for Drugs. Available from: http://www.fda.gov/
ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/
ucm074357.htm [accessed 2013 Feb 19].
17. Law E, Youmans SL. Combating counterfeit medications: The california pharmacist perspective. J Pharm Pract 2011;24:114- 21.
18. U.S. Department of Health and Human Services. Food and Drug Administration. Guidance for Industry Standards for Securing the Drug Supply Chain- Standardized Numerical Identification for Prescription Drug Packages. Issued March 2010. Available from: http://www.fda.gov/downloads/Regula- toryInformation/Guidances/UCM206075.pdf [accessed 2013 Feb 19].
19. Seo DM, Jeong HJ, Kim HS. An e-pedigree Study on how to track and trace quality and authentication of pharmaceutical products. Logistics 2011;19:141-57(Korean).
20. APhA Annual Meeting. FDA Effort: Counterfeit Drugs.
ILISA B.G. BERNSTEIN, PHARM.D., J.D. Director, Office of Compliance Center for Drug Evaluation and Research.
March 2012.
21. U.S. Food and Drug Administration: Drug Safety and Availa- bility. Reporting of Counterfeit Drug Products. [cited 2009 July 9]
Available from: http://www.fda.gov/Drugs/DrugSafety/ucm170314.htm [accessed 2013 Feb 19].
22. Krüger J. Anti-counterfeiting in gobal pharmacovigilance a question of patient’s safety, Germany; 2011.
23. National Association of Boards of Pharmacy. Internet Drug Outlet Identification Program Progress Report for State and Federal Regulators: July2012. Available from: http://www.
nabp.net/programs/assets/NABP%20Internet%20Drug%- 20Outlet%20Report_July_2012_Final.pdf [accessed 2013 Feb 19].
24. U.S. Food and Drug Administration. FDA NEWS RELEASE.
FDA takes action against thousands of illegal Internet phar- macies. Available from: http://www.fda.gov/NewsEvents/ News- room/PressAnnouncements/ucm322492.htm [accessed 2013 Feb 19].
25. U.S. Food and Drug Administration: Information for consumers (Drugs). BeSafeRx: Know Your Online Pharmacy. [cited 2012
Oct 10] Available from: http://www.fda.gov/Drugs/Resources- ForYou/Consumers/BuyingUsingMedicineSafely/Buying MedicinesOvertheInternet/BeSafeRxKnowYourOnline- Pharmacy/ucm20027044.htm [accessed 2013 Feb 19].
26. Executive Office of the President of the United States. 2011 U.S. Intellectual Property Enforcement Coordinator Annual Report on Intellectual Property Enforcement, Published in March, 2012 Available from: http://www.whitehouse.gov/
sites/default/files/omb/IPEC/ipec_annual_report_mar2012.pdf [accessed 2013 Feb 19].
27. Liang BA, Mackey T. Searching for safety: Addressing sear- ch engine, website, and provider accountability for illicit on- line drug sales. Am J Law Med 2009;35:125-84.
28. National Association of Boards of Pharmacy. VIPPS Criteria.
Available from: http://www.nabp.net/programs/accreditation/
vipps/vipps-criteria [accessed 2013 Feb 19].
29. 최건섭. 의약품 사이버거래(전자상거래) 실태조사 및 관련 제도 수립방안 연구(식품의약품안전청 연구용역보고서), 한국보건산업진흥원, 2003.
30. U.S. Food and Drug Administration: Drug Safety and Availa- bility. Counterfeit Alert Network. [cited 2009 July 8] Availa- ble from: http://www.fda.gov/Drugs/DrugSafety/ucm- 170315.htm [accessed 2013 Feb 19].
31. Roche. Roche Position on Counterfeiting. Available from:
http://www.roche.com/roche_position_on_counterfeiting.pdf [accessed 2013 Feb 19].
32. Merck. Counterfeiting of Medical Products Available from:
h t t p : / / www. me r c k . c o m/ a b o u t / v i ews - a n d - p o s i t i o n s / Counterfeiting2009.pdf [accessed 2013 Feb 19].
33. Breithaupt H. DNA and consumer confidence. EMBO Rep 2003;4:232-4.
34. PACKAGING NEWS (2006 JAN 6). Pfizer Using RFID to Fight Fake Viagra. Available from: http://www.rfidjournal.com/
article/view/2075 [accessed 2013 Feb 19].
35. Wertheimer AI, Chaney NM, Santella T. Counterfeit pharma- ceuticals: Current Status and future projections. J Am Pharm Assoc 2003;43:710-7.
36. Yang SK. KSSMA Eradication Campaign for Counterfeit PDE5I. 제18차 대한남성과학회 연수강좌, 2012.