35
책임저자: 신연명, 부산시 서구 암남동 34
602-702, 고신대학교 의과대학 외과학교실 Tel: 051-990-6462, Fax: 051-246-6093
E-mail: sym@ns.kosinmed.or.kr
접수일:2009년 12월 17일, 게재승인일:2010년 3월 30일 본 논문은 2009년 대한외과학회 추계 통합학술대회에서 포스터 전시되었음.
1기 위암의 재발에 대한 임상적 고찰
고신대학교 의과대학 외과학교실
백상현ㆍ양송이ㆍ신연명
Clinicopathological Analysis of Recurrence in Stage 1 Gastric Cancer
Sang Hyun Baik, M.D., Song I Yang, M.D., Yeon Myeong Shin, M.D.
Department of General Surgery, Kosin University College of Medicine, Busan, Korea
Purpose: Recently, diagnosis of stage 1 gastric cancer has increased in number and prognosis is excellent when proper treatment is done. However, some patients have recurrence and their prognosis is poor. Thus, we investigated the risk factors of recurrence in stage 1 gastric cancer patients.
Methods: From January 2004 to December 2008, a total of 1,241 number patients were operated on for stage 1 gastric cancer at the Department of General Surgery, Kosin University Gospel Hospital. We reviewed the characteristics of all patients retrospectively and compared them to recurred group (n=24) and non-recurred group (n=1,114). We analyzed the risk factors associated with recurrence.
Results: Twenty-four patients with stage 1 gastric cancer were recurred after radical gastrectomy. Recurrence rate was 2.05%. The most common pattern of recurrence was hematogenous (41.7%), and lymphatic (20.8%), peritoneal seeding (16.7%), combined form (12.5%), and locoregional (8.3%). Five-year survival rate was 50.08% of recurrence group. Of clinicopathological factors, depth of invasion, lymph node metastasis, lymphatic involvement and tumor marker were statistically significant between recurred and other group.
Conclusion: In this study, tumor marker, tumor depth, node status, lymphatic channel involvement were possible risk factors of recurrence for stage 1 gastric cancer. More intensive follow up and care is needed for those with such risk factors. (J Korean Surg Soc 2010;79:35-42)
Key Words: Stage 1 gastric cancer, Recurrence, Risk factor 중심 단어: 1기 위암, 재발, 위험인자
서 론
조기 위암은 림프절 전이 여부와 관계없이 위벽의 침윤 도가 점막 혹은 점막하층에 국한된 위암으로 정의하고 있 다.(1-4) 이와 비슷하게 AJCC-UICC (6th ed)에서 1기 위암은
점막층 및 점막하층까지 침범하면서 N1에 해당되는 림프 절 전이를 가지거나 림프절 전이가 없이 근육층 및 장막하 층까지 침범한 위암이라고 정의하였다. 최근 들어 건강에 대한 관심이 높아지고 국가적으로 검진 사업이 진행되며 진단 기술이 발전하여서 1기 위암의 진단 비율도 점차 높아 지고 이에 따른 1기 위암의 수술 빈도도 많이 증가하였 다.(5-7) 이런 환자들의 술후 예후도 5년 생존율이 90% 이상 일 정도로 좋은 것으로 알려져 있다. 따라서 수술 후에도 진행성 위암과 같이 적극적인 항암치료나 다른 보조적인 치료도 하지 않는 것이 일반적이다.(1-3,6,8,9) 그러나 그런 환자에서도 빈도는 많지 않으나 재발하는 경우가 있으며 예후도 좋지 못하다.(2,3,6,10) 따라서 1기 위암에서도 재발
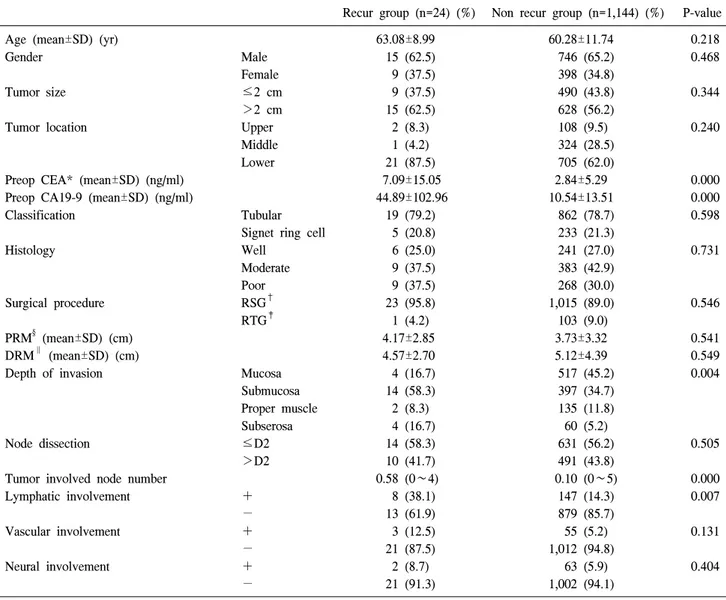
Table 1. Clinicopathological characteristics of patients
Recur group (n=24) (%) Non recur group (n=1,144) (%) P-value
Age (mean±SD) (yr) 63.08±8.99 60.28±11.74 0.218
Gender Male 15 (62.5) 746 (65.2) 0.468
Female 9 (37.5) 398 (34.8)
Tumor size ≤2 cm 9 (37.5) 490 (43.8) 0.344
>2 cm 15 (62.5) 628 (56.2)
Tumor location Upper 2 (8.3) 108 (9.5) 0.240
Middle 1 (4.2) 324 (28.5)
Lower 21 (87.5) 705 (62.0)
Preop CEA* (mean±SD) (ng/ml) 7.09±15.05 2.84±5.29 0.000
Preop CA19-9 (mean±SD) (ng/ml) 44.89±102.96 10.54±13.51 0.000
Classification Tubular 19 (79.2) 862 (78.7) 0.598
Signet ring cell 5 (20.8) 233 (21.3)
Histology Well 6 (25.0) 241 (27.0) 0.731
Moderate 9 (37.5) 383 (42.9)
Poor 9 (37.5) 268 (30.0)
Surgical procedure RSG† 23 (95.8) 1,015 (89.0) 0.546
RTG‡ 1 (4.2) 103 (9.0)
PRM§ (mean±SD) (cm) 4.17±2.85 3.73±3.32 0.541
DRM∥ (mean±SD) (cm) 4.57±2.70 5.12±4.39 0.549
Depth of invasion Mucosa 4 (16.7) 517 (45.2) 0.004
Submucosa 14 (58.3) 397 (34.7)
Proper muscle 2 (8.3) 135 (11.8)
Subserosa 4 (16.7) 60 (5.2)
Node dissection ≤D2 14 (58.3) 631 (56.2) 0.505
>D2 10 (41.7) 491 (43.8)
Tumor involved node number 0.58 (0∼4) 0.10 (0∼5) 0.000
Lymphatic involvement + 8 (38.1) 147 (14.3) 0.007
− 13 (61.9) 879 (85.7)
Vascular involvement + 3 (12.5) 55 (5.2) 0.131
− 21 (87.5) 1,012 (94.8)
Neural involvement + 2 (8.7) 63 (5.9) 0.404
− 21 (91.3) 1,002 (94.1)
*CEA = carcinoembryonic antigen; †RSG = radical subtotal gastrectomy; ‡RTG = radical total gastrectomy; §PRM = proximal resection margin; ∥DRM = distal resection margin.
의 가능성을 완전히 배제할 수는 없다고 생각이 되며 이에 영향을 미치는 수술 전후의 임상 병리학적 인자에 대한 조 사를 통해서 환자의 치료와 경과 관찰에 도움이 되고자 하 였다.
방 법
2004년 1월 1일부터 2008년 12월 31일까지 5년간 위암으 로 진단 받고 본원에서 수술 후 병리조직 검사상 1기로 진 단 받은 1,241명의 환자를 대상으로 의무기록 및 병리기록 을 후향적으로 조사하였고 추적이 누락된 73명을 제외한 1,168명을 최종 대상으로 하였다. 이들은 술 후 본원에서 정
한 일정에 따라서 정기적인 검사를 받았으며 혈액화학검 사, 흉부방사선, 내시경, 컴퓨터단층촬영, 양전자단층촬영 술의 결과로 추적하고자 한 5년 동안의 기간 내 재발 소견 이 보이는 24명의 환자를 재발군으로 하고, 나머지 1,144명 의 환자를 대조군으로 정하여 각 군의 나이, 성별, 연령, 수 술 방법, 술 후 병리조직검사, 수술 전후 혈액화학검사 및 방사선학적 검사 결과들을 분석하였다.
모든 환자들은 D1+α 이상의 림프곽청술을 시행하였다.
생존 여부 분석은 직접적인 전화 및 최근까지의 의무기록, 그리고 통계청의 생사 여부 및 사망 원인 결과를 이용하여 조사하였다. 통계분석은 SPSS (version 12.0)를 이용하였으 며 생존분석은 Kaplan Meier 생존분석법을 이용하였고 재
Fig. 1. Survival curves of recur and non-recur group.
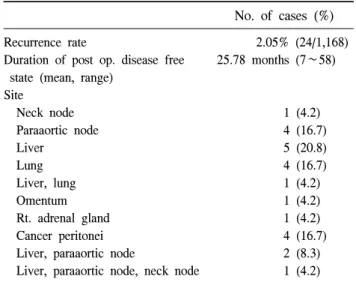
Table 2. Duration and site of recurrence
No. of cases (%) Recurrence rate 2.05% (24/1,168) Duration of post op. disease free 25.78 months (7∼58) state (mean, range)
Site
Neck node 1 (4.2) Paraaortic node 4 (16.7)
Liver 5 (20.8)
Lung 4 (16.7)
Liver, lung 1 (4.2)
Omentum 1 (4.2)
Rt. adrenal gland 1 (4.2) Cancer peritonei 4 (16.7) Liver, paraaortic node 2 (8.3) Liver, paraaortic node, neck node 1 (4.2)
Table 3. Pattern of recurrence Type No. of cases
(%)
Duration of disease free state (mean months, range)
Lymphatic 5 (20.8) 38.60 (7∼58)
Hematogenous 10 (41.7) 24.00 (7∼42)
Local 2 (8.3) 25.00 (11∼39)
Peritoneum 4 (16.7) 29.25 (23∼43)
Mixed 3 (12.5) 11.67 (8∼19)
발과 관련 있는 인자들에 대한 분석은 Chi square test, ANOVA test를 이용하였다. P-value가 0.05 미만인 경우에 통계학적으로 유의하다고 판정하였다.
결 과
1) 임상병리학적 특성(Table 1)
재발군에서 환자들의 성비는 남자 15예, 여자 9예였고, 평균 연령은 63.08세(48∼77)였다. 병변의 위치는 upper, middle, lower로 나누었을 때, lower가 21예로 가장 많았으며 육안 소견은 주관적인 의견을 완전히 배제할 수는 없으나 융기형, 함몰형, 혼합형으로 나누었을 때 함몰형이 14예로 가장 많았다. 병기는 T1N0 (IA기) 11예, IB기 중 T1N1 7예, T2N0 6예였다. 술전 병변의 조직형은 tubular adenocar- cinoma가 19예, signet ring cell type adenocarcinoma가 5예였 으며 분화도는 well differentiated type이 6예, moderate 9예, poor 9예였다. 크기에 따라서는 2 cm를 기준으로 그 이상이 15예, 미만이 9예였다. 수술은 1예를 제외하고 모두가 위아 전절제술을 시행하였다.
비재발군의 성비는 남자 746예, 여자 398예였고, 평균 연 령은 60.28세(28∼87)였다. 위치는 upper 108예, middle 324 예, lower 705예였으며 육안 소견은 함몰형이 781예로 가장 많았다. 술 전 조직형은 tubular adenocarcinoma가 862예, sig- net ring cell type adenocarcinoma가 233예, 그 외 11예였으며 분화도는 well differentiated type이 241예, moderate가 383예, poor가 268예였다. 수술은 대부분이 위아전절제술(1,015예) 을 시행하였다.
2) 생존율 및 추적기간(Fig. 1)
환자들의 추적 종료일은 2009년 11월 30일이었으며, 그 때까지 1,141명의 환자가 생존하고 있었고, 26명의 환자가 사망하였다. 이 중 재발한 군에서 8명, 나머지가 비재발군 에서 타암 및 다른 원인으로 사망하였다. 생존한 환자들의 중앙추적일수는 38개월(3∼80)이었고, 추적률은 94.12%였 다.
재발군의 5년 생존율은 50.08%, 대조군의 5년 생존율은 98.6%로 두 군 간에 통계적으로 유의한 차이를 보였다(P=
0.00). 그리고 재발한 기간을 2년으로 나누었을 때, 2년 이내 재발한 경우가 12명으로 50.0%였으며 2년 이후 재발한 경 우와 비교한 5년 생존율은 각각 13.1%, 80.0%로 통계적인 의미가 있었다(P=0.00).
3) 재발 부위 및 재발 기간(Table 2, 3, Fig. 2)
총 1,168명의 대상 환자 중 24명이 재발로 진단되어 재발 률은 2.05%이었다. 재발의 진단은 내시경, 초음파, CT 등의 술 후 정기적인 추적검사 등을 통하였으며, 1예는 복강경을
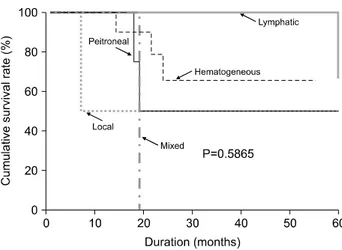
Fig. 2. Survival curves by recurrence pattern.
Table 4. Results of multi-variant analysis of significant factors
P-value Exp (B)
95% CI*
Lower bound
Upper bound
Preop-CEA† 0.010 0.968 0.944 0.992
Depth of invasion 0.044 4.344 1.037 18.191 Tumor involved node number 0.009 0.585 0.392 0.873
*95% CI = 95% confidence interval; †CEA = carcinoembryonic antigen.
통하여 확진하였다. 구체적인 부위는 neck node 1예, para- aortic node 4예, liver가 5예, lung이 4예, liver, lung 동시 재발 이 1예, omentum 1예, adranal gland 1예, cancer peritonei가 4예, liver, paraaortic node 동시 재발이 2예, liver, paraaortic node, neck node 동시 재발이 1예였다. Omentum 부위에 재 발한 경우는 주변 간과 췌장까지 침범되었으며, adrenal gland부위에 재발한 경우는 장간막에도 전이 소견이 관찰 되어 수술이 불가능하였다. 이를 전이 부위에 따라 림프절, 혈행성, 국소, 복막, 복합 재발의 다섯 가지 그룹으로 나누 어 보았고, 림프절 재발 5예, 혈행성 재발 10예, 국소 재발 2예, 복막 재발 4예, 복합 재발 3예였다. 재발 부위에 따른 5년 생존율은 림프절 재발 66.67%, 혈행성 재발 65.63%, 국 소 재발 50.0%, 복막 재발 50.0%, 복합 재발 0.00%였고, 각 군 간의 생존율의 통계적인 의미는 없었다(P=0.507). 재발 하기까지의 평균 기간은 25.78개월이었으며 재발 양상에 따른 평균 기간은 림프절 재발 38.60개월, 혈행성 재발 24.00개월, 국소 재발 25.00개월, 복막 재발 29.25개월, 복합 재발 11.67개월이었다.
4) 재발과 관련된 인자들에 대한 분석(Table 1, 4)
각 군의 여러 가지 특징을 비교하여 그 중 통계적인 의미 가 있는 인자들을 조사해 보았다. 여러 가지 임상적인 특징 들을 비교 분석하였으며 그 중 의미가 있는 것이 술전 종양 표지자(CEA, CA19-9), 종양의 침범 깊이(mucosa, sub- mucosa), 전이된 림프절의 개수, 림프관 침범 여부가 있었 다. 단변량 분석에서 의미 있는 인자들을 대상으로 logistic linear regression을 이용해 다변량 분석을 해보았다. 전이된 node 개수가 가장 의미가 있었으며 그 다음이 술전 CEA,
종양의 침범 깊이(mucosa, submucosa)였다.
5) 재발군에서의 치료 여부 및 생존율 분석
재발군에서 재발로 진단된 후 치료 방법에 있어서도 차 이가 있었다. 이에 대해서는 객관적인 기준에 의해서 치료 방법을 정한 것은 아니고 환자의 경제적인 여건 그리고 임 상 상태 등의 영향으로 치료 방법에 있어서 차이를 보였다.
수술을 다시 한 경우는 없었으며, 항암치료와 보존적인 치 료의 두 가지 군으로 나눌 수가 있었다. 항암치료한 경우가 16예(66.7%), 보존적인 치료만 한 경우가 7예(29.2%)였다. 1 예는 타병원으로 전원간 경우이다. 치료 방법에 따른 5년 생존율은 항암치료한 경우가 51.59%, 보존적인 치료를 한 경우가 51.43% (P=0.57)로 통계학적인 의미는 없었다.
고 찰
시대가 발전하면서 의료 기술도 발전을 거듭하고 그에 따라 여러 종류의 암에 있어서도 발견 시점이 조기에 진단 되는 경우가 더 많아지고 있고 위암도 예외가 아니다.(1,2,8) 우리나라에서도 조기 위암 및 1기 위암의 진단 빈도가 더 높아지고 진단 연령도 젊어지고 있다.(5,6) Yuasa와 Nimura (5)는 전체 위암 중 조기 위암의 유병률은 일본에서는 45∼
51%, 서양에서는 7∼28%라고 하고, 일본에서의 전체 위암 중에 30∼40%를 차지한다고 한다.(7) 조기 위암은 림프절 전이와 상관없이 위벽의 침윤 정도가 점막층이나 점막하층 에 국한되어 있는 위암으로,(1-4) 그것의 예후는 매우 양호 하여 10년 질병특이사망률(disease specific survival rate)이 90% 전후로 보고되고 있으며,(2) 5년 및 10년 생존율(cancer related survival rates)도 각각 98.6%, 94.8%라고 한다.(1,3,6,8,9) 따라서 수술 후 항암약물치료나 다른 적극적인 치료는 일 반적으로 하지 않는 것이 대부분이고, 1기 위암에서도 마찬
가지이다.(2) 그러나 일부에서는 추적관찰 기간 중 재발하 는 경우가 있는 것도 사실이다.(6) Lai 등(3)은 조기 위암의 수술 후 재발하는 빈도를 1.4%에서 7%로 보고하였고, Lee 등(6)은 1.4∼6.4%라고 하였다. 그리고 재발한 경우, Sano 등(10)은 평균 생존 기간이 40개월 정도로 예후도 좋지 못 한 것으로 보고되고 있다. 재발률은 일본의 경우는 0.3∼
4.2%, 유럽의 경우는 0∼34%, 북미의 경우는 0∼20%로 보 고되고 있다.(2) 본 연구에서는 술 후 조직검사상 1기로 판 정 받은 환자들을 조사하였으며 대상군의 재발률은 2.05%
로 보고된 문헌들과 비슷하였다.
재발에 영향을 미치는 여러 가지 인자들에 대해서 여러 가지를 생각해 볼 수 있겠지만 지금까지 보고된 내용에 의 하면 주로 종양의 침윤도(depth), 림프절 전이 여부(node positive), 종양의 크기, 종양세포의 분화도, 종양세포의 혈 관, 신경, 림프관 침범 여부, 종양의 육안 소견, 림프절 절제 범위 등이 있다.(2,6,8,9,11) 이 중 진행성 위암과 마찬가지로 위벽의 침윤도나 림프절 전이 유무가 재발과 관련이 있다 고 하는 보고가 많은데,(2) 위벽 침윤도에 따른 재발의 경 우, 점막하층에는 소동맥, 소정맥 또는 작은 림프관들이 풍 부하기 때문에 침윤이 점막하층까지 퍼졌을 때 림프절 전 이의 발생률이 증가할 수 있다.(12) Sano 등(10)은 점막하층 암에서 3.7% 점막층암에서 0.4%로 보고하였고, Furusawa 등(13)도 점막하층암 4.0%, 점막층암 1.7%의 재발을 보고하 여 침윤도가 깊을수록 재발과의 관련성이 깊은 것으로 보 고하였다.(2) 본 연구에서는 종양의 침윤도에 따른 재발률 의 차이는 점막층 16.7%, 점막하층 58.3%였다(P=0.004). 그 리고 림프절의 침범 여부인데 Saka 등(11)은 조기 위암에서 의 재발률이 1.4∼2.8%이었으나 림프절 침범이 있는 경우 에는 7∼20%로 높다고 보고하였고, Ichiyoshi 등(14)은 전이 가 있는 경우 12.5%, 없는 경우 2.7%, Sano 등(10)은 10.7%, 1.1%로 보고하였다. 수술 중 림프절 절제범위에 대해서 Yoshikawa 등(15)은 조기 위암에서 2군 림프절까지 침범되 어 있는 경우(pN2 according to the Japanese classification)는 드물고 Saka 등(11)은 2,368명의 조기 위암에서 2군 림프절 까지 전이된 경우는 2.7%였다고 보고하였다. 따라서 조기 위암의 수술 중에 2군 림프절까지 반드시 절제하는 것이 생존율 향상에 도움을 주는지는 의문스럽다고 하였다. Shin 등(16)도 조기 위암의 경우 높은 생존율로 인해 근치적 림 프절 절제술의 효용성을 확인하기 위하여는 많은 수의 환 자를 대상으로 한 장기적인 연구가 필요하므로 근치적 림 프절 절제가 위암의 재발을 방지하는 방법인지를 입증하기
는 어렵다고 하였다. 그러나 조기 위암 혹은 1기 위암이라 고 하더라도 재발 양상이나 시기에 관계없이 재발한 경우 는 예후가 불량하여 Kitamura 등(17)은 조기 위암이라고 하 더라도 전이 림프절 수가 5개 이상의 경우는 보조적 항암면 역화학요법이 필요함을 주장한 바 있다.
일본위암학회의 위암치료규정에서는 조기 위암 환자에 서 림프절 전이가 의심되고 병변의 크기가 2.1 cm 이상인 경우에 2군 림프절 절제술을 할 것을 권장하고 있 다.(11,12,18) Kim 등(8)도 large size, undifferentiated histo- logic type, submucosal invasion 등이 있을 경우는 역시 2군 림프절 절제술을 권장하였다. 본 연구에서도 림프절 침범 여부에 따라서 재발률에 통계적으로 유의한 차이가 있었으 나 술중 림프절 절제 범위에 따라서는 생존율이나 재발률 의 차이는 보이지 않았다. 한편, Saka 등(11)은 UICC TNM classification에 따라서 pN1 (6개 이하 metastatic nodes)에 침 범되었을 때는 재발률이 6%였으나 pN2와 pN3 (7 이상 metastatic nodes)에 침범되었을 때는 재발률이 38%로 침범 된 림프절의 수가 많을수록 재발의 확률도 높아서 술 후 보조적인 치료 및 보다 면밀한 추적이 필요하다고 하였 다.(5)
수술 방법에 있어서 Kikuchi 등(9)은 재발과 관련이 없다 고 보고하였고, 본 연구에서도 1기 위암 환자의 재발과 생 존율에 수술 방법이 통계적으로 영향을 미치지는 않았다.
종양표지자와 관련하여 본 연구에서는 술전 종양표지자 가 재발과 유의하게 관계가 있는 것으로 나타났다. Na 등 (19)은 carcinoembryonic antigen (CEA)이 위암에서 대장암에 비해 양성률은 낮지만 암의 진행 정도, 즉 위벽침윤도 및 림프절 전이 등과 상관 관계가 있으며 진행성 위암 및 장막 침윤이 된 경우 CEA의 양성률이 유의하게 높았다고 한다.
CA19-9도 역시 위벽침윤도, 림프절 전이, 원격 전이, 병기 와 밀접한 상관관계가 있다고 하였다. 1기 위암의 재발에서 종양표지자가 임상적으로 어느 정도의 의미가 있을까에 대 해서는 지속적인 연구가 필요하리라고 본다. 나이에 대해 서도 Lo 등(4)은 75세 이상의 고령 환자들이 그 보다 젊은 환자보다 예후가 좋지 못하다고 하였으나 이는 나이가 많 으면서 동반 질환 등의 다른 조건의 영향 때문이라고 하였 고 본 연구에서 나이와 재발과의 관계는 통계학적인 의미 는 없었지만 그에 따른 동반 조건들에 대한 연구가 더 필요 하리라 생각된다.
조직분화도에 따른 재발률은 Sano 등(10)의 경우 분화암 과 미분화암에서 각각 2.3%와 1.3%, Lai 등(3)은 10.8%와
1.4%로 분화암에서 재발이 많은 것으로 보고하였고, 이에 대해 Sano 등(10)은 분화암의 경우 혈행성 전이를 잘하기 때문이라고 하였고, Boku 등(20)은 분화암의 경우 심한 침 윤성으로 인해서 혈행 및 림프재발의 경향이 높다고 이야 기 하였다. 본 연구에서는 분화도에 따른 재발률의 차이는 없었다. 육안형에 따른 재발률에 대해서 Sano 등(10)은 융기 형(I, IIa)과 함몰형(IIc, IIc+III)보다 혼합형(IIa+IIc)에서 비 교적 많은 재발이 있었다고 하고, Furusawa 등(13)과 Ichiyoshi 등(14)은 융기형(혼합형 포함)이 함몰형보다 혈행 성 재발이 많음을 보고하여 융기형이 함몰형보다 재발이 많다고 하였다. 본 연구에서는 비재발군과 비교하여 융기 형에서의 재발률이 3.3%로 가장 높았고, 함몰형이 1.8%, 혼 합형이 2.6%였다. 병변의 크기와의 관계에 있어서는 Kim 등(21)은 병변의 크기가 클수록 림프절 전이가 잘되며 특히 병변의 크기가 2 cm 이상일 때 림프절 전이와 밀접한 관계 가 있다고 하였고, 보고자에 따라 차이가 있지만 Iriyama 등 (22)은 크기가 5 cm 미만의 종양에서 림프절 전이가 적다고 하였고, Baba 등(23)은 3 cm, Hioki 등(24)은 4 cm , Habu 등 (25)은 5 cm, Sowa 등(26)은 3 cm로 병변의 크기가 클수록 림프절 전이가 잘 된다고 하였고, Hisamichi와 Sugawara(27) 와 Nagata 등(28)은 1 cm 이하의 작은 암종의 경우에는 림프 절 전이가 거의 없는 것으로 보고하고 있어 결국 종양의 직경이 커질수록 림프절 전이와 관계가 깊고 결국 재발과 도 유의한 연관성이 있다고 생각할 수 있겠으나 크기에 대 한 정확한 기준에 대해서는 보다 많은 연구가 있어야 되리 라고 생각된다.(1,14,29) 본 연구에서도 병변의 크기와 림프 절 전이 그리고 재발과의 관계에 있어서 병변의 크기를 2 cm을 기준으로 나누어서 조사하였는데, 2 cm 미만일 때의 림프절 침범 여부는 3.6%, 재발률은 1.8%, 2 cm 이상일 때 의 림프절 침범 여부는 8.0%, 재발률은 2.3%로 종양의 크기 가 클수록 다른 보고에서와 같이 림프절 침범 및 재발률에 차이를 보였다.
림프관 및 혈관, 신경침범 여부에 대해서는 Furusawa 등 (13)은 병소 점막 내 정맥내 종양세포의 침윤이 있는 경우 나, 림프관 침범이 있는 경우에 재발이 많다고 보고하였고, Ahn 등(2)은 혈관 및 림프관 침범이 있는 경우 림프절 침범 이 의의 있게 많다고 보고하였다. Ha와 Kwon(30)은 혈관 침 범이 있을 경우 위암에서의 재발 가능성이 1.8배 높다고 하 였다. 본 연구에서도 상기 인자에 대한 조사를 하여 세 가지 경우 중 림프관 침범이 있는 경우에 통계적으로 유의한 의 미가 있었다(P=0.002).
전이 부위와 예후와의 관계에 있어서 Lo 등(4)은 liver, lung, bone, adrenal gland나 brain으로의 혈행성 전이가 52.4%로 가장 많았다고 하였으며, Sano 등(10)은 재발 환자 의 59.3%가 혈행성 재발로 사망한다고 보고하였고, Furusawa 등(13)과 Ichiyoshi 등(14)도 재발의 주 양상을 혈행성 재발 (47∼68%)로 보고하였고, Ahn 등(2)도 재발된 45예 중 31예 (69%)가 혈행성 전이를 하고 있었으며, 그 중 간전이가 21 예로 가장 많았고, 그 외 폐, 골 및 뇌전이가 있었다고 하였 다. Ha와 Kwon(22)도 조기위암환자의 재발에서 12명 중 10 명이 혈행성 전이 소견을 보였다고 한다. 혈행성 및 림프절 전이는 점막 또는 점막하층에 있던 종양 세포의 림프절 침 범이나 맥관침범으로 인한 것이라고 생각되고, 복막 재발 은 조기위암에서의 장막침범의 경우에서 주로 볼 수 있다 고 한다.(11) 그러나 Lee 등(6)은 림프절 침범이나 점막하층 의 침범만 있는 경우에서도 복막 재발을 한 2예를 보고하였 고, Saka 등(11)의 경우에도 같은 2예를 보고하였는데, 림프 절 침범만으로도 역시 복막재발의 가능성이 있다고 생각해 볼 수 있다. 본 연구에서도 혈행성 재발인 경우가 10예 (41.7%)로 가장 많았고, 림프절 재발 및 복막 재발의 경우는 각각 5예(20.8%), 4예(16.7%), 국소재발이 2예(8.3%), 그 외 복합 재발이 3예(12.5%)였다. 5년 생존율에 있어서는 혈행 성 재발이 65.6%, 림프절 재발이 66.7%, 복막 재발이 50.0%, 국소 재발이 50%, 복합 재발이 0.00%로 각 부위별 간 통계 적인 의미는 없었다(P=0.51).
재발 후 치료에 있어서는 혈행성 재발이 많은 재발의 특 성으로 인해 보존적 치료에 의존하는 경우가 많고 예후도 불량하다고 한다.(2,31) Ahn 등(2)은 45예의 재발예 중 2예 에서만 근치적 절제가 가능하였고, 나머지 43예 중 12예에 서 경도자 동맥 화학색전술이나 전신적 항암화학요법을 시 행하고 나머지는 대증적 치료를 하였다고 하고 치료군과 비치료군에서의 생존 기간이 17.9개월과 8.8개월로 치료군 에서 더 오래 생존하는 경향을 보였으나 두 군 간에 나이나 전신 상태 등을 고려하였을 때 정확한 비교는 어려웠다고 한다. 본 연구에서도 재발한 군에서 항암화학요법 등의 치 료를 한 군과 보존적인 치료만 한 비치료군으로 나누었을 때 생존율에 있어서 차이가 있었지만 통계적인 의의는 없 었다.
결 론
본원에서 2004년 1월 1일부터 2008년 12월 31일까지 1기
위암으로 판정된 1,241명의 환자들 중 술 후 정기적인 검사 에서 재발로 진단 받은 24명의 환자를 대상으로 비재발군 과 여러 가지 임상적인 특성을 비교 분석한 결과 재발에 영향을 미치는 통계학적으로 의미 있는 인자는 술전 종양 표지자(CEA, CA19-9) (P=0.000, P=0.000), 종양의 침범 깊이 (mucosa, submucosa) (P=0.004), 전이된 림프절의 개수(P=
0.000), 그리고 림프관 침범 여부(P=0.007)가 있었다. 임상적 으로 의미 있는 인자에 대해서 술 전 검사 및 술 후 조직검 사상에서 상기와 같은 소견이 있다면 좀 더 면밀한 추적 검사가 필요하리라고 생각된다. 재발 후 치료에 있어서는 본 연구에서는 통계학적인 의미가 없었으나 그에 대한 좀 더 많은 예와 장기적인 추적을 한다면 보다 객관적인 결과 를 도출할 수 있을 것으로 생각되고 재발 후에도 생존율 향상에 도움을 줄 수 있는 방법에 대해서도 연구가 더 필요 하겠다.
ACKNOWLEDGEMENTS
본 연구의 자료 수집 및 통계로 수고해주신 이은하, 허진 선생님께 감사드립니다.
REFERENCES
1) Shin JK, Shin YD, Yoon C, Joo HZ. Risk factors affecting lymph node metastasis and recurrence in early gastric cancer.
J Korean Gastric Cancer Assoc 2001;1:119-23.
2) Ahn JS, Bang HY, Lee JI, Noh WC, Hwang DY, Choi DW, et al. Recurrence of early gastric cancer. J Korean Gastric Cancer Assoc 2001;1:180-6.
3) Lai JF, Kim S, Kim K, Li C, Oh SJ, Hyung WJ, et al.
Prediction of recurrence of early gastric cancer after curative resection. Ann Surg Oncol 2009;16:1896-902.
4) Lo SS, Wu CW, Chen JH, Li AF, Hsieh MC, Shen KH, et al. Surgical results of early gastric cancer and proposing a treatment strategy. Ann Surg Oncol 2007;14:340-7.
5) Yuasa N, Nimura Y. Survival after surgical treatment of early gastric cancer, surgical techniques, and long-term survival.
Langenbecks Arch Surg 2005;390:286-93.
6) Lee HJ, Kim YH, Kim WH, Lee KU, Choe KJ, Kim JP, et al. Clinicopathological analysis for recurrence of early gastric cancer. Jpn J Clin Oncol 2003;33:209-14.
7) Borie F, Millat B, Fingerhut A, Hay JM, Fagniez PL, De Saxce B. Lymphatic involvement in early gastric cancer: prev- alence and prognosis in France. Arch Surg 2000;135:1218-23.
8) Kim DY, Joo JK, Ryu SY, Kim YJ, Kim SK. Factors related to lymph node metastasis and surgical strategy used to treat
early gastric carcinoma. World J Gastroenterol 2004;10:737- 40.
9) Kikuchi S, Katada N, Sakuramoto S, Kobayashi N, Shimao H, Watanabe M, et al. Survival after surgical treatment of ear- ly gastric cancer: surgical techniques and long-term survival.
Langenbecks Arch Surg 2004;389:69-74.
10) Sano T, Sasako M, Kinoshita T, Maruyama K. Recurrence of early gastric cancer. Follow-up of 1475 patients and review of the Japanese literature. Cancer 1993;72:3174-8.
11) Saka M, Katai H, Fukagawa T, Nijjar R, Sano T. Recurrence in early gastric cancer with lymph node metastasis. Gastric Cancer 2008;11:214-8.
12) Kim MK, An JY, Choi MG, Noh JH, Sohn TS, Kim S.
Clinicopathologic characteristics of stage IV early gastric cancer. J Korean Gastric Cancer Assoc 2008;8:136-40.
13) Furusawa M, Notsuka T, Tomoda H. Recurrence of early gas- tric cancer. Semin Surg Oncol 1991;7:344-50.
14) Ichiyoshi Y, Toda T, Minamisono Y, Nagasaki S, Yakeishi Y, Sugimachi K. Recurrence in early gastric cancer. Surgery 1990;107:489-95.
15) Yoshikawa T, Tsuburaya A, Kobayashi O, Sairenji M, Motohashi H, Noguchi Y. Is D2 lymph node dissection neces- sary for early gastric cancer? Ann Surg Oncol 2002;9:401-5.
16) Shin DW, Hyung WJ, Noh SH, Min JS. Risk factors for re- currence after curative surgery for early gastric cancer. J Korean Gastric Cancer Assoc 2001;1:106-12.
17) Kitamura K, Nishida S, Yamamoto K, Ichikawa D, Okamoto K, Yamaguchi T, et al. Poor prognosis in early gastric cancer complicated by five or more positive nodes. Hepatogastroen- terology 1998;45:583-6.
18) Japanese Gastric Cancer Association. Guidelines for Gastric Cancer Treatment. 2nd ed. Tokyo: Kanehara; 2004. p.9-11.
19) Na KY, Chang YS, Kim YH, Joo SH, Lee SH. The prognostic significance of the preoperative serum CEA, CA19-9 and AFP levels in gastric cancer patients. J Korean Surg Soc 2008;75:
302-6.
20) Boku T, Nakane Y, Okusa T, Hirozane N, Imabayashi N, Hioki K, et al. Strategy for lymphadenectomy of gastric cancer.
Surgery 1989;105:585-92.
21) Kim DH, Song TJ, Kim SJ, Kim CS, Koo BH. Analysis of factors related to lymph node metastasis in early gastric cancers. J Korean Surg Soc 2000;58:375-82.
22) Iriyama K, Asakawa T, Koike H, Nishiwaki H, Suzuki H. Is extensive lymphadenectomy necessary for surgical treatment of intramucosal carcinoma of the stomach? Arch Surg 1989;
124:309-11.
23) Baba H, Maehara Y, Okuyama T, Orita H, Anai H, Akazawa K, et al. Lymph node metastasis and marcoscopic features in early gastric cancer. Hepatogastroenterol 1994;41:380-3.
24) Hioki K, Nakane Y, Yamamoto M. Surgical strategy for early gastric cancer. Br J Surg 1990;77:1330-4.
25) Habu H, Takeshita K, Sunagawa M, Endo M. Lymph node
metastasis in early gastric cancer. Int Surg 1986;71:244-7.
26) Sowa M, Kato Y, Nishimura M, Kubo T, Maekawa H, Umeyama K. Surgical approach to early gasrtic cancer with lymph node metastasis. World J Surg 1989;13:630-6.
27) Hisamichi S, Sugawara N. Mass screening for gastric cancer by X-ray examination. Jpn J Clin Oncol 1984;14:211-23.
28) Nagata T, Ikeda M, Nakayama F. Changing state of gastric cancer in Japan. Histologic perspective of the past 76 years.
Am J Surg 1983;145:226-33.
29) Folli S, Morgagni P, Roviello F, De Mazoni G, Marrelli D,
Saragoni L, et al. Risk factors for lymph node metastasis and their prognostic significance in early gastric cancer (EGC) for the Italian Research Group for Gastric Cancer (IRGGC). Jpn J Clin Oncol 2001;31:495-9.
30) Ha TK, Kwon SJ. Clinocopathologic characteristics according to the type of recurrence in curatively-resected gastric cancer patients. J Korean Gastric Cancer Assoc 2007;7:23-30.
31) Kim YI, Noh SH, Lee WJ, Min JS. Recurrence pattern and prognosis after curative resection of gastric cancer. J Korean Surg Soc 1996;50:467-74.