의학
의학
의학
의학 박사학위
박사학위
박사학위
박사학위 논문
논문
논문
논문
사람
사람
사람
사람 중이
중이
중이
중이 진주종에서
진주종에서
진주종에서
진주종에서
하위
하위
하위
하위 신호전달
신호전달
신호전달 물질의
신호전달
물질의
물질의 규명
물질의
규명
규명
규명
아
아
아
아 주
주
주
주 대
대
대
대 학
학
학
학 교
교 대
교
교
대
대
대 학
학
학
학 원
원
원
원
의
의
의
의 학
학
학
학 과
과
과
과
사
사
사람
람
람 중
중
중이
이
이 진
진
진주
주
주종
종
종에
에
에서
서
서
하
하
하위
위
위 신
신
신호
호
호전
전
전달
달
달 물
물
물질
질
질의
의
의 규
규
규명
명
명
지
지
지도
도
도교
교
교수
수
수 박
박
박 기
기
기 현
현
현
이
이
이 논
논
논문
문
문을
을
을 의
의
의학
학
학 박
박
박사
사
사학
학
학위
위
위 논
논
논문
문
문으
으
으로
로
로 제
제
제출
출
출함
함
함.
.
.
2
2
20
0
00
0
05
5
5년
년
년 8
8
8월
월
월
아
아
아 주
주
주 대
대
대 학
학 교
학
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
김
김
김 지
지
지 수
수
수
김
김
김지
지
지수
수
수의
의
의 의
의
의학
학
학 박
박
박사
사
사학
학
학위
위
위 논
논
논문
문
문을
을
을 인
인
인준
준
준함
함
함.
.
.
심
심
심사
사
사위
위
위원
원
원장
장
장
이
이
이 영
영
영 돈
돈
돈
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
정
정
정 명
명
명 현
현
현
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
박
박
박 기
기
기 현
현
현
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
정
정
정 연
연
연 훈
훈
훈
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
김
김
김 철
철
철 호
호
호
인
인
인
아
아
아 주
주
주 대
대
대 학
학 교
학
교
교 대
대
대 학
학
학 원
원
원
감사의
감사의
감사의
감사의 글
글
글
글
본 논문의 시작부터 완성까지 자상한 지도로 이끌어 주신 박기현 교수님께 먼저 진심으로 감사드리며, 자세한 조언과 지도로 많은 도움을 주신 정연훈 교수 님께 감사드립니다. 그리고 저의 많은 부족함을 채워주시고 논문의 완성을 위해 서 아낌없는 도움을 주신 정명현 교수님과 이영돈 교수님께 감사드립니다. 항상 따뜻한 격려와 조언으로 저를 이끌어 주신 김철호 교수님께 감사드립니다. 아울러 그 동안 여러 가지 부탁을 아무런 불평 없이 들어주고 많은 도움을 주신 이비인후과학 교실의 여러분들께 진심으로 감사의 뜻을 전합니다. 제가 여기까지 올 수 있었던 것은 결코 저 혼자의 힘이 아님을 절실히 느끼 고, 많은 분들의 도움과 지도로 이루어진 것임을 알기에 더욱 소중한 보람을 간직 하게 되었습니다. 앞으로도 현재의 위치에 안주하지 않고 항상 정진하는 모습으로 더욱 열심 히 노력할 것을 스스로 다짐해 봅니다. 오늘이 있기까지 사랑으로 돌보아주신 고모님, 부모님, 장인장모님, 그리고 사랑하는 아내 희정, 딸 민서와 논문 완성의 기쁨을 함께 하고 싶습니다. 저 자 씀국문요약
-사람
사람
사람
사람 중이
중이
중이
중이 진주종에서
진주종에서
진주종에서
진주종에서 하위
하위 신호전달
하위
하위
신호전달
신호전달
신호전달 물질의
물질의
물질의
물질의 규명
규명
규명
규명
목적 목적 목적 목적 : : : 중이 진주종은 상피세포의 과증식, 과각질화를 특징으로 하는 중이에 발생하: 는 질환이나 그 발생기전은 정확히 밝혀져 있지 않다. 따라서 진주종 세포의 성장과 분화 그리고 사멸에 관련된 세포 내 신호전달 체계에 대한 연구는 진주종의 발생기 전을 밝히는데 중요한 연구이다. 이에 저자는 사람 중이 진주종 상피에서 성장 및 증식에 관여하는 세포표면 수용체인 epidermal growth factor receptor (EGFR), platelet derived growth factor receptor-α 및 -β(PDGFR-α, PDGFR-β), 세포 내 신호전달 물질인 phopholipase C-γ1 (PLC-γ1), phosphatidylinositol 3'-kinase(PI3K)의 발현을 분석함으로써, 사람 중이 진주 종에서의 성장인자 수용체(growth factor receptors)와 하위 신호전달 물질 (downstream signal transduction molecules)의 역할을 밝히고 진주종 상피세 포의 세포 내 신호전달 체계를 규명하고자 하였다.재료 재료 재료
재료 및 및 및 방법 및 방법 방법 방법 :::: 아주대학교 병원 이비인후과에서 진주종성 중이염으로 수술 받은 환 자 10 명으로부터 수술 시 중이 진주종 상피조직, 대조군으로 동일 환자의 후이개 상피조직을 채취하여 역전사 중합효소반응(reverse transcription - polymerase chain reaction, RT-PCR), 면역조직화학적 염색 및 Western blot을 시행하였다.
결과 결과 결과
결과 : : : : RT-PCR상에서 중이 진주종 상피세포에서는 EGFR, PDGFR-β, PLC-γ 1이 발현되었고, PDGFR-α, PI3K는 발현되지 않았으며, 후이개 상피세포에서
는 PDGFR-β의 발현만이 확인되었고 다른 물질은 발현되지 않았다. 면역조직 화학적 염색에서는 역시 PDGFR-α, PI3K는 중이 진주종 상피 및 후이개 상피 에서 모두 발현되지 않았으며, EGFR은 중이 진주종 상피에서는 기저층과 기저 상층 모두에서, 후이개 상피에서는 기저층에서만 발현되었다. PDGFR-β는 일 부 중이 진주종 상피에서 기저층, 기저상층 모두에서 강하게 발현되었고, 후이개 상피에서는 기저층과 기저상층 하부에서 약하게 발현되었다. 한편 세포 내 신호 전달 물질인 PLC-γ1은 중이 진주종 상피의 기저층, 기저상층 모두에서 발현이 되었고, 후이개 상피에서는 기저층에서 약하게 발현되었다. Western blot에서는 EGFR, PLC-γ1에서 중이 진주종 상피세포가 후이개 상피세포보다 강하게 발 현되었고, PDGFR-β는 중이 진주종 상피세포보다 후이개 상피세포에서 더 강 하게 발현이 되었으며, 다른 물질은 발현이 되지 않았다. 결론 결론 결론 결론 : : : : 사람 중이 진주종 상피에서는 정상 상피와는 달리 EGF 수용체 자극에 따라 PLC-γ1이 활성화되는 세포 내 하위 신호전달 체계가 과각질화 현상을 일으키는 진주종 발생기전에 중요할 것으로 생각한다. 핵심어 : 중이 진주종, 신호전달 체계, Western blot, 면역조직화학적 염색, RT-PCR
차
차
차
차 례
례
례
례
국문요약 ……… i 차례 ……… iii 그림 차례 ……… iv 표 차례 ……… vi I. 서론 ……… 1 II. 재료 및 방법 ……… 3 A. 재료 ……… 3 B. 방법 ……… 3 1. 표본제작 ……… 3 2. 역전사중합효소반응에 의한 m-RNA발현 ……… 3 3. 면역조직화학적 염색 ……… 5 4. Western blot ……… 6 III. 결과 ……… 9 IV. 고찰 ……… 21 V. 결론 ……… 28 참고문헌 ……… 29 영문요약 ……… 38그
그
그림
림
림차
차
차례
례
례
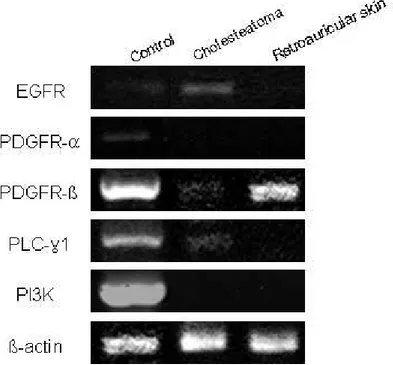
Fig. 1. RT-PCR of EGFR, PDGFR-α, PDGFR-β, PLC-γ1, PI3K
in human middle ear cholesteatoma and retroauricular skin ……… 12
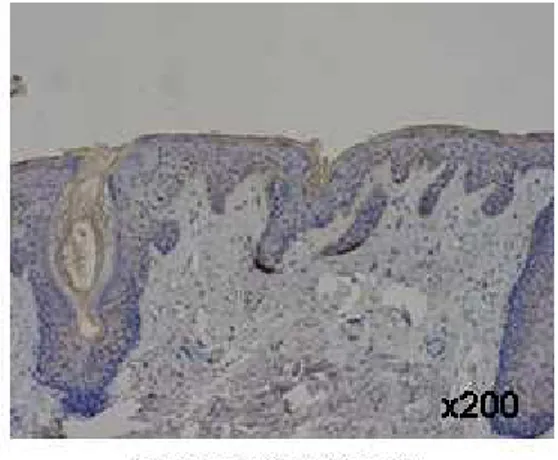
Fig. 2. EGFR immunohistochemical staining in human middle ear
cholesteatoma and retroauricular skin(×200) ……… 13
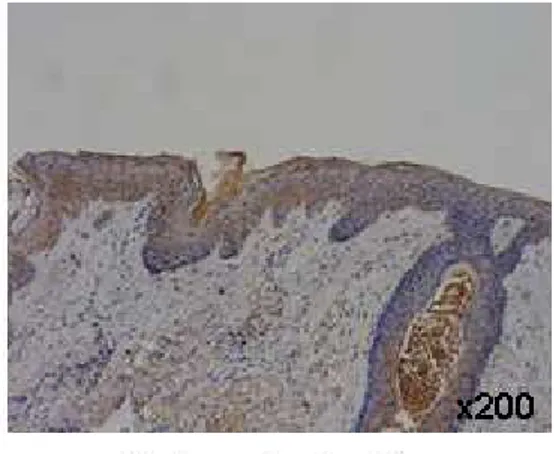
Fig. 3. PDGFR-β immunohistochemical staining in human middle ear
cholesteatoma and retroauricular skin(×200) ……… 14
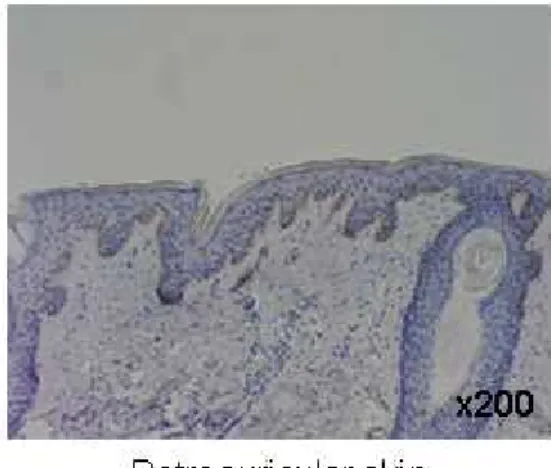
Fig. 4. PLC-γ1 immunohistochemical staining in human middle ear
cholesteatoma and retroauricular skin(×200) ……… 15
Fig. 5. Western blot of EGFR in human middle ear cholesteatoma
and retroauricular skin ……… 16
Fig. 6. Western blot of PDGFR-β in human middle ear cholesteatoma
and retroauricular skin ……… 17
Fig. 7. Western blot of PLC-γ1 in human middle ear cholesteatoma
Fig. 8. Schema of the signal transduction pathway in keratinocytes
표
표
표차
차
차례
례
례
Table 1. Primary antibodies used in this study ……… 8
Table 2. Summary of patterns of markers in each epithelium
using immunohistochemical staining ……… 19
Table 3. Summary of patterns of markers in each epithelium
I.
I.
I.
I. 서
서
서
서 론
론
론
론
중이 진주종은 만성 중이염과 동반되거나 또는 단독 질환으로 발생하여, 중이 주위의 두개골을 포함한 구조물들을 파괴하고 난청과 어지럼증 등의 내이 질환을 유 발함은 물론, 심할 경우에는 두개강 내까지 침범하여 생명을 위협할 수 있는 질환으 로, 이 질환의 원인과 발병기전으로는 기본적으로 상피세포의 과증식 (hyperproliferation), 과분화(hyperdifferentiation), 이동(migration) 등이 관여 하는 것으로 알려져 있다(Derlacki와 Clemis, 1965; Buckingham, 1968; Sade, 1983; Sculerati와 Bluestone, 1989; Kojima 등, 1994; Shinoda 등, 1995, Stammberger 등, 1995). 현재까지 사람의 중이 진주종의 과분화나 과증식에 대해 서는 면역조직화학적 염색법을 통한 cytokeratin, involucrin, filaggrin 등의 발현 을 확인하여 주로 연구하여 왔으나(Broekaert 등, 1988; Chao와 Huang, 1989; Bujia 등, 1993; 박기현 등, 1994; 박기현 등, 1996), 최근에는 분자생물학적 방법 이 도입되면서 세포 외부의 신호가 어떻게 세포 표면의 수용체를 경유하여 세포 내 부로 전달되는 지에 대한 연구도 활발해지고 있다. 세포 내에서 일어나는 여러 가지 생리적 현상은 세포 외부의 연결물질(ligand) 이 세포 표면에 존재하는 특이적인 수용체(receptor)와 결합함으로써 세포 내부에 서 일어나는 일련의 반응을 통해 나타나게 된다. 이렇게 외부의 정보가 세포 내로 전 달되는 과정을 신호전달 체계(signal transduction pathway)라고 한다(Rhee, 1991; Heldin 등, 1998). 세포의 분화와 증식에 관여하는 cell signal에는 diacylgylcerol(DAG)과 inositol 1,4,5-triphosphate(IP3) 등이 있는데(Berrige , 1987; Ryu 등, 1987; Koch 등, 1991; 최지호, 1996), phospholipase C(PLC) 는 PDGFR이나 EGFR과 같은 receptor tyrosine kinase의 기질로phosphatidylinositol-4,5-biphosphate(PIP2)를 IP3와 DAG로 가수분해하여 protein kinase C(PKC) 활성 및 Ca2+의 대사 조절, c-fos와 C-myc의 발현, MAP kinase의 활성 등의 DNA증가와 세포의 분화 및 세포의 종양화 변환을 유발 하고, arachidonic acid의 생성에도 관여하는 이차 전달물질로 알려져 있다 (Carpenter와 Cohen, 1979; Ryu 등, 1987; Meisenhelder 등, 1989; Koch 등, 1991; Martin, 1991; Punnonen 등, 1993; 최지호, 1996; Huang 등, 1996). 최 근 여러 연구에서 PLC-γ1은 PDGFR이나 EGFR과 같은 receptor protein tyrosine kinase와 PLC-γ1 내에 존재하는 Src homology2(SH2) domain이 서 로 반응하여 활성화되어 신호가 전달되는 것으로 알려졌다(Koch 등, 1991). PI3K 는 주로 세포의 성장 및 증식에 관여하는 세포 내 신호전달 물질로, 이러한 점에서 본다면 과증식, 과분화하는 경향이 있는 진주종 조직에서도 세포 내 신호전달 물질 로 PI3K가 관여하고 있을 것으로 생각된다. 또한, 중이 진주종 상피의 형성과정에 세포의 성장과 분화를 조절하는 유전인자의 이상이 연관될 수 있다는 가설이 제시되 고 있어 세포의 성장과 분화에 관여하는 여러 신호전달 인자들을 규명하는 것이 중 요하다고 생각한다(Shinoda와 Huang, 1995). 이에 저자는 세포의 성장 및 증식에 관여하는 세포표면 수용체인 epidermal growth factor receptor(EGFR), platelet derived growth factor receptor-α 및 -β(PDGFR-receptor-α, PDGFR-β), 세포 내 신호전달 물질인 phopholipase C-γ1(PLC-γ1), Phosphatidylinositol 3'-kinase(PI3K)를 이용하여 사람 중이 진주종 상피에서의 발현을 분석함으로써, 사람 중이 진주종에서의 성장인자 수용체(growth factor receptors)와 하위 신호전달 물질(downstream signal transduction molecules)의 역할을 밝히고, 진주종 상피세포의 세포 내 신호전달 체계를 규명하고자 하였다.
II.
II.
II.
II. 재료
재료
재료
재료 및
및
및 방법
및
방법
방법
방법
A. 재료 아주대학교 병원 이비인후과에서 진주종성 중이염으로 수술 받은 환자 10 명 으로부터 수술 시 중이 진주종 상피조직과 대조군으로 동일 환자의 후이개 상피조직 일부를 채취하였다. 이를 위하여 환자의 동의를 얻었으며, 병원연구윤리위원회의 승 인을 얻었다. B. 방법 1. 표본제작 중이수술 시 채취한 진주종 상피조직과 후이개 상피조직을 10% 중성 포르말 린에 48 시간 고정하여 에탄올(ethanol) 농도를 높여주면서 탈수시킨 후, 파라핀에 포매하여 보관하였다. 파라핀 포매 조직을 4~5 ㎛ 두께로 연속 절편하여 면역조직 화학적 염색에 사용하였다. RT-PCR과 Western blot을 위해서는 중이 진주종 상피조직과 후이개 상피조 직을 채취하여 생리식염수로 세척한 후 -70℃로 조직을 급속냉동 시켰다. 특히 후 이개 상피조직을 절제할 때는 상피하조직이 포함되지 않도록 현미경 하에서 최대한 주의하여 채취하였다. 2. 역전사중합효소반응에 의한 m-RNA 발현USA)에 넣어 균질화 시킨 후, 총 RNA를 추출하였다. 중이 진주종 조직과 후이개 상피조직에서 추출된 총 RNA 2 ㎍을 반응혼합물[10× Buffer RT 2.0 ㎕, dNTP Mix(5 mM each dNTP) 2.0 ㎕, Oligo-dT primer(10 μM) 2.0 ㎕, RNase inhibitor(10 units/㎕) 1.0 ㎕, Omniscript Reverse Transcriptase 2 Unit, RNase-free water] 20 ㎕에 넣고 37℃에서 60 분, 94℃에서 5 분간 역전사하여 cDNA를 합성하였다. PCR은 MinicyclerTM(MJ Research, Waltham, MA, USA) 를 사용하였고, 합성된 cDNA를 Taq DNA polymerase 1 Unit(Roche Diagnostics Co., Indianapolis, IA, USA)과 각각의 primer로 증폭시켰다. 사용된 각각의 primer는 다음과 같다. β-actin; up 5'- TACATGGCTGGGGTGTTGAA -3' down 5'- AAGAGAGGCATCCTCACCCT -3' EGFR; up 5'- GGGAAGAGACCTGCATTATCA -3' down 5'- TCATGCTCCAATAAAGCACTGC -3' PDGFR-α; up 5'- CATTTACATCATCACAGAGT -3' down 5'- TCAAAGATGCTCTCAGGAGC -3' PDGFR-β; up 5'- ACTGGGAGGAGGAGCAGGAG -3' down 5'- CAGTGATGATATAGATGGGT -3' PI3K; up 5'- TTAACCCTCTCACAGCAGAG -3' down 5'- AGAATCACAGCGAACCTCTG -3' PLC-γ1; up 5'- CCGTGTCCAGCAAGAGGGCC -3' down 5'- GAGTCGGCAGCAACATCCAG -3'
PCR과정은 초기 변성을 94℃에서 3 분간 실시한 후, 변성은 94℃에서 30 초, 56℃에서 30 초, 72℃에서 30 초간을 총 42 cycles 실시하고, 신장반응 (extension)은 72℃에서 5 분간 시행하였다. 양성 반응을 위한 대조군으로 EGFR, PDGFR-α, PDGFR-β, PLC-γ1에는 NIH3T3 세포주를, PI3K에는 A549 세 포주를 사용하였다. 3. 면역조직화학적 염색 파라핀에 포매한 조직을 4 ㎛로 절편을 만들어 poly-L-lysin으로 도포된 슬 라이드(slide)에 부착시켰다. 조직 슬라이드를 58℃ 오븐에서 12 시간 처리를 하 고, xylene으로 15 분씩 3 회 처리하여 파라핀을 제거하였다. 100%, 90%, 80%, 70%로 농도를 달리한 에탄올에 각각 5 분간 처리하면서 함수화 과정을 진행하였 다. 조직의 내인성 과산화 효소의 활성을 억제하기 위하여 3% 과산화수소수와 메탄 올(methanol)을 1:9의 비율로 혼합한 용액에서 15 분간 처리하고, 비특이적 반응 을 억제하기 위하여 정상 염소 혈청에 30∼40 분간 처리하였다. 일차 항체인 항 EGFR항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:100으로, 항 PDGFR-α항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:30으로, 항PDGFR-β항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:30으 로, 항PLC-γ1항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:150 으로, 항PI3K항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:50으로 각각 희석시켜서(Table 1), 4℃에서 16∼18 시간 동안 반응시켰다. 각각의 슬라이 드를 phosphate buffered saline(PBS)으로 세척 후 이차 항체를 처리하고 avidin-biotin complex와 30 분간 반응시킨 후 3-amino-9-ethyl-carbizole (AEC)로 약 4 분 정도 발색시키고, Meyer's hematoxylin으로 대조 염색을 시행
하였다. 각각의 일차 항체마다 10 개의 진주종 조직 표본 중 5 장씩의 슬라이드를 염색하였고 각각 염색 시마다 후이개 상피조직을 동일한 조건으로 염색하였다. 면역조직화학적 염색의 판정은, 염색된 조직 상피를 기저층(basal layer)과 기 저상층(suprabasal layer)으로 나누어 관찰하였으며, 일차 항체 대신 PBS를 사용 한 표본을 음성 대조군으로 하여 양성 반응은 모두 특이 반응임을 확인하였고, 반응 이 세포막 주변부만 약하게 염색된 경우를 약양성(focal staining, (±)), 400 배 시 야를 2/3까지 채우는 경우를 양성(+), 400 배 시야를 거의 채우는 정도로 강하게 염색이 된 경우를 강양성(++)으로 판정하였으며, 100 배 현미경 시야에서 염색이 잘된 부위를 확인하고, 400 배 시야에서 10 회 판독하여 평균치를 구하였다. 4. Western blot
조직을 EBC 완충액(40 mM Tris/HCl, pH 8.0, 120 mM NaCl, 0.5% NP-40, 2 ㎍/㎖ aprotinine, 2 ㎍/㎖ pepstatin, 2 ㎍/㎖ leupeptin, 100 ㎍/㎖ phenylmethylsulfonyl fluoride)에 넣은 후 유리파쇄기를 이용하여서 조직을 파쇄 한 후, 4℃에서 20 분간 보관하면서 5 분마다 vortex로 섞어주었다. 그 후 4℃에서 12,000 rpm으로 15 분간 원심 분리하여 상층액 만을 다시 취하였다. 소의 혈청 알 부민 액을 표준으로 하여 Bradford법으로 각각의 단백질 양을 측정한 후 2 ㎎/㎖ 농 도의 단백질이 되게 2× sodium dodecyl sulfate(SDS) sample 완충액(100 mM Tris/HCl, pH 6.8, 200 mM dithiothreitol, 4% SDS, 0.2% bromophenol blue, 20% glycerol)을 가한 후 75℃에서 5 분간 가열하여 시료로 이용하였다. 전기영동 은 mini-gel kit(Bio-RadⓇ)를 이용하여 100 V로 1.5∼2 시간동안 영동을 시켰 고, 젤은 6.5% SDS/polyacrylamide를 사용하였다. 전기영동으로 분리된 단백질은 nitrocellulose membrane으로 50 V에서 약 1 시간 동안 전기적인 방법으로 옮겼
으며, Ponceaus 용액을 이용하여 단백질이 nitrocellulose membrane으로 옮겨졌 음을 확인하였다. 이 nitrocellulose membrane을 5% non-fat dry milk가 함유된 TNE 완충액(10 mM Tris/HCl, pH 7.5, 2.5 mM EDTA, 50 mM NaCl, 0.1% Tween 20)으로 1 시간 처리한 후 세균증식 억제를 위한 10% sodium azide가 함 유된 각각의 일차 항체를 4℃에서 16 시간 반응시켰다. 항EGFR항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:1,000으로, 항PDGFR-α항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:1,000으로, 항PDGFR-β항체 (Santa cruz Biotec. Inc. Santa Cruz. CA, USA)를 1:1,000으로, 항PLC-γ1 항체(Santa cruz Biotec. Inc. Santa Cruz. CA, USA)를 1:4,000으로, 항PI3K 항체(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA)를 1:1,000으로, 희석시켰 다(Table 1). 그 후 TNE 완충액으로 10 분간 3 회 수세 후 이차 항체를 은박지로 싼 용기에 nitrocellulose membrane을 옮기고 1 시간정도 처리한 다음 다시 TNE 완충액으로 수세한 후 chemilumin-nescence reagent(NEN, Boston, MA)를 이 용하여 X-ray film(KodakⓇ)에서 3 초에서 5 분 동안 감광시켰다.
Western blot 결과의 분석은 진주종과 후이개 상피의 해당 band의 발현 강도 를 서로 비교하여 발현이 매우 강하면 강양성(++), 보통의 강도로 확실한 발현이 보이면 양성(+), 부분적 발현 또는 희미한 발현을 보이면 약양성(±), 발현이 되지 않으면 음성(-)으로 해석하였다.
Table Table Table
Table 1. 1. 1. Primary 1. Primary Primary antibodies Primary antibodies antibodies used antibodies used in used used in in in this this this study.this study.study.study.
Antibody Dilution
Immunostain Western blot EGFR (polyclonal)
(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA) 1:100 1:1,000 PDGFR-α (monoclonal)
(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA) 1:30 1:1,000 PDGFR-β (polyclonal)
(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA) 1:30 1:1,000 PLC-γ1 (monoclonal)
(Santa Cruz Biotec. Inc. Santa Cruz, CA, USA) 1:150 1:4,000 PI3K (monoclonal)
III.
III.
III.
III. 결
결
결 과
결
과
과
과
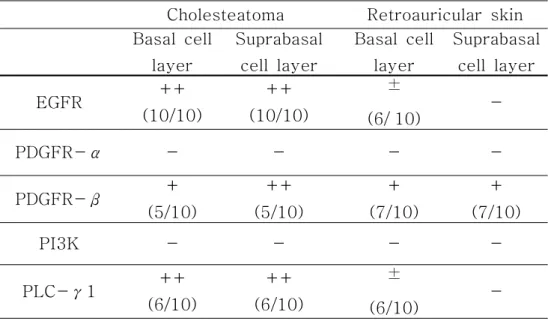
1. RT-PCR RT-PCR 방법을 이용하여 중이 진주종 상피세포와 후이개 상피세포의 각 세 포수용체와 세포 내 물질에 대한 mRNA 발현을 분석하였다. PDGFR-α, PI3K는 두 조직 모두에서 발현되지 않았다. 정량적 분석은 힘들지만 EGFR, PDGFR-β, PLC-γ1이 두 조직에서 발현되었는데, 그 중 EGFR, PLC-γ1은 진주종 상피세 포가 후이개 상피세포보다 더 발현이 잘되었고, PDGFR-β는 진주종 상피세포보다 후이개 상피세포에서 더 발현이 잘되었다(Fig. 1). 2. 면역조직화학적 염색 EGFR EGFREGFR EGFR 중이 진주종 조직과 후이개 상피조직을 동일한 조건하에서 염색하여서 본 결 과, 중이 진주종 조직의 경우는 10 예 조직 모두에서 기저상층과 기저층에서 강하게 양성 반응을 보였으며, 후이개 상피조직의 경우는 4 예는 음성 반응을, 6 예는 기저 층에서만 약양성 반응을 보였다(Table 2, Fig. 2). PDGFR-PDGFR- PDGFR-PDGFR-ββββ 중이 진주종 조직과 후이개 상피조직을 동일한 조건하에서 염색하여서 본 결 과, 중이 진주종 조직의 경우는 10 예 중 5 예에서 기저층과 기저상층에 강하게 양 성 반응을 보였고, 5 예에서는 음성 반응을 보였다. 후이개 상피조직의 경우는 10 예 중 7 예에서 기저층에 양성 및 기저상층 하반부에 양성 반응을 보였고, 2 예에서 는 약양성 반응을, 1 예에서는 음성 반응을 보였다(Table 2, Fig. 3).PLC-PLC- PLC-PLC-γγγγ1111 중이 진주종 조직과 후이개 상피조직을 동일한 조건하에서 염색하여서 본 결 과, 중이 진주종 조직의 경우는 10 예 중 6 예에서 기저층과 기저상층에 강하게 양 성 반응을 보였고, 2 예에서 기저상층이 기저층보다 약간 강하게 염색되는 양성 반 응을, 2 예에서는 음성 반응을 보였다. 후이개 상피조직의 경우는 10 예 중 6 예에 서 기저층에 약양성 반응을, 4 예에서 음성 반응을 보였다(Table 2, Fig. 4). PDGFR-PDGFR-
PDGFR-PDGFR-αααα와 와 와 와 PI3KPI3KPI3KPI3K
중이 진주종 조직과 후이개 상피조직을 동일한 조건하에서 염색하여서 본 결 과, 중이 진주종 조직과 후이개 상피조직의 경우 모두 10 예 중 1-2 예에서만 약양 성 반응을 보였고, 대부분 음성 반응을 보였다(data not shown).
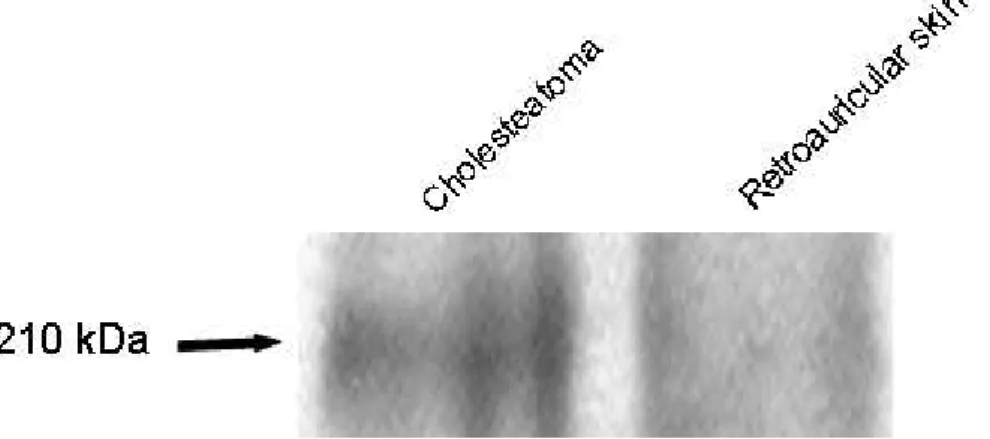
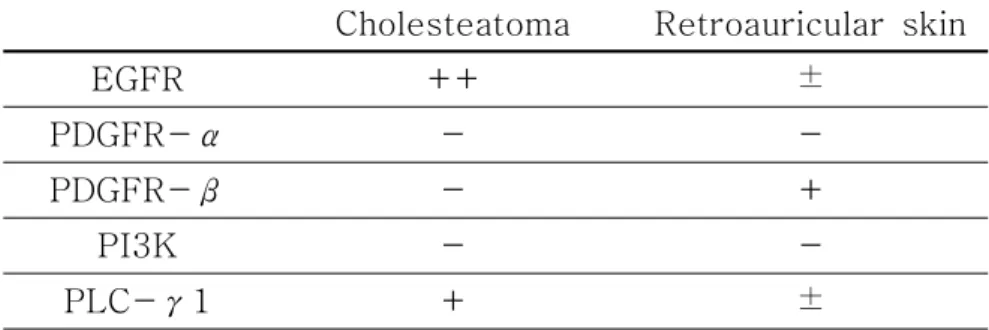
3. Western blot EGFR
EGFREGFR EGFR
총 8 회의 실험을 각각 다른 시료를 이용하여 시행하였으며, 60 ㎍ protein /lane에서 중이 진주종 조직은 6 회에서 210 kDa의 protein band의 강한 양성 발 현을 보였으나, 후이개 상피조직은 발현이 미미하였다. 나머지 2 회는 중이 진주종 조직, 후이개 상피조직에서 모두 발현이 관찰되지 않았다(Table 2, Fig. 5). PDGFR-PDGFR- PDGFR-PDGFR-ββββ 총 9 회의 실험을 각각 다른 시료를 이용하여 시행하였으며, 40 ㎍ protein /lane에서 중이 진주종 조직은 2 회에서 180 kDa의 protein band의 약한 양성 발 현을 보였으나, 후이개 상피조직은 6 회에서 양성 발현을 보였다(Table 3, Fig. 6).
PLC-PLC- PLC-PLC-γγγγ1111
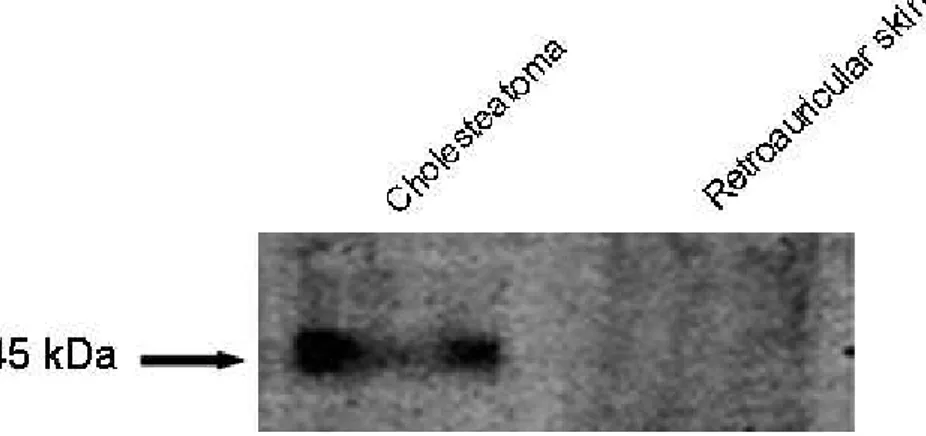
총 10 회의 실험을 각각 다른 시료를 이용하여 시행하였으며, 40 ㎍ protein /lane에서 중이 진주종 조직은 7 회에서 145 kDa의 protein band의 양성 발현을 보였고, 후이개 상피조직은 7 회에서 약한 양성 발현을 보였다. 나머지 3 회에서는 중이 진주종 조직, 후이개 상피조직 모두에서 발현이 관찰되지 않았다(Table 3, Fig. 7).
PDGFR-PDGFR-
PDGFR-PDGFR-αααα와 와 와 와 PI3KPI3KPI3KPI3K
총 10 회의 실험을 각각 다른 시료를 이용하여 시행하였으며, 10 회 모두 중이 진주종 조직과 후이개 상피조직에서 PDGFR-α(170 kDa)와 PI3K(110 kDa)가 모두 발현이 관찰되지 않았다(Table 3).
Fig. Fig. Fig.
Fig. 1. 1. 1. RT-PCR 1. RT-PCR RT-PCR of RT-PCR of of of EGFR, EGFR, PDGFR-EGFR, EGFR, PDGFR-PDGFR-PDGFR-αααα, , , PDGFR-, PDGFR-βPDGFR-PDGFR-βββ, , , , PLC-PLC-PLC-γPLC-γ1, γγ1, 1, PI3K 1, PI3K PI3K PI3K in in in in human human human human middle
middle middle
middle ear ear ear cholesteatoma ear cholesteatoma cholesteatoma cholesteatoma and and and and retroauricular retroauricular retroauricular skin. retroauricular skin. skin. skin. The expression of EGFR and PLC-γ1 is noted in the cholesteatoma epithelium more than in the retroauricular skin, while the expression of PDGFR-β is noted in the retroauricular skin more than in the cholesteatoma epithelium. The expression of PI3K and PDGFR-α is not noted in the both epithelia.
Fig. Fig. Fig.
Fig. 2. 2. 2. 2. EGFR EGFR EGFR EGFR immunohistochemical immunohistochemical immunohistochemical immunohistochemical staining staining in staining staining in in in human human human middle human middle middle middle ear ear ear ear cholesteatoma
cholesteatoma cholesteatoma
cholesteatoma and and and retroauricular and retroauricular retroauricular retroauricular sssskkkkiiiinn((((×nn ×××222020000000)))).... Positive staining is noted in both basal and suprabasal layers of cholesteatoma epithelium, while weakly positive staining is noted only in the basal layer of retroauricular skin.
Fig. Fig. Fig.
Fig. 3. 3. 3. PDGFR-3. PDGFR-PDGFR-βPDGFR-ββ immunohistochemical β immunohistochemical immunohistochemical immunohistochemical staining staining in staining staining in in in human human human human middle middle middle middle ear ear ear ear cholesteatoma
cholesteatoma cholesteatoma
cholesteatoma and and and retroauricular and retroauricular retroauricular retroauricular sssskkkkiiiinn((((×nn ×××222020000000)))).... Positive staining is noted in both cholesteatoma epithelium and retroauricular skin.
Fig. Fig. Fig.
Fig. 4. 4. 4. PLC-4. PLC-PLC-PLC-γγγ1 γ1 1 1 immunohistochemical immunohistochemical staining immunohistochemical immunohistochemical staining staining in staining in in human in human middle human human middle middle ear middle ear ear ear cholesteatoma
cholesteatoma cholesteatoma
cholesteatoma and and and retroauricular and retroauricular retroauricular retroauricular sssskkkkiiiinn((((×nn ×××222020000000)))).... Positive staining is noted in both basal and suprabasal layers of cholesteatoma epithelium, while weakly positive staining is noted only in the basal layer of the retroauricular skin.
Fig. Fig. Fig.
Fig. 5. 5. 5. 5. Western Western Western Western blot blot of blot blot of of of EGFR EGFR EGFR EGFR in in human in in human human human middle middle middle ear middle ear ear cholesteatoma ear cholesteatoma cholesteatoma and cholesteatoma and and and retroauricular
retroauricular retroauricular
retroauricular skin. skin. skin. skin. The cholesteatoma specimens show staining of protein band, whereas the retroauricular skin specimens show no staining of protein band.
Fig. Fig. Fig.
Fig. 6. 6. Western 6. 6. Western Western blot Western blot blot blot of of PDGFR-of of PDGFR-PDGFR-PDGFR-ββββ, , in , , in in human in human human human middle middle middle middle ear ear cholesteatoma ear ear cholesteatoma cholesteatoma cholesteatoma and and and and retroauricular
retroauricular retroauricular
retroauricular skin. skin. skin. The cholesteatoma specimens show no staining of skin. protein band, whereas the retroauricular skin specimens show staining of protein band.
Fig. Fig. Fig.
Fig. 7. 7. Western 7. 7. Western Western Western blot blot blot of blot of PLC-of of PLC-PLC-γPLC-γγγ1 1 in 1 1 in in human in human human human middle middle middle middle ear ear cholesteatoma ear ear cholesteatoma cholesteatoma cholesteatoma and and and and retroauricular
retroauricular retroauricular
retroauricular skin.skin.skin.skin. The cholesteatoma specimens show more intense staining of protein band, whereas the retroauricular skin specimens show weak staining of protein band.
Table Table Table
Table 2. 2. 2. 2. Summary Summary Summary Summary of of of of patterns patterns patterns of patterns of markers of of markers markers in markers in in in each each epithelium each each epithelium epithelium epithelium using using using using immunohistochemical
immunohistochemical immunohistochemical
immunohistochemical staining.staining.staining.staining.
++: strong positive, +: positive, ±: weak positive, -: negative. Cholesteatoma Retroauricular skin Basal cell layer Suprabasal cell layer Basal cell layer Suprabasal cell layer EGFR ++ (10/10) ++ (10/10) ± (6/`10) -PDGFR-α - - - -PDGFR-β + (5/10) ++ (5/10) + (7/10) + (7/10) PI3K - - - -PLC-γ1 ++ (6/10) ++ (6/10) ± (6/10)
-Table Table Table
Table 3. 3. 3. 3. Summary Summary Summary of Summary of patterns of of patterns patterns patterns of of of of markers markers in markers markers in in in each each each epithelium each epithelium epithelium epithelium using using using using Western Western Western Western blot(most
blot(most blot(most
blot(most commonly commonly commonly observed commonly observed observed observed pattern pattern pattern pattern of of of expression).of expression).expression).expression).
++: strong positive, +: positive, ±: weak positive, -: negative. Cholesteatoma Retroauricular skin
EGFR ++ ±
PDGFR-α -
-PDGFR-β - +
PI3K -
IV.
IV.
IV.
IV. 고
고
고
고 찰
찰
찰
찰
진주종은 기원에 상관없이 중이강 내에 비정상적인 각질편평상피세포가 존재 하는 것으로 특징 지워질 수 있다. 중이강 내의 편평상피세포들은 과증식과 과분화 의 양상을 보이며, 이 현상들은 cytokeratin 16, Ki-67, filaggrin 그리고 involucrin 등을 이용하여 어느 정도 증명이 되어 왔으나(Bujia 등, 1993; Sasaki 와 Huang, 1994; Stammberger 등, 1995; Ergun 등, 1996), 최근에는 신호전달 체계가 발견되면서 이러한 연구에 분자생물학적 개념을 많이 도입하고 있다. 인체를 구성하는 세포는 각각의 단일한 세포 단위의 기능을 수행하고, 또한 하 나의 기관으로서, 나아가서는 하나의 개체 수준의 기능을 수행하여야 한다. 이를 위 해서는 세포와 세포 간에 정보의 교환이 원활하게 이루어져야 하고, 결국 변화하는 외부 상황에 대하여 적절하게 대처함으로써 개체가 생명현상을 유지하게 된다. 즉, 신호전달 체계란 외부의 정보가 세포막을 통과하여 세포질을 거쳐 핵 내로 전달되어 세포의 변화를 유발하는 일련의 과정으로, 성장과 분화, 대사 등 생명 현상의 모든 과정에 필수적이며, 이러한 신호전달 체계의 이상은 여러 질병을 초래하게 된다. 이 여러 단계들 중에서 한 부분의 이상이 있다면 신호전달 과정이 정상적으로 이루어지 지 않을 것이고, 비정상적인 증식이나 세포의 괴사 등을 유발할 수도 있을 것이다. 진주종 세포에서 이 신호전달 체계의 기전이 밝혀진다면, 진주종의 병태생리에 대한 이해는 물론이고, 나아가서 진주종의 치료와 예방에 있어서 중요한 전기를 마련할 수도 있을 것으로 생각한다. 편평상피세포의 증식과 분화의 조절에는 일차 신호전달 물질들인 interleukin -1(IL-1), interleukin-6(IL-6), tumor necrotic factor-α(TNF-α), tumor necrotic factor-β(TNF-β), tranforming growth factor-α(TGF-α),
prostaglandin, leukotrien, epidermal growth factor(EGF), platelet derived growth factor(PDGF) 등이 관여하고(Downward 등, 1984; Moon 등, 2002), 이 중 TGF-α, EGF, PDGF는 수용체의 tyrosine phosphorylation을 통해 세포증식 을 유도하는 중요한 물질로 알려져 있으며(민원식 등, 1995), 수용체의 tyrosine kinase가 활성화되면, 이 효소의 기질인 신호전달 물질로 Src homology 2(SH2) domain을 가지고 있는 phosphatidylinositol 3'-kinase(PI3K), phospholipase C-γ(PLC-γ), Grb2/Sos1, Src 등이 활성화된다(Fig. 8)(Ushiro와 Cohen, 1980; Meisenhelder 등, 1989; Rhee, 1991; Bujia 등, 1996; Heldin 등, 1998).
EGFR은 210 kDa의 당단백질로 세포 내부의 tyrosine kinase 부위, 세포 외 부의 ligand 결합부위, 세포막 부위의 세 부분으로 나뉘며(Costa와 Stamm, 1988), 세포 외 부위와 EGF가 결합하여 세포 내 부위의 tyrosine kinase를 활성화시키고, 신호전달 경로를 통하여 핵 내에서 c-jun 또는 c-fos 등의 transcription factor의 발현을 통해 유전자의 발현을 조절하여 세포의 증식을 유도한다(Cohen, 1983; Hunter, 1984; Carpenter, 1987; Shinoda와 Huang, 1995). EGFR은 모든 배엽 세포 기원의 조직에 존재하나, 특히 피부, 위장관, 비뇨생식기의 상피에 많이 존재하 는 것으로 알려져 있다. 특히 피부질환인 건선이나 피부종양(King 등, 1990; Xian 등, 1995), 뇌종양(Fleming 등, 1992), 사람의 진주종(Schulz 등, 1993; Dlugosz 등, 1994; Ergun 등, 1996; 손수중 등, 1997; 송영호 등, 1998)에서는 EFGR의 과발현이 알려져 있다. 정상 상피에 있어서는 EGFR의 발현이 기저상층에는 관찰되 지 않으나 기저층에서 나타난다는 보고가 있고(Schulz 등, 1993), 기저상층과 기저 층 모두에서 발현되지 않는다는 보고도 있다(Gullick과 Hughes, 1991; Ergun 등, 1996).
Fig. Fig. Fig.
Fig. 8. 8. 8. Schema 8. Schema Schema Schema of of the of of the the signal the signal signal transduction signal transduction pathway transduction transduction pathway pathway pathway in in in in keratinocytes keratinocytes keratinocytes keratinocytes of of of human of human human human middle
middle middle
middle ear ear ear ear cholesteatomacholesteatomacholesteatomacholesteatoma
PIP2: phosphatidylinositol-4,5-biphosphate IP3: inositol-1,4,5- triphosphate
DAG: diacylglycerol
PLC-γ1: phospholipase C-γ1 PI3K: phosphatidylinositol 3'-kinase PKC: protein kinase C
본 연구에서는 진주종에서 기저상층과 기저층 모두 강한 발현을 보였고, 후이개 상 피에서는 기저층에서만 부분적으로 발현되었다. EGFR이 진주종의 세포 표면에 많 이 분포함은 진주종 세포의 비정상적인 과증식의 원인 중 중요한 하나가 될 가능성 이 높을 것으로 생각되며(Tsuruhara 등, 1993), 후이개 상피에서의 미약한 발현은 다른 보고(Gullick과 Hughes, 1991; Fleming 등, 1992; Ergun 등, 1996)와일치 한다.
PDGFR은 PDGFR-α(170 kDa)와 PDGFR-β(180 kDa)의 두 종류로 PDGF와 결합하여 역시 수용체의 tyrosine kinase를 활성화시킨다(Cooper 등, 1982). PDGF는 dimerized 단백질로 A chain과 B chain이 disulfide bond로 연결 되어있으며, PDGF-AA, AB 그리고 BB의 세 가지 isoform이 존재하고, 이들은 강 력한 화학주성인자이며 또한 섬유아세포나 혈관내피세포의 세포분열을 촉진시킨다. PDGFR-α는 세 가지의 PDGF와 모두 높은 친화도를 보이나, PDGFR-β는 PDGF-BB와만 강한 친화도를 보인다(Ebert 등, 1995; Heldin 등, 1998). 저자는 PDGF와 결합한 이후 EGFR과 유사한 신호전달 체계를 보이는 PDGFR의 발현을 사람 중이 진주종에서 관찰하였는데, PDGFR-α는 RT-PCR, 면역조직화학적 염 색, Western blot 모두에서 발현되지 않았지만, PDGFR-β는 면역조직화학적 염 색에서 강하게 발현됨을 확인할 수 있었다. 한편, 정상 후이개 상피에서는 PDGFR-β가 약하게 발현되고 있었다. 이러한 결과를 토대로, 진주종에서 PDGF-BB 형태 의 isoform과 결합되는 PDGFR-β가 활성화 되어있다고 생각할 수도 있지만, 면 역조직화학적 염색에서만 양성 반응을 보이고, RT-PCR과 Western blot에서는 음 성 반응을 보인 것을 고려하면 면역조직화학적 염색의 결과가 위양성일 가능성도 있 다고 판단한다. 이에 대한 검증은 추후 추가적인 연구가 필요할 것으로 생각한다.
Phospholipase C(PLC)는 돼지의 뇌에서 최초로 세 종류의 isozyme이 분리 되었고(Ryu 등, 1987; Sur 등, 1988), 현재는 크게 β, γ, δ의 세 가지 형태로 분 류되며, 포유동물에서는 총 10 종이 알려져서 β 형태가 4 종류, γ 형태가 2 종류, δ 형태가 4 종류이다. 이 중 PLC-γ1은 제한적인 분포를 보이는 PLC-β나 -δ 와는 달리 거의 모든 조직에서 어느 정도는 발현이 되는 것으로 알려져 있고, 선택적 으로 성장 촉진인자의 신호를 전달하는 효소이다(송영호 등, 1998). PLC-γ1은 EGFR과 PDGFR이 각각 EGF와 PDGF와 결합함으로써 활성화되는 상피증식을 유 도하는 가장 중요한 물질인 tyrosine kinase의 기질로, 배아의 발달과 여러 종양에 서 많은 연구가 시행되어 왔다(Meisenhelder 등, 1989; Nanney 등, 1992; Yang 등, 1994; 전영명 등, 1997). 활성화된 PLC-γ1은 세포막의 인지질 (Phospholipid)인 phosphatidylinositol-4,5-biphosphate(PIP2)를 가수분해하 여 세포질 내의 이차 전달물질(second messenger, mediator)인 inositol-1,4,5- triphophate(IP3)와 diacylglycerol(DAG)을 생성하게 된다. 이외에도 PLC-γ1 은 Ca2+과 protein kinase C의 존재 하에 Na+/H+ exchanger의 활성화에도 관여 하는 것으로 알려져 있다. 또한, PLC-γ1이 없는 세포에 IP3와 DAG를 투여한 경 우 세포의 증식이 일어나지 않는 것이 보고되어, PLC-γ1은 세포분열 과정에 중요 한 역할을 담당하는 것으로 생각된다(Rhee 등, 1989; Demali 등, 1997; Wang 등, 1998). 본 연구에서, 면역조직화학적 염색에서는 진주종 조직에서 기저상층과 기저 층 모두 PLC-γ1의 발현이 강하게 관찰되었고, 후이개 상피조직에서는 미약한 발 현을 관찰할 수 있었으며, Western blot 및 RT-PCR에서도 역시 동일한 소견을 관 찰할 수 있었다. 결국, 진주종의 경우 PLC-γ1을 매개로 하여 과증식을 유발하는 기전이 관여함을 확인할 수 있었다. 즉, 세포 외부의 자극에 따른 PLC-γ1을 통한 세포 내부의 하위 신호전달 체계가 진주종 세포에서 활성화되어있음을 알 수 있다.
PI3K는 지금까지 활발하게 연구되어 온 세포 내 신호전달 물질중의 하나로 (Sarah 등, 1996), inositol에 작용하여 inositol ring의 3'을 인산화 시키는 lipid kinase이다. PI3K의 생리학적 중요성은 아직 확실하게 밝혀진 바가 없으나 세포의 성장, 생존, 증식, 분화 및 대사, membrane trafficking 조절, apoptosis의 억제에 관여하며(Mindaugas와 Andruis, 1993; Helden 등, 1998; Jason 등, 1998; Sally 등, 1999), 이외에도 상피세포의 MSP(macrophage stimulating protein)에 의한 integrin 의존성 유착반응을 매개한다(Alla 등, 1999). 또한, PI3K의 regulatory subunit(p85)은 profilin이라는 actin 결합단백에 작용하여 세포골격의 구성을 조절하고(Bhargavi 등, 1998), 세포막 기저부의 glucose transporter의 인 슐린(insulin)에 대한 translocation이나 recycling에도 관여하여 인슐린 저항성 당 뇨병의 한 병인임이 확인됐다(Torben 등, 1997). PI3K는 두 개의 subunit 즉, regulatory subunit(p85)과 catalytic subunit(p110)으로 구성되어 있으며, catalytic subunit(p85)은 PDGFR에 의해 활성화된다. 그 과정에 대하여 간략히 설 명해 보면, regulatory subunit(p85)의 두 개의 SH2 domain과 PDGFR의 tyrosine kinase가 결합함으로써 regulatory subunit(p85)의 인산화가 일어나게 되면 catalytic subunit(p110)의 구조적 변화가 생기게 되고, 이로 인하여 catalytic subunit(p110)의 활성이 증가한다(Mindaugas와 Andruis, 1993; Matthias 등, 1997; Heldin 등, 1998). 활성화된 PI3K는 inositol에 작용하게 되는 데, 그 중에서도 PIP2에 먼저 작용하여 18 inositol의 3'의 인산화가 일어나며, inositol이 활성화되어 세포기능에 영향을 주게 된다(Alex, 1998). 본 연구에서는 PI3K가 진주종 상피에서 거의 발현되지 않았는데, 이는 진주종 세포의 세포 내 신 호전달이 PI3K보다는 PLC-γ1에 의해 활성화될 가능성을 제시한다. 이는 PI3K 가 주로 PDGFR에 의해 활성화되는 것에 기초할 때, 본 연구에서 중이 진주종 조직
에서 PDGFR이 α type은 발현되지 않고 β type만이 발현되며, 정상 후이개 상피 조직과 발현의 차가 크지 않은 것과 종합할 때, 진주종 상피세포에서의 세포 내 활성 체계가 주로 PLC-γ1에 의해 이루어진다고 생각할 수 있다. 본 연구의 결과를 보면, 이전에 Mongolian Gerbil을 이용한 동물모델에서의 연구와 비슷하게(이동훈 등, 1999) 중이 진주종 조직에서는 과다히 발현된 EGFR 과 이와 관련된 신호전달 물질인 PLC-γ1을 이용하는 신호전달 체계가 활성화되 어있음을 알 수 있었다. 또한 정상 후이개 상피조직에서는 EGFR, PDGFR, PLC-γ1의 발현이 낮은 것으로 보아 진주종 조직만큼 세포성장 및 분열 기전이 활성화되 어있지 않거나, 다른 신호전달 체계가 더 활성화되어있을 수 있다고 판단한다. 현재 의 결과로 진주종의 광범위한 신호전달 체계를 모두 설명할 수는 없으나 앞으로의 연구에 중요한 자료의 일부를 차지할 수 있을 것이라 믿으며, 신호전달 체계를 이해 하기 위해서는 신호전달 물질로서 tyrosine kinase의 기질로 이용되는 다른 물질들 에 대한 연구와 PLC-γ1, PI3K 이후의 신호전달 과정에 대한 연구, 그리고 anti -phosphotyrosin항체 등을 이용한 tyrosine phosphorylation의 정도에 대한 연 구 등이 병행되어야 할 것으로 생각한다. 또한, 진주종의 형성 단계나 조직 파괴의 유무 등의 각기 다른 상황을 실험적으로 유도하면 한 단계 나아간 진주종의 과증식 및 과분화의 연구가 가능하리라 생각한다.
V.
V.
V.
V. 결
결
결
결 론
론
론
론
저자는 RT-PCR, Western blot, 면역조직화학적 염색 방법을 이용하여 사람 중이 진주종에서 정상 후이개 상피와는 달리 EGFR, PLC-γ1이 과발현되고 있으 며, PDGFR-α와 PI3K는 발현되지 않음을 확인하였다. 사람 중이 진주종 상피에 서는 EGF 세포수용체 자극에 따라 PLC-γ1이 활성화되는 세포증식 및 분열에 관 한 세포 내 하위 신호전달 체계가 PDGFR과 PI3K를 통한 신호전달 체계보다도 진 주종 발생기전에 더 관여하는 것으로 생각한다.참
참
참고
고
고문
문
문헌
헌
헌
1. 김진형, 김형종, 박지영: 중이 진주종 상피 및 배양된 각질세포에서 상피성장인자 수용체의 발현에 관한 연구. 대한이비인후과학회지 41:559-566, 1998 2. 민원식, 정희섭, 박재영, 전병훈, 송계용: 진주종 편평상피세포에서 증식표지인자 발현에 관한 면역조직화학적 연구. 대한이비인후과학회지 38:1884-1900, 1995 3. 박기현, 전영명, 박홍준: 중이진주종상피의 사이토케라틴에 대한 면역조직화학 적 연구. 대한이비인후과학회지 37:5-13, 1994 4. 박기현, 전영명, 박홍준: 실험적 진주종의 사이토케라틴 발현양상. 대한이비인 후과학회지 39:747-753, 1996 5. 손수중, 이상호, 박준식, 이승흔, 이상숙: 중이 진주종에서 In Situ Hybridization 과 면역조직화학법에 의한 상피성장인자 수용체 mRNA와 단백의 발현에 관한 연구. 대한이비인후과학회지 40:1632-1641, 1997 6. 송영호, 홍남표, 이동엽, 김영도, 안회영, 차창일: 중이 진주종에서 Phospholipase C-γ1의 발현. 대한이비인후과학회지 41:830-838, 1998 7. 이동훈, 박기현, 박홍준, 전정민, 황성철: Mongolian Gerbil에서 실험적으로 유도된 진주종에서의 신호전달체계에 관한 연구. 대한이비인후과학회지 42:679-685, 1999 8. 전영명, 박기현, 이동훈, 황성철: 중이진주종에서의 PLC-γ1의 발현. 대한이비 인후과학회지 40:984-989, 19979. 최지호: 각질 형성 세포 내의 신호전달 체계. 대한피부연구학회지 3:99-110, 1996
10. Alex T: The synthesis and cellular roles of phosphatidylinositol-4,5 -biphosphate. Curr Opin Cell Biol 10:254-261, 1998
11. Alla D, Alison S and Edward JL: Macrophage stimulating protein induced epithelial cell adhesion is mediated by a PI3-K-dependent, but FAK-independent mechanism. Exp Cell Res 248:575-582, 1999
12. Berrige MJ: Inositol triphosphate and diacylglycerol: two interacting second messengers. Ann Rev Biochem 56:159-193, 1987
13. Bhargavi V, Veerendra BC, Surya SS: PI3-K binds to profilin through the P85α subunit and regulates cytoskeletal assembly. Biochem Mol biol int 46:241-248, 1998
14. Broekaert D, Cornille A, Eto H: A comparative immunohistochemical study of cytokeratin and vimentin expression in the middle ear mucosa and cholesteatoma, and in epidermis. Virchows Arch Pathol Anat
413:39-51, 1988
15. Buckingham RA: Etiology of a middle ear cholesteatoma, kodachrome study of pathogenesis. Ann Otol Rhinol Laryngol 77:1054-1058, 1968 16. Bujia J, Holly A, Schilling V, Negri B, Pitzke P: Abberant expression of
epidermal growth factor receptor in aural cholesteatoma. Laryngoscope
17. Bujia J, Kim C, Holly A, Sudhoff H, Ostos P, Kastenbauer E: Epidermal growth factor receptor(EGFR) in human middle ear cholesteatoma: An analysis of protein production and gene expression. Am J Otol 17 :203-206, 1996
18. Bujia J, Schilling V, Holly M, Stammberger M, Kastenbauer E: Hyperproliferation associated keratin expression in human middle ear cholesteaoma. Acta Otolaryngol (Stockh ) 113:354-368, 1993
19. Carpenter G: Receptors for epidermal growth factor and other polypeptide mitogens. Annu Rev Biochem 56:881-894, 1987
20. Carpenter G, Cohen S: Epidermal growth factor. Annu Rev Biochem
48:193-216, 1979
21. Chao WY, Huang CC: An immunohistochemical study cytokeratin expression in human middle ear cholesteatoma. Arch Otorhinolaryngol
246:37-42, 1989
22. Cohen S: The epidermal growth factor(EGF). Cancer 51:1787-1791, 1983
23. Cooper JA, Bowen-pope D, Raines E: Similar effects of platelet derived growth factor and epidermal growth factor on the phosphorylation of tyrosine in cellular protein. Cell 31:363-367, 1982
24. Costa S, Stamm H: Predictive value of EGF receptor in breast cancer.
25. Demali KA, Whiteford CC, Ulug ET, Kazlauskas: Patelet derived growth factor-dependent cellular transformation requires either phospholipase or phophatidylinositol 3 kinase. J Bio Chem 272:9011-9018, 1997
26. Derlacki E, Clemis J: Congenital cholesteatoma of the middle ear and mastoid. Ann Oto Rhino Laryngol 74:700-727, 1965
27. Dlugosz AA, Cheng C, Denning MF, Dempsey PJ, Coffey RJ, Yuspa SH: Keratinocyte growth factor receptor ligands induced transforming growth factor α expression and activate the epidermal growth factor receptor signaling pathway in cultured epidermal keratinocytes. Cell growth Differ 5:1283-1292, 1994
28. Downward Y, Yarden Y, Mayers E: Close similarity of epidermal growth factor receptor and v-erb-B oncogene protein sequences. Nature
307:521-527, 1984
29. Ebert M, Yokohama M, Friess H, Kobrin MS, Buchler MW, Korc M: Induction of platelet-derived growth factor-α and -β chain and overexpression of their receptors in human pancreatic cancer. Int J Cancer 62:529-535, 1995
30. Ergun S, Zhen X, Carlsoeoe B: Expression of transforming growth factor-α and epidermal growth factor receptor in middle ear cholesteatoma. Am J Otol 17:393-396, 1996
31. Fleming TP, Saxena A, Clark C, Robertson JT, Oldfield EH, Aaronson SA: Amplification and/or overexpression of platelet-derived growth factor receptor and epidermal growth factor receptor in human glial tumors. Cancer Res 52:4550-4553, 1992
32. Gullick WJ, Hughes CM: Immunohistochemical detection of the epidermal growth factor receptor in paraffin-embedded human tissues.
J Pathol 164:285-289, 1991
33. Heldin CH, Ostman A, Ronnstrand L: Signal transduction via platelet derived growth factor receptors. Biochim Biophys Acta 1378:79-113, 1998
34. Huang CC, Chen CT, Huang TS, Shinoda H: Mediation of signal transduction in keratinocytes of human middle ear cholesteatoma by ras protein. Eur Arch Otorhinolaryngol 253:385-389, 1996
35. Hunter T: The epidermal growth factor receptor gene and its product.
Nature 311:414-416, 1984
36. Jason L, Dora F, Mingyao L, Irene T, Isabella C, Danifiela R, Martin P: PDGF-induced glucosaminoglycan synthesis is mediated via PI3-K. Am J Physiol 274:702-713, 1998
37. King LE, Gates RE, Stoscheck CM: EGF/TGF-α receptors and psoriasis. J Invest Dermatol 95:10-12, 1990
38. Koch CA, Anderson D, Moran MF, Ellis C and Pawson T: SH-2 and SH-3 domains: Elements that control interactions of cytoplasmic signaling proteins. Science 252:668-674, 1991
39. Kojima H, Shiwa M, Kamide Y, Moriyama H: Expression and localization of mRNA for epidermal growth factor and epidermal growth factor receptor in human cholesteatoma. Acta Otolaryngol (Stockh) 114:423-429, 1994
40. Martin RFJ: Receptor regulation of phosphoinositidase C. Pharmacol Ther 49:329-345, 1991
41. Matthias K, John CW and Peter B: Platelet-derived growth factor in human brain tumors. J Neurooncol 35:289-301, 1997
42. Meisenhelder J, Suh PG, Rhee SG, Hunter T: Phospholipase C-γl is a substrate for the PDGF and EGF receptor protein tyrosine kinases in vivo and in vitro. Cell 57:1109-1122, 1989
43. Mindaugas V, Andruis K: PLC-γ1 and PI3K are downstream mediators of PDGF receptor's mitogenic signal. Cell 73:321-334, 1993
44. Moon SK, Lee HY, Li JD: Activation of a Src-dependent raf-MEK 1/2-ERK signaling pathway is required for IL-1α induced upregulation of β defensin 2 in human middle ear epithelial cells. Biochem Biophys Acta 1590:41-50, 2002
45 Nanney LB, Gates R, Todderud G, King LE, Carpenter G: Altered distribution of phospholipase C-γ1 in benign hyperproliferative epidermal disease. Cell Growth Differ 3:233-239, 1992
46. Punnonen K, Denning M, Lee E, Li L, Rhee SG, Yuspa SH: Keratinocyte differentiation is associated with changes in the expression and regulation of phospholipase C isozymes. J Invest Dermatol
101:719-726, 1993
47. Rhee SG: Inositol phospholipid-specific phospholipase C: interaction of the γ1 isoform with tyrosine kinase. Trends Biochem Sci 16:297-301, 1991
48. Rhee SG, Suh PG, Ryu SH, Lee SY: Studies of inositol-specific phospholipase C. Science 244:546-550, 1989
49. Ryu SH, Cho KS, Lee KY, Suh PG, Rhee SG: Purification and characterization of two immunologically distinct phosphoinositide -specific phospholipase C from bovine brain. J Biol Chem
262:12511-12518, 1987
50. Sade J, Babiachi A, Pinkus G: The metaplastic and congenital origin of cholesteatoma. Acta Otolaryngol(Stockh) 96:119-123, 1983
51. Sally JL, Bart V, Michael DW: Signalling through Phosphoinositide 3-kinases: lipids take centre stage. Curr Opin Cell Biol 11:219-225, 1999
52. Sarah S, David F, Richard K: Signal transduction through lipid second messengers. Curr Opin Cell Biol 8:159-167, 1996
53. Sasaki M, Huang CC: Expression of cytokeratins 13 and 16 in middle ear cholesteatoma. Otolaryngol Head Neck Surg 110:310-317, 1994 54. Schulz P, Bujia J, Holly A, Schilling V, Kastenbauer E: Possible
autocrine growth stimulation of cholesteatoma epithelium by transforming growth factor-α. Am J Otol 14:82-87, 1993
55. Sculerati N, Bruestone CD: Pathogenesis of cholesteatoma. Otolaryngol Clin Nor Am 22(5):859-868, 1989
56. Shinoda H, Huang CC: Expression of c-jun and p53 protein in human middle ear cholesteatoma: Relationship to keratinocyte proliferation, differentiation, and programmed cell death. Laryngoscope 105 :1232-1237, 1995
57. Stammberger M, Bujia J, Kastenbauer E: Alteration of epidermal differentiation in middle ear cholesteatoma. Am J Otol 16:527-531, 1995
58. Sur PG, Ryu SH, Chai WC, Lee KY, Rhee SG: Monoclonal antibodies to three phospholipase C isozymes from bovine brain. J Bio Chem
263:14477-14504, 1988
59. Torben H, Carsten BA, Soren ME, Soren AU, Jesper OC: Identification of a common aminoacid polymorphism in the p85α regulatory subunit of PI3-K. Diabetes 46:494-501, 1997
60. Tsuruhara K, Iwano T, Ushiro K: Proliferative activity of cholesteatoma epithelium. In: Nakano Y, editor. Cholesteatoma and Mastoid Surgery Amsterdam. Kugler 223-226, 1993
61. Ushiro M, Cohen S: Identification of phosphotyrosine as a product of epidermal growth factor-activated protein kinase in A431 cell membranes. J Biol Chem 255:8363-8365, 1980
62. Wang Z, Gluck S, Zhang L, Moran MF: Requirement for phopholipase C-γ1 enzymatic activity in growth factor induced mitogenesis. Mol Cell Biol 18:590-597, 1998
63. Xian W, Kiguchi K, Imamoto A, Rupp T, Zilberstein A, Di-Giovanni J: Activation of the epidermal growth factor receptor by skin tumor promotors and in skin tumor from SENCAR mice. Cell Growth Differ 6 :1447-1455, 1995
64. Yang LJ, Rhee SG, William JR: Epidermal growth factor induced activation and translocation of phopholipase C-γ1 to the cytoskeleton in rat hepatocytes. J Biol Chem 269:7156-7162, 1994
---AAABBBSSSTTRTRRAAACCCTTT--
-Downstream
Downstream
Downstream
Downstream Signal
Signal
Signal Transduction
Signal
Transduction
Transduction Pathway
Transduction
Pathway
Pathway
Pathway
in
in
in
in Human
Human
Human
Human Middle
Middle
Middle Ear
Middle
Ear
Ear Cholesteatoma
Ear
Cholesteatoma
Cholesteatoma
Cholesteatoma
Jie-Soo Jie-Soo Jie-Soo Jie-Soo KimKimKimKim
Department Department Department
Department of of of of Medical Medical Medical SciencesMedical SciencesSciencesSciences The
The The
The Graduate Graduate Graduate School, Graduate School, School, School, Ajou Ajou Ajou UniversityAjou UniversityUniversityUniversity
(Supervised (Supervised (Supervised
(Supervised by by by Professor by Professor Professor Keehyun Professor Keehyun Keehyun Keehyun Park)Park)Park)Park)
Objectives ObjectivesObjectives
Objectives: Human cholesteatoma in the middle ear is characterized by the presence of a keratinized epithelium which is believed to have the hyperproliferative property. The pathogenesis of cholesteatoma including its hyperproliferative characteristic is still unknown. The proliferation and differentiation of cells in specialized tissues and the expression of their properties are under the control of a large number of regulatory processes and complex interactions called signal transduction. The signal transduction pathway may be initiated by the external signals such as growth factors which bind to their receptors and activate tyrosine kinases in the plasma membrane. With the development of the techniques of cell and molecular biologies, there have been many efforts to find the causes and to examine
the biologic behaviors of the cholesteatoma.
This study was undertaken to investigate the distribution of PLC-γ1, EGFR, PI3K and PDGFR in human middle ear cholesteatoma.
Materials Materials Materials
Materials and and and and MethodsMethodsMethodsMethods: Using Western blot, RT-PCR and immunohistochemical techniques, we investigated the reaction patterns of antibodies to PLC-γ1, EGFR, PDGFR-α, PDGFR-β, and PI3K as the proliferation and differentiation markers in 10 human middle ear cholesteatoma specimens. For the control, same study was performed with retroauricular skin.
Results ResultsResults
Results: In RT-PCR, EGFR, PDGFR-β, and PLC-γ1 were detected in cholesteatoma epitheliums, while PDGFR-α and PI3K were not detected. Only PDGFR-β was detected in retroauricular skins. In immunostaining, intensity of PDGFR-α and PI3K were not expressed in cholesteatoma epitheliums and retroauricular skins. EGFR protein was detectable in both basal cell and the suprabasal cell layers of cholesteatoma epitheliums, while it was detectable only in the basal cell layer of retroauricular skins. Strong expression of PDGFR-β was detected in some cholesteatoma epitheliums, while it was detected weakly in retroauricular skins. Expression of PLC-γ 1 at the suprabasal cell layer and basal cell layer were more intense in cholesteatoma epitheliums than that in retroauricular skins. Using Western blot, EGFR and PLC-γ1 were detected strongly in cholesteatoma
epitheliums than in the retroauricular skins, while PDGFR-β was detected strongly in retroauricular skins than in the cholesteatoma epitheliums.
Conclusion ConclusionConclusion
Conclusion: In human middle ear cholesteatomas, the role of downstream signal transduction pathway through EGFR and PLC-γ1 seemed to be dominant for the proliferation and differentiation of the keratinocyte.
KEY WORDS: Cholesteatoma, downstream signal transduction pathway, Western blot, RT-PCR, immunohistochemical staining