의
의
의학
학
학 석
석
석사
사
사학
학
학위
위
위 논
논
논문
문
문
S
S
Su
u
ur
r
rv
v
vi
i
iv
v
vi
i
in
n
n의
의
의 과
과발
과
발
발현
현
현:
:
:직
직
직장
장암
장
암
암의
의
의 근
근
근치
치
치적
적
적
절
절
절제
제
제술
술
술 후
후
후 발
발
발생
생한
생
한
한 국
국
국소
소
소재
재
재발
발
발의
의
의
위
위
위험
험
험인
인
인자
자
자로
로써
로
써
써의
의
의 가
가
가능
능
능성
성
성
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
박
박
박 용
용
용 근
근
근
S
S
Su
u
ur
r
rv
v
vi
i
iv
v
vi
i
in
n
n의
의
의 과
과
과발
발
발현
현
현:
:
:직
직
직장
장
장암
암
암의
의
의 근
근
근치
치
치적
적
적
절
절
절제
제
제술
술
술 후
후
후 발
발
발생
생한
생
한
한 국
국
국소
소
소재
재
재발
발
발의
의
의
위
위
위험
험
험인
인
인자
자
자로
로
로써
써
써의
의
의 가
가
가능
능
능성
성
성
지
지
지도
도
도교
교
교수
수
수 서
서
서 광
광
광 욱
욱
욱
이
이
이 논
논
논문
문
문을
을
을 의
의학
의
학
학 석
석
석사
사
사학
학
학위
위
위 논
논
논문
문
문으
으
으로
로 제
로
제
제출
출
출함
함
함.
.
.
2
2
20
0
00
0
07
7
7년
년
년 2
2
2월
월
월
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
박
박
박 용
용
용 근
근
근
박
박
박용
용
용근
근
근의
의 의
의
의
의학
학
학 석
석
석사
사
사학
학
학위
위
위 논
논
논문
문
문을
을 인
을
인
인준
준
준함
함
함.
.
.
심
심
심사
사
사위
위
위원
원
원장
장
장
조
조
조 용
용
용 관
관
관
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
서
서
서 광
광
광 욱
욱
욱
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
김
김
김 영
영
영 배
배
배
인
인
인
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
2
2
20
0
00
0
06
6
6년
년
년 1
1
12
2
2월
월
월 2
2
22
2
2일
일
일
- 국문요약 -
Survivin
Survivin
Survivin
Survivin
의
의
의
의 과발현
과발현
과발현
과발현:
:
:
:
직장암의 근치적
직장암의
직장암의
직장암의
근치적
근치적 절제술
근치적
절제술
절제술 후
절제술
후
후
후
발생한
발생한
발생한
발생한 국소재발의
국소재발의
국소재발의
국소재발의 위험인자로써의
위험인자로써의
위험인자로써의 가능성
위험인자로써의
가능성
가능성
가능성
배경 배경배경배경)))) 직장암에서 전직장간막절제술(total mesorectal excision)및 수술전 병합 방사선화학요법(preoperative chemoradiation therapy)의 발전으로 재발율이 상당히 향상되었음에도 불구하고, 여전히 국소재발의 예측과 치료는 어려운 과 제로 남아있다. 또한 같은 병기에서 보이는 치료에 대한 다양한 반응은 보다 정 확한 예후 인자의 필요성을 보여준다. 최근, 세포자멸사 억제 단백질 군 (inhibition of apoptosis protein family)의 하나인 survivin이 암 치료 후 재발 및 생존에 연관성이 있다는 보고들이 있다. 목적 목적 목적 목적)))) 이에 저자들은 직장암에서 survivin의 발현 유무 및 국소 재발과의 연관 성에 대하여 알아보고자 하였다. 방법방법방법방법))) 직장암으로 근치적인 수술을 받은 TNM 병기 II 혹은 III 환자 중 국소 ) 재발한 23명과, 재발이 없었던 60명의 환자를 대상으로 임상 및 병리학적인 자 료를 후향적으로 분석하였다. 또한, 환자 46명을 대상으로 수술 후 얻은 조직으 로 면역조직화학기법(Immunohistochemistry)을 시행하여 p53, bcl-2,
survivin 및 cleaved caspase-3 발현 여부와 재발과의 관계를 분석하였다. 결과결과결과결과))) 임상 및 병리학적 자료 분석에 의하면, 국소 재발에 유의하게 연관성이 ) 있는 인자로는 림프절 전이(45% vs 69.6%, P < 0.046) 및 측부 절제연 잔존암 (1.7% vs 30.4%, P < 0.000)이 있었다. 종양 조직의 면역조직화학기법 결과, 재 발군이 비재발군에 비해 survivin이 높게 발현(high expression)되었으며 (29.2% vs 59.1%, P < 0.043) 그 외 인자들에서는 통계적으로 유의한 차이가 없었다.
예측할 수 있는 인자로 사용할 수 있으며, 향후 직장암 치료에 있어 표적인자 (target)로 사용할 수 있을 것으로 생각된다.
핵심어 : 직장암, 국소 재발, 세포자멸사, survivin
차
차
차
차 례
례
례
례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림 차례 ··· ⅳ 표 차례 ··· v . Ⅰ 서론 ··· 1 . Ⅱ 재료 및 방법 ··· 5 A. 대상 ··· 5 B. 항체 ··· 6 C. 면역조직화학염색 ··· 6 D. 면역조직화학염색 판독 ··· 7 E. 통계분석 ··· 7 . Ⅲ 결과 ··· 9 A.. 임상 및 병리학적 특성 ··· 9B. p53, bcl-2, surviving 및 cleaved caspase-3 의 발현 ··· 9
C. survivin 과 국소 재발과의 관련성 ··· 10 . Ⅳ 고찰 ··· 17 . Ⅴ 결론 ··· 21 참고문헌 ··· 22 ABSTRACT ··· 27
그림
그림
그림
그림 차례
차례
차례
차례
Fig 1. Histochemical staining for p53, bcl-2, survivin and cleaved caspase-3
표
차례
Table 1. Relation between clinicopathological factors and local recurrence
··· 11
Table 2. Expressions of p53, bcl-2, surviving and cleaved caspase-3 in relation to local
recurrence ··· 12
Table 3. Expression of survivin in relation to local recurrence with exclusion of lateral
margin positive cases 13
Table 4. Microscopic lateral margin(+/-) and survivin expression 14
Table 5. relationship between expression of cleaved caspase-3, p53, bcl-2 and survivin
Ⅰ
Ⅰ
Ⅰ
Ⅰ.
.
.
.
서
서
서
서
론
론
론
론
대장암은 서구 특히 미국에서는 두번 째로 호발하는 암이며, 국내에서도 최근 그 발생 빈도가 급증하여 남,녀 공히 제 4위의 암발생율, 그리고 연간 1000예 의 신환이 발생하는 것으로 보고되고 있다. 특히 직장암은 대장의 말단 부분, 즉 엉치뼈 곶 (sacral promontory)으로부터 치상판에 이르는 약 15cm 정도에 서 발생되는데, 과거에는 대장암 전체에서 직장암이 차지하는 비율이 50% 이 상이었으나, 최근 대장암의 발현이 점차로 근위부로 이행하는 경향 때문에 약 30~40%로 감소하는 추세이다. 직장암도 대장암의 일부이기 때문에 직장암이 나 결장암이 생물학적으로 다른 이유는 없으나, 해부학적으로 직장은 골반강이 라는 뼈로 이루어진 협소한 공간에 위치하고 비뇨생식계 장기들과 매우 인접되 어 있기 때문에 결장암과는 달리 절제수술이 좁은 수술 시야에서 이루어지고 넉넉한 절제연을 확보할 수 없다는 문제를 가지게 된다. 바로 이와 같은 치료적 인 요인으로 인해서 직장암의 근치적 수술 후에 결장암과 달리 골반강내에서 재발되는 국소 재발이 현재까지도 임상적으로 심각한 문제가 되고 있다. 국소 재발성 직장암은 치료되지 않을 경우 원격전이의 근원지가 되어 궁극적 으로 사망에 이르게 하지만, 그 자체로도 심한 골반 내 신경통증, 소장 및 대장 폐쇄, 비뇨기관의 폐쇄에 의한 요독증 및 비뇨 생식기 장기로의 침윤과 그로 인 한 누공형성으로 인해 환자들에게 사망시까지 극심한 통증과 삶의 질 저하를 초래한다.국소 재발은, 전직장간막절제술 (total mesorectal excision, TME) 의 도입 및 술전 항암화학 및 방사선 요법의 시행으로 발생율이 현저하게 낮아졌지만, 아
직까지도 10% 내외의 발생율이 보고 되고 있다 (Heald 등, 1998; The German
rectal cancer study group, 2004). 동일한 임상병리학적인 병기
(clinicopathologic stage)를 가진 환자군에게 같은 수술 및 보조요법 (adjuvant therapy) 을 시행한 후에도 치료반응이 다르게 나타나는 것은 각각의 종양이 가 지고 있는 서로 다른 유전적 측면 (genetic profile)이 기인한다고 볼 수 있다. 따라서 기존의 병리학적 병기 (pathologic staging)의 한계를 보완할 수 있는, 분자 생물학 적인 인자 ( molecular marker)의 필요성이 대두된다. 세포자멸사 (Apoptosis)는 동물의 발생 및 분화과정에서 유전적인 프로그램 에 의해 일어나는 세포사멸로써 동물의 발달과 조직의 항상성 유지에 매우 필수 적인 과정이다. 세포자멸사는 death receptors, 방사선, 항암 약물, 특정 발암유
전자 및 종양억제유전자 (tumor suppressor genes)들의 과발현
(overexpression)으로 인한 세포 내외의 신호전달 체계에 의해 유도된다 (Li 와 Yuan, 1999). 이와 같은 세포자멸사 기전은 여러 단계의 세포 내 신호전달 체계의 작용에 의해 일어나게 되는데 대표적으로 caspase cascade를 들 수 있다. 이는 세포자 멸사를 촉진 또는 억제하는 단백질에 의해 조절된다 (Thompson, 1995). Caspases 는 세포 내에서 불활성화 상태인 procaspases 형태로 합성되지만, 세포자멸 신호전달에 의해 단백질 내의 aspartic acid가 절단됨으로써 활성화된 다. 활성화된 caspase는 caspase cascade를 순차적으로 활성화 시킴으로써 proteolytic cascade의 증폭을 가져온다 ( Alberts 등, 2002).
세포자멸사 기전의 손상은 종양의 발생과 진행에 있어서 중요한 요소가 된다. 이는 종양 세포의 장기 생존과 무한 증식을 가능하게 하고, 외인성 생존인자
(exogenous survival factors)의 필요를 감소시킨다. 또한, 종양이 커지면서 발 생하는 저산소 (hypoxia) 환경에서 종양세포의 사멸을 억제함으로써 유전자 변 이 (genetic alteration) 가 축적되게 하고, 분화(differentiation)를 방해하며 신 생혈관 생성 (angiogenesis)을 촉진하고, 종양의 진행 과정에서 세포의 운동성 (motility) 과 침윤성 (invasiveness) 을 높여주는 작용을 하게 된다. 따라서 손 상된 세포자멸사 기전을 밝히는 것은 암 연구의 중요한 밑거름이 된다 (Reed, 2003).
세포자멸사를 조절하는 요소로써 대표적인 bcl-2 family와 IAP (inhibitor of apoptosis) family가 있다. bcl-2 family는 procaspases 의 활성을 조절하는데, 이 family 중 bcl-2 나 Bcl-XL 등은 미토콘드리아 (mitochondria)에서 cytochrome c 방출을 억제하여 세포자멸사의 발생을 막는 반면, Bax 및 Bak 등은 미토콘드리아에서 cytochrome c 의 방출을 자극하여, caspase cacade 활 성화를 유도함으로써 세포자멸사를 촉진한다.
IAP family는특정 procaspase와 결합하여 이들의 활성을 억제하는 역할을 한 다. 이 family 중 survivin은 암 조직에서 비정상적으로 발현 되지만, 정상적으 로 분화된 성인 조직에서는 나타나지 않아 암 연구에 있어 주목 받고 있다 (Li, 2003). Survivin의 발현에 관여하는 유전자는 염색체 17q25에 위치하며 telomere로부터 3% 떨어진 곳에 위치한다 (Ambrosini 등, 1997). 이 유전자는 세 개의 intron과 네 개의 exon으로 구성되어 있으며, 발현된 단백질은 baculovirus IAP repeat(BIR)를 보이나 RING finger는 존재하지 않는다(La Casse 등, 1998). Survivin은 caspase cascade의 최종 작동체 (terminal effectors)인 caspase-3 및 caspase-7와 결합하여 활성화를 억제하는 것으로
알려져 있다. 몇몇 암세포주 (cancer cell line)를 이용한 연구에서 survivin의 과발현은 항암화학요법 및 방사선 요법을 시행할 경우 치료의 저항성과 연관성 이 있으며 survivin si RNA 등을 이용하여 survivin 발현을 억제할 경우 이러한 치료에 효과적으로 반응하는 것이 밝혀졌다 (Lu 등, 2004;Fuessel 등, 2006). 또한 survivin의 발현은 직장암의 근치적 절제술 후 예후에 나쁜 영향을 끼치 는 것으로 보고 되고 있다 (Kawasaki 등, 1998; Sarela 등, 2000). 최근 survivin의 과발현은 방광암의 국소재발과, 직장암에서 술전 항암화학 및 방사선 병행요법 과 근치적 절제술을 함께 시행한 후 발생한 국소재발의 위험인자라는 것이 밝혀졌다 (Swana 등, 1999; Rodel 등, 2005). 하지만 이러한 결과들은 병 기에 따른 차이에 대한 언급이 없었다. 본 연구에서는 TNM 분류 상 II기 및 III기에 해당하는 직장암 조직을 이용하 여 근치적 절제술 후 국소재발에 연관된 인자들에 대해 분석하였으며, 직장암에 서의 survivin의 발현과 국소 재발의 예후인자로써의 가능성을 조사하였다.
Ⅱ
Ⅱ
Ⅱ
Ⅱ.
.
.
.
재료
재료 및
재료
재료
및
및
및 방법
방법
방법
방법
A. A. A. A. 대상대상대상대상 1998년 7월부터 2003년 6월까지 5년 동안, 아주대학교 병원 외과에서 363명의 직장암 환자가 근치적 절제술을 받았다. 본 연구에서는, 수술 술기 차 이를 배제하기 위하여, 한 명의 외과의(Dr. 서광욱)에게서 근치적 전방절제술 (curative anterior resection)을 시행 받은 환자 중, TNM 분류상 II기 및 III기 환자들을 대상으로 하였다. 복회음부 절제술 (abdominoperineal resection) 및 국소 절제술을 시행 받은 환자나, 수술 이전에 타 장기 전이가 발견된 환자, 술 후 40개월 이상 추적 관찰이 되지 않은 환자들은 본 연구에서 제외하였다. 본 연구에 포함된 모든 환자들은 전직장간막절제술 (TME) 방법을 통하여, 근 치적 직장 절제술을 받았으며, 집도의가 직장 주위 조직을 직접 눈으로 확인하면 서 섬세하게 박리하여, 직장의 장간막을 전부 절제하였다. 환자들은 퇴원 후 자세한 이학적인 검사 및 혈청내 CEA(carcinoembryonic antigen) 수치 검사를 통한 지속적인 외래 추적 관찰을 받았으며 대장경 검사, 흉부 X-ray 검사 및 복부 전산화 단층 촬영 검사는 매년 시행하거나 임상적으 로 필요하다고 판단될 때 시행하였다. 국소재발군은 방사선 검사 혹은 대장내시경을 통한 조직 검사상 수술을 시행 한 범위 내에서 명백한 암 재발이 확인 되었을 때로 정의 하였다. Control 군은 술후 40개월 이상 추적 관찰 후 국소 및 전신 재발이 없는 환자들을 대상으로 하였다.B. B. B. B. 항체항체항체항체
면역조직화학검사를 위하여 사용한 일차 항체들은 다음과 같다: monoclonal anti-human p53 protein (Zymed, San Francisco, CA), dilution 1:100; monoclonal anti-human bcl-2 protein (Zymed, San Francisco, CA), dilution 1:100; polyclonal anti-human survivin protein (Lab Vision, Fremont, CA), dilution 1:500; anti-human cleaved caspase-3 protein (Cell Signaling, Beverly, MA), dilution 1:100. 이차 항체는 biotinylated anti-mouse IgG 혹은 anti-rabbit IgG (Jackson ImmunoResearch, West Grove, PA)를 사용하였다. 발색을 위하여 Horseradish peroxidase-conjugated anti-rabbit IgG 와 horseradish peroxidase-conjugated anti-mouse IgG HRP (Vector Laboratories Inc., Burlingame, CA or Zymed Invitrogen, Carlsbad, CA). 를 이용하였다. C. C. C. C. 면역조직화학면역조직화학면역조직화학면역조직화학 염색염색염색염색 면역조직화학 염색은 포르말린에 고정시킨 조직의 파라핀 포매 조직을 4-㎛ 두께로 박절한 후, xylene을 이용한 탈파라핀과 알코올을 이용한 함수과 정을 거쳐 세척하였다. 조직에서 antigen epitope을 노출 시키기 위하여, 10mM
sodium citrate buffer(pH 6.0)에 조직 슬라이드를 넣고 10분간
microwave(700W)로 처리한 후 30분간 실온에 놓아둔 뒤 세척하였다. Endogenous peroxidase의 활성을 억제하기 위하여 3% 과산화수소수로 5분간 반응 시켰다. Goat 혹은 horse normal serum으로 비특이성 단백질 염색을 차단 하였으며, p53, bcl-2, survivin에 대한 일차 항체는 상온에서 한 시간동안,
cleaved caspase-3는 4℃에서 하룻밤 동안 반응 시켰다. 이차 항체로 30분 동 안 반응 시킨 후, 세척하고 avidin biotin complex(ABC)-HRP solution 반응시
켰다. 색소원으로 3,3 ’ -diaminobenzidine tetrahydrochloride(DAB)
substrate kit (Zymed, Invitrogen, Carlsbad, CA)를 반응시켰다. Permount (Sigma, St.Louis, MO)로 봉입 후 microscope (Carl Zeiss axiostar plus, Germany)으로 관찰하였다. D. D. D. D. 면역조직화학면역조직화학면역조직화학면역조직화학 염색염색염색염색 판독판독판독 판독 조직표본을 현미경으로 200배 시야에서 관찰한 후, 다음과 같이 구분하 였다. p53의 발현은 종양세포의 10% 이상에서 핵 내 염색이 되었을 경우를 positive, cleaved caspase-3의 발현은 핵 내 혹은 세포질에 5%이상 염색되었 을 경우를 positive로 하였다.
세포질 내 bcl-2와 survivin의 발현 정도는 이전 연구들에서 사용한 방법을 이용하였다 (Sinicrope 등, 1995;Rodel 등, 2005). 발현 빈도(frequency)는 다 음의 category로 정하였다: 0 (<5%), 1(5-25%), 2(25-50%), 3(>50%). 염색
의 강도(intensity)는 다음과 같이 점수로 환산하였다: 1+(weak),
2+(moderate), 3+(intense). 염색의 빈도와 강도에 해당하는 점수를 곱하여, 각 조직 표본의 weighted score를 0부터 9까지로 계산하였다. Weighted score 가 3점 이하인 경우를 low expression, 4점 이상인 경우를 high expression으 로 정의하였다.
E. E. E.
범주형 변수 (categorical variables)를 비교하기 위해 chi-squre test 혹은 필요한 경우 Fisher exact test를 시행하였으며, 연속형 변수 (continous variables)는 평균과 표준편차를 기술하고 student t-test를 사용하여 각 군간 을 비교하였다.
모든 통계 분석은 Social Science (SPSS) for Windows version 11.5 (SPSS, Inc., Chicago, IL)를 이용하였으며, p value가 0.05 미만인 경우에 유 의하다고 정의하였다.
Ⅲ
Ⅲ
Ⅲ
Ⅲ.
.
.
.
결
결
결
결
과
과
과
과
A. A. A. A. 임상임상임상임상 및및및및 병리학적병리학적병리학적병리학적 특성특성특성특성 국소 재발이 발생한 23명의 환자에서 16명은 골반 내 재발, 7명은 골반 내 재발과 전신 재발을 동반하였다. 이 23명의 환자들의 술 후 재발 기간은 4~36 (median 14) 개월이었다. 10명 (43.5%)은 술 후 1년 내 재발하였으며 21명 (91.3%)은 2년 내 재발하였다. TNM 분류상 II & III 기에 속하며, 40개월 이상 추적 관찰하여 골반 및 전신 재발이 없었던 환자는 60명이었다. 이들 두 군에 속한 83명의 임상적 특성 및 절제된 조직의 병리학적 특성 간의 차이는 없었다. 국소재발의 위험은 주위 림프 절 전이 (45% vs 69.6%, p < 0.046) 및 측부연 암세포 침윤(1.7% vs 30.4%, p < 0.000)과 유의한 결과를 보였으나, 혈관림프관 침윤과는 관계가 없었다 (Table 1). B. B. B.B. p53, bclp53, bclp53, bcl-p53, bcl---2, survivin 2, survivin 2, survivin 및2, survivin 및및및 cleaved caspase cleaved caspase- cleaved caspase cleaved caspase---3333의의의의 발현발현발현 발현
세포자멸사 기전의 억제와 국소재발의 상호 관련성을 조사하기 위해 국 소 재발 군과 control 군의 조직을 이용하여 p53, bcl-2, survivin 및 cleaved caspase-3의 발현 여부를 면역조직화학염색을 통해 확인하였다. Control 군에 서 다른 위험인자들의 영향을 최소화하기 위하여 주위 림프절 전이가 있었던 환 자들의 조직만으로 분석을 한정하였다. p53, bcl-2 분석에서는 2개, survivin 분 석에서는 1개, cleaved caspase-3 분석에서는 4개의 sample이 검사상 잘못으
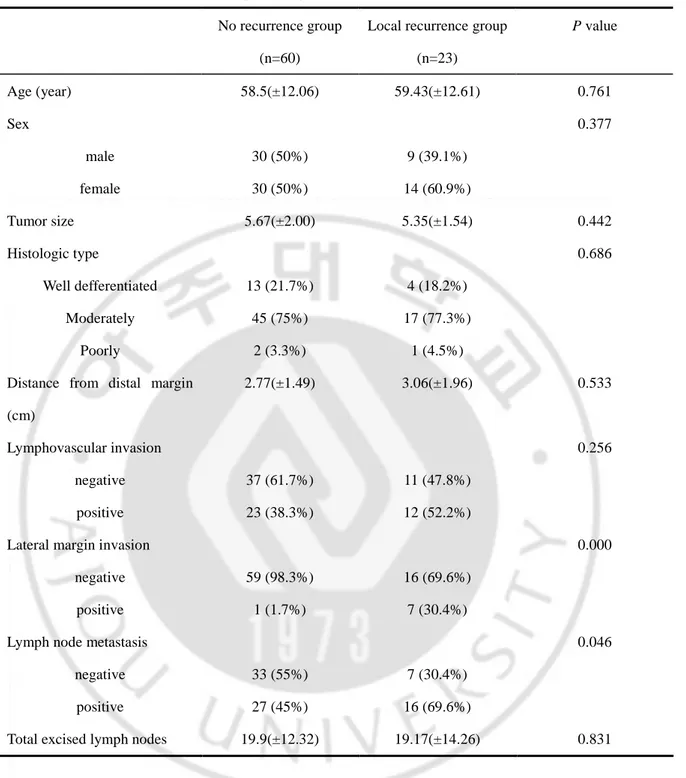
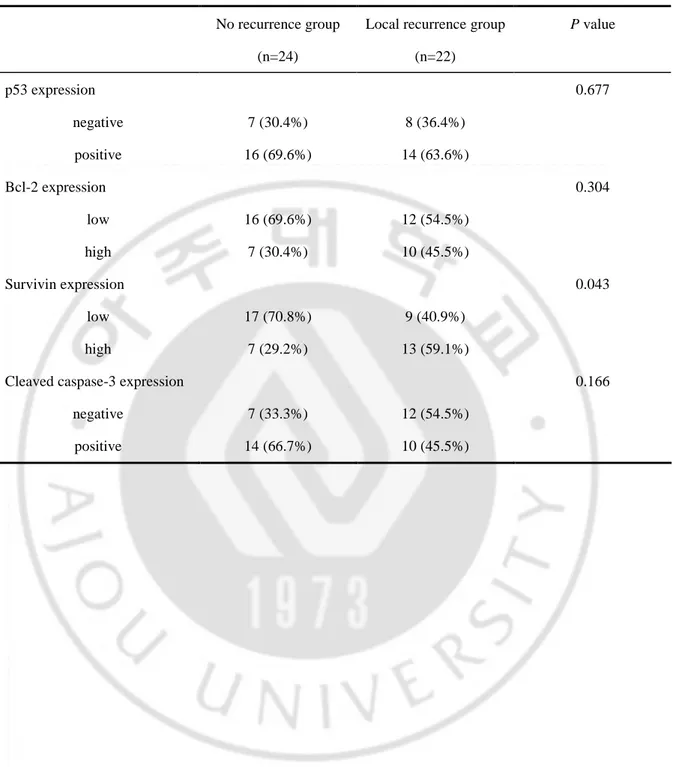
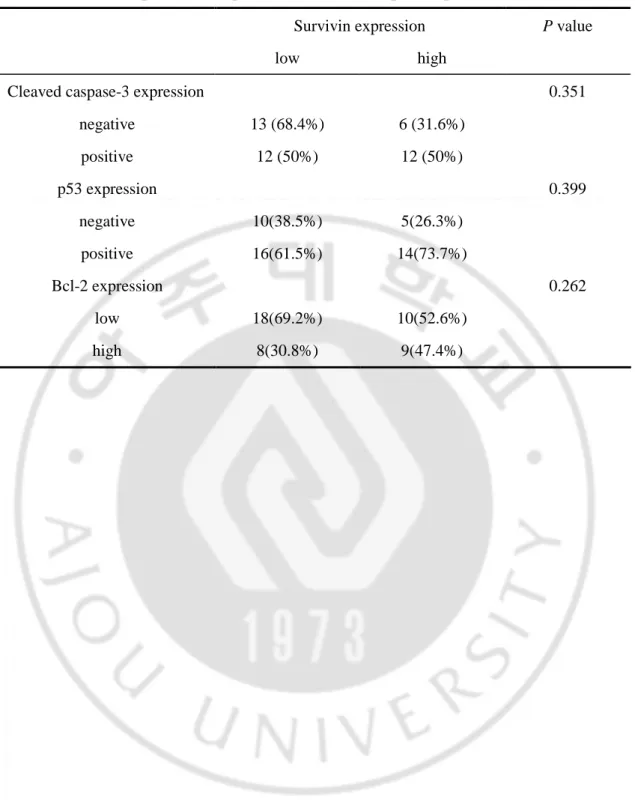
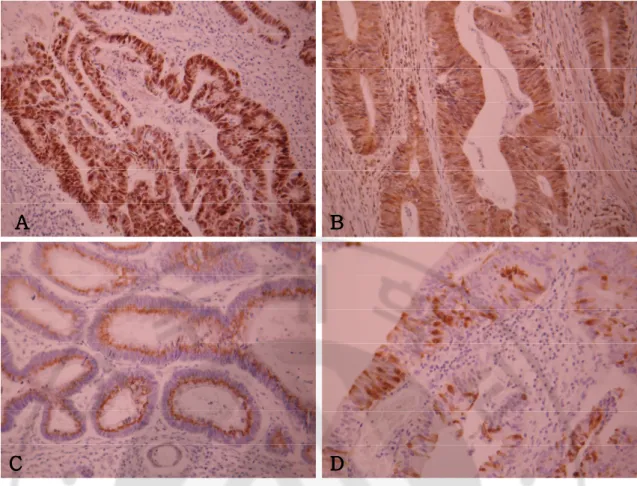
로 인하여 해석이 불가능하였으며, 이들 조직 표본은 분석에서 제외되었다. p53 단백질에 대한 염색반응은 핵 내에서만 국한되어 나타났으며, 30명 (66.7%) 환자의 조직에서 positive 소견을 보였다 (Fig. 1-A). bcl-2 단백질에 대한 염색 반응 분석에서는 7명 (37.8%), survivin 단백질에 대해서는 20명 (43.5%)이 세포질 내에서 높은 발현 (high expression)을 보였다 (Fig. 1-B,C). Cleaved caspase-3에 대해서는 24명 (55.8%)이 핵 내 혹은 세포질에서 positive 소견을 보였다 (Fig. 1-D).
C. C. C.
C. SurvivinSurvivinSurvivinSurvivin과과과과 국소국소국소국소 재발과의재발과의재발과의 연관성재발과의 연관성연관성 연관성
Table 2. 에서는 survivin의 발현 정도가 국소 재발 군과 control 군 사 이에서 통계학적 유의성을 보여준다: control group에서는 24명의 환자 조직 중 17명 (70.8%) 에서 survivin의 발현이 낮았고, 국소 재발 군에서는 22명 중 13 (59.1%)명에서 survivin이 과발현 되었다 (p < 0.043). 하지만 측부연 암세 포 침윤 환자들을 제외하고 비교하였을 때는 통계학적 유의성을 관찰할 수 없었 다 (Table 3). 그러나 측부연 암세포 침윤이 있었던 조직에서 survivin의 과발 현 경향을 보였다 (Table 4). p53, bcl-2 및 cleaved caspase-3의 발현은 국 소재발과의 연관성이 없었으며, survivin의 발현 정도와 cleaved caspase-3 발 현과의 역 (inversely) 연관성도 관찰 할 수 없었다 (Table 5).
Table 1. Relation between clinicopathological factors and local recurrence
No recurrence group (n=60)
Local recurrence group (n=23) P value Age (year) 58.5(±12.06) 59.43(±12.61) 0.761 Sex 0.377 male 30 (50%) 9 (39.1%) female 30 (50%) 14 (60.9%) Tumor size 5.67(±2.00) 5.35(±1.54) 0.442 Histologic type 0.686 Well defferentiated 13 (21.7%) 4 (18.2%) Moderately 45 (75%) 17 (77.3%) Poorly 2 (3.3%) 1 (4.5%) Distance from distal margin
(cm)
2.77(±1.49) 3.06(±1.96) 0.533 Lymphovascular invasion 0.256
negative 37 (61.7%) 11 (47.8%) positive 23 (38.3%) 12 (52.2%)
Lateral margin invasion 0.000 negative 59 (98.3%) 16 (69.6%)
positive 1 (1.7%) 7 (30.4%)
Lymph node metastasis 0.046 negative 33 (55%) 7 (30.4%)
positive 27 (45%) 16 (69.6%)
Table 2. Expressions of p53, bcl-2, survivin and cleaved caspase-3 in relation to local recurrence
No recurrence group (n=24)
Local recurrence group (n=22) P value p53 expression 0.677 negative 7 (30.4%) 8 (36.4%) positive 16 (69.6%) 14 (63.6%) Bcl-2 expression 0.304 low 16 (69.6%) 12 (54.5%) high 7 (30.4%) 10 (45.5%) Survivin expression 0.043 low 17 (70.8%) 9 (40.9%) high 7 (29.2%) 13 (59.1%)
Cleaved caspase-3 expression 0.166 negative 7 (33.3%) 12 (54.5%)
Table 3. Expression of survivin in relation to local recurrence with exclusion of lateral margin positive cases
No recurrence (n=24) Local recurrence (n=16) P value Survivin 0.188 low 17 8 high 7 8
Table 4. Microscopic lateral margin(+/-) and survivin expression Microscopic lateral margin (-)
(n=40) Lateral margin (+) (n=6) P value survivin 0.072 low 25 1 high 15 5
Table 5. relationship between expression of cleaved caspase-3, p53, bcl-2 and survivin
Survivin expression P value
low high
Cleaved caspase-3 expression 0.351 negative 13 (68.4%) 6 (31.6%) positive 12 (50%) 12 (50%) p53 expression 0.399 negative 10(38.5%) 5(26.3%) positive 16(61.5%) 14(73.7%) Bcl-2 expression 0.262 low 18(69.2%) 10(52.6%) high 8(30.8%) 9(47.4%)
A
A
A
A
C
C
C
C
B
B
B
B
D
D
D
D
Fig. 1. Histochemical staining for p53, bcl-2, survivin and cleaved caspase-3. A,
nuclear p53 accumulation was observed in tumor cells. B, bcl-2 staining was observed in the cytoplasm of tumor cells and in infiltrating lymphocytes. C, survivin expression was restricted to the cytoplasm of tumor cells within the glandular structure. D, cleaved caspase-3 was detected in the cytoplasm and nucleus of tumor cells (X200).
Ⅳ
Ⅳ
Ⅳ
Ⅳ.
.
.
.
고
고
고
고
찰
찰
찰
찰
직장암에서 술 후 국소재발은 극심한 통증 및 여러 합병증을 동반하기 때문에 이에 대한 예방이 중요한 치료 요소라고 하겠다. Dr. Heald에 의하여 전 직장간막절제술(TME)이 직장암 수술에 도입되면서, 국소 재발의 발생율은 감소 하였지만, 아직도 10% 내외의 발생율을 보고하고 있다 (Bokey 등, 1999). 이 러한 국소 재발을 낮추고 생존율을 높이기 위한 시도가 있었는데, 1990년부터 미국에서는 II기 및 III기 직장암에서 항암화학 및 방사선 병행 요법이 국소재발 을 낮추고 생존율을 높인다는 여러 randomized trial을 근거로 술 후 보조요법 으로 사용되었다. 2001년에 시행한 meta-analysis에서는 술 전 방사선요법이 국소 재발의 감소와 생존율의 향상을 가져옴을 밝혀냈으며, 1861명의 I기부터 IV기 환자들을 대상으로 randomized analysis를 시행한 Dutch trial에서 전직장 간막절제술(TME)를 시행 받은 환자에서도, 술 전 항암화학 및 방사선 병행요법 을 시행한 경우 국소 재발을 현저히 낮출 수 있다 (11.4% vs 5.8%)는 보고를 하였다 (Colorectal cancer collaborative group, 2001;The Dutch colorectal cancer group, 2001). 2004년 German trial에서는 술 후 보다 술 전에 시행한 항암화학 및 방사선 병행요법이 국소재발을 유의하게 낮춘다는(6% vs 13%) 결 과를 보고하였다 (The German rectal cancer study group, 2004). 하지만 이러 한 결과들에도 불구하고, 여전히 국소 재발은 발생되고, 오히려 같은 병기에서 동일한 수술 및 수술 전후 보조요업을 시행 받은 환자에서 선택적으로 일어난다 는 것은 현재의 치료법이 가지고 있는 한계이다.혈관-림프선 종양세포 침윤 등이 위험인자로 거론된다. 본 연구에서도 국소재발 군이 control 군에 비하여, 국소 림프절 전이 및 암의 측부연 침범 정도가 현저히 높 게 나타났다. 하지만 종양 세포의 혈관-림프선 침윤은 국소 재발과의 연관성이 없는 것으로 나타났다. 결국 국소 림프절 전이가 성공적인 직장암 절제술 후 나 타나는 국소 재발에 가장 중요한 위험인자라고 할 수 있다. 그러나 국소 림프절 전이를 동반한 직장암 환자에서 일부만 국소 재발이 일어나는 원인을 알기 위해 서는 종양의 분자 생물학적 차이에 기인 할 것으로 생각된다. 믿을 만한 예후 인 자를 통한 직장암의 세부 분류(subclassification)가 필요하며, 이는 각각의 환자 에서 선택적인 보조 요법을 시행할 수 있는 기준이 될 수 있을 것으로 생각했다. 최근 세포자멸사 억제 기전 및 이를 암 치료에 활용할 수 있는 가능성에 대한 관심이 높아지고 있다. 이에 근래 가장 주목 받는 요소로써 survivin이 있다. 면 역조직화학염색 방법 혹은 RT-PCR을 통하여 survivin의 발현을 분석한 결과 여러 다른 암 조직에서는 발현이 되지만, 정상적으로 분화된 조직에서는 발현되 지 않는 것으로 알려져 있다. 여러 다른 연구에서 대장 및 직장암에서 survivin 의 발현은 53~63.5%로 보고 하고 있다. 본 연구에서는 survivin이 과발현된 조 직이 43.5%였다 (Table 2). Wild-type p53은 주로 세포 분화의 G1 phase에서 나타나며, 세포자멸사의 조절에 중요한 역할을 하지만, mutant p53의 경우는 세포자멸사가 일어나는 것 을 완화시킨다고 보고 되고 있다. p53의 돌연변이는 단백질의 반감기가 현저히 증가 되기 때문에, 면역조직화학 염색으로 측정이 가능하며, 이는 암에서 나쁜 예후 인자 인 것으로 알려져 있다 (Kim 등, 2002). 하지만 본 저자들은 p53의 발현과 국소 재발과의 연관성은 찾지 못하였으며, 이는 Swana 등 의 연구와 유
사한 결과를 보였다 (Table 2). 본 저자들은 survivin의 발현과 p53의 발현의 연관성도 찾지 못하였다 (Table 3).
Survivin 단백질은 주로 caspase-3의 활성화를 직접적으로 억제함으로써 세 포자멸사를 방해하는 것으로 알려져 있다. 따라서 본 저자는 survivin 발현과 cleaved caspase-3 발현 간의 역(inverse) 연관성이 있을 것으로 기대하였지 만, 유의한 결과는 얻지 못하였다 (Table 5).
이러한 survivin의 발현이 암의 진행성(progression) 및 예후와의 연관성에 대 해 여러 후향적인 연구들이 진행되었으며, 직장암 뿐만 아니라 여러 다른 암에서 도 암의 악성도 및 불량한 예후, 또한 환자의 생존율 저하와 연관이 있는 것으로 밝혀졌다 (Kawasaki 등, 1998; Adida 등, 1998; 등, 2000; Sarela 등, 2001; Kato 등, 2001, Knutsen 등, 2004). 하지만, 이러한 이전 연구에서는 국소 재발 및 전신 재발과 survivin 발현과는 유의한 연관성이 보고되지 않았다. 또한 대장 직장암에서의 연구에서는 가장 중요한 예후 인자인 국소 림프절 전이에 대한 고 려가 없었다. 따라서 본 저자는 기존에 밝혀진 가장 중요한 위험인자인 국소 림 프절 전이를 배제한 상태에서, survivin의 발현과 국소 재발의 연관성을 분석하 기 위하여 TNM III기 병기 환자들만을 대상으로 연구를 진행하였다. 본 연구의 결과를 바탕으로, survivin의 발현이 TNM III 병기의 직장암 환자에서 술 후 국 소 재발의 위험 인자로 간주될 수 있을 것으로 판단된다 (Table 2). Survivin의 발현은 방사선 요법 및 항암화학요법에 대한 종양 세포의 저항성과 연관성이 있으며, antisense oligodeoxynucleotide나 siRNA를 통하여 survivin 의 발현을 억제함으로써, 이들 치료의 반응성을 높일 수 있다는 보고들이 있다 (Lu 등, 2004; Fuessel 등, 2006). 이러한 결과들은 항암 치료에서 survivin을
억제하는 것이 기존 치료 방법의 성공율을 증가 시키며, 국소 및 전신 전이를 예 방하는 효과적인 방법이 될 수 있음을 간접적으로 보여주는 것이다.
Ⅴ
Ⅴ
Ⅴ
Ⅴ.
.
.
.
결
결
결
결
론
론
론
론
본 연구는 특정 예후 인자들의 발현이 TNM II기 및 III기 직장암에서 국 소재발과의 연관성이 있는지를 알아보고자 진행되었고, TNM III기 직장암 환자 들의 조직을 이용하여 세포자멸사의 억제와 연관된 인자들의 발현 정도를 확인 하였다. 그 중 survivin의 과발현은 TNM III기 직장암의 국소재발과 연관성이 있음을 확인하였다. 이러한 결과는 survivin의 선택적 억제 약물 연구를 통해 효 과적인 치료와 국소재발율을 줄일 것으로 예상된다.참고문헌
참고문헌
참고문헌
참고문헌
1. Adida C, Berrebi D, Peuchmaur M, Reyes-Mugica M and Altieri DC.
Anti-apoptosis gene, surviving, and prognosis of neuroblastoma. Lancet 351:882-883,
1998
2. Ambrosini G, Adida C, Altieri D. A novel aniapoptosis gene, survivin, expressed in
cancer and lymphoma. Nat Med 3:917-921, 1997
3. Alberts B, Johnson A, Lewis J, Raff M, Roberts K and Walter P: Molecular biology
of the cell, 4th edition. Garland Science, pp.1010-1014, 2002
4. Bokey EL, Ojerskog B, Chapuis PH, Dent OF, Newland RC and Sinclair G. Local
recurrence after curative excision of the rectum for cancer without adjuvant
therapy: role of total anatomical dissection. Br J Surg 86:1164-1170, 1999
5. Colorectal cancer collaborative group. Adjuvant radiotherapy for rectal cancer: a
systematic overview of 8507 patients from 22 randomised trials. Lancet
6. Fuessel S, Herrmann J, Ning S, Kotzsch M, Kraemer K, Schmidt U, Hakenberg OW,
Wirth MP and Meye A. Chemosensitization of bladder cancer cells by
surviving-directed antisense oligodeoxynucleotides and siRNA. Cancer Lett 232:243-254,
2006
7. Heald RJ, Moran BJ, Ryall RDH, Sexton R and MacFarlane JK: Rectal cancer-The
Basingstoke Experience of Total Mesorectal Excision, 1978-1997. Arch Surg
133:894-899, 1998
8. Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki
T, Moriyama S, Kudo J, Fujii Y. Expression of surviving in esophageal cancer:
correlation with the prognosis and response to chemotherapy. Int J Cancer 95:92-95,
2001
9. Kawasaki H, Altieri DC, Lu C, Toyoda M, Tenjo T and Tanigawa N: Inhibition of
apoptosis by surviving predicts shorter survival rates in colorectal cancer. Cancer
Res 58: 5071-5074, 1998
10. Kim Y, Lee JH, Chun h, Nam S, Lee W, Song SY, Kwon OJ, Hyun JG, Sung IK,
correlation with proliferative activity in rectal cancer. J Surg Oncol 79:236-242,
2002
11. Knutsen A, Adell G and Sun X. Survivin expression is an independent prognostic
factor in rectal cancer patients with and without preoperative radiotherapy. Int J Rad
Onco Biol Phys 60:149-155, 2004
12. La Casse E, Baird C, Kormeluk R, Mackenzie A. The inhibitors of apoptosis(IAPs)
and their emerging role in cancer. Oncogene 17:3247-3249, 1998
13. Li F: Survivin study: what is the next wave? J cell physiol 197:8-29, 2003
14. Li H, Yuan J: Deciphering the pathways of life and death. Curr Opin Cell Biol
11:261-266, 1999
15. Lu B, Mu Y, Cao C, Zeng F, Schneider S, Tan J, Price J, Chen J, Freeman M and
Hallahan DE: Survivin as a therapeutic target for radiation sensitization in lung
cancer. Cancer Res 64:2840-2845, 2004
17. Rodel F, Hoffmann J, Distel L, Herrmann M, Noisternig T, Papadopoulos T, Sauder
R and Rodel C: Survivin as a radioresistance factor, and prognostic and therapeutic
target for radiotherapy in rectal cancer. Cancer Res 65(11): 4881-4887, 2005
18. Sarela AI, Macadam RCA, Farmery SM, Markham AF and Guillou PJ: Expression
of the antiapoptosis gene, Survivin, predicts death from recurrent colorectal
carcinoma. Gut 46: 645-650, 2000
19. Swana HS, Grossman D, Anthony JN, Weiss RM and Altieri DC. Tumor content of
the antiapoptosis molecule surviving and recurrence of bladder cancer. N Engl J
Med 341:452-453, 1999
20. Sinicrope F, Ruan S, Cleary K, Stephen L, Lee J and Levin B: Bcl-2 and p53
oncoprotein expression during colorectal tumorogenesis. Cancer Res 55:237-241,
1995
21. The Dutch colorectal cancer group. Preoperative radiotherapy combined with total
22. The German Rectal Cancer Study Group: Preoperative versus Postoperative
Chemoradiotherapy for Rectal Cancer. N Engl J Med 351: 1731-1740, 2004
23. Thompson C: Apoptosis in the pathogenesis & treatment of disease. Science 267:
- ABSTRACT -
Expression of Survivin: Possible Predictor of Local Recurrence
after Curative Resection for Rectal Cancer
Yong Keun Park
Department of Medical Sciences The Graduate School, Ajou University
(Supervised by Professor Kwang Wook Suh)
Local recurrence has always been a challenging problem following rectal cancer surgery, desite of the advances in surgical technique(TME) as well as adjuvant therapy(preoperative CCRT). There is a need for better prognostic markers due to the varieties of treatment response within same clinicopathologic stage. Survivin, a novel member of IAP protein, is often associated with increasing recurrence risk and poor prognosis. We investigated the expression of survivin in rectal cancer and its potential impact on local recurrence.
Retrospective clinicopathological data were analysed in 23 patients of local relapse and 60 patients of no recurrence with rectal cancer, staged II and III. Immunohistochemical staining for p53, bcl-2, survivin and cleaved caspase-3 were performed on paraffin-embedded tissue sample of 46 rectal cancer.
By clinicopathological data, risk factors for local recurrence were positive nodes (45% vs 69.6%, P < 0.046) and lateral margin invasion(1.7% vs 30.4%, P < 0.000). Immunohistochemistry revealed “high expression” of survivin could be a predictive parameter of local recurrence in stage III rectal cancer(29.2% vs 59.1%, P < 0.043).
recurrence and that survivin may be a target for cancer therapy.
Key words: rectal cancer, local recurrence, apoptosis, inhibitor of apoptosis protein, p53, bcl-2, survivin