서론
황색포도알균(Staphylococcus aureus)은 지역사회와 병원 감염의 중요한 원인균으로 피부 및 연조직 감염, 폐렴, 균혈증 등을 일으킨다. 카테터 또는 인공기구의 사용 및 침습적 시술 이 늘면서 황색포도알균에 의한 심각한 감염이 증가하고 있 으며, 이들 균주들은 기존 항생제에 대해 내성을 보이는 경우 가 많아 적절한 항생제 치료가 어려워지고 있다[1,2]. 1961년 메티실린 내성 황색포도알균(methicillin-resistant S.aureus, MRSA)이 출현하였으며, MRSA가 병원 내 만연하게 되었다[3,4]. MRSA감염증 치료를 위해 vancomycin 사용이 꾸준히 증가하였고 결과 1996년 vancomycin에 감수성이 저 하된 황색포도알균(vancomycin-intermediate S. aureus)가 보고되었고, 2002년부터 vancomycin 고도내성 황색포도알 균(vancomycin-resistant S. aureus)이 보고되었다. 지역사회획득 메티실린 내성 황색포도알균(community acquired methicillin-resistant S. aureus, CA-MRSA) 은 원내 MRSA 획득과 관련된 기존의 위험인자가 없으면 서 외래 또는 입원 48시간 이내에 채취한 검체에서 MRSA 가 분리된 경우로 정의하고 있다[5]. CA-MRSA는 1980년 미국에서 마약 중독자에서 처음으로 보고되었는데, 1997년 건강한 4명의 어린이가 중증패혈증으로 사망하고, 원인균이 MRSA라는 사실이 알려지면서 CA-MRSA에 대한 관심이 높 아지기 시작했다. 국내 일반 인구에서 MRSA 보균율은 2002 년 2.5%였으며, 2003년도에 창원지역 어린이 40여 명에서
메티실린 내성 황색포도알균 감염의 항생제 치료
추 은 주 | 순천향대학교 의과대학 부천병원 감염내과Antimicrobial therapy for methicillin-resistant
Staphylococcus aureus
Eun Ju Choo, MD
Division of Infectious Diseases, Bucheon Hospital, Soonchunhyang University College of Medicine, Bucheon, Korea
Received: February 2, 2018 Accepted: February 16, 2018 Corresponding author: Eun Ju Choo
E-mail: mdchoo@schmc.ac.kr © Korean Medical Association
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons. org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Methicillin-resistant Staphylococcus aureus (MRSA) is a common cause of healthcare-associated infections. Recently, community-associated MRSA has emerged, manifesting as skin and soft tissue infections in patients without any prior healthcare contact. Vancomycin, a glycopeptide in clinical use for more than 50 years, still remains an acceptable treatment option. However, significant concerns have been raised regarding the decreasing susceptibility of S. aureus to this agent. The growing awareness of the limitations of vancomycin has served as an impetus for development of newer agents. There has been an increase in the number of agents available to treat MRSA infections. Linezolid, daptomycin, telavancin, and ceftaroline have received regulatory approval in the last decade for the treatment of MRSA. Although these drugs do have certain differentiating attributes and may offer some advantages over vancomycin, they also have significant limitations.
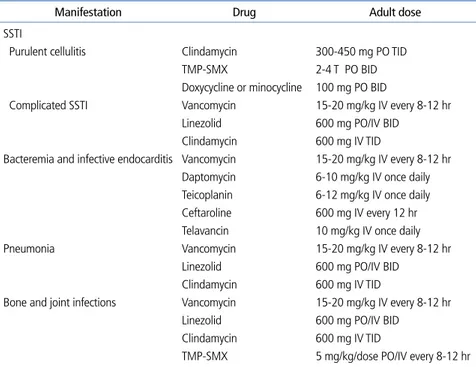
CA-MRSA에 의한 포도알균화상피부증후군(Staphylococcal scalded skin syndrome)이 발생하였고, 이들 환아의 비강에 서 MRSA가 분리되었다[6]. CA-MRSA의 경우 베타락탐 계 열 항생제에 내성이지만 대부분의 다른 항생제에 감수성이 유지되는 것으로 알려져 있다. 지역사회 및 병원에서 흔히 접 하게 되는 피부 및 연조직감염증의 경우 CA-MRSA에 의한 감염이 가능하여 항생제 선택에 주의가 필요하다[7]. 최근 임 상적으로 문제가 되고 있는 MRSA 감염에 대한 적절한 항생 제 치료에 대하여 Table 1과 같이 정리하였다[8].
Vancomycin
MRSA에 의한 중증 감염증에서 가장 효과적으로 사용할 수 있는 항생제는 vancomycin이며 우선적으로 추천되는 항 생제이다. 항생제의 약동학적, 약력학적인 지표 중 치료 효과 에 관련성이 있는 지표로서 time above minimum inhibitory concentration (MIC), peak/MIC, area under curve (AUC)/ MIC가 있다. Vancomycin에서는 이 중 AUC/MIC가 가장 중요한 지표로 AUC/MIC를 최소 400 이 상으로 유지해야 좋은 치료효과를 기대 할 수 있다[8,9]. AUC/MIC를 높게 유지 하기 위해서는 혈중약물농도 중 trough level를 높게 유지하는 것이 중요하며 원 인균의 MIC가 상승하면 AUC 또한 상 승되어야 한다. 과거에는 MRSA균주들 의 대부분이 MIC <1 μg/mL로 낮아서 AUC/MIC가 400 이하고 감소되는 경우 가 적었으나, 최근에 분리되는 MRSA균 주들의 MIC는 1 또는 2 μg/mL로 증가 되어 있는 경우가 적지 않아 AUC/MIC 를 400 이상으로 유지하기가 어려운 경 우가 있고 이로 인해 vancomycin 치료 실패의 위험성이 증가하고 있다. 국내 한 대학병원에서 분리된 MRSA균주 중 10% 미만에서 MIC <1 μg/mL이었고 vancomycin에 대한 MIC 증가가 심각한 문제임이 확인되었 다[10]. Vancomycin에 대한 감수성 저하 MRSA의 위험인자 로 베타락탐 또는 vancomycin의 반복적인 사용, 고령, 당뇨 병, 만성 신부전, 정형외과 기구감염 등이 알려져 있다[11]. 따 라서 최근에는 MRSA에 의한 중증 감염의 경우 vancomycin 의 trough level 을 15-20 μg/mL으로 높게 유지할 것을 권 고하고 있다. 중증 감염의 예로서 균혈증을 동반한 경우, 감염 성 심내막염, 골수염, 뇌수막염, 폐렴, 중증 피부 및 연조직 감 염을 들 수 있다. Vancomycin을 투여하는 경우 therapeutic drug monitoring을 해서 용량을 조절하는 것이 필요하며, 신독성 발생에 주의를 기울여야 한다. Vancomycin trough level을 높이기 위해서 투여 용량을 증가시켜야 하는데, 그 결 과 vancomycin에 의한 신독성이 증가하고 있다[12].
Teicoplanin
Teicoplanin은 vancomycin과 항균력과 효능이 비슷한 glycopeptide이다. MRSA균혈증 치료 시 초치료로 사용하Table 1. Antibiotics for treatment of methicillin-resistant Staphylococcus aureus infections
Manifestation Drug Adult dose
SSTI
Purulent cellulitis Clindamycin 300-450 mg PO TID
TMP-SMX 2-4 T PO BID
Doxycycline or minocycline 100 mg PO BID
Complicated SSTI Vancomycin 15-20 mg/kg IV every 8-12 hr Linezolid 600 mg PO/IV BID
Clindamycin 600 mg IV TID
Bacteremia and infective endocarditis Vancomycin 15-20 mg/kg IV every 8-12 hr Daptomycin 6-10 mg/kg IV once daily Teicoplanin 6-12 mg/kg IV once daily Ceftaroline 600 mg IV every 12 hr Telavancin 10 mg/kg IV once daily
Pneumonia Vancomycin 15-20 mg/kg IV every 8-12 hr
Linezolid 600 mg PO/IV BID Clindamycin 600 mg IV TID
Bone and joint infections Vancomycin 15-20 mg/kg IV every 8-12 hr Linezolid 600 mg PO/IV BID
Clindamycin 600 mg IV TID
TMP-SMX 5 mg/kg/dose PO/IV every 8-12 hr
SSTI, skin and soft tissue infection; PO, per os; TID, three times a day; TMP-SMX, trimethoprim/sulfamethoxazole; T, tablet; BID, twice a day; IV, intravenously.
기도 하지만 근거가 부족하여 vancomycin을 사용하기 힘든 경우 대체로 사용하는 경우가 많다. 신독성 발생에 대한 우 려로 vancomycin 대신 teicoplanin을 투여하는 경우가 있는 데, 국내 대부분의 병원에서 teicoplanin에 대한 therapeutic drug monitoring이 시행되지 않으므로 적절한 용량을 결정 하기 어려워 중증 감염증에서 teicoplanin을 사용할 경우 주 의가 필요하다. 충분한 용량을 사용한 경우 최근 메타연구에 서 vancomycin에 비열등한 결과를 보였다[13].
Linezolid
Linezolid는 oxazolidinone계 정균 항생제로 50S ribo-some subunit와 결합하여 단백질 합성의 초기단계를 방해한 다. 이러한 새로운 기전을 통한 작용 때문에 linezolid는 기존 의 항생제들과 교차내성을 갖지 않는 장점이 있다. MRSA, vancomycin 고도내성 황색포도알균, vancomycin-resistant enterococcus 등 다제내성 그람양성균에 우수한 항균력을 나 타낸다. Linezolid는 정맥 및 경구투여가 가능한데, 100% 경 구 흡수율을 보인다. 혈중 단백결합률(31%)이 낮아서 조직 투 과가 좋다(피부 및 연조직, 폐, 신장, 간, 뇌척수액). 고가의 약 제이며 1차 치료제로 국내 건강보험 적용이 되지 않아 사용에 제한이 있으나, vancomycin, teicoplanin에 치료 실패한 경우 또는 부작용 발생한 경우 사용 가능한 항생제이다. Vancomycin과 달리 폐 상피조직액에 고농도로 도달하여, 특히 MRSA 폐렴에 대해서 vancomycin보다 우월한 치료효 과를 보고한 연구들이 있어 vancomycin 신독성 등의 부작 용을 고려한다면 MRSA 폐렴에서 linezolid의 사용을 고려해 볼 수 있다[14,15]. 골관절염에서 임상적 치유율은 55-98%, 미생물학적 치유율은 73-98%로 골관절염 치료에 사용될 수 있다[16]. 균혈증에서 치료성적은 vancomycin과 비슷하다. 내성 출현에 관해서는 내성을 보이는 황색포도알균이 보고 되고 있으며 인공 삽입물, 장기이식, 장기간 항생제 치료 등 과 연관된 것으로 알려져 있다. 부작용으로 대개 2주 이상 장기간 투여했을 때, 투여기간 및 용량에 비례해서 골수억제 (주로 일시적 혈소판 감소증)가 발생할 수 있으므로 주기적 인 검사가 필요하다. 장기간 투여한 환자에게는 비가역적 말 초신경증도 발생한다.
Quinolone계 항균제
Quinolone계 항균제는 생체이용률이 높고 부착된 세균 에도 작용하며 뼈에도 잘 침투한다. MRSA감염증에 단독으 로 치료하는 경우 내성균주가 쉽게 선택되어 감염의 재발이 나 치료 실패를 초래할 수 있어 다른 항균제와 병합하여 투 여하는데 rifampin과 병합이 권장된다[17]. Levofloxacin, moxifloxacin 같이 최근에 개발된 약제들은 포도알균에 대 한 MIC가 매우 낮고 내성 발생의 가능성도 적을 것으로 생 각되고 있다. 인공삽입물연관 포도알균 감염 환자에게 경구 moxifloxacin을 3개월 단독 투여하여 전체 82.6% (38/46) 가 치유되었고, 인공삽입물을 보유한 환자는 71% (15/21)가 치유되었다[18]. 이는 rifampin을 ciprofloxacin과 병합하여 장기간 치료한 것에 필적한 결과이다.Rifampin
Rifampin은 생체이용률(70-90%)이 높고 여러 가지 조 직과 생막을 잘 침투하는 살균제제이다. 통상적인 상태보다 MIC가 10-100배 더 높은 제자리성장기에 있는 부착된 포 도알균도 효과적으로 제거할 수 있다. 이런 장점으로 인공관 절염이나 금속고정물이 삽입된 골수염 치료에 반드시 필요 한 약제이다. Rifampin은 RNA중합효소의 표적부위에서 한 단계만 돌연변이가 생겨도 내성이 쉽게 유발된다. 단독으로 투여하면 안 되고 내성 발현을 줄이기 위해 다른 항균제와 병합치료(fusidic acid, quinolone)가 권장된다. Rifampin 병합요법은 포도알균에 의한 골관절염 치료에 유망하다 [19,20]. Rifampin을 중증 감염 병합치료제로 사용하곤 하 는데, vancomycin과 함께 투여 시 상승효과가 없으며 오히 려 길항작용으로 효과가 감소한다는 보고가 있었다[21]. 감 염성 심내막염에서도 vancomycin과의 병합치료의 이득이증명되지 못했다. Rifampin은 cytochrome P450효소체계 를 활성화하므로 항응고제나 면역억제제 등 약제를 복용하 고 있다면 약물교차반응을 염두에 두어야 한다.
Trimethoprim-sulfamethoxazole
Trimethoprim-sulfamethoxazole (TMP-SMX)는 경구 흡 수율이 우수하고 황색포도알균에 살균력이 있어 과거에는 다 양한 감염증 치료에 사용되었으나 내성균주의 확산으로 사 용이 줄고 있으나, CA-MRSA에 내성이 드물다. 세포 외에 thymidine이 많아지면 세균이 TMP-SMX 작용기전을 우회하 기 때문에 혈관내 감염이나 고름집이 있거나 괴사조직이 많은 감염에 사용하면 안 된다. 만성골수염과 같이 세균부하가 적 은 감염증 치료에 적합하다[22]. 장기간 고용량으로 사용 시 피 부발진, 골수 억제, 전해질 이상 등의 부작용이 생길 수 있다.Clindamycin
Clindamycin은 대부분의 CA-MRSA에 감수성이 있고 독 소를 억제하는 능력이 있다. 경구 흡수율 및 조직 투과도가 좋다. CA-MRSA 감염증을 clindamycin으로 치료할 때 유도 형 내성이 문제가 될 수 있어 주의가 필요하다. 항생제 감수성 검사에서 clindamycin에 감수성을 보이더라도 erythromycin 에 내성을 보이는 경우는 유도형 내성이 있는 균주(MLSb형) 로 치료 도중에 내성이 발현하여 부적절한 치료 결과로 이어 질 수 있다. 골관절염에 단독으로 혹은 다른 항균제와 병합하 여 장기간 치료제로 권장되고 있으나, Clostridium difficile 관 련 질환이 발생가능하여 주의가 필요하다[23].Fusidic acid
Fusidic acid는 항균범위가 좁은 단백합성억제제로 주 로 포도알균에 항균효과를 나타낸다. 내성균이 자연적으로 나타나므로 내성균 발현을 줄이기 위해 다른 항균제와 병 합치료가 권장된다. Fusidic acid는 포도알균에 의한 급만 성골수염, 관절염, 기타 정형외과감염 등의 골관절염 치료 에 오랫동안 사용되어 왔다[24]. MRSA에 의한 피부 연조 직 감염이나 골관절감염 치료에 초기 vancomycin 투여 후, rifampin-fusidic acid병합이 사용되고 있다.Tetracycline
지역에 따라 차이는 있지만 CA-MRSA의 88%에서 tetra-cycline에 감수성을 보였으며 CA-MRSA 감염증의 83%, CA-MRSA에 의한 연조직 감염증의 93%에서 치료 성공률을 보였다[5]. Tetracycline에 비해서 doxycycline이 황색포도알 균에 대한 항균력과 경구 흡수율이 좋은 장점이 있다.Tigecycline
Tigecycline은 glycylcycline 계열의 새로운 정균 항생제 로 그람양성, 그람음성(Pseudomonas sp. 제외) 및 혐기균 에 항균력을 가진다. 동물 실험에서 골조직, 신장, 뇌척수액 등에 우수한 조직 침투력을 보였으며, 복합성 피부 및 연조 직 감염에 대한 임상연구에서 86% 임상적 치유율을 보이며, vancomycin 및 aztreonam 병합 치료군과 효과에서 차이가 없었다[25]. 복강 내 감염과 지역사회폐렴에 사용할 수 있다. 균혈증을 포함한 중중감염에 사용시 비교군보다 낮은 혈중 농도와 높은 사망률을 보여 추천하지 않는다. Warfarin 혈 중농도를 높일 수 있어 동시 투여 시 주의를 요하며 주요 부 작용으로 경도의 오심과 구토가 있을 수 있다.국내 미출시 MRSA 항생제
1. Daptomycin Daptomycin은 그람양성균에 대한 항균력이 우수한 최초의 cyclic lipopeptide 계열의 항생제로 2003년 미국 식 품의약국 승인을 받았다. 황색포도알균에 의한 혈류감염 및 우측심내막염 환자의 치료에 있어 기존의 nafcillin 또는 vancomycin과 대등한 효능을 보였다[26]. Vancomycin에 대한 MIC가 높거나 균집락이 많은 감염에서 vancomycin 보다 치료성적이 좋아 사용을 고려할 수 있다[27]. 하지만 전향적 폐렴 연구에서는 ceftriaxone에 비해서 효과가 의 미 있게 떨어져 연구를 조기에 중단하게 되었는데, 폐 계면 활성제에 의해 분해되고 폐 조직 투과력이 좋지 않아 호흡 기 감염 치료에는 권장되지 않는다[28]. 부작용으로는 횡문 근 융해증이 일부에서 보고되어 혈중 creatine kinase 확인 이 필요하다. 2. Telavancin
Telavancin은 가장 최신의 2세대 glycopeptide (sem-isynthetic lipoglycopeptide) 항생제로 반감기가 길어 하루 1회 투여가 가능하고 조직 투과력이 향상되었다. 복합성 피 부 및 연조직 감염 임상연구에서 vancomycin 등 기존 항생 제와 비교해 우수한 임상적 치유율(82% vs. 69%)과 미생물 적 치유율(84% vs. 74%)을 보여 2009년 미국 식품의약국 에서 승인되었다[29]. 원내 폐렴에 대한 임상연구는 부적합 한 치료결과였고, 심내막염을 포함한 균혈증에 연구는 진 행 중이다. 3. Ceftaroline
Ceftaroline은 PBP2a에 친화력이 높아서 MRSA에 항균 력이 있는 5세대 cephalosporin항생제다. Staphylococci, pneumococci 등 그람양성균 및 그람음성균에 대해 광범위 한 항균력을 가진다. 감염성 심내막염 토끼 동물모델에서 MRSA에 대해서는 vancomycin과 동등한 효과를, vanco-mycin에 감수성이 저하된 황색포도알균에 대해서는 우월한 효과를 보였다. 복합성 피부 및 연조직 감염과 지역사회획득 폐렴에 우수한 치료효과를 보여 치료제로 승인되었다. 심내 막염을 포함한 균혈증에 대한 치료에 대한 2차 치료제로 사 용되거나 daptomycin과 병합용법으로 구제치료에 사용되 기도 한다.
결론
MRSA감염의 치료는 신속한 원인제거와 적절한 항생 제 사용이 중요하다. Vancomycin이 여전히 가장 효과적 으로 추천되는 항생제이나 치료실패시 특히 균혈증 동 반된 경우 daptomycin, ceftaroline 같은 새로운 항생제 를 단독 혹은 병합요법으로 고려할 수 있다. 피부 및 연조 직감염증의 경우 CA-MRSA에 의한 감염을 고려해야 한 다. 골관절감염의 경우 장기간 치료가 필요하여 초기 항생 제 정주치료 이후 경구 병합용법을 사용할 수 있다. 감수 성이 있다면 연구가 가장 많이 되었고 치료효과가 확인된 rifampin과 quinolone계 항균제 병합을 고려한다. 내성이 거나 부작용 발생 시 rifampin-fusidic acid 병합이나 이 외 clindamycin, TMP-SMX와 병합도 사용할 수 있다. 병 합요법을 사용할 수 없을 때는 새로운 계열의 quinolone, clindamycin, TMP-SMX, linezolid 등의 단독투여도 고려 할 수 있겠다. 찾아보기말: 메티실린 내성 황색포도알균; 반코마이신; 약물치료 ORCIDEun Ju Choo, https://orcid.org/0000-0003-2842-7041
REFERENCES
1. Kang CI, Song JH. Antimicrobial resistance in Asia: current epidemiology and clinical implications. Infect Chemother 2013;45:22-31.
2. Choo EJ, Chambers HF. Treatment of methicillin-resistant Staphylococcus aureus bacteremia. Infect Chemother 2016; 48:267-273.
3. Cunha BA. Methicillin-resistant Staphylococcus aureus: clini-cal manifestations and antimicrobial therapy. Clin Microbiol Infect 2005;11 Suppl 4:33-42.
4. Song JY, Kim WJ. Antimicrobial therapy of multidrug-resistant gram-positive bacterial infections. Korean J Med 2006;71 Suppl 2:S786-S803.
Como-Sabetti K, Jernigan JA, Harriman K, Harrison LH, Lynfield R, Farley MM; Active Bacterial Core Surveillance Program of the Emerging Infections Program Network. Methicillin-resistant Staphylococcus aureus disease in three communities. N Engl J Med 2005;352:1436-1444.
6. Kim JS, Kim UJ. Community-acquired MRSA. Infect Che-mother 2004;36 Suppl 2:137-140.
7. Kim M, Kim NJ. Antimicrobial resistance and treatment update of skin and soft tissue infections. Korean J Med 2011;81:699-707.
8. Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, Kaplan SL, Karchmer AW, Levine DP, Murray BE, J Rybak M, Talan DA, Chambers HF; Infectious Diseases Society of America. Clinical practice guidelines by the infectious dis- eases society of America for the treatment of methicillin-resis-tant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011;52:e18-e55.
9. Kang CI. Whatʼs new in the management of bacterial infec-tions in the era of multidrug-resistant bacteria? J Korean Soc Transplant 2013;27:81-86.
10. Park KH, Kim ES, Kim HS, Park SJ, Bang KM, Park HJ, Park SY, Moon SM, Chong YP, Kim SH, Lee SO, Choi SH, Jeong JY, Kim MN, Woo JH, Kim YS. Comparison of the clinical features, bacterial genotypes and outcomes of patients with bacteraemia due to heteroresistant vancomycin-intermediate Staphylococcus aureus and vancomycin-susceptible S. aureus. J Antimicrob Chemother 2012;67:1843-1849.
11. Ruef C. Epidemiology and clinical impact of glycopeptide resistance in Staphylococcus aureus. Infection 2004;32:315-327.
12. van Hal SJ, Paterson DL, Lodise TP. Systematic review and meta-analysis of vancomycin-induced nephrotoxicity asso-ciated with dosing schedules that maintain troughs between 15 and 20 milligrams per liter. Antimicrob Agents Chemother 2013;57:734-744.
13. Yoon YK, Park DW, Sohn JW, Kim HY, Kim YS, Lee CS, Lee MS, Ryu SY, Jang HC, Choi YJ, Kang CI, Choi HJ, Lee SS, Kim SW, Kim SI, Kim ES, Kim JY, Yang KS, Peck KR, Kim MJ. Multicenter prospective observational study of the comparative efficacy and safety of vancomycin versus teicoplanin in patients with health care-associated methicillin-resistant Staphylococcus aureus bacteremia. Antimicrob Agents Chemother 2014;58:317-324.
14. Wunderink RG, Niederman MS, Kollef MH, Shorr AF, Kunkel MJ, Baruch A, McGee WT, Reisman A, Chastre J. Linezolid in methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a randomized, controlled study. Clin Infect Dis 2012;54:621-629.
15. Walkey AJ, OʼDonnell MR, Wiener RS. Linezolid vs glyco-peptide antibiotics for the treatment of suspected methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a meta-analysis of randomized controlled trials. Chest 2011;139: 1148-1155.
16. Bassetti M, Vitale F, Melica G, Righi E, Di Biagio A, Molfetta L, Pipino F, Cruciani M, Bassetti D. Linezolid in the treatment of Gram-positive prosthetic joint infections. J Antimicrob Chemother 2005;55:387-390.
17. Schrenzel J, Harbarth S, Schockmel G, Genne D, Bregenzer T, Flueckiger U, Petignat C, Jacobs F, Francioli P, Zimmerli W, Lew DP; Swiss Staphylococcal Study Group. A randomized clinical trial to compare fleroxacin-rifampicin with flucloxaci-llin or vancomycin for the treatment of staphylococcal infec-tion. Clin Infect Dis 2004;39:1285-1292.
18. San Juan R, Garcia-Reyne A, Caba P, Chaves F, Resines C, Llanos F, Lopez-Medrano F, Lizasoain M, Aguado JM. Safety and efficacy of moxifloxacin monotherapy for treatment of orthopedic implant-related staphylococcal infections. Antimi-crob Agents Chemother 2010;54:5161-5166.
19. Perlroth J, Kuo M, Tan J, Bayer AS, Miller LG. Adjunctive use of rifampin for the treatment of Staphylococcus aureus infections: a systematic review of the literature. Arch Intern Med 2008;168:805-819.
20. Kim BN. Oral agents for the treatment of orthopedic infec-tions caused by methicillin-resistant Staphylococci. Infect Chemother 2011;43:322-338.
21. Shelburne SA, Musher DM, Hulten K, Ceasar H, Lu MY, Bhaila I, Hamill RJ. In vitro killing of community-associated methicillin-resistant Staphylococcus aureus with drug combi-nations. Antimicrob Agents Chemother 2004;48:4016-4019. 22. Garau J, Bouza E, Chastre J, Gudiol F, Harbarth S.
Manage-ment of methicillin-resistant Staphylococcus aureus infec-tions. Clin Microbiol Infect 2009;15:125-136.
23. Lew DP, Waldvogel FA. Osteomyelitis. Lancet 2004;364:369-379.
24. Coombs RR. Fusidic acid in staphylococcal bone and joint infection. J Antimicrob Chemother 1990;25 Suppl B:53-60. 25. Stein GE, Craig WA. Tigecycline: a critical analysis. Clin Infect
Dis 2006;43:518-524.
26. Fowler VG Jr, Boucher HW, Corey GR, Abrutyn E, Karchmer AW, Rupp ME, Levine DP, Chambers HF, Tally FP, Vigliani GA, Cabell CH, Link AS, DeMeyer I, Filler SG, Zervos M, Cook P, Parsonnet J, Bernstein JM, Price CS, Forrest GN, Fätkenheuer G, Gareca M, Rehm SJ, Brodt HR, Tice A, Cosgrove SE; S. aureus Endocarditis and Bacteremia Study
Group. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med 2006;355:653-665.
27. Moore CL, Osaki-Kiyan P, Haque NZ, Perri MB, Donabedian S, Zervos MJ. Daptomycin versus vancomycin for blood-stream infections due to methicillin-resistant Staphylococcus aureus with a high vancomycin minimum inhibitory concen-tration: a case-control study. Clin Infect Dis 2012;54:51-58. 28. Anstead GM, Owens AD. Recent advances in the treatment of
infections due to resistant Staphylococcus aureus. Curr Opin Infect Dis 2004;17:549-555.
29. Stryjewski ME, Chu VH, O'Riordan WD, Warren BL, Dunbar LM, Young DM, Vallee M, Fowler VG Jr, Morganroth J, Barriere SL, Kitt MM, Corey GR; FAST 2 Investigator Group. Telavancin versus standard therapy for treatment of complicated skin and skin structure infections caused by gram-positive bacteria: FAST 2 study. Antimicrob Agents Chemother 2006;50:862-867.
Peer Reviewers’ Commentary
본 논문은 메티실린내성 황색포도알균(MRSA)감염의 항생제 요 법에 대한 종설 논문이다. 현재 우리나라에서 분리되는 황색포 도알균의 약 70%는 메티실린 내성이며 빈도와 중증도 측면에서 의료관련 감염의 가장 중요한 균이다. Vancomycin으로 대표되 는 치료약제 역시 무분별한 사용은 vancomycin 내성을 유발할 수 있다는 사실도 증명된 바 있다. 본 원고는 vancomycin의 적 절한 사용의 중요성은 물론 치료효과를 예측함에 있어 혈중 농 도 측정의 의미를 강조하였다. 그 외에도 MRSA 감염에 사용할 수 있는 항생제들의 특징과 장·단점을 체계적으로 기술하여 임 상의들이 환자들의 특징을 고려하여 항생제를 선택 하는데 도움 이 될 것이다. 아직까지 국내에 도입되지 않은 주요 항생제들에 대한 소개를 포함하여 최신지견에 대한 이해를 돕고 있어, 우리 나라에서 MRSA 감염에 대한 항생제 치료를 하는데 좋은 지침이 될 것으로 기대된다. [정리: 편집위원회]