이
이
이학
학
학 석
석
석사
사학
사
학
학위
위
위 논
논
논문
문
문
사
사
사람
람
람포
포
포피
피
피세
세
세포
포
포와
와
와
H
H
Hu
u
uh
h
h7
7
7간
간
간암
암세
암
세
세포
포
포주
주
주에
에
에서
서
서
B
B
BT
T
TG
G
G2
2
2
TI
T
T
I
IS
S
S2
2
21
1
1/
/
/P
P
PC
C
C3
3
3
유
유
유전
전
전자
자발
자
발
발현
현
현조
조
조절
절
절에
에
에
의
의
의한
한
한 세
세
세포
포
포노
노화
노
화
화유
유
유도
도
도 연
연
연구
구
구
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
강
강
강 소
소
소 영
영
영
사
사
사람
람
람포
포
포피
피
피세
세
세포
포
포와
와
와
H
H
Hu
u
uh
h
h7
7
7간
간
간암
암세
암
세
세포
포
포주
주
주에
에
에서
서
서
B
B
BT
T
TG
G
G2
2
2
TI
T
T
I
IS
S
S2
2
21
1
1/
/
/P
P
PC
C
C3
3
3
유
유
유전
전
전자
자발
자
발
발현
현
현조
조
조절
절
절에
에
에
의
의
의한
한
한 세
세
세포
포
포노
노화
노
화
화유
유
유도
도
도 연
연
연구
구
구
지
지
지도
도
도교
교
교수
수
수 임
임
임 인
인
인 경
경
경
이
이
이 논
논
논문
문
문을
을
을 이
이
이학
학
학 석
석
석사
사
사학
학
학위
위
위 논
논
논문
문
문으
으
으로
로 제
로
제
제출
출
출함
함
함.
.
.
2
2
20
0
00
0
08
8
8년
년
년
2
2
2월
월
월
아
아
아 주
주
주 대
대
대 학
학 교
학
교
교 대
대
대 학
학
학 원
원
원
의
의
의 학
학
학 과
과
과
강
강
강 소
소
소 영
영
영
강
강
강소
소
소영
영
영의
의 이
의
이
이학
학
학 석
석
석사
사
사학
학
학위
위
위 논
논
논문
문
문을
을
을 인
인
인준
준
준함
함
함.
.
.
심
심
심사
사위
사
위
위원
원
원장
장
장
임 인
임
임
인
인 경
경
경
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
윤
윤
윤 계
계
계 순
순
순
인
인
인
심
심
심 사
사
사 위
위
위 원
원
원
박
박
박 태
태
태 준
준
준
인
인
인
아
아
아 주
주
주 대
대
대 학
학
학 교
교
교 대
대
대 학
학
학 원
원
원
2
2
20
0
00
0
07
7
7년
년
년 1
1
12
2
2월
월
월 2
2
21
1
1일
일
일
- 국문요약 -
사람포피세포
사람포피세포
사람포피세포
사람포피세포와
와
와
와 Huh7
Huh7
Huh7
Huh7
간암세포주
간암세포
간암세포
간암세포
주
주에서
주
에서
에서
에서
BTG2
BTG2
BTG2
BTG2
TIS21/PC3TIS21/PC3TIS21/PC3TIS21/PC3유전자
유전자
유전자
유전자발현조절
발현조절
발현조절에
발현조절
에 의한
에
에
의한
의한
의한 세포노화유도
세포노화유도
세포노화유도 연구
세포노화유도
연구
연구
연구
목적 목적목적
목적:::: TIS21 (TPA inducible sequences 21)는 mouse, BTG2 (B-cell translocation gene-2)는 human, PC3 (pheocromocytoma clone-3)는 rat 에 존재하는 동등 유전자이고, anti-proliferative gene family 에 속한다. TIS21BTG2/PC3
는 세포 내에서 전사보조인자, 신경세포 분화인자 및 성장 억제인자로서 thymocyte 의 stage-specific expansion 을 매개하는 중요인자이고 조혈모세포 증식억제인자로 보고된 바 있다. 사람과 생쥐에서 암 억제유전자이고 세포증식을 억제하는 pan-cell cycle regulator 로서의 기능을 하는 사실 등은 TIS21 유전자가 세포노화에 관련이 있음을 시사한다. 본 연구실에서는 이미 293 세포에서 TIS21 과발현을 유도하면 세포증식이 떨어지고 세포의 크기가 증가하는 현상을 보고한 바도 있다. 이때 그 기전으로서는 TIS21 과발현에 의하여 cyclin E 와 cyclin-dependent kinase (cdk) 4 의 합성이 감소할 뿐만 아니라 G1-S transition 때 cdk activity 도 현저하게 감소함이 널리 인정되었다. 본 연구에서는 세포의 자연노화 및 유도노화 과정 중에 TIS21BTG2/PC3 의 발현이 증가하는 현상을 통해서 TIS21BTG2/PC3 에 의해 노화 현상이 유도되는 것인지 아니면 유지되는 것인지, 또한 이런 현상은 어떤 기전을 통해서 이뤄지는 것인지 알아보고자 하였다. 재료 재료재료 재료 및및및및 방법방법방법: 방법: : : 젊은 HDF 세포를 계대배양하면서 replicative senescence 를 유도하고, Huh7 세포에 200 μM H2O2 의 농도로 한 번 또는 반복적으로 처리하여 조기노화세포를 만들었다. 정상 생쥐와 TIS21 생쥐의 태아에서
MEF 세포를 분리하였다. 세포노화의 진행 정도는 Senescence associated-β-galactosidase assay (SA-β-gal)와 세포성장율 측정으로 표현하였다. 단백질의 발현과 세포 내 위치변화는 immunoblotting 과 면역형광염색을 수행하여 측정하였다. 세포 내 TIS21BTG2
발현양은 RT-PCR, Real-time PCR 로 측정하였다. 활성산소양은 2’7’-dichlorofluorescin diacetate 로 염색하여 fluorescence activated cell sorter (FACS)로 측정하였으며, 미토콘드리아 막의 전위차는 JC-1 염색 후 FACS 형광 측정을 하였다. 결과 결과결과 결과: : : : 1. 젊은 HDF 세포를 계대배양하여 replicative senescence 가 진행되는 세포에서 SA-β-gal 활성이 증가하고, 세포성장율이 떨어지는 것을 관찰할 수 있었고, 노화표지자인 SA-p-Erk1/2 의 발현이 노화된 HDF 세포에서 증가하는 것을 확인하였으며, 이때 BTG2 mRNA 의 발현이 증가하는 것을 관찰하였다. 2. H2O2 를 단독 또는 반복적으로 처리한 경우 Huh7 세포의 크기가 증가하였고, 세포성장율이 떨어지면서 SA-β-gal 활성과 핵 내 actin 의 축적양이 증가하는 것을 면역형광법으로 관찰하였으며, BTG2 mRNA 의 발현이 증가하는 것을 RT-PCR 로 측정하였다. 3. TIS21 유전자를 발현하는 Huh7 세포에서 성장율이 현저하게 감소하였으며, SA-β-gal 활성이 증가하였고, SA-p-Erk1/2 의 발현도 증가되어 있는 것을 관찰하였다. 4. 정상생쥐와 TIS21 생쥐의 태아에서 각각 TIS21+/+ MEF 와 TIS21 -/-MEF 를 분리해서 TIS21 -/-된 것을 RT-PCR 로 확인하였고, TIS21 MEF 는 TIS21+/+ MEF 보다 성장율이 좋은 것을 관찰하였다. 또한, SA-β-gal 활성도 감소되어 있었다. H2O2 를 처리하였을 때 SA-β-gal 활성이 TIS21
-/-
MEF 에서 TIS21+/+ MEF 보다 감소되어 있었다.
5. Adenovirus 로 TIS21 을 과발현시킨 Huh7 세포 내에 활성산소의 양은 차이가 없었지만, 미토콘드리아 막의 전위차가 감소되어 있었으며, MnSOD 의
발현이 증가되어 있는 것을 관찰하였다. 이때, Huh7 세포에 doxorubicin 을 처리하면 SA-β-gal 활성과 활성산소의 발현양이 증가되는 것을 관찰하였다. 결론 결론결론 결론:::: 젊은 HDF 세포를 계대배양으로 노화시키는 경우와 Huh7 세포에 H2O2 를 처리하여 조기노화를 유도한 세포에서 노화가 진행되었음을 여러 가지 노화표지자로 측정하였고, 이러한 세포에서 BTG2TIS21/PC3 발현이 증가되어 있는 것을 관찰함으로써 노화과정과 BTG2TIS21/PC3 의 기능 사이에 관계가 있음을 알게 되었다. 이러한 기전은 TIS21 유전자가 계속적으로 발현되는 세포와 TIS21 MEF 를 이용해서 BTG2TIS21/PC3 발현증가와 노화과정진행이 연관되어 있음을 알 수 있었다. BTG2TIS21/PC3 에 의해서 노화과정이 유도될 때 어떠한 변화가 생기는지 알아보고자 세포 내 활성산소의 양과 미토콘드리아 막의 전위차를 측정한 결과, adenovirus 를 이용해 TIS21 을 과발현 시켰을 때 세포 내 활성산소의 양은 대조표준과 차이가 없었지만, 미토콘드리아 막의 전위차가 약간 감소하였으며 MnSOD 발현양이 증가되었다. Adenovirus 를 이용해 TIS21 을 과발현 시키고 doxorubicin 을 처리하였을 때 SA-β-gal 활성이 대조표준보다 증가되었고, 세포 내 활성산소의 양이 약간 증가하였다. 이를 통해서 BTG2TIS21/PC3 에 의해서 세포노화가 유도되고, 이러한 현상은 BTG2TIS21/PC3 단독 효과만으로는 부진하지만, doxorubicin 이나 H2O2 와 같은 DNA 손상유도물질을 동반 처리하면 세포노화유도가 촉진되는 것을 알 수 있었다. 결과적으로, BTG2TIS21/PC3 과발현을 유도하여 암세포 노화를 촉진함으로써, 암세포의 빠른 증식을 지연 또는 억제시켜 암세포 치료의 효과에 도움이 될 것이라 기대된다. 핵심어: BTG2 TIS21/PC3 , 세포노화유도, HDF, Huh7
차
차
차
차
례
례
례
례
국문요약 ……… ⅰ 차례 ……… ⅳ 그림차례 ……… ⅵ I . 서 론 …… … … ……… … … …… … … …… … … …… … … …… … … 1 A. 세포노화 ……… 1 B. T I S 2 1B T G 2 / P C 3 … … … 3 II. 재료 및 방법 ……… 6 A. 사람 포피세포 분리, HDF 세포 ……… 6 B. 생쥐 태아 섬유모세포 분리, MEF 세포 ……… 7C. Huh7세포에 TIS21 complementary DNA (cDNA) transfection …… 7
D. 세포 수 집계 ……… 8
E. TIS21 adenovirus ……… 8
F. Doxorubicin-induced senescence ……… 8
G. Senescence associated-β-galactosidase assay ……… 9
H. 면역형광세포염색 ……… 9 I. RNA분리와 RT-PCR ……… 10 J. Real-time PCR ……… 11 K. 세포 내 활성산소 (ROS)의 양 측정 ……… 12 L. 미토콘드리아 막 전위차 측정 ……… 13 M. 미토콘드리아 염색 ……… 13
N. Western blot analysis ……… 14
O. 통계처리 ……… 15
III. 결과 ……… 16
A. 노화된 세포에서 BTG2TIS21 의 발현증가 ……… 16
C. TIS21BTG2 과발현에 의한 노화현상유도로 나타나는 생화학적 변화 ……… 18 IV. 고찰 ……… 33 V. 결론 ……… 37 참고문헌 ……… 38 영문요약 ……… 47
그림
그림
그림
그림 차례
차례
차례
차례
Fig. 1. Expression of BTG2 mRNA was increased in the replicative
senescence of HDF cells. ……… 21 Fig. 2. Expression of BTG2 mRNA was also increased in the H2O2 induced-
senescence in Huh7 cells. ……… 23 Fig. 3. Over-expression of TIS21 induced cellular senescence
phenotypes in Huh7 cells. ……… 26 Fig. 4. Expression of TIS21 increased cellular senescence phenotypes
in MEF cells. ……… 27 Fig. 5. Generation of reactive oxygen species was not changed, whereas
mitochondrial membrane potential (MMP) was slightly decreased in Huh7 cells by TIS21 over-expression. ……… 29 Fig. 6. TIS21-induced senescence phenotypes were accelerated by
treatment of doxorubicin expression. ……… 31 Fig. 7. TIS21BTG2
induced cellular senescence phenotypes measured by various markers. ……… 32
I.
I.
I.
I.
서
서 론
서
서
론
론
론
A. A. A. A. 세포노화세포노화세포노화세포노화 정상 세포는 손상되지 않은 신진대사 활동을 함에도 불구하고 일정 기간 동 안 세포분열을 하고 나면 더 이상 분열을 할 수 없는 상태에 빠진다. 이를 ‘replicative cellular senescence’라 한다 (Hayflick, 1965). 노화세포는 몇 가지 대표적인 특징을 가진다. ; 세포 크기가 커지거나 세포질이 납작해지고, filopodia, lamellipodia와 stress fiber가 많아지고, 길이도 길어지는 것과 같은 특이적인 형태 변화가 생기게 된다 (Chang 등, 1999; Lim 등, 2000). 성장을 촉진하는 인자에 의한 반응으로 세포분열주기 중에서 S기로 들어가는 것이 불가 능하게 되고 (Campisi, 2001), G1기에 정지되어있어 더 이상 세포가 성장하지 않게 된다 (Stein 와 Dulic, 1995). 이는 노화세포들은 G1에서 S 주기로의 진행 에 관여하는 세포주기 조절인자들의 발현 또는 기능에 결함이 있는 것으로 밝혀 졌는데, cyclin A, B, cdc2는 노화세포에서 발현이 감소되어 있는 반면 (Richter 등, 1991; Stein 등, 1991), cyclin-dependent kinase inhibitors인 p21WAF1/CIP1과 p16INK4a
은 발현이 증가되어 있다 (Stein 등, 1999). 또한 retinoblastoma 단백질은 저인산화되어 있는 것이 보고되어있다 (Futreal 와 Barrett, 1991). 노화된 세포는 SA-β-gal 활성이 pH 6.0에서 증가되어 있고 (Dimri 등, 1995; Shelton 등, 1999), 늙은 human diploid fibroblast (HDF)에서 p-Erk1/2의 발현이 세포질에 유지되어 있으며 젊은 HDF에서의 발현보다 증가되
어 있고 (Kim 등, 2003; Lim 등, 2000), 핵에 G-actine의 발현이 축적되어 있 음이 보고된 바 있다 (Kwak 등, 2004). 현재 이러한 것들이 노화의 표지로서 사용되고 있다. 노화의 종류와 노화를 유발하는 물질에는 여러 가지가 있는데, replicative senescence는 산화환원스트레스 (redox stress)나 어떠한 발단에 의해서 telomere의 길이가 점점 짧아져서 생기는 것이고 (Chiu 와 Harley, 1997; Furumoto 등, 1998; Naderi 등, 2006; Passos 와 von Zglinicki, 2005; Passos 와 Von Zglinicki, 2006), 다른 종류의 노화는 DNA를 손상시키는 약물 에 의해서 유발되는 것이다. 두 종류 모두 DNA damage checkpoint kinases ataxia telaectasia-mutated (ATM)와 Chk (checkpoint kinase)를 통해서 노 화가 유발되는 것으로 보고된 바 있다 (d'Adda di Fagagna 등, 2003; Di Leonardo 등, 1994; Herbig 등, 2004). 자외선, 약물 또는 cytokine 등 세포외 부의 자극에 의한 스트레스 (Chen 와 Ames, 1994; Duan 등, 2005)나 DNA 손상 (Robles 와 Adami, 1998)을 입었을 경우에 세포가 스트레스에 오랫동안 노출되어 세포는 조기노화 과정이 진행된다. 이를 stress-induced premature senescence (SIPS)라 한다 (Serrano 와 Blasco, 2001). 이는 세포 내 활성 산 소가 증가되어 매개하는 것으로 알려져 있다. 또 한, Oncogene 활성화에 의해서 도 노화가 유도된다 (Mooi 와 Peeper, 2006; Serrano 등, 1997). 노화의 매개 체로는 tumor suppressor p53과 retinoblastoma protein/p16이 속하는데 (Chen 등, 2005; Narita 등, 2003; Serrano 등, 1997), 형질 변환된 세포에서 노화 프로그램이 이뤄지지 않는다면, 대부분은 tumor suppressor 유전자가 비 활성화되어 있기 때문이다. 이러한 세포는 계속 세포 분열하게 되어 악성종양으 로 변하게 될 수도 있다. 이런 세포를 다시 노화과정이 진행되게 하면 암이 이뤄
지는 것을 예방하거나 방해하는 방법이 될 수도 있다 (Campisi, 2001; Schmitt, 2007).
B. B. B.
B. BTG2BTG2BTG2BTG2TIS21/ /TIS21/ /TIS21/ /TIS21/ /PC3PC3PC3PC3
BTG2TIS21/PC3 는 APRO 상동 범위인 Box-A (Tyr49
-Asn71
)와 Box-B (Leu96
-Glu115
)를 가진 APRO (antiproliferative) 단백질 집단에 속한다 (Matsuda 등, 2001). TIS21 (TPA inducible sequences 21) 유전자는 초기의 성장 반응 유전자 (Sukhatme 등, 1987)로 12-O-tetradecanoyl phorbol-13-acetate (TPA)를 SW3T3 세포에 처리해서 분리되었다 (Fletcher 등, 1991). TIS21 과 상동유전자인 PC3 는 rat PC12 세포에서 (Bradbury 등, 1991), BTG2 (B-cell translocation gene 2)는 human 에서 밝혀졌다 (Rouault 등, 1996). BTG2TIS21/PC3
의 기능에 대한 연구는 아직 광범위하게 이뤄지지는 않았지만, 잠재적인 역할로는 (1) 전사 공동 조절자 (transcriptional co-regulator)로 BTG2TIS21/PC3
와 상호작용을 하는 단백질의 활성을 조절하는데 관여한다 (Duriez 등, 2004; Morel 등., 2003; Prevot 등, 2001; Rouault 등, 1998). (2) 신경조직의 분화에 관여하는 인자로 신경세포의 증식을 저해하고 (Canzoniere 등, 2004; Corrente 등, 2002; el-Ghissassi 등, 2002; Iacopetti 등, 1999), PC12 세포에서는 생존인자로서 신경돌기를 성장시키고, 신경상피세포를 분화시키는데 관여한다 (Calegari 등, 2002; Calegari 등, 2005; Canzoniere 등, 2004; el-Ghissassi 등, 2002; Haubensak 등, 2004; Kosodo 등, 2004; Wang 등, 1997). (3) 흉선세포가 특정한
분화단계에 맞게 증식하도록 하는데 중요한 매개자와 조혈모세포의 증식을 억제하는 조절자로서 역할을 한다 (Konrad 와 Zuniga-Pflucker, 2005; Oswald 등, 2006). (4) SV40T 생쥐에서 흉선암, 신장세포암과 전립선암에서 종양억제유전자로서 기능을 하고, 생쥐와 사람에게서 생긴 유방암이 노화되는 현상을 조절한다 (Elmore 등, 2005; Ficazzola 등, 2001; Kawakubo 등, 2004; Lim 등, 1995; Ryo 등, 2005; Struckmann 등, 2004). (5) 세포주기 조절자로 pRB 에 의존적인 방법과 비의존적인 방법으로 세포를 G1/S 주기에 정지시키거나 p53 유전자가 존재하지 않는 U937 세포에서는 G2/M 주기에 세포를 정지시키거나 세포사를 일으킨다 (Guardavaccaro 등, 2000; Hong 등, 2005; Lim 등, 1998; Ryu 등, 2004). (6) TIS21-/- 생쥐에서 척추동물의 발달 양식 (patterning) 조절자이고, 제브라피시 (zebrafish)의 축옆중배엽 (paraxial mesoderm) 발달과정과 아프리카발톱개구리 (Xenopus)의 척색 (notochord: 척수의 아래로 뻗어있는 연골로 된 줄모양의 물질) 발달과정 조절자로서 기능을 한다고 보고된 바 있다 (Park 등, 2004; Sakaguchi 등, 2001; Sugimoto 등, 2005). 여러 가지 TIS21 유전자의 잠재적인 기능 중에서 관심을 가지게 된 부분은 BTG2TIS21 가 정규장소 밖에서 발현이 되면 유방암세포를 G1 기에 정지시켜 세포성장을 저해시키고, 이러한 효과는 cyclin D 에 의해서 전환되게 된다 (Kawakubo 등, 2004). 또한, 임인경 교수 연구실에서 293 세포에 외부유전자인 TIS21 을 지속적으로 발현되게 하였더니 세포의 크기가 커지면서 세포성장이 감소되었고, cyclin E 와 CDK4 의 합성이 지연되고, cyclin E 와 관련된 CDK 의 활성이 감소되면서 G1-S 시기의 전환이 저해되는 현상을 이미 보고한 바 있다 (Lim 등, 1998). 그러므로, BTG2TIS21/PC3 은 최소한 cyclin
D1 과 cyclin E 두 가지 경로를 통해서 세포 주기 정지를 유도 할 수가 있다. 이러한 현상을 통해서 본 연구에서는 TIS21 유전자와 노화현상간의 상관관계가 있을 것이라고 생각하게 되어 노화과정과 TIS21 이 어떠한 관계가 있는지, 노화가 진행되는 과정에서 TIS21 이 어떤 효과를 나타내는지 살펴보았다.
Ⅱ
Ⅱ
Ⅱ
Ⅱ.
.
.
. 재료
재료
재료 및
재료
및
및
및 방법
방법
방법
방법
A. A. A.
A. 사람사람사람사람 포피포피포피포피 세포세포 분리세포세포 분리분리분리, Human Diploid Fibroblast (HDF) , Human Diploid Fibroblast (HDF) , Human Diploid Fibroblast (HDF) , Human Diploid Fibroblast (HDF) 세포세포세포 세포
본 실험에서 이용한 세포는 4 세 소년의 포피를 아주대학병원에서 수술 후
동의를 받아 사용하였다. 포피를 살균한 가위와 핀셋으로 1 x 5 mm 로 잘게 자르고 저민 후, 저민 조직을 Dulbeccos' phosphate-buffered saline (D-PBS)에 헹구고, 5 ml 의 0.25 % collagenase 를 1.5 시간 동안 처리한 후, 1000 g 에서 5 분 동안 원심분리를 하였다. 침전물에 0.0125 % trypsin 이 포함된 10 ml 의 D-PBS 를 처리한 후 5 % CO2 가 있는 37 ℃ 배양기에서 5 분 동안
배양하였다. 배양 후, trypsin 을 불활성화 시키기 위해 fetal bovine serum (FBS, GibcoBRL, Life Technologies, NY)을 1 ml 첨가한 후 각각의 세포로 분리하기 위해 10 분 동안 vortex 하였다. 1,000 g 에서 3 분 동안 원심분리 한 후, 침전물을 10 ml 의 D-PBS 에 두 번 헹궜다. 마지막으로, 침전물을 10 % FBS 와 0.5 % antibiotics (GibcoBRL, Life Tchnologies, NY)가 첨가된 Dulbecco's Modified Eagle Medium (DMEM, GibcoBRL, Life Tchnologies, NY) 배지 10 ml 에 섞어 배양하였다. 다음 날, 배양 용기에 붙은 세포를 제외하고 배지에 떠있는 세포를 제거한 후, 다시 새로운 배지로 교환하였다. 세포가 배양 용기에 가득 찼을 때를 기준으로 population doubling (PD)의 수를 다음 실험을 위하여 모니터링을 하였다.
B. B. B.
B. 생쥐생쥐생쥐생쥐 태아태아태아 섬유모세포태아 섬유모세포 분리섬유모세포섬유모세포 분리분리분리, Mouse Embryo Fibroblast (MEF) , Mouse Embryo Fibroblast (MEF) , Mouse Embryo Fibroblast (MEF) 세포, Mouse Embryo Fibroblast (MEF) 세포세포세포
C57BL/6 정상 생쥐와 TIS21 유전자를 knockout 시킨 생쥐의 15 일된
태아의 내부 기관을 제거한 후, 몸 부분만 D-PBS 에 헹구고, 살균한 가위와 핀셋으로 pipetting 이 가능할 때까지 잘게 자르고 저민다. 저민 조직을 15 ml conical tube 에 옮긴 후, trypsin/EDTA 를 2 ml 처리하여 37 ℃ 에서 10 분 동안 반응시켰다. trypsin/EDTA 의 효과를 없애기 위해서 2 배 양의 10 % FBS 와 0.5 % antibiotics 가 첨가된 DMEM 배지를 넣어주고, 3,000 rpm 으로 5 분간 원심 분리하였다. 상층액을 조심스럽게 따서 100 mm plate 에 분주하고 배지의 총양이 10 ml 정도 되도록 10 % FBS 와 0.5 % antibiotics 가 첨가된 DMEM 배지를 첨가한 후, 5% CO2 가 있는 37 ℃ 배양기에서 배양하였다. 다음 날, 바닥에 붙은 세포를 제외하고 배지에 떠있는 세포를 제거한 후, 다시 새로운 배지로 교환하였다. 세포가 배양 용기에 가득 찼을 때를 passage 0 이라고 정하였다. C. Huh7 C. Huh7C. Huh7
C. Huh7 세포에세포에세포에 TIS21 세포에 TIS21 TIS21 TIS21 complecomplecomplecomplemenmenmenmenttttaryary DNA (aryary DNA ( DNA ( DNA (cDNAcDNAcDNA)cDNA))) transfection transfection transfection transfection
pcDNA3-HA (Invitrogen, SanDiego, CA) vector 에 ligation 된 TIS21 cDNA 를 Huh7 세포에 Lipopectamine (Invitrogen)을 이용하여 transfection 하였고, transfection 된 Huh7 세포를 3 주 동안 975 ㎍/ml Geneticin (Gibco BRL, Bethesda, MD)을 이용하여 selection 하였다. 이후에도 계속 계대배양을 할 때마다 800 ㎍/ml Geneticin 을 이용하여 selection 하면서 실험에 이용하였다.
D DD
D. . . . 세포세포세포세포 수수수수 집계집계집계 (Cell number counting)집계 (Cell number counting) (Cell number counting) (Cell number counting)
세포를 24 well plate 에 well 당 3 x 103으로 분주한 다음, 각 시간대 별로
trypsin 을 처리하여 세포를 떼어낸 후 tryphan blue 로 염색한 후 hemocytometer 를 이용하여 세포 수를 계산하였다.
E. TIS21 adenovirus E. TIS21 adenovirusE. TIS21 adenovirus E. TIS21 adenovirus (Ad) (Ad) (Ad) (Ad)
TIS21 cDNA 를 cytomegalovirus (CMV) enhancer and chicken β-actin promoter 를 가진 replication-defective E1- and E3-adenoviral vectors 에 삽입하였다. TIS21 adenovirus 를 293 사람 신장 상피세포에서 증대시켰고, virus 입자는 0.45 ㎛ 로 여과하여 정제하였다. 대조표준으로 사용하기 위해서 bacterial β-galactosidase (LacZ) adenovirus 도 비슷하게 준비하였다.
F. D F. DF. D
F. Doxoruoxoruoxoruoxorubicinbicinbicinbicin----induced senescenceinduced senescenceinduced senescence induced senescence
Huh7 세포를 6 well 에 분주한 후, 100 multiplicity of infections (m.o.i) TIS21 adenovirus 를 세포에 감염시키고 30 분 간격으로 배양용기를 흔들어서 virus 가 세포에 잘 감염될 수 있도록 하고, 4 시간 후에 배지를 갈아주었다. 50 ng/ml Doxorubicin 을 단독 처리하거나 10 mM N-acetyl-L-cysteine (NAC, Sigma)를 동반 처리하였다.
G GG
G. Senescence associated. Senescence associated. Senescence associated-. Senescence associated---βββ-β---galactosidase (SAgalactosidase (SA-galactosidase (SAgalactosidase (SA---ββββ----gal) assaygal) assaygal) assay gal) assay
HDF 세포를 6 well plate 에 well 당 5 x 104 으로 분주한 후, 다음날
PBS 로 세포를 세척한 후 3% formaldehyde (in phosphate buffered saline(PBS)) 용액으로 상온에서 5 분간 고정하였다. PBS 로 세포를 세척하고 X-gal 염색 용액 (1 mg/ml X-gal (in dimethylformamide), 0.2 M citric acid/sodium phosphate buffer, pH 6.0, 5 mM potassium ferrocyanide, 5 mM potassium ferricyanide, 150 mM sodium chloride, 2 mM magnesium chloride)을 가하여 37 ℃ humidified chamber 에서 10-20 시간 동안 반응시킨 후 SA-β-gal 활성 증가를 광학 현미경으로 관찰하였다. Huh7 세포는 6 well plate 에 well 당 3 x 104
으로 분주한 후, 다음날 H2O2 (200
μM, Sigma-Aldrich, St. Louse, MO)를 한번 또는 반복 처리하거나 adenovirus 를 감염시킨 후, doxorubicin (DOXO, 50 ng/ml, Il-Dong Pharmaceuticals Co, Seoul, Korea)을 한번 처리하고 표기한 시간에 SA-β-gal assay 를 수행하였다. 또한, passage 10 인 MEF 세포를 6 well plate 에 well 당 6 x 104
으로 분주한 후, 다음날 H2O2 를 처리하지 않거나 한번
처리하고 표기한 시간에 SA-β-gal assay 를 수행하였다. H
HH
H. . . 면역형광세포염색. 면역형광세포염색면역형광세포염색면역형광세포염색 (Immunocytochemistry) (Immunocytochemistry) (Immunocytochemistry) (Immunocytochemistry)
HDF 세포를 coverslip 을 깔아 놓은 6 well plate 에 well 당 5 x 104 으로
분주 후, 다음날 coverslip 을 꺼냈다. 그리고 coverslip 을 PBS 로 세척하고 4 % paraformaldehyde (in phosphate buffered saline (PBS)) 용액으로 4 ℃에서 15 분간 고정하였다. Coverslip 에 고정된 세포를 PBS 로 두 번 세척한
후 0.1 % Triton X-100 용액으로 세포를 투과 (permeabilization) 시켰다. 3 % BSA 로 1 시간 동안 blocking 한 후 보고자 하는 단백질에 대한 첫 번째 항체 (anti-actin antibody (Sigma-Aldrich, St. Louse, MO))를 하루 동안 4 ℃에서 반응시켰고, PBST (0.1% Triton X-100 in PBS)로 5 분씩 3 번 세척하였다. 그리고 형광물질이 결합되어 있는 두 번째 항체 (Texas red Donkey anti-rabbit IgG (H+L), Jackson laboratory, West Grove, PA)와 Hoechst33258 (1 μg/ml) (4', 6-diamidino-2-phenylindole, Sigma, St. Louis)로 상온에서 한 시간 동안 반응시킨 후, PBST 로 5 분씩 3 번 세척하였다. 그리고 100% glycerol 로 mounting 하여 형광 현미경 (Carl zeiss, Axioimager M1, AxioVision 4.5 software)으로 관찰하였다.
IIII.... RNA RNA RNA 분리와 RNA분리와분리와분리와 RT RT RT RT----PCRPCRPCR PCR
세포를 60 mm plate 에 분주하고, 다음날 total RNA 를 Guanidinium
Thiocyanate 용액 (GT, 4 M guanidinium thiocyanate, 25 mM sodium citrate, pH 7.0, 0.5 % N-Lauryl sarcosine, 0.1 M 2-Mercaptoethanol (in DEPC-water))을 이용하여 분리하였다. cDNA 를 합성하기 위하여 1 ㎍의 RNA 를 SuperScriptTM Ⅱ Reverse Transcriptase (invitrogen, Carlsbad, CA, USA)와 oligo dT 18mer primer 를 이용하였다. 합성된 cDNA 를 다음의 primers 와 Ex taq polymerase (TAKARA Bio inc., Japan)를 이용하여 증폭하였다. : BTG2 (178 bp) forward primer, 5'-CAAAAGCCGTCCAAGGGC-3', reverse primer, CTTGTGGTTGATGCGAATGC-3', TIS21 (505 bp) forward primer,
5'-CCGAATTCAGGATCCATGAGCCACGGGAAGAGAACC-3', reverse primer, 5'-GGCTCGAGGATCCCTAGCTGGAGACGGCCATCAC-3',
glyceraldehyde-3-phosphate dehydrogenase (GAPDH, 196 bp) forward primer, 5'-CCATGGAGAAGGCTGGGG-3', reverse primer, 5'-CAAAGTTGTCATGGATGACC-3'. BTG2 는 95 ℃ 30 초, 58 ℃ 30 초, 72 ℃30 초로 30 cycles, TIS21 은 94 ℃ 40 초, 56 ℃ 40 초, 72 ℃ 1 분으로 30 cycles, GAPDH 는 95 ℃ 30 초, 58 ℃ 30 초, 72 ℃30 초로 26 cycles 에서 증폭시켰다. 생성물을 1.2 %나 1.5 % agarose gel 로 전기 영동하여 확인하였다. J
JJ
J. Real. Real. Real. Real----Time PCRTime PCRTime PCRTime PCR
GT 용액을 이용하여 분리한 total RNA 1 ㎍을 이용하여 cDNA 를 만들고,
합성된 cDNA 가 polymerase 에 의해서 이중가닥 DNA 가 합성되면 DNA 사이에 SYBR® Green 이 이중가닥 DNA 에 결합하여 형광을 나타내는
원리를 이용한 것으로 이 형광강도를 검출하여 증폭산물의 생성량을 측정할 수 있다. Power SYBR® Green PCR Master Mix (SYBR® Green 1 Dye, AmpliTaq
Gold® DNA Polymerase LD, dNTPs 와 dUTP/dTTP 혼합액 (blend), Passive
Reference 1 과 optimized buffer, Applied Biosystems, Warrington, UK)와 BTG2, GAPDH primer 를 이용하여 ABI PRISM 7000 Sequence Detection System (Applied Biosystems, Warrington, UK)으로 60 ℃에서 30 초 동안 40 cycles 로 수행하였다. : BTG2 forward primer, 5'-GAAAAGCCGTCCAAGGGC-3', reverse primer,
5'-CTTGTGGTTGATGCGAATGC-3', GAPDH forward primer, 5'-TGGGCTACACTGAGCACCAG-3', reverse primer, 5'-GGGTGTCGCTGTTGAAGTCA-3'. 결과는 상대적인 threshold cycle (Narita et al.) 값을 통해서 분석하였다. 즉, 발현량의 차이를 파악하기 쉽도록 control 시료를 “1”로 하고, test 시료의 Ct 값과 control 시료의 Ct 값의 차 (ΔCt )를 구하고, 1 을 ΔCt 로 나눠주어 상대량을 구했다. 각각의 시료를 GAPDH 도 위와 같은 방법으로 상대량을 구한 후 표준화하였다. K K K
K. . . 세포. 세포세포세포 내내내내 활성산소활성산소활성산소활성산소 ( (ROS ( (ROSROSROS))))의의의의 양양양양 측정측정측정측정
세포 내 활성산소의 양을 측정하기 위해서 2', 7'-dichlorofluorescin diacetate (H2DCFDA, Molecular probes, Eugene, OR) 라는 형광 probe 를
사용하였다. H2DCFDA 는 세포 안에서 diacetylation 될 수 있고 세포 안의 radical, 주로 H2O2 와 반응해서 형광 물질인 2’, 7’-dichlorofluorescin (DCF)로 바뀐다. 그러므로 세포 내 ROS 의 양을 측정할 수 있는 지표로 사용하였다. 세포에 adenovirus 를 감염시킨 후 지시된 시간에 ROS 양을 측정하고자 하는 세포에 H2DCFDA (20 µM) 를 넣어주고 37 ℃에서 15 분 동안 반응시켰다. 반응시킨 세포에 trypsin 을 처리하여 배양용기에서 떼어낸 후 원심분리기를 이용하여 세포를 침전시켰다. 침전된 세포를 PBS 에 섞어서 fluorescence activated cell sorter (FACS, Becton Dickinson, San Jose, CA)를 이용하여 DCF 형광 변화를 측정하였다.
L LL
L.... 미토콘드리아미토콘드리아미토콘드리아미토콘드리아 막막막 전위차막 전위차전위차전위차 (mitochondrial membrane potential) (mitochondrial membrane potential) (mitochondrial membrane potential) 측정 (mitochondrial membrane potential) 측정측정측정
세포 내 미토콘드리아 막의 전위차를 측정하기 위해서 전위차에 민감한 방식으로 미토콘드리아에 축적되는 green fluorescent dye JC-1 (Molecular probes, Eugene, OR)을 이용하였다. Huh7 세포를 60 mm dish 에 분주한 후, 12 시간 후 adenovirus 를 감염시켰다. 이틀 후, JC-1 (5 ㎍/ml)을 세포에 넣어서 15 분간 염색하였다. PBS 로 2 회 세척한 후 trypsin 을 처리하여 세포를 60 mm plate 에서 떼어낸 후 원심분리기를 이용하여 세포를 침전시켰다. 침전된 세포를 PBS 에 섞어서 FACS 를 이용하여 JC-1 의 형광 변화를 측정하였다. 이 경우 미토콘드리아 막의 전위 (potential)가 낮으면 초록색을 띄고, 막의 전위 (potential)가 높으면 aggregation 이 생겨서 빨간색을 띈다. 이것은 녹색 (527 nm)에서 빨강 (590 nm)으로 형광이 이동해서 생기는 것이다. 미토콘드리아 막의 전위차를 비교하기 위해서 빨간색을 띄는 세포를 비율적으로 계산하였다. M M M M. . . 미토콘드리아. 미토콘드리아미토콘드리아 염색미토콘드리아 염색염색 염색
세포 내 미토콘드리아 수를 측정하기 위해서 redox-insensitive living dye MitoTracker Red (Molecular probes) 를 이용하였다. Huh7 세포를 60 mm dish 에 분주하고, 12 시간 후 adenovirus 를 감염시켰다. 이틀 후, MitoTracker Red (100 nM)로 30 분 동안 세포를 염색하였다. PBS 로 2 회 세척한 후 trypsin 을 처리하여 세포를 60 mm plate 에서 떼어낸 후 원심분리기를 이용하여 세포를 침전시켰다. 침전된 세포를 PBS 에 섞어서 FACS 를 이용하여 측정하였다. 또한, 형광현미경으로 세포 내 미토콘드리아를 관찰하였다.
N NN
N. . . Western blot analysis. Western blot analysisWestern blot analysis Western blot analysis
Huh7 세포에 H2O2 를 한번 또는 반복 처리한 후 세포들을 수거하여 RIPA
buffer (50 mM Tris, pH 7.4, 150 mM NaCl, 1 % NP-40, 0.5 % deoxycholic acid, 0.1 % SDS)에 단백질 분해효소 저해제를 첨가하여 세포를 용해시켰다. 12,000 rpm 에서 약 10-15 분간 원심분리한 후 상층액을 취하였다. 상층액의 단백질 농도는 단백질 정량 시약 (Bio-Rad, Hercules, CA)으로 정량한 후 100 ℃에서 3 분간 끓여주었다. 준비된 sample 을 SDS-polyacrylamide gel 에서 전기영동한 후 polyvinylidinedifluoride membrane (PVDF, MILLIPORE, Bedford, MA)에 transfer 한 다음 blocking buffer (5% 탈지분유가 포함된 PBST)로 1 시간 동안 상온에서 blocking 하였고, blocking buffer 에 희석한 각 일차 특이 항체를 4℃에서 하루 동안 반응시켰다. 이후 PBST (0.02% Tween-20 이 포함되어 있는 PBS)로 10 분씩 3 회 씻어준 후, HRP (horseradish peroxidase)가 붙어있는 이차항체 (Amersham Bioscience, UK)를 1:5,000 으로 희석하여 상온에서 반응시킨 후 PBST 로 10 분씩 3 회 씻어주고 ECL system (Amersham Bioscience, UK)시약을 처리하여 발광시키고 X-ray film 에 감광시켰다. Actin 은 Sigma 항체를, p44/42 MAP Kinase, p-p44/42 MAPK(Thr202/Tyr204) (E-10)는 Cell Signaling (Cell Signaling Technology, Beberly, MA) 항체를 이용하였다. 또한, MnSOD 는 LabFrontier (LabFrontier, Seoul, Korea) 항체를, HA 는 Santacruz
(SantaCruz
O OO
O. . . . 통계처리통계처리통계처리통계처리
III.
III.
III.
III. 결
결
결
결 과
과
과
과
A. A.A.
A. 노화된노화된노화된 세포노화된 세포세포세포에서에서에서 BTG2에서 BTG2 BTG2 BTG2TIS21TTTIS21IS21IS21의의의의 발현증가발현증가발현증가발현증가
HDF 세포를 계속 계대배양하면서 replicative senescence 세포가 되도록 한 후, replicative senescence 세포가 되었음을 확인하기 위해서 세포가 두 배로 증식하는 시간 (doubling times)이 1, 5, 10 일인 세포를 이용하여 노화표지자로 사용하는 SA-β-gal assay 와 세포의 성장률을 비교하였더니, 세포가 두 배로 증식하는 시간이 길어질수록 SA-β-gal 이 염색된 세포의 수가 증가하였고, 그러한 세포는 성장률도 훨씬 떨어지는 것을 관찰하였다 (Fig. 1AB). 이때 사용한 세포들의 단백질 발현의 차이를 비교하기 위해서 임인경 교수 연구실 (2000) 에서 노화의 표지자로 보고한 바 있는 SA-pErk1/2 를 보았는데, 마찬가지로 세포가 두 배로 증식하는 시간이 길어진 세포에서 Erk1/2 의 인산화 정도가 증가되어 있음을 보았다 (Fig. 1C). 이 세포에서 BTG2 의 발현양을 RT-PCR 과 real-time PCR 로 비교한 결과, 노화된 세포에서 BTG2 의 발현양이 증가함을 관찰하였다 (Fig. 1DEF). 또한, 스트레스를 이용한 조기노화모델을 만들기 위해서 Huh7 세포에 200 μM 의 H2O2 를 한번 또는 반복 처리하고 세포의 크기가 약간 증가하는 것을 관찰하였고, 200 μM 의 H2O2 를 처리하지 않거나 반복 처리한 세포를 이용해서 세포 성장율을 비교하였더니 200 μM 의 H2O2 를 반복 처리한 세포에서는 거의 성장을 하지
않는 것을 관찰하였다 (Fig. 2AB). 이때 SA-β-gal 을 염색하였을 때 H2O2 를
임인경 교수 연구실에서 노화표지자로 보고한 nuclear actin 을 보았는데, SA-β-gal assay 에서와 마찬가지로 H2O2 를 한번 또는 반복 처리한 세포에서
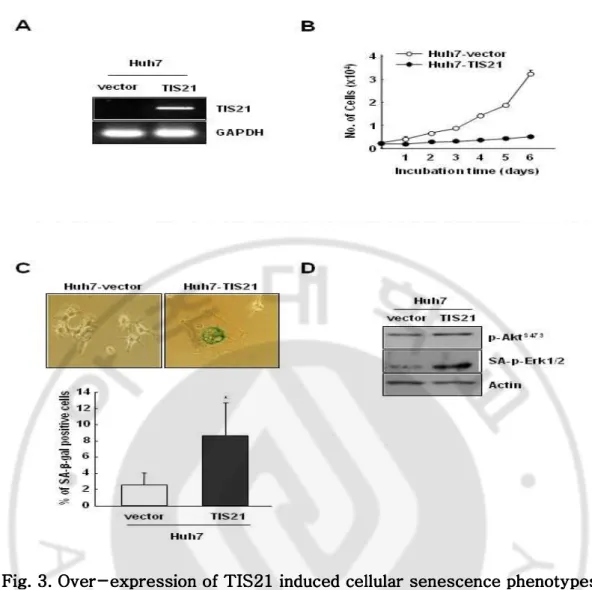
nuclear actin 을 가진 세포의 수가 증가하는 것을 관찰하였다 (Fig. 2CD). 이러한 세포에서 RT-PCR 과 real-time PCR 을 수행한 결과 BTG2 의 발현양을 조기노화현상을 나타내는 세포에서 증가되어 있음을 관찰하였다 (Fig. 2EF). 이러한 두 가지 노화모델을 이용한 실험을 통해서 노화현상과 BTG2TIS21 간의 상관관계가 있음을 시사한다. B. TIS21 B. TIS21B. TIS21 B. TIS21BTG2BTG2BTG2BTG2과발현에과발현에 의한과발현에과발현에 의한의한의한 노화현상유도노화현상유도노화현상유도노화현상유도 TIS21BTG2 에 의해서 노화현상이 유도되는 것인지 알아보기 위해서
TIS21 이 계속적으로 발현되는 Huh7 세포를 만들어 Huh7-vector 세포와 Huh7-TIS21 세포에서 TIS21 의 발현양을 비교하였다(Fig. 3A). 두 가지 세포의 성장율을 비교한 결과, Huh7-vector 세포보다 Huh7-TIS21 세포에서 세포 성장율이 감소되어 있고, SA-β-gal 염색된 세포의 수도 현저하게 증가되어 있는 것을 관찰하였다(Fig. 3BC). 이때, 단백질발현의 차이를 비교하였더니, Huh7-TIS21 세포에서 SA-pErk1/2 의 발현이 증가되어 있는 것을 관찰하였다 (Fig. 3D). 이러한 현상을 다시 한번 확인하기 위해서, TIS21BTG2 유전자를 knockout 시키는 방법을 이용하였다. 먼저, C57BL/6 정상 생쥐와 TIS21 knockout 생쥐의 태아에서 MEF 를 분리하였고, 이때는 passage 0 로 하며 이것을 계대배양 하면 passage 1 이 되는 것으로 passage 수를 계산하여 실험을 진행하였다 (Fig. 4A). passage 3 인 TIS21+/+
MEF 와 TIS21-/- MEF 를 이용하여 TIS21 knockout 되었음을 확인하였고 (Fig. 4B
upper), 세포의 성장율을 비교하였더니 TIS21+/+
MEF 보다 TIS21
-/-MEF 에서 세포 성장율이 훨씬 좋은 것을 관찰하였다 (Fig. 4B lower). 계대배양을 통해서 replicative senescence 가 진행되는 passage 10 인 MEF 를 이용하여 SA-β-gal assay 를 수행한 결과, TIS21+/+
MEF 보다 TIS21 -/-MEF 에서 SA-β-gal 염색된 세포의 수가 감소되어 있음을 관찰하였다 (Fig. 4C). H2O2 를 처리하였을 때도 이러한 현상이 나타나는지 알아보기 위해서
passage 3 인 TIS21+/+
MEF 와 TIS21
MEF 에 50, 100 μM 의 H2O2 를
한번 처리하고 3 일 후에 SA-β-gal assay 를 수행하였더니, passage 10 인 MEF 에서와 마찬가지로 TIS21+/+ MEF 보다 TIS21 MEF 에서 SA-β-gal 염색된 세포의 수가 감소되어 있음을 관찰하였다 (Fig. 4D). 이러한 현상을 통해서 TIS21BTG2 에 의해서 노화현상이 유도되는 것을 알 수가 있다. C. TIS21 C. TIS21C. TIS21 C. TIS21BTG2BTG2 BTG2BTG2과발현에과발현에과발현에과발현에 의한의한의한의한 노화현상유도로노화현상유도로 나타나는노화현상유도로노화현상유도로 나타나는나타나는나타나는 생화학적생화학적생화학적생화학적 변화변화변화변화 세포에 TIS21BTG2 가 어떤 효과를 나타내어 생화학적인 변화를 통해 노화현상이 유도가 되는 것인지 알아보기 위해서 Huh7 세포에 Ad-LacZ 와 Ad-TIS21-HA 를 감염시키고 24, 48 시간 후에 세포 내 활성산소의 양을 측정하였더니 두 세포간의 활성산소양의 차이는 없었다 (Fig. 5A). 임인경 교수 연구실에서 U937 세포에 vector 와 tis21 cDNA 를 transfection 한 후 MMP 를 측정하였을 때 vector 를 transfection 한 세포보다 tis21 cDNA 를 transfection 한 세포에서 MMP 가 감소되어 있는 현상을 보고한 바 있다 (Hong 등, 2005). 또한, 직장암세포에서 MnSOD (Manganese Superoxide Dismutase)에 의해 노화가 유도될 때 활성산소의 양은 차이가 없었지만, MMP 가 감소함으로써
노화가 유도되는 것이라고 보고한 바 있다 (Behrend 등, 2005). 이러한 현상이 본 연구에 사용한 방법에서도 적용되는지 알아보기 위해서 먼저, MnSOD 의 발현양 차이를 비교한 결과, Ad-TIS21-HA 를 감염시킨 세포에서 MnSOD 의 발현양이 현저하게 증가되어 있음을 관찰할 수 있었고, TIS21 MEF 세포에서 MnSOD 의 발현양이 현저하게 감소되어 있는 것을 관찰하였다 (Fig. 5B). Huh7 세포에 adenovirus 를 감염시키고 48 시간 후 JC-1 으로 염색하고 FL-1(green)과 FL-2(red)로 측정하여 MMP 를 측정하였다. FL-2(red) ratio 를 구하였는데, Ad-LacZ 를 감염시킨 세포보다 Ad-TIS21-HA 를 감염시킨 세포에서 FL-2(red) ratio 가 약간 감소한 현상을 관찰하였다 (Fig. 5C). 세포 내 미토콘드리아 수의 차이를 알아보기 위해서 MitoTracker Red 로 염색하여 FACS 로 측정하였고 또한, 형광현미경으로 관찰하였다. 세포 내 미토콘드리아 수의 차이는 나지 않지만, 미토콘드리아 막의 전위차에서 FL-2 (red)가 약간 감소한 것으로 보아 미토콘드리아 막의 전위차가 약간 감소하였다고 볼 수 있을 것 같다 (Fig. 5D). 그렇다면, TIS21BTG2 과발현시킨 후 doxorubicin 을 처리하였을 경우 TIS21BTG2 에 의한 노화현상이 더욱 촉진되는지를 알아보기 위해서 Huh7 세포에 adenovirus 를 이용해 GFP 와 TIS21-HA 를 감염시켰다. 다음날, 50 ng/ml 의 DOXO 를 단독 또는 활성산소 저해제인 10 mM 의 NAC 를 함께 처리하고 2 일 후에 SA-β-gal assay 를 하였더니, Ad-GFP 를 감염시키고 DOXO 를 처리한 세포보다 Ad-TIS21-HA 를 감염시키고 DOXO 를 처리한 세포에서 SA-β-gal 염색된 세포의 수가 증가하였고, Ad-TIS21-HA 를 감염시킨 후 DOXO 와 NAC 를 함께 처리한 세포에서 SA-β-gal 염색된 세포의 수가 Ad-GFP 감염시킨 후 DOXO 를 처리한 세포와
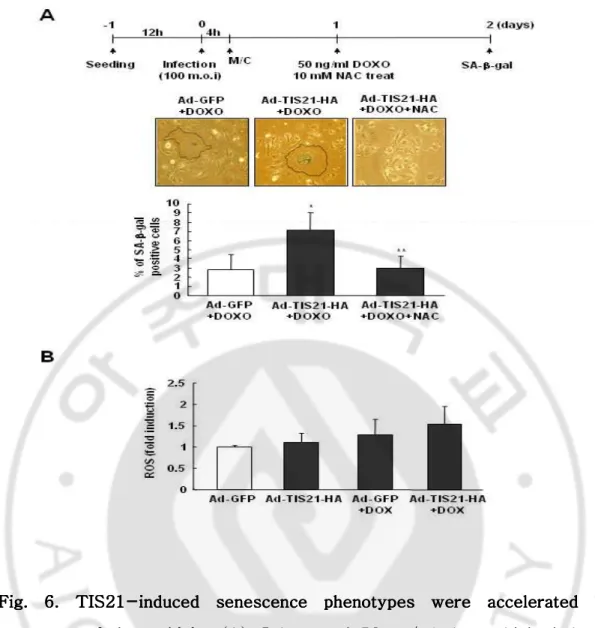
비슷하게 나타났다 (Fig. 6A). SA-β-gal assay 를 수행한 것과 같은 조건으로 각 세포 내 생성된 활성산소의 발현양을 비교하였는데, GFP 보다 HA 를 감염시킨 세포에서, 또한 이때 DOXO 를 처리한 Ad-TIS21-HA 세포에서 세포 내 활성산소의 발현양이 증가되어 있음을 관찰하였다 (Fig. 6B). 이는 TIS21BTG2 가 노화현상을 유도하는데, TIS21BTG2 단독 효과만으로는 큰 차이가 나타나지 않지만, H2O2 나 DOXO 와 같은 DNA 손상물질을 동반 처리하게 되면 노화유도현상은 더욱 촉진됨을 알 수가 있다.
Fig. 1. Expression of BTG2 mRNA was increased in the replicative Fig. 1. Expression of BTG2 mRNA was increased in the replicative Fig. 1. Expression of BTG2 mRNA was increased in the replicative Fig. 1. Expression of BTG2 mRNA was increased in the replicative senescence of HDF cells.
senescence of HDF cells. senescence of HDF cells.
senescence of HDF cells. (A) HDF cells with different doubling times were stained to evaluate senescence-associated-β-galactosidase activities and were observed by phase contrast microscope (x200). Arrows indicate cells with SA-β-gal activity. *p < 0.0005 relative to doubling time (DT) 1d. (B) At the indicated times, cells were harvested by trypsinazation and counted by excluding dead cells with trypan blue staining. Data indicate the average counts and S.D from three independent experiments. (C) Western blot analysis was carried out to detect expression of SA-pErk1/2, Erk1/2 and actin expressions. (D) Expression level of BTG2 mRNA were analyzed via RT-PCR. (E) The bands of (D) indicate densitometry values as a ratio relative to DT 1d values. (F) BTG2 mRNA levels were measured by real-time PCR.
Fig. 2. Expression of BTG2 mRNA was also increased in the H Fig. 2. Expression of BTG2 mRNA was also increased in the HFig. 2. Expression of BTG2 mRNA was also increased in the H
Fig. 2. Expression of BTG2 mRNA was also increased in the H2222OOOO2222 induced induced- induced induced-- -senescence of Huh7 cells.
senescence of Huh7 cells. senescence of Huh7 cells.
senescence of Huh7 cells. (A) Scheme showing of H2O2 induced premature
senescence (upper panel). Huh7 cells were treated with 200 μM H2O2
once a day for 3 days and observed by phase contrast microscope(x100). Morphological changes of Huh7 cells exposed to 200 μM H2O2 (lower
panel). *p < 0.05 ; **p < 0.01, relative to control. M/C indicate media change. (B) Huh7 cells were treated with 200 μM H2O2 once a day for 3 days at
the indicated times, cells were harvested by trypsinization and counted by excluding dead cells with trypan-blue staining. Data indicate the average counts and S.D from three independent experiments. (C) Huh7 cells were treated with 200 μM H2O2 once a day for 3 days and examined for
SA-β-gal activities and were observed by phase contrast microscope (x200). *p < 0.005 relative to control. (D) Huh7 cells were treated with 200 μM H2O2
once a day for 3 days and subjected to immunocytochemistry with anti-actin antibody (x400). Cells with nuclear anti-actin accumulation were counted as the percentage of total cells. *p < 0.01 relative to control. (E) Expression of BTG2 mRNA was analyzed via RT-PCR (upper panel). The level was measured by densitometry values as a ratio relative GAPDH expression (lower panel). (F) Real-time PCR analysis showing BTG2 mRNA level relative to GAPDH expression.
Fig. 3. Ov Fig. 3. OvFig. 3. Ov
Fig. 3. Overerer-er---expression of TIS21 induceexpression of TIS21 induceexpression of TIS21 induceexpression of TIS21 inducedd cellular senescence dd cellular senescence cellular senescence phenotypes cellular senescence phenotypes phenotypes in phenotypes in in in Huh7 cells.
Huh7 cells.Huh7 cells.
Huh7 cells. (A) Huh7 cells were transfected with pcDNA3 vector and wild-type TIS21. Efficiency of the over-expression of pcDNA3-TIS21 was evaluated using RT-PCR with TIS21 specific primers. (B) At the indicated times, cells were harvested by trypsinization and counted by excluding dead cells with trypan blue staining. Data indicate the average counts and S.D from three independent experiments. (C) Cells were examined for SA-β-gal activities and were observed by phase contrast microscope (x100). (D)Western blotting was carried out to detect the p-AktS473
, SA-p-Erk1/2, and actin, as a control, expressions.
Fig. Fig. Fig.
Fig. 4. Expression of TIS21 increased4. Expression of TIS21 increased4. Expression of TIS21 increased4. Expression of TIS21 increased cellular senescence cellular senescence cellular senescence cellular senescence phenotypes phenotypes phenotypes in phenotypes in in in MEF cells.
MEF cells.MEF cells.
MEF cells. (A) MEF cells were prepared with 15-day old embryos obtained from TIS21+/+ and TIS21-/- mice. (B) Expression of TIS21 mRNA were analyzed by RT-PCR (upper panel). At the indicated times, cells were harvested by trypsinization and counted by excluding dead cells with trypan blue staining. Data indicate the average counts and SD from three independent experiments (lower panel). *p < 0.01; **p < 0.001, relative to TIS21+/+. (C) Passage-10 MEF cells were examined for SA-β-gal activities and were observed by phase contrast microscope (x100). *p < 0.005 relative to TIS21+/+. (D) Scheme of H2O2 induced premature
senescence (upper panel). Passage-3 MEF cells were treated with H2O2
for the indicated times and examined for SA-β-gal activities (lower panel). Each bar represents mean ± SD. *p < 0.005 relative to TIS21+/+ control.
Fig. 5. Fig. 5. Fig. 5.
Fig. 5. Generation of reactive oxygen species Generation of reactive oxygen species Generation of reactive oxygen species was not changedGeneration of reactive oxygen species was not changedwas not changedwas not changed,,,, whereaswhereaswhereas whereas mitochondrial membrane potential (MMP) was slightly decreased in Huh7 mitochondrial membrane potential (MMP) was slightly decreased in Huh7 mitochondrial membrane potential (MMP) was slightly decreased in Huh7 mitochondrial membrane potential (MMP) was slightly decreased in Huh7 cells by TIS21 over
cells by TIS21 overcells by TIS21 over
cells by TIS21 over---expression.-expression.expression.expression. (A) Huh7 cells were infected with adenovirus-LacZ and adenovirus-TIS21-HA at 100m.o.i. After indicated times of infection, cellular oxidative activity was measured with the redox-sensitive dye DCF-DA. Labeled cells were analyzed by flow cytometry in the FL-1 channel. There was no difference between the control and test. (B) Western blotting was carried out to detect expressions of MnSOD, HA and actin. (C) After 48h of 100m.o.i infection, MMP was detected by the emission intensity of dual fluorescent potential-sensitive dye JC-1. JC-1 labeled cells were analyzed by flow cytometry and the red (590 nm, FL-2 channel) ratio, which is the function of electrochemical gradient of inner mitochondrial membrane, was calculated. *p < 0.0001 relative to Ad-LacZ. (D) Mitochondrial mass was analyzed by use of the mitochondrial dye MitoTracker Red. Cells were stained with the redox-insensitive living dye MitoTracker Red and analyzed in the FL-2 channel of a flow cytometer (upper panel). Representative photomicrographs of fluorescent images show mitochondria (x100).
Fig. 6. TIS21 Fig. 6. TIS21Fig. 6. TIS21
Fig. 6. TIS21----induced sinduced sinduced senescence phenotypes induced senescence phenotypes were enescence phenotypes enescence phenotypes were were were accelerated accelerated accelerated accelerated by by by by ttttreareareareatment of doxorubicin. tment of doxorubicin. tment of doxorubicin. (A) Scheme of 50 ng/ml doxorubicin induced tment of doxorubicin. premature senescence. Huh7 cells were infected with adenovirus-GFP and adenovirus-TIS21-HA at 100m.o.i (upper panel). After indicated times of DOXO treatment, cells were stained to evaluate SA-β-gal activities (x200). *p < 0.01 relative to GFP+DOXO. **p < 0.005 relative to Ad-TIS21-HA+DOXO. (B) After 48h of 100m.o.i infection and DOXO treatment, cells were incubated for 10 min with DCF-DA, and then, harvested for measuring ROS levels by FACS.
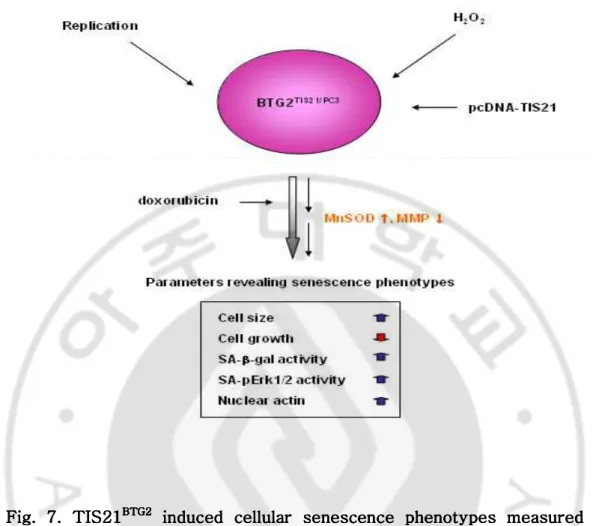
Fig. 7. TIS21 Fig. 7. TIS21 Fig. 7. TIS21
Fig. 7. TIS21BTG2BTG2BTG2BTG2 induced cellular senescence phenotypes measured by induced cellular senescence phenotypes measured by induced cellular senescence phenotypes measured by induced cellular senescence phenotypes measured by
various markers. various markers. various markers.
various markers. When Huh7 cancer cells were stimulated by replication or 200 µM H2O2 with 100 µM doxorubicin, mitochondrial membrane potential
difference was slightly lost with an increased expression of BTG2 and ROS level. The cells were also expressed various marker of cellular senescence, such as increased cell size, reduced cell growth, increase of SA-β-gal, SA-p-Erk1/2 expression, as well as actin accumulation in nuclei. These findings strongly suggest that over-expression of TIS21BTG2 could induces senescence phenotypes in Huh7 cancer cells, which was evidenced by TIS21-/- MEF and adenovirus-TIS21-HA infection assays.
IV.
IV.
IV.
IV. 고
고
고
고 찰
찰
찰
찰
anti-proliferative gene TIS21BTG2/PC3 는 전사 공동 조절자 (transcriptional co-regulator), 신경조직의 분화에 관여하는 인자, 흉선세포가 특정한 분화단계에 맞게 증식하도록 하는데 중요한 매개자와 조혈모세포의 증식을 억제하는 조절자, 종양억제유전자, 세포주기 조절자, 척추동물의 발달양식(patterning) 조절자 등 여러 가지 잠재적인 역할을 한다고 알려져 있다 (Lim, 2006). 본 연구에서는 그 중 종 TIS21BTG2 가 종양억제유전자로 생쥐와 사람에게서 생긴 유방암의 노화현상이 나타나도록 조절한다는 것 (Elmore 등, 2005; Ficazzola 등, 2001; Kawakubo 등, 2004; Lim 등, 1995; Ryo 등, 2005; Struckmann 등, 2004)과 세포주기 조절자로서 세포를 G1/S 주기에 정지시키거나 p53 유전자가 존재하지 않는 U937 세포에서는 G2/M 주기에 세포를 정지시키거나 세포사를 일으키는 기능을 한다는 것 (Guardavaccaro 등, 2000; Hong 등, 2005; Lim 등, 1998; Ryu 등, 2004)을 흥미롭게 생각하게 되어 노화와 TIS21BTG2 가 관련이 있지 않을까 궁금하게 되었다. 계대배양을 통해서 노화된 HDF 세포를 이용해서 노화가 진행되었는지를 세포 성장율, SA-β-gal 활성, Erk1/2 의 인산화 정도를 통해서 관찰하였고, 노화된 HDF 세포 (DT 10d)에서 TIS21BTG2 발현이 증가되어있음을 확인하였다 (Fig. 1). H2O2 를 한번 또는 반복 처리하여 조기노화를 유도한 Huh7 세포에서
통해서 관찰하였고, H2O2 를 한번 처리한 세포보다 반복 처리한 세포에서 노화진행이 더 빠르게 나타났고, TIS21BTG2 발현이 증가되어있음을 알게 되었다 (Fig. 2). 이 두 가지 노화모델을 통해서 노화현상과 TIS21BTG2 와 상관관계가 있음을 알 수 있었고, 이를 증명하기 위해서 TIS21BTG2 발현이 계속적으로 이뤄지는 Huh7 세포와 TIS21 MEF 세포를 이용하였다. 계속적으로 TIS21BTG2 발현이 이뤄지는 Huh7 세포에서 세포성장율이 감소하고 SA-β-gal 활성이 증가되어 있으며, Erk1/2 의 인산화 정도가 대조표준과 비교했을 때 증가되어 있는 것을 관찰하였다 (Fig. 3). 또한, TIS21 MEF 에서 세포성장율이 대조표준과 비교했을 때 두드러지게 좋은 것을 관찰하였고, SA-β-gal 활성이 감소되어 있는 것을 관찰하였다. SA-β-gal 활성은 H2O2 를 한번 처리하고 3 일 정도 지난 TIS21 MEF 에서도 대조표준과 비교했을 때 감소되어 있었다 (Fig. 4). TIS21BTG2 가 과발현되면 노화와 비슷한 현상이 나타나고, TIS21BTG2 가 발현되지 않으면 노화와 비슷한 현상이 적게 나타나는 것을 알 수 있었다. 이로써 TIS21BTG2 에 의해서 노화현상이 유도된다는 것을 추정하게 되었다 (Fig. 7). TIS21BTG2 에 의해서 노화현상이 유도될 때 세포 내에서 어떤 변화가 생기는 것인지 알아보고자 하였다. Hydrogen peroxide (H2O2)는 reactive oxygen
species (ROS)의 일종으로 세포 안으로 쉽게 확산될 수 있으며 superoxide anions 또는 hydroxyl radicals 보다 상대적으로 안정적이다 (Davies, 1999). 세포 내 대사과정에서 생성되는 oxygen free radicals 은 노화인자로서 중요하게 작용한다 (Ames 와 Shigenaga, 1992; Harman, 1956; Harman, 1981; Sohal
와 Allen, 1990). 정상적인 세포노화에서 대사과정 동안에 미토콘드리아에서 생성된 활성산소는 세포 내 거대분자에 손상을 주고 이것은 세포의 기능을 감소시키고 결국 생명체의 노화를 초래한다 (Harman, 2001). 따라서 대사가 급격하게 활성화되거나 기능이 저하되어 미토콘드리아에서의 활성산소 생성이 증가되면 조기노화가 촉진되는 것으로 생각된다. 본 연구에서는 TIS21BTG2 발현 증가로 노화과정이 유도될 때 세포 내 활성산소 양이 증가하는지 알아본 결과, 세포 내 활성산소 양은 대조표준과 차이가 없었다. 직장암세포에서 MnSOD (Manganese Superoxide Dismutase)에 의해 노화가 유도될 때 활성산소의 양은 차이가 없었지만, 미토콘드리아 막 전위차가 감소됨으로서 노화가 유도된 것이라고 보고된 것 (Behrend 등, 2005)과 U937 세포에 vector 와 tis21 cDNA 를 transfection 한 후 MMP 를 측정하였을 때 vector 를 transfection 한 세포보다 tis21 cDNA 를 transfection 한 세포에서 MMP 가 감소되어 있는 현상이 보고된 바 있다 (Hong 등, 2005). Behrend 등, 과 유사하게 본 연구에서 사용한 TIS21BTG2
가 과발현된 Huh7 세포에서도 MMP 가 약간 감소되어 있었고, 미토콘드리아 matrix 단백질로 superoxide radicals (O2·-)를 hydrogen peroxide (H2O2)로 dismutation 을 촉진시키는 역할을 하는 MnSOD
발현양이 TIS21BTG2 를 과발현시킨 Huh7 세포에서 증가되어 있었고, TIS21-/- MEF 세포에서는 거의 발현되지 않았다 (Fig. 5). TIS21BTG2 에 의해서 유도되는 세포노화현상이 TIS21BTG2 단독 효과만으로는 큰 차이가 없지만, doxorubicin 을 처리하게 되면 이러한 노화현상이 더욱 촉진되는 것인지 알아보고자 TIS21BTG2 를 과발현시키고 doxorubicin 을 처리하고, SA-β-gal 활성과 세포 내 활성산소의 양을 측정한
결과, TIS21BTG2 에 의해서 나타나는 현상보다 약간 더 증가하는 것을 관찰할 수 있었다 (Fig. 6). 앞으로는 TIS21BTG2 에 의해서 유도되는 노화현상이 TIS21BTG2 발현을 억제하였을 때 느려지는지 알아보고, 어떤 기전을 통해서 TIS21BTG2 에 의해 노화현상이 유도되는 것인지 계속 연구를 진행되어야 할 것이라고 사료된다.
Ⅴ
Ⅴ
Ⅴ
Ⅴ.... 결
결
결 론
결
론
론
론
본 연구를 통해서 사람의 정상포피세포와 Huh7 간암세포주에서 TIS21BTG2 발현증가와 함께 세포노화가 유도되는 현상을 관찰하였다. 이와 같은 사실은 아데노바이러스 감염으로 TIS21BTG2 계속 발현되는 Huh7 세포와 TIS21 -/-MEF를 이용한 실험을 통해서 TIS21BTG2에 의해서 노화현상이 유도되는 현상을 확인하였다. 이에 대한 분자생화학적 기전으로서는 TIS21BTG2 발현이 증가된 세포에서 MnSOD 발현 증가로 인한 활성산소의 증가가 의심되었으며, doxorubicin 투여에 의한 DNA 손상유발 시에는 이러한 현상이 좀더 확신됨을 알게 되었다. 향후 TIS21BTG2 발현을 저해하였을 때, 노화유도현상이 감소하는지, 또한 어떠한 기전에 의해서 TIS21BTG2 에 의해 노화현상이 유도되는 것인지에 대한 연구는 계속 진행되어야 할 과제로 남아있다.참
참
참
참 고
고
고
고 문
문
문
문 헌
헌
헌
헌
1. Ames BN and Shigenaga MK: Oxidants are a major contributor to aging. Ann N Y Acad Sci. 663: 85-96. 1992
2. Behrend L, Mohr A, Dick T and Zwacka RM: Manganese superoxide dismutase induces p53-dependent senescence in colorectal cancer cells. Mol Cell Biol. 25: 7758-7769. 2005
3. Bradbury A, Possenti R, Shooter EM and Tirone F: Molecular cloning of PC3, a putatively secreted protein whose mRNA is induced by nerve growth factor and depolarization. Proc Natl Acad Sci U S A. 88: 3353-3357. 1991
4. Calegari F, Haubensak W, Haffner C and Huttner WB: Selective lengthening of the cell cycle in the neurogenic subpopulation of neural progenitor cells during mouse brain development. J Neurosci. 25: 6533-6538. 2005
5. Calegari F, Haubensak W, Yang D, Huttner WB and Buchholz F: Tissue-specific RNA interference in postimplantation mouse embryos with endoribonuclease-prepared short interfering RNA. Proc Natl Acad Sci U S A. 99: 14236-14240. 2002
6. Campisi J: Cellular senescence as a tumor-suppressor mechanism. Trends Cell Biol. 11: S27-31. 2001
7. Canzoniere D, Farioli-Vecchioli S, Conti F, Ciotti MT, Tata AM, Augusti-Tocco G, Mattei E, Lakshmana MK, Krizhanovsky V, Reeves SA, Giovannoni R, Castano F, Servadio A, Ben-Arie N and Tirone F: Dual control of neurogenesis by PC3 through cell cycle inhibition and induction of Math1. J Neurosci. 24: 3355-3369. 2004
8. Chang BD, Broude EV, Dokmanovic M, Zhu H, Ruth A, Xuan Y, Kandel ES, Lausch E, Christov K and Roninson IB: A senescence-like phenotype distinguishes tumor cells that undergo terminal proliferation arrest after exposure to anticancer agents. Cancer Res. 59: 3761-3767. 1999
9. Chen Q and Ames BN: Senescence-like growth arrest induced by hydrogen peroxide in human diploid fibroblast F65 cells. Proc Natl Acad Sci U S A. 91: 4130-4134. 1994
10. Chen Z, Trotman LC, Shaffer D, Lin HK, Dotan ZA, Niki M, Koutcher JA, Scher HI, Ludwig T, Gerald W, Cordon-Cardo C and Pandolfi PP: Crucial role of p53-dependent cellular senescence in suppression of Pten-deficient tumorigenesis. Nature. 436: 725-730. 2005
11. Chiu CP and Harley CB: Replicative senescence and cell immortality: the role of telomeres and telomerase. Proc Soc Exp Biol Med. 214: 99-106. 1997
12. Corrente G, Guardavaccaro D and Tirone F: PC3 potentiates NGF-induced differentiation and protects neurons from apoptosis. Neuroreport. 13: 417-422. 2002
13. d'Adda di Fagagna F, Reaper PM, Clay-Farrace L, Fiegler H, Carr P, Von Zglinicki T, Saretzki G, Carter NP and Jackson SP: A DNA damage checkpoint response in telomere-initiated senescence. Nature. 426: 194-198. 2003
14. Davies KJ: The broad spectrum of responses to oxidants in proliferating cells: a new paradigm for oxidative stress. IUBMB Life. 48: 41-47. 1999
15. Di Leonardo A, Linke SP, Clarkin K and Wahl GM: DNA damage triggers a prolonged p53-dependent G1 arrest and long-term induction of Cip1 in normal human fibroblasts. Genes Dev. 8: 2540-2551. 1994