광경화성 단백질 기반 수화젤 이배훈 Page 1 / 18 BRIC View 2017-T35
광경화성 단백질 기반 수화젤
이 배 훈
Wenzhou Institute of Biomaterials and Engineering, Wenzhou Medical University
E-mail: bhlee@wibe.ac.cn 요약문 단백질은 생물체의 기본 구성요소의 하나로서 다양한 생물화학적 반응에 관여한다. 콜라젠은 우리 몸에서 가장 풍부한 단백질 중 하나로써 결합조직의 주성분이다. 콜라젠을 가수분해해서 얻은 젤라틴(gelatin)은 식품으로 그리고 약물을 담은 캡슐로써 널리 활용되고 있으나 체온에서 물에 용해되며 기계적 물성이 약한 단점이 있어 그 응용성이 제한된다. 최근에 공학적으로 개발된 gelatin methacryloly(GelMA)은 광경화성 단백질로써 빛에 의해 기계적 물성을 조절할 수 있는 장점에다 단백질 고유의 성질(세포 부착성(cell adhesion), 생체적합성 (biocompatibility), 생분해성(biodegradability))로 인해 혈관/연골/뼈 재생에 필요한 삼차원 스캐폴드로 활용되고 있으며 삼차원 바이오프린팅의 바이오잉크로 활용되고 있다. 또한 GelMA는 다양한 기능성 물질들(고분자과 나노입자)과 함께 기능성 복합체를 형성할 수 있어 그 응용이 확대되고 있다. 본 보고서에서 미세제조기술의 발전과 더불어 시간적/공간적 물성 제어가 용이한 광경화성 gelatin methacryloyl 소재의 최근 개발 동향을 다루었다.
Key Words: 광경화성(photocrosslinkable), 단백질기반(protein-based), gelatin methacryloyl, 수 화젤(hydrogel), 바이오잉크(bioink)
목 차
1. 서론 2. 본론 2.1 광경화성 gelatin methacryloyl(GelMA) 2.2 광경화성 GelMA 수화젤 제조 2.3 광경화성 GelMA의 응용 BRIC View 동향리포트광경화성 단백질 기반 수화젤 이배훈 Page 2 / 18 2.4 광경화성 GelMA 재료의 전임상과 임상 3. 결론 4. 참고문헌
1. 서론
현재의 세포 배양연구는 2D 세포 배양에서 3D 세포 배양으로 전환되고 있다[1]. 왜냐하면 3D 배양시스템에서 배양된 세포들은 실제 생체 내 세포들의 거동과 유사한 특성들을 보여주고 있기 때문이다. 수화젤(hydrogel)은 3D 배양에서 폭넓게 사용되는 대표적인 스캐폴드이다[2-4]. 수화젤은 많은 양의 수분을 포함한 삼차원 가교 구조체로서 천연의 세포외기질(extracellular matrix, ECM)을 닮은 특성을 가지고 있다. 수화젤은 생체적합성이 좋고 세포 및 생리활성물질을 캡슐화할 수 있는 장점을 가지고 있다. 수화젤은 보통 합성고분자와 천연고분자로 제조될 수 있다. 합성 수화젤은 기계적 물성을 쉽게 조절할 수 있는 반면에, 생물활성물질이 없는 단점이 있다[5]. 한편 천연 고분자로 만든 수화젤은 대체로 좋은 생물활성 특성을 가지고 있으나 기계적 물성이 약한 단점이 있다. 그리하여 많은 응용 분야에서 대표적인 천연고분자이자 세포외기질의 주요 물질인 단백질의 기계적 물성을 개선하기 위해 화학가교제(예, formaldehyde, glutaraldehyde)와 효소물질(예, transglutaminases)을 사용한다[6, 7]. 하지만 이런 화학적 가교방법은 가교제의 독성 문제와 함께 가교을 시간적 그리고 공간적으로 제어하기 어려운 단점이 있다. 그래서 많은 연구자들은 세포와 생물활성물질을 안전하게 포함하면서 수화젤의 기계적 물성을 시간적으로 공간적으로 조절할 수 있는 빛에 의해 가교되는 광경화성 수화젤을 고안하고 시작했다[8, 9]. 여기서 gelatin에 methacrylic anhydride(MAA)로 처리하여 만든 gelatin methacryloyl(gelatin methacrylamide(-NH-CO-C(CH3)=CH2)와 gelatin methacrylate(-O-CO-C(CH3)=CH2))은 gelatin 고유의 생체적합성, 세포 부착성, 생분해성을 그대로 보유하고 있고 또한 빛을 이용하여 가교를 할 수 있어 기계적 물성을 손쉽게광경화성 단백질 기반 수화젤 이배훈 Page 3 / 18 조절할 수 있는 대표적인 광경화성 단백질이다[1, 5, 8, 10-15]. 이러한 gelatin methacryloyl의 생물활성과 조절 가능한 기계적 물성으로 인해 gelatin methacryloyl은 삼차원 세포 배양 및 바이오 연구에서 활용되고 있다. 최근에는 바이오프린팅(bioprinting)과 바이오제조(biofabrication) 기술의 발전으로 좀더 복잡한 구조의 생체 조직과 유사한 스캐폴드를 제조할 수 있는 길이 열리게 되었는데 gelatin methacryloyl이 기본 재료로 널리 활용되고 있다[3, 16-20]. 본 동향에서는 최근에 폭넓게 활용되는 광경화성 단백질 물질인 gelatin methacryloyl의 개발 현황을 다룬다.
2. 본론
2.1 광경화성 gelatin methacryloyl
2.1.1 다양한 용도의 생체 재료 gelatin과 가교 방법
Gelatin은 식품, 약물 전달용 캡슐, 사진용 에멀션 등 다양한 분야에서 사용되고 있다[21]. 조직공학과 재생의약 분야에서도 gelatin은 생체 적합성, 생분해성, 가공성이 우수하며 저렴하여 약물전달용 수화젤을 제조하는데 유용한 재료이다. Gelatin은 미국 식약청에서 음식 가공 및 상처 치료용 재료로 승인된 물질로써 백신을 포함한 다양한 단백질 제형의 안정제로써 그리고 혈장 증량제(예, Gelofundiol, Haemacel, Gelofusine)로써 의료클리닉에 사용된다. Gelatin은 부분적으로 가수분해된 collagen(주로 collagen I) 물질들로 구성된 단백질성 재료로써 산성에서 가수분해된 collagen은 gelatin type A로 분류되고, 염기성에서 가수분해된 collagen은 gelatin type B로 분류된다. Gelatin 용액은 낮은 온도에서 물리적 젤을 형성하며 30℃ 이상에서는 다시 녹는 성질을 가진다. Gelatin의 물리적 젤의 강도를 측정하여 Bloom(50-300g) number로 보통 구분한다. Bloom number가 클수록 젤의 강도가 크다. Collagen과 다르게 gelatin은 가열변성으로 인해 제한된 항원성을 가지고 있다[1, 22]. Gelatin은 세포부착과 관련된 펩타이드(arginine-glycine-aspartic acid, RGD)와 기질금속 단백질 분해효소(matrix metalloproteinase, MMP)에 분해되는 펩타이드를 그대로 갖고 있어 세포의 이주(migration), 증식(proliferation), 분화(differentiation)에 관련된 세포 거동들을 인테그린(integrin)에 의해 중재된 세포 부착과 세포에 의해 분비되는 효소 분해를 통해 조절할 수 있다. 하지만 체온 37도에서 gelatin은 물에 용해되어 스캐폴드로써 구조적 안정성을 제공할 수 없기 때문에 glutaraldehyde 또는 EDC(1-Ethyl-3-(3-dimethylaminopropyl)-carbodiimide)/NHS(N-hydroxysuccinimide)와 같은 화학 가교제를 통해 물리적 특성을 개선한다[23-27]. 하지만 화학가교제의 독성으로 인해 세포캡슐화에는 사용이 제한된다. 천연에서 유래한 transglutaminase, genipin 같은 가교제가 있어 세포독성이 개선된 gelatin 수화젤이 사용되고 있으나 수화젤의 물리적 특성을 시간과 공간적으로 제어하기가 어려운 단점이 있다[28-30]. 최근에 개발된 gelatin methacryloyl(GelMA)은 gelatin을 methacrylic anhydride로 처리하여 합성한 물질로 빛에 의해 광가교를 할 수 있어 광중합을 통한 수화젤 제조가 시간적으로 공간적으로 제어하기에 용이하며 기존의 화학가교제의 의한 가교보다 생체적합하고 세포독성없이 세포캡슐화가 가능하여 바이오프린팅과 바이오미세제조 기술에 폭넓게 응용되고 있다[3, 8, 16, 31]. Gelatin methacryloyl의광경화성 단백질 기반 수화젤 이배훈 Page 4 / 18
수화젤은 광중합을 통해 가교가 가능한데 수화젤의 강도는 gelatin methacryloyl의 치환도(degree of substitution 또는 degree of functionlization 또는 degree of methacryloylation)와 농도, 개시제의 농도, 빛의 조사 시간과 빛의 강도를 통해 조절이 가능하다.
2.1.2 광경화성 gelatin methacryloyl(GelMA) 합성
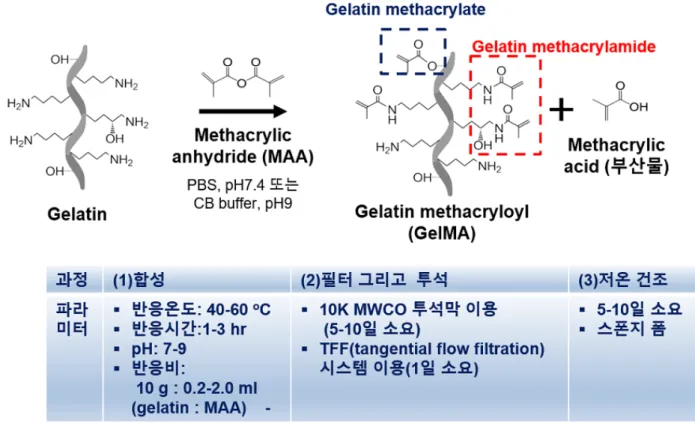
Gelatin에 기능성 그룹을 첨가하는 것은 화학적 가교를 좀더 정밀하게 조절 가능하게 하여 원하는 물성의 수화젤를 제조하는데 용이하다. Gelatin의 가교와 세포 캡슐화를 동시에 성취할 수 있는 광가교는 시간적 또는 공간적 측면에서 제어가 가능하여 복잡한 신체의 유사 조직을 제조하는데 사용될 수 있다. 광가교에서 빛은 파장이 비교적 긴 UV(ultraviolet light)와 가시광선(visiable, VIS)을 사용한다. 지금까지 다양한 광경화성 gelatin이 합성되었다. 예를 들면 gelatin methacryloyl, stryrenated gelatin, acrylamide 치환 gelatin, furfurylamine 치환 gelatin, 그리고 norbornene 치환 gelatin 등이 있다. 하지만 폭넓게 활용되고 있는 광경화성 gelatin 유도체는 gelatin methacryloyl(GelMA)이다[1].GelMA는 gelatin methacrylamide (gelatin의 free amino groups과 methacrylic anhydride가 반응한 물질, gelatin-NH-CO-C(CH3)=CH2)로 불리어지기도 하고 gelatin methacrylate 또는 methacrylated gelatin (gelatin의 hydroxyl groups과 methacrylic anhydride가 반응한 물질, gelatin-O-CO-C(CH3)=CH2)으로 불려지기도 하지만 보통 합성시 gelatin methacrylamide와 gelatin methacrylate를 동시에 포함하고 있기 때문에 gelatin methacryloyl이라 불린다[5]. GelMA는 2000년도에 Schacht 그룹에 의해 광경화성 생체재료로 처음으로 소개되었다[14]. GelMA는 단백질 고유의 생물활성과 조절 가능한 물리적 특성으로 인해 조직공학 용도로 폭넓게 이용되기 시작했다[31-33]. GelMA 수화젤을 제조할 때 첫 번째로 GelMA의 methacryloylation 정도(degree of substitution: DS, 치환도)를 먼저 고려해야 한다. GelMA의 치환도가 높을수록 가교밀도가 증가하고 제조된 수화젤의 강성(stiffness)이 증가한다. GelMA의 치환도는 gelatin과 반응 시약(methacrylic anhydride)의 몰비에 의해 조절된다. 기본적으로 GelMA는 gelatin과 methacrylic anhydride의 반응으로 통해 얻어진다. 반응 완충 용액으로는 PBS(phosphate buffered saline, pH 7.4)와 CB (carbonate bicarbonate buffer solution, pH 9)이 주로 사용되며 CB버퍼에서 높은 치환도를 보였다[10, 12, 13]. GelMA 반응시 methacrylic anhydride를 gelatin 용액(10%)에 서서히 첨가해 주는데 methacrylic anhydride가 물에 안녹고 기름 방울처럼 뭉칠 수 있기 때문에 용액은 500-600 rpm에서 강하게 휘저어야 하며 반응 온도는 gelatin이 용해되는 40-60℃가 적당하며 반응은 1-3시간 소요된다[10, 12]. GelMA 반응 중에 부산물로 methacrylic acid가 생성되기 때문에 반응 용액의 pH를 7-9로 유지하는 것이 정반응(forward reaction)에 유리하다. 반응 후 용액의 pH를 7.4로 다시 맟추거나, 물을 추가적으로 첨가한 후 부산물인 methacrylic acid를 제거하기 위해 반응 용액은 투석막(dialysis membrane MWCO: 10K)을 통해 5-10일간 37-50℃에서 투석한다. TFF(tangential flow filteration) 시스템 사용시 투석 시간을 단축할 수 있다. 투석 후 동결건조하면 다공성 스폰지 형태의 GelMA를 얻을 수 있다(그림 1).
광경화성 단백질 기반 수화젤 이배훈 Page 5 / 18
그림 1. Gelatin methacryloyl의 합성 과정.
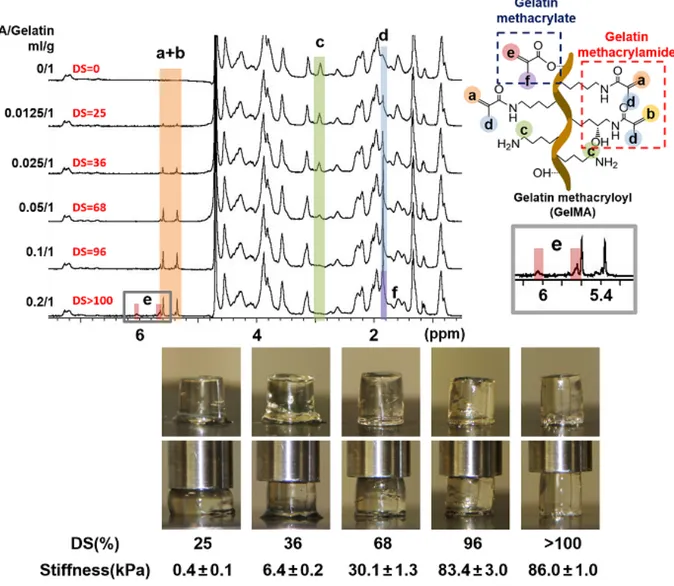
GelMA의 치환도(DS)는 gelatin과 methacrylic anhydride의 반응비를 통해 조절할 수 있다. Gelatin과 methacrylic anhydride의 반응 몰비를 gelatin의 free amino groups를 기준으로 하여 1:0.5-2.2으로 조절할 때 치환도를 25%에서 100%까지 조절할 수 있다. 일반적으로 gelatin의 lysine과 hydroxylysine의 primary amino groups이 methacrylic anhydride와 반응하여 gelatin methacrylamide를 만든다. Methacrylic anhydride를 과량으로 사용할 경우 gelatin은 free amino groups이 먼저 반응을 하여 gelatin methacrylamide를 형성한 후 남은 methacrylic anhydride은 gelatin의 수산화기가 포함된 아미노산들과 반응하여 추가적으로 gelatin methacrylate를 형성한다. GelMA의 치환도(DS)를 계산을 위해 1H-NMR분석(DS=치환된 free amino groups/전체 free amino groups*100)과 fluoraldehyde(excitation/emission=340/455nm) 또는 TNBS(2,4,6-trinitrobenzenesulphonic acid, Habeeb method: gelatin의 남아 있는 free amino groups과 TNBS를 반응하게 한 후 335nm에서 흡광도를 측정하여 평가함.)를 이용한 분광학적 분석을 사용한다[1, 5, 10, 34](그림 2). GelMA의 1H-NMR 테스트에서 GelMA는 D
20에 5-10% 농도로 37℃에서 준비하며 상온 이상에서 측정한다. NMR 스펙트럼에서 5.4 ppm 또는 5.6 ppm(methacrylamide의 peaks)의 chemical shifts를 1.1 ppm 또는 7.2 ppm의 peaks(methyl groups과 phenyl groups으로 GelMA 반응에 참여하지 않는 기준 protons)와 비교 계산할 수 있고, 2.9 ppm(반응 후에도 남아 있는 free amino groups에 해당하는 peak)의 chemical shift를 통해 gelatin methacrylamide의 치환도를 계산할 수 있다. Gelatin methacrylate의 치환도 계산을 위해서는 6.1 ppm(methacrylate의 특성 peaks)에서의 chemical shifts를 이용해야 한다. 최근 Fe(III)-hydroxamic acid-based assay를 이용하여 보다 정확하게 gelatin methacrylate의 치환도를 계산한 보고가 있다[34]. 분광학적 분석시 gelatin과
광경화성 단백질 기반 수화젤 이배훈 Page 6 / 18
glycine 아미노산을 기준 물질로 하여 여러 농도에서 함께 측정하여 계산한다.
그림 2. Gelatin methacryloyl(gelatin methacrylamide와 gelatin methacrylate)의 반응비(MAA/gelatin)에 따른 치환도(DS)와 치환도에 따른 GelMA 수화젤의 경도 변화.
2.2 광경화성 gelatin methacryloyl(GelMA) 수화젤 제조
광경화성 GelMA는 삼차원 세포 배양 용도로 세포를 캡슐화하는데 시간적 공간적 제어가 용이하여 다양한 모양과 다양한 기계적 물성 그리고 생분해성이 조절되는 다이나믹한 세포 캡슐화가 가능하다. 세포를 포함한 GelMA 수화젤은 세포 및 조직 특이적 특성에 맞게 생물학적 그리고 물리화학적 성질들이 갖추어져야 한다. 예를 들어 연골 조직은 부하를 받는 조직임으로 연골조직 유사체를 제조시 연골조직과 같은 생물학적 그리고 물리적 특성을 가지고 있어야 한다. 연골세포(chondrocytes)들을 캡슐화할 경우에는 연골세포들은 수화젤 안에서 퍼지는(spreading) 모폴러지 대신 구형의 모폴러지를 갖고 있어야 연골세포의 기능을 발휘한다. 광경화성 GelMA는 농도와 치환도를 통해 또는 다른 첨가물(hyaluronic acid methacrylate (HA-MA), chondroitin sulfate광경화성 단백질 기반 수화젤 이배훈 Page 7 / 18
methacrylate (CS-MA), poly(hydroxymethylglycolide-co-e-caprolactone)/poly(e-caprolactone) (pHMGCL/PCL))을 이용하여 GelMA 수화젤의 기계적 물성을 조절하여 연골세포의 모폴러지를 조정할 수 있다[35-37]. 이것은 연골세포들을 고농도(10-30%)와 치환도(DS)가 80% 이상인 GelMA 수화젤에 캡슐화할 때 수화젤의 가교 중합도의 증가를 통해 세포들의 퍼지는(spreading) 현상을 방지하고 구형의 모폴러지를 갖도록 돕는다. 보통 60-80% 치환도(DS)를 갖는 광경화성 GelMA 샘플들은 안정한 수화젤을 형성하는데 치환도가 증가할수록 수화젤의 강성은 증가하고 작은 pore size를 갖는다. 그리고 GelMA의 사용 농도는 5-30%이며, 농도가 낮을 수록 부드러운 수화젤(1-5 kPa)을 얻으며 농도가 진할수록 강성도가 높은 딱딱한 수화젤(10-200 kPa)을 얻는다[10, 36]. 즉 광경화성 GelMA의 치환도와 농도가 GelMA 수화젤의 강성을 조절하는 주요 인자들이다. 그리고 광가교에 관여하는 기타 인자들로는 개시제(initiator: I2959, LAP, VA-086, eosin Y/triethanolamine)의 농도, 빛의 강도(intensity), 노출 시간 등이 있다. 광가교에 관여하는 이런 인자들은 세포독성과 연관되어 있다. 개시제의 농도가 증가할수록 빛 조사시 생성되는 활성 라디칼들이 세포독성을 야기할 수 있어 적절한 개시제 농도를 사용해야 한다. 또한 각 개시제별로 물의 용해도가 다르다. 빛의 강도와 노출시간이 증가하면 세포에 손상을 입힐 수 있다. 그리고 UV보다는 가시광선에서 개시되는 개시제들(예, LAP와 eosin Y)이 안전성에서 우수하나 type 2형인 eosin Y는 공동 개시제 triethanolamine이 필요하고 개시효율이 낮은 단점이 있다[38]. 비교적 긴 UV 파장(365 nm)에서 개시되는 I2959 개시제가 폭넓게 사용되고 있으나 물에 대한 용해도가 낮은 단점이 있다. I2959 개시제의 경우, 보통 광경화성 GelMA(5-30%)의 세포 갭슐화를 위한 조건으로는 0.05-0.1% w/v 개시제 농도와 1-20 mW/cm2에서 3-5분 조사하면 세포가 캡슐화된 수화젤을 얻을 수 있으며 좋은 세포 생존도(80% 이상)를 갖는다[12](그림 3). 광경화 조사조건은 수화젤의 두께와 투명 정도에 따라 달라질 수 있어 각 케이스별로 최적화되어야 한다. 그리고 세포를 캡슐화한 GelMA 수화젤은 세포 배양 기간 동안 세포에서 분비되는 효소들(예, MMP(matrix metalloproteinases))에 의해 분해될 수 있어 수화젤의 모폴러지, 기계적 물성, 다공성에 시간에 다른 변화를 줄 수 있으며 in vivo에서 복원되는 조직의 재생 속도에 맞추어 조절될 때 성공적인 재생을 이룰 수 있다. 광경화성 GelMA 수화젤의 특성(물리적 특성, 분해성, 세포 거동)에 영항을 주는 인자들(GelMA 치환도, 농도, 개시제의 농도, 빛의 세기, 노출시간, 세포 농도 등)을 응용 분야에 맞게 선택해야 한다. 광경화성 GelMA 수화젤의 조절 가능한 유용한 특성(물리적 특성, 분해성, 세포 거동)과 손쉽게 다른 첨가물(천연고분자(예, hyaluronic acid, chondroitin sulfate), 합성고분자(예, polycaprolactone, poloxamer), 무기입자들(예, carbon nanotube, graphene oxide, nanosilicate))과 좋은 복합체를 이룰 수 있는 장점으로 인해 GelMA는 다양한 영역의 조직공학(신경조직 재생, 혈관화, 관절, 뼈, 피부, 근육, 심장, 간, 신장)에서 폭넓게 활용되고 있다. 요약하면 세포캡슐화용 광경화성 GelMA 수화젤은 원하는 세포와 조직 응용에 맞게 기계적 물성이 조절될 수 있다. 부드러운 조직으로부터 딱딱한 조직에 이르기 까지 GelMA 수화젤의 물성 조절은 유연하다. GelMA 수화젤은 세포캡슐화시 좋은 생존도를 보여주고 있으며 생체 내에서 생분해된다. GelMA 수화젤의 생분해 정도는 치환도를 통해 어느 정도 조절이 가능하다. GelMA 수화젤은 다른 기능성 첨가물질을 통해 기존의 세포 부착성과 생분해성 외에 추가적인 기능들이 더해질 수 있다. 예를 들면 carbon nanotube를 첨가함을 통해 전기전도성을 부여할 수 있고,
광경화성 단백질 기반 수화젤 이배훈 Page 8 / 18 galactose 도입을 통해 간세포 배양을 촉진할 수 있으며 hydroxyapatite를 추가함을 통해 뼈전도 특성을 개선할 수 있다. GelMA 수화젤의 활용도는 다양한 bioapplications에서 계속 확대되고 있다. 그림 3. 광경화성 GelMA의 세포캡슐화에 이용되는 개시제의 종류와 개시 조건들.
2.3 광경화성 GelMA의 응용
2.3.1 Biofabrication 기술을 활용한 광경화성 GelMA의 응용
광경화성 GelMA는 세포 캡슐화에 많이 이용되고 있는데 과거의 기술로는 디스크 형태의 벌크형 수화젤 형태로 제조되어 세포와 재료와의 상호작용을 연구하는데 사용되어 왔다. 최근에는 미세유체공학(microfluidics)[39], 스테리오리소그라피(stereolithography)[40], 바이오 프린팅 (bioprinting)[3, 18, 41], 미세금형[42]과 같은 미세제조기술이 발달하면서 광경화성 GelMA를 이용한 복잡하면서도 잘 정돈된 구조체를 만들 수 있게 되었다. 미세유체공학을 이용하여 세포를 작은 GelMA 수화젤 미세 방울에 캡슐화를 시킬 수 있게 되었고, 미세유체 방적 기술을 이용하여 세포를 GelMA 섬유에서 삼차원 세포 배양을 할 수 있게 되었다[39](그림 4). 섬유와 수화젤을 복합화한 GelMA 3D 배양 시스템은 스캐폴드의 기계적 강도를 향상시킴과 동시에 세포와 스캐폴드들이 삼차원적으로 상호작용할 수 있도록 제조되었다[8, 31]. 아울러 GelMA 3D 배양 시스템은 세포들이 섬유와 GelMA 수화젤 복합체에서 방향성 있게 배열할 수 있는 구조를 제공해 준다.광경화성 단백질 기반 수화젤 이배훈 Page 9 / 18 광경화성 GelMA는 소프트리소그라피 기술을 통해 마이크로 패턴이 표현된 구조체를 제조하는데 이용되었다[42]. 미세 금형에서 포토 마스크에 기초한 제조기술은 실제 인체 조직과 같은 큰 사이즈의 구조체를 제조하기가 어렵다. 미세 금형과 달리 스테레오리소그라피는 마스크없이 삼차원 구조체를 컴퓨터 프래그래밍에 따라 제조할 수 있다. 스페리오리소그라피에서 빛에 의해 가교되는 gelatin methacryloyl이 유용하게 사용되고 있다[40]. 그림 4. 광경화성 GelMA의 다양한 응용(미세유체, 전기방사, 콜로이드 템플레이팅, 바이오프린팅, 스프레이젤, 나노복합체)[8, 19, 39, 43-45]. 바이오프린팅은 새롭게 대두되는 기술로 복잡한 구조의 조직을 정밀하게 프린팅할 수 있는 장점이 있다. 광경화성 GelMA는 바이오잉크로써 바이오프린팅의 재료로 활용된다[3, 16, 43, 44]. 다양한 형태의 조직 유사체를 광경화성 GelMA을 활용하여 층층이 쌓아 올려 제조할 수 있다. GelMA 바이오 잉크에 poloxamer gel을 희생잉크로 함께 사용했을 경우 프린트된 조직 구조체는 poloxamer가 물에 녹아 사라진 후 생긴 터널(관)을 형성하게 되는데 혈관내피세포들이 자랄 수 있는 공간으로 이용되며 프린트된 구조체에 혈관생성을 촉진하는 기술로 활용된다[45]. 또한 GelMA 바이오잉크의 인쇄적성 향상을 위해 점성 강화제(viscosity enhancer)와 같은 gellan gum, hyaluronic acid와 같은 물질들을 첨가되기도 한다[36, 46]. 또한 폴리카프로락톤(polycarprolactone)은 열가소성 플라스틱으로 3D 프리팅을 통해 잘 정돈된 구조의 틀을 제조하는 데 사용되며 광경화성 GelMA를
광경화성 단백질 기반 수화젤 이배훈 Page 10 / 18
추가적으로 프린팅하는 전략을 쓰기도 하는데 이 전략은 부하가 크게 작용하는 뼈와 연골와 같은 조직 구조물 제조에 쓰인다[47]. 한편 광경화성 GelMA 자체만으로도 온도를 이용하여 프린팅이 가능하다. 광경화성 GelMA는 낮은 온도(4-20℃)에서 물리적 젤을 형성하고 37℃에서는 물처럼 흐르기 때문에 GelMA 용액을 노즐을 통해 방출 후 수집판에 선(filament) 형태로 프린팅을 하게 되는데 수집판(collection plate)의 온도를 20℃ 미만으로 저온을 유지함을 통해 GelMA 바이오 잉크의 접촉과 동시에 고체화됨을 통해 프린트된 구조물의 구조적 안정성(structural stability)을 향상시킬 수 있다[16]. 요약하면 미세제조기술의 발달과 함께 광경화성 GelMA는 공간적으로 제어가 가능한 다양하고 복잡한 구조물을 제조하는데 유용한 도구가 되고 있다.
2.3.2 광경화성 GelMA를 이용한 다양한 조직 공학의 응용
광경화성 GelMA는 생물활성과 기계적 물성에서 탁월한 성능과 조절 능력을 갖고 있다. 여기서 GelMA에 세포특이적 반응과 다양한 신호들을 제공할 수 물질들을 첨가함으로 통해 GelMA 복합재료가 세포/조직특이적으로 특화하여 여러 조직공학에 응용될 수 있다. 예를 들면 광경화성 GelMA는 수용성이기 때문에 무기물질들(예, carbon nanotube(CNT), graphene oxide(GO), nanosilicate, calcium phosphate) 및 기능성 고분자물질들(예, silk, hyaluronan, polycaprolactone, poly(ethylene glycol))과 단순 혼합을 통해 복합체를 형성하여 추가적인 생물학적 신호들과 물리적 신호들을 제공해주는 수화젤 복합체로 활용된다(표 1).심혈관 조직은 전도성 Purkinje fiber 형태의 미세환경을 갖는다. 이런 심혈관 조직을 모방하기 위해 광경화성 GelMA는 carbon nanotube와 graphene oxide 마이크로 입자와 함께 사용하여 전기 전도성을 갖는 섬유형 GelMA 패치로 활용되었다[48-50]. 순수한 GelMA에 비해 carbon nanotube와 graphene oxide를 포함한 전도성 GelMA 복합체 패치에서 쥐의 신생 심장근육세포 들이 동시에 박동하는 속도와 자극 임계값 면에서 좋은 성능을 보여주었다[50-52]. 또한 gold nanorod을 포함한 GelMA 전도성 수화젤도 심장세포의 기능을 회복하는데 좋은 매트릭스임이 보고되었고 심근경색 치료용으로 가능성을 보여주었다[53]. 조직공학에서 제조된 조직 유사 구조체 안에서 산소와 영양분을 원활히 공급하는 것은 조직 구조체 안에서 세포와 조직의 괴사를 방지할 수 있게 된다. 산소와 영양분의 원활한 공급을 위해서는 혈관 구조가 조직 공학 구조체 안에서 잘 발달되어야 한다[54-56]. 조직 구조체 내에서 혈관생성을 위해 혈관내피세포들을 활용하는데, 조직 구조체를 먼저 제조 후 혈관내피세포를 심을 경우 직경이 큰 혈관구조를 만들 수 있고, 혈관내피세포들을 조직 구조체에 캡슐화하여 제조할 경우 조직 구조체 안에서 미세혈관구조가 잘 발달되게 된다. 광경화성 GelMA에 캡슐화된 mesenchymal stem cell(MSC), endothelial colony forming cells(ECFCs), human umbilical vein endothelial cells(HUVECs)은 자율적으로 미세혈관 조직을 형성하였다[57, 58]. 그리고 광경화성 GelMA에 VEGF-mimicking peptide를 결합시키는 것도 혈관세포들의 혈관재생을 촉진한다[54]. GelMA를 fiber 형태로 제조하는 것과 GelMA의 치환도(DS)를 통해서도 혈관재생을 조절할 수 있다[8, 58].
광경화성 단백질 기반 수화젤 이배훈 Page 11 / 18 표 1. 광경화성 GelMA에 함께 사용하며 세포/조직 특이적인 기능을 제공해 주는 물질들과 용도 간 조직 공학에서 GelMA는 간세포를 캡슐화하여 간세포 스페로이드(spheroid)를 제조할 수 있으며 간세포 스페로이드는 30일간의 간세포 기능을 유지하였고 acetaminophen 약물 대사에서도 다른 동물실험과 유사한 결과를 보였다[59]. 간세포는 asialoglycoprotein receptor(ASGPR)를 많이 가지고 있고, galactose가 ASGPR와 바인딩을 하며 간세포의 부착과 기능에 관여하는 것으로 알려졌다. GelMA에 galactose가 포함된 lactobionic acid를 첨가했을 때 galactosylated된 GelMA 수화젤은 간세포의 생존성(90% 이상)을 향상시켰고 21일간 간세포의 유전자 특이 마커들의 발현들을 촉진하였다[60]. 최근에 GelMA를 이용하여 간의 lobule 구조와 유사한 hexagonal 형태의 삼차원 스캐폴드가 polystyrene colloidal templating 기술로 제조되었다. 제조된 GelMA 3D
구분 성분 세포/조직 특이적 반응 용도 참고
문헌 생체
고분자
Hyaluronic acid/chondroitin sulfate methacrylate +GelMA
연골세포, 구형 세포 모 폴러지 연골생성 및 기 계적 강도 보강 [35] Tropoelastin methacrylate/ AMP Tet213 펩다이드 +GelMA 상처치료, 항균작용 상처치료용 스프 레이 접착제 [64] Cartilage-drived matrix(CDM) +GelMA MSC의 연골분화 연골 재생 스캐 폴드 [65] 합성 고분자 Poly(glycerol sebacate)(PGS) /poly(caprolacone)(PCL) microfiber+HMAM-GelMA 심장밸브처럼 연속적인 부하에 견딜수 있는 강 화된 기계적 물성 심장밸브 매트릭 스 [66] 무기물 Carbon nanotube(CNT) +GelMA 전기 전도성/기계적 물 성 향상 심장패치 [50,52,67] Graphene oxide(GO)+GelMA Methacrylated graphene oxide(GO)+GelMA 전기 전도성/기계적 물 성 향상 심장조직공학 [48,49,68] Gold nanoparticles+GelMA 줄기세포의 골분화 뼈조직공학 [53] Hydroxyapatite+GelMA 미네랄 생성 임플란트/뼈조직 공학 [61,62,69,70] Nanosilicates+GelMA 골생성/미네랄생성 뼈조직공학 [63] Polyacrylamide (PAAm), Laponite nanoclay,+GelMA 혈액적합성, 생체적합성 생체적합GelMA 가교제 [71]
광경화성 단백질 기반 수화젤 이배훈 Page 12 / 18
ICC(inverted colloidal crystal) 수화젤은 균일한 porosity를 가지고 있고 핸들링하기 쉬우며 간세포들이 삼차원으로 연결되어 성장하였다. 알부민 생산분비, 간세포 효소(CYP3A4) 활동 영역에서 GelMA 3D ICC 스캐폴드는 2D GelMA 수화젤보다 더 좋은 기능성을 보였다[19].
뼈는 유무기 복합체로 주로 collagen I과 무기물(calcium phosphate, 주로 hydroxyapatite)로 구성된다. 뼈의 강도는 hydroxyapatite로 인해 기인하며 뼈의 점탄성과 강인함은 collagen 섬유로 기인한다. 뼈조직 공학에서 광경화성 GelMA는 뼈의 구성요소(세포, 단백질, 무기물)와 유사하게 조골 세포와 인산칼슘(calcium phosphate; hydroxyapatite)와 함께 사용하여 뼈 유사체로써 활용되고 있다[61, 62]. 그리고 nanosilicate와 GelMA의 복합체는 human mesenchymal stem cells의 증식과 이주를 촉진했으며, 성장인자(BMP-2)가 없어도 줄기세포들을 뼈분화로 유도할 수 있는 능력을 보여주었고, 동물 실험결과에서 좋은 생체 적합성을 나타내었다[63]. 조직 유사체의 건축에서 중요한 것은 조직 유사체의 크기, 생물학적 기능성, 구조적 안정성이다[1]. 조직 유사체 구조물의 크기가 증가할수록 산소와 영양분의 전달이 효과적으로 이루어지는 혈관시스템이 잘 갖추어져야 하며 구조적으로 안정한 형태를 유지하도록 구조물의 기계적 물성도 개선되어야 한다. 기존 연구에서는 광경화성 GelMA를 이용하여 마이크로 사이즈의 조직 유사체를 제조한 반면 임상에 사용할 수 있는 크기의 조직 유사 구조물을 제조한 보고는 거의 없다. 최근의 3D bioprinting 기술들은 임상에 사용할 수 있는 크기의 gelMA 구조물을 제조하는데 크게 기여할 수 있다. 또한 광경화성 GelMA로 제작된 조직 유사 구조물들이 임상에 사용되기 위해서는 GelMA 구조물 안에서 일어나는 장기간의 세포의 거동, 매트릭스의 리모델링, 조직의 성숙과 관련된 연구 정보들이 축적되어야 한다.
2.4 광경화성 GelMA 재료의 전임상과 임상에의 응용
광경화성 GelMA는 전임상 연구결과에서 조직 접착제(adhesives)와 실란트(sealants)로써 기존의 상품화된 피브린(fibrin)과 PEG 기반 재료와 비교하여 대등하거나 우수한 첩착 성능과 상처치료 효과를 보였다[8, 31, 64, 72]. 또한 GelMA는 In vivo에서 생분해됨과 동시에 새로운 조직으로 대체되는 것이 확인되었고, GelMA의 분해속도는 어느 정도 한도 내에서 새로운 조직의 리모델링 속도에 맞추어 조절될 수 있었다[58]. 예를 들어 GelMA의 치환도는 GelMA의 기계적 물성을 개선할 뿐만 아니라 생체에서 요구되는 분해 기간을 조절할 수 있는 요소이다[73]. 임상에의 응용을 위해서 GelMA 재료는 몇 가지 요구사항을 만족해야만 한다. 광경화성 GelMA은 methacryloyl의 광가교로 수화젤을 형성하는데 분해시 작은 조각의 methacrylate/methacrylamide를 포함한 분자들이 떨어져 나가게 된다. Methacrylate/methacrylamide를 포함한 작은 분자의 분해산물들이 어떻게 대사과정을 거치는지 면밀히 규명되어야 한다. GelMA type B는 대체적으로 좋은 생체 적합성을 보여주는 대신 type A에서 염증반응이 관찰되었는데 이것은 type A에서 잔류한 내독소물질(endotoxin)로 기인한 것으로 사려된다[74]. 그리고 GelMA 내 남아있는 내독소물질은 세포 거동에 영향을 미칠 수 있어 GelMA에 존재하는 내독소 물질의 영향은 철저하게 설명되어야 한다. 한편 대부분의 단백질 관련 제품에서 발견될 수 있는 제품간 품질 변동성(batch-to-batch variability)에 대해 GelMA 제품에서도 조사되어야 한다. 아울러 GelMA 단백질 유도체는 소 또는
광경화성 단백질 기반 수화젤 이배훈 Page 13 / 18
돼지의 조직으로부터 유래되었기 때문에 동물로부터 옮겨질 수 있는 질병(예, bovine spongiform encephalopathy)에 대해 철저하게 조사되어야 한다. 현재 gelatin은 임상에 널리 사용되고 있어 광경화성 GelMA가 임상에 적용되기까지 큰 무리가 없을 것으로 예상된다. 그리고 현재 광경화성 GelMA와 개시제 Irgacure2959은 폭넓게 사용되는 플랫폼으로 장파장 UV(365nm)에서 수화젤을 형성하는데 UV 대신에 380nm 이상의 가시광선에서 개시되는 저렴하고 효율이 높은 개시제의 개발이 GelMA의 임상으로의 길을 단축시킬 것이다[38].
3. 결론
Gelatin methacryloyl(GelMA)은 매우 유용한 광경화성 단백질 생체 재료이다. GelMA는 gelatin 고유의 세포 부착성, 생분해성, 생체적합성을 그대로 유지하고 있으며, 동시에 methacryloylation으로 인해 광경화를 시킬 수 있어 GelMA 수화젤의 기계적 물성을 개선 및 조절할 수 있다. 또한 GelMA는 다양한 물질들(생체고분자, 합성고분자, 나노입자)과 복합체를 형성할 수 있어 다양한 기능(전기전도성, 기계적 물성, 생체특이적 신호)을 추가할 수 있다. 광경화성 gelatin methacryloyl은 시간적/공간적으로 제어가 용이한 삼차원 구조체의 재료로써 마이크로 유체, 바이오프린팅, 3D 세포 배양에 폭넓게 사용되고 있다. Gelatin methacryloyl로 만든 삼차원 구조체는 현재까지는 실험실에서 연구용/전임상용으로 활용되고 있는 수준이다. 앞으로 임상에 적용되기 위해서는 GelMA의 분해산물(올리고머 methacrloyl 분해물질)의 안전성이 확보되어야 하며, 임상에 적용할 수 있는 크기 규모의 scale-up과 균일한 다공성과 삼차원적으로 서로 연결된 특성을 가진 재현성이 있는 삼차원 구조체 제조 기술의 발전이 있어야 한다. 나아가 목표로 하는 조직 재생에 맞게 조직 특이적인 생물학적 기능을 제공할 수 있어야 한다. 최근 gelatin methacryloyl과 미세콜로이드 템플레이팅 기술을 이용하여 균일한 다공성과 삼차원적으로 서로 연결된 재현성 있는 세포 구조물을 제조할 수 있게 되었다[19]. 또한 템플레이팅 기술로 제조된 잘 정돈된 나노 공극을 갖는 GelMA inverse opal 스캐폴드에 glucose oxidase와 catalase로 채워진 glutaraldehyde로 가교된 albumin 수화젤을 첨가했을 때 self-healing 되는 structural color 수화젤이 제조 되었는데 다양한 분야(광학과 생물의약공학)에 응용 잠재력을 보여주었다[75]. 앞으로 GelMA는 3D printing/biofabrication 기술을 통한 복잡한 구조의 설계 및 앞으로 개발될 특이적 생물학적 기능을 갖는 다른 광경화성 단백질 생체재료와의 혼합을 통해 다양한 조직의 재생에 성공적으로 적용될 것을 기대하게 된다.
4. 참고 문헌
[1] B.J. Klotz, D. Gawlitta, A.J. Rosenberg, J. Malda, F.P. Melchels, Gelatin-Methacryloyl Hydrogels: Towards Biofabrication-Based Tissue Repair, Trends Biotechnol 34(5) (2016) 394-407.
[2] H. Stratesteffen, M.J. Kopf, F. Kreimendahl, A. Blaeser, S. Jockenhoevel, H. Fischer, GelMA-collagen blends enable drop-on-demand 3D printablility and promote angiogenesis, Biofabrication9(4) (2017) 045002.
광경화성 단백질 기반 수화젤 이배훈 Page 14 / 18 scaffolds triggers mineral deposition by primary human osteoblasts, Biofabrication 9(1) (2017) 015009.
[4] M. Costantini, S. Testa, E. Fornetti, A. Barbetta, M. Trombetta, S.M. Cannata, C. Gargioli, A. Rainer, Engineering Muscle Networks in 3D Gelatin Methacryloyl Hydrogels: Influence of Mechanical Stiffness and Geometrical Confinement, Front Bioeng Biotechnol 5 (2017) 22.
[5] K. Yue, G. Trujillo-de Santiago, M.M. Alvarez, A. Tamayol, N. Annabi, A. Khademhosseini, Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels, Biomaterials 73 (2015) 254-71.
[6] X. Wu, Y. Liu, A. Liu, W. Wang, Improved thermal-stability and mechanical properties of type I collagen by crosslinking with casein, keratin and soy protein isolate using transglutaminase, Int J Biol Macromol 98 (2017) 292-301.
[7] B. Zhu, W. Li, N. Chi, R.V. Lewis, J. Osamor, R. Wang, Optimization of Glutaraldehyde Vapor Treatment for Electrospun Collagen/Silk Tissue Engineering Scaffolds, ACS Omega 2(6) (2017) 2439-2450.
[8] X. Sun, Q. Lang, H. Zhang, L. Cheng, Y. Zhang, G. Pan, X. Zhao, H. Yang, Y. Zhang, H.A. Santos, W. Cui, Electrospun Photocrosslinkable Hydrogel Fibrous Scaffolds for Rapid In Vivo Vascularized Skin Flap Regeneration, Advanced Functional Materials 27(2) (2017) 1604617.
[9] M. Bartnikowski, N.J. Bartnikowski, M.A. Woodruff, K. Schrobback, T.J. Klein, Protective effects of reactive functional groups on chondrocytes in photocrosslinkable hydrogel systems, Acta Biomater 27 (2015) 66-76. [10] H. Shirahama, B.H. Lee, L.P. Tan, N.J. Cho, Precise Tuning of Facile One-Pot Gelatin Methacryloyl (GelMA) Synthesis, Sci Rep 6 (2016) 31036.
[11] D. Loessner, C. Meinert, E. Kaemmerer, L.C. Martine, K. Yue, P.A. Levett, T.J. Klein, F.P. Melchels, A. Khademhosseini, D.W. Hutmacher, Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms, Nat Protoc 11(4) (2016) 727-46.
[12] B.H. Lee, N. Lum, L.Y. Seow, P.Q. Lim, L.P. Tan, Synthesis and Characterization of Types A and B Gelatin Methacryloyl for Bioink Applications, Materials 9(10) (2016) 797.
[13] B.H. Lee, H. Shirahama, N.-J. Cho, L.P. Tan, Efficient and controllable synthesis of highly substituted gelatin methacrylamide for mechanically stiff hydrogels, RSC Adv. 5(128) (2015) 106094-106097.
[14] A.I. Van Den Bulcke, B. Bogdanov, N. De Rooze, E.H. Schacht, M. Cornelissen, H. Berghmans, Structural and rheological properties of methacrylamide modified gelatin hydrogels, Biomacromolecules 1(1) (2000) 31-8. [15] C. Puckert, E. Tomaskovic-Crook, S. Gambhir, G.G. Wallace, J.M. Crook, M.J. Higgins, Electro-mechano responsive properties of gelatin methacrylate (GelMA) hydrogel on conducting polymer electrodes quantified using atomic force microscopy, Soft Matter 13(27) (2017) 4761-4772.
[16] W. Liu, M.A. Heinrich, Y. Zhou, A. Akpek, N. Hu, X. Liu, X. Guan, Z. Zhong, X. Jin, A. Khademhosseini, Y.S. Zhang, Extrusion Bioprinting of Shear-Thinning Gelatin Methacryloyl Bioinks, Adv Healthc Mater 6(12) (2017). [17] S. Knowlton, B. Yenilmez, S. Anand, S. Tasoglu, Photocrosslinking-based bioprinting: Examining crosslinking schemes, Bioprinting 5 (2017) 10-18.
[18] Z. Wei, B.T. Harris, L.G. Zhang, Gelatin methacrylamide hydrogel with graphene nanoplatelets for neural cell-laden 3D bioprinting, Conf Proc IEEE Eng Med Biol Soc 2016 (2016) 4185-4188.
[19] B.H. Lee, H. Shirahama, M.H. Kim, J.H. Lee, N.-J. Cho, L.P. Tan, Colloidal templating of highly ordered gelatin methacryloyl-based hydrogel platforms for three-dimensional tissue analogues, NPG Asia Materials 9(7) (2017) e412.
[20] P. Im, D.H. Ji, M.K. Kim, J. Kim, Fabrication of cell-benign inverse opal hydrogels for three-dimensional cell culture, J Colloid Interface Sci 494 (2017) 389-396.
광경화성 단백질 기반 수화젤 이배훈 Page 15 / 18 [21] V.B. Djagny, Z. Wang, S. Xu, Gelatin: a valuable protein for food and pharmaceutical industries: review, Crit Rev Food Sci Nutr 41(6) (2001) 481-92.
[22] T. Ozaki, N. Nishimura, T. Muto, K. Sugata, S. Kawabe, K. Goto, K. Koyama, H. Fujita, Y. Takahashi, M. Akiyama, Safety and immunogenicity of gelatin-free varicella vaccine in epidemiological and serological studies in Japan, Vaccine 23(10) (2005) 1205-8.
[23] J.Y. Lai, Corneal stromal cell growth on gelatin/chondroitin sulfate scaffolds modified at different NHS/EDC molar ratios, Int J Mol Sci 14(1) (2013) 2036-55.
[24] C. Park, C.L. Vo, T. Kang, E. Oh, B.J. Lee, New method and characterization of self-assembled gelatin-oleic nanoparticles using a desolvation method via carbodiimide/N-hydroxysuccinimide (EDC/NHS) reaction, Eur J Pharm Biopharm 89 (2015) 365-73.
[25] T. Furuike, T. Chaochai, T. Okubo, T. Mori, H. Tamura, Fabrication of nonwoven fabrics consisting of gelatin nanofibers cross-linked by glutaraldehyde or N-acetyl-d-glucosamine by aqueous method, Int J Biol Macromol 93(Pt B) (2016) 1530-1538.
[26] T. Yu, W. Wang, S. Nassiri, T. Kwan, C. Dang, W. Liu, K.L. Spiller, Temporal and spatial distribution of macrophage phenotype markers in the foreign body response to glutaraldehyde-crosslinked gelatin hydrogels, J Biomater Sci Polym Ed 27(8) (2016) 721-42.
[27] A. Bigi, G. Cojazzi, S. Panzavolta, K. Rubini, N. Roveri, Mechanical and thermal properties of gelatin films at different degrees of glutaraldehyde crosslinking, Biomaterials 22(8) (2001) 763-8.
[28] F. Montemurro, C. De Maria, G. Orsi, L. Ghezzi, M.R. Tine, G. Vozzi, Genipin diffusion and reaction into a gelatin matrix for tissue engineering applications, J Biomed Mater Res B Appl Biomater 105(3) (2017) 473-480. [29] S. Focaroli, G. Teti, V. Salvatore, S. Durante, M.M. Belmonte, R. Giardino, A. Mazzotti, A. Bigi, M. Falconi, Chondrogenic differentiation of human adipose mesenchimal stem cells: influence of a biomimetic gelatin genipin crosslinked porous scaffold, Microsc Res Tech 77(11) (2014) 928-34.
[30] X. Xie, J.K. Tian, F.Q. Lv, R. Wu, W.B. Tang, Y.K. Luo, Y.Q. Huang, J. Tang, A novel hemostatic sealant composed of gelatin, transglutaminase and thrombin effectively controls liver trauma-induced bleeding in dogs, Acta Pharmacol Sin 34(7) (2013) 983-8.
[31] X. Zhao, X. Sun, L. Yildirimer, Q. Lang, Z.Y. Lin, R. Zheng, Y. Zhang, W. Cui, N. Annabi, A. Khademhosseini, Cell infiltrative hydrogel fibrous scaffolds for accelerated wound healing, Acta Biomater 49 (2017) 66-77.
[32] X. Zhou, M. Nowicki, H. Cui, W. Zhu, X. Fang, S. Miao, S.-J. Lee, M. Keidar, L.G. Zhang, 3D bioprinted graphene oxide-incorporated matrix for promoting chondrogenic differentiation of human bone marrow mesenchymal stem cells, Carbon 116 (2017) 615-624.
[33] X. Zhang, J. Li, P. Ye, G. Gao, K. Hubbell, X. Cui, Coculture of mesenchymal stem cells and endothelial cells enhances host tissue integration and epidermis maturation through AKT activation in gelatin methacryloyl hydrogel-based skin model, Acta Biomater 59 (2017) 317-326.
[34] K. Yue, X. Li, K. Schrobback, A. Sheikhi, N. Annabi, J. Leijten, W. Zhang, Y.S. Zhang, D.W. Hutmacher, T.J. Klein, A. Khademhosseini, Structural analysis of photocrosslinkable methacryloyl-modified protein derivatives, Biomaterials 139 (2017) 163-171.
[35] P.A. Levett, F.P. Melchels, K. Schrobback, D.W. Hutmacher, J. Malda, T.J. Klein, A biomimetic extracellular matrix for cartilage tissue engineering centered on photocurable gelatin, hyaluronic acid and chondroitin sulfate, Acta Biomater 10(1) (2014) 214-23.
광경화성 단백질 기반 수화젤 이배훈 Page 16 / 18 Malda, Gelatin-methacrylamide hydrogels as potential biomaterials for fabrication of tissue-engineered cartilage constructs, Macromol Biosci 13(5) (2013) 551-61.
[37] K.W. Boere, J. Visser, H. Seyednejad, S. Rahimian, D. Gawlitta, M.J. van Steenbergen, W.J. Dhert, W.E. Hennink, T. Vermonden, J. Malda, Covalent attachment of a three-dimensionally printed thermoplast to a gelatin hydrogel for mechanically enhanced cartilage constructs, Acta Biomater 10(6) (2014) 2602-11.
[38] I. Noshadi, S. Hong, K.E. Sullivan, E. Shirzaei Sani, R. Portillo-Lara, A. Tamayol, S.R. Shin, A.E. Gao, W.L. Stoppel, L.D. Black Iii, A. Khademhosseini, N. Annabi, In vitro and in vivo analysis of visible light crosslinkable gelatin methacryloyl (GelMA) hydrogels, Biomater Sci (2017).
[39] X. Zhao, S. Liu, L. Yildirimer, H. Zhao, R. Ding, H. Wang, W. Cui, D. Weitz, Injectable Stem Cell-Laden Photocrosslinkable Microspheres Fabricated Using Microfluidics for Rapid Generation of Osteogenic Tissue Constructs, Advanced Functional Materials 26(17) (2016) 2809-2819.
[40] Z. Wang, R. Abdulla, B. Parker, R. Samanipour, S. Ghosh, K. Kim, A simple and high-resolution stereolithography-based 3D bioprinting system using visible light crosslinkable bioinks, Biofabrication 7(4) (2015) 045009.
[41] C. McBeth, J. Lauer, M. Ottersbach, J. Campbell, A. Sharon, A. Sauer-Budge, 3D bioprinting of GelMA scaffolds triggers mineral deposition by primary human osteoblasts, Biofabrication 9(1) (2016) 015009.
[42] J.W. Nichol, S.T. Koshy, H. Bae, C.M. Hwang, S. Yamanlar, A. Khademhosseini, Cell-laden microengineered gelatin methacrylate hydrogels, Biomaterials 31(21) (2010) 5536-44.
[43] Z. Wang, Z. Tian, F. Menard, K. Kim, Comparative study of gelatin methacrylate hydrogels from different sources for biofabrication applications, Biofabrication 9 (4) (2017) 044101.
[44] M. Rimann, M. Müller, U. Graf-Hausner, Bioresorbable polymers for bioprinting applications, Bioresorbable Polymers for Biomedical Applications From Fundamentals to Translational Medicine (2017) 331-362.
[45] D.B. Kolesky, R.L. Truby, A.S. Gladman, T.A. Busbee, K.A. Homan, J.A. Lewis, 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs, Adv Mater 26(19) (2014) 3124-30.
[46] V.H. Mouser, F.P. Melchels, J. Visser, W.J. Dhert, D. Gawlitta, J. Malda, Yield stress determines bioprintability of hydrogels based on gelatin-methacryloyl and gellan gum for cartilage bioprinting, Biofabrication 8(3) (2016) 035003.
[47] J. Visser, B. Peters, T.J. Burger, J. Boomstra, W.J. Dhert, F.P. Melchels, J. Malda, Biofabrication of multi-material anatomically shaped tissue constructs, Biofabrication 5(3) (2013) 035007.
[48] S.R. Shin, C. Zihlmann, M. Akbari, P. Assawes, L. Cheung, K. Zhang, V. Manoharan, Y.S. Zhang, M. Yuksekkaya, K.T. Wan, M. Nikkhah, M.R. Dokmeci, X.S. Tang, A. Khademhosseini, Reduced Graphene Oxide-GelMA Hybrid Hydrogels as Scaffolds for Cardiac Tissue Engineering, Small 12(27) (2016) 3677-89.
[49] S.R. Shin, B. Aghaei-Ghareh-Bolagh, T.T. Dang, S.N. Topkaya, X. Gao, S.Y. Yang, S.M. Jung, J.H. Oh, M.R. Dokmeci, X.S. Tang, A. Khademhosseini, Cell-laden microengineered and mechanically tunable hybrid hydrogels of gelatin and graphene oxide, Adv Mater 25(44) (2013) 6385-91.
[50] S.R. Shin, S.M. Jung, M. Zalabany, K. Kim, P. Zorlutuna, S.B. Kim, M. Nikkhah, M. Khabiry, M. Azize, J. Kong, K.T. Wan, T. Palacios, M.R. Dokmeci, H. Bae, X.S. Tang, A. Khademhosseini, Carbon-nanotube-embedded hydrogel sheets for engineering cardiac constructs and bioactuators, ACS Nano 7(3) (2013) 2369-80.
[51] H. Sun, J. Tang, Y. Mou, J. Zhou, L. Qu, K. Duval, Z. Huang, N. Lin, R. Dai, C. Liang, Z. Chen, L. Tang, F. Tian, Carbon nanotube-composite hydrogels promote intercalated disc assembly in engineered cardiac tissues through beta1-integrin mediated FAK and RhoA pathway, Acta Biomater 48 (2017) 88-99.
광경화성 단백질 기반 수화젤 이배훈 Page 17 / 18 [52] S.R. Shin, H. Bae, J.M. Cha, J.Y. Mun, Y.C. Chen, H. Tekin, H. Shin, S. Farshchi, M.R. Dokmeci, S. Tang, A. Khademhosseini, Carbon nanotube reinforced hybrid microgels as scaffold materials for cell encapsulation, ACS Nano 6(1) (2012) 362-72.
[53] A. Navaei, H. Saini, W. Christenson, R.T. Sullivan, R. Ros, M. Nikkhah, Gold nanorod-incorporated gelatin-based conductive hydrogels for engineering cardiac tissue constructs, Acta Biomater 41 (2016) 133-46.
[54] S. Prakash Parthiban, D. Rana, E. Jabbari, N. Benkirane-Jessel, M. Ramalingam, Covalently immobilized VEGF-mimicking peptide with gelatin methacrylate enhances microvascularization of endothelial cells, Acta Biomater 51 (2017) 330-340.
[55] X. Sun, W. Altalhi, S.S. Nunes, Vascularization strategies of engineered tissues and their application in cardiac regeneration, Adv Drug Deliv Rev 96 (2016) 183-94.
[56] L.E. Bertassoni, M. Cecconi, V. Manoharan, M. Nikkhah, J. Hjortnaes, A.L. Cristino, G. Barabaschi, D. Demarchi, M.R. Dokmeci, Y. Yang, A. Khademhosseini, Hydrogel bioprinted microchannel networks for vascularization of tissue engineering constructs, Lab Chip 14(13) (2014) 2202-11.
[57] R.Z. Lin, Y.C. Chen, R. Moreno-Luna, A. Khademhosseini, J.M. Melero-Martin, Transdermal regulation of vascular network bioengineering using a photopolymerizable methacrylated gelatin hydrogel, Biomaterials 34(28) (2013) 6785-96.
[58] Y.C. Chen, R.Z. Lin, H. Qi, Y. Yang, H. Bae, J.M. Melero-Martin, A. Khademhosseini, Functional Human Vascular Network Generated in Photocrosslinkable Gelatin Methacrylate Hydrogels, Adv Funct Mater 22(10) (2012) 2027-2039.
[59] N.S. Bhise, V. Manoharan, S. Massa, A. Tamayol, M. Ghaderi, M. Miscuglio, Q. Lang, Y. Shrike Zhang, S.R. Shin, G. Calzone, N. Annabi, T.D. Shupe, C.E. Bishop, A. Atala, M.R. Dokmeci, A. Khademhosseini, A liver-on-a-chip platform with bioprinted hepatic spheroids, Biofabrication 8(1) (2016) 014101.
[60] E. Gevaert, T. Billiet, H. Declercq, P. Dubruel, R. Cornelissen, Galactose-functionalized gelatin hydrogels improve the functionality of encapsulated HepG2 cells, Macromol Biosci 14(3) (2014) 419-27.
[61] M. Sadat-Shojai, M.T. Khorasani, A. Jamshidi, 3-Dimensional cell-laden nano-hydroxyapatite/protein hydrogels for bone regeneration applications, Mater Sci Eng C Mater Biol Appl 49 (2015) 835-43.
[62] Y. Zuo, X. Liu, D. Wei, J. Sun, W. Xiao, H. Zhao, L. Guo, Q. Wei, H. Fan, X. Zhang, Photo-cross-linkable methacrylated gelatin and hydroxyapatite hybrid hydrogel for modularly engineering biomimetic osteon, ACS Appl Mater Interfaces 7(19) (2015) 10386-94.
[63] A. Paul, V. Manoharan, D. Krafft, A. Assmann, J.A. Uquillas, S.R. Shin, A. Hasan, M.A. Hussain, A. Memic, A.K. Gaharwar, A. Khademhosseini, Nanoengineered biomimetic hydrogels for guiding human stem cell osteogenesis in three dimensional microenvironments, J Mater Chem B Mater Biol Med 4(20) (2016) 3544-3554. [64] N. Annabi, D. Rana, E. Shirzaei Sani, R. Portillo-Lara, J.L. Gifford, M.M. Fares, S.M. Mithieux, A.S. Weiss, Engineering a sprayable and elastic hydrogel adhesive with antimicrobial properties for wound healing, Biomaterials 139 (2017) 229-243.
[65] B.B. Rothrauff, G. Yang, R.S. Tuan, Tissue-specific bioactivity of soluble tendon-derived and cartilage-derived extracellular matrices on adult mesenchymal stem cells, Stem Cell Res Ther 8(1) (2017) 133.
[66] M. Eslami, N.E. Vrana, P. Zorlutuna, S. Sant, S. Jung, N. Masoumi, R.A. Khavari-Nejad, G. Javadi, A. Khademhosseini, Fiber-reinforced hydrogel scaffolds for heart valve tissue engineering, J Biomater Appl 29(3) (2014) 399-410.
광경화성 단백질 기반 수화젤 이배훈 Page 18 / 18 Y. Sakka, A. Khademhosseini, T. Matsue, Dielectrophoretically aligned carbon nanotubes to control electrical and mechanical properties of hydrogels to fabricate contractile muscle myofibers, Adv Mater 25(29) (2013) 4028-34. [68] C. Cha, S.R. Shin, X. Gao, N. Annabi, M.R. Dokmeci, X.S. Tang, A. Khademhosseini, Controlling mechanical properties of cell-laden hydrogels by covalent incorporation of graphene oxide, Small 10(3) (2014) 514-23. [69] X. Chen, S. Bai, B. Li, H. Liu, G. Wu, S. Liu, Y. Zhao, Fabrication of gelatin methacrylate/nanohydroxyapatite microgel arrays for periodontal tissue regeneration, Int J Nanomedicine 11 (2016) 4707-4718.
[70] M. Bartnikowski, A.R. Akkineni, M. Gelinsky, M.A. Woodruff, T.J. Klein, A Hydrogel Model Incorporating 3D-Plotted Hydroxyapatite for Osteochondral Tissue Engineering, Materials (Basel) 9(4) (2016).
[71] C. Li, C. Mu, W. Lin, Novel hemocompatible nanocomposite hydrogels crosslinked with methacrylated gelatin, RSC Adv. 6(49) (2016) 43663-43671.
[72] A. Assmann, A. Vegh, M. Ghasemi-Rad, S. Bagherifard, G. Cheng, E.S. Sani, G.U. Ruiz-Esparza, I. Noshadi, A.D. Lassaletta, S. Gangadharan, A. Tamayol, A. Khademhosseini, N. Annabi, A highly adhesive and naturally derived sealant, Biomaterials 140 (2017) 115-127.
[73] A.H. Nguyen, J. McKinney, T. Miller, T. Bongiorno, T.C. McDevitt, Gelatin methacrylate microspheres for controlled growth factor release, Acta Biomater 13 (2015) 101-10.
[74] M. Sirova, S. Van Vlierberghe, V. Matyasova, P. Rossmann, E. Schacht, P. Dubruel, B. Rihova, Immunocompatibility evaluation of hydrogel-coated polyimide implants for applications in regenerative medicine, J Biomed Mater Res A 102(6) (2014) 1982-90.
[75] F. Fu, Z. Chen, Z. Zhao, H. Wang, L. Shang, Z. Gu, Y. Zhao, Bio-inspired self-healing structural color hydrogel, Proc Natl Acad Sci U S A 114(23) (2017) 5900-5905.
※ 본 콘텐츠는 의 후원으로 작성되었습니다.
The views and opinions expressed by its writers do not necessarily reflect those of the Biological Research Information Center. 이배훈(2017). 광경화성 단백질 기반 수화젤. BRIC View 2017-T35
Available from http://www.ibric.org/myboard/read.php?Board=report&id=2829 (Sep.28, 2017) Email: member@ibric.org