서 론
진행성 근디스트로피 중 하나인 뒤시엔느 근디스트로 피(Duchenne Muscular Dystrophy; DMD)는 디스 트로핀(dystrophin) 유전자의 이상으로 디스트로핀의 생성에 이상을 초래하여 골격근, 평활근, 심근의 퇴행
및 위축을 일으키는 질환이다.1 이 질환은 영유아기부터 시작되는 점진적인 근육의 소실 및 위축으로 인하여 10 대 초반에 휠체어 이동만이 가능하게 되고, 75%에서 20세 이전에 만성 호흡부전이 발생하여 사망하는 것으 로 알려져 있다.1,2 그러나 최근에는 적절한 호흡관리 및 합병증의 관리를 통해 환자의 수명이 연장되고 있어,3,4
뒤시엔느 근디스트로피 환자의 영양 상태 평가
연세대학교 의과대학 재활의학교실 및 근육병재활연구소
정철오∙정강재∙최정화∙박윤길∙윤여훈
– Abstract –
Nutritional Status of Duchenne Muscular Dystrophy in South Korea
Chul Oh Jung, M.D., Kang Jae Jung, M.D., Jung Hwa Choi, M.D., Yoon Ghil Park, M.D., Yeo Hoon Yoon, M.D.
Department of Rehabilitation Medicine, Rehabilitation Institute of Muscular Disease, Yonsei University College of Medicine
Objectives: To investigate nutritional status and various related factors of Korean Duchenne muscular dystrophy(DMD) patients by assessing body mass index(BMI)
Methods: Demographical data including height, weight, BMI and nutritional related factors reviewed ret- rospectively on the medical records of 106 DMD patients. And we also reviewed their functional aspect such as walking ability. We divide the patients into two groups: patients under and more than 19 years old. We divide again each group into four groups along with BMI score: low weight, normal, overweight, and obesity. And then each groups are compared with nutritional related factors and walking ability.
Results: The older subjects showed the lower BMI, with statistically significant difference in age among each groups. As a biochemical aspect, In low weight group total lymphocyte count, white blood cell count decreased with statistically significance in patients under 19 years old. As a functional aspect, the subjects in low weight group show the more dependency on ambulation.
Conclusions: The accurate evaluation for nutritional status and the continuous nutritional support is required for the rehabilitation of DMD patients.
Key Words: Duchenne Muscular Dystrophy, Progressive Muscular Dystrophy, Body Mass Index, Nutrition, Immune
Address reprint requests to Yoon Ghil Park, MD
Department of Rehabilitation Medicine, Gangnam severance Hospital, 146-92, Dogok-dong, Gangnam-gu, Seoul 135-720, Korea
TEL: 82-2-2019-3493, FAX: 82-2-2019-3499, E-mail: drtlc@yuhs.ac
투고일: 2011년 8월 2일, 1차 수정일: 2011년 9월 29일, 2차 수정일: 2011년 10월 17일, 게재 확정일: 2011년 10월 21일
�본 연구는 (재)제원연구재단의 2009년도 위탁연구비 지원으로 이루어졌음.
장기간의 적절한 영양관리 또한 DMD 환자의 관리에 있어서 중요한 인자로 대두되고 있다.
임상적으로 영양상태는 체질량지수(Body Mass Index; BMI),5,6 삼두근 피부 주름 두께(triceps- skinfold thickness),7 팔둘레(midarm circumfer- ence)8와 같은 신체 측정치와 총임파구수(Total Llym- phocyte Count; TLC),9,10 혈색소,11 혈청 알부민,12 크레아틴13 같은 생화학적 영양지표들, 그리고 그 외에 실질체중(lean body mass)14과 전지저항법(bioelec- trical impedance)15 등을 이용하여 측정할 수 있다.
DMD 환자에서는 증상의 발현에 따라 체지방률, 골 격근의 용적, 활동 수준 등의 급격한 변화를 보이는데, 일반적으로 질병이 진행되면서 골격근이 감소하나 체지 방이 증가하면서 과체중이 되거나, 골격근의 단백질 감 소가 더욱 빨라져 저체중에 이르게 된다.16 따라서, DMD 환자의 영양 상태는 체질량지수가 정상 범위라도 체구성 중 체지방이 과다하고, 활동 수준이 감소되어 있 어 정상인에 비해 영양상태가 불량한 경우가 대부분이 다. 또한 증상이 진행됨에 따라 영양공급 방법의 변화나 호흡기 사용, 기관 삽관술 시행 등, 여러 요인에 의한 영양 섭취 제한으로 인하여 영양 결핍이 발생하게 된다.
DMD 환자들의 신체 발달의 변화에 대한 연구로는 McDonald 등에 의하면 나이에 따른 키의 변화는 10세 이전에는 일부에서만 정상의 50%ile 이하이다가 10세 이후 급격히 감소되는 양상을 보이며, 5세부터 13세 사 이에 근력의 저하가 빠르게 진행되고, 13세 경부터 관 절의 구축이 발생하면서, 휠체어에 의존하게 된다고 하 였다.17 Willig 등은 252명의 DMD 환자들을 대상으로 한 연구에서 7-13세 사이에는 54%의 환자가 정상 체중 분포 곡선의 90%ile 이상에 분포하다가 13세 이후부터 체중 감소가 시작되어 18세에는 54%의 환자가 저체중 상태가 된다고 하였다.18 또한 Griffiths 등은 환자의 체중이 증가함에 따라 근육이 아닌 섬유조직이나 체지 방 침착이 증가하며, 6-17세 사이에 매년 근육량이 4%
씩 감소한다고 하였다.19
DMD 환자의 신체상의 변화 중 과체중이나 비만은 약한 근육들의 부담을 증가시키고 호흡이나 이동동작을 어렵게 하며, 저체중의 경우 질환의 진행에 따라 체중의 감소가 더욱 심해지고 골격근의 파괴를 가속화시키는 등 많은 기능저하와 합병증을 유발하게 된다. Hankard 등은 DMD 환자들에서 체중이 증가하더라도 근육량은 증가하지 않기 때문에 비만이 근육량 감소로 인한 장애 를 심화시키는 인자로 볼 수 있으며, 특히 골격의 변형 을 가속시키고 이로 인한 정형외과적 수술의 예후를 악 화시킨다고 하였다.20 Edward 등은 비만이 호흡기능을 악화시키는 원인이며, 불필요한 체지방을 감소시킴으로 써 약해진 근육에 부담을 줄이고, 운동능력과 호흡기능 을 향상시킬 수 있다고 하였다.21 Okada 등에 의하면
DMD 환자는 나이가 많을수록 근조직 파괴로 단백질의 소실이 증가하게 되고, 이로 인하여 단백질 요구량과 기초 대사량이 증가하게 된다. 저체중은 과도한 근육의 감소를 반영하므로 단백질을 포함한 적절한 영양 공급 이 이루어지지 않을 경우, 기초 대사에 필요한 에너지 를 공급하기 위하여 근육 조직을 활용함으로써, 근육의 감소가 더욱 빨라지게 된다. 이러한 근육의 감소는 호 흡근과 심근의 감소, 그리고 잔여 수명의 감소를 의미 한다.22
따라서 DMD 환자들의 정확한 발달 및 영양상태 또 한 이와 관련된 인자들을 확인하고 적절한 영양 공급과 체중 관리를 시행함으로써 호흡기능과 운동기능 저하를 느리게 하고, 근골격계와 심혈관계 합병증의 발생을 지 연시켜 재활치료의 효과를 높이며 궁극적으로 환자의 수명과 삶의 질을 향상시킬 수 있다. 그러나 현재 국내 에는 DMD 환자의 성장과 신체 기능의 변화에 대한 연 구23만 진행되었으며, 영양상태의 변화나 신체 기능과 영양상태의 관계에 대한 정확한 보고는 없는 상태이다.
이에 본 연구에서는 국내 DMD 환자들의 체질량지수 분포를 통한 영양상태를 조사하고 이와 관련된 인자들 에 대해 알아보고자 하였다.
연구대상 및 방법
1. 연구 대상
대상군은 Brooke24 등이 제시한 DMD의 진단 기준을 만족하고, 근육생검 검사나 분자 유전 검사를 시행하여 DMD로 진단된 환자를 대상으로 하였다. 근육생검 검 사는 외측 광근(vastus lateralis muscle)에서 생검을 시행하고 디스트로핀 면역조직화학 염색(immunohis- tochemical stain)에 서 근 세 포 에 면 역 반 응 성 (immunoreactivity)이 감소되거나 소실된 경우 DMD에 합당한 소견으로 판단하였다.25 분자 유전 검사 는 Multiplex Ligation-dependent Probe Amplifi- cation(MLPA) 또는 Multiplex Polymerase Chain Reaction(MPCR)을 사용하였으며 디스트로핀 유전자 의 결손, 중복, 점돌연변이(point mutation), 미세결 손(microdeletion), 미세삽입(microinsertion) 등 변 이를 보이는 경우 DMD에 합당한 것으로 판단하였
다.26,27 평가 당시 폐렴 등의 급성 염증성 질환, 다른 신
경학적 병변, 만성 소모성 질환, 말초신경병변이 있는 환자들과 신체에 단기간 변화를 줄 수 있는 수술 직후 시기의 환자는 제외하였다(Table 1). 2007년 1월부터 2010년 12월 까지 본원에 입원한 총 119명의 환자를 대상으로 하였다. 이중 13명(급성 염증성 질환 11명, 폐 결핵 1명, 다발성 경화증 1명)이 기준에 부합하지 않아 제외하여 총 106명의 환자를 대상으로 하였고, 연
령은 3.8세부터 35.9세까지로 평균 17.6세이었다. 연구 는 의무기록 및 평가 결과지를 토대로 후향적 조사를 시행하였으며 각 환자들의 체질량지수, 혈액 검사 및 보행능력에 대한 평가 결과를 조사하였다.
2. 연구 방법
(1) 체질량지수에 따른 영양 상태 분류
대상군 별로 신체계측학적 평가로 체중 및 신장을 측 정하였다. 체중은 0.1 kg을 최소단위로 신장은 0.1 cm 을 최소단위로 각각 측정하였다. 대상군의 신장측정 시 에는 기립자세유지가 어려운 경우가 많아 앙와위에서의 신장을 측정하였고, 관절 구축 등의 합병증이 있는 경우 는 대퇴길이 및 하퇴길이를 따로 측정하여 보정하였다.
측정된 신장 및 체중을 기준으로 체중을 신장의 제곱값 으로 나누어 체질량지수를 구하였다. 체질량지수에 따라 대상군을 4그룹으로 분류하였으며, 교정연령 18세 까지 는 2007 소아청소년 표준 성장도표를 이용하여 ① 저체 중은 5%ile 미만, ② 정상은 5%ile 이상 85%ile 미만,
③ 과체중은 85%ile 이상 95%ile 미만, ④ 비만은 95%ile 이상으로 하였고, 19세 이상 성인은 각 그룹을 체질량지수 ① 18.5 미만, ② 18.5 이상 25 미만, ③ 25 이상 30 미만, ④ 30 이상으로 설정하였다.28
(2) 혈액 및 생화학적 영양지표
신장 및 체중 측정 당시 시행한 혈액 및 생화학적 검 사 결과를 기준으로 하였으며 백혈구수, 헤모글로빈, 평균적혈구혈색소량, 평균적혈구용적, 총임파구수, 혈 청 단백질, 혈청 알부민, 백혈구중 임파구비율, 백혈구 중 호중구비율을 검사 하였다.
(3) 기능상태 평가
기능상태 평가로 보행능력 및 의자차 의존도를 평가 하였다. 보행능력은 와상상태, 의존적 의자차 이동, 독 립적 의자차 이동 및 보행가능 그룹으로 분류하였다.
또한 체질량지수에 따른 보행능력의 변화를 정확히 확인
하기 위해 보행능력을 상실하는 시기로 알려진 7세에서 13세 사이의 환자를 저체중과 저체중인 아닌 군으로 나 누고, 독립보행 가능 여부에 대해 비교 평가하였다.17
3. 분석 방법
통계학적 분석은 SPSS version 15.0 프로그램을 사 용하여 시행하였다. 연령에 따른 체질량지수의 변화를 알기 위하여 체질량지수 그룹간 차이를 독립표본 T-검 증(independent t-test)을 이용하였으며, 체질량지수 에 영향을 미치는 혈액학 및 생화학적 지표를 알기 위 하여 체질량지수에 영향을 미칠 수 있는 연령을 보정한 공분산분석(ANCOVA)을 이용하였다. 체질량지수와 보행능력과의 관계를 알아보기 위하여 각 그룹간 Chi- square test를 이용하였고 연령대별로 나누어 Man- tel-Haenszel methods를 이용하여 보정하였다.
결 과
1. 연령에 따른 체질량지수
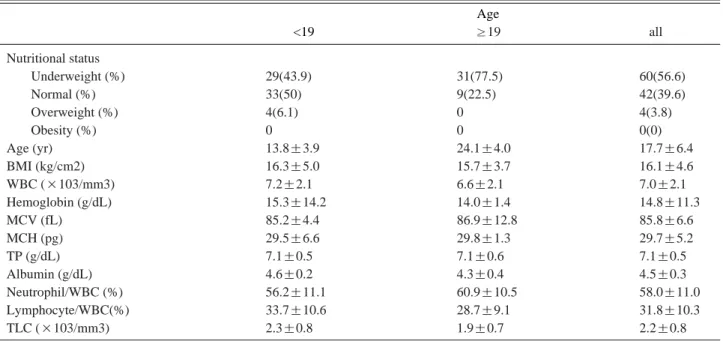
총 106명의 평가 결과 저체중군은 60명 정상군은 42 명이고 과체중군은 4명이었다(Table 2). 연구대상 환 자 중 비만에 해당하는 환자가 없어 비만군은 그룹간 비교에서 제외하였다. 18세까지의 소아는 66명으로 이 중 저체중군은 29명(43.9%), 정상군은 33명(50.0%), 과체중군은 4명(6.1%)이었으며, 19세 이상 성인 40명 중 저체중군은 31명(77.5%), 정상군은 9명(22.5%)이 었고, 과체중 환자는 없었다(Table 2). 저체중환자는 7세경부터 나타났으며, 13세경 7명중 3명(43%)이 저 체중이었고, 이후 같은 연령대에서 저체중의 비율이 증 가하는 양상을 보였다(Fig. 1). 전체 환자의 그룹간 비 Table 1. Diagnostic Criteria of Duchenne Muscular Dystrophy
1. Male
2. Onset of weakness < age of 5 3. Initial proximal muscle weakness 4. No ptosis or EOM weakness
5. No skin rash or sensory abnormality 6. Apparent hypertrophy of calf muscle 7. Significant contractures at some time 8. Elevated serum creatine kinase activity 9. Myopathic EMG findings or biopsy 10. X-linked recessive inheritance
Brooke et al. EOM: Extraocular muscle, EMG: Electromyography
BMI: Body mass index, 5%ile: 5%ile of normal develop- ment curve, 50%ile: 50%ile of normal development curve, 85%ile: 85%ile of normal development curve, 90%ile:
90%ile of normal development curve
Fig. 1. Distribution of BMI According to Age in DMD Patients Below 19 Year Old.
교 상 나이는 저체중에서 19.48±6.21세, 정상에서 15.60±5.86세, 과체중에서 12.27±5.75세로 군간에 의미 있는 차이를 보였다(p<0.01). 대상군을 소아와 성인으로 나누어 그룹간 비교를 한 경우, 소아에서 평 균나이는 저체중에서 14.37±3.12세, 정상에서 13.44
±4.37세, 과체중에서 12.27±5.75세로 군간에 의미 있는 차이를 보이지 않았으며(Table 3), 성인에서도 저체중에서 24.59±4.23세, 정상에서 23.51±3.15세 로 체질량지수와 나이는 관련이 없는 것으로 나타났다 (Table 4).
2. 생화학적 지표
전체 환자의 그룹간 비교에서 생화학적 지표에서는 다 양한 인자들 중 백혈구수와 총임파구수가 저체중군에서 정상군에 비해 유의한 감소 소견을 보였다(p<0.05). 헤 모글로빈, 평균적혈구혈색소량, 평균적혈구용적, 혈청 단백질, 혈청 알부민, 백혈구중 임파구비율, 백혈구중 호중구비율은 각 그룹간에 통계적으로 유의한 차이를 보이지 않았다. 소아에서 그룹간 생화학적 지표를 비교 한 경우 체질량지수가 감소함에 따라 백혈구와 총임파 구수는 감소하고, 평균적혈구용적이 증가하는 것으로 Table 2. Demographic Data of Duchenne Muscular Dystrophy Patients
Age
<19 ≥19 all
Nutritional status
Underweight (%) 29(43.9) 31(77.5) 60(56.6)
Normal (%) 33(50) 9(22.5) 42(39.6)
Overweight (%) 4(6.1) 0 4(3.8)
Obesity (%) 0 0 0(0)
Age (yr) 13.8±3.9 24.1±4.0 17.7±6.4
BMI (kg/cm2) 16.3±5.0 15.7±3.7 16.1±4.6
WBC (×103/mm3) 7.2±2.1 6.6±2.1 7.0±2.1
Hemoglobin (g/dL) 15.3±14.2 14.0±1.4 14.8±11.3
MCV (fL) 85.2±4.4 86.9±12.8 85.8±6.6
MCH (pg) 29.5±6.6 29.8±1.3 29.7±5.2
TP (g/dL) 7.1±0.5 7.1±0.6 7.1±0.5
Albumin (g/dL) 4.6±0.2 4.3±0.4 4.5±0.3
Neutrophil/WBC (%) 56.2±11.1 60.9±10.5 58.0±11.0
Lymphocyte/WBC(%) 33.7±10.6 28.7±9.1 31.8±10.3
TLC (×103/mm3) 2.3±0.8 1.9±0.7 2.2±0.8
Values are mean±standard deviation. BMI: Body mass index, WBC: White blood cell, MCV: Mean corpuscular volume, MCH: Mean corpuscular hemoglobin, TP:Total protein, TLC: Total lymphocyte count
Table 3. Differences of Parameters According to the Nutritional Status of DMD Patients Below 19
Underweight Normal Overweight P value
(n=29) (n=33) (n=4)
Age (yr) 14.37±3.12 13.44±4.37 12.27±5.75 0.482
BMI (kg/cm2)* 11.92±2.26 18.76±2.83 27.47±0.56 <0.001
WBC (×103/mm3)* 6.53±1.59 7.74±2.41 8.39±2.08 0.043
Hemoglobin (g/dL) 13.35±2.05 13.72±1.32 13.93±1.18 0.638
MCV (fL) * 86.87±4.11 83.86±4.13 83.40±4.42 0.015
MCH (pg) 29.19±1.58 29.96±9.25 28.95±1.31 0.886
TP (g/dL) 7.07±0.55 7.22±0.49 7.20±0.27 0.501
Albumin (g/dL) 4.56±0.27 4.59±0.25 4.55±0.24 0.907
Neutrophil/WBC (%) 56.66±13.22 56.73±9.47 55.25±12.67 0.970
Lymphocyte/WBC(%) 32.86±12.12 33.58±9.48 35.03±11.71 0.918
TLC (×103/mm3)* 2.03±0.62 2.50±0.84 2.83±0.94 0.025
Values are mean±standard deviation. BMI: Body mass index, WBC: White blood cell, MCV: Mean corpuscular volume, MCH: Mean corpuscular hemoglobin, TP:Total protein, TLC: Total lymphocyte count
p-value by ANOVA, *p<0.05
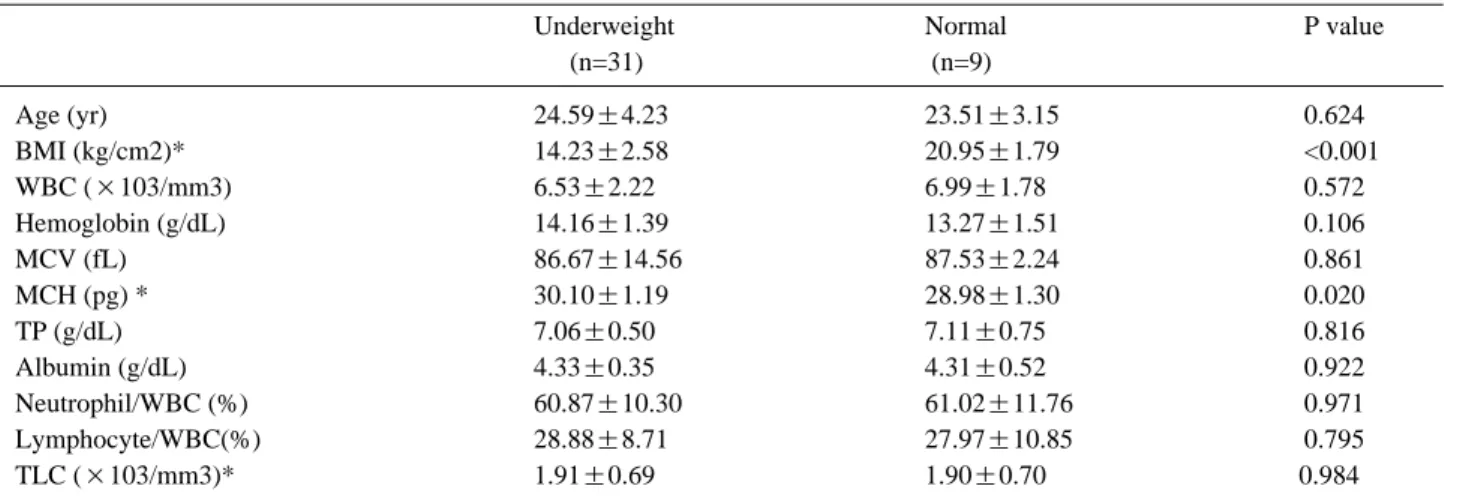
나타났으며(Table 3)(p<0.05), 다른 생화확적 지표에 서는 유의한 관련을 보이지 않았다. 성인에서는 생화학 적 지표 중 평균적혈구혈색소량이 저체중군에서 정상군 에 비해 높게 나타났고(Table 4)(p<0.05), 다른 지표 에서 유의한 차이는 보이지 않았다.
3. 기능상태 지표
보행능력의 경우 대상환자 중 95명(89.6%)이 의자차 에 의존하여 거동하거나 거동이 불가능한 와상상태였고, 보행능력 그룹을 와상상태부터 보행가능까지 4군으로 나누어 비교 시, 보행능력의 상실에 따라 체중이 유의하 게 감소하였다(p<0.01). 19세 미만 소아에서는 66명중 11명(16.7%)이 독립적으로 보행이 가능하였고, 4명 (6.1%)은 의자차에 의존하나 스스로 의자차를 추진할 수 있었고, 47명(71.2)은 타인의 도움을 받아 의자차로 거동하였으며, 4명(6.1%)은 와상상태였다. 19세 이상 성인에서는 40명 모두 타인의 도움을 받아 의자차로 거 동하거나 와상상태였다. 성인과 소아를 각각 따로 분류 하여 체질량지수와 보행능력을 비교할 경우 소아에서는 보행능력 상실과 체질량지수의 감소가 연관되어 나타났 으나(p<0.05), 성인에서는 그룹간 의미 있는 차이가 없 는 것으로 나타났다. 7-13세 환자를 저체중인 군과 저 체중인 아닌 환자로 나누어 보행능력을 비교하였을 경우
통계적으로 유의한 결과는 나오지 않았으나 저체중인 환 자에서는 84.6%, 저체중인 아닌 환자에서는 64.3%가 독립적인 보행이 불가능 한 상태로 저체중인 환자에서 보행능력이 저하되는 경향을 보였다(Table 5).
고 찰
영양 상태의 평가는 이학적 평가, 혈액 및 생화학적 검사 등 여러가지 평가를 통해 종합적으로 이루어지게 된다. 이학적 평가 중 인체계측학적 평가로 신장 체중 등의 측정치를 이용하여 정상치와 비교함으로써 평가에 이용할 수 있으며 생화학적 지표인 총임파구수, 혈색 소, 혈청 알부민, 크레아틴 등을 통하여 알아볼 수 있
다.5,9-13 본 연구에서는 이러한 인체계측학적 지표 중 쉽
게 측정할 수 있는 신장과 체중을 이용한 체질량지수를 기준으로 하였다. 체질량지수는 환자의 영양 상태를 측 정하는 최적의 지표로 널리 사용 되고 있으며, Mini Nutrition Assessment29, Malnutrition Universal Screening Tool30과 같은 영양 상태 평가를 위한 선별 검사의 진단 기준의 하나로 사용되고 있다.31
본 연구에서 전체 환자를 체질량지수로 분류한 각 그 룹의 평균 연령은 정상군이 15.60±5.86세, 저체중 군 이 19.48±6.21세로, 저체중 군에서 통계적으로 유의 하게 평균 연령이 더 높은 것으로 나타났으나, 과체중 Table 4. Differences of Parameters According to the Nutritional Status of DMD Patients of 19 and Over
Underweight Normal P value
(n=31) (n=9)
Age (yr) 24.59±4.23 23.51±3.15 0.624
BMI (kg/cm2)* 14.23±2.58 20.95±1.79 <0.001
WBC (×103/mm3) 6.53±2.22 6.99±1.78 0.572
Hemoglobin (g/dL) 14.16±1.39 13.27±1.51 0.106
MCV (fL) 86.67±14.56 87.53±2.24 0.861
MCH (pg) * 30.10±1.19 28.98±1.30 0.020
TP (g/dL) 7.06±0.50 7.11±0.75 0.816
Albumin (g/dL) 4.33±0.35 4.31±0.52 0.922
Neutrophil/WBC (%) 60.87±10.30 61.02±11.76 0.971
Lymphocyte/WBC(%) 28.88±8.71 27.97±10.85 0.795
TLC (×103/mm3)* 1.91±0.69 1.90±0.70 0.984
Values are mean±standard deviation. BMI: Body mass index, WBC: White blood cell, MCV: Mean corpuscular volume, MCH:
Mean corpuscular hemoglobin, TP:Total protein, TLC: Total lymphocyte count p-value by ANOVA, *p<0.05
Table 5. Correlation Between Body Mass Index and Ambulatory Function of DMD Patients Between 7-13 Year Old
Underweight Normal overweight Total
(n=13) (n=14)
Bed ridden or wheelchair ambulation (%) 11 (84.6%) 9 (64.3%) 20
Independent walking (%) 2 (15.4%) 5(35.7%) 7
p-value by Fisher's Exact test p== 0.385
이상은 숫자가 적어 동시에 비교하기 어려웠다. 본 연 구에서 과체중 이상의 수가 비교적 적게 나타난 원인은 대상 환자의 평균연령이 13.8세이며 과체중이 보일 수 있는 8세에서 11세 사이의 환자의 수가 12명으로 전체 연구대상 환자 중 차지하는 비율이 11.3%로 적기 때문 인 것으로 생각할 수 있다. 또한 정기적인 진료와 적극 적인 재활 치료, 호흡기 사용, 측만증, 심근병증과 같 은 합병증에 대한 치료 등으로 DMD 환자들의 평균수 명이 늘어나면서 본 연구대상 환자에서도 저체중이 주 로 나타나는 13세 이상의 환자 비율이 증가한 것도 과 체중 이상의 수가 비교적 적게 나타난 원인으로 생각할 수 있다.32,33 대상 환자를 성인과 소아로 구분하여 그룹 간 비교를 하였을 경우 전체 환자를 대상으로 한 결과 와는 달리 그룹간 평균 연령의 의미 있는 차이를 보이 지 않았다. 본 연구에서 소아의 연령에 따른 체질량지 수 분포를 보면 약 7세 경부터 저체중 환자가 나타나기 시작하여 이후에는 저체중, 정상체중 그리고 과체중이 혼재된 양상을 보였다(Fig 1). 또한 19세 이상 성인의 경우 체질량지수 감소로 과체중 이상인 환자는 없었으 나, 저체중과 정상체중이 혼재된 양상을 보였는데, DMD 환자에서 13세 이전의 과체중이 17세 이후에도 후기 과체중을 유발하는 인자가 된다는 Martigne 등의 보고에 따라 본 연구의 결과를 설명할 수 있다.34
본 연구에서 백혈구수와 총임파구수는 저체중에서 정 상군에 비해 통계적으로 유의하게 감소하였다. 과거 영 양소와 면역 기능에 관한 연구에 의하면, 단백질의 경 우 임파구수, 임파구의 증식, 항체 반응을 결정하는 중 요한 인자로 밝혀져 있으며,35 철은 T 세포의 증식에 기 능에 관여하게 된다.36 아연은 임파구의 활성화에 영향 을 주며, 임파구의 세포자멸사(apoptosis)의 주요한 세 포내 조절인자이다.37,38 결국 임파구의 생성과 증식에 필 요한 여러 요소들 중 어느 한 가지라도 결핍될 경우 백 혈구수의 감소가 나타날 수 있으며, 이로서 연령의 증가 에 따라 불량한 영양상태를 보이는 DMD 환자의 백혈 구수의 감소를 설명할 수 있다. 19세 미만의 소아 환자 를 대상으로 하여 비교하였을 때, 체질량지수의 감소에 따라 백혈구수, 총임파구수의 감소뿐만 아니라 평균적 혈구용적의 증가가 관찰되었다. 평균적혈구용적의 증가 는 비타민 B-12와 엽산등의 영양 결핍으로 인한 DNA 합성 장애로 발생하는 대적혈구성 빈혈(microcytic anemia)에서 나타날 수 있다.39 그러나 대적혈구성 빈 혈의 경우 평균적혈구혈색소량의 증가가 함께 관찰되므 로 본 연구의 결과는 임상적으로 큰 의미는 없는 것으 로 판단된다. 성인에서 체질량지수의 감소에 따라 평균 적혈구혈색소량이 감소한 부분도 철 결핍성 빈혈을 고 려해볼 수 있으나 평균적혈구용적의 감소가 동반되지 않은 점으로 볼 때 임상적으로 의미가 있다고 보기 어 렵다. 또한 성인에서 평균적혈구혈색소량 외에 다른 생
화학적 영양 지표는 그룹간 차이를 보이지 않았는데 이 는 19세 이상의 DMD 환자의 경우 병이 진행됨에 따라 대부분 영양이 불량한 상태가 되어 통계적으로 유의한 차이를 보이지 않았을 가능성이 있다.
본 연구에서 전체 환자를 대상 비교하였을 경우와 19 세 미만의 환자를 대상으로 비교하였을 때 보행능력의 상실에 따라 체중이 유의하게 감소하였다. 그러나 DMD 환자는 일반적으로 연령이 증가함에 따라 근력의 저하와 관절의 구축으로 13세 경부터 휠체어에 의존하 게 되므로,17 모든 연령의 환자를 대상으로 할 경우 보 행능력의 저하는 체질량지수의 감소 보다는 병의 자연 적인 경과에 따른 변화일 가능성이 크다. 실제로 본 연 구에서 19세 이상 성인 40명 모두 독립적인 보행능력을 상실한 상태였으며, 19세 미만의 소아에서 전체 66명 중 14세 이상인 환자가 35명으로 과반수 이상(53%)이 었고 이 환자들 모두가 독립적인 보행능력을 상실한 상 태였다. 일반적으로 보행능력을 상실하는 시기로 알려 진 7세에서 13세 환자의 경우 저체중인 환자에서 보행 능력이 저하되는 경향을 보였으나 통계적으로 유의하지 않았다. DMD 환자에서 근력의 감소와 보행을 포함한 신체 기능의 상실을 비교한 과거의 연구에 의하면 DMD 환자들의 근력 감소의 속도는 환자 마다 큰 차이 를 보이나 대부분의 환자에서 신체 기능의 감소가 환자 의 연령보다도 근력의 감소와 더 밀접하게 연관되어 진 행된다고 보고하였다.40 DMD 환자는 일반적으로 증상 의 발현에 따라 골격근의 단백질 감소가 더욱 빨라져 골격근의 용적이 감소하며 저체중에 이르게 되므로,16 근력의 감소로 인한 보행능력의 상실이 불량한 영양 상 태와 연관이 있을 것으로 추측할 수 있다. 그러나 본 연구에서 이와 다른 결과를 보인 것은 7세에서 13세 환 자의 수가 27명으로 대상군의 수가 적어 통계적인 연관 성을 보이지 않았을 가능성이 있으며 영양상태와 보행 능력의 관계에 대한 추가적인 대규모 연구가 필요하다.
본 연구를 통하여 DMD 환자들은 연령이 증가하면서 영양상태가 불량해지며 특히 7세경부터 저체중 상태가 발생할 수 있음을 알 수 있었다. 또한, 본 연구에서 소 아의 경우 약 44%가 소아청소년 표준 성장도표 상 5%ile 이하였고, 성인에서는 78%가 체질량지수 18.5 이하로 영양상태가 불량한 경우가 대부분이었다. 혈액 검사에서는 19세 미만의 소아에서 백혈구수와 총임파구 수가 환자의 영양 상태를 반영하는 것으로 나타났다.
기능적인 면에서 7세에서 13세 사이의 환자에서 영양 상태가 불량할수록 보행능력이 저하되는 경향이 보였 다. 따라서 DMD 환자의 경우 7세를 전후하여 정기적 으로 영양 상태를 평가하고 적절한 영양관리를 시행하 는 것이 연령 증가에 따른 불량한 영양상태로의 진행을 연장시키고 궁극적으로 적극적인 재활치료를 지속하기 위해 필요하며, 정확한 영양상태 평가를 위해 백혈구수
와 총임파구수의 변화를 관찰하는 것이 도움이 될 수 있을 것으로 판단된다.
본 연구의 제한점으로는, 대상환자의 영양상태를 체 질량지수를 기준으로 분류하였는데, 체질량지수의 경우 DMD 환자들의 영양상태 지표로서 적합하지 않을 수 있다는 것이다. 체질량지수는 체중을 신장의 제곱으로 나누어 구하게 되는데, 병이 진행함에 따라 기립 자세 를 유지하지 못하거나 관절 구축이 있는 환자의 경우, 줄자를 사용하여 상체와 대퇴, 하퇴의 길이를 따로 측 정하였기 때문에 측정된 신장이 환자의 실제 신장과 정 확히 일치 하지 않았을 가능성이 있다. 체중의 경우 과 거 연구에서 환자의 근육이 심하게 감소하거나, 또는 감소하더라도 신체 활동 저하로 인한 지방조직의 축적 으로 인해 정상 체중에 근접할 수 있기 때문에 표준 성 장 도표는 DMD 환자에서 적용하기 어렵다고 하였다.19 따라서 DMD 환자의 영양상태를 가장 잘 대변하는 지 표를 찾아내고 이를 기준으로 한 추가적인 연구가 필요 하겠다.
결 론
본 연구 결과에서 DMD 환자의 영양상태는 성장에 따라 대부분 불량한 영양 상태로 진행하였으며, 생화학 적 지표로 백혈구수, 총임파구수가 체질량지수와 관련 이 있었다. 또한 7세에서 13세 사이의 환자에서 영양 상태가 불량할수록 보행능력이 저하되는 경향이 보였 다. 따라서 DMD 환자의 영양상태와 관련된 지표 확인 과 정확한 영양 상태 평가를 통한 적절한 영양 공급과 체중 관리가 신체 기능 저하 속도를 늦추고 합병증 발 생 시기를 연장 시킴으로써, 궁극적으로 환자의 수명 연장과 삶의 질 향상에 도움을 줄 수 있을 것이다.
참고 문헌
1. Boland BJ, Silbert PL, Groover RV, Wollan PC, Silver- stein MD. Skeletal, cardiac, and smooth muscle failure in Duchenne muscular dystrophy. Pediatr Neurol 1996: 14:
7-12
2. Sasaki K, Sakata K, Kachi E, Hirata S, Ishihara T, Ishikawa K. Sequential changes in cardiac structure and function in patients with Duchenne type muscular dystro- phy: a two-dimensional echocardiographic study. Am Heart J 1998: 135: 937-944
3. Finder JD, Birnkrant D, Carl J, Farber HJ, Gozal D, Ian- naccone ST, et al. Respiratory care of the patient with Duchenne muscular dystrophy: ATS consensus statement.
Am J Respir Crit Care Med 2004: 170: 456-465
4. Bach JR, Ishikawa Y, Kim H. Prevention of pulmonary
morbidity for patients with Duchenne muscular dystrophy.
Chest 1997: 112: 1024-1028
5. Mei Z, Grummer-Strawn LM, Pietrobelli A, Goulding A, Goran MI, Dietz WH. Validity of body mass index com- pared with other body-composition screening indexes for the assessment of body fatness in children and adoles- cents. Am J Clin Nutr 2002: 75: 978-985
6. Malina RM, Katzmarzyk PT. Validity of the body mass index as an indicator of the risk and presence of over- weight in adolescents. Am J Clin Nutr 1999: 70: 131S- 136S
7. Johnston FE. Validity of triceps skinfold and relative weight as measures of adolescent obesity. J Adolesc Health Care 1985: 6: 185-190
8. Mohan M, Ghosh S, Ramanujacharyulu TK. Assessment of malnutrition by midarm circumference and its ratio to head circumference. Indian Pediatr 1980: 17: 503-506 9. Cereda E, Pusani C, Limonta D, Vanotti A. The association
of Geriatric Nutritional Risk Index and total lymphocyte count with short-term nutrition-related complications in institutionalised elderly. J Am Coll Nutr 2008: 27: 406- 413
10. Grzegorzewska AE, Leander M. Total lymphocyte count and subpopulation lymphocyte counts in relation to dietary intake and nutritional status of peritoneal dialysis patients.
Adv Perit Dial 2005: 21: 35-40
11. Carmel R. Nutritional anemias and the elderly. Semin Hematol 2008: 45: 225-234
12. James WP. Protein synthesis and breakdown and amino acid catabolism in protein-calorie malnutrition. Proc Nutr Soc 1972: 31: 225-231
13. Balmer SE, Rutishauser IH. Serum creatine kinase in mal- nutrition. J Pediatr 1968: 73: 783-787
14. Caravaca F, Dominguez C. Lean body mass as an index of nutrition in CAPD patients. Perit Dial Int 1994: 14: 407- 408
15. Garcia Sanchez I, Perez de Oteyza C, Calvo Lasso de la Vega E, Castuera Gil A. [Nutrition alterations in internal medicine. Body composition analysis with bioelectrical impedance]. Rev Clin Esp 2007: 207: 6-12
16. McCrory MA, Wright NC, Kilmer DD. Nutritional aspects of neuromuscular diseases. Phys Med Rehabil Clin N Am 1998: 9: 127-143
17. McDonald CM, Abresch RT, Carter GT, Fowler WM, Jr., Johnson ER, Kilmer DD, et al. Profiles of neuromuscular diseases. Duchenne muscular dystrophy. Am J Phys Med Rehabil 1995: 74: S70-92
18. Willig TN, Carlier L, Legrand M, Riviere H, Navarro J.
Nutritional assessment in Duchenne muscular dystrophy.
Dev Med Child Neurol 1993: 35: 1074-1082
19. Griffiths RD, Edwards RH. A new chart for weight control in Duchenne muscular dystrophy. Arch Dis Child 1988:
63: 1256-1258
20. Hankard R, Gottrand F, Turck D, Carpentier A, Romon M, Farriaux JP. Resting energy expenditure and energy sub- strate utilization in children with Duchenne muscular dys- trophy. Pediatr Res 1996: 40: 29-33
21. Edwards RH, Round JM, Jackson MJ, Griffiths RD, Lil- burn MF. Weight reduction in boys with muscular dystro- phy. Dev Med Child Neurol 1984: 26: 384-390
22. Okada K, Manabe S, Sakamoto S, Ohnaka M, Niiyama Y.
Protein and energy metabolism in patients with progres- sive muscular dystrophy. J Nutr Sci Vitaminol (Tokyo) 1992: 38: 141-154
23. Moon JH, Park YG, Park JS, Na YM, Kim YJ, Kang SW.
Clinical Profile of Duchenne Muscular Dystrophy. J Kore- an Acad Rehab Med 2001: 25: 241-248
24. Brooke MH, Griggs RC, Mendell JR, Fenichel GM, Shu- mate JB, Pellegrino RJ. Clinical trial in Duchenne dystro- phy. I. The design of the protocol. Muscle Nerve 1981: 4:
186-197
25. Kim DS, Park KH, Nam SO, Lee CH, Park KJ. Signifi- cance of Immunohistochemical Study in Patients with Muscular Dystrophy. J Korean Neurol Assoc 2004: 22:
613-622
26. Cho HN, Hong JM, Lee KA, Choi YC. Clinical Useful- ness of Molecular Diagnosis in Dystrophin Gene Muta- tions Using the Multiplex Ligation-dependent Probe Amplification (MLPA) Method. J Korean Neurol Assoc 2010: 28: 22-26
27. Beggs AH, Koenig M, Boyce FM, Kunkel LM. Detection of 98% of DMD/BMD gene deletions by polymerase chain reaction. Hum Genet 1990: 86: 45-48
28. Oh KW, Jang MJ, Lee NY, Moon JS, Lee CG, Yoo MH, et al. Prevalence and trends in obesity among Korean chil- dren and adolescents in 1997 and 2005. Korean J Pediatr 2008: 51: 950-955
29. Beck AM, Ovesen L, Osler M. The ‘Mini Nutritional Assessment’ (MNA) and the ‘Determine Your Nutritional
Health’ Checklist(NSI Checklist) as predictors of morbidity and mortality in an elderly Danish population. Br J Nutr 1999: 81: 31-36
30. Karsegard VL, Ferlay O, Maisonneuve N, Kyle UG, Dupertuis YM, Genton L, et al. [Simplified malnutrition screening tool: Malnutrition Universal Screening Tool (MUST)]. Rev Med Suisse Romande 2004: 124: 601-605 31. Cook Z, Kirk S, Lawrenson S, Sandford S. Use of BMI in
the assessment of undernutrition in older subjects: reflect- ing on practice. Proc Nutr Soc 2005: 64: 313-317
32. Eagle M, Baudouin SV, Chandler C, Giddings DR, Bul- lock R, Bushby K. Survival in Duchenne muscular dystro- phy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul Dis- ord 2002: 12: 926-929
33. Parker AE, Robb SA, Chambers J, Davidson AC, Evans K, O’Dowd J, et al. Analysis of an adult Duchenne muscu- lar dystrophy population. QJM 2005: 98: 729-736 34. Martigne L, Salleron J, Mayer M, Cuisset JM, Carpentier
A, Neve V, et al. Natural evolution of weight status in Duchenne muscular dystrophy: a retrospective audit. Br J Nutr 2011: 105: 1486-1491
35. Lesourd B. Protein undernutrition as the major cause of decreased immune function in the elderly: clinical and functional implications. Nutr Rev 1995: 53: S86-91: dis- cussion S92-84
36. Beard JL. Iron biology in immune function, muscle metab- olism and neuronal functioning. J Nutr 2001: 131: 568S- 579S: discussion 580S
37. Shankar AH, Prasad AS. Zinc and immune function: the biological basis of altered resistance to infection. Am J Clin Nutr 1998: 68: 447S-463S
38. Fraker PJ, King LE. Reprogramming of the immune sys- tem during zinc deficiency. Annu Rev Nutr 2004: 24: 277- 298
39. Rumsey SE, Hokin B, Magin PJ, Pond D. Macrocytosis-- an Australian general practice perspective. Aust Fam Physician 2007: 36: 571-572
40. Allsop KG, Ziter FA. Loss of strength and functional decline in Duchenne’s dystrophy. Arch Neurol 1981: 38:
406-411