난담반 단독제와 난담반과 죽염 혼합제 경구 투여의 독성 연구
최은아․이종훈․윤대환1․유화승*
대전대학교 둔산한방병원 동서암센터, 1 : 동신대학교 한의과대학 경혈학교실
Study on Oral Administration of Egg White Combined Chalcanthite and Bamboo-Salt with Egg White Combined Chalcanthite
Eun A Choi, Jong Hoon Lee, Dae Hwan Youn1, Hwa Seung Yoo*
East-West Cancer Center, College of Oriental Medicine, Daejeon University.
1 : Department of Meridian and Acupoint, College of Oriental Medicine, Dongshin University
Our former study indicated efficacy of apoptotic cell death on animal study by using Egg white combined Chalcanthite (EC). Clinically, bamboo salt is using because of safety. Hence we investigated a toxicity study for determining safety by adding bamboo salt in former materiel. We had two studies: toxicity of EC and of Bamboo salt with egg white combined Chalcanthite (BC). Both were studied in 1-week single and 5-week repeated oral dose toxicity tests on male Imprinting Control Region mice. In EC, doses used in 1 week single oral dose toxicity tests were 0, 0.05, 0.5, 5 and 50 mg/kg/day and 0, 0.01, 0.05, 0.25 and 0.5 mg/kg/day. In BC, doses used by 0, 0.08, 8.3, 83.3 and 166.6 mg/kg/day in single oral dose toxicity and 0, 4.2, 8.3, 41.7 and 83.3 mg/kg/day in repeated oral dose toxicity tests. Their blood and urine were assayed and organ morphology were examined. Mann-Whitney U test and ANOVA tests were used by analysing methods. First, significant increased left renal weight in all groups of EC and BC.
Second, increased ALT score was found in EC-S2 and increased relative liver weight was found in EC-S3. In addition, increased relative weight and urine bilirubin and urobilinogen were found in EC-R2 and EC-R3. There was no significant toxic change in BC. The Mixture of EC had a possibility of hepatotoxicity in the short and long term.
Processed BC appears to be safe and non-toxic in these studies and a no-observed adverse effect level (NOAEL) was established at 83.3 mg/kg/day in mice. Relatively, The BC were safer than The EC.
Key words : chalcanthite, bamboo-salt, toxicity, egg white, dan fan, damban
* 교신저자 : 유화승, 대전시 서구 둔산동 1136, 둔산한방병원 동서암센터
․E-mail : altyhs@dju.kr, ․Tel : 042-470-9132
․접수 : 2012/01/20 ․수정 : 2012/02/13 ․채택 : 2012/03/20
서 론
담반이란 결정수를 5분자 지닌 황산구리의 결정
CuSO
4·5H
2O인 밀도 2.286 g/㎤의 청색의 수용성 삼사정계 (Triclinic) 황산구리에 해당하는 천연 광물 Chalcanthite로, 최토, 거부, 해독작용이 있다고 기재되어 있다
1-4). 담반의 처방례는 중 약대사전에 13건이 나오는데 그 중 외용으로 바르는 것이 10건 이며, 함수가 1건, 목구멍에 불어넣는 것이 1건, 내복은 중풍탄탄 에 1건에 불과하여 주로 외용약으로 사용하여 종독을 치료하는 예가 주를 이룬다
3).
교과서에 기재되어 있는 담반의 주 생산지는 운남, 산서, 강 서, 광동, 협서 감숙성 등 중국의 여러 지역으로 나와 있으나
4), 실제 담반의 주 광물인 Chalcanthite는 지중해 연안국과 남미, 미 국 등 세계 여러 나라에 널리 분포되어 있다
2,5). 주요 성분은 SO
3, CuO, H
2O지만 실제 광석에는 Fe
2O
3와 같은 형태로 철, 망간 코 발트와 같은 미량의 다른 광물 성분이 존재한다
5,6).
담반에 대한 연구는 현재까지 미비한 상태이다. Pubmed에 서 2011년 11월 현재 담반의 중국 명칭인 Dan-fan 및 Danfan으 로는 검색되지 않았고, 라틴어명인 Chalcanthitum으로 0건, 영어 명인 Chalcanthite로 3건의 논문이 검색되고 있다
7-9). 그러나 이 3 건의 논문은 모두 2000년 이전의 논문인데다가 광물학적 내용만 을 담아 의학적인 의미를 부여할 수는 없다.
난담반이란 이러한 광물성 약재인 담반을 열처리하여 얻은
고담반을 난백과 결합하여 만들 물질이다. 임상에서 난담반을 사
용할 경우 난담반 단독으로 사용하지 않고 죽염을 혼합하여 사 용하는데, 이는 죽염이 난담반의 생체 내에서의 작용을 돕는 것 으로 추측되고 있다
10).
죽염은 천일염을 왕대나무 통에 넣고 황토로 입구를 봉한 뒤, 가마에 넣고 작장불로 구운 다음 얻은 소금 기둥을 분쇄하여 다시 통에 넣고 굽기를 9회 반복하여 얻은 소금이며 제조 과정 중 마지막에 1400도 이상의 고온으로 가열하여 용해된 액상의 소금을 굳혀 분쇄하여 사용하는 것이 특징이다
11,12). 죽염은 예로 부터 전해오는 민간약재로, 소금 그 자체는 의학입문, 동의보감 등 여러 약서에 식염으로 기재되어 있으나 죽염으로 기재된 의 서는 존재하지 않는다. 그 이전에도 여러 형태로 국내에 존재하 였을 것이라 추정되나 죽염이라는 명칭 자체가 1981년에 붙여진 명칭이기 때문이다
11).
죽염은 담반에 비하여 비교적 많은 연구가 이루어져 있다.
역시 2011년 11월 현재 Pubmed에서 Bamboo salt로 22건, Bamboo-salt로 10건의 논문이 검색되며(중복 있음), 특히 10건의 논문은 모두 국내 연구자에 의하여 이루어졌다
13-22). 국내논문은 국회전자도서관에서 55건 검색할 수 있었다. 국제논문은 연구 내 용이 다양한 데 비하여, 국내 논문은 치약의 내용물로서의 죽염 과 식품으로서의 죽염의 활용 방안에 관계된 내용이 다수를 차 지하고 있는 것이 특징이었다. 한의계의 논문은 6건이었다
2,23-27). 위의 10건의 국제논문으로 나타난 죽염의 효능은 항염작용, 면역 반응조절, 면역증진, 약침 상태에서의 cisplatin의 부작용 감소, 항 돌연변이 효과, 치아손상복원이 있다. 한편, 국내논문 중 죽염 의 독성에 관한 동물 실험이 있는데, Single oral dose toxicity 실 험에서 수컷에서 4174 mg/kg, 암컷에서 4898 mg/kg의 LD50을 나타내며 3000 mg/kg/day의 Repeated toxicity 에서의 무독성 이 보고되고 있다
28,29).
본 연구는 난담반과 난담반과 죽염의 혼합물의 독성을 동물 실험으로 확인하였다. 이전 연구에서 세포 단계에서의 난담반의 세포자살유도 효능을 연구하였는데, 이번에는 이전 연구에서 사 용된 난담반의 독성과 실제 임상에서 사용되는 난담반과 죽염의 혼합물의 독성을 연구하여 임상에 응용이 되고자 한다.
재료 및 방법
본 연구는 난담반의 독성 실험(Egg white combined Chalcanthite; EC)과 난담반과 죽염 혼합물에 대한 독성 실험 (Bamboo salt with egg white combined Chalcanthite; BC)의 두 단계로 구성되어 있다.
1. 실험재료 1) 실험 동물
체중 40 g 내외의 ICR계 웅성 mouse를 사용하였고 EC 실험 동물은 대한실험동물센타에서, BC 실험 동물은 셈타코(서울, 한 국)에서 구입하여 사육실에 도착한 후 실험실 환경을 온도는 21±5 ℃, 습도는 60±10%로 조절하여 적응시킨 후 이용하였다. 1 주 동안 고형사료와 물을 충분히 주며 실험실 환경에 적응시킨
후 사용하였다.
2) 실험 물질 제조
EC 실험에는 난담반 100 g을 80 ℃에서 6시간 동안 끓인 다 음 3,000×g의 속도로 30 min동안 centrifugation시킨 후 supernatants를 lyophilize하여 검액으로 사용하였다. BC 실험에 는 난담반과 죽염을 15:1로 배합하여 60 kg성인 기준 5 g/day용량 을 기준으로 각각 농도별로 증류수에 희석하여 구강 투여하였다.
2. 방법
EC, BC 모두 ICR 웅성 마우스로 1주일간의 Single oral dose toxicity와 5주일간의 Repeated oral dose toxicity를 진행하였다.
각각의 실험은 다섯 군으로 이루어지며, 한 군에는 다섯 마리의 실험 동물을 배정하였다. 두 실험 중 각각의 Single oral dose toxicity와 Repeated oral dose toxicity는 방법이 같으며, 검액의 용량에만 차이가 있다.
1) 실험군 분리
(1) EC Single oral dose toxicity 군 분리
군 분리는 검액을 0 mg/kg/day 구강투여군(EC-S1, n=5), 0.05 mg/kg/day 구강투여군(EC-S2, n=5), 0.5 mg/kg/day 구강 투여군(EC-S3, n=5), 5 mg/kg/day 구강투여군(EC-S4, n=5), 50 mg/kg/day 구강투여군(EC-S5, n=5)으로 나누었으며, 투여 방법 은 검액을 동물 음용수에 섞어 zonde를 사용하여 1회 구강 투여 하였다.
(2) EC Repeated oral dose toxicity 군 분리
군 구성은 난담반 시료를 0 mg/kg/day 구강투여군(EC-R1, n=5), 0.01 mg/kg/day 구강투여군(EC-R2, n=5), 0.05 mg/kg/day 구강투여군(EC-R3, n=5), 0.25 mg/kg/day 구강투 여군(EC-R4, n=5), 0.5 mg/kg/day 구강투여군(EC-R5, n=5)으로 나누었으며, 투여 방법은 검액을 동물 음용수에 섞어 zonde를 사용하여 5주간 매일 1회씩 구강 투여하였다.
(3) BC Single oral dose toxicity 군 분리
군 분리는 검액을 0 mg/kg/day 구강투여군(BC-S1, n=5), 0.08 mg/kg/day 구강투여군(BC-S2, n=5), 8.3 mg/kg/day 구강 투여군(BC-S3, n=5), 83.3 mg/kg/day 구강투여군(BC-S4, n=5), 166.6 mg/kg/day 구강투여군(BC-S5, n=5)으로 나누었으며, 투 여 방법은 검액을 동물 음용수에 섞어 zonde를 사용하여 1회 구 강 투여하였다.
(4) BC Repeated oral dose toxicity 군 분리
군 구성은 검액을 0 mg/kg/day 구강투여군(BC-R1, n=5), 4.2 mg/kg/day 구강투여군(BC-R2, n=5), 8.3 mg/kg/day 구강 투여군(BC-R3, n=5), 41.7 mg/kg/day 구강투여군(BC-R4, n=5), 83.3 mg/kg/day 구강투여군(BC-R5, n=5)으로 나누었으며, 투여 방법은 검액을 동물 음용수에 섞어 zonde를 사용하여 5주간 매 일 1회씩 구강 투여하였다.
2) Single oral dose toxicity (1) 육안 관찰 및 체중 측정
검액 투여 30분 후부터 8시간까지 매시간 그리고 투여 다
음날부터 일주일까지는 매일 1회씩 일반증상 및 사망 여부를 관
찰하였으며, 실험 종료(1주 경과)시 생존동물은 체중을 측정하고 눈의 외관상 각막 손상 등의 안구증상을 육안으로 관찰하였다.
(2) 혈액학적 검사 및 부검
육안 관찰과 체중 측정을 한 후 urethane(25%)으로 마취시 켜 외관검사를 실시한 후 심장천자법으로 채혈하여, 채혈한 혈액 은 자동혈구 계수기(HEMAVET 950, USA)를 이용하여 혈액학적 검사를, 생화학분석기(DRI-CHEM 4000i, Fuji)를 이용하여 혈액 생화학적 검사를 시행하였으며, 채혈 후 잔여 혈액에 대해 방혈 치사 후 부검을 실시하여 심장, 간, 신장, 비장, 고환, 뇌, 폐에 대 한 장기무게를 측정 기록하였다.
3) Repeated toxicity (1) 일반증상 관찰
시험기간 동안 매일 일반상태의 변화, 운동성, 외관, 자율신 경 등의 일반증상을 관찰하여 기록하였다.
(2) 안과학적 검사
안과학적 검사는 시험 종료 마지막 주에 눈의 외관상 각막 손상 등의 안구증상을 육안으로 관찰하였다.
(3) 체중의 변화
체중은 시험물질 투여개시 직전, 투여 개시 후 주 1회씩 그 리고 부검 전에 절식시 체중을 측정하였다.
(4) 부검
부검 시에 모든 시험군의 생존 동물에 대하여,
urethane(25%) 마취 하에서 채혈한 후 남은 혈액을 방혈하는 방 식으로 동물을 희생시켜 부검을 실시하였으며, 장기에 대한 육안 이상소견 유무를 확인하였다.
(5) 장기중량 측정
투여 및 시험 종료 시까지 생존해 있는 모든 동물에 대해 부 검을 실시하여 심장, 간, 신장, 비장, 고환, 뇌, 폐에 대한 장기무 게를 측정 기록하였다.
(6) 혈액학적 검사
모든 실험동물에 대하여 부검 전 심장천자법으로 채혈하여 실시하였으며, 자동혈구 계수기(HEMAVET 950, USA)를 이용하 여 총 적혈구수(Total erythrocyte count, RBC), 혈색소량 (Hemoglobin, Hb), 헤마토크리트치(Hematocrit, HCT), 평균적혈 구용적(Mean cell volume, MCV), 평균 적혈구 헤모글로빈 량 (Mean cell hemoglobin, MCH), 평균 적혈구 헤모글로빈 농도 (Mean cell hemoglobin concentration, MCHC), 총 백혈구 수 (Total leukocyte count, WBC) 및 혈소판 수(Platelet, PLT)를 측 정하였다.
(7) 혈액생화학적 검사
채혈한 전혈 일부를 vacutainer tube(vacutainer, Greiner bio-one, Austria)를 이용하여 3,000 rpm으로 15분간 원심분리한 후 혈청을 분리한 후, total protein, albumin, A/G ratio, creatinine, BUN, total cholesterol, triglyceride, AST, ALT 등을 생화학분석기(DRI-CHEM 4000i, Fuji)를 이용하여 측정하였다.
(8) 뇨검사
뇨검사는 시험 종료 마지막 주에 SIEMENS Multistix 10SG(Not. 9G27C, USA) REF 2300(03536597) 스트립과 뇨 측정
기(Clinitek STATUS, USA)를 이용하여 glucose, bilirubin, specific gravity, blood, pH, urobilinogen, nitrite, leukocyte를 측 정하였다.
3. 통계처리
본 시험의 체중, 사료․음수 섭취량, 혈액 및 혈액생화학적 검사, 장기중량 측정에서 얻어진 모든 자료에 대해서 Mann-Whitney U-test와 one way ANOVA test를 Window용 SPSS(Ver 10.1, SPSS)를 이용하여 수행하였으며, P0.05의 신뢰구 간에서 통계적 유의성을 부여하였다.
결 과
1. 난담반 단독 투여군의 Single oral dose toxicity 1) 사망률과 일반증상
시험기간 동안 모든 시험군에서 빈사 및 폐사 동물의 발생, 검액 투여에 의한 일반증상과 안과학적 증상은 관찰되지 않았다.
2) 체중 및 장기 무게
Absolute organ weights에서는 대조군(EC-S1)에 비해, EC-S2군과 EC-S3군은 간 무게가 유의하게 증가하였고, EC-S4군 에서는 체중, 뇌 무게 및 심장 무게가 유의하게 감소하였고, EC-S5군에서는 체중과 뇌 무게는 유의하게 감소하였지만, 비장 무게와 폐 무게는 유의하게 증가하였다(P≤0.05). Relative organ weights에서는 대조군(EC-S1)에 비해, EC-S2군에서는 간 무게가 유의하게 증가하였고, EC-S5군에서는 비장 무게, 폐 무게 및 심 장 무게가 유의하게 증가하였다(P≤0.05)(Table 1).
3) 혈액학적 관찰
대조군(EC-S1)에 비해, EC-S2군에서는 Hb와 PLT이 유의하 게 증가하였으며, EC-S3군에서는 WBC, RBC, Hb, HCT, PLT이 유의하게 증가하였으며, S3군에서는 WBC, PLT가 유의하게 증가 하였으며, EC-S4군에서는 WBC, PLT가 유의하게 증가하였으며, EC-S5군에서는 WBC, MCHC가 유의하게 증가하였다(P≤
0.05)(Table 2).
4) 혈액생화학적 관찰
대조군(EC-S1)에 비해, EC-S2군에서는 Total protein이 유의 하게 감소하였고, A/G ration과 Creatinine이 유의하게 증가하였 고, EC-S3군에서는 Total protein과 BUN이 유의하게 감소하였 고, ALT가 증가하였다. EC-S4군에서는 Total protein, Albumin, BUN 및 Triglycerides가 유의하게 감소하였고, A/G ratio는 유 의하게 증가하였고, EC-S5군에서는 Total protein이 유의하게 감 소하였고, A/G ration과 Creatinine이 유의하게 증가하였다(P≤
0.05)(Table 3).
2. 난담반 단독 투여군의 Repeated toxicity 1) 사망률과 일반증상
시험기간 동안 모든 시험군에서 빈사 및 폐사 동물의 발생, 검액 투여에 의한 일반증상과 안과학적 증상은 관찰되지 않았다.
2) 체중의 변화
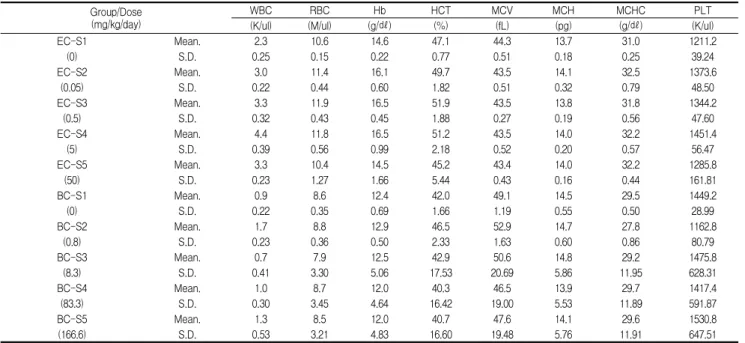
Table 1. Relative organ weights of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 1 week
Group/ Dose (mg/kg/day) Body weight Liver Kidney
Spleen Testis
Brain Lung Heart
Lt. Rt. Lt. Rt.
(g) (%) (%) (%) (%) (%) (%) (%) (%) (%)
EC-S1 Mean. 34.8 4.1 0.6 0.6 0.3 0.3 0.3 1.3 0.4 0.4
(0) S.D. 0.45 0.25 0.05 0.08 0.03 0.12 0.01 0.06 0.02 0.03
EC-S2 Mean. 34.8 4.8 0.6 0.7 0.3 0.3 0.3 1.1 0.4 0.4
(0.05) S.D. 1.30 0.16 0.04 0.16 0.03 0.09 0.04 0.37 0.06 0.08
EC-S3 Mean. 34.4 4.6 0.6 0.6 0.3 0.3 0.3 1.3 0.4 0.4
(0.5) S.D. 1.52 0.22 0.04 0.06 0.05 0.06 0.07 0.06 0.04 0.06
EC-S4 Mean. 33.6 4.4 0.6 0.6 0.3 0.3 0.3 1.3 0.5 0.3
(5) S.D. 0.55 0.19 0.04 0.03 0.01 0.05 0.05 0.08 0.09 0.02
EC-S5 Mean. 33.0 4.4 0.8 0.8 0.4 0.3 0.3 1.3 0.6 0.5
(50) S.D. 1.22 0.25 0.15 0.11 0.09 0.06 0.05 0.05 0.13 0.12
BC-S1 Mean. 33.8 3.7 0.8 0.8 0.3 0.3 0.3 1.4 0.5 0.4
(0) S.D. 1.10 0.24 0.05 0.06 0.03 0.01 0.02 0.06 0.12 0.03
BC-S2 Mean. 33.8 3.7 0.8 0.8 0.4 0.3 0.3 1.4 0.5 0.4
(0.8) S.D. 1.10 0.13 0.04 0.07 0.07 0.02 0.02 0.07 0.03 0.03
BC-S3 Mean. 32.8 3.7 0.8 0.9 0.3 0.3 0.3 1.5 0.6 0.5
(8.3) S.D. 1.48 0.31 0.06 0.08 0.06 0.03 0.04 0.08 0.07 0.06
BC-S4 Mean. 32.8 3.8 0.9 0.9 0.3 0.3 0.3 1.5 0.6 0.4
(83.3) S.D. 1.92 0.16 0.08 0.10 0.05 0.04 0.05 0.10 0.05 0.04
BC-S5 Mean. 33.2 3.8 0.9 0.6 0.4 0.3 0.3 1.5 0.6 0.4
(166.6) S.D. 1.48 0.32 0.10 0.06 0.07 0.03 0.05 0.08 0.06 0.01
Number of each groups = 5. EC-S=Egg combined Chalcanthite, Single oral toxicity group. BC-S=Bamboo-salt with egg combined Chalcanthite, Single oral toxicity group
Table 2. Hematological values of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 1 week
Group/Dose
(mg/kg/day) WBC RBC Hb HCT MCV MCH MCHC PLT
(K/ul) (M/ul) (g/㎗) (%) (fL) (pg) (g/㎗) (K/ul)
EC-S1 Mean. 2.3 10.6 14.6 47.1 44.3 13.7 31.0 1211.2
(0) S.D. 0.25 0.15 0.22 0.77 0.51 0.18 0.25 39.24
EC-S2 Mean. 3.0 11.4 16.1 49.7 43.5 14.1 32.5 1373.6
(0.05) S.D. 0.22 0.44 0.60 1.82 0.51 0.32 0.79 48.50
EC-S3 Mean. 3.3 11.9 16.5 51.9 43.5 13.8 31.8 1344.2
(0.5) S.D. 0.32 0.43 0.45 1.88 0.27 0.19 0.56 47.60
EC-S4 Mean. 4.4 11.8 16.5 51.2 43.5 14.0 32.2 1451.4
(5) S.D. 0.39 0.56 0.99 2.18 0.52 0.20 0.57 56.47
EC-S5 Mean. 3.3 10.4 14.5 45.2 43.4 14.0 32.2 1285.8
(50) S.D. 0.23 1.27 1.66 5.44 0.43 0.16 0.44 161.81
BC-S1 Mean. 0.9 8.6 12.4 42.0 49.1 14.5 29.5 1449.2
(0) S.D. 0.22 0.35 0.69 1.66 1.19 0.55 0.50 28.99
BC-S2 Mean. 1.7 8.8 12.9 46.5 52.9 14.7 27.8 1162.8
(0.8) S.D. 0.23 0.36 0.50 2.33 1.63 0.60 0.86 80.79
BC-S3 Mean. 0.7 7.9 12.5 42.9 50.6 14.8 29.2 1475.8
(8.3) S.D. 0.41 3.30 5.06 17.53 20.69 5.86 11.95 628.31
BC-S4 Mean. 1.0 8.7 12.0 40.3 46.5 13.9 29.7 1417.4
(83.3) S.D. 0.30 3.45 4.64 16.42 19.00 5.53 11.89 591.87
BC-S5 Mean. 1.3 8.5 12.0 40.7 47.6 14.1 29.6 1530.8
(166.6) S.D. 0.53 3.21 4.83 16.60 19.48 5.76 11.91 647.51
Number of each groups = 5. EC-S=Egg combined Chalcanthite, Single oral toxicity group. BC-S=Bamboo-salt with egg combined Chalcanthite, Single oral toxicity group.
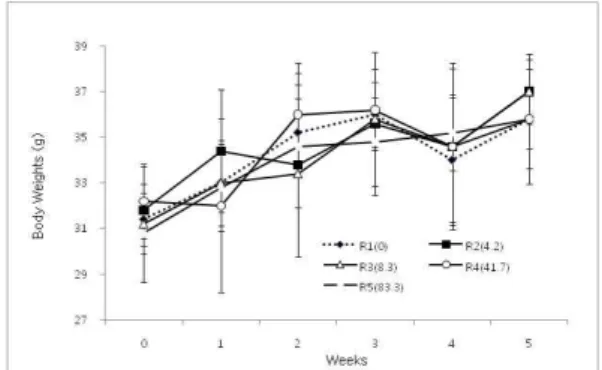
대조군(EC-R1)에 비해, EC-R2군에서 3주째에 유의하게 감소 하였지만(P≤0.05), 대체적으로 5주 동안 일반적인 체중증가가 관찰되었다(Fig 1).
3) 체중 및 장기 무게
Absolute organ weights에서는 대조군(EC-R1)에 비해, 체중 은 모든 실험군에서 유의한 변화는 없었으며, EC-R2군은 간 무 게, 좌측 신장 무게, 비장 무게 및 폐 무게가 유의하게 증가하였 고, EC-R3군은 간 무게, 좌측 신장 무게 및 비장 무게가 유의하 게 증가하였고, EC-R4군은 좌측 신장 무게 및 폐 무게가 유의하
게 증가하였고, EC-R5군은 좌측 신장 무게 뇌 무게 및 폐 무게가 유의하게 증가하였다(P≤0.05). Relative organ weights에서는 대 조군(EC-R1)에 비해, EC-R2군과 EC-R3군은 간 무게, 좌측 신장 무게 및 비장 무게가 유의하게 증가하였고, EC-R4군은 폐 무게 가 유의하게 증가하였고, EC-R5군은 간 무게, 좌측 신장 무게 및 폐 무게가 유의하게 증가하였다(P≤0.05)(Table 4).
4) 혈액학적 관찰
대조군(EC-R1)에 비해, EC-R4군에서는 MCV가 유의하게 감
소하였으며, EC-R5군에서는 RBC가 유의하게 증가하였으며,
Table 3. Blood Chemical values of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 1 week
Group/Dose (mg/kg/day) Total
protein Albumin A/G ration Creati-nine BUN Total cholesterol Triglyc-erides AST ALT
(g/dl) (g/dl) (mg/dl) (mg/dl) (mg/dl) (mg/dl) (U/L) (U/L)
EC-S1 Mean. 5.6 2.8 1.0 0.2 33.3 104.6 149.4 110.6 54.4
(0) S.D. 0.17 0.08 0.03 0.03 3.39 6.93 16.48 15.70 10.97
EC-S2 Mean. 5.2 2.6 1.0 0.2 32.0 104.2 199.8 102.0 50.2
(0.05) S.D. 0.12 0.08 0.01 0.03 0.39 12.16 19.15 8.40 6.76
EC-S3 Mean. 4.9 2.2 0.8 0.2 24.4 89.4 144.0 147.0 103.4
(0.5) S.D. 0.11 0.48 0.22 0.00 1.04 4.02 10.03 13.96 23.44
EC-S4 Mean. 4.8 2.5 1.1 0.2 25.2 94.0 98.8 113.2 54.4
(5) S.D. 0.08 0.04 0.04 0.00 0.74 2.55 14.42 20.50 11.07
EC-S5 Mean. 4.6 2.5 1.1 0.3 35.5 90.2 156.8 89.8 55.4
(50) S.D. 0.20 0.15 0.06 0.07 2.09 5.65 11.57 14.36 7.37
BC-S1 Mean. 4.9 2.4 1.0 0.1 30.1 135.2 165.4 109.2 30.0
(0) S.D. 0.13 0.12 0.06 0.00 4.08 26.37 9.91 15.53 4.36
BC-S2 Mean. 5.3 2.8 1.2 0.1 30.1 140.4 148.2 116.4 32.0
(0.8) S.D. 0.25 0.22 0.11 0.00 6.48 10.55 48.50 20.62 13.47
BC-S3 Mean. 5.1 2.5 1.0 0.1 25.6 130.6 115.6 103.8 32.6
(8.3) S.D. 2.06 1.04 0.41 0.00 10.63 56.82 62.81 44.70 16.36
BC-S4 Mean. 4.9 2.5 1.1 0.2 45.0 121.6 115.2 120.4 33.2
(83.3) S.D. 1.99 1.01 0.37 0.00 21.08 51.54 69.04 51.64 15.55
BC-S5 Mean. 5.0 2.5 1.0 0.1 26.3 132.2 96.8 114.0 35.2
(166.6) S.D. 1.63 0.98 0.38 0.02 11.85 55.63 45.87 49.77 14.67
Number of each groups = 5. EC-S=Egg combined Chalcanthite, Single oral toxicity group. BC-S=Bamboo-salt with egg combined Chalcanthite, Single oral toxicity group.
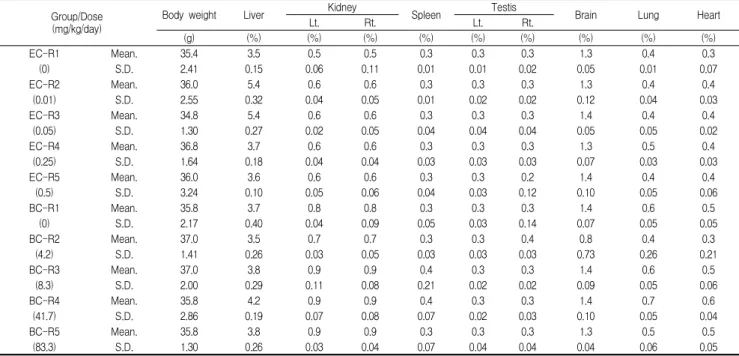
Table 4. Relative organ weights of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 5 weeks
Group/Dose
(mg/kg/day) Body weight Liver Kidney
Spleen Testis
Brain Lung Heart
Lt. Rt. Lt. Rt.
(g) (%) (%) (%) (%) (%) (%) (%) (%) (%)
EC-R1 Mean. 35.4 3.5 0.5 0.5 0.3 0.3 0.3 1.3 0.4 0.3
(0) S.D. 2.41 0.15 0.06 0.11 0.01 0.01 0.02 0.05 0.01 0.07
EC-R2 Mean. 36.0 5.4 0.6 0.6 0.3 0.3 0.3 1.3 0.4 0.4
(0.01) S.D. 2.55 0.32 0.04 0.05 0.01 0.02 0.02 0.12 0.04 0.03
EC-R3 Mean. 34.8 5.4 0.6 0.6 0.3 0.3 0.3 1.4 0.4 0.4
(0.05) S.D. 1.30 0.27 0.02 0.05 0.04 0.04 0.04 0.05 0.05 0.02
EC-R4 Mean. 36.8 3.7 0.6 0.6 0.3 0.3 0.3 1.3 0.5 0.4
(0.25) S.D. 1.64 0.18 0.04 0.04 0.03 0.03 0.03 0.07 0.03 0.03
EC-R5 Mean. 36.0 3.6 0.6 0.6 0.3 0.3 0.2 1.4 0.4 0.4
(0.5) S.D. 3.24 0.10 0.05 0.06 0.04 0.03 0.12 0.10 0.05 0.06
BC-R1 Mean. 35.8 3.7 0.8 0.8 0.3 0.3 0.3 1.4 0.6 0.5
(0) S.D. 2.17 0.40 0.04 0.09 0.05 0.03 0.14 0.07 0.05 0.05
BC-R2 Mean. 37.0 3.5 0.7 0.7 0.3 0.3 0.4 0.8 0.4 0.3
(4.2) S.D. 1.41 0.26 0.03 0.05 0.03 0.03 0.03 0.73 0.26 0.21
BC-R3 Mean. 37.0 3.8 0.9 0.9 0.4 0.3 0.3 1.4 0.6 0.5
(8.3) S.D. 2.00 0.29 0.11 0.08 0.21 0.02 0.02 0.09 0.05 0.06
BC-R4 Mean. 35.8 4.2 0.9 0.9 0.4 0.3 0.3 1.4 0.7 0.6
(41.7) S.D. 2.86 0.19 0.07 0.08 0.07 0.02 0.03 0.10 0.05 0.04
BC-R5 Mean. 35.8 3.8 0.9 0.9 0.3 0.3 0.3 1.3 0.5 0.5
(83.3) S.D. 1.30 0.26 0.03 0.04 0.07 0.04 0.04 0.04 0.06 0.05
Number of each groups = 5. EC-R=Egg combined Chalcanthite, Repeated oral toxicity group. BC-R=Bamboo-salt with egg combined Chalcanthite, Repeated oral toxicity group.
MCH와 MCHC은 유의하게 감소하였다(P≤0.05)(Table 5).
5) 혈액생화학적 관찰
대조군(EC-R1)에 비해, EC-R2군에서는 Creatinine, Total cholesterol 및 Triglycerides가 유의하게 증가하였으며, GPT는 유 의하게 감소하였으며, EC-R3군에서는 BUN이 유의하게 감소하였 으며, Triglycerides는 유의하게 증가하였다(P≤0.05)(Table 6).
6) 뇨검사
대조군(EC-R1)에 비해, EC-R2군에서는 GLU, BIL, BLO, pH,
UGO, NIT, LEU에서 변화가 있었으며, EC-R3군에서는 GLU, BIL, SG, pH, UGO에서 변화가 있었으며, EC-R4군에서는 BIL, pH에서 변화가 있었으며, EC-R5군에서는 GLU, BLO, pH, NIT, LEU에서 변화가 있었다.
3. 난담반과 죽염 혼합물의 Single oral dose toxicity 1) 사망률과 일반증상
시험기간 동안 모든 실험군에서 빈사 및 폐사 동물의 발생,
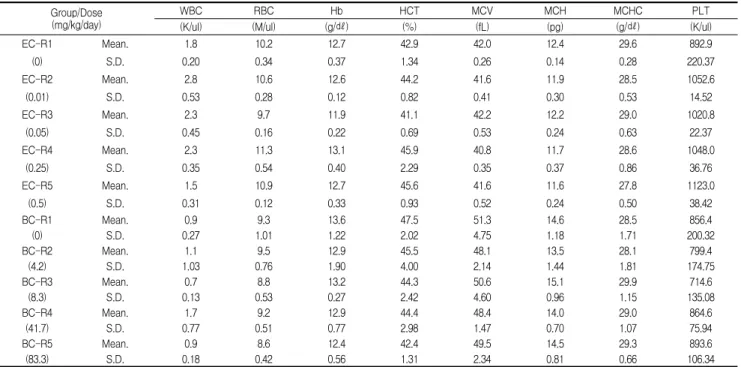
Table 5. Hematological values of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 5 weeks
Group/Dose (mg/kg/day)
WBC RBC Hb HCT MCV MCH MCHC PLT
(K/ul) (M/ul) (g/㎗) (%) (fL) (pg) (g/㎗) (K/ul)
EC-R1 Mean. 1.8 10.2 12.7 42.9 42.0 12.4 29.6 892.9
(0) S.D. 0.20 0.34 0.37 1.34 0.26 0.14 0.28 220.37
EC-R2 Mean. 2.8 10.6 12.6 44.2 41.6 11.9 28.5 1052.6
(0.01) S.D. 0.53 0.28 0.12 0.82 0.41 0.30 0.53 14.52
EC-R3 Mean. 2.3 9.7 11.9 41.1 42.2 12.2 29.0 1020.8
(0.05) S.D. 0.45 0.16 0.22 0.69 0.53 0.24 0.63 22.37
EC-R4 Mean. 2.3 11.3 13.1 45.9 40.8 11.7 28.6 1048.0
(0.25) S.D. 0.35 0.54 0.40 2.29 0.35 0.37 0.86 36.76
EC-R5 Mean. 1.5 10.9 12.7 45.6 41.6 11.6 27.8 1123.0
(0.5) S.D. 0.31 0.12 0.33 0.93 0.52 0.24 0.50 38.42
BC-R1 Mean. 0.9 9.3 13.6 47.5 51.3 14.6 28.5 856.4
(0) S.D. 0.27 1.01 1.22 2.02 4.75 1.18 1.71 200.32
BC-R2 Mean. 1.1 9.5 12.9 45.5 48.1 13.5 28.1 799.4
(4.2) S.D. 1.03 0.76 1.90 4.00 2.14 1.44 1.81 174.75
BC-R3 Mean. 0.7 8.8 13.2 44.3 50.6 15.1 29.9 714.6
(8.3) S.D. 0.13 0.53 0.27 2.42 4.60 0.96 1.15 135.08
BC-R4 Mean. 1.7 9.2 12.9 44.4 48.4 14.0 29.0 864.6
(41.7) S.D. 0.77 0.51 0.77 2.98 1.47 0.70 1.07 75.94
BC-R5 Mean. 0.9 8.6 12.4 42.4 49.5 14.5 29.3 893.6
(83.3) S.D. 0.18 0.42 0.56 1.31 2.34 0.81 0.66 106.34
Number of each groups = 5. EC-R=Egg combined Chalcanthite, Repeated oral toxicity group. BC-R=Bamboo-salt with egg combined Chalcanthite, Repeated oral toxicity group.
Table 6. Blood Chemical values of mice treated with Egg white combined Chalcanthite and Bamboo-salt with Egg white combined Chalcanthite for 5 weeks
Group/Dose (mg/kg/day)
Total
protein Albumin A/G
ratio Creatin-ine BUN Total cholesteroll Triglycer-ides AST ALT
(g/dl) (g/dl) (mg/dl) (mg/dl) (mg/dl) (mg/dl) (U/L) (U/L)
EC-R1 Mean. 5.0 2.4 1.0 0.2 36.6 64.6 111.6 106.8 51.4
(0) S.D. 0.15 0.11 0.04 0.04 2.30 4.75 10.05 15.25 4.18
EC-R2 Mean. 4.9 2.4 1.0 0.7 32.3 78.4 209.6 73.8 30.0
(0.01) S.D. 0.12 0.08 0.04 0.06 1.01 3.95 14.08 5.32 2.69
EC-R3 Mean. 4.8 2.3 1.0 0.2 27.4 71.8 144.4 108.2 58.4
(0.05) S.D. 0.08 0.04 0.02 0.04 1.05 5.58 11.63 6.92 10.66
EC-R4 Mean. 5.3 2.6 0.9 0.2 41.5 74.0 109.6 108.2 44.4
(0.25) S.D. 0.11 0.07 0.04 0.04 1.27 3.43 5.22 6.94 7.50
EC-R5 Mean. 5.1 2.5 0.9 0.2 34.2 65.8 91.4 102.0 66.6
(0.5) S.D. 0.09 0.08 0.04 0.04 2.20 3.11 6.65 9.12 19.08
BC-R1 Mean. 5.1 2.6 1.0 0.1 34.0 133.6 70.4 106.4 35.0
(0) S.D. 0.08 0.07 0.05 0.00 9.89 16.68 73.71 22.38 9.43
BC-R2 Mean. 5.2 2.7 1.1 0.1 29.1 128.8 75.4 92.8 27.0
(4.2) S.D. 0.09 0.08 0.08 0.00 8.87 17.85 28.16 22.77 5.57
BC-R3 Mean. 4.9 2.5 1.0 0.1 30.7 119.4 59.4 107.2 32.0
(8.3) S.D. 0.20 0.05 0.09 0.00 9.68 13.96 8.79 23.15 9.41
BC-R4 Mean. 4.9 2.5 1.0 0.1 24.7 118.6 82.2 93.4 31.2
(41.7) S.D. 0.20 0.10 0.00 0.04 3.13 10.90 4.76 9.21 3.90
BC-R5 Mean. 5.0 2.5 1.0 0.1 27.4 129.4 98.8 90.4 29.8
(83.3) S.D. 0.27 0.16 0.06 0.00 3.18 28.60 22.51 28.04 2.17
Number of each groups = 5. EC-R=Egg combined Chalcanthite, Repeated oral toxicity group. BC-R=Bamboo-salt with egg combined Chalcanthite, Repeated oral toxicity group.
검액 투여에 의한 일반증상과 안과학적 증상은 관찰되지 않았다.
2) 체중 및 장기 무게
Absolute organ weights에서는 대조군(BC-S1)에 비해, BC-S4군에서 좌측 고환은 유의하게 감소하였지만 뇌의 무게는 유의하게 증가하였고, BC-S5군에서는 우측 신장이 유의하게 감 소하였다(P≤0.05)(Fig 2). Relative organ weights에서는 대조군 (BC-S1)에 비해, BC-S5군에서는 좌측 신장과 뇌의 무게가 유의하 게 증가한 반면에 우측 신장 무게가 유의하게 감소하였다(P≤
0.05)(Table 1).
3) 혈액학적 관찰
대조군(BC-S1)에 비해, BC-S2군에서 WBC, HCT, MCV가 유 의하게 증가하였으나, MCHC, PLT가 유의하게 감소하였고, BC-S4군에서는 MCV가 유의하게 감소하였다(P≤0.05)(Table 2).
4) 혈액생화학적 관찰
대조군(BC-S1)에 비해, BC-S2군에서는 Total protein,
Albumin, A/G ration이 유의하게 증가하였고, BC-S3군에서는
Creatinine, BUN이 유의하게 증가하였고, BC-S5군에서는 Triglycerides가 유의하게 감소하였다(P≤0.05)(Table 3).
Fig. 1. Body weight changes in mice treated with Egg white combined Chalcanthite oral administration for 5 weeks.
General increase of body weights was found. Data was mean ± S.D. (n=5).Fig. 2. Body weight changes in mice treated with oral administration of Bamboo salt with Egg white combined Chalcanthitefor 5 weeks.
General increase of body weights was found. Data was mean ± S.D. (n=5).
4. 난담반과 죽염 혼합물의 Repeated toxicity 1) 사망률과 일반증상
시험기간 동안 모든 시험군에서 빈사 및 폐사 동물의 발생, 검액 투여에 의한 일반증상과 안과학적 증상은 관찰되지 않았다.
2) 체중의 변화
대조군(BC-R1)에 비해, 모든 실험군들에서 대체적으로 일반 적인 체중증가가 관찰되었다(Fig 2).
3) 체중 및 장기 무게
Absolute organ weights에서는 대조군(BC-R1)에 비해, 체중 은 모든 실험군들에서 유의한 변화는 없었으며, BC-R2군은 좌측 신장 무게, 비장 무게가 유의하게 감소하였고, 좌측 고환, 우측 고환 무게가 유의하게 증가하였고, BC-R4군은 좌측 신장, 폐, 심 장무게가 유의하게 증가하였다(P≤0.05). Relative organ weights 에서는 대조군(BC-R1)에 비해, BC-R2군은 좌측 신장, 비장 무게 가 유의하게 감소하였으며, BC-R3군은 간, 좌측 신장, 우측 신장, 폐, 심장 무게가 유의하게 증가하였고, BC-R5군은 좌측 신장, 우 측 신장 무게가 유의하게 증가하였다(P≤0.05)(Table 4).
4) 혈액학적 관찰
대조군(BC-R1)에 비해, BC-R5군에서는 HCT가 유의하게 감 소하였다(P≤0.05)(Table 5).
5) 혈액생화학적 관찰
대조군(BC-R1)에 비해, BC-R3군에서는 Albumin이 유의하 게 감소하였다(P≤0.05)(Table 6).
6) 뇨검사
대조군(BC-R1)에 비해, BC-R2군에서는 SG, BLO, pH, BC-R3군에서는 SG, BC-R4군에서는 pH, BC-R5군에서는 SG, pH 에서 변화가 있었다.
고 찰
이번 연구 중 가장 많은 용량이 166.6 mg/kg/day인 난담반 과 죽염의 혼합물이므로 이보다 20배 이상 높은 양의 죽염의 무 독성이 보고된 이상 이번 물질에서 독성이 나타난다고 하면 난 담반의 독성에 의한 것이라 판단하는 것이 일반적이다. 왜냐하면 비록 독성을 줄이기 위해 담반을 난담반으로 가공하였다 하더라 도 기본적으로 담반에는 충분한 독성이 있다고 알려져 있기 때 문이다. 그러나 담반의 독성에 대하여 구체적인 연구 결과가 없 는 이상 문헌에 의존해 예측할 수밖에 없는데, 문헌을 검색해도 담반의 약성에 ‘유독’하다는 문건 이외의 부작용이 기재된 예를 찾지 못하였다.
먼저 난담반의 Single oral dose toxicity 실험에서는 실험동 물의 사망이나 다른 육안 이상 징후는 발견되지 않았다. EC-S2군 (0.05mg/kg/day)에서 유의하게 간장의 무게가 증가하였으나 용 량이 증가한 다른 군에서는 대조군보다 일반적으로 높기는 했지 만 유의한 차이를 나타내지는 못했다. 그러나 간장의 상대 중량 이 가장 높았던 EC-S2군에서는 ALT의 큰 차이가 없고, 오히려 EC-S3군(0.5 mg/kg/day)에서 증가하였다. 반면, EC-S4군 (5mg/kg/day)과 EC-S5군(50 mg/kg/day)은 ALT의 증가가 나 타나지 않았다. 간장 독성이 있다고 설명하기에는 용량을 늘린 군에서 독성이 나타나지 않은 사실에 근거하면 충분하지 않으며, 전반적으로 독성이 없다고 설명하기에도 일부 집단(EC-S3)에서 수치의 상승이 나타나 현재 연구로는 확실한 답을 내릴 수 없으 나 독성의 가능성이 있으므로 주의하는 것이 좋다고 판단된다.
장기 투여를 전제한 연구한 난담반의 5주간의 Repeated toxicity 전반적인 체중 증가가 나타났으며, 전반적인 PLT의 증 가가 나타나나 유의하지는 않았으며, 가장 용량이 낮은 EC-R2군 (0.01 mg/kg/day)에서 creatinin의 증가가 나타났으나 용량을 늘 린 EC-R3, EC-R4, EC-R5군(0.05-0.5 mg/kg/day)에서는 대조군 과의 차이가 나타나지 않았다.
난담반과 죽염을 배합한 BC군의 Single oral dose toxicity 실험에서는 실험동물의 사망은 나타나지 않았으며, 혈액학적 간 장 및 신장의 수치 상승은 모두 나타나지 않았다, Repeated toxicity 실험에서는 전반적인 체중 증가가 나타났으며 특이할 혈 액학적 이상은 발견되지 않았다.
본 연구에서 두 실험 대상에서 거의 같이 나온 점이 있는데,
모두 각각의 대조군에 비하여 좌측 신장의 상대 중량이 증가하
였다는 점이다. 우측 신장의 경우는 증가한 경우도 있으며 증가
하지 않은 경우도 있으나 유독 좌측 신장의 무게는 Repeated
toxicity 실험에서 모두 유의한 증가를 나타냈다.
신장의 비대는 수신증이나 다낭종질환, RCC(Renal cell carcinoma), Wilm's tumor에서 나타날 수 있다). 일반적으로 요 로계의 어딘가가 감염이나 종양 등으로 막혀 나타날 수 있는 증 상이다. 그러나 최소한 육안으로 장기에 대한 검사를 시행하였는 데도 이상 소견이 나타나지 않았다는 점과 모든 군에서 나타났 다는 점, 그리고 좌측에만 나타났나는 점, 그리고 Creatinine과 BUN 수치에는 별다른 이상이 없었고 소변 검사가 무난히 이루 어진 점을 근거로 이를 신장의 이상에 의한 중량의 증가로 판단 하기는 어렵다고 판단된다. 따라서 신장 독성을 논할 근거가 되 지 않는다고 판단하였다.
한편, EC-R2군(0.01 mg/kg/day)과 EC-R3군(0.05 mg/kg/day)에서는 유의한 간장 무게의 증가가 나타났다. 더불 어 따로 기재하지는 않았으나 소변 중 빌리루빈과 유로빌리노겐 수치도 대조군(EC-R1)에 비해 유의하게 높았다. AST, ALT의 상 승이 이루어지지 않고 EC-R3군에서는 오히려 수치가 유의하게 하락하였다는 점과 혈중 빌리루빈 수치나 약인성 간손상을 고려 해 볼 만한 다른 혈액검사가 이루어지지 않았다는 점, 그리고 용 량 증가군(EC-R4, EC-R5)에서 유의한 변화가 없는 점으로 미루 어 간장 독성을 확정지을 수는 없으나, 역시 간장의 부담을 증가 시키는 요인일 가능성은 있다.
우리가 주로 생각하는 담반의 CuSO
4·5H
2O와 주 성분 중 하 나인 CuO는 차이가 있다. 큰 차이가 있는 부분은 수용성과 구리 의 함유량이다. CuSO
4·5H
2O의 경우 수용성이고 구리의 함유량 이 25% 내외인 데 반해 CuO는 80%의 구리 함유량을 지니고 있 으며 물에 녹지 않고 pH 1.4 이하의 강산성 용액에서만 용해된 다고 알려져 있다
30). CuO는 구리의 고함량으로 인한 생산성 때 문에 과거에는 비타민제 등으로 사용되었으나, CuSO
4·5H
2O에 비하여 생체 구리 이용량이 거의 없어 추천하지 않는 보고가 있
다
31-33). 난담반은 광물성 한약재인 담반을 100~160도로 12시간
가열처리하여 얻은 고담반을 토종유정란의 난백과 혼합하는 방 식으로 사용한다. 난담반 수치 과정 중 가열처리하여 탈수시키는 과정이 있는데, 이러한 부분이 구리 섭취에는 효과적이지 않다.
그러나 이러한 방법이 구리 섭취를 억제할 수 있는 방법이 될 수 도 있어 역으로 구리의 독성에서 비교적 자유로워질 수 있다. 과 거 난담반의 연구에서 NCI-H460에 대한 세포자살유도 효과가 구리의 섭취에서 나타나는 것이 아니라면, 이러한 가공법은 권장 할 수 있는 방법이다.
일반적으로 구리는 간과 뇌의 basal ganglia, 신장, 눈에 축 적되어 기능장애를 유발할 수 있는데, 간에서는 만성 간경화를 유발할 수 있으며 뇌에서는 심각할 경우 신경학적 장애를 유발 할 수 있다. 구리 수치의 증가 중 가장 잘 알려진 윌슨병과 같은 경우는 상염색체 이상으로 인한 ATP7B의 불활성으로 간에서 담 즙으로 구리 배설이 원활히 이루어지지 않아 발생하는 질환이다
34)
. 한편, 구리 독성으로 인하여 인지 장애나 알츠하이머 병이 악 화된다는 연구도 있다
35). 이 연구에서는 그 원인 중 하나로 장기 간의 구리가 함유된 미네랄 제재의 복용을 꼽고 있다. 아직까지 그 기전은 명확히 밝혀진 것은 없으나 담반 제재의 독성이란 혈
중 또는 특정 장기의 구리 농도를 상승시켜 유발된 구리 독성일 가능성이 의심된다. 일반적으로 한의학의 치료법에 담반의 사용 용도가 함유된 구리에 의한 것일 가능성은 크지 않다. 따라서 담 반 제재를 사용할 경우 장기간의 복용을 자제하고, 사용할 경우 구리 섭취를 최대한 억제할 수 있는 방법이 필요하다. 이러한 의 미에서의 난담반의 가공법은 일리가 있다.
그러나 담반은 탈수 과정에서 산화구리의 생성 뿐 아니라 다른 주요 성분인 삼산화황을 유발할 수 있다. 삼산화황은 세포 내에서 독성이 적은 사산화황의 형태로 존재하게 되나 이 역시 장기간의 복용과 대용량의 섭취로 인하면 독성이 나타날 수 있 고, 이에 대한 무독성 반응 실험은 존재하지 않는다. 난담반의 가 공법으로는 이 부분에 대한 설명을 할 수 없으며, 이 부분은 앞 으로 담반 제재를 사용하기 위해서 추가로 연구가 필요한 부분 이다.
본 연구에서 난담반과 죽염의 혼합제(BC)의 난담반 용량이 난담반 단독 투여군(EC)보다 최종적으로 더 높은 난담반 함유량 을 나타내고 있으므로 앞서 고찰한 단독 투여군 중 일부에서 나 타난 간 부담은 상대적으로 난담반과 죽염의 혼합제 쪽이 사용 하기에 부담이 적다고 판단할 근거가 될 수 있다.
두 집단의 차이는 죽염의 존재 여부에만 있지만, 이것이 죽 염의 효과라고 입증할 수 있는 이론적 가설을 성립시킬 만한 기 전을 만들 수 없었는데, 이는 여태까지 죽염의 연구 성과 중에 해독작용에 대한 연구가 없기 때문이다. 특히 간장 독성이나 구 리 독성에 대한 연구가 필요하며, 이러한 연구 결과가 나오면 현 재 연구 결과에 대한 정확한 평가가 가능해 질 것이다.
결 론
난담반 단독 투여제는 간장 독성으로부터의 안전성이 확보 되었다고 판단하기는 어려우며, 난담반과 죽염 15:1 혼합물은 83.3 mg/kg/day 까지는 mouse 실험 상 안전성은 확보된 것으 로 판단된다.
참고문헌