대한소화기학회지 2001;38:325-335
서 론
3 )암세포의 발생으로부터 증식, 진전, 전이에 이르는 과정 에는 여러 가지 유전자의 변화가 축적되고, 발암기전의 각 단계마다 다양한 유전자 변화가 있는 것으로 알려져 있 다 .1 ,2
위암은 우리 나라에서 가장 빈도가 높은 암의 하나로 최 접수 : 2001년 1월 16일, 승인 : 2001년 10월 9일
연락처: 오상훈, 614-735, 부산시 부산진구 개금동 633-165 인제대학교 부산백병원 외과학교실
Tel: (05 1) 890-6352, Fax: (051) 898-9427
※ 본 논문은 2000년 인제연구장학재단의 연구비 보조로 이루어졌 음 .
근 유전자 수준에서 발암 과정을 규명하고 이를 예후인자 로 활용하려는 노력이 많이 이루어지고 있다 . 위암 환자에 서 예후를 예측할 수 있는 수단으로 병리학적 TNM 병기가 임상적으로 이용되고 있으나 동일한 병기, 세포형 및 분화 도를 보이는 환자군에서도 치료 성적이 다른 경우를 흔히 볼 수 있어 추가적으로 예후를 예측할 수 있는 방법이 필요 하고, 분자생물학적인 차원에서 위암의 원인과 진행 과정 을 규명하고 이를 예후인자 및 고위험군의 색출에 활용할 수 있는가를 연구하여 그 결과를 치료에도 적용시키려는 노력이 필요하다. 또 암의 재발과 전이는 다단계의 발생 과 정을 거치는 것으로 알려져 있는데 암세포의 이동 . 침윤, 신생혈관 생성, 그리고 숙주의 면역체계로부터의 회피 등 의 과정이 밝혀지고 있으나 유전자 수준에서 어떠한 조절
위암 환자에서 p53, DCC 및 n m 23 유전자 변이의 발현 양상과 임상적 의의
인제대학교 부산백병원 외과학교실
황성환・오상훈・최영길
T h e C l i n i c a l S i g n if i c a n c e o f Mu ta t i o n i n t h e p 5 3 , D C C a n d n m 2 3 G e n e s i n P a t i e n t s w i t h G a s t r i c C a r c i n o m a
S u n g H w a n H w a n g , M .D ., S a n g H o o n O h , M .D ., a n d Y o u n g K i l C h o i , M .D .Dep artment of Surg ery, Inj e Univers ity College of M edicine, Pusan Paik Hosp ital, Busan, Korea
Backgroun d/Aim s: Multiple gene abnormalities are observed in gastric carcinogenesis. We analyzed the mutation of p53, DCC and nm23 genes in gastric carcinoma and evaluated their clinical significance. Methods : Mutations of p53, DCC and nm23 genes were investigated using PCR-SSCP analysis in 40 patients with gastric carcinoma.
The correlations between mutations of these genes and clinicopathologic variables or prognosis were examined.
Results: The incidence of mutation in the p53, DCC and nm23 genes were 47.5 %, 30.0 % and 25.0 %, respectively.
The mutation of the p53 genes significantly correlated with lymph node metastasis and lymphatic invasion . The mutation of the nm23 genes showed a significant correlation with tumor size, histologic type, depth of invasion, lymph node metastasis, and venous invasion . The mutation of the DCC genes had no correlation with clinico- pathologic variables. The overall 5-year survival rate of the patients was 60.0 %. The mutation of the p53 and nm23 genes significantly affected on survival of the patients, but mutation of the DCC genes did not. By multivariate analysis, the most significant prognostic factors were lymph node metastasis and depth of invasion . The mutation of p53, DCC, and nm23 genes had little prognostic value in gastric carcinoma. Conclusions: It is suggested that the mutation of the p53 and nm23 genes may have a role in the tumor invasion and metastasis in gastric carcinoma, possibly leading to a poor prognosis. (K orean J Gastroenterol 200 1;38 :325-335)
Key W ords : Gastric carcinoma, Mutation of p53, DCC and nm23, Prognostic factor
3 2 6 대한소화기학회지: 제38권 제5호 2001
이 일어나고 있는가에 대해서는 많은 연구가 필요한 실정 이다 .
저자들은 외과적으로 절제된 위암 조직에서 중합효소연 쇄반응-단일쇄 형태변환 다형성 방법(PCR-SSCP)으로 종양 억제유전자인 p53 및 DCC와 항전이유전자인 nm23의 돌연 변이 발현 양상을 조사하고, 이를 위암의 진행도와 연관지 어 생물학적인 특성과의 관계를 추정하였으며 생존 분석을 통하여 p53, DCC 및 nm23의 유전자 변이가 예후 추정인자 로 이용될 수 있는지 알아보고자 하였다.
대상 및 방법
1. 대 상
1990년 1월부터 7월까지 인제대학교 부산백병원 외과에 서 근치적 절제술을 시행받은 위암 환자 중 절제 표본의 보 존 상태가 양호하고 현미경 시야에서 암 조직의 비율이 높 은 파라핀 포매 위암 조직절편 40개를 추출하였다. 남자 25 명, 여자 15명으로 남녀 비 1.7:1이었으며 평균 연령은 54.8
± 11.3세였다.
병리조직 소견상 조기 위암이 13예, 진행 위암이 27예였 고 진행 위암은 Borrm ann I형 2예, II형 8예, III형 14예, IV 형 3예였다 . 종양의 크기는 장경 5 cm 미만 29예, 5 cm 이 상이 11예였으며, 종양의 위치 분포는 위 상부 11예, 중앙 부 10예, 하부 19예였다 . WHO의 조직학적 분류법3에 따라 고분화 및 중분화암 19예, 저분화암 10예, 점액암 2예, 인환 세포암 l9예였고, Lauren분류4상 미만형 16예, 장형 2 1예, 혼합형 3예였다 . 종양의 위벽 침윤 깊이는 점막과 점막하층 14예, 고유근층 6예, 장막층 20예였고 림프관 침윤은 28예, 혈관 침윤은 16예, 그리고 영역 림프절 전이는 25예에서 양 성 소견을 보였다. UICC 병기 분류5 상 IA기 9예, IB기 4 예, II기 3예, IIIA기 8예, IIIB기 15예, IV기 1예였다(Table
1).
2 . 방 법
1) 종양 및 정상 점막 분리
종양 부위가 충분히 포함된 파라핀 블럭과 각 종양의 정 상 점막 블럭을 H&E염색 슬라이드 검색을 통하여 선택하 여 각 파라핀 블럭에서 7 m 두께의 15개의 절편을 유리 슬라이드에 부착시켰다 . 파라핀은 60℃에서 1시간, 100%
xylene에 10분간 2회 반응시켜 제거하였고 100 %, 95 % 에 탄올에 세척 후 공기 중에 건조시켰다 . 종양세포가 포함된 부위를 현미경 관찰하에 수성 펜으로 표시한 후 25 gauge 침을 이용하여 종양 부위만 선택적으로 미세 박리하였는데 각 절편에 30 L의 lysis buffer ( 10 mM Tris-HCl, pH 8.0,
10 mM EDTA, 150 m M NaCl)를 첨가하여 분리를 용이하 게 하였다. 분리된 종양 및 정상 점막 조직은 microtube에 보관하였다 .
2 ) DNA의 분리6
분리된 조직을 sodium dodecyl sulfate (CalBiochem , La Jolla, CA , USA)의 최종 농도가 1% 되게 첨가한 후 충분히 섞어주었고 조직 lysate 1 mL당 proteinase K (Boehninger Mannheim , Mannheim , Germany)를 300 - 500 g 첨가한 후 55℃에서 용해될 때까지 반응시켰다 . DNA 분리는 DNA extraction kit (Qiagen, Hilden , Germany)를 이용하였다 . 추 출된 DNA는 광비색계로 순도와 농도를 측정한 후 1% 한 천겔 전기영동한 후 손상 정도, 순도, 및 농도를 재확인하 였다 .
3 ) 중 합 효 소 연 쇄 반 응 - 단 일 쇄 형 태 변 환 다 형 성 (P C R - S S C P )
종양과 정상 점막에서 분리된 DNA들은 중합효소반응으 로 시발체(primer)를 이용하여 각 유전자 부위를 증폭하였 다 . p53 (17p 13.1) 유전자의 증폭을 위한 시발체의 염기배 열은 CAT TAG CAG TCT GGA AAT CCT C CGC TAT TGT ACT GAA AAC CTG A (5 ' -3 '), DCC 유전자 ( 18q2 1.3)의 증폭을 위해서는 TTC CGC CAT GGT TTT TAA ATC A AGC TCA TTT TCA GCC ACA CA (5 ' -3 ')
Fig. 1. Analysis of mutation in paired normal (N) and tumor (T) DNA in the p53 genes (A), DCC genes (B) and nm23 genes (C).
Mutation is characterized by appearance of additional band in the tumor DNA (dotted arrow) and/or disappearance of band in tumor DNA (loss of heterozygosity, arrow).
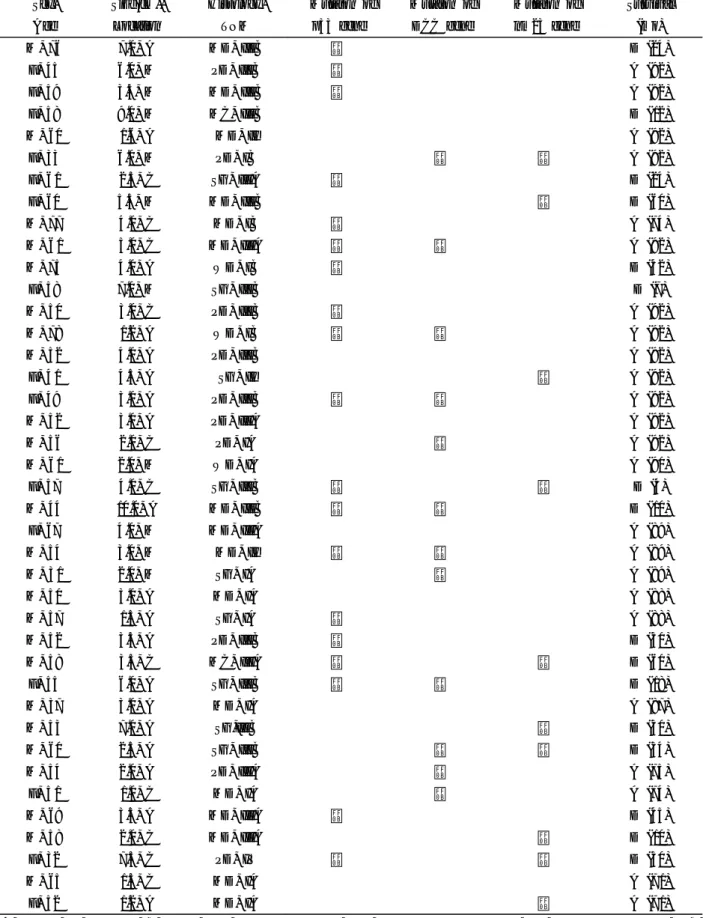
Table 1. Summary of the Clinicopathologic Data from 40 Cases of Gastric Carcinoma
Sex, Size(cm ), Histology, Mutaton of Mutaton of Mutaton of Survival Age Location TNM p53 gene DCC gene nm23 gene (mo)
M , 76 7 .0, A MD, IIIB + D (24)
F, 45 6.0, M PD, IIIB + A (92)
F, 59 3.5, M MD, IIIB + A (92)
F, 58 9 .0, M MC, IIIB D ( 12)
M , 60 1.6, A MD, II A (92)
F, 33 6.0, M PD, IB + + A (92)
F, 6 1 2 .5, C SG, IIIA + D (24)
F, 60 5 .5, M MD, IIIB + D (60)
M , 77 4 .0, C MD , IB + A (74)
M , 6 1 5 .0, C MD, IIIA + + A (92)
M , 75 4 .0, A WD , IB + D (42)
F, 58 7 .0, M SG, IIIB D (7)
M , 50 3.0, C PD, IIIB + A (92)
M , 78 1.2, A WD , IB + + A (92)
M , 52 4 .0, A PD, IIIB A (92)
F, 4 1 4 .5, A SG , II + A (92)
F, 49 3.0, A PD, IIIB + + A (92)
M , 52 3.0, A PD, IIIA A (92)
M , 56 2 .0, C PD, IA + A (92)
M , 6 1 2 .0, M WD , IA A (90)
F, 57 4 .0, C SG, IIIB + + D (4)
M , 44 10 .0, A MD, IIIB + + D ( 10)
F, 67 4 .0, M MD, IIIA A (89)
M , 54 3.0, M MD, II + + A (89)
M , 3 1 2 .0, M SG, IA + A (89)
M , 50 3.0, A MD , IA A (88)
M , 57 1.5, A SG, IA + A (88)
M , 52 3.5, A PD, IIIB + D (30)
M , 58 3.5, C MC, IIIA + + D (60)
F, 55 6.0, A SG, IIIB + + D ( 18)
M , 37 3.0, A MD , IA A (87)
M , 53 7 .0, A SG,IIIB + D (30)
M , 60 2 .5, A SG, IIIB + + D (34)
M , 54 2 .0, A PD, IIIA + A (75)
F, 5 1 1.0, C MD , IA + A (74)
M , 69 3.5, A MD, IIIA + D (45)
M , 58 2 .0, C MD, IIIA + D ( 10)
F, 32 7 .5, C PD, IV + + D (30)
M , 65 1.5, C MD , IA A (7 1)
F, 52 1.2, A MD , IA + A (7 1)
A, antrum ; M , midbody ; C, cardia ; W D, well differentiated; MD, m oderately differentiated; PD , poorly differentiated ; MC, mucinous ; SG, signet ring cell ; A, alive; D , deceased .
황성환 외 2인 . 위암 환자에서 p53, DCC 및 nm23 유전자 변이 3 2 7
3 2 8 The Korean Journal of Gastroenterology: Vol. 38, No. 5, 2001
를, nm23 ( 17q2 1.3) 유전자의 증폭을 위해서는 TTG ACC GGG GTA GAG AAC TC (5 ' -3 ')를 각각 사용하였다.
PCR반응액은 1x PCR buffer (20 mM Tris-HCl (pH 8.4), 50 mM KCl, 1.5 mM MgCl2), 200 M deoxynucleotide triphosphate (dNTP, Pharmacia, Peapack, NJ, USA), 2 M primer (Bioneer , 충주, 한국), 2.5 units Taq DNA Polymerase (Prom ega, Madison , WI, USA), 200 ng template DNA가 포함된 최종 부피가 20 L로 구성하였다 . PCR반응 은 thermal cycler (DNA Thermal Cycler 480, Perkin Elmer Cetus Corp ., Norwork, CT, U SA)을 이용하여 95℃ 에서 1 분, 55-56℃에서 1분, 72℃에서 1분간 총 30회 주기를 실시 한 후 마지막 72℃에서 5분간 최종 반응시켰다.
PCR 최종 산물 용액 8 L을 gel loading 용액(98%
formamide, 10 mM EDTA pH 8.0, 0.025 % xylene cyanol, 0 .025 % bromophenol blue)에 1: 1로 희석하여 95℃에서 2분 간 가열한 후 얼음 속에 보관하였다. 7 M urea가 함유된 polyacrylamide denaturating gel에 50W에서 약 2시간 동안 전기영동한 후 PlusOne DNA silver staining kit (Pharm a- cia, Peapack, NJ, U SA)을 이용하여 silver염색을 하였다. 두 장의 cellophane 사이에 염색이 끝난 gel을 넣고 공기 중에 건조한 후 관찰하였다 . 유전자 변이는 정상 조직과 종양조 직을 비교하여 정상 조직에 나타나지 않는 밴드가 보일 때 와 정상 부분과 비교하여 대립유전자의 소실이 있을 때 Loss of Heterozygosity (LOH)로 판정하였다(Fig . 1) .
3 . 통 계 학 적 분 석
개인용 컴퓨터를 이용하여 p53, DCC, 및 nm 23 유전자의 변이와 연령, 성별, 종양의 육안형, 크기, 위치, 조직학적 분 화도, Lauren 분류, 위벽 침윤 깊이, 림프절 전이, 림프관 침 윤, 혈관 침윤, UICC 병기, 그리고 생존 여부와 생존 기간 등 총 17개의 항목으로 나누어 입력하였다.
p53, DCC 및 nm23 유전자 변이와 임상 및 병리학적 변 수들 간의 연관성을 crosstab를 이용하여 구하였고 chi- square test로 검정하였다 . 생존 분석은 Kaplan -Meier법으로 누적 생존율을 구하여 log rank test로 비교하였다. p53, DCC 및 nm23 유전자 변이와 임상병리학적 인자를 독립 변 수로하여 종속 변수인 생존 여부 에 대한 위험도를 Cox proportional hazard model을 이용하여 다변량 분석을 하였다 . 통계치의 유의 수준은 5 %로 설정하였다.
결 과
1. p 5 3 , D C C 및 n m 2 3 유 전 자 변 이 의 빈 도 p53 유전자의 변이는 19예(47.5 %)에서, DCC 유전자의
변이는 12예(30.0 %)에서, nm23 유전자의 변이는 10예 (25 .0 %)에서 관찰되었다 .
2 . 유 전 자 변 이 와 임 상 및 병 리 소 견 의 관 계 p53 유전자 변이와 환자의 연령, 성별, 종양의 육안 소 견, 크기, 위치, Lauren 분류, WHO 조직학적 분화도, 위벽 침윤 깊이, 혈관 침윤 및 UICC 병기에 따른 차이는 관찰할 수 없었다. 림프절 전이 양성 25예 중 16예(64.0 %), 전이 음 성 15예 중 3예(20.0%)에서 p53 유전자의 변이가 관찰되어 림프절 전이가 있는 경우에 의의 있게 높았으며(p =0.035), 림프관 침윤 여부에 따라 침윤이 있었던 28예 중 17예 (60 .7 %), 침윤이 없었던 12예 중 2예( 16.7 %)에서 관찰되어 림프관 침윤 예에서 의의 있게 높았다(p =0.022)(Table 2).
DCC 유전자 변이와 환자의 연령, 성별, 종양의 육안 소 견, 크기, 종양의 위치, Lauren 분류, WHO 조직학적 분화 도, 위벽 침윤 깊이, 림프절 전이, 림프관 침윤, 혈관 침윤 및 UICC 병기에 따른 차이는 관찰할 수 없었다(Table 3).
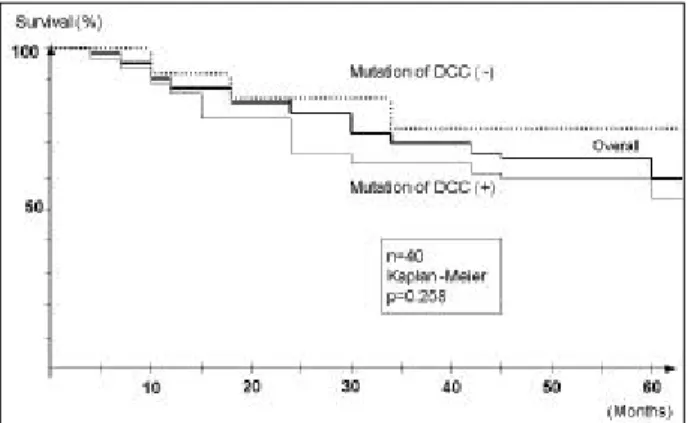
Fig. 3. Survival curves for patients with gastric carcinoma accord- ing to the mutation in the DCC genes. There is no statistically significant difference in survival rates.
Fig. 2. Survival curves for patients with gastric carcinoma according to the mutation in the p53 genes. Patients without mutation in the p53 genes show better survival than those with mutation.
Hwang, et al. Mutation of p53, DCC and nm23 genes in gastric carcinoma 329
nm23 유전자 변이와 환자의 연령, 성별, 종양의 육안 소견, 위치, Lauren 분류, 림프관 침윤 및 UICC 병기에 따른 빈도 의 차이는 관찰할 수 없었다. 종양의 크기가 5 cm 미만인 경우 29예 중 5예(17.2%), 5 cm 이상인 경우 11예 중 5예 (45.5%)에서 nm23 유전자 변이가 관찰되어 5 cm 이상 예 에서 의의 있게 높았으며(p=0.043), WHO 조직학적 분화도 는 점액암과 인환세포암에서 의의 있게 발현 빈도가 높았
다(p=0.040). 암의 위벽 침윤 깊이에 따른 빈도는 점막과 점 막하층의 14예 중 2예(14.3%), 고유근층 6예 중 1예 (16.7%), 장막층 20예 중 7예(35.5%)로 침윤이 진행될수록 높았다(p=0.030). 림프절 전이 양성 25예 중 8예(32.0%), 전 이 음성 15예 중 2예(13.3%)로 림프절 전이 양성군에서 의 의 있게 높았고(p=0.026), 혈관 침윤이 있는 16예 중 7예 (43.8%), 혈관 침윤이 없는 24예 중 3예(20.8%)로 혈관 침 Table 2. Relation between p53 Mutation and Clinicopathologic Characteristics of the Gastric Carcinoma
No. of studied No. of p53 mutation (%) p value
(n=40) (n=19)
Age ≤ 60 30 13 (43.3)
> 60 10 6 (60.0) 0.2 17
Sex Male 25 12 (48.0)
Female 15 7 (46.6) 0.462
Gross findings AGC 27 13 (48.1)
EGC 13 6 (46.2) 0.906
Tumor size ≤ 5 cm 29 14 (48.2)
> 5 cm 11 5 (45.4) 0.629
Tumor location Cardia 11 7 (63.6)
Mid-body 10 4 (40.0)
Antrum 19 8 (42.1)
Diffuse 0 0 (0.0) 0.119
Lauren 's classificaiton Diffuse 16 8 (50.0)
Intestinal 2 1 9 (42.9)
Mixed 3 2 (66.7) 0.129
WHO classification Tubular WD/MD 19 9 (47.4)
PD 10 5 (50.0)
Mucinous 2 1 (50.0)
Signet ring cell 9 4 (44.4) 0.558
Depth of invasion M/SM 14 6 (42.9)
PM 6 2 (33.3)
SS/ SE 20 11 (55.0) 0.590
Lymph node Positive 25 16 (64.0)
metastasis Negative 15 3 (20.0) 0.035
Lymphatic Present 28 17 (60.7)
invasion Absent 12 2 (16.7) 0.022
Vein invasion Present 16 6 (37.5)
Absent 24 13 (54.2) 0.301
TNM stage Ia/Ib 13 4 (30.7)
II 3 1 (33.3)
IIIa/IIIb 23 13 (56.5)
IV 1 1 (100.0) 0.278
AGC, advanced gastric carcinoma; EGC, early gastric carcinoma; WD, well differentiated; MD, moderately differentiated; PD, poorly differentiated; M, mucosa; SM, submucosa; PM, proper muscle; SS, subserosa; SE, serosa extended.
330 대한소화기학회지: 제38권 제5호 2001
윤시에도 의의 있게 높았다(p=0.021)(Table 4).
3. 유전자 변이와 생존율의 관계
전체 환자의 5년 생존율은 60.0%였다. p53 유전자 변이 가 관찰되었던 환자의 5년 생존율은 48.5%, 관찰되지 않았 던 환자의 5년 생존율이 74.5%로 p53 유전자 변이 음성 예 에서 의의 있게 양호한 생존율을 보였다(p=0.041) (Fig. 2).
DCC 유전자 변이가 있었던 환자의 5년 생존율은 53.5%, 없었던 환자의 5년 생존율 75.0%로 DCC 유전자 변이 음성 군에서 양호한 생존율을 보였으나 통계적 의의는 없었다 (p=0.258) (Fig. 3).
nm23 유전자 변이 양성군의 5년 생존율은 39.5%, 음성 군의 5년 생존율은 73.9%로 nm23 유전자 변이가 관찰되지 않은 군에서 의의 있게 양호한 생존율을 보였다(p=0.011) Table 3. Relation between DCC Mutation and Clinicopathologic Characteristics of the Gastric Carcinoma
No. of studied No. of DCC mutation (%) p value
(n=40) (n=12)
Age ≤ 60 30 10 (33.3)
> 60 10 2 (20.0) 0.507
Sex Male 25 8 (32.0)
Female 15 4 (26.7) 0.722
Gross findings AGC 27 7 (25.9)
EGC 13 5 (38.5) 0.418
Tumor size ≤ 5 cm 29 8 (27.6)
> 5 cm 11 4 (36.4) 0.292
Tumor location Cardia 11 2 (18.1)
Mid-body 10 3 (30.0)
Antrum 19 7 (36.8)
Diffuse 0 0 (0.0) 0.561
Lauren 's Diffuse 16 5 (31.3)
classificaiton Intestinal 2 1 7 (33.3)
Mixed 3 0 (0.0) 0.344
WHO classification Tubular WD/MD 19 5 (26.3)
PD 10 4 (40.0)
Mucinous 2 0 (0.0)
Signet ring cell 9 3 (33.3) 0.087
Depth of invasion M/SM 14 6 (42.9)
PM 6 2 (33.3)
SS/ SE 20 4 (20.0) 0.152
Lymph node Positive 25 6 (24.0)
metastasis Negative 15 6 (40.0) 0.185
Lymphatic Present 28 8 (28.6)
invasion Absent 12 4 (33.3) 0.263
Vein invasion Present 16 4 (25.0)
Absent 24 8 (33.3) 0.573
TNM stage Ia/Ib 13 5 (38.5)
II 3 1 (33.3)
IIIa/IIIb 23 6 (26.1)
IV 1 0 (0.0) 0.316
AGC, advanced gastric carcinoma; EGC, early gastric carcinoma; WD, well differentiated; MD, moderately differentiated; PD, poorly differentiated; M, mucosa; SM, submucosa; PM, proper muscle; SS, subserosa; SE, serosa extended.
황성환 외 2인 . 위암 환자에서 p53, DCC 및 nm23 유전자 변이 33 1
(Fig. 4).
4 . 예후인자에 대한 단변량 분석
임상병리학적 소견과 p53, DCC 및 nm23 유전자 변이에 대해서 각각이 생존에 미치는 영향에 대한 단변량 분석 결 과 림프절 전이 여부, 위벽 침윤 깊이, UICC 병기, 혈관 침 습, 종양의 크기, WHO 조직학적 분화도가 의의 있게 예후
에 영향을 미치는 것으로 나타났다. 환자의 연령, 성별, 병 소의 위치, p53, DCC 및 nm23 유전자 변이는 의미 있는 예 후인자가 아닌 것으로 나타났다(Table 5).
5. 예후인자에 대한 다변량 분석
위암 환자의 생존에 영향을 미치는 독립적인 예후인자를 밝히기 위하여 proportional harzard model을 이용하여 다변 Table 4. Relation between nm23 Mutation and Clinicopathologic Characteristics of the Gastric Carcinoma
No. of studied No. of nm23 mutation (%) p value
(n=40) (n=14)
Age ≤ 60 30 12 (40.0)
> 60 10 2 (46.7) 0.697
Sex Male 25 7 (28.0)
Female 15 7 (46.7) 0.060
Gross findings AGC 27 11 (40.7)
EGC 13 3 (23.1) 0.072
Tumor size ≤ 5 cm 29 7 (24.1)
> 5 cm 11 7 (63.6) 0.043
Tumor location Cardia 11 4 (45.5)
Mid-body 10 3 (40.0)
Antrum 19 7 (26.3)
Diffuse 0 0 (0.0) 0.530
Lauren 's Diffuse 16 7 (43.8)
classificaiton Intestinal 21 7 (33.3)
Mixed 3 0 (0.0) 0.336
WHO classification Tubular WD/MD 19 5 (26.3)
PD 10 3 (30.0)
Mucinous 2 1 (50.0)
Signet ring cell 9 5 (55.6) 0.456
Depth of invasion M/SM 14 2 (14.3)
PM 6 1 (16.7)
SS/SE 20 11 (55.0) 0.030
Lymph node Positive 25 12 (48.0)
metastasis Negative 15 2 (13.3) 0.026
Lymphatic Present 28 11 (39.3)
invasion Absent 12 3 (25.0) 0.385
Venous invasion Present 16 9 (56.3)
Absent 24 5 (20.8) 0.02 1
TNM stage Ia/Ib 13 2 (15.4)
II 3 1 (33.3)
IIIa/IIIb 23 10 (43.5)
IV 1 1 (100.0) 0.062
AGC, advanced gastric carcinoma; EGC, early gastric carcinoma; WD, well differentiated; MD, moderately differentiated; PD, poorly differentiated; M, mucosa; SM, submucosa; PM, proper muscle; SS, subserosa; SE, serosa extended.
332 The Korean Journal of Gastroenterology: Vol. 38, No. 5, 2001
량 분석을 실시한 결과 통계적으로 유의한 위암 환자의 독 립적인 예후인자는 림프절 전이, 위벽 침윤 깊이, 병소의 크 기 순으로 영향을 미치는 것으로 확인되었다. 환자의 연령, 성별, 육안적 형태, 병소의 위치, 병소의 크기, 세포분화도 등의 임상병리학적 소견과 p53, DCC 및 nm23 유전자 변이 는 독립적인 예후인자가 아닌 것으로 나타났다(Table 6).
고 찰
p53 유전자는 1979년 이 유전자의 산물인 핵단백이 악성 으로 변형된 SV40 세포주에서 SV40 large T 항원과 복합 체를 형성하는 인단백으로 처음 발견되었으며7, 정상 p53 유전자의 이상이나 DNA tumor virus들이 p53 유전자에 결 합함으로써 유전자의 작용이 소실될 때 암의 발생이 현저 히 증가하는 것으로 알려져 있다.8 종양억제유전자인 p53 유전자의 변이는 소화기암을 비롯한 인체 악성 종양의 발 암 과정에서 가장 흔히 관찰되는 유전자 변화이다.9 - 1 1
위암 환자의 병소에서 p53 유전자 변이의 빈도는 32.8%
에서 67%로 다양하게 보고되고 있어 p53 유전자와 위암 발생의 관련성을 제시하고 있는데12 - 17, 본 연구에서는 p53 유전자 변이의 빈도는 47.5%였다. p53 유전자 변이의 빈도 가 연구자에 따라 차이가 많이 나는 이유는 대상 조직이나 검사 방법에 영향을 받은 것으로 저자들은 DNA의 양이 적 거나 약간의 변성이 있어도 이형성 소실과 재배열 등의 DNA 이상 및 점돌연변이를 함께 검출할 수 있는 PCR- SSCP검사법을 사용하였기 때문에 비교적 높은 발현율을 보인 것으로 생각된다.
p53 유전자 변이와 위암의 진행도 및 예후와의 연관성에 대해서는 연구자에 따라 보고를 달리하여1 1 , 14 , 16 , 1 8
논쟁의 대 상이 되고 있다. 저자들의 연구에서는 p53 유전자 변이가 조기 위암에서 48.1%, 진행 위암에서 46.2%로 차이를 발견 할 수 없었고, 위벽 침윤 깊이, 혈관 침윤, 종양의 생물학적 악성도 및 TNM 병기에 따라 통계적으로 유의한 차이를 발 견할 수 없었지만, 림프절 전이와 림프관 침윤 양성의 경우 에는 의의 있게 p53 유전자 변이의 빈도가 높아 암의 진행 Table 6. Multivariate Analysis of Risk Factors for Survival
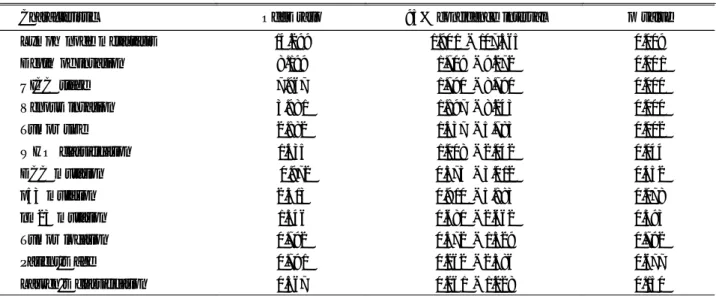
Characteristics Chi-square p value Lymph node metastasis 2 1.07 0.000 Depth of invasion 8.259 0.004
Tumor size 8.042 0.004
Fig. 4. Survival curves for patients with gastric carcinoma according to the mutation in the nm23 genes. Patients without mutation in the nm23 genes show better survival than those with mutation.
Table 5. Univariate Analysis of Risk Factors for Survival
Characteristic Odds ratio 95% confidence interval p value Lymph node metastasis 14.299 1.90 1 - 107.565 0.009
Depth of invasion 8.199 1.709 - 9.272 0.00 1
UICC stage 7.967 1.790 - 8.790 0.000
Venous invasion 3.981 1.897 - 8.243 0.000
Tumor size 2.882 1.437 - 5.783 0.002
WHO classification 1.435 1.008 - 2.042 0.044
DCC mutation 0.972 0.573 - 3.0 12 0.452
p53 mutation 2.313 0.9 10 - 5.883 0.078
nm23 mutation 1.346 0.680 - 2.662 0.393
Tumor location 0.792 0.472 - 1.329 0.792
Patient's age 0.791 0.262 - 2.386 0.677
Lauren 's classification 0.567 0.261 - 1.228 0.150
Hwang, et al. Mutation of p53, DCC and nm23 genes in gastric carcinoma 333
도에 어느 정도 영향이 있음을 알 수 있었다. 또한 p53 유 전자 변이 양성군의 5년 생존율은 42.8%였고 음성군의 5년 생존율 70.8%에 비하여 불량한 예후를 보여서, p53 변이 양성군에서 5년 생존율 24%, 음성군에서 56%로 병기 또는 림프절 전이 여부에 관계없이 p53 변이 양성 종양에서 예 후가 불량하다고 보고한 Martin 등16의 연구와 비슷한 결과 를 보였다.
DCC 유전자는 분자량 370 kDa의 종양억제유전자로 대 장암 환자의 약 70%에서 변이를 보이는데19, 유방암2 0과 방 광암2 1에서도 변이가 보고되어 있다. 위암 환자 중에서 조 직학적으로 고분화 암에서 DCC 유전자를 비롯한 대장암 관련 종양억제유전자인 APC, MMC 유전자의 변이가 위암 발암 과정의 초기에 발생하여 다른 유전자의 변화에도 영 향을 미치고, 특히 장형 위암은 전암 병변의 발암 단계를 거치는 대장암에서와 비슷하게 만성 위축성 위염, 장형화 생 등의 전암 병변을 거쳐 발생할 것이라고 보고되고 있으
며2 2 ,2 3, 위암 환자의 61%에서 DCC 유전자의 변이가 관찰
된다고 보고하고 있다2 4.
본 연구에서는 DCC 유전자의 변이가 30.0%에서 관찰되 었다. 그러나 종양의 진행도나 병리 소견에 따른 유전자 변 이의 차이는 발견할 수 없었고, 예후와의 관계에서도 DCC 유전자 변이 양성 환자의 5년 생존율이 53.5%로 변이 음성 군의 75.0%보다 낮았으나 통계적 의의가 없는 것으로 나타 났다.
nm23은 1988년 Steeg 등2 5에 의해 처음 발견된 항전이 유전자로 분자량이 17kDa이며 152개의 아미노산으로 구성 되어 있다. 사람에서는 nm23-H1과 nm23-H2의 두 가지가 있으며 이들의 아미노산 구조가 88%의 상동성을 가지고
있다.2 6 ,2 7 nm23 유전자의 발현은 전이의 표현형을 억제하여
유방암, 대장암, 전립선암 등의 인체 악성 종양에서 림프절 전이율이 낮고 무병 생존 기간이 길며 좋은 예후를 보이는 것과 관련이 있다.
위암의 발생과 진행 과정에서 nm23 유전자의 역할에 대 해서는 검사 방법에 따라 8%에서 84%의 광범위한 발현 빈 도를 보고하고 있다.2 8 - 3 0 이는 nm23 유전자 변이가 DNA의 이상으로 인한 변이뿐 아니라 nm23 유전자의 염기서열이 전사(transcription)에 영향을 주어 DNA는 정상이라 하더라 도 비정상적인 mRNA와 단백질을 생산하게 되기 때문에 나타난다.3 1 따라서 nm23 유전자의 변이를 관찰하기 위해 서는 DNA검사법보다는 northern blotting이나 면역조직화 학염색법으로 검사하여야 정확성을 기할 수 있을 것이라 생각된다. 또한 nm23 유전자의 변이와 위암의 진행도 및 예후와의 연관성에 대해서도 연구자에 따라 보고를 달리 하고 있다.2 8 - 3 0 ,3 2 - 3 4
본 연구에서 nm23 유전자의 변이는 25.0%에서 관찰되
었다. 이는 southern blotting 방법에 의한 8%2 8, 14%3 0보다 는 높은 빈도를 보이나 northern blotting2 8이나 면역조직화 학염색법2 9에 의한 nm23 유전자의 발현율에는 미치지 못하 였다. 그러나 nm23 유전자 변이는 암의 진행도와 예후에 영향을 미침을 알 수 있었는데, 저자들은 종양의 크기가 5 cm 이상인 경우, 조직학적으로 점액암과 인환세포암에서, 위벽 침윤 깊이에 따라, 림프절 전이 및 혈관 침윤 양성 예 에서 nm23 유전자 변이의 빈도가 의의 있게 높았다. 예후 와의 관계를 보면 nm23 유전자 변이 양성 예에서 5년 생존 율이 39.5%로 음성 예의 73.9%에 비해 현저히 불량하였다.
위암 환자의 예후는 종양 그 자체의 성상 및 치료 방법 에 큰 영향을 받으며, 예후를 예측하는 데는 병기, 위벽 침 윤 깊이, 영역 림프절 전이 여부, 원격 전이 유무, 종양의 크기, 병리조직학적 분화도 및 환자의 연령 등의 인자들이 중요하게 작용을 한다고 알려져 있다.3 5 ,3 6 그리고 예후는 외과적 치료 방법의 선택에 결정적으로 영향을 받으며 특 히 근치적으로 절제되었나에 따라 크게 영향을 받는다고 하였다.
본 연구에서 p53과 nm23 유전자의 변이는 암의 진행 정 도에 영향을 미치며 예후가 불량함을 알 수 있었지만 다변 량 분석의 결과를 보면 영역 림프절 전이와 위벽 침윤 깊이 가 가장 중요한 독립적인 예후인자로 확인되었다.
본 연구에서는 다단계 발암 과정에 관여하는 다양한 유 전자 변화 중에서 극히 일부에 해당하는 종양억제유전자인 p53, DCC 및 항전이유전자인 nm23에 대한 조사를 하였다.
위암 환자의 일부에서만 p53, DCC 및 nm23 유전자의 변이 가 발견된다는 사실은 이들 변이 유전자가 발암 과정에 영 향을 미치나 위암의 발생과 진전이 다른 경로를 통해 일어 날 수도 있음을 나타낸다. 대상 환자 수가 많지 않고 독립 적인 예후인자로서의 가치는 적지만 본 실험의 결과를 기 초로 해서 향후 연구가 발전되면, 위암의 생물학적 특성, 발암 과정 및 위암 환자의 예후을 분자생물학적 수준에서 자세히 파악할 수 있을 것이고, 유전자치료 등 보조적 전신 적 치료의 효과를 극대화하여 위암 환자의 치료 성적을 향 상시킬 수 있으리라 기대된다.
요 약
목적 : 위암의 발생 및 진행 과정에 관여할 것으로 생각 되고 있는 종양억제유전자인 p53과 DCC 유전자 및 항전이 유전자인 nm23 유전자의 변이가 위암 환자의 임상 및 병리 학적 특성과 관련이 있는지 여부와 예후에 어떤 영향을 미 치는가를 알아보고자 하였다. 대상 및 방법 : 1990년 1월부 터 7월까지 인제대학교 부산백병원 외과에서 근치적 절제 술을 시행받은 위암 환자의 파라핀 포매 위암 조직절편 40
334 대한소화기학회지: 제38권 제5호 2001
개를 대상으로 하였다. 위암 조직과 정상 위점막에서 DNA
를 분리하여 중합효소연쇄반응-단일가닥구조다형
(PCR-SSCP) 방법으로 p53과 DCC 및 nm23 유전자의 변이 여부를 확인하였고, 이를 임상 및 병리 소견과 비교하고 생 존 분석을 시행하였다. 결과 : p53 유전자의 변이는 19예 (47.5%)에서, DCC 유전자의 변이는 12예(30.0%)에서, nm23 유전자의 변이는 10예(25.0%)에서 관찰되었다. p53 유전자의 변이는 림프절 전이와(p=0.035) 림프관 침윤 예 (p=0.022)에 많았고 nm23 유전자 변이는 종양의 크기 5cm 이상(p=0.043), 점액암과 인환세포암(p=0.040), 위벽 침윤 깊이의 정도(p= 0.045), 림프절 전이(p=0.046), 혈관 침윤 (p=0.02 1)의 경우에 많았다. DCC 유전자의 변이는 환자의 임상 및 병리 소견과 연관성이 없었다. 전체 환자의 5년 생 존율은 60.0%였다. DCC 유전자 변이는 생존율에 영향을 미치지 못하였으나 p53 유전자 변이군(p=0.041)과 nm23 유 전자 변이군은(p=0.011) 의의 있게 불량한 예후를 보였다.
예후인자의 다변량 분석의 결과, 주위 림프절 침범과 위벽 침윤 깊이의 정도가 중요한 예후인자였으며 p53, DCC 및 nm23 유전자의 변이는 독립적인 예후인자가 아니었다. 결 론 : 위암 환자의 일부에서 p53, DCC 및 nm23 유전자의 변 이가 발견되었다. p53 유전자와 nm23 유전자의 변이가 있 는 경우는 암의 진행 정도가 심하였고 예후가 불량하였다.
색인단어 : 위암, 유전자 변이, 예후인자
참 고 문 헌
1. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. Cancer Res 1992;52:6735-6740.
2. Tahara E. Molecular mechanism of stomach carcinogenesis.
J Cancer Res Clin Oncol 1993;119:265-272.
3. Watanabe YH, Jass JR, Sobin LH. Histological typing of oesophageal and gastric tumors. 2nd ed. Berlin: Springer;
1990
4. Lauren P. The two histological main types of gastric carcinoma, diffuse and so-called intestinal-type carcinoma, an attempt at a histo-clinical classification. Acta Pathol Microbiol Immunol Scand 1965;64:31-49.
5. Hermanek P, Wittekind C. News of TNM and its use for classification of gastric cancer. World J Surg 1995;19:
491-495.
6. Goelz SE, Hamilton SR, Vogelstein B. Purification of DNA from formaldehyde-fixed and paraffin-embedded human tissue. Biochem Biophys Res Commun 1985;130:118-126.
7. Lane DP, Crawford LV. T antigen is bound to a host protein in SV40 transformed cells. Nature 1979;278:261-
263.
8. Michalovitz D, Halevy O, Oren M. Conditional inhibition of transformation and of cell proliferation by a temperature- sensitive mutant of p53. Cell 1990;62:67 1-680.
9. Harris AL. Mutant p53- the commonest genetic abnormality in human cancer? J Pathol 1990;162:5-6.
10. Hollstein MC, Sidransky D, Vogelstein B, Harris CC. p53 mutations in human cancers. Science 199 1;253:49-53.
11. Uchino S, Noguchi M, Ochiai A, Saito T, Kobayashi M, Hirohashi S. p53 mutation in gastric cancer; a genetic model for carcinogenesis is common to gastric and colorectal cancer. Int J Cancer 1993;54:759-764.
12. Yokozaki H, Kuniyasu H, Kitadai Y, Nishimura K, 쌔애 H, Ayhan A. p53 point mutations in primary human gastric carcinomas. J Cancer Res Clin Oncol 1992;119:67-70.
13. Shiao YH, Rugge M, Correa P, Lehmann HP, Scheer WD.
p53 alteration in gastric precancerous lesions. Am J Pathol 1994;144:5 11-5 17.
14. Starzynska T, Markiewski M, Domagala, et al. The clinical significance of p53 accumulation in gastric carcinoma.
Cancer 1996;77:2005-2012.
15. 오성태, 김진복, 황태숙. 위암에서의 c-erbB-2 및 p53 단백질 발현과 임상병리학적 소견과의 관계 -다변량적 예후인자 분 석-. 대한외과학회지 1994;47:634-648.
16. Martin HM, Filipe MI, Morris RW, Lane DP, Silvertre F.
p53 expression and prognosis in gastric carcinoma. Int J Cancer 1992;50:859-862.
17. 민진식, 이희대, 이기범, 최승호, 박찬일, 노성훈. 위암환자에 서 예후인자로서 EGFR, p2 1 (ras oncogene product) 및 p53 의 연구. 대한외과학회지 1994;46:502-5 10.
18. Gabbert HE, Muller W, Schneiders A, Meier S, Hommel G.
The relationship of p53 expression to the prognosis of 4 18 patients with gastric carcinoma. Cancer 1995;76:720-726.
19. Fearon ER, Cho KR, Nigro JM, et al. Identification of a chromosome 18q gene that is altered in colorectal cancers.
Science 1990;247:49-56.
20. Thompson AM, Morris RG, Wallace M, Wyllie AH, Steel CM, Carter DC. Allele loss from 5q21(APC/MCC) and 18q2 1(DCC) mRNA expression in breast cancer. Br J Cancer 1993;68:64-68.
2 1. Presti JC Jr, Reuter VE, Galan T, Fair WR, Cordon-Cardo C. Molecular genetic alterations in superficial and locally advanced human bladder cacer. Cancer Res 1991;5 1:5405- 5409.
22. Tahara E. Genetic alterations in human gastrointestinal cancers; the application to molecular diagnosis. Cancer 1995;75(suppl):1410-14 17.
황성환 외 2인 . 위암 환자에서 p53, DCC 및 nm23 유전자 변이 335
23. Sano T, Tsujino T, Yoshida K, et al. Frequent loss of heterozygosity on chromosomes 1q, 5q, and 17p in human gastric carcinomas. Cancer Res 199 1;5 1:2926-2931.
24. Uchino S, Tsuda H, Noguchi M, et al. Frequent loss of heterozygosity at the DCC locus in gastric cancer. Cancer Res 1992;52(11):3099-3102.
25. Steeg PS, Bevilacqua G, Kopper L. Evidence for a novel gene associated with low tumor metastatic potential. J Natl Cancer Inst 1988;80:200-204.
26. Nickerson JA, Wells WW. Association of nucleoside diphosphate kinase with microtubules. Biochem Biophys Res Commun 1978;85:820-826.
27. Stahl JA, Leone A, Rosengard AM, Porter L, King CR, Steeg PS. Identification of a second human nm23 gene, nm23-H2. Cancer Res 1991;51(1):445-449.
28. Nakayama H, Yasui W, Yokozaki H, Tahara E. Reduced expression of nm23 is associated with metastasis of human gastric carcinomas. Jpn J Cancer Res 1993;84(2):184-190.
29. Kim KM, Lee A, Chae HS, Shim SI. Expression of p53 and NDP-K/nm23 in gastric carcinomas-association with metastasis and clinicopathologic parameters. J Korean Med Sci 1995;10(6):406-4 13.
30. Hwang BG, Park IC, Park MJ, et al. Role of the nm23-H 1
gene in the metastasis of gastric cancer. J Korean Med Sci 1997;12(6):5 14-5 18.
31. Landschulz WH, Johnson PF, McKnight SL. The leucine zipper: a hypothetical structure common to a new class of DNA binding proteins. Science 1988;240:1759-1764.
32. Kodera Y, Isobe K, Yamauchi M, et. al. Expression of nm23 H-1 RNA levels in human gastric cancer tissues, a negative correlation with nodal metastasis. Cancer 1994;73 (2):259-265.
33. Ura H, Denno R, Hirata K. The significance of nm23 protein expression in human gastric carcinomas. Surg Today 1996;26(12):957-965.
34. Yeung P, Lee CS, Marr P, Sarris M, Fenton-Lee D. nm23 gene expression in gastric carcinoma: an immunohisto- chemical study. Aust N Z J surg 1998;68(3):180-182.
35. Maruyama K. The most important prognostic factors for gastric cancer patients: a study using univariate and mutivariate analysis. Scand J Gastroenterol 1987;22(suppl
133):63-68.
36. Hermanek P, Sobin LH. International Union Against Cancer (UICC): TNM classification of malignant tumors. 4th ed.
Berlin: Springer: 1987