598
목 적: 사람 Bone Morphogenetic Protein-7 (BMP7) 유전자를 안정적으로 발현하는 세포와 재조합 BMP7 아데노바이러 스(AdBMP7)를 개발하여 골형성 및 골재생과 관련된 근골격계 질환에 활용하는 것이다.
대상 및 방법: 골육종세포주 U2OS로부터 역전사 중합효소 연쇄 반응으로 사람 BMP7 유전자를 클로닝하고, HEK293세포 로 BMP7 유전자를 도입시킨 후, BMP7 단백질을 생산하는 세포를 선별하였다. 재조합 BMP7 아데노바이러스(AdBMP7)는 AdEasy vector system을 사용하여 제작하였다. 면역 결핍 생쥐의 피하조직 및 근육조직에 BMP7 발현 세포와 AdBMP7 바이러스를 주사한 후, 골형성 정도를 X-선 및 조직학적으로 확인하였다.
결 과: BMP7 발현 HEK293로부터 활성형 BMP7이 발현되며 면역 결핍 생쥐의 피하조직 및 근육조직에 세포를 이식하였 을 경우 골형성이 유도되었다. AdBMP7 바이러스 자체 및 AdBMP7을 형질 도입한 사람 섬유아세포를 면역 결핍 생쥐의 근육조직에 주사하였을 경우 골형성이 유도되었다.
결 론: 이상의 결과를 통하여 본 연구에서 제작한 BMP7 발현 HEK293세포와 재조합 BMP7 아데노바이러스는 동물 및 시 험관 시험에서 골형성 및 재생에 유용하게 활용될 수 있을 것으로 생각한다.
색인 단어: BMP7, 아데노바이러스, 골형성, 유전자 치료
Purpose: The aim of this study was to develop recombinant human Bone Morphogenetic Protein-7 (BMP7)- stable cells and recombinant human BMP7 adenoviruses (AdBMP7) for osteoinduction and osteoregen- eration in musculoskeletal diseases.
Materials and Methods: The human BMP7 cDNA was amplified from a human osteosarcoma cell line, U2OS using a reverse transcription-polymerase chain reaction and cloned into a eukaryotic expression vector. The BMP7-stable HEK293 cells (HEK293/BMP7) were prepared by transfecting the recombinant BMP7 plasmid vector. The recombinant human BMP7 adenovirus (AdBMP7) was constructed using the AdEasy vector system. The BMP7 expression levels in HEK293/BMP7 and AdBMP7 were measured by activity staining for alkaline phosphatase in mouse C2C12 promyoblast cells. The BMP7-stable HEK293 cells, AdBMP7 itself, or AdBMP7-transduced human fibroblasts were injected into the subcutaneous tis- sues and the calf muscles of immunocompromised mice. The amount of ectopic bone formation was evaluated by radiographic and histological analyses.
Results: Ectopic bone formation was observed after injecting the BMP7-stable HEK293 cells with either the AdBMP7 itself or AdBMP7-transduced human fibroblasts into the subcutaneous tissues and calf mus- cles of immunocompromised mice.
Conclusion: These results showed that HEK293/BMP7 cells and AdBMP7 have a significant potential for bone formation and the regeneration of various bone diseases.
Departments of Orthopaedic Surgery, Biochemistry & molecular biology*, College of Medicine, Yeungnam University, Daegu, Korea
Woo Seok Jang, M.D., Jeong Rae Kim, M.D., Wook Jin Sohn, M.D., Jae Sung Seo, M.D., Myun Whan Ahn, M.D., Yeon Sil Jang*, Hyun Kyung Kim*, and Jae Ryong Kim, M.D.*
Osteoinduction Using Recombinant Bone Morphogenetic Protein-7 Gene
598
재조합 Bone Morphogenetic Protein-7 유전자를 이용한 골 유도
장우석ㆍ김정래ㆍ손욱진ㆍ서재성ㆍ안면환ㆍ장연실*ㆍ김현경*ㆍ김재룡*
영남대학교 의과대학 정형외과학교실, 생화학 분자생물학교실*
598 598 통신저자 : 안 면 환
대구광역시 남구 대명동 317-1 영남대학교병원 정형외과
TEL: 053-620-3643∙FAX: 053-628-4020 E-mail: mwahn@med.yu.ac.kr
*본 연구는 경일약품의 연구비 지원에 의하여 이루어졌음.
Address reprint requests to Myun Whan Ahn, M.D.
Department of Orthopaedic Surgery, College of Medicine, Yeungnam University, 317-1 Daemyeong-dong, Nam-gu, Daegu 705-717, Korea
Tel: +82.53-620-3643, Fax: +82.53-628-4020 E-mail: mwahn@med.yu.ac.kr
골형성 단백질(Bone morphogenetic protein, BMP) 은 transforming growth factor- (TGF- ) super- family에 속하는 펩타이드 성장 인자의 하나이다. 포유 동물에서 조직 간세포(stem cell)에 작용하여 골세포 및 연골 세포로 분화를 촉진시키는 역할을 하는 것으로 알 려져 있다24). 지금까지 15종류의 골형성 단백질이 밝혀 져 있으며 이 중에서 골형성을 유도하는 것으로 확인된 것은 5종으로 BMP2, BMP3, BMP4, BMP6, BMP7
이다8,10,12). 그 외에 세포 성장 및 분화 조절, 세포 사멸
에도 관여하는 것으로 알려져 있다4,14).
BMP의 임상적 활용은 BMP 단백질과 BMP 유전자 를 이용한 유전자 치료제로 크게 나누어진다. BMP 단백 질의 경우 유전자 재조합 기법에 의해 생산된 인간 BMP2 (rhBMP2), 인간 BMP7 (rhBMP7) 단백질을 근골격계 재생에 이용한 임상 연구들이 보고되었다11,25). 재조합 BMP 단백질을 임상에 적용하기 위해서는 마이크로그 램에서 밀리그램 단위의 많은 양이 필요하며26) BMP를 지속적으로 분비시키고 골세포의 성장을 위한 구조물로 작용할 수 있는 운반체가 필요한 것으로 알려져 있다1,23). 따라서 운반체는 감염, 염증 반응, 면역 반응 등을 일으 키지 않아야 하지만 아직까지 이런 조건을 갖춘 적절한 운반체가 유용하지 않은 것으로 알려져 있다16). 재조합 BMP 단백질을 대신하여 BMP 유전자를 이용한 유전자 치료법도 많이 연구되고 있다. 레트로바이러스 벡터5,13) 나 아데노바이러스 벡터를 이용하여 BMP 유전자를 조 직에서 직접적으로 발현시키는 in vivo 방법이나2,21)재 조합 BMP 바이러스 벡터를 골수 세포, 근육 세포, 섬유 아세포 등으로 먼저 감염시킨 후 이를 조직에 이식하는 ex vivo 방법들이 여러 동물 모델에 적용, 성공적으로 골 형성 및 재생 효과를 나타내는 것으로 보고되었다10,17,18). 바이러스 벡터를 이용하지 않고 재조합 BMP 플라스미 드를 전기충격법에 의해 직접 조직에 넣어 발현시키는 방법도 보고되고 있다16).
따라서 본 연구에서는 사람 BMP7 유전자를 안정적으 로 발현하는 세포와 재조합 BMP7 유전자를 발현하는 아데노바이러스 벡터를 개발함으로써 골형성 및 골재생 과 관련된 근골격계 질환에 활용하고자 하였다.
대상 및 방법
1. 연구 대상
BMP7을 증폭하는데 사용한 primer들은 Bionix사 (캐나다)로부터 제작하였다(Table 1). 사람 골육종 세포 U2OS, 사람 배아신장 세포 HEK293, 생쥐 promy- oblast C2C12세포는 미국 ATCC사로부터 구입하였다.
수컷 면역결핍 생쥐(SCID mice/Balb c)는 중앙실험동 물로부터 구입하여, 청정 사육실에서 사육하였다.
2. 방법 1) RNA 추출
RNA는 acid-phenol-quanidinium thiocyanate- chloroform extraction방법으로 분리하였다7). RNA 농도는 260 nm에서의 흡광도를 측정하여 결정하였다.
2) 역전사 중합효소 연쇄 반응
사람 BMP7의 유전자는 역전사 중합효소 연쇄 반응으 로 증폭하였다. PCR 반응은 PerkinElmer 2400 중합 효소 연쇄 반응 기계를 사용하여 95℃에서 3분간 반응 시킨 후 94℃10초, 68℃2분 30초로 5회, 94℃10초, 67℃ 15초, 68℃2분 30초로 5회, 94℃10초, 65℃ 15초, 68℃2분 30초로 20회 반복하고, 68℃7분간 더 반응시켰다. Primer로는 110F, 123F, 1423R, 1441R 을 이용하였다(Table 1).
3) BMP7의 클로닝 및 염기서열 확인
역전사 중합효소 연쇄 반응으로 증폭된 BMP7 DNA 들을 gel extraction kit를 사용하여 추출하였다. 추출 한 DNA를 PCR2.1-Topo TA cloning kit를 사용하 여 PCR2.1 플라스미드 벡터로 삽입한 후 Top10 com- petent E. coli를 형질 전환하였다. 정제한 플라스미드 를 제한 효소 처리한 후 아가로즈 겔에서 전기영동하여 Key Words: BMP7, Adenovirus, Osteogenesis, Gene therapy
primer sequence
110F TAG AGC CGG CGC GAT GAC CGT G 123F ATG CAC GTG CGC TCA CTG CGA G 1423R AGG AGC TAG TGG CAG CCA CAG G 1441R AAG GGT CTG AAT TCT CGG AGG AGC Table 1.Primers used for cloning the BMP7
BMP7 유전자가 삽입된 재조합 플라스미드를 가진 E coil클론을 확인하였다. 클로닝된 BMP7 유전자의 염 기서열은 Macrogen사(한국)에 의뢰하여 dideoxy sequencing법으로 확인하였다.
4) pcDNA3.1 벡터로 BMP7의 subcloning
pCR2.1/BMP7을HindIII, EcoRV 처리하여 BMP7 유전자를 분리한 후, 진핵세포 발현 벡터인 pcDNA3.1 의 Hind III, EcoR V 자리로 삽입시켰다. pcDNA/
BMP7이 제대로 제작되었는지는 Hind III, EcoR V 처리한 후 아가로즈 겔 전기영동으로 확인하였다.
5) HEK293세포에서 유전자 재조합 BMP7의 발현
LipofectAMINE 2000 (Life technologies사)을 사 용하여 pcDNA3.1/BMP7 재조합 플라스미드를 HEK- 293세포로 진핵형질전환(transfection)하였다. BMP7 의 발현은 Northern blot 분석과 alkaline phospha- tase 활성 염색으로 확인하였다.
6) Alkaline phosphatase 활성 염색
C2C12세포를 24 well plate에 70% 정도 차지하도 록 배양하였다. 배양액을 제거한 후, BMP7을 발현하는 것으로 확인된 HEK293 세포의 배양액을 넣고 37℃, 5% 이산화탄소 배양기에서 72시간 동안 배양하였다.
세포를 PBS 용액으로 한 번 세척한 후, 2% parafor- mal-dehyde 용액으로 30분간 고정하였다. PBS로 두 번 세척하고 alkaline phosphatase 활성을 alkaline phosphatase 염색 시약(Sigma사)으로 확인하였다.
7) BMP7 유전자 재조합 아데노바이러스 제작
BMP7 유전자 재조합 아데노바이러스는 Q. Biogene 사의 AdEasy vector system을 사용하여 제작하였다.
pCR2.1/BMP7를 Hind III와 Xba I으로 절단한 후 BMP7 유전자를 분리하였으며, pShuttle-CMV 벡터 의HindIII, XbaI 자리로 삽입하였다. PmeI 효소를 처리한 pShuttle/BMP7 플라스미드 1 g을 100 ng의 pAdEasy-1 벡터와 섞은 후, Bio-Rad electroporator 를 사용하여 200 Ohms, 25 F, 2.5 KV에서 BJ5183 competent cell을 형질 전환하였다. 형질 전환된 세포 를 LB-kanamycin (50 g/mL) 한천 배지에서 하룻
밤 배양하였다. 크기가 작은 세포 군집(colonies)들을 2 mL의 LB-kanamycin 배양액에 접종한 후, 37℃에서 하룻밤 동안 배양하였다. 플라스미드를 분리 정제한 후 0.7% 아가로즈 겔에서 전기영동하여 플라스미드 크기 가 40 kb인 것을 선별하였다. 선별한 플라스미드들을 DH5 E. coli균주로 전기 충격기를 사용하여 형질 전 환하고, LB-kanamycin 배양액에 배양한 후 플라스미 드를 분리하였다. 최종적으로 3회 더 선별, 정제하여 재 조합 BMP7 아데노바이러스(AdBMP7)를 제조하였다.
8) 면역결핍 생쥐에서 HEK293/BMP7, AdBMP7 바이러스 및 AdBMP7 형질 도입된 사람 섬유아세포의 골형성 조사 HEK293/BMP7와 HEK293/pcDNA 세포를 배양 한 후 1×106개의 세포를 3마리의 면역 결핍 생쥐의 오 른쪽과 왼쪽 종아리 근육, 그리고 등쪽 피하 조직으로 주사하였다. BMP7 재조합 아데노바이러스의 효과를 관찰하기 위하여 정제된 AdBMP7 또는 대조군으로 AdLacZ 바이러스를 9×1011개를 각각 3마리의 면역 결 핍 생쥐의 오른쪽과 왼쪽 종아리 근육으로 주사하였다.
2주와 4주 후 생쥐들을 에테르로 마취시킨 후 X선 촬영 을 하였다. 생쥐를 희생시킨 후, 조직을 절제하여 조직 염색을 시행하여 현미경으로 관찰하였다.
결 과
1. 역전사 중합효소 연쇄 반응을 이용한 BMP7의 증 폭 및 클로닝
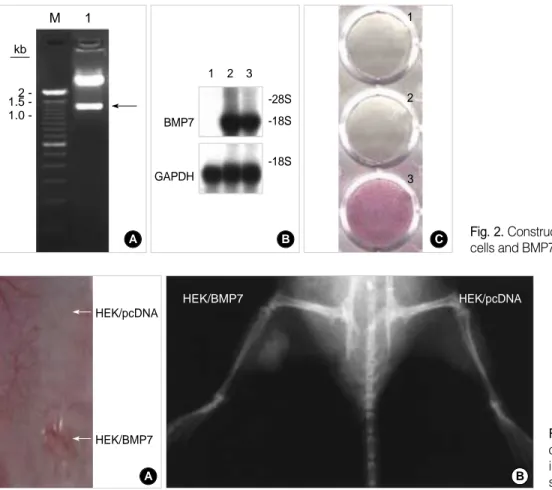
증폭된 유전자를 아가로즈 겔에서 전기영동하여 확인한 결과 BMP7은 1.3 kb의 진한 DNA 띠와 1.1 kb, 0.8 kb 의 연한 DNA 띠가 증폭됨을 확인할 수 있었다(Fig. 1A).
2. BMP7의 subcloning 및 BMP7을 발현하는 HEK293세포 제작
pcDNA3.1/BMP7의 경우 Hind III, EroR V 처리 하였을 때 1.4 kb의 DNA 띠가 각각 관찰되어 예상대로 올바르게 subcloning되었음을 확인하였다(Fig. 2A).
BMP7의 발현을 방사성 동위원소가 표지된 BMP7 probe 를 사용하여 Northern blot 분석으로 확인한 결과 BMP7 재조합 유전자가 HEK293 세포에서 잘 발현되었다(Fig.
2B). C2C12 세포는 생쥐 promyoblast로서 BMP의 처리에 의해 골세포로 분화되며, 그 과정에서 alkaline
phosphatase 활성이 증가하는 것으로 잘 알려져 있다
22). 본 연구에서도 HEK293/BMP7 세포의 배양액을 C2C12세포에 처리한 결과, alkaline phosphatase 활성이 증가됨을 확인하였다(Fig. 2C).
3. HEK293/BMP7의 골형성 효과 조사
2주 후 HEK293/BMP7 세포를 주입한 오른쪽 종아
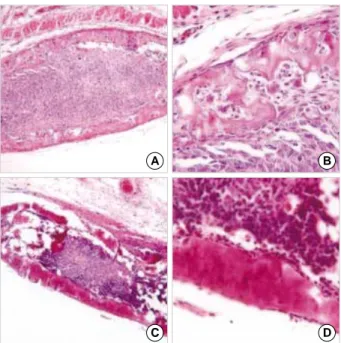
리 근육에서 딱딱한 덩어리가 만져졌으나 BMP7 유전자 가 삽입되지 않은 HEK293/pcDNA3.1 세포를 주입한 왼쪽 종아리 근육에서는 변화가 없었다. 피하 조직에서도 마찬가지로 HEK293/BMP7 세포를 주입한 부분에서 는 딱딱한 덩어리가 만져졌으나 HEK293/pcDNA3.1 세 포를 주입한 부분에서는 변화가 없었다(Fig. 3A). X-선 촬영을 한 결과 HEK293/BMP7 세포를 주입한 종아리 근육에서 뼈로 추정되는 직경 4 mm, 길이 7 mm 정도 의 X-선 비투과성 종괴가 관찰되었다(Fig. 3B).
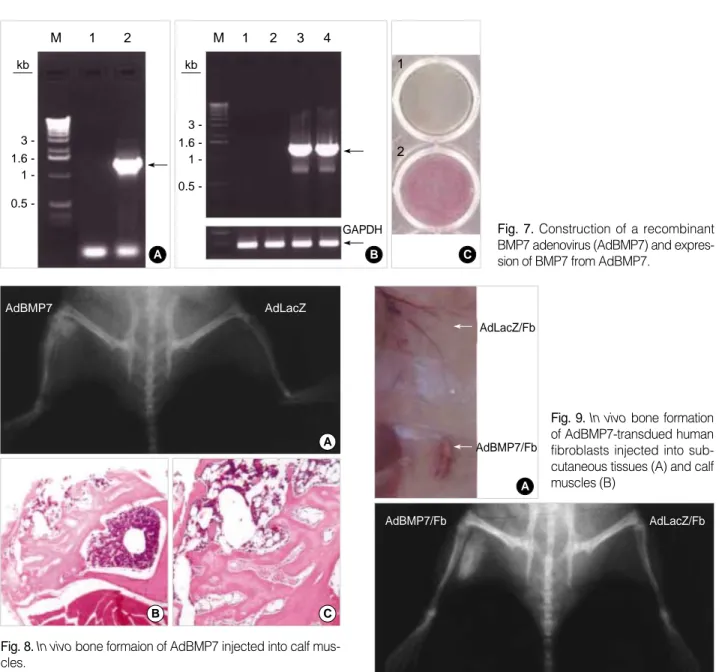
현미경으로 골조직이 형성되었는지 관찰하였는데 피 하 조직에서는 2주째에, 주위 조직과 잘 구분이 되고, 내 부에 HEK 세포로 추정되는 세포들을 포함하고 있는 해 면골 조직이 형성되었음을 확인할 수 있었다(Fig. 4A, B). 4주째에는 치밀골 조직이 확실히 형성되었으며 내 부에는 적혈구 등과 같은 골수 세포들이 존재함을 확인 할 수 있었다(Fig. 4C, D). 4주째 골조직 내에는 HEK 세포에서 유래된 것으로 추정되는 종괴가 관찰되었다.
근육 조직의 경우, 적출한 2주째 종괴에서는 근육과 잘 구분되며 내부에 적혈구, HEK 세포로 추정되는 세포들 Fig. 1.RT-PCR of BMP7 from U2OS cells (A) and cloning of
BMP7 into a pCR2.1 vector (B).
A
M 1
kb
2 - 1.5 - 1.0 -
B
M 1
kb
3 - 2 - 1 - 0.5 -
Fig. 3.In vivo bone formation of BMP7-stable HEK293 cells injected into subcutaneous tis- sues (A) and calf muscles (B).
A HEK/pcDNA
HEK/BMP7
B
HEK/BMP7 HEK/pcDNA
Fig. 2.Construction of BMP7-stable HEK293 cells and BMP7 expression in the cells.
A B C
M 1
kb
1.5 -2 - 1.0 -
BMP7
GAPDH
-28S -18S
-18S
1
2
3 1 2 3
과 함께 해면골 조직 및 골 조직이 관찰되었다(Fig. 5A, B). 4주째 조직에서는 골수 조직, 치밀골 조직들과 함께 암세포들의 증식으로 치밀골 조직의 일부가 분해된 것을 관찰할 수 있었다(Fig. 5C, D).
4. BMP7 유전자 재조합 아데노바이러스 제작 및in vitro활성조사
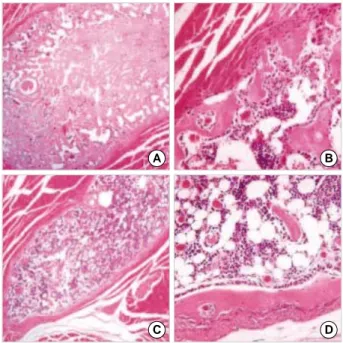
pCR2.1/BMP7 플라스미드로부터 BMP7을 분리한 후 pShuttle 벡터로 subcloning하였다(Fig. 6A). pShut- tle/BMP7을 각각 pAdEasy-1 벡터와 대장균 내에서 상동 재조합한 후 pAdEasy/BMP7이 제대로 만들어졌 음을 확인하였다(Fig. 6B, C).
QBI-293A 세포로 pAdEasy/BMP7을 진핵형질전 환하고 3주 후에 바이러스 집락을 육안으로 뚜렷이 관찰 할 수 있었다. 최종적으로 선별된 재조합 바이러스에 BMP7 유전자가 존재하는지 중합효소 연쇄 반응으로 확인하였다(Fig. 7A). AdBMP7 바이러스를 사람 섬유 아세포에 형질 도입 하였을 때 BMP7이 발현됨을 역전 사 중합효소 연쇄 반응법으로 확인하였다(Fig. 7B). 그 리고 AdBMP7를 형질 도입한 섬유아세포에서 alkaline phosphatase가 활성화되는지 직접 alkaline phos- phatase 활성염색으로 확인하였다(Fig. 7C).
Fig. 6.Construction of BMP7 adenoviral vectors.
A B C
M 1 M 1* 2 3* 4 5 M 1 2
kb
3 - 1.6 - 1 -
0.5 -
kb
40 - 15 - 6 - 4 - 2 -
3 - 2 -
1 - kb Fig. 4.Histological fingings for bone formation of BMP7-stable
HEK293 cells injected into subcutaneous tissues.
A
C
B
D
Fig. 5.Histological examination for bone formation of BMP7-sta- ble HEK293 cells injected into calf muscle.
A
C
B
D
5. AdBMP7 아데노바이러스의 골형성효과 조사 주사한 지 4주 후에 X-선 촬영을 한 결과, AdBMP7 바이러스를 주입한 다리에서 경골과 붙어 있는 뼈로 추 정되는 직경 3 mm 정도의 둥근 X-선 비투과성 종괴가 관찰되었다(Fig. 8A). 조직표본을 제작하여 관찰한 결 과 피질골, 해면골, 골수조직을 갖춘 골 조직이 경골과 부착하여 생성되었음을 확인할 수 있었다(Fig. 8B, C).
2주 후 AdBMP7가 형질 도입된 섬유아세포를 주사한 피하 조직에서 딱딱한 종괴가 만져졌으며 피하 조직을 박리하여 조사한 결과 뼈로 추정되었다(Fig. 9A). 마찬 가지로 근육조직에서도 딱딱한 종괴가 만져졌으며 X- 선 촬영결과 직경 3.5 mm, 길이 9 mm 정도의 뼈로 추
정되는 종괴가 관찰되었다(Fig. 9B). 그러나 AdLacZ 가 형질 도입된 섬유아세포를 주사한 조직에서는 별 변 화가 없었다. 세포를 주입한 지 2주와 4주 후에 생쥐를 희생시켜 각각의 조직 표본을 제작하여 골형성 정도를 조사하였다. 피하 조직과 근육 조직 모두에서 2주째에 는 주위 조직과 잘 구분되는 해면골로 구성된 골조직의 형성을 관찰할 수 있었으며(Fig. 10A, B, 11A,B), 4주 째에는 치밀골, 골수를 갖춘 성숙된 골조직이 형성되었 음을 관찰할 수 있었다(Fig. 10C, D, 11C, D). 주사한 3마리 모두에서 골형성이 관찰되었다.
Fig. 8.In vivo bone formaion of AdBMP7 injected into calf mus- cles.
B
A
C
AdBMP7 AdLacZ
Fig. 9.In vivo bone formation of AdBMP7-transdued human fibroblasts injected into sub- cutaneous tissues (A) and calf muscles (B)
A AdLacZ/Fb
AdBMP7/Fb
B
AdBMP7/Fb AdLacZ/Fb
Fig. 7.Construction of a recombinant BMP7 adenovirus (AdBMP7) and expres- sion of BMP7 from AdBMP7.
A B C
M 1 2 M 1 2 3 4
1
2 kb
3 - 1.6 - 1 - 0.5 -
3 - 1.6 - 1 - 0.5 -
GAPDH kb
고 찰
BMP7은 osteogenic protein-1 (OP-1)으로도 알려 져 있는데 431 아미노산으로 이루어진 분자량 49 kDa 의 단백질이다. 세포 내에서 합성된 후, 절단 및 당화 (glycosylation) 과정을 거치면서 139 아미노산의 성숙 단백질이 된 후 골형성 활성을 가지는 것으로 알려져 있 다6). 그리고 BMP7은 골형성 이외에 신장과 눈의 발생 에 중요한 역할을 하는 것으로도 알려져 있다15,19).
골형성 및 재생을 유도하는 것으로 잘 알려진 BMP 중에서도 골형성 및 재생 연구와 관련하여 BMP 유전자 치료제 및 재조합 BMP 단백질의 활용은 BMP2가 대부 분이며 일부 BMP4, BMP7이 보고되어 있다3). BMP7 을 유전자 치료제로 이용한 것은 Breitbart 등에 의해 처음 보고되었는데5) BMP7 레트로바이러스 벡터를 제 작하여 골막세포를 형질 도입 한 후 이를 PCA 운반체에 이식하고 토끼의 두개골 결손 모델에 적용하므로 골형성 및 재생에 BMP7 유전자 치료제가 활용될 수 있음을 제 시하였다. BMP7 아데노바이러스를 사람 섬유아세포로 형질 도입 한 후 이를 젤라틴 스폰지에 넣어 면역 결핍 생쥐의 피하 조직으로 이식하였을 때 3주 후 골형성이 이루어짐을 확인하였으며 더 나아가 쥐의 두개골 결손 모델에서도 골재생 효과가 있음을 보고하였다17). BMP7 아데노바이러스를 콜라겐 운반체와 섞어 직접 피하나 근
육으로 이식하였을 때 역시 4주 이내에 골형성이 유도됨 을 확인하였다9). BMP7 레트로바이러스 벡터를 토끼의 골막에서 유래된 중배엽 간세포로 형질 도입한 후 이를 토끼의 슬관절 골연골 결손 모델에 적용하였는데 8-12 주 후 완전한 골 재생 효과가 있음을 보고하였다20).
본 연구 결과에서 제작된 AdBMP7의 골형성 능력을 조사한 결과, AdBMP7 바이러스 자체를 근육에 주사하 였을 경우 골형성이 유도됨을 관찰할 수 있었다. 더욱이 AdBMP7 바이러스를 사람 섬유아세포로 형질 도입하고, 이 세포를 이용하여 피하 조직과 근육 조직에서 골형성 능을 조사한 결과 2주에 해면골이 생성되고, 4주에 성숙 된 골수와 치밀골을 갖춘 성숙된 골조직이 형성됨을 관 찰할 수 있었다. 이러한 결과로부터 본 연구에서 개발된 AdBMP7 유전자 치료제는 다른 연구자들에 의해 보고 된 BMP7 유전자 치료제들과 비교할 수 있을 정도로 골 형성에 매우 효과적임을 확인할 수 있었다. 따라서 본 연 구 과정을 통하여 개발된 AdBMP7을 직접 또는 AdBMP7 을 형질 도입한 세포를 세라믹, 콜라겐, PLCA 등과 같 은 다양한 운반체에 부착하여 여러 가지 근골격계 질환 모델 즉, 두개골 결손, 척추 융합, 골연골 손상 등에 적 용하여 골형성 및 재생에 활용할 수 있도록 해야 할 것이 다. BMP7 유전자 치료제를 개발하는 과정에서 BMP7 을 안정적으로 발현하는 HEK293 세포를 제작하므로 Fig. 10.Histological examination for bone formation of AdBMP7-
transduced human fibroblasts injected into subcutaneous tis- sues.
A
C
B
D
Fig. 11.Histological examination for bone formation of AdBMP7- transduced human fibroblasts injected into calf musles.
A
C
B
D
골형성 및 재생에 활용할 수 있는 세포 치료제의 가능성 을 조사하였다. BMP7을 발현하는 세포 치료제 개발에 대한 연구 보고는 아직 없다. 본 연구에서 개발된 HEK- 293/BMP7 세포가 면역 결핍 생쥐의 피하 및 근육 조 직에서 골형성을 유도하였지만 HEK293 세포가 불멸 화된 사람 세포이므로 이 세포에서 유래된 암조직이 동 시에 형성됨을 관찰할 수 있었다. 따라서 현재로서는 직 접 세포를 활용한 세포 치료제로 사용하기에는 어려움이 있을 것이다. 그러나 이 세포를 대량으로 배양하여 세포 밖으로 분비되는 BMP7 단백질을 분리 정제하여 활용 할 수 있는 방법을 개발하면 유용할 것이다.
결 론
본 연구에서 개발된 BMP7 발현 HEK293 세포와 재 조합 BMP7 아데노바이러스는 in vitro 및 in vivo 실 험에서 골형성 및 재생에 유용하게 활용될 수 있을 것으 로 생각한다.
참고문헌
1. Alam I, Asahina I, Ohmamiuda K and Enomoto S: Com- parative study of biphasic calcium phosphate ceramics impregnat- ed with rhBMP-2 as bone substitutes. J Biomed Mater Res, 54:
129-138, 2001.
2. Alden TD, Pittman DD, Hankins GR, et al: In vivo endochon- dral bone formation using a bone morphogenetic protein 2 aden- oviral vector. Hum Gene Ther, 10: 2245-2253, 1999.
3. Alden TD, Varady P, Kallmes DF, Jane JA Jr and Helm GA:
Bone morphogenetic protein gene therapy. Spine, 27(16 Suppl 1):
S87-S93, 2002.
4. Bostrom K, Tsao D, Shen S, Wang Y and Demer LL: Matrix GLA protein modulates differentiation induced by bone morpho- genetic protein-2 in C3H10T1/2 cells. J Biol Chem, 276: 14044- 14052, 2001.
5. Breitbart AS, Grande DA, Mason JM, Barcia M, James T and Grant RT:Gene-enhanced tissue engineering: Applications for bone healing using cultured periosteal cells transduced retrovi- rally with the BMP-7 gene. Ann Plast Surg, 42: 488-495, 1999.
6. Celeste AJ, lannazzi JA, Taylor RC, et al: Identification of transforming growth factor beta family members present in bone- inductive protein purified from bovine bone. Proc Natl Acad Sci
USA, 87: 9843-9847, 1990.
7. Chomczynski P and Sacchi N: Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 162: 156-159, 1987.
8. Daluiski A, Engstrand T, Bahamonde ME, et al: Bone mor- phogenetic protein-3 is a negative regulator of bone density, Nat Genet, 27: 84-88, 2001.
9. Franceschi RT, Wang D, Krebsbach PH and Rutherford RB:Gene therapy for bone formation: in vitro and in vivo osteogenic activity of an adenovirus expressing BMP7. J Cell Biochem, 78:
476-486, 2000.
10. Gazit D, Turgeman G, Kelley P, et al: Engineered pluripo- tent mesenchymal cells integrate and differentiate in regenerating bone: a novel cell-mediated gene therapy. J Gene Med, 1: 121-133, 1999.
11. Geesink RG, Hoefnagels NH and Bulstra SK: Osteogenic activity of OP-1 bone morphogenetic protein (BMP-7) in a human fibular defect. J Bone Joint Surg, 81-B: 710-718, 1999.
12. Groeneveld EH and Burger EH: Bone morphogenetic proteins in human bone regeneration. Eur J Endocrinol, 142: 9-21, 2000.
13. Gysin R, Wergedal JE, Sheng MH, et al: Ex vivo gene thera- py with stromal cells transduced with a retroviral vector contain- ing the BMP4 gene completely heals criticla size calvarial defect in rats. Gene Ther, 9: 991-999, 2002.
14. Hay E, Lemonnier J, Fromigue O and Marie PJ: Bone mor- phogenetic protein-2 promotes osteoblast apoptosis through a Smad- independent, protein kinase C-dependent signaling pathway. J Biol Chem, 276: 29028-29036, 2001.
15. Jena N, Martin-Seisdedos C, McCue P and Croce CM: BMP7 null mutation in mice: developmental defects in skeleton, kidney, and eye. Exp Cell Res, 230: 28-37, 1997.
16. Kishimoto KN, Watanabe Y, Nakamura H and Kokubun S: Ectopic bone formation by eletroporatic transfer of bone mor- phogenetic protein-4 gene. Bone, 31: 340-347, 2002.
17. Krebsbach PH, Gu K, Franceschi RT and Rutherford RB:
Gene therapy-directed osteogenesis: BMP-7-transduced human fibroblasts form bone in vivo. Hum Gene Ther, 11: 1201-1210, 2000.
18. Lee JY, Musgrave D, Pelinkovic D, et al: Effect of bone mor- phogenetic protein-2-expressing muscle-derived cells on healing of
critical-sized bone defects in mice. J Bone Joint Surg, 83-A: 1032- 1039, 2001.
19. Martinez G and Bertram JF: Organization of bone morpho- genetic proteins in renal development. Nephron Exp Nephrol, 93:
El8-22, 2003.
20. Mason JM, Breitbart AS, Barcia M, Porti D, Pergolizzi RG and Grande DA:Cartilage and bone regeneration using gene- enhanced tissue engineering. Clin Orthop, 379(Suppl): S171-178, 2000.
21. Okubo Y, Bessho K, Fujimura K, Lizuka T and Miyatake SI:In vitro and in vivo studies of a bone morphogenetic protein-2 expressing adenoviral vector. J Bone Joint Surg, 83-A(Suppl 1):
S99-104, 2001.
22. Partridge K, Yang X, Clarke NM, et al: Adenoviral BMP-2 gene transfer in mesenchymal stem cells: in vitro and in vivo bone formation on biodegradable polymer scaffolds. Biochem Biophys Res Commun, 292: 144-152, 2002.
23. Urist MR, Lietze A and Dawson E: Beta-tricalcium phosphate delivery system for bone morphogenetic protein. Clin Orthop, 187:
277-280, 1984.
24. Wozney JM, Rosen V, Celeste AJ, et al: Novel regulators of bone formation: molecular clones and activities. Science, 242: 1528- 1534, 1988.
25. Yamagiwa H, Endo N, Tokunaga K, Hayami T, Hatano H and Takahashi HE:In vivo bone-forming capacity of human bone marrow-derived stromal cells is stimulated by recombinant human bone morphogenetic protein-2. J Bone Miner Metab, 19:
20-28, 2001.
26. Yasko AW, Lane JM, Fellinger EJ, Rosen V, Wozney JM and Wang EA:The healing of segmental bone defects, induced by recombinant human bone morphogenetic protein (rhBMP-2).
A radiographic, histological, and biomechanical study in rats. J Bone Joint Surg, 74-A: 659-670, 1992.