암전이와 순환종양세포
암으로 인한 사망원인의 90% 이상은 원발성 암 (primary tumor site) 부위로부터 멀리 떨어진 곳으로 전이가 일어나 는 것(distant metastasis)에 기인한다. 당연히 암 전이를 억제하면 암으로 인한 사망을 줄일 수 있을 것으로 생각될 것이다. 우리는 암전이에 대해 얼마나 알고 있는가? 2014년 Nature에 “Three known unknowns” 라는 제목의 글에는 비록 암치료에 대한 진보가 있었지만 우리가 암에 대해 알 지 못한다고 알려진 세 가지(항암제 저항성, 암 전이, 암세 포 주변의 정상세포의 역할)를 논하고 있다. 이 글에서는 혈 액속에서 떠돌아 다니는 순환종양세포(circulating tumor cell; CTC)가 암 전이에 대한 비밀스런 답을 갖고 있을 거 라고 기술한다. 현재 세계적으로 암 연구는 순환종양세포를 분리하고 분석하고 임상적으로 적용하려는 많은 시도를 하 고 있다. 이 논단에서는 순환종양세포 연구의 역사와 분리 기술, 도전 그리고 임상적 적용과 기대에 대해 기술하고자 한다.
암 전이의 복잡한 단계
우리는 암이 왜 그리고 어떻게 전이되는지에 대해 잘 모
르고 있다. 그 이유는 암 전이가 여러 가지 복잡한 단계로 이루어져 있어 암전이의 전체 과정을 이해하기위한 연구가 쉽지는 않기 때문이다. 간단한 도식으로 표현한다면 암 전 이는 적어도 다음과 같은 6가지 단계를 거친다고 할 수 있 다 (그림 1). 그러므로 이 여러 단계 중 어느 한 단계라도 제 대로 이루어지지 않는다면 암 전이는 일어나기 힘들다.
암 전이에 대한 연구는 적어도 이 여섯 가지 과정에 대한 연구이다. 각 과정동안 필요한 유전자들의 발현과 만들어진 단백질의 시/공간적 배치와 역할, 그리고 이를 조절하는 인 자들을 찾기 위해 많은 연구가 진행되고 있다.
암전이의 초기 과정으로 Epithelial-Mesenchymal Transition (EMT):
대부분의 고형암(solid tumor)은 상피세포 (epithelial cell)에서 기원한다. 상피세포는 E-cadherin 이라는 세 포 표면 단백질로 서로 연결되고 tight junction과 gap junction으로 세포끼리 연접(cell-cell adhesion)을 잘 이 루고 있으며 따라서 운동성이 없다. 이러한 상피 세포가 운 동성을 갖으려면 상피세포 특유의 강한 세포 연접을 끊고 좀 더 자유로운 형태의 모습으로 변해야 한다. 즉 세포 연접
암 전이와 순환 종양 세포
김 용 연
국립암센터 기초실용화연구부 비교생명의학연구과 E-mail: ynk@ncc.re.kr, ynkim33@gmail.com
molecular and cellular Biology Newsletter
을 어깨동무에 비유한다면, 달리기를 잘 하기 위해서 어깨 동무를 풀고 달릴 준비 자세로 바꾸어야 하는 것이다. 이러 한 자세 바꿈을 EMT라고 할 수 있다. 어떻게 잠잠한 초기 의 암세포가 전이능력을 획득하는가에 대해 가장 잘 알려진 이론은 EMT이다. EMT는 지난 십여년 동안 특성 연구가 점진적으로 잘 진행되어 왔고 전이가 일어나기 위해 암세포 가 필수적으로 획득해야 하는 전이 과정의 주요한 특성이 다. EMT는 1982년 각막상피세포에서 처음 묘사되었고 이 용어는 배 발생 동안에 매우 활발히 일어나고 상처치유에 도 활발한 생리적 기능으로 세포 생물학적 프로그램을 뜻한
다. 분자적 특징으로는 세포연접 분자인 E-cadherin의 감 소와 tight junction의 붕괴이고 mesenchymal maker들 즉, N-cadherin, vimentin, fibronectin등이 증가 한다.
세포는 더 방추형으로 모양이 바뀌고 세포의 극성(apical- basal polarity)이 없어진다 (그림2). 또한 EMT가 일어나 면 세포는 운동성과 모양 가변성(plasticity)이 증가하고 세 포사멸에 대한 저항성도 획득한다. EMT의 이러한 특성으로 말미암아 정상세포는 배 발생 동안 이동하고 살아남을 수 있으며, 상처 치유를 위해 상처 난 곳으로 정상 세포가 이동 할 수 있는 것이다. 즉, EMT는 발생과정과 발생 이후의 개 그림 1. A. 원발성 암에서 암세포가 떨어져 나와 암세포가 혈관 근처까지 이동함. B. 혈관을 뚫고 혈액 안으로 들어감, C. 혈류를 타고 다른 곳으로 이동함, D. 혈관을 뚫고 다른 조직으로 들어감, E. 새로운 환경임에도 불구하고 생존함, F. 새로운 환경에 적응하고 분열/성장하여 2차 전이암을 형성함.
그림 2. EMT과정에서 세포의 모양변화, 분자적 변화, 운동성 변화
체의 homeostasis 유지에 필수적인 프로그램이다. 그런데 EMT 프로그램이 암이라는 환경에서 병적으로 활성화 되면 암의 전이와 항암제 저항성을 초래하고 여러 가지 암에서 예후가 좋지 않다.
EMT가 일어난 암세포는 혈관까지 침투하여 이동하고 혈 관을 이루는 내피 세포를 뚫고 혈액으로 들어와 순환종양세 포가 된다. 그럼 이때 순환종양세포는 epithelial cell 인가?
아니면 mesenchymal cell인가?
순환종양세포 연구 역사와 분리 기술 동향
순환종양세포는 1869년 오스트리아 의사인 Thomas Ashworth에 의해 처음으로 관찰되었다. 암 전이로 사망한 환자의 혈액에서 암세포를 관찰한 후 Thomas Ashworth 는 암세포가 원래 발생한 부위에서 떨어져 나와 혈액을 타 고 다니다가 다른 곳에서 정착하여 자라서 암전이를 일으킨 다고 보고하였다. 그러나 오랫동안 순환종양세포 자체 연 구는 쉽지 않았다. Pubmed에서 “circulating tumor cell”
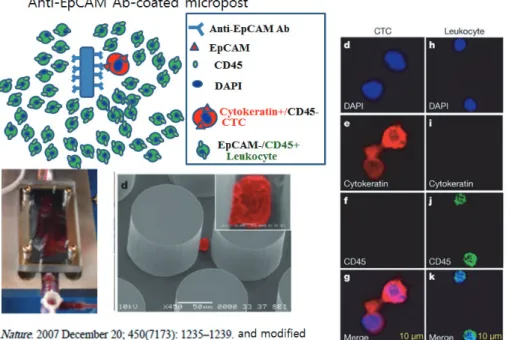
로 검색하면 2016년 3월 까지 17383편의 논문이 발표되 었으며, 그중 Review 논문은 2366편이다. 1951년부터 매 해 1~2 편이 논문이 10년간 발표 되었고 지난 5년간 5400 여편의 논문이 발표되어 순환종양세포 연구는 최근에 관심 이 집중되고 있다. 순환종양세포 연구의 붐에는 순환종양세 포 분리 기술 개발이 한 몫을 하고 있다. 순환종양세포 관 찰 후 100년이 지나서 순환종양세포 detection 시도는 시 작되었지만 본격적인 시작은 1998년에 Racilark 시도한 immunomagnetic separation이다. 순환종양세포의 분리 기술은 단순한 가정에서 시작되었다. “암환자의 혈액에 떠 돌아다니는 상피세포는 암세포이다“ 라는 가정이다. 그림3 에서 보듯이 epithelial cell adhesion molecule (EpCAM) 은 상피세포에서 발현되는 단백질이므로 EpCAM에 결합하 는 항체(anti-EpCAM Ab)로 코팅된 마그네틱 비드 또는 micropost를 이용하여 혈액에 있는 암세포를 capture하여 분리하는 Positive selection의 방법은 초기의 보편화 된 방 법이다. 세포임을 알기 위해 핵을 DAPI로 염색하고 분리된 세포가 암세포임을 확인하기 위해 상피세포에만 발현되는
그림 3. EpCAM항체를 이용한 CTC Detection, Isolation and Validation by Immunostaining using DAPI, Cytokeratin antibody and CD45 antibody.
molecular and cellular Biology Newsletter
cytokeratin과 백혈구에만 발현하는 CD45의 존재를 항체 로 염색하여 DAPI+/Cytokeratin+/CD45- 이면 순환종양 세포로 판단한다.
이러한 EpCAM-based immunomagnetic 원리에 기반 을 둔 CellSearch system은 2004년에 세계 최초, 그리고 유일하게 미국의 FDA의 승인을 받은 순환종양세포 탐지 방 법이 되었다. CellSearch system을 이용하여 암환자의 7.5 ml 혈액에서 순환종양세포를 검출하여 검출된 세포 수와 암 의전이, 암의 진행, 암환자의 생존률, 항암치료에 반응성 등 에 상관관계를 입증하는 연구가 잇달아 발표 되면서 순환 종양세포는 Liquid Biopsy로서 임상적으로 유용한 tool로 자리를 잡게 되었다. 그러나 최근에는 CellSearch system 은 여러 가지 면에서 도전을 받게 되었다. 상피세포 기원인 암일지라도 순환종양세포가 EMT를 겪었다면 세포 표면의 EpCAM 발현은 감소되었을 것이고, 상피세포 기원 암이 아 닌 경우, 예를 들면 melanoma 경우는 EpCAM의 발현은 없을 것이다. 따라서 CellSearch system은 순환종양세포의 효율적 Detection/Isolation측면에서 도전을 받고 있고 전 세계적으로 EpCAM 아닌 다른 마커들을 이용하거나 암세 포의 크기(size), 물리적 특성(deformability)등 다양한 원 리를 이용하여 순환종양세포를 분리하고 동정하고 있다. 다 음 그림4에서 보여 주듯 암세포의 특징을 이용하여 다양하
게 순환종양세포를 Detection/Isolation 방법이 개발 되고 있다(그림4).
위에서 설명한 바와 같이 암세포 특이하게 세포 표면에 서 발현하는 마커를 기반으로 positive selection으로 암세 포를 분리하는 방법이 있다. EMT가 일어난 경우의 순환종 양세포까지 검출하기 위해 EpCAM뿐만 아니라 EMT마커 에 대한 항체 등 여러 항체를 섞어서 순환종양세포의 감지 와 분리 효율을 높이고 있다 (그림4a). Negative selection 으로 CD45항체를 이용하여 백혈구를 제거하고 남는 모 든 세포를 회수하는 방법이 있다 (그림4b). 암세포는 백혈 구보다 크기가 큰 것을 이용하여 체에 거르듯이 순환종양 세포를 분리하는 방법 (그림4c, d)이 있고, 밀도를 이용하 여 Ficoll 원심분리하는 방법 (그림4e), 암세포의 전하차이 를 이용하여 분리 하는 방법(그림4f), 암세포의 크기에 따 라 spiral microchanel에서 분리하는 방법 (그림4g)등이 있 다. 아직도 순환종양세포를 혈액에서 효율적으로 분리하고 자 개발 중이고 각 방법에 따라 검출 효율이 다르며, 각각 장단점이 있다. 이런 점에서 혈액의 적혈구를 제거한 후 모 든 세포를 슬라이드에 올려 염색 후 스캔하여 순환종양세포 를 detection 하는 Epic 시스템은 순환종양세포를 전혀 놓지 지 않는 효율성을 강조 한다. 하지만 여전히 그에 따른 장단 점이 있다. 열거한 바와 같이 순환종양세포의 enrichment
그림 4. 순환종양세포 Enrichment technology.
방법은 정형화 되어있지는 않고 아직도 암환자의 혈액으로부 터 순환종양세포를 최고의 효율로 분리, 동정, 분석할 수 있 는 최상의 생물학적, 물리학적 개념은 무엇인지, 새로운 원 리와 방법으로 개발하고 있는 중이다.
순환종양세포를 감지하는 마커들
분리한 세포가 순환종양세포인지 동정하기 위해 마커를 사용한다. 그런데 우리가 생각하고 있는 제한된 마커가 순환 종양세포를 detection하는데 충분한가? 완벽한 순환종양세 포의 마커는 모든 순환종양세포에만 발현되고 혈액 내재 세 포들(백혈구, 혈관내피세포, 중간배엽세포, 조혈모세포)에 는 발현이 되지 않아야 한다. EpCAM은 상피세포에만 발 현이 되어 주로 순환종양세포 enrichment 과정에서 쓰이 고 Cytokeratins(CK8, CK18, and CK19)는 상피세포 특 이적 세포골격 단백질로 carcinoma 환자의 순환종양세포 를 탐지하는데 gold standard marker가 되었다. 그러나 benign colon disease 환자에서 순환상피세포가 있기 때 문에 이 경우에는 false-positive로 탐지 될수 있다. 더구 나 EMT를 겪은 순환종양세포는 false-negative로 간과될 수 있다. 즉, 순환종양세포를 탐지하는데 Cytokeratins에 만 의지할 수는 없으므로 다른 마커들을 찾는 것이 또 하나
의 도전이다. EMT에도 감소하지 않는 단백질인 plastin3가 순환종양세포의 새로운 마커가 되었고 암특이적 유전변이 를 감지하는 FISH analysis도 현재 이용하고 있다. 조직 특 이 마커로 Prostate–specific antigen, PSA는 전립선암, mammaglobin은 유방암 특이적 마커로 쓰이고, EGFR과 HER2도 순환종양세포 검출마커로 쓰인다. 그럼에도 불구 하고 앞으로 암특이적 마커의 발굴은 더 필요할 것이다.
검출된 모든 순환종양세포의 수가 중요할까?
(enumeration and beyond enumeration)
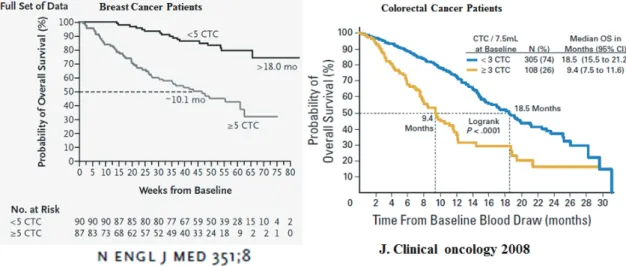
CellSearch 시스템을 이용하여 순환종양세포수와 전이의 상관성, 암의 악성화, 생존율에 대한 상관성의 연구가 지난 10여년간 활발하게 진행되었다. 초기에 연구 결과들은 유방 암, 전립선암, 대장암, 폐암 등 암 환자의 혈액 7.5ml에 순 환종양세포수가 5 보다 크면 생존율이 낮다고 보고하였다 ( 그림5). 또한 순환종양세포의 수가 5보다 크면 치료 후에 도 생존기간이 5보다 작은 환자보다 짧아짐이 보고 되었다.
CellSearch 시스템 뿐 만아니라 EpCAM-independent 방 법으로 순환종양세포를 검출하여 검출된 수와 전이 상관성, 그리고 생존율에 대한 보고가 많아지면서 순환종양세포가 암의 악성화, 진행, 예후예측, 그리고 치료 반응성을 모니터
그림 5. Prognostic value of CTC enumeration for survival of metastatic breast cancer patients and colorectal cancer patients
molecular and cellular Biology Newsletter
링하는 Liquid biopsy로서 관심을 끌게 되었다.
최근에는 단순히 7.5 ml 혈액속의 순환종양세포의 수를 측정하는 (enumeration) 차원을 떠나 또 다른 면에서 임 상적 적용을 하고자 노력을 하고 있다. 원발성 암 또는 전 이된 부위에서 떨어져 나온 세포이기 때문에 순환종양세포 의 genome을 분석하여 암을 일으킨 원인 유전자 또는 치 료 저항성 원인 유전자를 찾는 것이다. 예를 들면 대장암환 자에서 KRAS 돌연변이가 있으면 EGFR 저해제에 잘 반 응하지 않는 것으로 알려져있다. 원발성 암에서는 KRAS wild-type인 환자의 혈액에서 분리한 순환종양세포 하나 하나를 분석한 결과 KRAS wild-type과 mutant-type 모 두가 발견된 경우가 있다 (intra-patient KRAS mutation heterogeneity). 암의 부위에 따라 암세포의 성질 및 유전 적 변이가 다른 암의 이질성(tumor heterogeneity)은 최 근 잘 알려져 있다. 현재 원발성암 조직의 일부분만 떼어 서 KRAS mutaion 분석하므로 조직 분석 만으로는 KRAS mutation heterogeneity를 놓칠 가능성이 있다. 그러나 암 세포가 암의 여러 부위에서 떨어져 나온다면 순환종양세포 가 암의 이질성을 반영할 수 있고 순환종양세포 각각을 분 석하면 KRAS wild-type과 mutant-type 모두를 발견할
가능성이 높다.
순환종양세포의 특성을 연구하기 위해 세계의 많은 연구 실에서 순환종양세포를 배양하는 시도를 하고 있고 몇몇의 성공 사례는 보고되고 있으나 아직 정형화된 방법은 없다고 볼 수 있다. 또한 분리한 순환종양세포를 xenograft하는 시 도와 몇몇의 성공 사례도 보고 되었다. 이러한 시도는 순환 종양세포가 전이에 관여하는 지, 그렇다면 그 특징이 무엇 인지 이해하고자 하는데 큰 도움이 된다. 그러므로 순환종 양세포의 배양과 xenograft 또한 전이 이해를 위해 도전해 야 할 부분이다.
순환종양세포가 전이에 성공하기 위해 넘어야 할 방해요소들
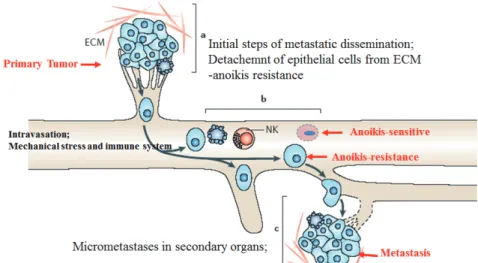
혈액속으로 일단 들어가면 혈액을 떠도는 암세포는 전 이에 성공하기 위해 반드시 넘어야 할 몇가지 관문이 있 다. 첫째, 혈류로 인한 shear stress와 혈액 세포들과의 충 돌은 순환종양세포의 생존력을 떨어뜨릴 수 있다. 그러 나 EMT가 일어난 순환종양세포는 상피세포에 비해 shear stress에 대한 저항성이 있어 살아 남을 가능성이 높다. 또
그림 6. Anoikis-resistance and metastasis
한 Platelet은 순환종양세포와 결합하여 shear stress로부 터 암세포를 보호한다는 보고도 있다. 둘째는 순환종양세 포가 세포외기질(extracellular matrix: ECM)에 부착되 지 않은 상태에서 살아 남아야 한다. 상피세포는 파이브로 넥틴과 콜라젠 같은 ECM에 부착하고 세포와 세포가 연접 하여 자란다. 세포 표면에 있는 integrin이 ECM에 결합하 고 세포부착단백질들 (cell-cell adhesion molecules and cell junction proteins)의 결합으로 세포와 세포는 연결되 어 생존하게 된다. 세포가 어떤 이유로 세포부착성을 잃고 ECM으로부터 떨어지고 세포 상호작용이 없으면 세포는 생 존을 위한 신호전달을 억제하고 세포사멸을 촉진하는 신호 전달을 활성화하여 세포사멸이 일어나며 이와 같은 세포부 착성 상실로 인한 세포사멸을 anoikis라고 한다. anoikis는 배 밸생(Embryogenesis) 동안에 매우 중요하며 배 발생이 후에도 tissue homeostasis에 중요하다. 세포가 부착성을 잃었을 때 정상 세포에서 anoikis는 매우 민감하게 나타난 다. 그러나 암세포의 경우 부착성을 잃어도 세포 사멸을 회 피하는 anoikis-resistance를 획득한다. 이것은 특히 성공 적으로 전이가 되기 위해 혈액 속에서 살아남아야 하는 순 환종양세포가 반드시 획득해야할 주요한 특성이다 (그림6).
세 번째 관문으로 순환종양세포는 면역체계에 대면하여 이 겨야 하는 것이다. 대장암의 경우 CD47이 증가되면 순환종 양세포는 machrophage와 dendritic 세포의 공격을 막을 수 있다고 보고되었다. 마지막으로, 순환종양세포는 혈액을 빠져나오기 위해 혈관내피세포와 필수적으로 결합해야하는 데 platelet이 이 과정을 촉진한다고 한다. 따라서 platelet aggregation을 저해하면 암세포가 활성화된 platelet과 결 합하는 것을 방해할 것으로 예견되고 있다.
순환종양세포가 전이에 성공하기 위한 마지막 단계: Breaking dormancy
순환종양세포가 모세혈관에 이르러 혈관내피세포에 부착 하고 마침내는 혈관을 뚫고 조직으로 이동한다. 순환종양세 포가 가장 많이 homing 하는 곳은 뼈이다. 그래서 골수는 disseminating tumor cell (DTC)의 저장고라고 생각되고
있다. 골수에 있는 DTC는 휴면상태로 지내면서 전신치료동 안에도 치료를 회피하여 살아 있다가 어떤 자극에 의해 다 시 분열하기 시작하여 암이 성장하고 전이가 되게 한다. 암 세포의 휴면의 주요 요인은 EMT라고 보고 있다. EMT 과 정을 거친 순환종양세포의 mesenchymal phenotype은 세포 성장 보다는 세포 운동성을 촉진하여 암세포가 혈관 을 빠져 나오게 한다. 빠져나온 순환종양세포는 EMT에서 mesenchymal-epithelial transition (MET)로 전환되어야 분열을 시작할 수 있고 마침내 전이암을 형성한다. 이런 점 에서 EMT와 MET의 중간적 성질을 띤 암세포는 훨씬 더 효 율적으로 침투하고 자라서 암전이가 잘 되도록 한다고 여겨 지고 있다. 무엇이 EMT를 MET로 전환시키는지, 어떤 요소 가 tumor dormancy를 깨뜨리는지를 찾는 것은 암 전이를 이해하기 위한 또 다른 도전이다.
마무리
암의 전이는 암세포가 원발성 암으로부터 떨어져나와 침 윤하여 근처의 혈액으로 들어감으로 시작한다. 암세포가 EMT를 겪으면서 세포의 운동성과 침윤성을 획득하고 순 환종양세포는 platelet 또는 machrophage와 결합하여 shear stress나 anoikis에도 견디게 된다. 혈류에서 살아남 은 순환종양세포는 혈관을 뚫고 나와 제2의 장소에서 적응 하여 자라서 전이가 완성된다. 그러므로 혈액에서 순환종양 세포 검출과 검출된 세포 수는 암전이를 예측하는데 중요한 지표임에는 분명하다. 검출된 세포가 암세포인지 확인하기 위해 특정 단백질의 분비나 발현, DNA 돌연변이, 그리고 RNA profiling을 분석한다. 앞으로는 순환종양세포의 임 상적 활용성을 높이기 위해 순도와 효율성이 높은 순환종양 세포 검출 기술 개발과 더불어 검출된 암세포를 single cell 수준에서 분석하거나 약물 테스트를 할 수 있는 기술의 접목 이 필요하다 .
임상적으로 순환종양세포는 암의 전이나 치료의 반응성 을 실시간으로 모니터링 할 수 있는 지표로서 매우 높은 가 치를 지닌다. 이와 더불어 순환종양세포의 분자적 특성을
molecular and cellular Biology Newsletter
분석하면 우리는 치료의 새로운 타겟을 발굴할 수 있고 개 인 맞춤으로 암전이 억제가 가능 할 것으로 전망된다. 무 엇보다도 순환종양세포의 전이 관련 생물학적 기능을 이해 하는 것이 가장 중요한데 이는 순환종양세포를 배양하거나 xenograft로 키우는 성공률을 높이는 데에 달려있다. 순환 종양세포 배양과 xenograft가 성공한다면 우리는 암전이에 대한 많은 이해와 정보를 바탕으로 새로운 암치료법을 시도 하고 반응성을 테스트 하는데 유용하게 쓸수 있다. 즉, 순환 종양세포의 생물학적 특성 분석은 암전이 생물학에 대한 깊 은 이해를 바탕으로 암전이를 억제하여 암을 컨트롤 하는데 유용한 정보를 제공 할 수 있다.
[ 참고 문헌 ]
1. Bourzac K. Nature. 2014 May 29;509(7502):S69-71.
2. Chaffer CL, Weinberg RA. Science. 2011 Mar 25;331(6024):1559-64.
3. Lindsay J Talbot, Syamal D Bhattacharya, Paul C Kuo. Int J Biochem Mol Biol 2012;3(2):117-136 4. Sunitha Nagrath, Lecia V. Sequist, Shyamala
Maheswaran, Daphne W. Bell, Daniel Irimia1, Lindsey Ulkus, Matthew R. Smith, Eunice L. Kwak, Subba Digumarthy, Alona Muzikansky, Paula Ryan, Ulysses J. Balis, Ronald G. Tompkins, Daniel A.
Haber & Mehmet Toner. Nature 2007, 450, 1235- 1239
5. Kiki C. Andree, Guus van Dalum, Leon W.M.M.
Terstappen, Mol Oncol. 2016 Mar;10(3):395-407
6. Catherine Alix-Panabières & Klaus Pantel. Nature Reviews Cancer 14, 623–631 (2014)
7. Joosse SA, Gorges TM, Pantel K. EMBO Mol Med.
2014 Nov 14;7(1):1-11.
8. Yong-Nyun Kim, Kyung Hee Koo, Jee Young Sung, Un-Jung Yun, and Hyeryeong Kim. International Journal of Cell Biology Volume 2012 (2012), Article ID 306879, 11 pages
9. Kiki C. Andree, Guus van Dalum, Leon W.M.M.
Terstappen. Molecular Oncology. Volume 10, Issue 3, March 2016, Pages 395–407
저 | 자 | 약 | 력
김 용 연
1983-1987 이화여자대학교 자연과학대학 생물학과 (학사) 1987-1989 이화여자대학교 대학원 동물생리학 발생학 전공
(석사)
1995-2000 미국 위스콘신대학 내분비생식생리/
생물분자화학 전공 (박사) 2000-2002 미국 위스콘신대학 내분비생식생리/
생물분자화학 (박사후연구과정) 2002-2005 서울대학교 의과대학 종양면역학 연구교수 2005-2010 국립암센터 소아암 연구과 선임연구원 2010-2012 국립암센터 소아암 연구과 책임연구원 2012-현재 국립암센터 비교생명의학연구과장