접수일:2009년 4월 10일, 승인일:2009년 4월 24일
책임저자:원 종 호 140-743 서울시 용산구 한남동 대사관길 22 순천향대학교병원 내과
냉동 전 실온에서 하룻밤 보관한 제대혈의 단기 및 장기 조혈능
정윤석ㆍ김숙자ㆍ김경하ㆍ김한조ㆍ김세형ㆍ김현정ㆍ이상철ㆍ배상병 김찬규ㆍ이남수ㆍ이규택ㆍ박성규ㆍ홍대식ㆍ박희숙ㆍ원종호
순천향대학교병원 내과
= Abstract =
Short & Long-term Repopulating Capacity of Cord Blood Cells That Are Stored Overnight before Cryopreservation
Yun-Seok Jung, Sook-Ja Kim, Kyung-Ha Kim, Han-Jo Kim, Se-Hyung Kim, Hyun-Jung Kim, Sang-Chul Lee, Sang-Byung Bae, Chan-Kyu Kim, Nam-Su Lee, Kyu-Taek Lee,
Sung-Kyu Park, Dae-Sik Hong, Hee-Sook Park, Jong-Ho Won
Division of Hematology & Oncology, Department of Internal Medicine, Soonchunhyang University College of Medicine, Seoul, Korea
Background: Umbilical cord blood (UCB) is generally stored overnight and it undergoes a CD34 positive selection process the next day for reducing the cost and due to the convenience. We intended to determine whether overnight storage of cord blood cells affects the short and long-term repopulating capacity.
Methods: Five individuals’ UCB samples were analyzed by colony assay, apoptotic cell counts and long term bone marrow culture. All the samples were divided to four groups, which were the fresh group (immediate use of harvest), the overnight storage group (overnight storage at room temperature after harvest), the immediate cryopreservation group (immediate cryopreservation after harvest) and the overnight cryo group (cryopreservaton after overnight storage at room temperature after harvest).
Results: The number of colony forming units-granulocyte macrophage (CFU-GM) was 116.2±20.1 in the fresh group and 90.8±15.8 in the overnight storage group (P=0.07). The number of CFUs-GM was similar between the immediate and overnight cryo groups (P=0.79). The immediate cryo group showed a significantly lower number of CFUs-GM as compared to that of the fresh group (P=0.03). The apoptotic cells were detected at 21±6.8% in the fresh group and this was 24.2±2.4% in the overnight storage group (P=0.32), and this was similar between immediate and overnight cryo groups (P=0.80). The fresh group had a significantly lower number of apoptotic cells compared to that of the immediate cryo group (P=0.02). After long term stromal-based culture, the mean production of CFU-GM colonies was similar between all the groups (P>0.05).
Conclusion: These results support the continue use of overnight storage of UCB before cryopreservation as a convenient, cost reducing measure. (Korean J Blood Transfus 2009;20:14-22)
Key words: Overnight storage, Umbilical cord blood cell, Cryopreservation
서 론
과거 조혈모세포 이식술은 주로 골수기증을 통 하여 이루어져 왔으며, 공여자는 주조직적합항원 이 일치하는 형제가 이상적이지만 형제간의 주조 직적합항원이 일치할 확률은 25%로 낮아 골수 공여자의 절대적인 부족이 골수이식의 문제였 다.1) 1974년 조혈모세포가 제대혈액에 존재한다 는 것이 처음 보고된 이후2) 버려졌던 제대혈을 사용함으로써 조혈모세포를 쉽게 수집할 수 있는 자원으로 이용하게 되었다. 그러나 제대혈을 전 량 냉동 보관하려면 부피가 크기 때문에 보관상 의 문제가 발생하여 이를 극복하기 위하여 단핵 구만 분리해 보관하는 방법, CD34 양성세포만 분 리하는 방법 등을 이용하고 있다.
그러나 분만이 밤이나 휴일에 이뤄지는 경우 제대혈에서 단핵구 또는 CD34 양성세포를 분리 하여 즉시 보관이 어려워 채취한 제대혈액을 실 온에서 보관한 후 24시간 이내에 수거하여 세포 분리 및 보관하는 방법을 시행하고 있으나 안전 성에 관한 문제가 꾸준히 제기되고 있다. 제대혈 이식의 경우 채취한 조혈모세포의 양이 매우 적 으므로 일부의 손상이 있더라도 생착에 큰 영향 을 미칠 가능성이 있어 이에 대한 정확한 확인이 필요한 실정으로 이에 본 연구진은 실온에서 제 대혈액을 보관한 후 이식능의 차이와 실온보관이 냉동 전후에 이식능에 미치는 영향을 보기 위하 여 제대혈에서 단핵구를 분리하여 연구를 시행하 였다.
본 연구에서 제대혈중 CD34 양성세포가 아닌 단핵구를 분리하는 방법을 이용한 것은 실제 제 대혈 은행에서 CD34 양성세포를 분리하지 않고 단핵구만을 분리하여 보관하는 실정이므로 이와 같은 조건에서 실험을 시행하고자 하였다.
재료 및 방법
1. 제대혈의 채혈
37∼42주 사이의 정상적인 만삭질식분만 다섯 예에서 제대혈을 채혈하였다. 채혈방법은 신생아 분만 직후 제대를 자른 다음 citrate phosphate dex- trose (CPD)가 담긴 50 mL 튜브에 무균적으로 최 대량을 채혈하였다.
2. 제대혈의 처리 시간
채혈된 제대혈은 총 네 군으로 나누어 실험을 진행하였다. 즉시처리군(fresh group)은 제대혈 채 혈 한 시간 이내에 단핵구를 분리하여 실험을 시 행하였으며, 즉시냉동군(immediate cryo group)은 즉시처리군과 같은 방법으로 단핵구를 분리 후 즉시 냉동하여 30일간 냉동 후 해동하여 실험을 진행하였다. 밤샘보관군은 제대혈 채혈 후 실온 에서 18시간에서 24시간 이내로 보관한 뒤 단핵 구를 분리하였으며, 익일냉동군은 밤샘보관군과 같은 방법으로 단핵구를 분리한 뒤 즉시 냉동하 여 30일간 보관 후 해동하여 실험을 시행하였다.
3. 단핵구 분리 및 냉동 보관
채취한 제대혈(fresh) 1 mL당 방부제가 포함되 지 않은 헤파린 10단위로 전처치된 혈액을 비중 1.077의 Ficoll-Hypaque 용액 위에 중첩시킨 후 400 g에서 25분간 원심 분리하였다. Ca++, Mg++이 없는 인산 완충 식염수(Phosphate buffered saline:
PBS)로 2회 세척한 후 Iscove’s Modified Dulbe- cco’s media (IMDM)배지에 부유시켰다. 단핵구는 10% 우태아혈청(Fetal Bovine Serum, Gibco, Gai- thersburg, MD)이 포함된 IMDM에 부유시킨 뒤 실험에 이용하였고, 즉시냉동군의 단핵구는 Pro- grammed Cell Freezing System (CryoMED)을 이용
하여 안전하게 얼렸으며 액체질소에서 30일간 보 관한 후 실험에 사용하였다. 익일냉동군은 제대 혈 채취 후 하룻밤 실온에서 보관한 검체를 같은 방법으로 단핵구를 분리하여 얼렸다.
4. Colony Assay (Colony forming unit- granulocyte macrophage CFU-GM 집락 배양)
네 군의 단핵구세포를 각각 1% Methylcellulose, 30% 우태아혈청(FBS), 1% 우혈청알부민(bovine serum albumin), 104M 2-Mercaptoethanol, 2 mM L-glutamine, 10% Agar Leukocyte Conditioned Me- dium과 3 units/mL의 Erythropoietin을 포함한 IMDM 배지(MethoCultTM H4431, Stem Cell Technologies Inc, Vancouver, Canada)에 5×104/plate의 세포를 넣고 35 mm Petri dish 에 분주하였다. 이를 37oC, 5% CO2 습윤 배양기에서 14일간 배양하였다. 각 실험은 3번 반복하여 실험하였으며 집락은 도립 현미경하에서 관찰하여 집락수를 세었다. CFU- GM 집락은 50개 이상의 과립계 세포가 모인 것 으로 정의하였다.
5. Annexin-V/PI staining
초기 아포토시스세포는 Annexin-V-FLOU Staining Kit (Roche Diagnostics Corporation, Indianapolis, IN, USA)를 이용하여 측정하였다. 요약하면 네 군의 단핵구세포를 0.1% sodium azide를 포함한 PBS Buffer로 2회 세척한 후 100μL의 세포 부유 액에 FITC가 부착된 annexin-V 5와 Propidium iodide (PI)용액 5μL를 넣고 4oC, 암소에서 15분 간 방치하였다. 여기에 Binding 용액 500μL를 첨 가하여 dual-color flow cytometry (FC 500, Beckman Coulter, Inc. Fullerton, CA 92835 USA)로 10,000개 의 세포 중 아포토시스 세포의 비율을 분석하였 다. 초기 아포토시스 세포는 Annexin V-FITC+이
고 PI−인 세포로 정의하였다.
6. 장기간 골수 배양(LTC-IC)
장기간 골수 배양에 필요한 간질세포(stromal cells)를 1,500 cGy로 방사선 조사한 후 각각의 비 활성화된 12.5% FBS 및 Horse serum, 1% Glutamin, 1% pyruvate, 1% penicillin-streptomycin, 106M 21- phophate hydrocortisone (Sigma Chemical Co, St Louis, MO)이 포함된 Iscocve's Modified Dulbe- cco's Medium (IMDM, GIBCO)에 부유시켜 25 cm2 tissue culture flask에 넣고 37oC, 5% CO2 배양 기에서 24시간 동안 부착시켰다. 여기에 각 군의 검체의 단핵구 5×106을 넣고 5주 동안 배양을 유 지하였다. 1주마다 새로운 배양액으로 바꿔주면 서 관찰하였다. 5주째 유착세포와 비유착세포를 모두 얻어서 그 중 일부 세포로 colony assay를 시 행하였다.
7. 통계분석
각각의 조건에 따라 배양한 집락수의 비교와 아포토시스의 비교는 Student's t-test를 사용하였 으며, P (probability) 값은 0.05 이하 시 유의한 차 이가 있는 것으로 판정하였다.
결 과
1. CFU-GM 집락형성 비교
즉시처리군에서 시행한 CFU-GM 집락수는 116.2±
20.1로, 밤샘 보관군의 90.8±15.8와 유의한 차이 를 나타내지 않았으나(P=0.07), 즉시냉동군의 집 락수가 86.9±31.2로 유의하게 낮았다(P=0.03). 익 일냉동군의 집락형성은 83.8±37.2로 채혈 후 즉 시냉동군과 비교 하였을 때 유의한 차이를 나타 내지 않았다(P=0.79)(Fig. 1).
Fig. 1. The comparison of CFU-GM colony numbers of cord blood mononuclear cells. Immediate cryo group has significantly lower numbers of CFU-GM compare to fresh group (P=0.03)(Fresh, immediate process after harvest; Overnight, overnight storage at room temperature after harvest; Immediate cryo, immediate cryopreservation after harvest; Overnight cryo, cryopreservation after overnight storage at room temperature after harvest).
Fig. 2. The comparison of the apoptosis ratio of cord blood mononuclear cells. Fresh group has sig- nificantly lower numbers of apoptotic cells compare to immediate cryo (P=0.02) and overnight cryo group (P=0.02).
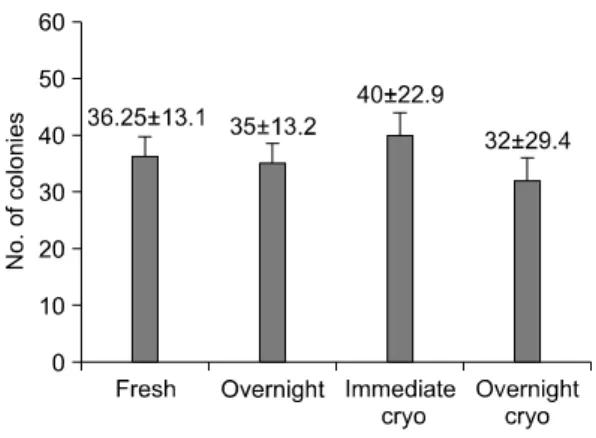
Fig. 3. The comparison of CFU-GM colony num- bers of cord blood mononuclear cells after long term bone marrow culture for 5 weeks. There was no statistically significant difference between all groups.
2. 아포토시스(Apoptosis)의 비율(%) 즉시처리군의 아포토시스는 21±6.8%, 밤샘보관 군에서는 24.2±2.4%로 차이를 보이지 않았다 (P=0.32). 즉시처리군과 냉동군간의 아포토시스 비교에서는 즉시냉동군이 32.6±11.5% (P=0.02), 익일냉동군이 31.7±8.2% (P=0.02)로 냉동군에서 모두 높았다. 즉시냉동군과 익일냉동군의 비교는 유의한 차이를 나타내지 않았다(P=0.80)(Fig. 2).
3. 장기간 골수배양 후 집락형성의 비교
즉시처리군의 단핵구를 5주간 골수 배양한 결 과 CFU-GM 집락 형성은 36.3±13.1, 밤샘보관군 의 단핵구의 배양 후는 35±13.2로 두 군 간의 유 의한 차이를 보이지 않았다(P=0.90). 즉시냉동군 은 40±22.9로 즉시처리군과 역시 유의한 차이를
나타내지 않았으며(P=0.61), 익일냉동군의 단핵 구를 배양 시 32±29.4로 나타났으며 즉시냉동군 과 비교하여 역시 유의한 차이를 보이지 않았다 (P=0.42)(Fig. 3).
Fig. 4. Inverted microscopic finding of cobble stone areas in long-term bone marrow culture (×100). (A) Culture for 1 week before cryopreservation in initial cord blood cells. (B) Culture for 1 week before cryopreservation in overnight storage of cord blood cells. (C) Culture for 5 weeks before cryopreservation in initial cord blood cells. (D) Culture for 5 weeks before cryopreservation in overnight storage of cord blood cells.
4. 도립현미경을 이용한 배양기간에 따른 단핵구의 관찰
배양 1주째와 5주째에 도립현미경으로 cobble stone area를 관찰하였다. 즉시처리군의 단핵구는 배양 1주째에 간질세포에 많은 수의 CD34양성세 포가 달라붙는 cobble-stone 모습을 보였으며, 밤 샘보관군에서 채취한 제대혈에서도 같은 모습이 관찰되었다. 5주간 배양 후 관찰에서도 두 군 간
의 차이점을 발견할 수 없었다(Fig. 4).
고 찰
조혈모세포의 세포 표면에 CD34 양성항원이 발현하는데3) 착안하여 백혈구 성분 채집물에서 CD34 양성세포만 분리하여 조혈모세포 이식에 사용하고 있다. 이러한 방법은 처리 과정에서 조 혈모세포의 손실이 발생하는 문제와 함께 채취
후 즉시 처리하는 비용이 많이 들며 휴일이나 늦 은 밤시간에는 즉시 분리가 어려운 단점이 있다.
이러한 비용의 문제와 채취시간의 제한을 해소하 는 방안이 필요하여 하룻밤 저장과 같은 단기간 의 저장이 필요하였으며, 말초혈액을 이용한 조 혈모이식에 대한 연구에서는 섭씨 4oC로 보관 시 자가 조혈모세포 이식에 있어 이식 결과에 영향 을 미치지 않았으며 비용을 절감할 수 있었다고 하였다.4,5) 장기간 보관을 위한 냉동 시, 냉동전과 비교하여 냉동후 CD34 양성세포의 수가 감소하 지만 자가 조혈모세포 이식의 결과에는 영향을 주지 않았다.6) 이에 더 나아가 냉동 전 하룻밤 보 관한 백혈구성분 채집물 역시 이식 후 단기, 장기 생착률 모두에 영향을 미치지 않는다고 보고되었 다.7)
제대혈액내의 조혈모세포의 사용은 Broxmeyer 등이 제대혈액의 조혈모세포가 이식에 사용할 수 있다고 보고한 이후 많은 연구들을 통하여 발전 하여 현재는 조혈모세포이식의 한 방법으로 활발 히 이루어지고 있다.8-11) 그러나 제대혈을 얻을 수 있는 분만의 시기가 저녁이나 휴일인 경우 CD34 양성세포의 분리를 즉시 시행하는 어려움이 있어 불가피하게 밤샘 저장이 필요하게 된다. 골수나 가동화된 말초혈액과 달리 제대혈은 용량이 적어 조혈모세포 성분의 절대량 역시 매우 적다는 단 점이 있어 조혈모세포의 손실유무가 저장에 가장 큰 문제가 된다. 따라서 앞서 언급한 말초혈액 조 혈모세포 이식처럼 제대혈에 있어서도 하룻밤 보 관과 냉동저장이 조혈모세포에 미치는 영향에 대 한 정확한 연구가 필요하며, 실제 제대혈은행에 서 제대혈의 보관방법으로 CD34 양성세포가 아 닌 단핵구만을 분리하여 보관하고 있어 단핵구를 이용한 보관방법에 대한 연구가 필요하다.
본 연구에서 제대혈 단핵구를 이용하여 CFU- GM 집락배양 하여 냉동 전후와 하룻밤 보관유무
에 대한 비교실험에서는 즉시처리군의 집락형성 을 밤샘보관군과 비교하였을 때는 통계학적 차이 를 나타내지 않았으나, 즉시냉동군과의 비교에서 는 차이를 보였다. 익일냉동군의 집락수와 즉시 냉동군간의 집락수를 비교 시에는 유의한 차이를 나타내지 않았다. 이는 이미 보고된 냉동보존 후 해동하였을 때의 세포생존율이 냉동보전 전의 세 포생존율에 비하여 감소한 결과12)와 일치하였으 나, 실온에서 하룻밤 보관이 세포의 생존율에 차 이를 보이지 않았으며, 실온에서 하룻밤 보관 후 냉동보존 후 해동하여도 채혈 후 즉시 냉동 보존 한 경우와 차이를 보이지 않아 실온에서의 보관 이 세포의 생존에 차이를 보이지 않는 것으로 나 타났다.
Pettengell 등은 골수나 말초혈액 조혈모세포 모 두 2∼3일정도는 4oC에 보관하였을 때 세포의 회 수율이 충분히 유지됨을 관찰하였고 72시간 경과 후에도 62%의 회수율을 보였다고 보고하였다.13) 이후의 Sugue 등14)의 보고에서는 12∼20oC의 조 건에서 백혈구성분 채집물을 밤샘 보관하였을 때 CFU-GM의 회수율이 98%라고 보고하여 하루 이 내의 단기 저장 시 실온에서도 임상적으로 생착 의 지연을 초래할 정도의 조혈모세포의 손실이 일어나지 않을 가능성이 제기되었다. 본 연구진 은 제대혈의 조혈모세포에 대한 단기 실온 보관 에 대한 연구를 CFU-GM 집락분석을 통하여 시 행하였으며, 실온에서 하룻밤 보관 시 집락형성 의 차이가 없음을 확인하였다.
아포토시스에 대한 연구에서는 즉시처리군과 밤샘보관군간의 유의한 차이를 보이지 않았으나, 즉시처리군과 냉동군 간의 비교에서는 유의한 차 이를 나타냈다. 또한 익일냉동군과 즉시냉동군 간의 비교 시 유의한 차이를 보이지 않아 실온에 서의 하룻밤 보관은 아포토시스에는 영향을 미치 지 않으며, 냉동보관이 아포토시스에 영향을 미
치는 것으로 나타났다. 냉동보관 시 조혈모세포 의 소실이 많아지는 것에 대하여는 세포의 뭉침 (cell clumping)과 조혈모세포 중 아포토시스 과정 에 있거나, 냉동보존 후 해동 시 초기 아포토시스 가 대량으로 일어난다는 보고로 설명할 수 있
다.15,16) Nico 등17)의 보고에서는 DNase의 추가가
세포의 뭉침을 감소시킬 수 있다고 하였으며, DNase 를 추가한 실험으로 CD34 양성세포를 2배로 얻 어 이를 입증하여 분리방법의 개선과 냉동방법의 개선이 필요할 것으로 보인다.
Colony assay와 annexin-V를 이용한 아포토시스 에 관한 연구결과를 종합하였을 때 아포토시스가 유의한 차이를 나타내는 냉동보관 시에서 집락형 성 역시 유의한 차이를 나타내어 냉동시의 아포 토시스가 집락형성에 영향을 미친다고 추정할 수 있다. 또한 실온에서 하룻밤의 보관의 경우 아포 토시스에서 차이가 없으며, 집락 형성에도 차이 를 보이지 않아 아포토시스와 집락형성의 상관성 을 생각할 수 있겠다.
체외 골수장기 배양법을 이용하여 장기간 조혈 능의 차이를 알아보기 위한 연구에서는 5주간의 배양 후 집락형성을 비교하였을 때 각 군 간의 CFU-GM 집락 형성에 통계학적으로 차이가 없어 생착능에는 차이가 없는 것을 볼 수 있었다. 최 등18)이 보고한 체외확장 시 냉동보존이 제대혈 조혈모세포의 집락형성에 영향을 주지 않는 것과 같은 결과를 본 연구에서 확인을 하였으며, 제대 혈을 실온에서 보관을 하였을 때도 냉동 전과 냉 동 후 모두 생착능에는 차이가 없는 것이 확인되 었다.
이상의 결과를 종합하면 제대혈의 보관을 위한 냉동은 단기 조혈능에는 영향을 미치지만 장기 조혈능에는 영향을 미치지 않으며, 제대혈을 실 온에 하룻밤 보관 후 단핵구를 분리하여도 단기 및 장기 조혈능에 영향을 미치지 않는 것으로 확
인되었다. 따라서 조혈모세포이식을 위하여 제대 혈 채취 및 보관 시 실온에서 24시간 이내로 보관 한 제대혈은 비교적 안전할 것으로 생각되며 향 후 적극적인 공여 제대혈의 보관으로 더욱 많은 제대혈 이식이 시행될 수 있기를 기대한다.
요 약
배경: 비용의 절감과 편의를 위해 제대혈을 하 룻밤 보관 후 다음날 CD34 양성세포의 분리를 시 행하고 있다. 본 연구진은 제대혈세포의 밤샘보 관이 단기 및 장기 조혈능에 미치는 영향에 대하 여 연구하고자 하였다.
방법: 다섯 예의 제대혈의 CFU-GM 집락형성 과 아포토시스 비교하였으며, 체외 골수 장기 배 양법을 이용하여 분석하였다. 채취된 모든 제대 혈은 즉시처리군(fresh), 밤샘보관군(overnight), 즉 시냉동군(immediate cryopreserved), 익일냉군(over- night cryopreserved)의 총 네 군으로 분류하였다.
결과: CFU-GM 집락배양 결과 즉시처리군의 집락수는 116.2±20.1였으며, 밤샘보관군에서는 90.8±
15.8로 유의한 차이를 보이지 않았다. 즉시냉동군 과 익일냉동군 간의 차이는 보이지 않았으며(P=
0.79) 즉시냉동군과 즉시처리군 간의 비교에서만 유의한 차이를 나타냈다(P=0.03). 아포토시스세 포는 즉시처리군에서 21±6.8%, 밤샘보관군에서 24.2±2.4%로 나타났다(P=0.32). 아포토시스세포 는 즉시처리군에서 즉시냉동군과 비교시 유의한 차이를 보였다(P=0.02). 제대혈의 단핵구 분리 후 장기배양 후 CFU-GM 집락배양에서는 네 군 모 두에서 유의한 차이를 나타내지 않았다.
결론: 본 연구의 결과 편의 및 비용 절감의 목 적으로 시행하는 제대혈의 냉동 전 밤샘보관이 지속적으로 사용 가능함을 입증하였다.
참고문헌
1. Hows JM. Histocompatible unrelated donors for bone marrow transplantation. Bone Marrow Transplant 1987;1:259-63
2. Knudtzon S. In vitro growth of granulocytic colonies from circulating cells in human cord blood. Blood 1974;43:357-61
3. Civin CI, Strauss LC, Brovall C, Fackler MJ, Schwartz JF, Shaper JH. Antigenic analysis of hematopoiesis III. A hematopoietic progenitor cell surface antigen defined by a monoclonal antibody raised against KG-1a cells. J Immu- nol 1984;133:157-65
4. Petzer AL, Gunsilius E, Zech J, Clausen J, Hoflehner E, Nussbaumer W, et al. Evaluation of optimal survival of primative progenitor cells (LTC-IC) from PBPC apheresis products after overnight storage. Bone Marrow Tran- splant 2000;25:197-200
5. Lazarus HM, Pecroa AL, Shea TC, Koc ON, White JM, Gabriel DA, et al. CD34+ selection of hematopoietic blood cell collections and autotransplantation in lymphoma: overnight storage of cells at 4 degress does not affect out- come. Bone Marrow Transplant 2000;25:559-66 6. Sartor M, Antonenas M, Garvin F, Webb M
Bradstock MK. Recovery of viable CD34+ cells from cryopreserved hemopoietic progenitor cell products. Bone Marrow Transplant 2005;
36:199-204
7. Parkins MD, Bahlis N, Brwon C, Savoie L, Chaudhry A, Russell JA, et al. Overnight storage autologous stem cell apheresis products before cryopreservation does not adversely impact early or long term engraftment following trans- plantation. Bone Marrow Transplant 2006;38:
609-14
8. Broxmeyer HE, Douglas GW, Hangoc G, Cooper S, Bard J, English D, et al. Human
umbilical blood as a potential source of trans- platable hematopoietic stem/progenitor cells.
Proc Natl Acad Sci U S A 1989;86:3828-32 9. Broxmeyer HE, Hangoc G, Cooper S, Ribeiro
RC, Graves V, Yoder M, et al. Growth charac- teristic and expansion of human umbilical cord blood and estimation of its potential for transplantation for adults. Proc Natl Acad Sci U S A 1992;89:4109-13
10. Cardoso A, Li ML, Batard P, Hatzfeld A, Brown EL, Levesque JP, et al. Release from quies- cence of CD34+ CD38- human umbilical cord blood cells reveals their potentiality to engraft adults. Proc Natl Acad Sci U S A 1993;90:8707- 11
11. Lansdorp PM, Dragowska W, Mayani H. On- togeny-related changes in proliferative poten- tial of human hematopoietic cells. J Exp Med 1993;178:787-91
12. Jun JW, Hong DS, Suh WS, Kim SJ, Park SK, Won JH, et al. Comparison of the clono- geneicity of cord blood CD 34 positive cells purified before and after cryopreservation.
Korean J Hematol Stem Cell Trans 1997;2:
113-22
13. Pettengell R, Woll PJ, O'Connor DA, Dexter TM, Testa NG. Viability of haemopoietic pro- genitors from whole blood, bone marrow and leukapheresis product: effects of storage media, temperature and time. Bone Marrow Trans- plant 1994;14:703-9
14. Sugrue MW, Hutcheson CE, Fisk DD, Roberts CG, Mageed A, Wingard JR, et al. The effect of overnight storage of leukapheresis stem cell products on cell viability, recovery, and cost.
J Hematother 1998;7:431-6
15. de Boer F, Dräger AM, Pinedo HM, Kessler FL, van der Wall E, Jonkhoff AR, et al. Extensive early apoptosis in frozen-thawed CD34-positive stem cells decrease threshold does for haemato-
logical recovery after autologous peripheral blood progenitor cell transplantation. Bone Marrow Transplant 2002;29:249-55
16. Sparrow RL, Komodromou H, Tippett E, Geor- gakopoulos T, Xu W. Apoptotic lymphocytes and CD34+ cells in cryopreserved cord blood detected by the fluorescent vital dye SYTO 16 and correlation with loss of L-selectin (CD62L) expression. Bone Marrow Transplant 2006;38:
61-7
17. Nicol A, Nieda M, Donaldson C, Denning- Kendall P, Bradley B, Hows J. Analysis of cord blood CD34+ cells purified after cryopre- servation. Exp Hematol 1995;23:1589-94 18. Choi JH, Gang HJ, Kim YG, Oh HA, Lee G,
Bae SH, et al. The effect of cryopreservation of ex vivo expansion potential of umbilical cord blood progenitor cells. Korean J Hematol Stem Cell Trans 2002;7:55-62