113
가나마이신 및 겐타마이신 비강 분무액을 아미카신 비강 분무액으로 바꾸는 방법
김 홍 집*
호서대학교 벤처전문대학원 (게재승인: 2009년 5월 29일)
Exchange method of the nasal cavity spraying amikacin instead of kanamycin and gentamicin
Hong-Jib Kim*
Venture Special Graduate School, Hoseo University, Asan 336-795, Korea (Accepted: May 29, 2009)
Abstract : Atrophic rhinitis (AR) is the one of important respiratory diseases and causes severe economic losses in pig industry. Severe attempts have been made to reduce the economic losses by preventing the disease. One of the methods is the spraying of antibiotics into nasal cavity of piglets. Recently, the efficacy of the spraying with kanamycin and gentamicin was reduced in the Korean swine industry. Therefore, the preventive methods have been required to be changed based on the antimicrobial susceptibility profiles of causative agents of swine AR. Based on the current situations of this disease,
Bordetella(
B.)
bronchisepticaand
Pasteurella(
P.)
multocida4D were isolated from pigs with clinical signs of AR. The isolation rates of
B. bronchisepticaand
P. multocida4D were 58.5% and 32.9%, respectively. In the antimicrobial susceptibility test, the bacteria were resistant to kanamycin and gentamicin which have been used as the spraying agents, but they were susceptible to amikacin. A new spraying agent was developed using amikacin using
β-glucan and yakbaltag as supplementary agents. Field efficacy of the agent was carried out with different schedule. The results from this study suggested that the newly developed spraying agents might be helpful to prevent AR in swine.
Keywords : atrophic rhinitis,
B. bronchiseptica,
β-glucan, nasal cavity,
P. multocida서 론
돼지위축성비염
(atrophic Rhinitis, AR)
은전세계적 으로양돈산업에막대한경제적인피해를주는질병으 로,
주로Bordetella ( B. ) bronchiceptica
와Pasteurella ( P. ) multocida 4D
혼합감염에의해서발병한다. B. bronchi-
septica
가근본적인 병인체로작용하여비강점막상피에자극을줌으로써
, P. multocida 4D
가2
차적으로감염을 증가시키는역할을함으로서병증을악화시킨다[8, 14- 17].
돼지위축성비염은국내에
1958
년미국에서들어온종돈에서처음으로보고된후로전국적으로높은발병 율을보이는만성소모성질병으로자돈에서발생하여 재채기등비염증세
,
코비틀림,
주둥이위축등코와안면골의변형
,
증체량저하등을유발하여양돈산업에경 제적으로막대한피해를발생시키는질병이다[4, 5, 18].
위축성비염의발생은원인균에따라서감염연령과밀 접한관련이있어서
B. bronchiseptica
만에의해서는1~3
주령까지의어린자돈에감염시만병변을유발하나
, P.
multocid a 4D
는12~16
주령의돼지에서도심한비갑개골*Corresponding author: Hong-Jib Kim
Venture Special graduate School, Hoseo University, Asan 336-795, Korea [Tel: +82-41-531-1636, Fax: +82-41-532-1636, E-mail: kimhongjib@hanmail.net]
위축을유발한다
.
그러나P. multocida 4D
는비강내에서점막의손상을통해서만정착
,
증식될수있기때문에단독감염으로는가벼운증상을일으킨다
. P. multocid a 4D
의 주요 병원성인자는 외독소인Dermonecrotoxin
(DNT)
임이실험적감염에의해서증명되었다[6, 11,
12, 26, 28, 32, 34].
즉
,
위축성 비염은 중요한 요인 중 하나인B.
bronchiseptica
가비강점막에침투정착해서비강점막에 손상을입히고,
그손상된부위에P. multocida 4D
가복합감염되어
DNT
독소를생성함으로서병증이심화되고진행성으로연결된다
[12, 28, 30, 33, 35].
위축성비염의발생에따라다른호흡기질병원인체들 이폐에침입이용이해짐으로서각종폐렴증상들이나 타나며
,
특히유행성폐렴의발생율이매우높아지고,
파 스튜렐라성폐렴과흉막폐렴발생의발생이증가되어,
폐사율이증가되며
,
증체율이저하됨으로서양돈산업에막대한경제적피해를주게된다
[4, 22].
현재까지위축성비염
(AR)
방제는다양한종류의백신접종
,
자돈시항생제비강분무접종,
사육환경개선등을통해이루어지고있다
[30, 32, 33].
현재포유자돈에 비강내분무용약제로kanamycin
과gentamicin
만을사 용하고있으나,
국내양돈산업에서무분별한항생제사용등으로내성균의출현에따라서항생제비강분무접
종법에검토가요구되고있는실정이다
[6, 19-21].
또한국내양돈산업의사육체계상접종항생제종류
,
접종방법
,
접종시기등에대한다양한검토가요구되고있어 서본연구에서는국내양돈산업에막대한경제적인피 해를주는돼지위축성비염의예방법중하나인비강분 무법을개선하고자실시하였다.
재료 및 방법
시험기간 및 시료 채취
본연구는국내의일반적인양돈장에서
2006
년6
월부터
2007
년5
월까지1
년간에걸쳐실시하였으며,
재채 기,
비출혈,
눈꼽,
코비틀림,
성장위축등돼지위축성비염의임상증상을나타내는
152
두의돼지비강내점액을 무균적으로채취하여공시하였다.
대상돼지를선발하여잘보정후알콜면으로비강부위의오염물질을완전
히제거한후약
15 cm
길이의멸균면봉을비강깊숙이삽입하여비강점액을채취한후멸균된인산완충식염수
(phosphate buffered saline)
에부유한후, 4
oC
냉장상태로실험실로운반하여균분리
,
동정을위한재료로사용하였다
.
원인균 분리, 동정
채취한 재료는
5%
면양혈액첨가 혈액배지(Difco, USA)
및1% Dextrose
첨가MacConkey agar
한천평판배지
(Difco, USA)
에도말한후, 37
oC
에서24~48
시간동안호기성배양으로실시하여
Cater [13]
의일반적인방법에 의하여 순수분리 하였다
.
순수 분리된 균은Koneman [25], Boone
와Castenholz [10]
및MacFaddin [27]
의생화학적검사방법등에준하여동정하였다.
분리
,
동정된균은PCR
방법에의해재확인하였다[31].
항생제감수성시험
순수분리된
B. bonchiseptica
및P. multocida 4D
에대해서
Mueller Hinton
한천평판배지(Difco, USA)
에항생 제disc
를이용하여Bauer
등[9]
의방법으로실시하였다
.
공시된항생제의종류및함량은Table 2
와같다.
Amikacin의 유효 농도 결정
분리균주들에대한
amikacin
의유효농도결정은순수분리한집락을
BHI broth
에접종한후37
oC
에서24 h
배양하여배양접종액준비하였고
, Mueller Hinton
한천 평판배지에amikacin
비강내분무액(40 mg/ml)
을각각0.1 ml, 0.5 ml, 1.0 ml, 2.0 ml, 5.0 ml
및10.0 ml
첨가 한배지에균배양액을접종하여24 h
배양후성장여부에 따라서 결정하였다
.
위의 방법에 의해서 결정된amikacin
의농도를바탕으로 한조성물A(10
배희석amikacin 10 ml),
조성물B(10
배희석amikacin 10 ml +
β
-glucan 10 ml),
조성물C(10
배희석amikacin 10 ml +
약발탁
10 ml),
조성물D(10
배희석amikacin 10 ml +
β
-glucan 10 ml +
약발탁10 ml)
및조성물E(
증류수10 ml)
가첨가된Muller-Hinton
한천배지에B. bronchiseptica (2 × 10
8CFU)
및P. multocida 4D(2 × 10
8CFU)
를각각 접종한후, 37
oC
에서배양후균의집락의형성여부를관찰하여감수성여부를판정하였다
.
이실험은1
개월간 격으로3
회반복실시하였다.
β-glucan의 유효 농도를 결정
β
-glucan
의유효농도는PT-K75
세포주를이용하여β- glucan
의최종농도가2%, 0.4%, 0.2%, 0.1%, 0.02%
및0.002%
가되도록첨가한후porcine cytomegalovirus
를Table 1. Isolation Rates of
Bordetella(
B.)
bronchisepticaand
Pasteurella(
P.)
multocida4D from pigs with atrophic rhinitis
Isolated organisms No. of pigs examined No. of pigs
positive %
B. bronchiseptica
152 89 58.5
P. multocida
4D 152 50 32.9
배양하여이바이러스가성장이억제되는최종희석배 수를유효농도로결정하였다
.
돼지에서의 amikacin 비강 분무액의 효능 시험 위의실험을통하여결정된유효농도를바탕으로
4
종류의 비강분무액
[
조성물1(
황산kanamycin 40 mg/
ml),
조성물2(
황산gentamicin 100 mg/ml),
조성물3(10
배희석
amikacin 10 ml +
β-glucan 10 ml)
및조성물4(10
배희석amikacin 10 ml +
β-glucan 10 ml +
약발 탁10 ml)]
을제조하여농장당20
두씩국내3
개농장에서 효능을 시험하였다
.
접종 시기는kanamycin
과gentamicin
은1
일령(8
시간이내), 1
주령, 2
주령, 3
주령 및4
주령에비강내분무하였고, amikacin
은1
일령(8
시간이내
), 3
일령, 10
일령및이유시에비강 분무하였 다.
실험제조한비강분무액에대한부작용발생여부는 분무후구토,
사료섭취감소,
움추림등의증상여부를바탕으로부작용여부를판단하였다
.
또한10
배희석amikacin
과동량의β-glucan
으로비강분무액을제조하여야외
10
개농장에서각기다른3
가지투여방법즉,
방법
1, 1
일령(8
시간이내), 3
일령, 10
일령및이유시의4
회를7
개농장에서,
방법2
는1
일령(8
시간이내), 3
일 령,
및10
일령등3
회를2
개농장에서,
방법3
은1
일령(8
시간이내)
에만분무하는방법을1
개농장에서실시하였다
.
비갑개위축에대한비강분무액의효능은실험군이
40~50
일령에도달하였을때제1
전구치와제2
전구치사이를절단하여비갑개골의위축및비중격의
만곡여부를확인하였고비갑개골과안면뼈사이간격이
8 mm
이상이면양성으로판정하였다[17, 26].
결 과
돼지 위축성비염 원인균의 분리, 동정
돼지위축성비염의임상증상을보이는돼지
152
두의비강으로가검물을채취하여원인균분리를시도한결 과
B. bronchiseptica
는89
두(58.5%)
로부터분리되었 고, P. multocida 4D
는50
두(32.9%)
로부터분리되었다(Table 1).
원인균의 항생제 감수성 검사
국내돼지위축성비염원인균
B. bronchiseptica
에대한 항생제 감수성 검사를 실시한 결과
amikacin,
amoxicillin, colistin
에대하여높은감수성을나타낸반면
,
국내 양돈장에서 비강 분무액으로 사용중인gentamicin
과kanamycin
에대하여는높은저항성을나타 내었다. P. multocida 4D
는amikacin, amoxicillin, colistin
에대하여높은감수성을나타낸반면역시
gentamicin
과
kanamycin
에대하여는 높은 저항성을나타내었다(Table 2).
Amikacin의 유효 농도 결정
Amikacin
의유효농도를결정하기위하여amikacin
희석액
(40 mg/ml)
을각각0.1 ml, 0.5 ml, 1.0 ml, 2.0 ml, Table 2. Susceptibility of
B. bronchisepticaand
P. multocida4D isolated pigs with atrophic rhinitis
Antimicrobial agents Potency/disc
B. bronchiseptica(n = 89)
P. moltocida(n = 50)
Susceptibility % Susceptibility %
Amikacin 30
µg 89 100.00% 50 100.00%
Amoxicillin 30
µg 65 73.03% 44 86.27%
Ampicillin 10
µg 2 2.25% 3 5.88%
Ceftiofur 30
µg 47 52.81% 24 47.06%
Cephalothin 30
µg 18 20.22% 31 60.78%
Ciprofloxacin 5
µg 35 39.33% 33 64.71%
Colistin 10
µg 78 87.64% 46 90.20%
Doxycycline 30
µg 1 1.12% 0 0.00%
Gentamicin 10
µg 22 24.72% 9 17.65%
Kanamycin 30
µg 12 13.48% 19 37.25%
Lycospectin 30
µg 31 34.83% 11 21.57%
Neomycin 30
µg 15 16.85% 26 50.98%
Norfloxacin 10
µg 37 41.57% 33 64.71%
Penicillin 10 U 0 0.00% 1 1.96%
Streptomycin 10
µg 0 0.00% 1 1.96%
Sulfamethoxazole + Trimethoprim 1.25 + 23.75
µg 18 20.22% 16 31.37%
Tetracycline 30
µg 0 0.00% 0 0.00%
5.0 ml,
및10.0 ml
첨가한배지에균배양액을접종한후24
시간배양한 결과B. bronchiseptica
및P. multocida
4D
모두amikacin
배양액첨가배지에서는성장하지않아모든희석액에서
100%
살균효과가있는것으로3
회반복실험에서모두확인되었다
.
β-glucan 의 유효 농도 결정
β
-glucan
의유효농도결정은β-glucan
을최종농도가2%, 0.4%, 0.2%, 0.1%, 0.02%
및0.002%
가되도록첨가한후
porcine cytomegalovirus
의성장억제정도를측정 한결과0.2%
까지에서porcine cytomegalovirus
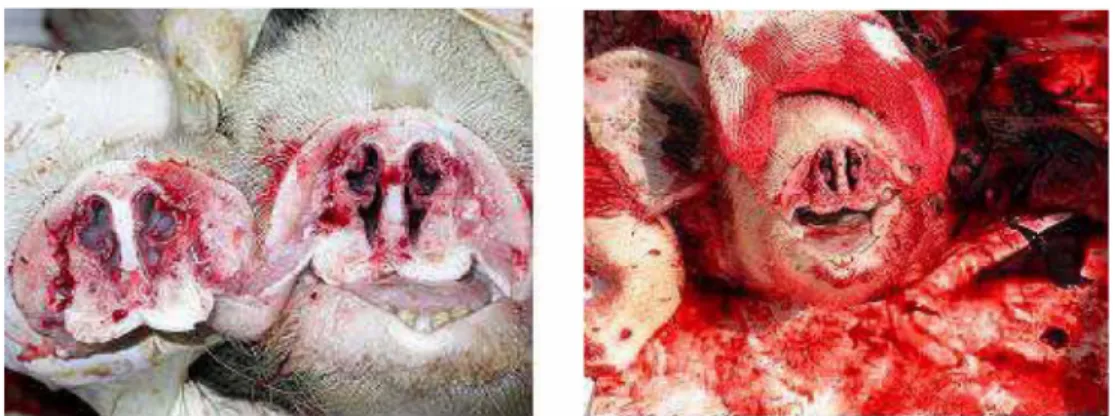
의발육Fig. 1. Cross sections of snouts of pigs sprayed with compound 1 (left) and compound 2 (right). Note, severe turbinate hypoplasia and deformations of the turbinates and nasal bone in the nasal cavity were observed. Compound 1 and 2 were Kanamycin and gentamicn, respectively.
Fig. 2. Cross sections of the snouts of pigs sprayed with compound 3 (two pictures in the left side panel) and compound 4 (right side panel). Note, normal turbinate bones were observed in the upper panel, but slight hypoplasia of turbinate was obsereved in the lower panel. Compound 3 consisted of 10 ml of 10× diluted amikacin and 10 ml of
β-glucan.
Compound 4 was added 10 ml of yagbaltag to compound 3.
이억제되었다
.
Amikacin 비강 분무 접종액의 야외 농장 적용 시험
현재 국내에서 사용 중인
kanamycin(
조성물1)
및gentamicin(
조성물2)
을이용한비강분무액의사용은현재국내양돈장의일반적인사육체계에대하여부가적 인작업이필요할뿐만아니라
,
비갑개골검사에서비강이완전이소실된것을확인할수있었다
(Fig. 1).
반면amikacin
을포함한비강분무액을(
조성물3
과4)
접종 한경우비갑개골검사에서정상적인형태로존재하는것을확인할수있었다
(Fig. 2).
또한모든실험돈에서3
회이상동일한비강에분무하여도구토,
침울등의부 작용을나타내지않았다.
본비강분무액을출생후즉시
, 3
일령, 10
일령및이유시등
4
회분무한경우는시험군140
두모두에서비갑개의이상이검출되지않았으나
,
이유시에접종을하지않은
3
회분무한시험군에는10%
의(40
두중4
두)
비갑개이상을관찰할수있었고
,
출생후즉시한번만 비강분무액을접종한실험군의50%
에서(20
두중10
두)
비갑개이상을관찰할수있었다
.
고 찰
돼지위축성비염은
B. bronchiseptica
가일차적으로 감염된후P. multocida 4D
가감염되어외독소인DNT
를분비함으로서돼지의비갑개위축
,
비출혈,
코와안 면의변형 및증체율 저하등으로국내외양돈 산업 에막대한 경제적인피해를주는만성 소모성질병이 다.
이질병의감염율은지역및시대에따라다양하다.
즉
,
돼지의비강으로부터B. bronchiseptica
의분리율을 살펴보면,
미국에서는돈군별분리율로는54%
및25%
를나타내었지만개체별로는
41%
의분리율을보고하였고
[21],
영국에서는도축장도살돈에서50%
의분리율을
[12],
일본에서는1970
년에임상적으로정상돈에서
0%, AR
감염돈에서17.2%
를분리하여 보고하였다[23, 24, 29].
또한국내육성돈에서35.7%,
도살돈에서50.4%
의차이를보였다[7].
국내양돈장에서의분리율은야외감염예에서
71.7% [1],
박등[3]
은6
개양돈장에서
18.4%
로서양돈장별로는0~34%
로다양하고또병변이인정된감염 예에서는
53.5%
라고 보고하였으며
,
신등[4]
과이등[5]
은3
개지역에서46.5%
로서 지역별로는0~55%
까지다양하게분리된다고보고하였다
.
또한장과김[7]
은돈군에있어서는90%
이상의분리율을보였다
.
본연구에서개체별분리율이58.5%
에달한것은과거의분리율과유사한결과로서그동안
B.
bronchiseptica
의예방을위하여많은노력을하였음에도불구하고국내양돈산업에 많은피해를주는 균으 로판단된다
.
반면
P. multocida
의분리율은1954
년에정상돈에서4.3%, AR
돈에서8.0%
라고보고하였고[22], 1962
년에5%
에서1967
년에9%
로증가하였다고보고한바있다[21]. Kang
등[23-25, 29]
은임상적정상돈에서0%, AR
감염돈에서
9.1%
라고 보고하였다.
또한김등[2]
은4~12
주령자돈의비갑개골에서B. bronchiseptica
균과P.
multocida
균의분리율은각각21.5%
와31.4%
이었고,
출하돈에서는 각각의분리율이
27.6%
와46.7%
로서P.
multocida
가우세하게분리되었다.
이러한보고는지역과시기에따라다양한결과를나타내고있으나본연
구에서분리율
32.9%
는과거의 결과와매우유사하여현재까지도국내양돈산업에서돼지위축성비염에의 한경제적피해가크다는것을암시하고있다
.
분리된
152
균주에대한항생제감수성시험결과과거의 항생제 결과 감수성이 높은 것으로 나타난
sulfonamide, kanamycin
등[4, 6, 13, 21, 22]
이본연구 에서는매우낮은감수성을나타내었다.
이는국내양돈장에서그동안이러한약제의많은사용으로인한내성 균출현에의한것으로판단된다
.
현재까지국내에서돼 지위축성비염원인균에대하여kanamycin
과gentamicin
이효능이높은것으로알려져있으나
,
본연구결과이 들에대한높은내성이관찰되었고, amikacin
에대하여 높은감수성을보여이항생제로대체한실험을실시하 였다.
β
-glucan
은정상적인세포의면역기능을활성화시켜돼지의체내에서면역강화물질을많이배출하도록 자 극하여
,
바이러스등에대한돼지의면역력을강화시키는것으로알려져있다
.
이러한비강분무액은amikacin
과β
-glucan
의적정량을물에용해또는현탁시켜분무하기에적절한농도로 제조하였다
.
이때비강분무액 에비강내로의침투성을높이고비강내부착성을높 이는것으로알려진전착제(
약발탁)
를포함하여사용하였다
.
Kanamycin
및gentamicin
을이용한 기존의방법과amikacin
을이용하여실험적으로제조한비강분무액을야외농장에서적용한결과를볼때현재국내돼지 사육체계에서한단계를줄일수있으며또한비갑개의 위축으로판단할때에우수한효과를나타낸것으로판 단된다
.
결 론
국내양돈산업에큰경제적피해를주는돼지위축 성비염의예방법을개선하기위하여국내돼지에돼지
위축성비염의원인균을분리
,
동정하였고이에대한항생제 감수성 검사를 실시한결과
, B. bronchiseptica
는58.5%
의분리율을P. multocida 4D
는32.9%
의분리율을 나타냈다.
기존에비강분무액에사용되는kanamycin
과gentamicin
에대하여는높은저항성을 나타내었으나,
amikacin
에대하여는높은감수성을나타내었다.
Amikacin
및β-glucan
의유효농도를결정하였고,
이를기준으로비강분무액을제조하여야외농장에서비교 한결과임상병리학적으로우수한결과를나타내었으 며
,
야외농장에서의투여방법을비교하여돼지위축성비염을예방할수있는비강분무액의조성과투여방 법을설정하였다
.
이실험을통하여확립된비강분무 액을투여방법에의하여투여시돼지위축성비염예방에 우수한효과를나타낼것으로사료된다.
참고문헌
1.
강병규.
전염성위축성비염돈으로부터분리한 Borde- tella bronchiseptica의화학요법제에대한감수성시 험.
대한수의학회지1980, 20 , 159-165.
2.
김봉환,
탁연빈,
조길재,
장희경.
돼지전염성위축성비염의임상학적및세균학적연구
.
대한수의학회지1991, 31 , 457-469.
3.
박정문,
석호봉,
이현수,
윤용덕.
돼지의전염성위축성비염에관한연구
. 1.
돼지에대한B. bronchiseptica 의항체,
균분리및병변조사.
가축위생연구소시험연구보고서
. 1976.
4.
신나리,
김종만,
유한상.
돼지위축성비염,
파스튜렐 라성폐렴 및흉막폐렴원인균의주요항원에대한IgG
와IgY
의상관관계분석.
대한수의학회지2002, 42 , 371-376.
5.
이성희,
위성하,
김승중,
강병규.
돈의전염성위축상비염의발생역학적조사와약제치료시험
.
대한수의사회지
1979, 15 , 323-330.
6.
이정민.
돼지위축성비염단위백신개발을위한재조합파스튜렐라독소단백질의면역원성검정
.
대한수의학회지
2007, 47 , 59-65.
7.
장희경,
김봉환.
영남지방돼지의Bordetella bronchi- septica 감염상황및분리균의생화학적특성.
대한 수의학회지1988, 28 , 75-81.
8. Alexander TJ, Thornton K, Boon G, Lysons RJ, Gush AF. Medicated early weaning to obtain pigs free from pathogens endemic in the herd of origin. Vet Rec 1980, 106 , 114-119.
9. Bauer AW, Kirby WM, Sherris JC, Turck M.
Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 1966, 45 , 493-496.
10. Boone DR, Castenholz RW. Bergey's Manual of Systematic Bacteriology. Vol. 1. pp. 140-598. Williams
& Wilkines, Baltimore, 1984.
11. Brockmeier SL, Register KB, Magyar T, Lax AJ, Pullinger GD, Kunkle RA. Role of the dermonecrotic toxin of
Bordetella bronchisepticain the pathogenesis of respiratory disease in swine. Infect Immun 2002, 70 , 481-490.
12. Cameron RD, Giles CJ, Smith IM. The prevalence of
Brodetella bronchisepticaand turbinate (conchal) atrophy in English pig herds in 1978-79. Vet Rec 1980, 107 , 146-149.
13. Cater GR. Diagnostic procedures in Veterinary Bacteriology and Mycology. 4th ed. pp. 12-476, Thomas CC, Springfield, 1984.
14. Cater GR, Rundell SW. Identification of type A strains of
P multocidausing staphylococcal hyaluronidase. Vet Rec 1975, 96 , 343.
15. Cross RF.
Bordetella bronchiseptica-induced porcine atrophic rhinitis. J Am Vet Med Assoc 1962, 141 , 1467-1468.
16. Davies RL, MacCorquodale R, Baillie S, Caffrey B.
Characterization and comparison of
Pasteurella multocidastrains associated with porcine pneumonia and atrophic rhinitis. J Med Microbiol 2003, 52 , 59-67.
17. DeJong MF. Progressive and nonprogressive atrophic rhinitis. In: Straw BE (ed.). Diseases of Swine. 8th ed.
pp. 355-384, Iowa State University Press, Ames, 1999.
18. Done JT, Upcott DH, Frewin DC, Hebert CN.
Atrophic rhinitis: Snout morphometry for quantitative assessment of conchal atrophy. Vet Rec 1984, 114 , 33- 19. 35. Giles CJ, Smith IM. Vaccination of pigs with
Bordetella bronchiseptica.Vet Bull 1983, 53 , 327-337.
20. Gois M, Barnes HJ, Ross RF. Potentiation of turbinate atrophy in pigs by long-term nasal colonization with
Pasteurella multocida. Am J Vet Res 1983, 44 , 372- 21. 378. Harris DL, Ross RF, Switzer WP. Incidence of certain microorganisms in nasal cavities of swine in Iowa. Am J Vet Res 1969, 30 , 1621-1624.
22. Harris DL, Switzer WP. Turbinate atrophy in young pigs exposed to
Bordetella bronchiseptica,
Pasteurella multocida,and combined inoculum. Am J Vet Res 1968, 29 , 777-785.
23. Kang BK, Koshimizu K, Ogata M. Studies on the etiology of infectious atrophic rhinitis of swine. II.
Agglutination test on
Bordetella bronchisepticainfection.
Nippon Juigaku Zasshi 1970, 32 , 295-306.
24. Kang BK, Koshimizu K, Ogata M. Studies on the
etiology of infectious atrophic rhinitis of swine: III.
Field survey by agglutination test in relation to incidence of
B. bronchisepticaand turbinate atrophy.
Nippon Juigaku Zasshi 1971, 33 , 17-23.
25. Koneman EW, Allen SD, Dowell VR, Sommers HM.
Diagnostic Microbiology. 2nd ed. pp. 57-458, JB Lippincott, Philadelphia, 1983.
26. Koshimizu K, Kodama Y, Ogata M, Sanbyakuda S, Otake Y, Mimura T. Studies on the etiology of infectious atrophic rhinitis of swine: V. Experimental
Bordetella bronchisepticainfection in conventional piglets. Nippon Juigaku Zasshi 1973, 35 , 223-229.
27. MacFaddin JF. Biochemical Tests for Identification of Medical Bacteria. 2nd ed. pp. 1-439. Williams &
Wilkins, Baleimore, 1980.
28. Nakai T, Sawata A, Kume K. Intracellular locations of dermonecrotic toxins in
Pasteurella multocidaand in
Bordetella bronchiseptica. Am J Vet Res 1985, 46 , 870-874.
29. Ogata M, Koshimizu K, Kang BK, Atobe H, Yamamoto K, Kino T, Ideda A. Studies on the etiology of infectious atrophic rhinitis of swine: I.
Relationship between the disease and bacterial flora of nasal cavity of pigs. Nippon Juigaku Zasshi 1970, 32, 185-199.
30. Pejsak Z, Wasi ska B, Markowska-Daniel I, Hogg A. Field evaluation of thirteen regimens for the control of progressive atrophic rhinitis. Comp Immunol Microbiol Infect Dis 1994, 17 , 125-132.
31. Register KB, DeJong KD. Analytical verification of a multiplex PCR for identification of
Bordetella bronchisepticaand
Pasteurella multocidafrom swine.
Vet Microbiol 2006, 117 , 201-210.
32. Rutter JM, Luther PD. Cell culture assay for toxigenic
Pasteurella multocidafrom atrophic rhinitis of pigs. Vet Rec 1984, 114 , 393-396.
33. Rutter JM, Mackenzie A. Pathogenesis of atrophic rhinitis in pigs: a new perspective. Vet Rec 1984, 114 , 89-90.
34. Rutter JM, Rojas X. Atrophic rhinitis in gnotobiotic piglets: Differences in the pathogenicity of
Pasteurella multocidain combined infections with
Bordetella bronchiseptica. Vet Rec 1982, 110 , 531-535.
35. Sakano T, Okada M, Taneda A, Mukai T, Sato S.
Effect of
Bordetella bronchisepticaand serotype D
Pasteurella multocidabacterin-toxoid on the occurrence of atrophic rhinitis after experimental infection with
B.bronchiseptica