서 론
심혈관계는 갑상선호르몬 작용의 주요 표적기관으로 갑상선 기 능의 이상은 심혈관 질환을 유발한다.1) 이 중 현성 갑상선기능저하 증은 관상동맥 석회화를 가속화시킨다.2)
무증상갑상선기능저하증(subclinical hypothyroidism)은 혈청 갑상
선 자극 호르몬(thyroid stimulation hormone, TSH)은 증가되어 있지 만 혈청 갑상선 호르몬은 정상 범위인 상태로 경미한 갑상선 기능부 전이라고도 한다.3) 무증상갑상선기능저하증은 TSH 수치에 따라 경 증(TSH, 4.0–10 mU/L)과 중증(TSH >10 mU/L)으로 분류되지만,3) 임 상적 차이는 명확하지 않다. 유병률은 4%–15%에 이르며, 여성에게서 더 흔하게 발생한다.4) 최근 건강검진을 하는 인구가 늘어남에 따라
Received April 2, 2018 Revised July 11, 2018 Accepted October 31, 2018
Corresponding author Hyun-Min Koh Tel: +82-55-233-5199, Fax: +82-55-233-5189 E-mail: sunkhm@naver.com
ORCID: http://orcid.org/0000-0002-3499-6198
Copyright © 2019 The Korean Academy of Family Medicine
This is an open-access article distributed under the terms of the Creative Commons At- tribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted noncommercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Original Article
https://doi.org/10.21215/kjfp.2019.9.1.36 eISSN 2233-9116
Korean J Fam Pract. 2019;9(1):36-43
Korean Journal of Family Practice
KJFP
무증상갑상선기능저하증과 심혈관 질환 위험인자 및 관상동맥석회화점수와의 연관성
조성경, 고현민*, 문진숙
성균관대학교 의과대학 삼성창원병원 가정의학교실
Association of Subclinical Hypothyroidism with Cardiovascular Risk Factors and Coronary Artery Calcium Score
Sung-Kyoung Cho, Hyun-Min Koh*, Jin-Sook Moon
Department of Family Medicine, Samsung Changwon Hospital, Sungkyunkwan University School of Medicine, Changwon, Korea
Background: Few studies have investigated the association between subclinical hypothyroidism (SCH) and coronary artery calcification (CAC). This study investigated this association in patients who visited a health promotion center.
Methods: This study included patients who visited the Health Promotion Center at a University Hospital between January 2014 and December 2015.
Serum thyroid stimulating hormone (TSH) level, free thyroxine level, and the CAC score (CACS) were measured in all patients. Patients were classified into euthyroid and SCH groups. An independent t-test and chi-squared test were performed to analyze the general characteristics. Patients were further classified into three groups based on serum TSH levels (serum TSH level <4.0, 4.0–10, and >10 μIU/mL), and the one-way analysis of variance test was performed to assess the clinical differences among three groups. Partial correlation coefficients were calculated to assess the correlation between serum TSH levels and cardiovascular risk factors. Patients with CACS=0 were classified into the non-calcification group, and those with CACS >0 were classified into the calcification group. The odds ratios of SCH to CAC were analyzed using logistic regression analysis.
Results: Serum TSH levels were significantly associated with body mass index, waist circumference, high-density lipoprotein cholesterol, and triglyceride levels. The risk of obesity, diabetes, and high triglyceride levels (>150 mg/dL) was significantly higher in the SCH group. Moreover, the SCH group with TSH levels >10 μIU/mL showed a significant risk of CAC (odds ratio, 3.18; 95% confidence interval, 1.10–9.21).
Conclusion: SCH with TSH levels >10 μIU/mL is independently associated with the CACS.
Keywords: Hypothyroidism; Thyrotropin; Coronary Artery Calcium Score; Cardiovascular Disease; Atherosclerosis
조성경 외. 무증상 갑상선 기능저하증과 관상동맥석회화 점수 Korean Journal of Family Practice
KJFP
무증상갑상선기능저하증을 진단받는 환자가 증가하고 있어 무증상 갑상선기능저하증이 심혈관계에 미치는 영향에 대한 관심이 증폭 하고 있다. 이에 따라 무증상갑상선기능저하증과 심혈관 질환과의 관계를 밝히고자 하는 연구들이 이루어졌으나, 무증상갑상선기능 저하증이 심혈관 질환과 연관성이 있다는5,6) 결과가 있는 반면, 두 질 환 사이에 관련이 없다는 연구 결과도 있다.7) 또한 대부분의 연구에 서 무증상갑상선기능저하증에서 나타나는 심혈관 질환의 위험 인 자 변화 양상에 대해 명확히 제시하지 못하고 있다.
임상적 심혈관 질환이 없는 사람에서 심혈관 질환의 위험도를 평 가하는 도구로 최근 영상 기술의 발달로 다중절편 방사선단층촬영 (multidetector computed tomography, MDCT)을 이용한 관상동맥석 회화(coronary artery calcium, CAC)를 진단하는 비침습적인 방법이 대두되고 있다. 관상동맥석회화를 객관적인 수치로 나타낸 관상동 맥석회화 점수(coronary artery calcium score, CACS)는 전통적인 방법 인 framingham risk score (FRS)에 비해 심혈관 질환 발생의 예측도가 높다.8)
무증상갑상선기능저하증과 관상동맥석회화의 관련성에 대한 연 구는 많지 않으며 주요 작용 기전 또한 명확하지 않다. 최근 무증상 갑상선기능저하증과 CACS와의 관련성을 본 연구가 있었으나9,10) 일 부 군에서만 규명된 결과로 일반화하기에는 연구가 부족한 실정이 다.
이에 본 연구는 일개 대학병원 건강증진센터를 내원한 성인을 대 상으로 무증상갑상선기능저하증과 CACS 및 전통적인 심혈관 질환 의 위험인자들 간의 상관관계에 대하여 알아보고자 한다.
방 법
1. 연구대상
본 연구는 2014년 1월부터 2015년 12월까지 건강검진을 목적으로 일개 대학병원 건강증진센터에 내원하여 혈청 갑상선 기능검사와 MDCT를 시행한 수검자 8,183명 중, 갑상선 기능 이상으로 치료를 받 고 있거나, 새롭게 갑상선기능 이상이 진단된 환자를 제외하였고, 고 지혈증 및 심혈관계 질환의 과거력이 있는 자, 아스피린, 와파린 등의 혈전방지제를 복용 중인 자, 지질 대사에 영향을 주는 약물을 복용 중인 자를 제외한 5,392명을 대상으로 하였다. 본 연구는 병원 내 연 구윤리심의위원회(Institutional Review Board)의 승인을 받아 진행하 였다(IRB no. SCMC 2018-02-004).
2. 측정변수
모든 연구 대상자들은 설문 및 문진표를 작성하였고, 문진표에는
인구사회학적 요인들과 생활습관(흡연, 음주), 질병 과거력 및 치료 유무에 대한 정보가 포함되었다. 흡연력은 현재 흡연자, 비흡연자의 두 군으로 분류하였고 음주력은 음주를 전혀 하지 않은 경우와 주 1 회 이상의 음주를 하는 경우로 나누었다. 신장과 체중은 신체 계측 을 통해 얻었으며, 체질량지수(body mass index, BMI)는 체중(kg)에 키(m)의 제곱으로 나누어 계산하였다. 허리둘레 측정은 최하위의 늑골하부와 골반 장골능의 중간부위를 측정하였다. 혈압은 수은 혈 압계를 이용하였으며 혈압 측정 시 상완부 팔 둘레의 80% 이상을 감 을 수 있는 커프를 사용하였으며, 심장 높이에 혈압 측정띠를 위치시 켜 측정하였다. 혈압 측정 전 10분 이상 안정을 취하게 한 후 앉은 자 세에서 수축기와 이완기 혈압을 측정하고, 5분 뒤 반복 측정하여 평 균을 이용하였다.
혈액 채취는 최소 8시간 이상 금식한 상태에서 시행하였고 공복 혈당, 당화혈색소(HbA1c), 총콜레스테롤, 저밀도지단백콜레스테롤 (low density lipoprotein cholesterol, LDL-C), 고밀도진단백콜레스테롤 (high density lipoprotein cholesterol, HDL-C), 중성지방(triglyceride, TG), 고감도 C-반응성 단백질(high sensitivity C-reactive protein, hs- CRP), 호모시스테인(homocysteine)을 측정하였다.
갑상선 호르몬은 효소면역측정법(enzyme immunoassay)을 통해 thyroid stimulating hormone (TSH), free thyroxine (FT4)를 측정하였 고, 각각의 정상범위는 TSH 0.4–4.0 µIU/mL, FT4 0.8–1.9 ng/dL이었 다.11)
3. 관상동맥석회화 점수 측정
64절편 MDCT 스캐너(SOMATOM Definition AS+Excel Edition;
Siemans, Munich, Germany)를 이용하여 비조영증강 방식으로 영상 을 획득하였으며, MDCT로 촬영한 영상에서 관상동맥 경로를 따라 130 HU 이상의 감쇠를 보이는 영역을 석회화로 정의하였고, Ag- atston 등12)에서 제시한 방법을 통해 CACS를 측정하였다. 무증상 환 자의 CACS와 심혈관계 질환 발생에 대한 메타분석에서 CACS가 0 인 환자에 비교하여 CACS가 0 이상일 때 심혈관계 질환 발생이 유의 하게 증가한다는 결과에 따라13) CACS=0을 비석회화군, CACS>0을 석쇠화군으로 정하였다.
4. 통계분석
연구대상자들을 정상갑상선기능군과 무증상갑상선기능저하증 군으로 분류하여 분석하였다. 그리고 데이터의 편향을 감소시키기 위해 CACS 값을 Log로 변환시켰다. 연속형 변수들은 평균과 표준편 차를 구하였고 독립 T 검정으로 분석하였고, 명목형 변수들은 전체 비율을 구하였으며 chi-square 검정으로 분석하였다. 그리고 TSH 농
Original Article
Korean Journal of Family Practice
Sung-Kyoung Cho, et al. Subclinical Hypothyroidism and Coronary Artery Calcium Score
Korean Journal of Family Practice
KJFP
도에 따라 정상, 4–10 µIU/mL와 10 µIU/m 이상인 경우의 각각 세 군 으로 나누었고 각각의 임상적 및 대사적 차이를 알아보기 위해 일원 분산분석(one-way ANOVA)을 하였다. 갑상선 호르몬과 심혈관계 관 련 인자와의 연관성을 알아보기 위해 연령과 성별을 보정한 후 TSH 및 FT4와 BMI, 허리둘레, 수축기혈압, 이완기혈압, 공복혈당, 총콜레 스테롤, LDL-C, HDL-C, TG, hs-CRP, HbA1c, 호모시스테인, Log- CACS의 편상관계수를 구하였다. TSH 및 FT4 농도가 CACS에 영향 을 주는지 알아보기 위해 CACS=0를 비석회화군, CACS>0을 석회 화군으로 분류하여 두 군에 대해 연령, 성별, 비만, 고혈압, 당뇨, 총 콜레스테롤, LDL-C, HDL-C, TG, hs-CRP, 호모시스테인, FT4 및 TSH 를 보정한 후 로지스틱 회귀분석을 하였다. FT4는 정상범위를 사분 위하여 세분화하였다. 비만, 고혈압, 당뇨 및 총콜레스테롤과 TG, LDL-C가 각각 한국의 이상지질혈증의 정상 기준14)인 200 mg/dL, 150 mg/dL, 130 mg/dL 이상인 경우를 위험인자로 설정하고 TSH 농도에 따른 세 군에서의 위험도를 알아보기 위해 성별, 연령을 보정한 후
로지스틱 회귀분석을 하였다 통계 프로그램은 STATA ver. 14.0 (Stata Corp., College Station, TX, USA)를 이용하였고, 유의수준은 P<0.05를 기준으로 하였다.
결 과
1. 연구대상자의 일반적인 특성
연구대상자는 총 5,392명으로 정상갑상선기능군은 4,941명, 무증 상갑상선기능저하증군은 451명이었다. 전체 남성은 3,745명(69.5%), 여성은 1,647명(30.5%)이었으며 전체 연령은 52.31±7.94세였다. Log CACS의 평균은 0.33±1.09였다.
정상갑상선기능군과 무증상갑상선기능저하증군에서 TSH와 FT4를 비교했을 때, TSH는 정상군에서 1.88±0.82 µIU/mL, 무증상갑 상선기능저하증군에서 5.81±2.74 µIU/mL였으며 FT4는 정상군에서 1.30±0.17 ng/dL, 무증상갑상선기능저하증군에서 0.21±0.18 ng/dL로
Table 1. Clinical and biochemical characteristics according to thyroid function
Variables Total
(n=5,392)
Euthyroid (n=4,941)
Subclinical hypothyroidism
(n=451) P-value
Sex <0.001
Male 3,745 (69.5) 3,494 (70.7) 251 (55.7)
Female 1,647 (30.5) 1,447 (29.3) 200 (44.3)
Age (y) 42.31±7.94 42.23±7.94 43.15±7.86 0.019
Body mass index (kg/m2) 0.147
≤22.9 2,228 (41.3) 2,042 (41.3) 186 (41.2)
23–24.9 1,434 (26.6) 1,329 (26.9) 105 (23.3)
25≤ 1,728 (32.0) 1,568 (31.7) 160 (35.5)
Waist circumference (cm) 82.97±8.37 82.95±8.33 83.24±8.76 0.481
Systolic BP (mmHg) 119.75±13.10 119.70±13.03 120.37±13.92 0.296
Diastolic BP (mmHg) 79.65±17.75 79.62±17.73 79.96±17.92 0.700
Glucose (mg/dL) 91.36±15.47 91.27±15.47 92.38±15.35 0.143
Total cholesterol (mg/dL) 188.42±26.95 188.31±27.07 189.65±25.64 0.311
LDL cholesterol (mg/dL) 117.68±23.70 117.60±23.81 118.57±22.49 0.409
HDL cholesterol (mg/dL) 58.78±15.37 58.86±15.35 57.95±15.59 0.230
Triglyceride (mg/dL) 116.58±85.34 115.79±84.64 125.24±92.36 0.024
hs-CRP (mg/dL) 1.14±3.13 1.14±3.16 1.10±2.77 0.784
HbA1c (%) 5.46±0.56 5.45±0.56 5.53±0.62 0.011
Free T4 (ng/dL) 1.30±0.17 1.30±0.17 1.21±0.18 <0.001
TSH (µIU/mL) 2.21±1.56 1.88±0.82 5.81±2.74 <0.001
Homocysteine (µmol/L) 10.30±4.95 10.33±0.485 9.97±5.96 0.153
Smoking 1,376 (25.5) 1,325 (26.8) 51 (11.3) <0.001
Alcohol 5,148 (95.5) 4,719 (95.5) 429 (95.1) 0.706
Hypertension 1,154 (21.4) 1,055 (21.4) 99 (22.0) 0.766
Diabetes 235 (4.4) 202 (4.1) 33 (7.3) 0.001
CACS 8.39±58.89 8.40±58.85 8.30±59.42 0.972
Log (CACS) 0.33±1.09 0.33±1.08 0.35±1.09 0.637
Values are presented as number (%) or mean±standard deviation.
BP, blood pressure; LDL, low-density lipoprotein; HDL, high-density lipoprotein; hs-CRP, high sensitive C-reactive protein; TSH, Thyroid stimulating hormone; CACS, cor- onary artery calcium score.
P-values were calculated using the independent t-test or Chi-square test.
조성경 외. 무증상 갑상선 기능저하증과 관상동맥석회화 점수 Korean Journal of Family Practice
KJFP
정상군에서 더 높았다(P<0.001). CACS의 평균은 8.39였으며정상갑 상선기능군에서 더 높았으나 유의하지 않았고, Log CACS는 무증상 갑상선기능저하증군에서 더 높았으나 유의하지 않았다.
정상군에 비해 무증상갑상선기능저하증군에서 여성의 비율이 통계적으로 유의하게 높았으며(P<0.001) 평균 연령도 43.15세로 유의 하게 높았다(P=0.049). TG, 당화혈색소의 평균은 무증상갑상선기능 저하증군에서 유의하게 높은 수치를 보였다(TG, P=0.024; HbA1c, P=0.011) (Table 1).
2. TSH 농도에 따른 임상적 및 대사적 특성 비교
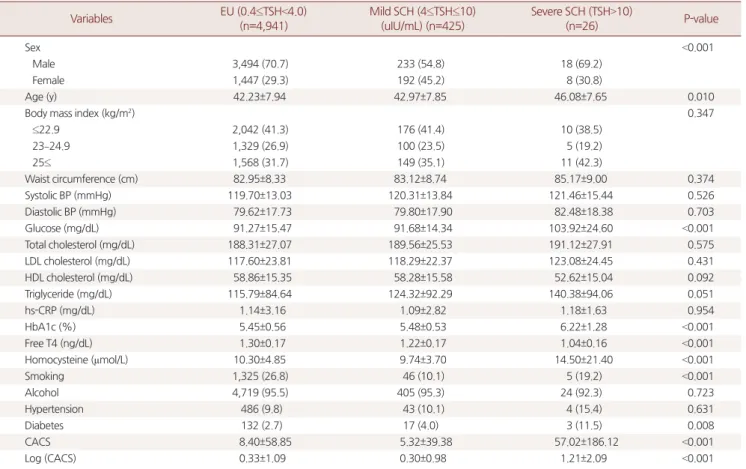
정상 갑상선기능군과 경증, 중증 갑상선기능저하군은 각각 4,941 명, 425명, 26명의 분포를 보였다. 평균 연령은 TSH가 높은 군일수록 높아졌으며, FT4 또한 TSH가 높아질수록 통계적으로 유의하게 낮 아졌다(P<0.001). CACS는 중증 무증상갑상선기능저하증군에서 유 의하게 높았으며, LogCACS 또한 세 군에서 각각 0.33±1.09, 0.30±0.98, 1.21±2.09로 중증 무증상갑상선기능저하증군에서 통계적으로 유의
하게 높았다(P<0.001). 호모시스테인은 정상군에 비해 무증상갑상선 기능저하증군에서는 낮았지만 중증 갑상선기능저하증군에서 유의 하게 더 높았다(P<0.001). 정상군에 비해 TSH가 높아질수록 공복혈 당, 당화혈색소가 유의하게 높아졌다(P<0.001). 비만, 허리둘레, 수축 기혈압, 이완기혈압, 총 콜레스테롤, LDL-C, TG는 TSH가 높은 군일 수록 높아졌으나 통계적으로 유의하지 않았다(Table 2).
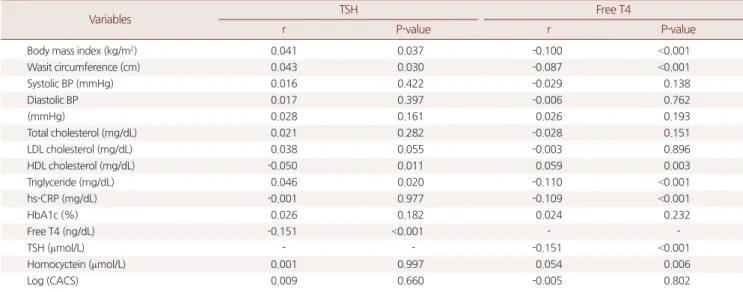
3. TSH 및 FT4와 심혈관계 관련 인자들과의 상관관계 분석 연령과 성별을 통제한 후의 혈중 TSH은 BMI, 허리둘레, TG와 양 의 상관관계를 가지며 HDL-C와는 음의 상관관계를 보였다. 혈중 FT4는 HDL-C, 호모시스테인과 양의 상관관계를 보이며 BMI, 허리 둘레, TG, hs-CRP와는 음의 상관관계를 보였다. 혈중 TSH와 FT4 모 두 LogCACS와는 연령과 성별을 보정한 후 각각 양의 상관관계, 음 의 상관관계를 보였으나 유의하지 않았다(Table 3).
Table 2. Comparison of clinical and biochemical characteristics according to serum TSH levels Variables EU (0.4≤TSH<4.0)
(n=4,941)
Mild SCH (4≤TSH≤10) (uIU/mL) (n=425)
Severe SCH (TSH>10)
(n=26) P-value
Sex <0.001
Male 3,494 (70.7) 233 (54.8) 18 (69.2)
Female 1,447 (29.3) 192 (45.2) 8 (30.8)
Age (y) 42.23±7.94 42.97±7.85 46.08±7.65 0.010
Body mass index (kg/m2) 0.347
≤22.9 2,042 (41.3) 176 (41.4) 10 (38.5)
23–24.9 1,329 (26.9) 100 (23.5) 5 (19.2)
25≤ 1,568 (31.7) 149 (35.1) 11 (42.3)
Waist circumference (cm) 82.95±8.33 83.12±8.74 85.17±9.00 0.374
Systolic BP (mmHg) 119.70±13.03 120.31±13.84 121.46±15.44 0.526
Diastolic BP (mmHg) 79.62±17.73 79.80±17.90 82.48±18.38 0.703
Glucose (mg/dL) 91.27±15.47 91.68±14.34 103.92±24.60 <0.001
Total cholesterol (mg/dL) 188.31±27.07 189.56±25.53 191.12±27.91 0.575
LDL cholesterol (mg/dL) 117.60±23.81 118.29±22.37 123.08±24.45 0.431
HDL cholesterol (mg/dL) 58.86±15.35 58.28±15.58 52.62±15.04 0.092
Triglyceride (mg/dL) 115.79±84.64 124.32±92.29 140.38±94.06 0.051
hs-CRP (mg/dL) 1.14±3.16 1.09±2.82 1.18±1.63 0.954
HbA1c (%) 5.45±0.56 5.48±0.53 6.22±1.28 <0.001
Free T4 (ng/dL) 1.30±0.17 1.22±0.17 1.04±0.16 <0.001
Homocysteine (µmol/L) 10.30±4.85 9.74±3.70 14.50±21.40 <0.001
Smoking 1,325 (26.8) 46 (10.1) 5 (19.2) <0.001
Alcohol 4,719 (95.5) 405 (95.3) 24 (92.3) 0.723
Hypertension 486 (9.8) 43 (10.1) 4 (15.4) 0.631
Diabetes 132 (2.7) 17 (4.0) 3 (11.5) 0.008
CACS 8.40±58.85 5.32±39.38 57.02±186.12 <0.001
Log (CACS) 0.33±1.09 0.30±0.98 1.21±2.09 <0.001
Values are presented as number (%) or mean±standard deviation.
TSH, Thyroid stimulating hormone; EU, euthyroid; SCH, Subclinical hypothyroidism; BP, blood pressure; LDL, low-density lipoprotein; HDL, high-density lipoprotein; hs- CRP, high sensitive C-reactive protein; CACS, coronary artery calcium score.
P-values were calculated using the one-way ANOVA.
Sung-Kyoung Cho, et al. Subclinical Hypothyroidism and Coronary Artery Calcium Score
Korean Journal of Family Practice
KJFP
4. TSH 및 FT4에 따른 관상동맥 석회화와의 연관성
경증의 무증상갑상선기능저하증군에서는 단변량 회귀분석 및 성별, 연령, 심혈관계 위험인자들을 보정한 후에도 교차비의 변화가 크지 않았으며 통계적으로 유의하지 않았다. 그러나 중증 무증상갑 상선기능저하증군에서 성별과 연령을 보정했을 때 정상군에 비해 관상동맥 석회화의 위험도가 3.64배로 유의하게 높았으며(P=0.004;
95% confidence interval [CI], 1.51–8.79), 성별, 연령 및 비만, 고혈압, 당 뇨, 총콜레스테롤, LDL-C, HDL-C, TG, hs-CRP, 호모시스테인, FT4, TSH를 모두 보정했을 때에도 교차비 3.18로 관상동맥 석회화의 통 계적으로 유의한 위험인자였다. FT4에 따른 CACS 연관성 분석에서 는 가장 낮은 사분위인 경우 세번째로 높은 사분위와 비교했을 때
석회화 발생 위험이 1.28배로 유의하게 높았으나, 심혈관계 위험인자 들을 모두 보정했을 때는 유의하지 않았다(Table 4).
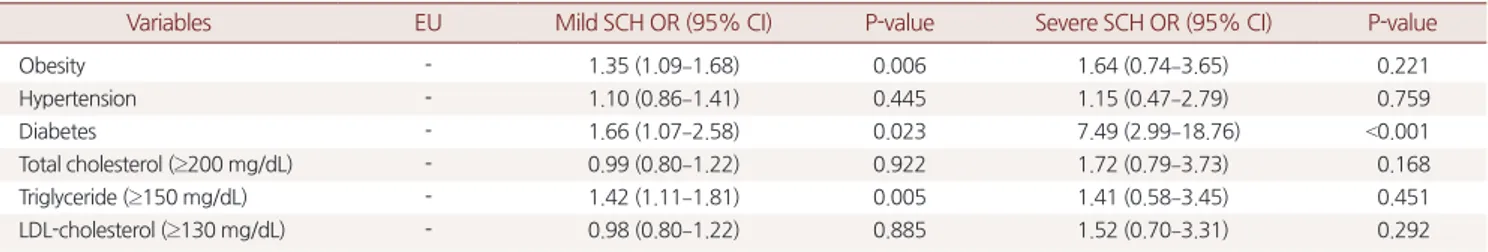
5. TSH에 따른 심혈관계 관련 인자들의 교차비 분석
정상군과 비교했을 때 경증 무증상갑상선기능저하증군에서 비 만과 TG가 150 mg/dL 이상일 교차비는 1.35 (P=0.006; 95% CI, 1.09–
1.68), 1.42 (P=0.005; 95% CI, 1.11–1.81)으로 통계적으로 유의했으며, 중 증 무증상갑상선기능저하증군에서는 교차비 1.64 (95% CI, 0.74–
3.65), 1.41 (95% CI, 0.58–3.45)였으나 통계적으로 유의하지 않았다. 그 리고 정상군에 비해 경증무증상갑상선기능저하증군과 중증 무증 상갑상선기능저하증군에서 당뇨병일 위험도는 각각 1.66 (95% CI,
Table 3. Partial correlation analysis between clinical variables and thyroid function hormones
Variables TSH Free T4
r P-value r P-value
Body mass index (kg/m2) 0.041 0.037 -0.100 <0.001
Wasit circumference (cm) 0.043 0.030 -0.087 <0.001
Systolic BP (mmHg) 0.016 0.422 -0.029 0.138
Diastolic BP 0.017 0.397 -0.006 0.762
(mmHg) 0.028 0.161 0.026 0.193
Total cholesterol (mg/dL) 0.021 0.282 -0.028 0.151
LDL cholesterol (mg/dL) 0.038 0.055 -0.003 0.896
HDL cholesterol (mg/dL) -0.050 0.011 0.059 0.003
Triglyceride (mg/dL) 0.046 0.020 -0.110 <0.001
hs-CRP (mg/dL) -0.001 0.977 -0.109 <0.001
HbA1c (%) 0.026 0.182 0.024 0.232
Free T4 (ng/dL) -0.151 <0.001 - -
TSH (µmol/L) - - -0.151 <0.001
Homocyctein (µmol/L) 0.001 0.997 0.054 0.006
Log (CACS) 0.009 0.660 -0.005 0.802
TSH, Thyroid stimulating hormone; BP, blood pressure; LDL, low-density lipoprotein; HDL, high-density lipoprotein; hs-CRP, high sensitive C-reactive protein; CACS, cor- onary artery calcium score.
Coefficients and P-values were calculated using partial correlation analysis and control variables are sex and age.
Table 4. Logistic regression analysis of risk factor for baseline CACS according to TSH and Free T4 levels
Variables Model 1 Model 2 Model 3
OR (95% CI) P-value OR (95% CI) P-value OR (95% CI) P-value
TSH (µIU/mL)
EU (0.4≤TSH<4.0) Reference - Reference - Reference -
Mild SCH (4≤TSH≤10) 0.99 (0.72–1.35) 0.950 1.14 (0.81–1.60) 0.452 0.98 (0.67–1.43) 0.925
Severe SCH (TSH>10) 4.12 (1.83–9.28) 0.001 3.64 (1.51–8.79) 0.004 3.18 (1.10–9.21) 0.033
Free T4 (ng/mL)
Q1 (≤1.17) Reference - Reference - Reference -
Q2 (1.17<FT4≤1.29) 0.90 (0.71–1.13) 0.355 0.79 (0.62–1.01) 0.062 0.86 (0.60–1.21) 0.389
Q3 (1.29<FT4≤1.4) 0.80 (0.63–1.01) 0.064 0.72 (0.55–0.93) 0.014 0.86 (0.53–1.39) 0.536
Q4 (>1.4) 0.91 (0.72–1.15) 0.415 0.84 (0.65–1.09) 0.185 1.02 (0.50–2.05) 0.967
Model 1 are univariable analysis. Model 2 are adjusted age and sex. Model 3 are multivariable analysis. Adjusted variables are age, sex, obesity, hypertension, diabetes, total cholesterol, LDL cholesterol, HDL cholesterol, triglyceride, hs-CRP, homocysteine, free T4 and TSH.
CACS, coronary artery calcium score; TSH, Thyroid stimulating hormone; OR, odd ratio; CI, confidential intervals; EU, euthyroid; SCH, subclinical hypothyroidism.
ORs and P-values of coronary artery calcium score were calculated using logistic regression.
조성경 외. 무증상 갑상선 기능저하증과 관상동맥석회화 점수 Korean Journal of Family Practice
KJFP
1.07–2.58), 7.49 (95% CI, 2.99–18.76)였으며 통계적으로 유의했다. 총 콜레스테롤이 200 mg/dL, LDL-C가 130 mg/dL 이상일 위험도는 TSH 가 높아질수록 커졌으나 통계적으로 유의하지 않았다(Table 5).
고 찰
본 연구에서 혈중 TSH는 심혈관계 관련 인자인 BMI, 허리둘레, HDL-C, TG와 유의한 상관관계를 가지며 경증 무증상갑상선기능저 하증군에서 비만, 당뇨병, TG가 150 mg/dL 이상일 위험도가 유의하 게 높았다. 그리고 중증 무증상갑상선기능저하증군과 CAC로 측정 된 무증상의 관상동맥 석회화는 독립적인 연관성이 있음을 확인하 였다.
현성 갑상선기능저하증에서의 심혈관계 질환 발생의 기전은 잘 알려져 있다. 현성 갑상선기능저하증에서는 동맥 강직도와 전신 혈 관 저항이 증가하게 되면서 고혈압이 발생한다.15) 특히 LDL-C와 TG 가 증가하며 이러한 LDL-C의 상승은 동맥경화를 일으킨다. 그리고 현성 갑상선기능저하증이 직접적으로 인슐린 저항성을 유발하지 않지만 상대적으로 갑상선 호르몬이 감소된 경우 인슐린 저항성을 증가시켜 심혈관계 질환 위험도를 증가시킨다.16) 그러나 무증상갑상 선기능저하증에서의 심혈관계 위험 인자의 변화 양상은 명확하지 않다. 본 연구에서는 무증상갑상선기능저하증군에서 HbA1c가 유 의하게 높았으며 TSH가 10 µIU/mL 이상인 군에서 공복혈당, HbA1c 가 유의하게 높았다. 그리고 무증상갑상선기능저하증군은 정상군 에 비하여 당뇨에 대한 위험도가 유의하게 높았다. 이러한 결과는 인 슐린 저항성은 무증상갑상선기능저하증과 연관성이 있다는 것을 시사한다. Stanická 등17)은 무증상갑상선기능저하증과 인슐린 저항 성 사이에 관련성이 있다고 보고하였으며, Skarulis 등18)의 연구에서 는 제2형 당뇨병과 무증상갑상선기능저하증을 가진 환자군은 혈당 조절에 취약해지며, 갑상선호르몬 치료를 시행한 후 혈당 조절이 개 선되었다.
무증상갑상선기능저하증이 혈중 지질에 미치는 영향은 다양하
게 보고되고 있다. Elder 등19)이 40세 이상의 무증상갑상선기능저하 증 여성을 대상으로 갑상선호르몬과 혈중 지질 농도 관계를 분석한 연구에서 무증상갑상선기능저하증과 총콜레스테롤은 양의 상관관 계를 보인다고 보고하였으며, Kvetny 등20)의 연구에서는 무증상갑상 선기능저하증 환자군에서 TG의 농도가 유의하게 높았다. 그리고 Caron 등21)은 무증상갑상선기능저하증군에서 HDL-C가 유의하게 감소했다고 보고했다. 그러나 Choi 등22)이 55세 이상의 여성을 대상 으로 한 연구에서 정상군과 무증상갑상선기능저하증군 사이에 총 콜레스테롤, LDL-C, HDL-C, TG의 유의한 차이가 없다고 보고하였 다. 본 연구에서는 정상군과 무증상갑상선기능저하증군 사이의 총 콜레스테롤, LDL-C, HDL-C의 유의한 차이는 없었으나, TG는 정상 군에 비해 무증상갑상선기능저하증군에서 유의하게 높았으며, 연 령과 성별을 보정한 후 혈중 TSH는 HDL-C와는 음의 상관관계를 가 지며 TG와는 양의 상관관계를 보였다. 이는 Caron 등21), Kvetny 등20) 의 연구결과와 일치한다. 그리고 경증 무증상갑상선기능저하증군 에서 TG가 150 mg/dL 위험도가 1.43배로 높았으며 혈중 TSH 농도가 10 µIU/mL 이상인 군에서는 위험도가 1.44배로 유사했으나 통계적 으로 유의하지 않았다. 이는 TSH 농도가 10 µIU/mL인 환자군 수가 26명으로 적기 때문에 유의하지 않게 나왔을 것으로 추측된다.
무증상갑상선기능저하증에서 심혈관 질환 진행 가능성을 예측 할 수 있는 지표로는 TSH와 FT4가 있다. Asvold 등23)은 TSH가 증가 하게 되면 관상동맥질환으로 인한 사망률이 증가한다고 보고한 반 면, Kim 등24)은 정상갑상선기능의 남성에서 혈중 FT4 농도가 관상동 맥석회화와 관련이 있다고 보고했다. 본 연구에서는 FT4의 정상범위 를 사분위로 세분화하여 심혈관계 위험인자들을 보정 후 각 범위에 따른 CACS와의 연관성을 보았을 때 유의하지 않은 반면, TSH에 대 해서는 유의한 관련성을 보였다. 이를 통해 FT4가 아닌 혈중 TSH 농 도가 심혈관 질환의 예측 지표로서 의미가 크다는 것을 알 수 있다.
본 연구에서는 혈중 TSH가 4–10 µIU/mL에서는 유의하지 않았으 나 TSH가 10 µIU/mL 이상인 중증 무증상갑상선기능저하증인 경우 CACS에 독립적으로 영향을 미치는 위험인자라는 것을 확인하였다.
Table 5. ORs for clinical factors according to serum TSH levels
Variables EU Mild SCH OR (95% CI) P-value Severe SCH OR (95% CI) P-value
Obesity - 1.35 (1.09–1.68) 0.006 1.64 (0.74–3.65) 0.221
Hypertension - 1.10 (0.86–1.41) 0.445 1.15 (0.47–2.79) 0.759
Diabetes - 1.66 (1.07–2.58) 0.023 7.49 (2.99–18.76) <0.001
Total cholesterol (≥200 mg/dL) - 0.99 (0.80–1.22) 0.922 1.72 (0.79–3.73) 0.168
Triglyceride (≥150 mg/dL) - 1.42 (1.11–1.81) 0.005 1.41 (0.58–3.45) 0.451
LDL-cholesterol (≥130 mg/dL) - 0.98 (0.80–1.22) 0.885 1.52 (0.70–3.31) 0.292
Multivariable logistic regression analysis was performed. Adjusted variables were sex and age.
OR, odds ratio; TSH, Thyroid stimulating hormone; EU, euthyroid; CI, confidential intervals; SCH, subclinical hypothyroidism; LDL, low-density lipoprotein.
Sung-Kyoung Cho, et al. Subclinical Hypothyroidism and Coronary Artery Calcium Score
Korean Journal of Family Practice
KJFP
이러한 결과는 Rodondi 등5)의 연구에서 혈중 TSH 농도에 따라 심혈 관계 질환의 발생 위험이 증가한다고 보고한 것과 일치한다. 이러한 원인은 혈중 TSH가 소폭 상승할 때 체내에서 나타나는 변화는 적으 나, TSH가 10 µIU/mL 이상으로 크게 증가할 경우, 현성 갑상선기능 저하증으로 진행할 가능성이 증가하게 되고 그에 따라 현성 갑상선 기능저하증에서 보이는 혈중 지질 이상과 인슐린 저항성 등의 변화 가 축적되면서 심혈관 질환이 발생하는 것이라 생각된다. 이러한 추 측에 대한 근거로 본 연구에서 정상군의 FT4 평균은 1.30 ng/dL, TSH 가 4–10 µIU/mL인 경증 무증상갑상선기능저하증군에서는 1.22 ng/
dL였지만, TSH가 10 µIU/mL 이상인 군에서는 1.04 ng/dL로 더 낮았 다. 그리고 Somwaru 등25)의 연구에서 TSH가 10 µIU/mL 이상인 경우 현성 갑상선기능저하증 발생에 독립적인 연관성이 있다는 결과와 Díez 와 Iglesias26)가 55세 이상의 무증상갑상선기능저하증 환자를 대 상으로 현성 갑상선기능저하증으로의 진행을 본 연구에서 혈중 TSH가 5.0–9.9 µIU/mL일 때 1.8%, 10–14.9 µIU/mL일 때 20%, 15 µIU/
mL 이상인 경우 74%에서 현성 갑상선기능저하증이 발생했다는 결 과가 이러한 추측을 뒷받침해준다. 이 결과는 혈중 TSH가 10 µIU/
mL 이상인 무증상갑상선기능저하증인 경우 현성 갑상선기능저하 증으로 진행할 가능성이 크며 죽상동맥경화증의 발생 및 진행 위험 을 높인다는 것을 설명하는 근거가 될 수 있겠다.
관상동맥 석회화를 평가하는 CACS는 심혈관 질환의 예측인자로 서 혈중 지질 등의 다른 위험인자보다 그 예측도가 우수하다고 알려 져 있다.8) Park 등27)이 2,404명의 건강한 성인을 대상으로 한 연구에 서 무증상갑상선기능저하증을 가진 남성에서 CACS가 유의하게 높 았으나 FRS상 중등도-고도의 위험도를 가진 군에서만 제한된 결과 였다. 222명의 성인을 대상으로 한 Silva 등9)의 연구에서도 FRS상 중 등도-고도의 위험도를 가진 무증상갑상선기능저하증군이 CACS와 유의한 연관성을 보였다. 그러나 상대적으로 대상자 수가 적었으며 CACS가 100 이상인 경우에만 연관성이 입증되어 일반화시키는데 한계가 있다. 하지만 본 연구는 연구대상자가 5,392명으로 규모가 비 교적 큰 연구였으며, 비석회화군과 석회화군 모두를 포함하여서도 무증상갑상선기능저하증과 CACS간의 독립적인 연관성을 보여주 었다는 데에 의의가 있다.
본 연구의 제한점은 첫째, 단면연구로서 추적관찰을 할 수 없기 때문에 무증상갑상선기능저하증 및 TSH와 CACS와의 인과관계를 증명할 수 없었다. 죽상동맥경화증이 진행되는 과정에서 무증상갑 상선기능저하증의 영향을 명확하게 하기 위해서는 전향적 연구가 필요할 것이다. 둘째, 혈중 TSH와 FT4의 정상범위의 기준이 명확하 지 않다. TSH와 FT4는 인종, 국가, 연령에 따라 정상 범위가 변화하기 때문에 각 연구마다 그 기준이 차이가 있다. 셋째, 갑상선 질환에서
심혈관 질환과 연관성이 있다고 보고되는 갑상선 자가면역항체를 고려하지 않았다. 그러나 심혈관 질환과 관련이 없다는 보고들도 있 어28) 그 연관성은 확실하게 정립되어 있지 않다.
이번 연구를 통해 혈중 TSH가 심혈관 질환의 위험인자와 상관관 계가 있으며, TSH가 10 µIU/mL인 중증 무증상갑상선기능저하증은 CACS와 독립적으로 관련성이 있음을 알 수 있었다. 이는 단순히 무 증상갑상선기능저하증과 관상동맥석회화의 연관성이 아닌 무증상 갑상선기능저하증의 임상적 의의와 치료의 적응증 확립에 근거가 될 수 있을 것으로 기대된다. 하지만 추가적으로 이에 대한 생화학적 병태생리를 규명할 수 있도록 전향적인 연구가 필요할 것으로 사료 된다.
요 약
연구배경:
무증상갑상선기능저하증과 관상동맥 석회화의 관련성 에 대한 연구는 많지 않으며 그 결과 또한 논란 중이다. 이에 본 연구 는 건강증진센터를 내원한 성인들을 대상으로 무증상갑상선기능저 하증과 심혈관질환의 위험인자 및 관상동맥석회화 점수와의 연관 성을 알아보고자 한다.방법:
2014년 1월부터 2015년 12월까지 건강검진을 위해 일개대학병 원 건강증진센터를 방문하여 혈청 갑상선 기능검사와 MDCT를 시 행한 성인 5,392명을 대상으로 하였다. 혈중 TSH 농도에 따라 정상갑 상선기능군과 무증상갑상선기능저하증군으로 분류하였고 두 군의 일반적인 특성 및 차이점을 분석하기 위해 독립 T 검정, chi-square 검 정을 사용했다. TSH 농도에 따라 세 군으로 나누어(0.4≤TSH<4.0, 4.0–10, >10 µIU/mL) 임상적 차이를 알아보기 위해 일원분산분석을 하였다. 혈중 TSH 및 Free T4와 심혈관 질환 위험인자들 간의 상관관 계를 알아보기 위해 연령과 성별을 통제한 후 편상관계수를 구하였 다. 관상동맥 석회화 점수는 MDCT를 통해 계산하여 0인 경우 비석 회화군, 0을 초과하는 경우를 석회화군으로 분류하여 로지스틱 회 귀분석을 이용하여 관상동맥석회화에 대한 무증상 갑상선기능저 하증의 교차비를 분석하였다. TSH 농도에 따른 세 군들에서의 심혈 관계 위험인자들의 위험도를 알아보기 위해 로지스틱 회귀분석을 하였다.결과:
혈중 TSH는 심혈관계 관련 인자인 BMI, 허리둘레, HDL-C, 중 성지방과 유의한 상관관계를 가지며 무증상 갑상선기능저하증군에 서 비만, 당뇨병, 중성지방이 150 mg/dL 이상일 위험도가 유의하게 높았다. 또한 TSH 농도가 10 µIU/mL 이상인 무증상갑상선기능저하 증군은 연령을 포함한 모든 변수를 통제한 후 교차비가 3.18 (95%confidence interval, 1.10–9.21)로 관상동맥석회화의 유의한 위험인자
조성경 외. 무증상 갑상선 기능저하증과 관상동맥석회화 점수 Korean Journal of Family Practice
KJFP
였다.
결론:
혈중 TSH가 10 µIU/mL 이상인 중증 무증상갑상선기능저하 증은 관상동맥석회화점수와 독립적으로 연관성이 있다.중심단어:
무증상갑상선기능저하증; 갑상선자극호르몬; 심혈관질 환 위험인자; 관상동맥석회화점수; 무증상죽상동맥경화증REFERENCES
1. Klein I, Ojamaa K. Thyroid hormone and the cardiovascular system. N Engl J Med 2001; 344: 501-9.
2. Cappola AR, Ladenson PW. Hypothyroidism and atherosclerosis. J Clin Endocrinol Metab 2003; 88: 2438-44.
3. Cooper DS, Biondi B. Subclinical thyroid disease. Lancet 2012; 379: 1142- 54.
4. Delitala AP, Fanciulli G, Maioli M, Delitala G. Subclinical hypothyroidism, lipid metabolism and cardiovascular disease. Eur J Intern Med 2017; 38: 17- 24.
5. Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, et al.
Subclinical hypothyroidism and the risk of coronary heart disease and mor- tality. JAMA 2010; 304: 1365-74.
6. Gencer B, Collet TH, Virgini V, Auer R, Rodondi N. Subclinical thyroid dys- function and cardiovascular outcomes among prospective cohort studies.
Endocr Metab Immune Disord Drug Targets 2013; 13: 4-12.
7. Vanderpump MP, Tunbridge WM, French JM, Appleton D, Bates D, Clark F, et al. The development of ischemic heart disease in relation to autoimmune thyroid disease in a 20-year follow-up study of an English community. Thy- roid 1996; 6: 155-60.
8. Greenland P, LaBree L, Azen SP, Doherty TM, Detrano RC. Coronary artery calcium score combined with Framingham score for risk prediction in as- ymptomatic individuals. JAMA 2004; 291: 210-5.
9. Silva N, Santos O, Morais F, Gottlieb I, Hadlich M, Rothstein T, et al. Subclin- ical hypothyroidism represents an additional risk factor for coronary artery calcification, especially in subjects with intermediate and high cardiovascu- lar risk scores. Eur J Endocrinol 2014; 171: 327-34.
10. Verma R, Verma A, Gupta P, Agrawal NK. Coronary artery calcium scoring is a better predictor of cardiac risk in subclinical hypothyroidism patients with low-risk Framingham score. Indian J Endocrinol Metab 2016; 20: 756- 62.
11. Pearce SH, Brabant G, Duntas LH, Monzani F, Peeters RP, Razvi S, et al. 2013 ETA guideline: management of subclinical hypothyroidism. Eur Thyroid J 2013; 2: 215-28.
12. Agatston AS, Janowitz WR, Hildner FJ, Zusmer NR, Viamonte M Jr, Detrano R. Quantification of coronary artery calcium using ultrafast computed to- mography. J Am Coll Cardiol 1990; 15: 827-32.
13. Pletcher MJ, Tice JA, Pignone M, Browner WS. Using the coronary artery calcium score to predict coronary heart disease events: a systematic review and meta-analysis. Arch Intern Med 2004; 164: 1285-92.
14. Committee for the Korean Guidelines for the Management of Dyslipid- emia. 2015 Korean guidelines for the management of dyslipidemia: execu- tive summary (English Translation). Korean Circ J 2016; 46: 275-306.
15. Biondi B, Klein I. Hypothyroidism as a risk factor for cardiovascular disease.
Endocrine 2004; 24: 1-13.
16. Bakker SJ, ter Maaten JC, Popp-Snijders C, Slaets JP, Heine RJ, Gans RO. The relationship between thyrotropin and low density lipoprotein cholesterol is modified by insulin sensitivity in healthy euthyroid subjects. J Clin Endocri- nol Metab 2001; 86: 1206-11.
17. Stanická S, Vondra K, Pelikánová T, Vlcek P, Hill M, Zamrazil V. Insulin sen- sitivity and counter-regulatory hormones in hypothyroidism and during thyroid hormone replacement therapy. Clin Chem Lab Med 2005; 43: 715- 20.
18. Skarulis MC, Celi FS, Mueller E, Zemskova M, Malek R, Hugendubler L, et al. Thyroid hormone induced brown adipose tissue and amelioration of di- abetes in a patient with extreme insulin resistance. J Clin Endocrinol Metab 2010; 95: 256-62.
19. Elder J, McLelland A, O’Reilly DS, Packard CJ, Series JJ, Shepherd J. The rela- tionship between serum cholesterol and serum thyrotropin, thyroxine and tri-iodothyronine concentrations in suspected hypothyroidism. Ann Clin Biochem 1990; 27: 110-3.
20. Kvetny J, Heldgaard PE, Bladbjerg EM, Gram J. Subclinical hypothyroidism is associated with a low-grade inflammation, increased triglyceride levels and predicts cardiovascular disease in males below 50 years. Clin Endocri- nol (Oxf) 2004; 61: 232-8.
21. Caron P, Calazel C, Parra HJ, Hoff M, Louvet JP. Decreased HDL cholesterol in subclinical hypothyroidism: the effect of L-thyroxine therapy. Clin Endo- crinol (Oxf) 1990; 33: 519-23.
22. Choi JK, Kim JS, Hwang CH, Kim DH, Hwang SW, Cho B, et al. Subclinical hypothyroidism and coronary risk factors in women above 55 years. J Kore- an Acad Fam Med 2002; 23: 96-103.
23. Asvold BO, Bjøro T, Platou C, Vatten LJ. Thyroid function and the risk of coronary heart disease: 12-year follow-up of the HUNT study in Norway.
Clin Endocrinol (Oxf) 2012; 77: 911-7.
24. Kim ES, Shin JA, Shin JY, Lim DJ, Moon SD, Son HY, et al. Association be- tween low serum free thyroxine concentrations and coronary artery calcifi- cation in healthy euthyroid subjects. Thyroid 2012; 22: 870-6.
25. Somwaru LL, Rariy CM, Arnold AM, Cappola AR. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012; 97: 1962-9.
26. Díez JJ, Iglesias P. Spontaneous subclinical hypothyroidism in patients older than 55 years: an analysis of natural course and risk factors for the develop- ment of overt thyroid failure. J Clin Endocrinol Metab 2004; 89: 4890-7.
27. Park YJ, Lee YJ, Choi SI, Chun EJ, Jang HC, Chang HJ. Impact of subclinical hypothyroidism on the coronary artery disease in apparently healthy sub- jects. Eur J Endocrinol 2011; 165: 115-21.
28. Collet TH, Bauer DC, Cappola AR, Asvold BO, Weiler S, Vittinghoff E, et al.
Thyroid antibody status, subclinical hypothyroidism, and the risk of coro- nary heart disease: an individual participant data analysis. J Clin Endocrinol Metab 2014; 99: 3353-62.