20
•교신저자:김철성, 조선대학교 의과대학 비뇨기과학교실 광주 동구 서석동 588 우 501-717
Tel: 062-220-3218, Fax: 062-231-3210 E-mail: cskim@chosun.ac.kr
비뇨기수술에 대한 예방적 항생제요법
조선대학교 의과대학 비뇨기과학교실 김 철 성
[Abstract]
Antimicrobial Prophylaxis for Urologic Surgery Chul Sung Kim
From the Department of Urology, College of Medicine, Chosun University, Gwangju, Korea
Surgical site infections (SSI) remain a significant contributor to postoperative morbidity and mortality.
Antimicrobial prophylaxis to prevent SSI is one of the most widely accepted practices in surgery. Despite the evidence of effectiveness and the publication of guidelines for antimicrobial prophylaxis to prevent SSIs, prophylaxis use is often suboptimal. Optimal prophylaxis requires application in appropriate types of operations, selection of safe and effective antimicrobials, initial administration and redosing to maintain effective serum and tissue levels throughout the operation and discontinuation when the patient is no longer receiving a benefit and the antimicrobial agent should be bactericidal, safe, and inexpensive.
Based on the published evidence, the infusion of the first antimicrobial dose should begin within 60 minutes before the surgical incision is made and prophylactic antimicrobials should be discontinued within 24 hours of the end of surgery. The initial antimicrobial dose should be adequate based on the patient's weight, adjusted dosing weight or body mass index. An additional dose of antimicrobial should be given intraoperatively if the operation is still continuing two half-lives after the initial dose.
Antimicrobial prophylaxis is recommended at the time of many clean-contaminated and some clean operations.
To reduce the risk of SSI, a systematic but realistic approach must be applied with the awareness that this risk is influenced by characteristics of the patient, operation, personnel and hospital. (Korean J UTII
2009;4:20-36)Key Words: Surgical wound infections, Antimicrobial prophylaxis, General surgery, Laparoscopic surgery,
Urologic Surgical Procedures
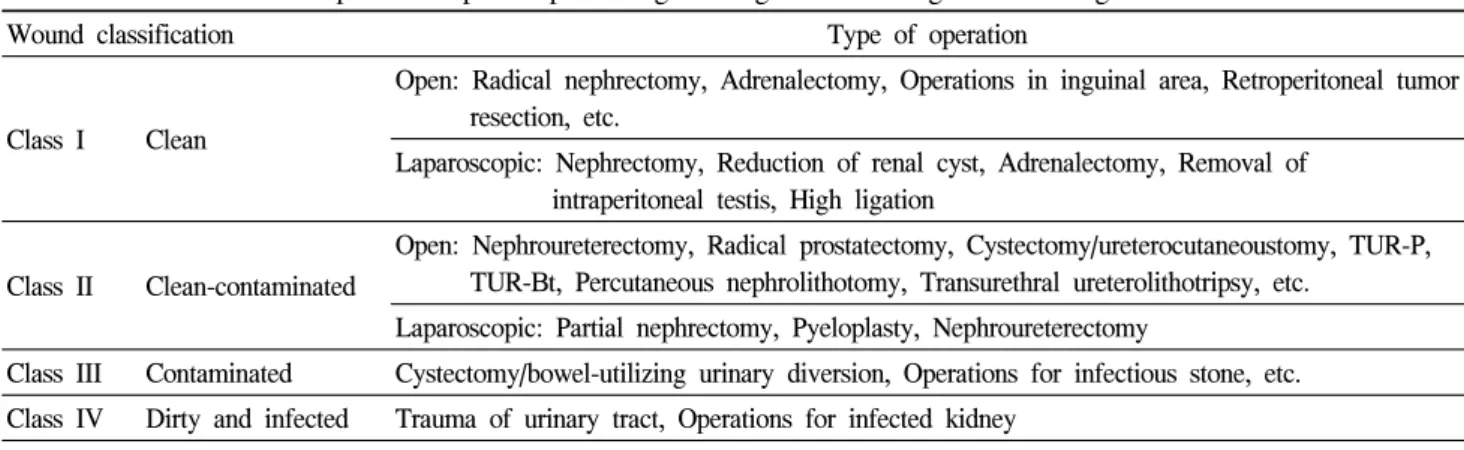
Table 1. Surgical wound classification
Clean Uninfected operative site, with primary skin closure.
Clean-contaminated Entry into respiratory, alimentary, genital, or urinary tracts.
Contaminated Fresh accidental wounds, major break in sterile technique, gross spillage from gastrointestinal tract, or presence of acute but nonpurulent inflammation at the operative site.
Dirty-infected
Old accidental wound with devitalized tissue or presence of clinical infection or perforated viscera at the operative site. This definition implies that organisms that might cause postoperative infection were present at the operative site before surgery.
서 론
수술부위감염과 요로감염은 비뇨기수술 후 발생
하는 흔한 합병증이다. 최근 우리나라에서 발표한 총 2,924건의 주요수술에 대한 수술부위 감염률은 2.9%로 보고하고 있으며
1국외의 연구결과에 의하 면 2.6∼7.9%로 보고하고 있다.
2-5수술부위감염은 복강밖의 청결수술의 5%, 복막수술의 20%를 차지 한다.
6수술부위 감염은 입원기간과 치료비용을 증 가시키고 심지어 환자가 사망에 이르게 한다.
7이 러한 감염성 합병증을 예방하기 위해서 수술실 환 경, 소독방법 및 술기의 개선이 이루어지고 예방 적 항생제의 진료지침이 제정되었으나 아직도 수 술부위감염이 입원환자의 합병증과 사망의 주된 원인으로 남아 있다.
수술 중 예방적 항생제의 투여는 국소적 또는 전신적 술 후 감염을 방지하기 위해서 술 전과 술 후 제한된 시간동안 항생제를 투여하는 것을 말한 다. 예방적 항생제 투여의 주 목적은 수술부위감 염 뿐 아니라 급성 신우신염, 급성전립선염, 급성 부고환염 및 폐혈증과 같은 증상이 있는 열성 비 뇨생식기의 감염을 방지하고 심내막염이나 폐렴같 은 타장기의 감염도 방지하는 것이다.
8수술부위감 염은 환자, 수술, 집도의사 및 수술관련 종사자 그 리고 수술실환경에 의해서 영향을 받기 때문에 수 술부위감염을 줄이기 위해서는 이들의 특성을 파 악하고 술 전, 술 중, 술 후에 체계적이고 현실성 있는 접근을 시도해야 한다.
9예방적 항생제 투여 는 수술부위감염을 예방하기 위한 여러 가지 방법
중 하나에 불과하며 불결한 위생이나 술기를 결코 보상할 수 없다.
수술부위감염과 술 후 요로감염을 감소시키기 위 한 예방적 항생제 투여의 효용성은 외과적 수술에 서는 잘 알려져 있지만 문헌고찰을 해보면
10비뇨 기수술에 대한 연구는 제한되어 있으며, 저자마다 예방적 항생제의 선택, 투여시간과 기간이 다양하 며, 서로 다른 연구사이의 비교는 연구자마다 정의 와 연구 설계 및 연구내용의 질이 다르기 때문에 쉽지 않다. 한편 최근 비뇨기수술은 개복수술보다 는 내비뇨기수술, 복강경수술 및 로봇수술이 활발 하게 이루어지고 있어 이들 수술에 대한 예방적 항 생제 사용에 대한 잘 설계된 전향적인 연구가 극히 드물어 현재까지 비뇨기수술에 대한 예방적 항생제 의 사용은 많은 논란거리가 되고 있다.
저자는 예방적 항생제의 투여시기 및 기간, 종 류, 용량, 등에 대하여 검토하고 기존에 발표된 미 국비뇨기과학회와 유럽비뇨기과학회의 진료지침을 비교분석하여 예방적 항생제의 적응증 및 적정한 투여방법을 알아보고자 한다.
본 론
1. 수술상처의 분류
수술상처의 분류체계는 다음과 같이 4가지 종류
로 나뉘어 사용된다 (Table 1).
9청결상처 (Class I/Clean): 감염되지 않은 수술상
처로서 염증이 없고 호흡기계, 소화기계, 생식기계
및 감염되지 않은 비뇨기계를 절개하지 않은 상
Table 2. Classification of open and laparoacopic urological surgeries according to CDC surgical wound classification
Wound classification Type of operation
Class I Clean
Open: Radical nephrectomy, Adrenalectomy, Operations in inguinal area, Retroperitoneal tumor resection, etc.
Laparoscopic: Nephrectomy, Reduction of renal cyst, Adrenalectomy, Removal of intraperitoneal testis, High ligation
Class II Clean-contaminated
Open: Nephroureterectomy, Radical prostatectomy, Cystectomy/ureterocutaneoustomy, TUR-P, TUR-Bt, Percutaneous nephrolithotomy, Transurethral ureterolithotripsy, etc.
Laparoscopic: Partial nephrectomy, Pyeloplasty, Nephroureterectomy
Class III Contaminated Cystectomy/bowel-utilizing urinary diversion, Operations for infectious stone, etc.
Class IV Dirty and infected Trauma of urinary tract, Operations for infected kidney
Table 3. Patients-related factors affecting host response
to SSIs
Advanced age
Anatomic anomalies of the urinary tract Poor nutritional status
Smoking
Chronic corticosteroid use Immunodeficiency Externalized catheters
Colonized endogenous/exogenous material Distant coexistent infection
Prolonged hospitalization
Table 4. Operation-related factors influencing the risk
of SSI development
Duration of surgical scrub Skin antisepsis
Preoperative shaving Preoperative skin prep Duration of operation Antimicrobial prophylaxis Operating room ventilation
Inadequate sterilization of instruments Foreign material in the surgical site Surgical drains
Surgical technique Poor hemostasis
Failure to obliterate dead space Tissue trauma
처. 청결상처가 일차 봉합되고 폐쇄 배액법으로 배액되는 경우, 비관통성 외상을 동반한 수술상처.
청결-오염상처 (Class II/Clean-Contaminated): 특별 한 오염이 없고 잘 조절된 상태하에서 호흡기계, 소화기계, 비뇨생식기계를 절개한 수술상처, 감염 이나 술기상 큰 오류가 없는 상태에서 담도계, 충 수돌기, 질과 후두를 침범하는 수술.
오염상처 (Class III/Contaminated): 외부로 노출된 신선한 외상성 상처, 무균술기에 중대한 오류가 있거나 위장관으로 부터 누출이 있는 수술, 급성 비화농성 염증부위의 절개.
불결-감염상처 (Class IV/Dirty-Infected): 활력이 없는 조직이 있는 오래된 외상성 상처, 기존에 있 는 감염부위를 침범하는 상처 및 파열된 장관의 상처. 이는 술 후 감염을 일으키는 세균이 수술 전에 이미 수술부위에 존재함을 의미한다.
이러한 수술상처 분류체계에 기술되어 있는 기 준을 바탕으로 술 후에 술 중 세균오염정도를 평 가하여 예방적 항생제를 투여하는 간단한 지침으 로 삼을 수 있으며 술 전에 시행 할 수술의 수술 상처 분류를 예상하여 예방적 항생제의 사용을 결 정할 수 있다.
수술상처 분류에 따른 수술창감염의 빈도는 청결 상처 1.5%, 청결-오염상처 7.7%, 오염상처 15.2%, 불결상처 40%라고 보고하고 있다.
11상기의 수술상처 분류에 의거한 비뇨기 수술의
분류는 표 2와 같다.
122. 위험요인
위험요인은 특정수술 후 수술부위감염의 발생과 의미 있고 독립적인 관련이 있는 요인을 말하며 역학조사에서 다변량 분석에 의하여 확인된다. 이 러한 위험요인은 환자관련요인과 수술적 요인으로 대별할 수 있다 (Table 3, 4).
9세균뇨나 균혈증에 대응하는 환자의 능력은 환 자의 위험요인에 의하여 결정되는데 요로계의 자 연적 방어기전과 면역체계를 파괴하여 감염의 위 험도를 증가시키는 요인은 고령의 나이, 요로계의 해부학적 이상, 불량한 영양상태, 흡연, 만성적 부 신피질호르몬 사용 및 면역결핍 상태 등이 있으 며, 국소적 세균의 수나 세균의 종류를 증가시키 는 위험인자는 카테터 유치, 균이 집락화된 내재 적 또는 외재적 물질, 다른 부위의 동반감염 및 장기입원 등이 해당된다 (Table 3). 수술적 요인은 술 전, 술 중, 술 후 요인이 모두 포함된다 (Table 4). 술 전 요인은 수술부위의 털 제거, 환자의 피 부소독, 수술 관련자들의 손 및 전박소독, 예방적 항생제 투여 등이 관여하고 술 중 요인은 수술실 의 환기, surgical attire와 drapes 및 수술술기가 해 당되며 술 후 요인은 술 후 절개부위 관리와 퇴원 계획이 포함 된다.
9비뇨기수술에 대한 예방적 항 생제를 적절히 투여하기 위해서는 위험인자에 대 한 철저한 이해와 개개의 환자상태에 대한 주의 깊은 평가가 필요하다.
3. 수술부위감염의 원인균
수술부위감염의 원인균은 특정부위의 수술종류에 따라 예상할 수 있는 특정세균이 관여한다. 가장 흔 히 발견되는 세균은 Staphylococcus aureus, coagulase negative Staphylococcus, E. coli, Entero- coccus이다.
대부분의 수술부위감염에서 원인균은 환자의 피부, 점막 및 위장관에 존재하는 정상세균총 (endogenous flora)이다.
13피부나 점막을 절개하면 노출된 조직은 호기성 그람양성구균 (예, Staphy- lococcus aureus, coagulase negative Staphylococcus sp., Group A
Streptococcus sp.)이 오염될 위험이 있다.
14또한 회음 부나 서혜부 절개를 하면 혐기성세균이나 그람음성 간균과 같은 장내세균이 오염될 수 있다. 비뇨기계 장기가 절개되면 호기성 그람음성간균 (예, E. coli, Proteus, Klebsiella sp.)과 그람양성구균 (예, Enterococcus)이 주로 오염된다. 수술 중 위장관이 절개되면 그람음성간균 (예, E. coli), 그람양성구균 (예, Enterococcus) 및 혐기성세균 (예, Bacillus fragilis)이 특징적인 수술부위감염의 오염균이다. 감 염의 원위병소로부터 수술부위로의 세균의 파종이 특히 임플란트나 보형물을 삽입한 환자에서 수술부 위감염을 일으킬 수 있다.
15-18수술부위감염의 외재 적 원인은 수술에 참여하는 사람, 수술실 환경, 수 술기구 및 수술재료 등이 있으며
19-21그람양성세균 (예, Staphylococcus, Streptococcus)이 오염균이 된다.
드물게 진균도 원인이 될 수 있다.
22한편 methicillin resistant Staphyloccous aureus (MRSA)와 같은 항생제 내성균주나 Candida spp.와 같은 진균이 증가하고 있 는데 이는 면역결핍환자의 증가와 광범위항생제의 남용이 원인으로 생각된다.
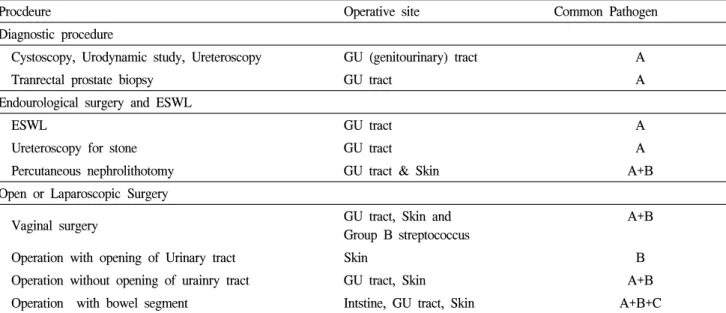
표 5는 수술종류에 따른 가능한 원인균을 기술 하였다.
4. 예방적 항생제 사용의 기본원칙
미국의 질병관리본부는 예방적 항생제의 효능과 안전을 극대화하기 위해서 다음과 같은 4가지의 기본원칙을 제시하였다.
9첫째, 예방적 항생제는 임상시험에 근거하여 항 생제 사용으로 수술부위감염을 감소시킬 수 있는 모든 수술이나 심장수술처럼 수술부위감염이 심각 한 위험을 초래할 수 있는 수술의 경우에 사용한 다.
23,24둘째, 예방적 항생제는 안전하고 값이 싸며, 특 정수술에 대한 술 중 오염가능성이 있는 균주에 살균작용이 있는 항생제를 사용한다.
셋째, 피부절개 시점에 혈장과 조직의 항생제 농도가 살균작용을 나타낼 수 있도록 항생제의 초 회 투여시기를 적절하게 맞춘다.
넷째, 수술을 시행하는 동안과 수술절개 부위를
Table 5. Expected pathogens of urologic operative sites
Procdeure Operative site Common Pathogen
Diagnostic procedure
Cystoscopy, Urodynamic study, Ureteroscopy GU (genitourinary) tract A
Tranrectal prostate biopsy GU tract A
Endourological surgery and ESWL
ESWL GU tract A
Ureteroscopy for stone GU tract A
Percutaneous nephrolithotomy GU tract & Skin A+B
Open or Laparoscopic Surgery
Vaginal surgery GU tract, Skin and
Group B streptococcus
A+B
Operation with opening of Urinary tract Skin B
Operation without opening of urainry tract GU tract, Skin A+B
Operation with bowel segment Intstine, GU tract, Skin A+B+C
A: Common GU tract organisms: E. coli, Proteus sp., Klebsiella sp., Enterococcus.
B: Common skin organisms: S. aureus, coagulase negative Staph. sp., Group A Strep. sp.
C: Common intestinal organisms: E. coli, Klebsiella sp., Enterobacter, Serratia sp., Proteus sp., Enterococcus, and Anaerobes ESWL: extracoporeal shock wave lithotripsy, GU: genitourinary
봉합 후 2∼3시간까지 혈장과 조직에 항생제의 치 료농도를 유지하도록 한다.
24-26일반적으로 예방적 항생제는 위장관을 절개하는 모든 청결-오염수술 에 사용되며 청결상처는 예방적 항생제의 사용이 필요 없으나 가끔은 청결수술도 적응이 되며 보형 물 삽입술이나 심장수술 같은 청결수술이 잘 알려 진 예방적 항생제 사용의 적응증이다.
91) 예방적 항생제의 적절한 투여시점
예방적 항생제가 최적의 효과를 내기 위해서는 투여시기와 투여용량이 중요하다.
예방적 항생제는 수술하는 동안 항생제의 혈중 및 조직농도를 세균에 대한 침입을 방지하기 위한 최소억제농도 이상으로 유지하여 술 후 국소적 또 는 전신적 감염을 방지하기 위해서 투여한다. 예 방적 항생제 사용의 이론적 근거는 1957년 Miles 등
27이 guinea pig의 진피에 황색포도구균을 접종하 여 발생한 피부감염이 결정기 (decisive period; 상 처오염 후 3시간 이내) 동안에 항생제를 투여하여 억제시킬 수 있다고 발표하였다. 이후 1961년
Burke는
28황색포도구균에 오염된 피부 및 절개부
위의 실험적 감염이 감염 전이나 직후에 항생제를
투여하여 피부감염의 크기가 의미 있게 감소하였
으며 항생제투여가 지연되면 3시간까지는 매 시간
마다 감염의 크기가 점점 커졌고 4시간째에는 피
부감염의 크기가 항생제를 투여하지 않은 대조군
과 동일한 크기로 커져 항생제를 세균오염 후 3시
간 내에 투여하면 감염크기를 감소시키는데 효과
적이라고 하였다. 이러한 관찰에 대한 임상적 타
당성은 Polk와 Lopez-Mayor
29에 의해서 확립되었는
데 위장관수술 환자에서 술 중과 술 후 cepha-
loridine을 투여한 비교에서 술 중 항생제를 투여한
환자에서 수술부위감염의 발생률이 의미있게 낮았
다고 하였으며 Stone 등
30은 예방적 항생제를 수술
전 1시간 이내에 투여한 환자에서 수술부위 감염
률이 가장 낮았으며 수술 후 1∼4시간에 항생제를
투여한 환자는 술 전 투여한 환자보다 의미 있게
수술부위 감염률이 높았고 예방적 항생제를 투여
하지 않은 환자와 비슷한 감염률을 보였다고 하였
다. 1992년 Classen 등
31은 청결 또는 청결-오염 수
Table 6. Suggested initial dose and time to redosing for antimicrobial commonly used for surgical prophylaxis Antimicrobial Half-life normal
renal function (h)
Half-life end-stage renal d's (h)
Recommended infusion time
(min)
Standard intravenous
dose (g)
Weight- based dose recommendation (mg)
Redosing interval (h)
Cefazolin 1.2-2.5 40-70 3-5‡
15-60§ 1-2 20-30 mg/kg 2-5
Cefuroxim 1-2 15-22 3-5‡
15-60§ 1.5 50 mg/kg 3-4
Cefamandole 0.5-2.1 12.3-18 3-5‡
15-60§ 1 3-4
Cefoxitin 0.5-1.1 6.5-23 3-5‡
15-60§ 1-2 20-40 mg/kg 2-3
Cefotetan 2.8-4.6 13-25 3-5‡
15-60§ 1-1 20-40 mg/kg 3-6
Aztreonam 1.5-2 6 3-5‡ 1-2 Maximum
2g (adult) 3-5
Ciproploxacin 3.5-5 5-9 60 400 mg 400 mg 4-10
Clindamycin 2-5.1 3.5-5.0 10-60
(<30 mg/min) 600-900 mg 3-6 mg/kg
(≥10 kg) 3-6
Erythromycin
base 0.8-3 5-6 NA
1g orally 19,18,9h
before surgery
9-13 mg/kg 3-6
Gentamicin 2-3 50-70 30-60
1.5 mg/kg, 1g orally 19,18,9h before surgery
30% ≥ Ideal
body weight 3-6
Neomycin 2-3 12-≥24 NA
1g orally 19,18,9h before surgery
20 mg/kg NA
Metronidazole 6-14 7-21 30-60 0.5-1 15 mg/kg (adult) 6-8
Vancomycin 4-6 44.1-406.4 12-≥24 1.0 10-15 mg/kg (adult) 6-12
‡: Dose injected directly into vein or running IV fluid
§: Intermittent IV infusion d's: disease
술에서 예방적 항생제의 투여시점과 수술부위감염 과의 관계를 기술하였는데 수술 전 2시간 이내에 항생제를 투여한 군은 수술부위 감염률이 0.6%로 서 가장 낮았고, 수술 후 3시간 이내에 투여한 군 은 1.4%로서 술 전 2시간 내에 투여군보다 수술부 위감염의 발생위험이 2.4배 높았으며, 술 후 3∼24 시간 후에 투여군은 3.3%로서 수술부위감염의 발
생위험이 5.8배 높았고, 술 전 2∼24시간 전에 투
여군은 3.8%로서 술 전 2시간 내에 투여군보다 수
술부위감염의 발생위험이 6.7배 높았다. 이 연구에
서 예방적 항생제는 수술 전 2시간 이내에 투여하
라고 보고하였다. 많은 연구들이 바람직한 예방적
효과를 얻기 위해서 예방적 항생제는 피부절개 시
점에 근접하여 투여하거나 그 이전에 투여하는 것
을 권고 한다.
28,30,31미국질병관리본부와 미국비뇨 기과학회의 진료지침에 의하면
6,32예방적 항생제의 초회투여는 피부절개 전 60분 이내에 시작하라고 하였다. 그러나 예외적으로 항생제 관련 부작용을 방지하기 위하여 fluoroquinlone이나 반코마이신의 정맥주사는 120분 이내에 투여한다. 유럽비뇨기과 학회의 진료지침에 의하면 예방적 항생제투여의 적절한 시간은 수술 전 2시간 이내이며 수술시작 후 3시간을 넘지 말라고 하였다. 실질적으로 경구 용 항생제는 수술 전 1시간에 투여하고 정맥용 항 생제는 마취유도기에 투여한다.
항생제의 약물 역동학을 고려해 보면 예방적 항 생제로 흔히 사용되는 베타-락탐 항생제 (penicillin, cephalosporin, monobactam, carbapenem)는 시간의존 성 살균제이다.
33살균력은 수술부위의 항생제 농 도가 수술부위를 오염시킬 가능성이 높은 세균에 대한 최소억제농도 이상으로 유지되는 시간과 직 접적으로 비례한다. 술 중 항생제의 추가투여는 항생제의 반감기와 최소억제농도 이상의 혈장농도 를 기준으로 결정한다. 흔한 세균의 최소억제농도 는 지역적인 감수성 양상에 따라 다르기 때문에 예방적 항생제 사용 전에 이를 알아야 한다. 항생 제가 살균력을 나타내는 다른 기전은 농도의존성 살균이다. 농도의존성 항생제는 aminoglycosies, fluoroquinolones과 metronidazole이 해당된다. 최대 살균효과는 최소억제농도이상을 유지하는 총 시간 보다 최대혈장농도에 의해 결정된다.
33많은 농도 의존성 항생제는 혈장농도가 감소한 후에도 오랫 동안 살균효과나 억제효과를 나타낸다. 따라서 예 방적 항생제는 항생제의 약물학적 특성을 파악한 후 사용하는 것이 현명하다. Table 6에는 흔히 추 천되는 예방적항생제의 반감기, 초기용량, 주입시 간 과 추가투여시간이 기술되어 있다.
2) 예방적 항생제의 추가투여
수술 중에 항생제를 재 투여하는 목적은 가장 감염의 위험이 높을 때 항생제의 적절한 조직농도 와 혈장농도를 유지하기 위함이다. 수술시간이 항 생제의 치료농도를 유지할 수 있는 시간을 초과 할 때는 추가항생제를 투여해야 한다. 일반적으로
추가항생제를 투여할 시점은 치료용량에 의한 조 직농도, 약물의 반감기와 병원균에 대한 최소 억 제 농도치에 의해서 평가 한다.
9많은 연구자들이 반감기가 짧은 항생제를 술 중 추가투여하면 수술 부위감염을 감소시킨다고 보고하였다.
25,34-36추가항 생제는 첫 투여한 항생제의 반감기의 2배의 시기 에 투여한다.
6Swoboda 등
37은 예방적 항생제의 청 소율은 수술 중 실혈양이 많을 때 증가한다고 하 였다. 술 중 실혈양이 1500cc 이상일 때는 추가투 여를 권유한다.
3) 예방적 항생제의 투여기간
예방적 항생제를 오랫동안 사용하는 것을 지지 하는 연구는 없다. 사실상 수술 중에 감염의 위험 도가 가장 높기 때문에 절개부위 봉합 후 또는 내 시경수술이 끝난 후에 항생제를 투여하는 것은 불 필요하며 예방적 항생제를 1회 투여법과 다회 투 여법사이의 비교에서 수술부위감염을 감소시키는 데 별 이득이 없다고 하였다.
9,26,38-40더구나 항생제 를 오랫동안 사용하게 되면 내성균주가 출현하고, 합병증이 발생하며 건강관리비용이 증가한다.
대부분의 경우 항생제는 1회 용량을 투여하거나 적어도 수술 후 24시간 이내에 중단한다.
Nelson 등
41은 수술종료 후 예방적 항생제를 24시간 사용한 환자군과 1주일동안 사용한 환 자군의 수술부위감염을 비교한 결과 유의한 차 이가 없다고 하였으며, Scher
25도 수술이 끝난 뒤 오랫동안 항생제를 사용하는 것이 수술부위 감염을 낮추지 못하며 수술종료 후 3시간 이내 에 단 1회의 예방적 항생제 투여로 수술부위감 염의 예방이 충분하다고 하였다. 그러나 보형물 삽입술을 시행하거나, 기존감염이 존재하거나, 유치된 카테터를 조작시에는 항생제를 보다 장 기간 사용하는 것을 고려해야한다.
32요도 카테터를 유치하고 있거나 감염석이 동반
된 경우는 시술 전에 동반감염을 치료할 수 없기
때문에 술 전에 억제항균요법을 시행하며 항생제
의 추가투여는 환자의 위험인자와 감염관련 합병
증에 따라서 수술종료 후 24시간 이후 까지 투여
한다. 가능하면 동반감염은 수술부위감염을 감소
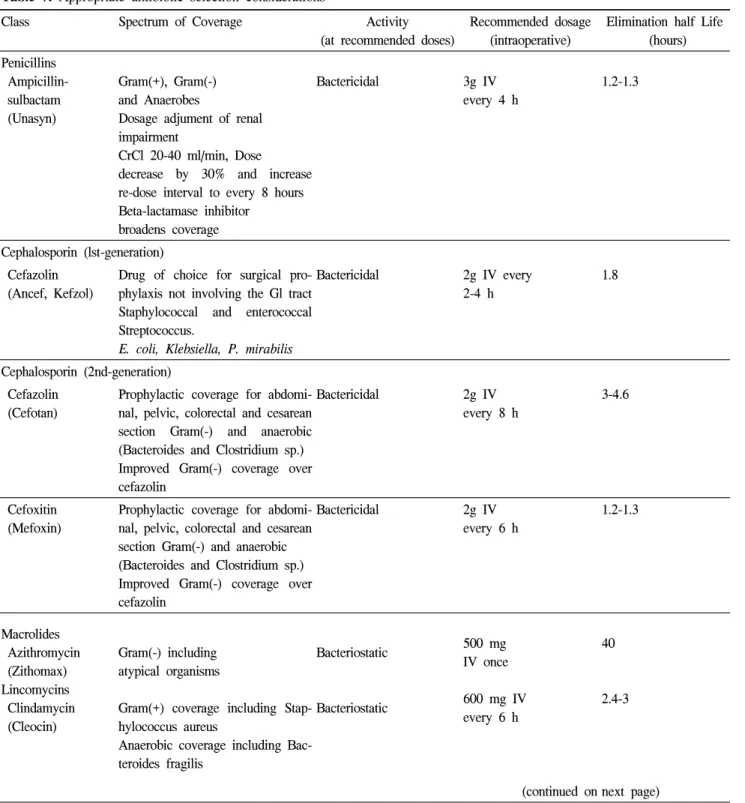
Table 7. Appropriate antibiotic selection considerations
Class Spectrum of Coverage Activity
(at recommended doses)
Recommended dosage (intraoperative)
Elimination half Life (hours) Penicillins
Ampicillin- sulbactam (Unasyn)
Gram(+), Gram(-) and Anaerobes
Dosage adjument of renal impairment
CrCl 20-40 ml/min, Dose
decrease by 30% and increase re-dose interval to every 8 hours Beta-lactamase inhibitor
broadens coverage
Bactericidal 3g IV
every 4 h
1.2-1.3
Cephalosporin (lst-generation) Cefazolin
(Ancef, Kefzol)
Drug of choice for surgical pro- phylaxis not involving the Gl tract Staphylococcal and enterococcal Streptococcus.
E. coli, Klebsiella, P. mirabilis
Bactericidal 2g IV every 2-4 h
1.8
Cephalosporin (2nd-generation) Cefazolin
(Cefotan)
Prophylactic coverage for abdomi- nal, pelvic, colorectal and cesarean section Gram(-) and anaerobic (Bacteroides and Clostridium sp.) Improved Gram(-) coverage over cefazolin
Bactericidal 2g IV
every 8 h
3-4.6
Cefoxitin (Mefoxin)
Prophylactic coverage for abdomi- nal, pelvic, colorectal and cesarean section Gram(-) and anaerobic (Bacteroides and Clostridium sp.) Improved Gram(-) coverage over cefazolin
Bactericidal 2g IV
every 6 h
1.2-1.3
Macrolides Azithromycin (Zithomax) Lincomycins Clindamycin (Cleocin)
Gram(-) including atypical organisms
Gram(+) coverage including Stap- hylococcus aureus
Anaerobic coverage including Bac- teroides fragilis
Bacteriostatic
Bacteriostatic
500 mg IV once 600 mg IV every 6 h
(continued on 40
2.4-3
next page)
시키기 위해 수술 전에 치료한다. 수술 후 오랫동 안 카테터를 유치하는 경우에는 카테터 제거시 치 료목적으로 항생제를 사용한다. 이 경우 카테터 제거 전 24∼48시간 내에 배양을 시행하여 감수성
검사에 따라 항생제를 투여하거나 경험적으로 항
생제를 투여한다.
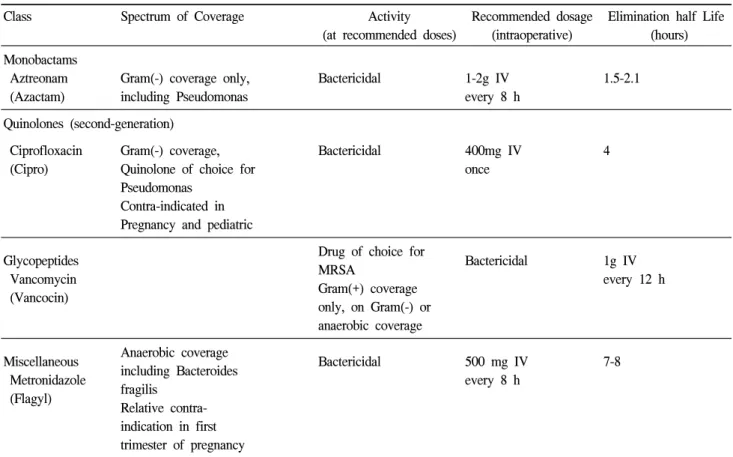
32Table 8. Appropriate antibiotic selection considerations (Continued)
Class Spectrum of Coverage Activity
(at recommended doses)
Recommended dosage (intraoperative)
Elimination half Life (hours) Monobactams
Aztreonam (Azactam)
Gram(-) coverage only, including Pseudomonas
Bactericidal 1-2g IV
every 8 h
1.5-2.1
Quinolones (second-generation) Ciprofloxacin
(Cipro)
Gram(-) coverage, Quinolone of choice for Pseudomonas
Contra-indicated in Pregnancy and pediatric
Bactericidal 400mg IV
once
4
Glycopeptides Vancomycin (Vancocin)
Drug of choice for MRSA
Gram(+) coverage only, on Gram(-) or anaerobic coverage
Bactericidal 1g IV
every 12 h
Miscellaneous Metronidazole (Flagyl)
Anaerobic coverage including Bacteroides fragilis
Relative contra- indication in first trimester of pregnancy
Bactericidal 500 mg IV
every 8 h
7-8
4) 예방적 항생제의 선택
적절한 예방적 항생제를 선택하기 위해서는 수술 부위와 항생제의 특성을 고려해야 한다. 예방적 항 생제가 갖추어야 할 특성은 항생제의 혈장과 조직 농도가 수술부위감염을 일으키는 특정세균에 대하 여 최소억제농도를 능가해야 하고, 수술 중 추가 투여없이 충분한 혈장 및 조직농도를 유지할 수 있 도록 긴 빈감기를 가져야 하며, 안전하고, 값이싸고 세균내성이 없어야 한다.
22개개의 항생제의 항균력 의 범위와 특성은 표 8에 요약되어 있다.
이상적인 예방적 항생제는 특정세균의 성장을 선택적으로 억제하고 살균작용을 나타내야 하며 환자에게 나타나는 부작용은 최소화 해야 한다.
비뇨기계에 사용하는 항생제는 cephalosporins, fluoroquinolones, aminoglycosides trimethoprim-sulfa- methoxazole (TMP-SMX), aminopenicillin+betalacta- mase inhibitor (BLI)가 효과적이고, 긴 반감기를 가
지며, 알레르기반응이 드물다 (Table 9). Fluoroqui- nolones과 aminoglycosides는 베타-락탐 알레르기가 있는 환자에서 사용할 수 있다. 그러나 페니실린 알레르기가 있는 환자에서 세팔로스포린은 부작용 의 발생빈도가 낮지만, 심한 페니실린 알레르기가 있는 경우는 다른 항생제로 대체하는 것이 좋다.
32예방적 항생제의 적절한 용량에 대한 연구는 제 한적이지만 정확한 용량을 투여하는 것은 투여시 간 못지않게 중요하다 (Table 10). 항생제는 적절한 혈장과 조직농도를 유지하기 위하여 환자의 체중 이나 체질량지수에 맞추어 적정용량을 투여해야 하며 cephalosporins와 같은 가장 흔히 사용하는 항 생제는 75kg 이상의 체중을 갖는 환자는 용량조정 을 해야 한다. 수술시간이 초기항생제의 반감기의 2배를 초과할 때는 추가항생제를 투여한다.
6많은 항생제가 기대되는 세균에 효과적이지만 예
방적 항생제는 임상시험에 근거하여 사용해야 한
다. 또한 예방적 항생제를 선택할 때는 임상의사는
Table 9. Recommended antimicrobial agents for urologic procedure
Procedure Choice of Antibiotics Duration of regimens
AUA guideline EAU guideline AUA EAU
Diagnostic Procedure Cystoscopy
Urodynamic study
• Fluoroquinolone
• TMP-SMX
• 2nd G cephalosporin
• TMP-SMX
Transrectal prostate biopsy • Fluoroquinolone
• 2nd / 3rd G cephalosporin
• Fluoroquinolone
• TMP-SMX
• Metronidazole
≤ 24hrs ≤ 72hrs
Endourological surgery and ESWL
ESWL • Fluoroquinolone
• TMP-SMX
• 2nd / 3rd G cephalosporin
• TMP-SMX
• Aminopenicillin + BLI
≤ 24hrs (-)
Ureteroscopy for urinary stone
• Fluoroquinolone
• TMP-SMX
• 2nd / 3rd G cephalosporin
• TMP-SMX
• Aminopenicillin + BLI
• Fluoroquinolon
≤ 24hrs Short course
Percutaneous nephrolithotomy
• 1nd / 2rd G cephalosporin
• Aminoglycoside
• Metronidazole or clindamyicn
• 2nd / 3rd G cephalosporin
• TMP-SMX
• Aminopenicillin + BLI
• Fluoroquinolone
≤ 24hrs Short course
TUR-P TUR-BT
• Fluoroquinolone
• TMP-SMX
• 2nd / 3rd G cephalosporin
• TMP-SMX
• Aminopenicillin + BLI
≤ 24hrs
Open or Laparoscopic surgery Operation without opening
of urinary tract • 1st cephalosporin (-) Single dose
Operation with opening of urinary tract
• 1st / 2rd G cephalosporin
• Aminoglycoside + Metronidazole or clindamycin
• 2nd / 3rd G cephalosporin
• TMP-SMX
• Aminopenicillin + BLI
≤ 24hr Single dose
Operation with use of bowel segment
• 2nd / 3rd G cephalosporin
• Aminoglycoside + Metronidazole
• 2nd / 3rd G cephalosporin
• Metronidazole ≤ 24hrs
Implant of prosthetic devices•Aminoglycoside + 1nd / 2rd G Cephalosporin or Vancomycin
• 2nd / 3rd G cephalosporin
• Penicillin (penicillase stable) ≤ 24hrs AUA: American Urologic Association, EAU: European Association of Urology, G: Generatoin,
BLI: β-lactamase inhibitor
ESWL: extracoporeal shock wave lithotripsy, TMP-SMX: trimethoprim-sulfamethoxazole, TUR-P: transurethral resection of prostate, TUR-BT: transurethral resection of bladder tumor
지역사회의 다양한 항생제내성의 양상을 알고 있어 야 한다. 특히 퀴놀론계 항생제가 많이 사용되고 있는 지역에서는 퀴놀론내성을 고려해야 한다.
425) 비뇨기계 특정수술이나 술기에서의 예방적
항생제의 사용지침
지금까지 발표된 예방적 항생제의 임상지침은
주로 일반외과의 개복수술을 대상으로 작성되었으
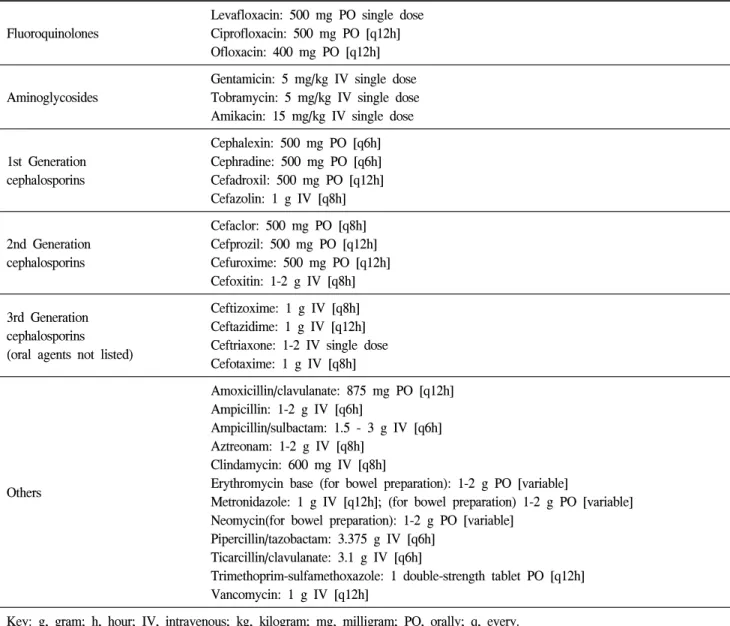
Table 10. Antimicrobial agents and doses for periprocedure use Fluoroquinolones
Levafloxacin: 500 mg PO single dose Ciprofloxacin: 500 mg PO [q12h]
Ofloxacin: 400 mg PO [q12h]
Aminoglycosides
Gentamicin: 5 mg/kg IV single dose Tobramycin: 5 mg/kg IV single dose Amikacin: 15 mg/kg IV single dose
1st Generation cephalosporins
Cephalexin: 500 mg PO [q6h]
Cephradine: 500 mg PO [q6h]
Cefadroxil: 500 mg PO [q12h]
Cefazolin: 1 g IV [q8h]
2nd Generation cephalosporins
Cefaclor: 500 mg PO [q8h]
Cefprozil: 500 mg PO [q12h]
Cefuroxime: 500 mg PO [q12h]
Cefoxitin: 1-2 g IV [q8h]
3rd Generation cephalosporins (oral agents not listed)
Ceftizoxime: 1 g IV [q8h]
Ceftazidime: 1 g IV [q12h]
Ceftriaxone: 1-2 IV single dose Cefotaxime: 1 g IV [q8h]
Others
Amoxicillin/clavulanate: 875 mg PO [q12h]
Ampicillin: 1-2 g IV [q6h]
Ampicillin/sulbactam: 1.5 - 3 g IV [q6h]
Aztreonam: 1-2 g IV [q8h]
Clindamycin: 600 mg IV [q8h]
Erythromycin base (for bowel preparation): 1-2 g PO [variable]
Metronidazole: 1 g IV [q12h]; (for bowel preparation) 1-2 g PO [variable]
Neomycin(for bowel preparation): 1-2 g PO [variable]
Pipercillin/tazobactam: 3.375 g IV [q6h]
Ticarcillin/clavulanate: 3.1 g IV [q6h]
Trimethoprim-sulfamethoxazole: 1 double-strength tablet PO [q12h]
Vancomycin: 1 g IV [q12h]
Key: g, gram; h, hour; IV, intravenous; kg, kilogram; mg, milligram; PO, orally; q, every.
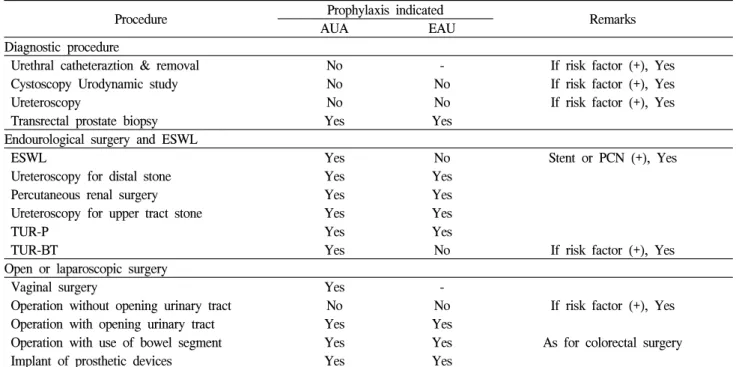
며 비뇨기수술에 대한 예방적 항생제의 전향적인 임상연구는 매우 제한적이고 드물어 비뇨기수술의 특성에 맞는 예방적 항생제사용에 대한 임상지침 의 제정이 요원한 실정이다. 저자는 미국비뇨기과 학회와 유럽비뇨기과학회에서 발표한 비뇨기수술 의 예방적 항생제에 대한 임상지침을 비교 분석하 고자 한다 (Table 11).
1. 진단적 수술이나 술기
외재용 요로카테터를 제거할 때 균주가 배양되
지 않는다면 항생제투여가 반드시 필요한 것은 아
니다. 간헐적 도뇨를 시행하거나
43요도카테터를
장기간 유치하고 있는 환자는
44예방적 항생제를
투여할 필요가 없다. 비감염성 요로계 질환이 세
균뇨가 있을 때 균혈증을 발생할 수 있는 위험요
인이 된다면 비뇨기계 수술 후 카테터 제거시 항
Table 11. Recommended antimicrobial prophylaxis for urologic procedure
Procedure Prophylaxis indicated
Remarks
AUA EAU
Diagnostic procedure
Urethral catheteraztion & removal No - If risk factor (+), Yes
Cystoscopy Urodynamic study No No If risk factor (+), Yes
Ureteroscopy No No If risk factor (+), Yes
Transrectal prostate biopsy Yes Yes
Endourological surgery and ESWL
ESWL Yes No Stent or PCN (+), Yes
Ureteroscopy for distal stone Yes Yes
Percutaneous renal surgery Yes Yes
Ureteroscopy for upper tract stone Yes Yes
TUR-P Yes Yes
TUR-BT Yes No If risk factor (+), Yes
Open or laparoscopic surgery
Vaginal surgery Yes -
Operation without opening urinary tract No No If risk factor (+), Yes
Operation with opening urinary tract Yes Yes
Operation with use of bowel segment Yes Yes As for colorectal surgery
Implant of prosthetic devices Yes Yes
ESWL: extracoporeal shock wave lithotripsy, TUR-P: transurethral resection of prostate, TUR-BT: transurethral resection of bladder tumor
AUA: American Urological Association, EAU: European Association of Urology
생제를 투여하는 것이 좋다.
45카테터 제거시 예방적 항생제는 위험요인이 있 는 환자에게 투여하며 TMP-SMX나 fluoroquinolone 같은 경구용 항생제를 투여한다. 세균뇨가 있을 때는 항생제 감수성검사 후 투여하고 배양검사에 서 균주가 자라지 않을 때는 투여하지 않는다.
32방광조영술, 요역동학검사, 단순방광요도경검사 와 같은 진단적 시술을 시행할 때는 소변배양검사 에서 균주가 자라지 않는다면 항생제투여는 반드 시 필요한 것은 아니다. 항생제는 위험요인이 있 는 환자에게 투여한다.
경직장전립샘생검을 시행할 때는 모든 환자에게 예방적 항생제를 투여한다. 예방적 항생제 사용은 의의있게 합병증과 세균뇨 발생을 감소시키며 1회 투여나 1일 투여가 3일 투여와 비슷한 효과를 나 타낸다.
46,472. 내비뇨기 수술과 체외충격파쇄석술
미국비뇨기과학회에서는 체외충격파쇄석술을 시 행 받는 모든 환자에게 예방적항생제 사용을 권유 하고 있다. 예방적항생제 사용은 술 후 세균뇨의 발생을 의의있게 감소시킨다.
48그러나 유럽비뇨기과학회에서는 표준적인 예방 적 항생제의 투여를 권고하지 않지만, 요관스텐트, 도뇨관 또는 신루관을 유치하고 있거나 감염석을 치료할 때와 같이 위험인자가 있을 때 예방적 항 생제를 투여하라고 하였다.
48요관경검사를 시행할 때는 모든 환자에게 예방
적 항생제를 투여한다. 요관경을 이용한 제석술을
시행한 환자에게 예방적 항생제투여는 술 후 세균
뇨를 의의 있게 감소시킨다.
49예방적 항생제를 투
여하지 않고 요관경검사를 시행하였을 때 세균뇨
가 발생할 기대치는 30%를 능가한다.
8그러나 유
럽비뇨기과학회에서는 요관경검사 후 발생하는 감
염의 위험도를 규정하는 임상시험이 거의 없고 명 백한 근거가 없지만, 단순 진단검사나 하부요관결 석의 치료 같은 저위험 술기와 상부요관결석, 매 몰결석 및 신내수술같은 고위험 술기를 구분하여 항생제를 투여하는 것이 논리적이며,
8다른 위험인 자 (결석크기, 길이, 출혈 및 술자의 경험)도 고려 하는 것이 필요하다고 하였다.
50경피적 신절석술을 시행하는 모든 환자에게 예
방적 항생제를 투여한다. 경피적 신절석술에 대한 예방적 항생제의 투여를 주장하는 잘 설계된 임상 연구는 없지만 예방적 항생제의 사용은 술 후 감 염을 의미 있게 감소시킬 수 있다. 술 전 세균뇨 가 없는 환자에게 예방적 항생제를 투여하지 않고 경피적 신절석술을 시행하였을 때, 35%에서 술 후 요로감염이 발생하였다.
51그러나 경피적 신절석술 전 ciprofloxacin을 정주한 군과 투여하지 않은 군 을 전향적 무작위 비교하였을 때 술 후 요로감염 의 발생률은 각각 0%와 40% 였다.
52경요도전립샘절제술을 시행받는 모든 환자에게 예방적 항생제를 투여한다. 32개의 전향적 무작위 연구에 대한 메타분석에 의하면 예방적 항생제를 투여 받은 환자를 대상으로 술 후 2∼5일째에 시 행한 소변배양검사에서 세균뇨는 26%에서 9%로 감소하였고 폐혈증은 4.4%에서 0.7%로 감소하였 다.
53임상적 효과가 입증된 항생제는 fluoroquino- lones, cephalosporins, aminoglycosides와 trimethoprim- sulfamethoxazole (TMP-SMX)이다.
방광조직검사, 요관카테터삽입술, 레이저전립샘 절제술과 같은 시술은 경요도전립샘절제술같은 잘 설계된 임상연구가 없지만 수술침습도나 조직손상 정도가 유사하기 때문에 경요도전립샘절제술에 준 하여 예방적 항생제를 투여한다.
경요도방광종양절제술을 시행하는 환자에게 예 방적 항생제를 투여하면 술 후 세균뇨의 발생을 의의 있게 감소시킨다.
54그러나 유럽비뇨기과학회 에서는 경요도방광종양절제술을 시행하는 환자에 게 예방적 항생제는 절제시간이 긴 큰 종양, 큰 괴사된 종양 및 위험인자가 있는 환자에게 투여하 라고 하였다.
3. 복강경수술
비뇨기복강경수술에서 예방적 항생제사용에 대 한 잘 설계된 무작위 임상연구가 부족하다. 그러 나 상응하는 개복수술에 준하여 복강경수술을 받 은 환자에게 예방적 항생제를 투여하는 것이 합리 적일 것으로 여겨진다.
4. 개복수술
질수술을 받는 모든 환자에게 예방적 항생제를
투여한다. 질을 통한 비뇨기수술에 대한 전향적 무작위 임상연구가 보고되지 않았지만, 비뇨기질 수술은 질식자궁절제술에 준하여 예방적 항생제사 용을 고려해 볼 수 있다. 질식자궁절제술에 대한 예방적 항생제의 메타분석에 의하면, 예방적 항생 제 투여는 예외없이 복강내 감염을 극적으로 감소 시키며
55항생제를 24시간 이내 투여군과 장기간 투여군 사이에 비슷한 효과를 나타냈다.
56수술상처분류에 따른 예방적 항생제의 적응증은 청결-오염상처와 오염상처이다. 반면에 불결-감염 상처는 치료용량의 항생제를 투여한다.
비뇨기계를 절개하지 않는 개복수술이나 복강경 수술은 위험요인이 있을 때 예방적 항생제를 투여 한다. 이 범주의 수술은 경복막수술, 후복막수술, 피부수술과 생식기수술이 해당된다. 그러나 비뇨 기계수술에 대한 자료가 제한되어 있기 때문에 비 뇨기계 이외의 청결한 복부수술에서 사용하는 예 방적 항생제의 사용지침을 권고한다.
비뇨기계를 절개하는 개복수술이나 복강경수술
은 모든 환자에게 예방적 항생제를 투여한다. 비 뇨기계를 절개하는 모든 수술은 청결-오염상처로 간주하며, 예방적 항생제투여시 술 후 요로감염을 감소시킨다. 비뇨기계를 절개하는 수술은 예방적 항생제를 투여하지 않을 때 열성요로감염의 예상 률이 5∼10%였으나 항생제를 투여할 때는 2∼3%
로 감소하였다.
8개복전립선절제술을 시행한 환자
들 중에서 항생제를 투여하지 않은 군과 비교시,
항생제투여군에서 의의 있게 술 후 감염이 46%에
서 5%로 감소하였다.
57유럽비뇨기과학회에서는 비 뇨기계를 절개하는 수술은 항생제투여는 1회의 정 맥용 주사요법이 추천된다.
장을 사용하는 개복수술이나 복강경수술은 모든 환자에게 예방적 항생제를 투여한다.
장분절을 사용하는 비뇨기수술에 대한 예방적 항생제투여의 효용성에 대한 전향적연구는 보고가 없지만 경피적내시경적위루조설술, 충수돌기절제 술과 대장직장수술에 대한 메타분석에 의하면
58-60장을 사용하는 수술에 예방적 항생제투여가 효과 가 있다고 확인하였다. 예방적 항생제는 1회나 1 일요법이 추천되나 수술시간이 길거나 위험인자가 있을 때는 72시간 이내 까지 사용한다. 대장직장 수술에 준하여 호기성세균과 혐기성세균에 모두 효과가 있는 항생제를 투여한다.
보형물삽입술을 시행하는 개복수술이나 복강경 수술은 모든 환자에게 예방적 항생제를 투여한다.
이물질을 삽입하는 것은 심각한 감염성 합병증을 일으킬 수 있다. 당뇨가 감염을 일으키는 특별한 위험인자이며, 주로 포도구균이 오염균이다. Mesh 를 이용한 탈장수술과 정형외과수술에 대한 메타 분석에 의하면
61,62예방적 항생제가 보형물삽입술 에 효과적이라고 한다. 많은 비뇨기과의사들은 음 경보형물삽입술 후에 항생제를 오랫동안 사용해 왔으나 정형외과적 연구에 의하면 예방적 항생제 의 투여기간은 24시간 이내가 적절하다고 하였다.
6결 론
수술창감염과 요로감염은 비뇨기수술 후 발생하 는 주된 합병증이다. 예방적 항생제를 투여하는 것은 중요한 예방수단이 된다. 비뇨기계수술에서 예방적 항생제의 목적은 진단이나 치료목적의 시 술로 인한 감염성 합병증을 예방하는데 있다. 비 뇨기수술에 대한 최적의 예방적 항생제 투여를 연 구하는 전향적 임상연구들이 제한적이고 비뇨기수 술은 기본적으로 일반외과 수술의 기본원칙을 따 르기 때문에 예방적 항생제 사용도 외과수술에 준 용하는 것이 합리적일 것으로 생각한다. 청결상처 는 보형물 삽입술 외에는 일반적으로 예방적 항생
제를 사용하지 않는다. 청결-오염상처는 예방적 항 생제를 투여해야 한다. 오염상처와 불결-감염상처 는 치료적 목적으로 항생제를 투여한다.
예방적 항생제는 특정세균에 살균작용을 나타내 고 안전하고 값이 싸며, 항생제내성이 없어야 한 다. 예방적 항생제의 초회투여는 피부절개 전 60 분 이내에 투여하며 수술시간이 초회 항생제투여 후 2배의 반감기를 넘을 때는 술 중에 항생제를 추가 투여해야한다. 예방적 항생제는 피부봉합 후 24시간 이내에 중단해야 한다. 항생제의 초회용량 은 환자의 체중이나 체질량지수에 의거하여 적정 한 양을 투여한다.
그러나 비뇨기수술에서 예방적 항생제의 적응증 을 정하고 항생제의 선택과 용량을 결정하는 것은 여러 가지의 임상지침에 의거하여 시행할 수 있지 만 개개인에게 항생제를 적절히 사용하기위해서는 임상지침뿐 아니라 환자의 위험요인을 종합적으로 평가하여 결정해야 한다.
REFERENCES
1. Sakong PY, Lee JS, Lee EJ, Ko KP, Kim CH, Kim Y, et al. Association between the pattern of prophy- lactic antibiotic use and surgical site infection rate for major surgeries in Korea. J Prev Med Public Health 2009;42(1):12-20
2. Barie PS. Surgical site infections: epidemiology and prevention. Surg Infect 2002;3(Suppl 1):S9-21
3. Oliveira AC, Carvalho DV. Postdischarge surveillance:
the impact on surgical site infection incidence in a Brazilian university hospital. Am J Infect Control 2004;32(6):358-61
4. Bratzler DW, Houck PM, Richards C, Steele L, Dellinger EP, Fry DE, et al. Use of antimicrobial pro- phylaxis for major surgery: baseline results from the National Surgical Infection prevention project. Arch Surg 2005;140:174-82
5. Fry DE. The surgical infection preventon project: proc- ess, outcome, and future impact. Surg Infect 2006;
7(Suppl 3):S17-26
6. Bratzler DW, Houck PM, Surgical Infection Preventive Guideline Writers Workgroup: antimicrobial prophy-
laxis for surgery: an advisory statement from the Nation Surgical Infection Prevention project. Am J Surg 2005;189:395-404
7. Kirkland KB, Briggs JP, Trivette SL, Wikinson WE, Sexton DJ. The impact of surgical site infections in the 1990s: attributable mortality, excess length of hos- pitalization, and extra costs. Infect Control Hosp Epidemiol 1999;20:725-30
8. Grabe M. Controversies in antimicrobial prophylaxis in urology. Int J Antimicrob Agents 2004;23:S17-23 9. Mangram AJ, Horan TC, Pearson ML, Silver LC,
Jarvis WR. Guideline for prevention of surgical site infection.1999. The Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidermiol 1999;20:250-78
10. Grabe M. Perioperative antibiotic prophylaxis in urology.
Curr Opin Urol 2001:11:81-5
11. Cruse PJE, Foord R. The epidemiology of wound in- fection: a 10-year prospective study of 62,939 wounds.
Surg Clin North Am 1980;60:27-4
12. Matsumoto T, Kiyota H, Matsukawa M, et al. Japa- nese guidelines for prevention of perioperative in- fections in urological field. Int J Urol 2007;14:890-909 13. Altemeier WA, Culbertson WR, Hummel RP. Surgical
considerations of endogenous infections-sources, types, and methods of control. Surg Clin North Am 1968;48:
227-40
14. Wiley AM, Ha'eri GB. Routes of infection; a study of using "tracer particles" in the orthopedic operating room. Clin Orthop 1979:139;150-5
15. Carlsson AK, Lidgren L, linberg L. Prophylactic anti- biotics against early and late deep infections after total hip replacements. Acta Orthop Scand 1977;48:405-10 16. Stuesse DC, Robinson Jh, Durzinsky DS. A late ster-
nal wound infection caused by hematogenous spread of bacteria. Chest 1995;108(6):1742-3
17. Edwards LD. The epidemiology of 2056 remote site in- fections and 1966 surgical wound infections occurring in 1865 patients; a four year study of 40.923 oper- ations at Rush-Presbyterian-St.Luke's Hospital, Chicago.
Ann Surg 1976;184:758-66
18. Valentine RJ. Weigelt JA, Dryer D, Rodgers C. Effect of remote infections on clean wound infection rates.
Am J Infect Control 1986;14:64-7
19. Dineen P, Drusin L. Epidemics of postoperative wound infections associated with hair carriers. Lancet 1973;
2(7839):1157-9
20. Mastro TD, Farley TA, Elliott JA, Facklam RR, Perks JR. Hadler JL, et al. An outbreak of surgical-wound infections due to group a streptococcus carried on the scalp. N Engl J Med 1990;323:968-72
21. Letts RM, doermer E. Conversation in the operating theater as a cause of airborne bacterial contamination.
J Bone Joint Surg 1983;65:357-62
22. Giamarellou H, Antoniadou A. Epidemiology, diag- nosis, and therapy of fungal infections in surgery.
Infect Control Hosp Epidemiol 1996;17(8):558-64 23. Ehrenkranz NJ. Antimicrobial prophylaxis in surgery:
mechanisms, microconceptions, and mischief. Infect Control Hosp Epidemiol 1993;14(2):99-106
24. Nicholas RL. Surgical antibiotic prophylaxis. Med Clin North Am 1995;79(3):509-22
25. Scher KS. Studies on the duration of antibiotic admin- istration for surgical prophylaxis. Am Surg 1997;63(1):
59-62
26. McDonald M, Grabsch E, Marshall C, Forbes A.
Single-versus multiple dose antimicrobial prophylaxis for major surgery: a systematic review. Aust NZ J Surg 1998;68:388-96
27. Miles AA, Miles EM, Burke J. The value and duration of defense reactions of the skin to the primary lodge- ment of bacteria. Br J Exp Pathol 1957;38:79-96 28. Burke JF. The effective period of preventive antibiotic
action in experimental incisions and dermal lesions.
Surgery 1961;50:161-8
29. Polk HC, Lopez-Mayor JF. Postoperative wound in- fection: a prospective study of determinant factors and prevention. Surgery 1969;66:97-103
30. Stone HH, Hooper CA, Kolb LD, et al. Antibiotic pro- phylaxis in gastric, biliary, and colonic surgery. Ann Surg 1976;184:443-52
31. Classen DC, Evans RS, Pestotnik SL, Horn SD, Menlove RL, Burke JP. Timing of prophylactic admin- istration of antibiotics and risk of surgical wound infection. N Engl J Med 1992;326(5):281-6
32. Wolf JS Jr., Bennett CJ, Dmochowski RR, Hollenbeck BK, Pearle MS, Schaeffer AJ. Best practice policy statement on urologic surgery antimicrobial prophylaxis.
J Urol 2008;179:1379-90
33. Mandell GL, douglas RG, Bennett JE & Dolin R, Mandell, Douglas, and Bennett's principles and practice of infectious diseases. 6th edn. New York: Elsevier/
Churchill Livingstone, 2005
34. Morita S, Nishisho I, Nomura T, Fukushima Y, Morimoto T, Hiraoka N, et al. The significance of the intraoperative repeated dosing of antimicrobials for preventing surgical wound infection in colorectal surgery. Surgery Today 2005:35(9):732-8
35. Zanetti G, giardina R & Platt R. Intraoperative redos- ing of cefazolin and risk for surgical site infection in cardiac surgery. Emerging Infectious Diseases 2001 Sep-Oct;7(5):828-31
36. Ohge H, Takesure Y, Yokoyama T, Murakami Y, Hiyama E, Yokoyama Y, et al. An additional dose of cefazolin for intraoperative prophylaxis. Surgery Today 1999:29(12):1233-6
37. Swoboda S, Oberdorfer K, Klee F, Hoppe-Tichy T, von Baum H, Geiss HK. Tissue and serum concen- trations of levofloxacin 500 mg administered intra- venously or orally for antibiotic prophylaxis in biliary surgery. Journal of Antimicrobial chemotherapy 2003;
51(2):459-62
38. Dellinger EP, Gross PA, Barret TL, Krause PJ, Martone WJ, McGowan JE Jr, et al. Quality standard for antimicrobial prophylaxis in surgical procedures.
Infectious Diseases Society of america. Clin Infect Dis 1994;18:422-7
39. American Society of Health-system Pharmacists. ASHP therapeutic guidelines on antimicrobial prophylaxis in surgery. Am J Health Syst Pharm 1999;56:1839-88 40. Hecker MT, Aron DC, Patel NP, Lehmann MK,
Donskey CJ. Unnecessary use of antimicrobials in hos- pitalized patients: current patterns of misuse with an emphasis on the antianaerobic spectrum of activity.
Arch Intern Med 2003; 163:972-8
41. Nelson CL, Green TB, Porter RA, Warren RD. One day versus seven days of preventive antibiotic therapy in orthopedic surgery. Clin Orthop Relat Res 1983;176:
258-63
42. Andriole VT. The quinolones: past, present, and future.
Clin Infect Dis 2005;41:S113-9
43. Clarke SA, Samuel M, Boddy SA. Are prophylatic an-
timicorbials necessary with clean intermittent catheriza- tion? A randomized controlled trial. J Pediatr Surg 2005;40:568-71
44. Niel-Weise BS, van den Broek PJ. Urinary catherter polices for long-term bladder drainage. Cochrane Database Syst Rev 2005;(1):CD004201
45. Jerkeman M, Braconier JH. Bacteremic and non-bac- teremic febrile urinary tract infection - a review of 168 hospital-treated patients. Infection 1992;20:143-5 46. Aron M, Rajeev TP, Gupta NP. Antibiotic prophylaxis
for transrectal needle biopsy of the prostate: a random- ized controlled study. BJU Int 2000;85:682-5
47. Sabbagh R, McCormack M, Peloquin F, Faucher R, Perreault JP, Perrottte P, et al. A prospective random- ized trial of 1-day versus 3-day antibiotic prophylaxis for transrectal ultrasound guided prostate biopsy. Can J Urol 2004;11(2):2216-19
48. Pearle MS, Roehrborn CG. Antimicrobial prophylaxis prior to shock wave lihotripy in patients with sterile urine before treatment: a meta-analysis and cost-effec- tiveness analysis. Urology 1997;49:679-86
49. Knopf H-J, Graff HJ, Schulze H. Perioperative anti- microbial prophylaxis in ureteroscopic stone removal.
Eur Urol 2003;44:115-8
50. Hendrikx AJ, Strijbos WE, de Knijff DW, Kumms J Jr, Doesburg WH, Lemmens WA. Treatment for ex- tended-mid and distal ureteral stones: SWL or uretero- scopy? Results of a multicenter study. J Endourol 1999;13(10):727-33
51. Charton M, Vallancien G, Veillon B, Brisset JM.
Urinary tract infection in percutaneous surgery for re- nal calculi. J Urol 1986;135:15-7
52. Darenkov AF, Derevianko II, Martov AG, Kondrat'eva EM, Siniukhin VN. The prevention of infectious-in- flammatory complications in the postoperative period in percutaneous surgical interventions in patients with urolithiasis. Urol Nefrol 1994;2:24-6
53. Berry A, Barratt A. prophylactic antimicrobial use in transurethral prostatic resection: a meta-analysis. J Urol 2002;167:571-7
54. MacDermott JP, Ewing RE, Somerville JF, Gray BK.
Cephradine prophylaxis in transurethral procedures for carcinoma of the bladder. Br J Urol 1988;62:136-9 55. Duff P, park RC. Antimicrobial prophylaxis in vaginal
hysterectomy: a review. Obstet Gynecol 1980;55:
193S-202S
56. Chang WC, Hung YC, Li TC, Chen HY, Lin CC.
Short course of prophylatic antimicrobials in lapa- roscopically assisted vaginal hysterectomy. J Reprod Med 2005;50:524-8
57. Prokocimer P, Quazza M, Giber, C, Lemoine JE, Joly ML, Dureuil B, et al. Short-term prophylactic anti- microbials in patients undergoing prostatectomy: report of a double-blind randomized trial with 2 intravenous doses of cefotaxime. J Urol 1986;135:60-4
58. Lipp A, Lusardi G. Systemic antimicrobial prophylaxis for percutaneous endoscopic gastrostomy. Cochrane Database Syst Rev 2006;(4):CD005571
59. Andersen BR, Kallehave FL, Andersen HK. Antimi- crobials versus placebo for prevention of postoperative infection after appendicectomy. Cochrane Database Syst Rev 2005;(3):CD001439
60. Song F, Glenny AM. Antimicrobial prophylaxis in col- orectal surgery: a systematic review of randomized controlled trials. Br J Surg 1998;85:1232-41
61. Sanabria, A, Dominguez LC, Valdivieso E, Gomez G.
Prophylactic antimicrobials for mesh inguinal hernio- plasty: a meta-analysis. Ann Surg 2007;245:392-6 62. Southwell-Keely JP, Russo RR, Macrh L, Cumming R,
Cameron I, Brnabic AJ. Antimicrobial prophylaxis in hip fracture surgery: a metaanalysis. Clin Orthop Relat Res 2004;(419):179-84