저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
이학 석사학위 논문
나노섬유 지지체를 이용한
3 차원 공배양 환경에서 암세포에 의한
내피세포의 성장 조절 기전에 대한 연구
Three-dimensional growth of endothelial cells
by cancer cells in the co-culture system
using nanofibrous scaffold
아 주 대 학 교 대 학 원
의생명과학과
나노섬유 지지체를 이용한
3 차원 공배양 환경에서 암세포에 의한
내피세포의 성장 조절 기전에 대한 연구
지도교수 곽 종 영
이 논문을 이학 석사학위 논문으로 제출함.
2020년 8월
아주대학교 대학원
의생명과학과
오 예 슬
i
요약
혈관신생은 기존 혈관으로부터 새로운 혈관의 생성을 통해 암으로의 성장을 제공할 수 있게 하는 메커니즘으로, 종양의 국소 성장과 전이에 중요한 요소이다. 이 연구는 내피세포의 성장에 암세포가 미치는 영향을 조사하기 위해 3차원 2층(Two-layer) 공배양 시스템을 개발하는 것을 목표로 하였다. Poly ε-caprolactone (PCL) 나노섬유 막은 전기방사 (electrospinning)를 통해 chloroform (C-PCL-M)과 chloroform 및 dimethylformamide (CD-PCL-M)을 용매로 하여 제작되었다. 상층에는 PCL-M 또는 CD-PCL-M을 부착하였고, 하층에는 C-PCL-M을 부착하였다. 상층에서는 내피세포, 하층에는 암세포를 배양하였으며 2개의 층을 조립하여 공동배양이 가능하도록 하였다. 혈관 내피 성장 인자(VEGF)가 없는 경우, 시간의 경과에 따른 bEnd.3 내피세포의 성장은 CD-PCL-M에서는 감소하였지만 C-PCL-M 에서는 감소하지 않았다. CD-PCL-M에서의 bEnd.3 세포의 성장은 CT26 암세포와의 공동 배양되었을 때 향상되었다. 이러한 bEnd.3 세포의 성장의 증가는 anti-VEGF 항체와 sorafenib을 처리하였을 때 차단되었다. 또한 공배양 환경에서 화학적 저산소 유도물질인 CoCl2을 첨가하였을 때, 암세포에서의 VEGF 및 HIF-1α의 발현이 증가하였으며 공배양 된 내피세포의 성장 또한 향상시켰다. 따라서 나노섬유 지지체에서의 내피세포의 성장은 나노섬유의 조성에 의존적이며, 이 공동배양 시스템은 암세포에 의한 내피세포의 성장을 분석하는 데 사용될 수 있다.ii
Keywords: 나노섬유(nanofiber), 전기방사(electrospinning), 3차원 세 포배양(3D cell culture), 내피세포(endothelial cell), 암세포(cancer cell)
iii
본문차례
요약 ... ⅰ
본문차례 ... ⅲ
그림차례 ... ⅴ
제 1 장 서론 ... 1
제 2 장 실험재료 및 방법 ... 5
2.1 실험 재료 ... 5 2.2 PCL 나노섬유의 전기방사 및 제조방법 ... 5 2.3 세포주 및 세포 배양 방법(bEnd.3, CT26) ... 6 2.4 PCL 나노섬유에서의 세포 배양 방법 ... 72.5 2층 공배양 시스템(Two-layer culture system) ... 7
2.6 세포 면역 화학 염색법(Immunocytochemistry) ... 8
2.7 공초점 레이저 현미경(Confocal laser microscopy) ... 8
2.8 주사전자현미경(Scanning electron microscopy, SEM) ... 9
2.9 세포 증식 분석(Cell proliferation assay) ... 9
2.10 효소 결합 면역 흡착 검사(Enzyme-linked immuno-sorbent assay, ELISA) ... 10
2.11 통계 분석(Statistical analysis)... 11
제 3 장 결과 및 토의... 12
3.1 CD-PCL-M 및 C-PCL-M의 형태 ... 12
iv 3.3 2층 공배양 시스템에서 암세포와 공배양 된 내피세포의 성장 ... 17 3.4 CD-PCL-M에서 공배양한 암세포에서 생산된 VEGF에 의한 bEnd.3 세포의 성장 ... 23 3.5 C-PCL-M에서 배양된 암세포에서 CoCl2의 효과에 따른 세포 성장과 HIF-1α 발현 및 VEGF 생성 ... 31 3.6 공배양 조건에서 내피세포의 성장에 대한 CoCl2의 영향 .. 35
제 4 장 결론 ... 41
참고문헌 ... 42
Abstract ... 47
v
그림차례
그림 1. CD-PCL-M 및 C-PCL-M에서 배양된 bEnd.3 내피세포의 성장 ... 14 그림 2. CD-PCL-M과 C-PCL-M에서 배양된 bEnd.3 내피세포의 성장 패턴 차이 ... 15 그림 3. CD-PCL-M 및 C-PCL-M에서 배양된 CT26 세포의 성장 18 그림 4. 2층 공배양 시스템의 실험 모식도 ... 20 그림 5. 2층 공배양 시스템에서 CT26 세포와 공배양 된 bEnd.3 세포의 성장 증가 ...21 그림 6. CD-PCL-M에서 배양된 bEnd.3 내피세포의 VEGF에 의한 성장 조절 ...25그림 7. Anti-VEGF antibody에 의한 공배양으로 유도된 bEnd.3 내피세포의 성장 억제 ...27 그림 8. Sorafenib에 의한 공배양으로 유도된 bEnd.3 내피세포의 성장 억제 ... 29 그림 9. 다양한 농도의 CoCl2를 처리한 C-PCL-M에서 배양된 CT26 세포의 증식 속도 ...33 그림 10. CoCl2를 고농도로 처리한 CT26 암세포의 증식 감소 ... 34 그림 11. 변형된 2층 공배양 시스템의 실험 조건 ... 37 그림 12. 공배양 환경에서 CoCl2에 의한 bEnd.3 세포의 성장 ... 38 그림 13. 공배양 환경에서 CoCl2 처리된 CT26 세포에 의한 bEnd.3 세포의 성장... 39
1
제 1 장 서론
혈관 신생(angiogenesis)은 기존 혈관으로부터 새로운 혈관의 생성이 암으로의 성장을 제공할 수 있게 하는 메커니즘으로, 효율적인 혈관 반응의 결과로 종양의 발달과 진행 및 전이가 나타난다[1]. 혈관 신생은 발아 및 분열 과정에 의해 혈관 구조(vasculature)의 성장을 계속한다[2]. 혈관 형성(Vasculogenesis)은 중배엽 세포 전구체로부터 내피세포의 배아 형성으로[3], 종양 혈관의 형성-혈관 신생에 의한 혈관 형성의 메커니즘은 돌연변이로 인해 종양 세포의 자발적인 분열에 의해 개시된다. 이어서 혈관 신생 자극제가 종양 세포에 의해 방출되고 이미 확립된 인근 혈관으로 이동하여 내피세포 수용체를 활성화시킨다. 이것은 혈관으로부터 단백질 분해 효소의 방출을 유도한다. 이 효소들은 혈관의 특정 지점을 목표로 하며 공극을 형성하는데, 이것이 새로운 혈관이 자라는 지점이다. 종양 세포는 약 50-100 개의 세포와 동등한 혈액 공급이 확립되어 있지 않으면 직경이 2-3 mm 이상 성장할 수 없기 때문에 혈액 공급을 필요로 한다[4]. 인접한 혈액 모세관에서 > 100-200 μm 거리에 위치한 종양은 종종 저산소 상태에 직면하게 된다. 이러한 저산소증은 종양 혈관 신생을 유도하는 주요 요인 중 하나로, 저산소증 하의 종양 세포에서 혈관 내피 성장 인자(VEGF)를 발현을 증가시킨다[5,6]. VEGF의 상향 조절은 운동에 대한 생리학적 반응의 결과로 나타나며, 혈관 형성에서의 역할은 혈관 손상에 대한 치료 가능성으로 알려져 있다[7-9]. In vitro 연구에서 VEGF가 혈관 형성의 강력한 자극제임을 명백하게 보여주었다. 이 성장 인자가 존재하는 경우, plate 내의 내피세포가 증식하고2
이동하여 모세관과 유사한 튜브 구조를 형성하기 때문이다[10]. 저산소증에 노출되면 저산소증 유도인자(hypoxia-inducible factor (HIF)-1α)에 의해 매개되는 전사 증가 및 mRNA의 3’region에 따른 VEGF mRNA 안정성의 증가로 인해 VEGF의 생산을 상향 조절한다[11, 12]. VEGF mRNA의 전사는 HIF-1에 의해 매개되어 trombospondin-1이나 angiostatin과 같은 항혈관 형성 인자의 하향 조절을 촉진한다[13]. 또한 VEGF의 분비는 호르몬(에스트로겐 및 프로게스테론) 및 EGF, TNF, IL-1, IL-6, PDGF 및 프로스타글란딘과 같은 사이토카인에 의해 촉진된다. In vitro 내의 세포에 CoCl2를
처리하였을 때, 저산소 상태에서 관찰된 것과 유사한 세포 변화가 나타나는 것으로 보고되어 있다[14]. 생리적 저산소증과 CoCl2
-induced 저산소증 사이에 차이는 있지만[1 5], CoCl2는 HIF-1α의 Von
Hippel-Lindau-결합 도메인을 점유함으로써 저산소증을 모방하여 HIF의 분해를 방지한다[16]. 조직에서의 내피세포와 종양 세포의 상호 작용은 3차원(3D) 조건 하에서 발생한다. 또한, VEGF 분비는 3D 환경과 산소 상태 모두에 의존한다[17]. 시험관 내에서 일반적인 2차원(2D) 세포 배양의 주요 단점은 두 가지 유형의 세포를 동시에 배양하지 못하는 것이다. 때문에 종양 조직에서 혈관 신생을 모방하는 여러 가지 3D 모델이 다양한 스캐폴드 및 시스템을 사용하여 개발되었으며[18], 내피세포와 종양 세포의 상호작용을 조사하는 대부분의 연구는 콜라겐 또는 다른 하이드로겔을 사용하여 수행되었다[19-21]. 그러나 3차원 환경에서 내피세포의 성장에 대한 종양 세포의 직접적인 영향을 확인할 수 있는 3D 공배양 시스템이 없었기 때문에, 그 동안 저산소 상태를 유발하는
3 화합물이 내피세포와 암세포의 성장에 미치는 영향에 초점을 둔 연구는 거의 없었다[22]. 암세포에 의한 혈관 신생 인자의 방출이 매우 낮고 반응성 내피세포의 증식 속도가 매우 높은 경우, 시험관 내 배양 시스템을 통해서는 암세포와 공동 배양된 내피세포 성장을 쉽게 확인할 수 없다. 또한, 2D 배양 시스템에서 화학적으로 유발된 저산소증은 세포의 생존력에도 영향을 미친다. 따라서, 암세포와의 공동 배양에서 내피세포의 성장률을 확인하고 세포 독성과 같은 한계를 극복하기 위해서는 3D 공동 배양이 필요하다. 나노 / 마이크로 섬유는 직경이 50-150 nm 인 콜라겐과 같은 세포 외 매트릭스(ECM)의 섬유 성분과 유사한 공간적 차원을 구현하여 세포를 배양하기 위해 개발되었다[23,24]. 전기 방사는 연속 섬유를 생산할 수 있는 나노섬유 제조 방법으로, poly (ε-caprolactone) (PCL), poly (D-lactide) 및 poly (vinyl alcohol)을 포함한 다양한 합성 중합체를 만들 수 있다[25]. 광범위한 섬유의 직경은 섬유 밀도, 평균 공극 직경 및 공극 분포의 차이를 초래하는데, 이렇게 다양한 나노섬유 지지체의 형태는 세포 부착 및 증식에 영향을 미친다[26,27]. 전기방사 PCL 나노섬유 막(PCL-M)은 다양한 유형의 세포에 대한 생체 적합성이 높기 때문에 다양한 유형의 세포의 성장, 증식 및 분화를 촉진하기 위한 지지체로 사용되어 왔다[28,29]. 내피세포의 증식과 기능을 향상시키기 위해 생체 적합성 및 생분해성을 가진 다양한 합성 중합체들을 이용하여 전기 방사된 나노섬유 막이 사용되었다[30]. 그러나, 나노섬유 지지체 상에서 내피세포의 특이적인 성장 및 세포의 형태는 조사되지 않았다. 또한, 암세포로부터 분비된 혈관 신생 인자에
4 대한 내피세포의 성장을 확인하기에 적합한 나노섬유 지지체가 시험되지 않았었다. 이 연구에서는 종양 중심 혈관 신생을 모방하는 것을 목표로 하였으며, 이를 위해 전기 방사된 PCL 나노섬유를 활용한 3D 공동 배양 시스템으로 2층 공배양 시스템(Two-layer system)을 구축하여 암세포와 공동 배양된 내피세포의 성장을 조사하였다. 또한, CoCl2를 이용한 저산소증 모방 조건을 이 시스템에 적용하여 암세포와 공동 배양된 저산소증-유도 내피세포 성장을 분석하였다.
5
제 2 장 실험재료 및 방법
2.1 실험 재료
PCL (Mn = 700,000-900,000), Chloroform (SAMCHUN),
Dimethylformamide (DMF), Dimethyl Sulfoxide, Phalloidin, 4′,6-diamidino-2-phenylindole dihydrochloride (DAPI), CoCl2 (Sigma),
DMEM High glucose (ATCC), Fetal Bovine Serum (FBS) (Merck), penicillin/streptomycin (Gibco), Trypsin-EDTA Solution (Welgene), ZO-1, Vimentin (Invitrogen), Anti-HIF-1α antibody (abcam), PDMS (Corning), Mouse recombinant VEGF164, Anti-VEGF antibody
(R&D system), Sorafenib (SANTA CRUZ)을 사용하였다.
2.2 PCL 나노섬유의 전기방사 및 제조방법
다공성 PCL 나노섬유는 이전에 보고된 방법에 따라 생성되었다 [26,35]. CD-PCL-M의 경우, 전기 방사용 중합체를 각각 99.5% pure chloroform:DMF (3:1, v/v), chloroform:DMF (1:1, v/v) 15%로 용해시키고 5 시간 동안 교반하여 균질한 용액을 수득하였다. C-PCL-M의 경우 전기 방사용 중합체를 99.5% pure chloroform에 15%로 용해시켰다. 나노섬유 막은 전기방사 (NanoNC, Seoul, Korea)를 통해 제조되었다. 준비된 용액을 2 개의 주사기에 담고 27G 노즐을 사용하여 대략 8 ㎕/min의 평균 유속과 약 17.5 kV의 전위로 전기방사 하였다.6
방사되는 나노섬유를 상온에서 4 시간 동안 100 rpm으로 회전 금속 맨드릴 상에 수집하였다. 노즐 팁과 컬렉터 사이의 거리는 20 cm로 설정하였다. 전기 방사된 섬유의 형태는 SEM4500 모델 (Sec, Suwon, Korea)과 함께 주사 전자 현미경(SEM)을 사용하여 관찰되었다. 섬유 직경 및 공극 크기는 ImageJ 소프트웨어 (ImageJ, National Institutes of Health, Bethesda, MD, USA)를 사용하여 SEM 이미지로부터 40 개를 랜덤으로 측정한 것의 평균을 구하여 측정하였다. 나노섬유의 두께는 고정밀 캘리퍼를 사용하여 측정하였다. 전기 방사로 제조된 나노섬유 막을 70% 에탄올에 침지시켜 12 시간 동안 UV 노출 하에 건조, 멸균하였다.
2.3 세포주 및 세포 배양 방법(bEnd.3, CT26 세포)
bEnd.3 Mouse Endothelial cells은 American Type Culture Collection (ATCC) (Manassas, VA, USA)에서 구입하였다. bEnd.3 세포는 Dulbecco’s Modified Eagle’s Medium (DMEM) (ATCC)에 10% FBS, 1% penicillin/streptomycin을 첨가한 배지에서 배양되었다. CT26 murine colon carcinoma cells은 Korean Cell Line Bank (Seoul, Korea)에서 얻었다. CT26 세포는 DMEM (Welgene, Seoul, Korea)에 10% FBS, 1% penicillin/streptomycin을 첨가한 배지에서 단층으로 배양되었다. bEnd.3 세포와 CT26 세포를 2-3일마다 한 번 계대 배양하였다. 모든 세포는 37 ℃의 온도와 5% CO2 농도의 환경이 조성된
7
2.4 PCL 나노섬유에서의 세포 배양 방법
PCL 나노섬유를 1 cm × 1.2 cm의 크기로 잘라 PDMS 용액을 얇게 바른 슬라이드 글라스 위에 부착하였다. 이 위에 8 well plate를 부착하고 DMEM에 6 시간 동안 37 ℃에서 침지시켜 세포 부착이 증가할 수 있도록 하였다. 내피세포 및 암세포를 30,000 cells/membrane으로 나노섬유 막에 분주하였다. 나노섬유 막에 분주된 내피세포 및 암세포는 10% FBS와 1% penicillin/streptomycin을 첨가한 DMEM 배지(500 ㎕)에서 최대 5 일 동안 배양되었다. 2D 배양 시스템의 경우, 8 well plate에서 동일한 절차로 수행하였다.2.5 2층 공배양 시스템(Two-layer culture system)
PCL 나노섬유에서 암세포와 내피세포를 공배양하여 이 세포들의 성장을 관찰하기 위해 transwell chamber을 이용한 2층 공배양 시스템을 만들었다(그림 4). 상단 chamber에 상부 층을 제작하기 위해 transwell insert의 polycarbonate 필터를 제거하고 CD-PCL-M 및 C-PCL-M을 5 mm 직경의 원형으로 잘라 PDMS로 부착하는 방법으로 교체하였다. 하부 층의 경우, PDMS 용액을 24 well plate에 넣어 적절히 굳힌 후 C-PCL-M을 겔 상태 PDMS의 표면 위에 부착시켰다. 하부 층 PDMS의 부피는 상부 막과 하부 막 간의 일정한 거리를 유지하기 위해 220 ㎕로 조정되었다. bEnd.3 세포를 위쪽 막에, CT26 세포는 아래쪽 막에 각각 30,000 개의 cells/well 로 분주하였다. 세포를 막에 부착시키기 위해 4 시간 동안 배양하였다. 이 후 2 개의 층을 조립하고,
8 세포를 10% FBS를 함유하는 DMEM에서 최대 5 일 동안 공동 배양하였다.
2.6 세포 면역 화학 염색법(Immunocytochemistry)
Culture plate 및 나노섬유에서 배양된 세포를 4% paraformaldehyde 로 실온에서 10 분 간 고정하였다. PBS로 5 분씩 3 번 세척하고 5% goat serum과 0.1% Triton X-100 이 포함된 PBS로 1 시간 동안 block 하였다. 1차 항체를 희석배수에 맞게 희석하여 4℃에서 18 시간 처리하였다. 1차 항체로는 anti-ZO-1 antibody (1:100 희석) (Invitrogen, CA, USA), anti-HIF-1α antibody (1:50 희석) (Abcam, Cambridge, UK), anti-Vimentin antibody (1:200 희석) (Invitrogen)을 사용하였다. 샘플을 PBS로 10 분씩 3 번 세척하고 2차 항체인 anti-rabbit AlexaFluor 594 antibody (1:200 희석) (Invitrogen)와 AlexaFluor 488-conjugated Phalloidin (1:400 희석) (Sigma)을 희석하여 상온에서 1 시간 동안 반응시켰다. PBS로 5 분 세척하고 DAPI (1:500 희석)를 10 분 간 반응시킨 후 mounting gel을 이용해 샘플을 봉입하였다.2.7 공초점 레이저 현미경(Confocal laser microscopy)
나노섬유에 부착한 형광이 표지된 세포를 K1 공초점 현미경 (Nanoscope, Korea)을 사용하여 관찰하였다. 이후 ImageJ 소프트웨어를 사용하여 이미지를 분석하였다.
9
2.8 주사 전자 현미경(Scanning Electron Microscope, SEM)
전기방사를 통해 제작된 PCL 나노섬유의 형태 및 나노섬유에 부착된 세포의 형태를 SEM을 이용해 관찰하였다. 배양된 세포를 PBS로 2 회 세척하고 3% 글루타르알데히드가 들어간 0.1 M 인산완충액으로 4 ℃에서 24 시간 동안 고정하였다. 그 후, 샘플을 0.1 M 인산완충액으로 3 번 세척 후 1% OsO4 (Sigma)가 들어간 0.1 M 인산완충액으로 1 시간 동안 2 차 고정하였다. 에탄올의 농도를 증가시키며(30%, 50%, 70%, 80%, 90%, 95% 및 100%) 탈수한 후 plate에서 나노섬유를 분리하였다. 모든 샘플은 양면 카본 테이프로 알루미늄 마운트에 부착하고 금 스퍼터로 코팅하였다. 금으로 코팅된 나노섬유와 나노섬유에 부착된 세포 형태는 SEM (SNE-4500M, Sec, Korea)을 사용하여 관찰되었다.
2.9 세포 증식 분석(Cell proliferation assay)
세포 증식 분석은 water-soluble tetrazolium salt-1 (WST1) assay의 원리를 이용하여 측정하였다. WST-1 assay는 수용성인 high sensitive water soluble tetrazolium salts가 세포 내에 존재하는 미토콘드리아 탈수소 효소와 반응하여 형성되는 오렌지색의 발색물질인 formazan을 이용해 측정하는 방법이다. WST과 반응하는 탈수소 효소는 대사적으로 왕성한 활동을 하는 세포의 미토콘드리아 전자전달계에 존재하는 효소로서, 살아있는 세포에만 유효하다. 세포의 성장은 cell
10
counting kit (Cell Counting kit-8 [CCK-8]; Dojindo Molecular Technologies, Gaithersburg, MD, USA)를 사용하여 측정하였다. 세포를 배양한 8 well plate, 또는 나노섬유를 부착한 8 well plate에서 상층액을 제거하고 세포 배양 배지 중 10% (v/v) CCK-8 solution을 포함한 용액을 well 당 300 ㎕ 첨가하였다. Transwell을 이용하여 two-layer 시스템에서 세포를 공동 배양한 경우, transwell insert 상부 층의 내피세포와 24 well 하부 층의 암세포를 분리하여 CCK 용액을 각각의 well에 첨가하였다. 5% CO2를 포함하는 배양기에서 37 ℃로 1
시간 동안 세포를 배양하였다. 1 시간 후 상층액을 수집하고 원심분리 하여 96 well plate로 옮겨주었다. Microplate reader Synergy H1 (Biotek, Seoul, Korea)을 사용하여 450 nm에서 흡광도를 측정하였다.
2.10
효소
결합
면역
흡착
검사(Enzyme-linked
immunosorbent assay, ELISA)
VEGF 분비량은 ELISA assay kit (R&D Systems, Minneapolis, MN, USA)를 사용하여 제조사의 프로토콜에 따라 분석하였다. Culture plate 및 나노섬유에서 CoCl2의 존재 또는 부재 하에 암세포를 배양하였다.
지시된 기간 동안 배양한 후, 상층액을 걷어 microplate reader Synergy H1을 사용하여 450 nm에서 흡광도를 측정하였다.
11
2.11 통계 분석(Statistical analysis)
결과는 평균 ± 표준 편차(SD) 값으로 표시하였다. 실험결과는 Student t-test로 검정하였으며, P-value 값이 <0.05 인 경우에만 통계적으로 유의하다고 간주하였다.
12
제 3 장 결과 및 토의
3.1 CD-PCL-M 및 C-PCL-M의 형태
전기방사를 통해 chloroform 과 chloroform 및 dimethyl-formamide를 용매로 한 PCL 나노섬유 막을 생성하였고 전기 방사된 섬유의 형태와 크기에 대한 용매의 효과를 조사하였다. CD-PCL-M 및 C-PCL-M 모두 평균 두께는 57.0 ± 10.2 μm (n = 15)였다. 나노섬유 막의 초미세 구조는 SEM을 통해 분석하였다. 두 막의 나노섬유는 무작위로 배향되었으며 구조적으로 콜라겐과 유사 하였다. 전기 방사된 나노섬유의 구조는 비드 형성없이 균일한 분포를 나타냈다. CD-PCL-M의 대부분의 섬유 직경은 500 nm와 1.5 μm (0.97 ± 0.35 μm) 인 반면 C-PCL-M의 섬유는 300 nm와 5 μm (3.86 ± 2.49 μm)의 직경으로 나타났다. CD-PCL 섬유는 C-PCL보다 좁은 섬유 직경 범위를 보였다. 나노섬유의 공극 크기는 ImageJ를 사용하여 분석하였고, CD-PCL-M은 C-PCL-M보다 다공성이 낮았다. 1:1 chloroform:DMF 혼합물에서, 섬유의 직경은 300 nm 내지 750 nm (470 ± 70 nm) 였다. 이러한 관찰 결과, C-PCL-M보다 CD-PCL-M에서 더 작은 공극을 형성하였고 균일한 섬유의 형태를 보였다.
13
3.2 CD-PCL-M 및 C-PCL-M에 분주된 내피세포의 성장
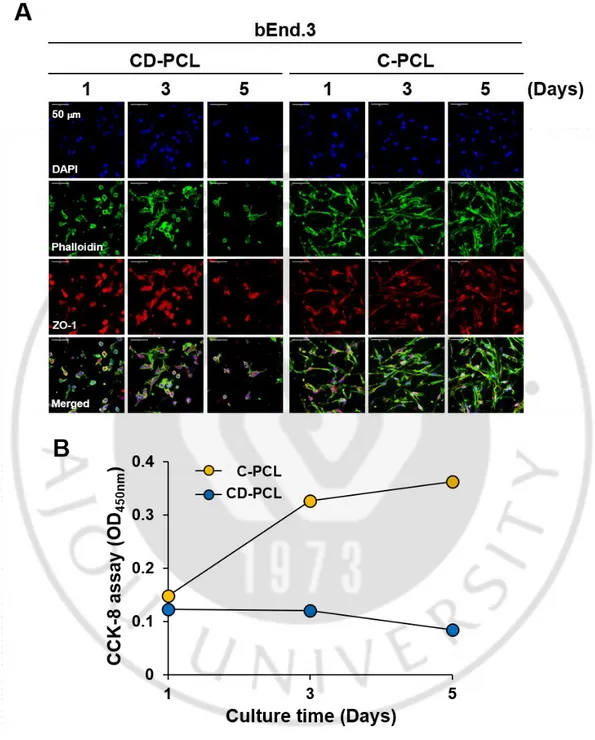
배양 배지에서 CD-PCL-M 및 C-PCL-M 상에서 내피세포를 배양한 후 나노섬유 지지체에서의 세포의 부착력과 확산을 평가하였다. 이 연구에서는 내피세포로 bEnd.3 mouse endothelial cell을 사용하였다. 내피세포를 막에서 1 일 동안 배양한 후 고정하여 SEM을 통해 관찰하였을 때, 나노섬유에서 1 일 동안 배양된 bEnd.3 세포가 나노섬유를 따라 잘 부착되고 퍼져서 섬유 표면에 뚜렷한 형태가 있음을 보여주었다(그림 1). 세포 부착력을 평가하였을 때 두 나노섬유 모두 bEnd.3 세포가 지지체에 전체적으로 고르게 분포하여 부착되었다 (그림 2A). CCK-8 분석 결과 CD-PCL-M에서의 단일 배양 시 bEnd.3 세포의 수는 1 일에서 5 일 동안 약간 감소한 것으로 나타났다 (그림 2B). CD-PCL-M과 비교하여, C-PCL-M에서 bEnd.3 세포의 성장은 안정적이었다. 녹색 및 적색 형광이 표지된 phalloidin 및 zona occludin (ZO)-1을 염색하여 bEnd.3 세포를 관찰하였을 때, 배양 후 5 일이 지나자 CD-PCL-M에서의 세포의 밀도가 현저히 감소하였다. 시간의 경과에 따라 bEnd.3 세포의 형태는 CD-PCL-M에서의 연장된 형태에서 구형으로 변화되었다. 대조적으로, C-PCL-M 상의 bEnd.3 세포는 5 일 간의 배양 후 둥근 형태보다 더욱 확장된 형태를 보였다. 이전의 연구에서도 이와 유사하게, CD-PCL-M에서 배양된 인간 관상 동맥 내피세포가 세포 배양 초기부터 구형 형태를 유지하고 시간이 경과하여도 퍼지지 않았다고 보고되었다[31]. 이러한 결과를 통해 나노섬유 막에서의 내피세포의 성장이 나노섬유의 조성, 구조 및 분포에 의존한다는 것을 시사할 수 있다.
14
그림 1. CD-PCL-M 및 C-PCL-M에서 배양된 bEnd.3 내피세포의 성장. bEnd.3 내피세포(3 × 104)를 CD-PCL-M 과 C-PCL-M에
분주하고 지시된 기간 동안 배양하였다(n = 4). SEM을 통해 분석한 나노섬유 막에서의 내피세포 부착 및 형태.
15
그림 2. CD-PCL-M 과 C-PCL-M 에서 배양된 bEnd.3 내피세포의 성장 패턴 차이. bEnd.3 내피세포 (3 × 104)를 CD-PCL-M 과
C-16
PCL-M 에 분주하고 지시된 기간 동안 배양하였다 (n = 4). (A) 면역 형광 염색 후 공초점 현미경을 통해 관찰한 세포의 성장 및 형태. DAPI(파란색), phalloidin(초록색), anti-ZO-1 antibody(빨간색). (B) CCK-8 assay 로 분석한 bEnd.3 세포의 증식 속도.
17
3.3 2층 공배양 시스템에서 암세포와 공배양 된 내피세포의
성장
CD-PCL-M과 C-PCL-M에서 암세포를 배양하였을 때, 암세포의 성장이 다르게 나타나는지를 평가하였다. 세포 분포도는 두 조건 모두에서 증가하였으나(그림 3A), CD-PCL-M보다 C-PCL-M에서 증식 속도가 더 높았다(그림 3B). 나노섬유 막의 큰 공극은 스캐폴드로의 깊은 세포 침윤을 촉진할 수 있기 때문에[26], 이 연구에서 암세포는 CD-PCL-M이 아닌 C-PCL-M에서 배양되었다. 내피세포의 성장에 대한 암세포의 영향을 조사하기 위해, 각각 상부 및 하부 나노섬유 막에서 배양된 내피세포 및 암세포를 사용하여 2층 공동 배양 시스템을 제작하였다(그림 4). 시간이 지남에 따라, 상부 CD-PCL-M 층에서 bEnd.3 세포의 단일 배양과 CT26 암세포와의 공동 배양 간의 세포 형태 및 분포의 뚜렷한 차이가 관찰되었다 (그림 5A). 상부 층의 내피세포를 면역 형광 염색을 통해 분석하였을 때, CD-PCL-M에서의 단일 배양에서는 세포의 수가 감소하였지만, CT26 암세포와의 공배양 하였을 때는 bEnd.3 세포의 형광 강도가 증가하였다. CCK-8 분석 결과 CD-PCL-M에서의 bEnd.3 세포의 수는 단일 배양 결과 1 일에서 5 일 동안 약간 감소한 것으로 나타났지만, CT26 세포와의 공동 배양 시 유의하게 증가하였다(그림 5B). C-PCL-M에서 bEnd.3 세포의 세포 증식률은 내피세포 단일 배양과 공동 배양 사이에 유의한 차이를 나타내지 않았다.18
19
그림 3. CD-PCL-M 및 C-PCL-M에서 배양된 CT26 세포의 성장. CT26 세포 (3 × 104)를 CD-PCL-M 과 C-PCL-M에 분주하고
지시된 기간 동안 배양하였다(n = 3). (A) 면역 형광 염색 후 공초점 현미경을 통해 관찰한 세포의 성장 및 형태. DAPI(파란색), phalloidin(초록색), anti-vimentin antibody(빨간색). (B) CCK-8 assay로 분석한 CT26 세포의 증식 속도. *p < 0.05, CD-PCL과 비교하였다.
20 그림 4. 2 층 공배양 시스템의 실험 모식도.
22 그림 5. 2층 공배양 시스템에서 CT26 세포와 공배양 된 bEnd.3 세포의 성장 증가. bEnd.3 세포 (3 × 104)를 상부 층의 CD-PCL-M 또는 C-PCL-M에 분주하고 CT26 세포 (3 × 104)를 하부 층의 C-PCL-M에 분주하여 그림 4에 명시된 방법으로 지시된 기간 동안 세포를 배양하였다(n = 3). (A) 공초점 현미경을 통해 관찰한 세포의 분포 및 형태 (B) CCK-8 assay로 분석한 bEnd.3 세포의 증식 속도. 데이터는 mean ± SD values 로 표시하였다(n = 3). *p < 0.05, 1 일차와 비교하였다.
23
3.4 CD-PCL-M에서 공배양한 암세포에서 생산된 VEGF에
의한 bEnd.3 세포의 성장
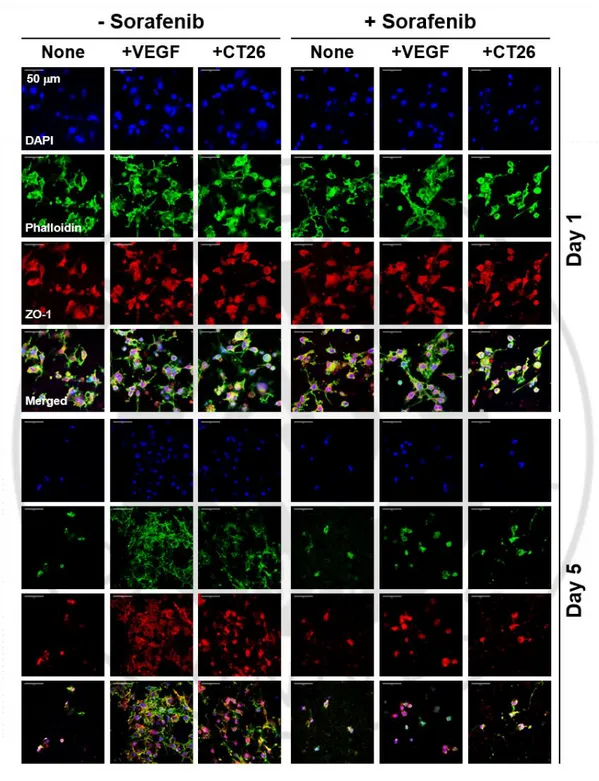
내피세포의 성장이 VEGF를 첨가하지 않았을 때 크게 감소하고 암세포와 공동 배양 시 회복되었기 때문에 암세포와 공동 배양 시 생성된 VEGF가 bEnd.3 세포의 성장을 유도하는지 조사했다. 먼저, CD-PCL-M 상에서 bEnd.3 세포를 배양하여 다양한 농도로 VEGF를 처리하여 실험을 수행하였다. VEGF는 배양 배지에서 5 일 동안 용량에 따라 점진적으로 세포의 분포를 증가시켰다(그림 6A). 또한, 세포 증식 분석을 수행한 결과, VEGF에 의해 bEnd.3 세포의 증식이 증가하는 것으로 나타났다(그림 6B). 이러한 결과는 VEGF가 3D 배양 조건에서 bEnd.3 세포의 성장 및 증식을 유도함을 시사한다. VEGF의 첨가로 유도된 내피세포의 성장 및 증식은 anti-VEGF 항체를 처리하였을 때 증식 정도가 감소되었다. C-PCL-M에서 배양된 암세포로부터 분비된 VEGF의 양을 측정하였다. CT26 세포에 의한 VEGF 분비는 CT26 세포를 3D 나노섬유 막에서 배양하였을 때 모두 시간의 경과에 따라 증가하였다. bEnd.3 및 CT26 세포를 공배양 후 anti-VEGF 항체를 첨가하였을 때, bEnd.3 세포의 성장은 anti-VEGF 항체 용량의 증가에 따라 현저하게 감소되었다(그림 7). 그림 6B에서도 확인할 수 있듯이, CT26 세포와 공동 배양된 bEnd.3 세포의 증식 또한 anti-VEGF 항체에 의해 억제되었다. Sorafenib은 VEGF 수용체 신호 전달을 억제하여 종양 혈관 신생을 차단한다[32]. bEnd.3 세포의 성장은 CT26 세포와의 공동 배양 및24
VEGF의 첨가 시 향상되었지만, sorafenib을 1 μM의 농도로 처리하였을 때 내피세포의 성장은 유의하게 억제되었다(그림 8).
26
그림 6. CD-PCL-M에서 배양된 bEnd.3 내피세포의 VEGF에 의한 성장 조절. bEnd.3 세포 (3 × 104)를 다양한 농도의 VEGF와 anti-VEGF
antibody (0.2 μg/ml)를 처리하여 배양하였다. 세포는 1 일부터 5 일까지 배양되었다 (n = 3). (A) 공초점 현미경을 통해 관찰한 세포의 형태. (B) CCK-8 assay로 분석한 bEnd.3 세포의 증식 속도. 세포 증식률은 fold increase로 제시하였다. 데이터는 mean ± SD values 로 표시하였다(n = 3). *p < 0.05
28
그림 7. Anti-VEGF antibody에 의한 공배양으로 유도된 bEnd.3 내피세포의 성장 억제. bEnd.3와 CT26 세포 (3 × 104)를 5 일 동안
2층 공배양 시스템에서 다양한 농도의 anti-VEGF antibody와 함께 공배양 하였다 (n = 3). (A) 상층 CD-PCL-M의 bEnd.3 세포를 DAPI, phalloidin, anti-ZO-1 antibody로 염색하고 공초점 현미경을 통해 세포 형태를 분석. (B) CCK-8 assay로 분석한 bEnd.3 세포의 증식률. 세포 증식률은 fold increase로 제시하였다. *p < 0.05, -anti-VEGF Ab와 비교하였다.
29
그림 8. Sorafenib에 의한 공배양으로 유도된 bEnd.3 내피세포의 성장 억제. bEnd.3 세포의 단독 배양(None), VEGF를 추가한 배양(+VEGF),
30
그리고 CT26 세포와의 공배양 조건에서(+CT26) sorafenib (1 μM)을 처리하여 1 일, 5 일 동안 세포를 배양하였다. 데이터는 mean ± SD values 로 표시하였다(n = 3).
31
3.5 C-PCL-M 에서 배양된 암세포에서 CoCl
2의 효과에 따른
세포 성장과 HIF-1
α
발현 및 VEGF 생성
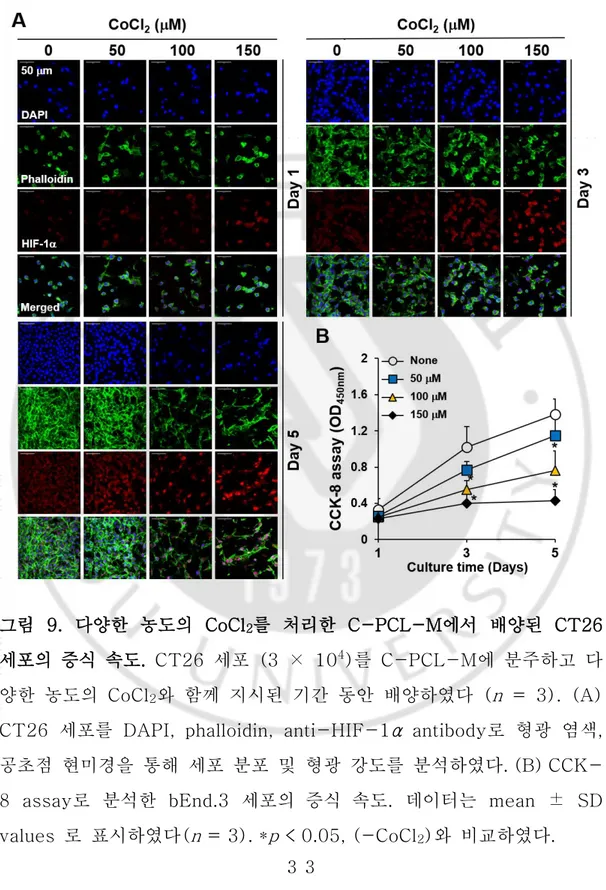
VEGF는 내피세포의 성장을 유도하는 가장 강력한 인자이지만, 암세 포로부터 분비되는 VEGF 이외의 성장 증가 인자들의 존재를 배제할 수 는 없다. 종양 저산소증은 VEGF 생성을 증가시키는 중요한 자극이다 [33]. 때문에 암세포와 공동 배양 시 CoCl2를 이용한 저산소증 모방 조 건이 내피세포 성장에 영향을 미치는지를 확인하였다. CoCl2 (150 μM) 를 공배양 환경에 첨가하였을 때, CoCl2는 배양 5 일까지 내피세포 성장 에 영향을 미치지 않았다. C-PCL-M 층에서 형광이 표지된 CT26 세 포의 분포와 밀도를 조사하였을 때, 단일 배양 조건의 CT26 세포는 CoCl2로 처리 시 대조군 세포와 비교하여 배양 3 일 후부터 세포 수 및 성장이 현저하게 감소하는 것으로 나타났다(그림 9A). HIF-1α는 저산 소증에 의해 활성화되는 주요 전사 인자로서, 종양 성장의 리프로그래밍 에 있어 중요한 역할을 한다[34]. 5 일 동안 CT26 세포에 상이한 농도 로 CoCl2를 처리하였을 때, CoCl2를 150 μM 처리한 암세포에서HIF-1α의 발현이 증가되었다. 1 일에서부터 5 일까지 배양한 CT26 암세포 의 증식속도를 CCK-8 분석을 통해 비교한 결과, 다른 농도로 CoCl2로
처리하였을 때 생존한 CT26 세포의 수는 시간에 따라 감소했다(그림 9B). 동시에, 3D 나노섬유 막 사이의 암세포의 성장과 증식에 대한 CoCl2의 효과를 확인했다. CoCl2 처리된 암세포로부터 분비된 VEGF의
양을 측정하였을 때, 처리되지 않은 조건과 CoCl2 처리된 조건 사이에
유의한 차이가 관찰되지 않았다(그림 10A). CoCl2가 암세포의 증식을
32 생성된 VEGF 농도 대 생존 세포의 비는 처리하지 않은 세포보다 CoCl2를 첨가한 세포에서 더 높게 나타났는데 이는 CoCl2를 처리하였을 때 생존한 CT26 세포는 더 적지만, 적은 수의 생존한 세포가 CoCl2를 처리하지 않은 세포보다 더 많은 VEGF를 생성할 수 있기 때문이라고 볼 수 있다(그림 10B).
33
그림 9. 다양한 농도의 CoCl2를 처리한 C-PCL-M에서 배양된 CT26
세포의 증식 속도. CT26 세포 (3 × 104)를 C-PCL-M에 분주하고 다 양한 농도의 CoCl2와 함께 지시된 기간 동안 배양하였다 (n = 3). (A)
CT26 세포를 DAPI, phalloidin, anti-HIF-1α antibody로 형광 염색, 공초점 현미경을 통해 세포 분포 및 형광 강도를 분석하였다. (B) CCK-8 assay로 분석한 bEnd.3 세포의 증식 속도. 데이터는 mean ± SD values 로 표시하였다(n = 3). *p < 0.05, (-CoCl2)와 비교하였다.
34
그림 10. CoCl2를 고농도로 처리한 CT26 암세포의 증식 감소. (A) CoCl2
150 μM을 처리하여 배양한 CT26 세포의 VEGF 생산량. VEGF의 농도 는 ELISA를 통해 측정. (B) (A)와 같이 배양된 CT26 세포에서 생산된 VEGF의 평균 농도를 평균 CCK-8 값과 비교하였다. 데이터는 mean ± SD values 로 표시하였다(n = 3).
35
3.6 공배양 조건에서 내피세포의 성장에 대한 CoCl
2의 영향
공동 배양 조건에서 내피세포의 성장에 미치는 저산소증의 영향을 조사하였다. 장기 배양 후 bEnd.3 세포에서 나타나는 성장 감소는 암세포와의 공동 배양 시 회복되었지만, 공동 배양 조건에서 CoCl2를 처리하였을 때 내피세포의 성장은 추가로 증가하지 않았으며, 공배양 된 CT26 세포로부터의 VEGF 분비량도 증가되지 않았다. 따라서, bEnd.3 세포 및 CT26 세포의 성장에 대한 CoCl2의 효과는 공동 배양 조건을 변형하여 내피세포의 성장이 억제된 상태에서 평가되었다(그림 11). 우선 bEnd.3 세포를 CD-PCL-M에서 2 일 동안 배양하였고, 이후 CT26 세포를 C-PCL-M에 분주하여 세포의 부착을 위해 4 시간 동안 배양하였다. bEnd.3 세포가 배양된 transwell 챔버를 CT26 세포를 배양한 24 well plate로 옮겨 2 개의 세포막 구조물을 조립하였고, CoCl2(150 μM)를 첨가하여 1 일 동안 공동 배양하였다. bEnd.3 세포와 CT26 세포의 공배양 조건에서 CoCl2를 처리한 경우의 상부 CD-PCL-M에서 bEnd.3 세포의 분포 및 밀도를 공초점 현미경으로 분석한 결과 bEnd.3 세포의 성장이 더욱 두드러지게 나타났다(그림 12). CoCl2로 1 일 처리한 후, CT26 세포의 수가 감소하지는 않았지만, CoCl2를 처리하지 않은 세포보다는 CoCl2가 처리된 CT26 암세포에서 HIF-1α의 발현이 증가하였다. 내피세포를 포함한 상층을 CCK-8 분석하였을 때 CT26 세포와 공배양 시 살아있는 bEnd.3 세포의 수가 유의하게 증가하였고 공동 배양에 CoCl2를 첨가하였을 때 세포의 수가 더욱 증가함을 확인할 수 있었다(그림 13A). 대조적으로, 살아있는 CT26 세포의 수는 CT26 세포의 단일 배양 및 공동 배양에 CoCl2를
36 첨가하였을 때 유의하게 감소하지 않았으며, 암세포의 단일 배양과 비교하였을 때도 bEnd.3 세포와 공동 배양 시 세포의 수가 증가하지 않았다(그림 13B). 마지막으로, ELISA를 통해 VEGF 분비량을 측정하였다. 그림 13C에서 확인할 수 있듯이, CoCl2 처리 후 1 일 동안 배양한 CT26 세포로부터 분비된 VEGF의 농도는 처리되지 않은 세포의 분비량보다 유의하게 더 높았다. VEGF 농도는 CT26 세포의 단일 배양에서 보다 CT26 및 bEnd.3 세포의 공동 배양에서 더 낮게 측정되었다. 공배양 환경에서 VEGF의 분비량이 더 낮게 나타나는 것은 분비된 VEGF가 내피세포의 세포막 수용체에 결합되기 때문에 초래될 수 있다. 이러한 결과는 화학적으로 유도된 저산소증이 암세포에서 VEGF 생성을 증가시키고 나노섬유 기반 2층 공배양 시스템에서 내피세포의 성장을 향상시켰음을 나타낸다.
37
38
그림 12. 공배양 환경에서 CoCl2에 의한 bEnd.3 세포의 성장. bEnd.3와
CT26 세포 (3 × 104)를 단독 배양 또는 공배양 하여 bEnd.3 세포에 대한 CoCl2의 효과를 조사하였다(n = 4). 상부 층의 bEnd.3 세포와
하부 층의 CT26 세포의 분포 및 형태를 면역 형광 염색 후 공초점 현미경을 통해 관찰하였다.
39 그림 13. 공배양 환경에서 CoCl2 처리 된 CT26 세포에 의한 bEnd.3 세포의 성장. 그림 12 와 같이 bEnd.3 와 CT26 세포 (3 × 104)를 단독 배양 또는 공배양 하였다(n = 3). (A) CoCl2 와 CT26 세포의 유무에 따른 bEnd.3 세포의 증식 속도를 CCK-8 assay 를 통해 측정. (B) CoCl2 와 bEnd.3 세포의 유무에 따른 CT26 세포의 증식 속도를 CCK-8 assay 를 통해 측정. (C) CT26 세포를 (B)와 같이 배양하고
40
ELISA 를 통해 VEGF 농도를 측정. 데이터는 mean ± SD 로 표시하였다(n = 3). *p < 0.05, NS, not significant
41
제 4 장 결론
본 연구를 통해 나노섬유를 기반으로 한 2층 공배양 시스템을 이용하여 내피세포와 암세포 간의 상호 작용을 조사할 수 있음을 확인하였다. 상부 CD-PCL-M 층의 bEnd.3 세포를 암세포 없이 단독으로 배양하였을 때, bEnd.3 세포의 성장이 저하되었다. 그러나 암세포와의 공배양을 통해 bEnd.3 세포의 성장을 향상시킬 수 있었다. 이러한 CD-PCL-M에서 암세포와 공배양 된 내피세포의 성장은 Sorafenib을 처리하였을 때 억제되었다. 또한 공배양 시스템에 CoCl2를 처리하여 저산소 환경을 조성하였을 때, 암세포에서의 HIF-1α 발현이 증가되었으며, VEGF의 생성 또한 증가되었다. 본 모델을 이용하여 특징적인 조성 및 구조를 갖는 나노섬유 막 상에서 특정 유형의 내피세포의 3차원 성장을 설명할 수 있다. 이 시스템을 통해 3차원 공배양 모델의 형태학적 분석의 장점을 보여줄 수 있으며, 내피세포와 암세포 사이의 상호작용에 대한 anti-angiogenic 약물의 효과를 분석할 수 있는 적절한 예를 제공할 수 있다.42
참고문헌
[1] Katayama Y, Uchino J, Chihara Y, Tamiya N, Kaneko Y, Yamada T, et al. Tumor Neovascularization and Developments in Therapeutics. Cancers. 2019;11(3).
[2] Oliver G. Lymphatic vasculature development. Nature reviews Immunology. 2004;4(1):35-45.
[3] Risau W, Flamme I. Vasculogenesis. Annual review of cell and developmental biology. 1995;11:73-91.
[4] Nishida N, Yano H, Nishida T, Kamura T, Kojiro M. Angiogenesis in cancer. Vascular health and risk management. 2006;2(3):213-9. [5] Semenza GL. Hypoxia and cancer. Cancer metastasis reviews. 2007;26(2):223-4.
[6] Wilson WR, Hay MP. Targeting hypoxia in cancer therapy. Nature reviews Cancer. 2011;11(6):393-410.
[7] Ding YH, Luan XD, Li J, Rafols JA, Guthinkonda M, Diaz FG, et al. Exercise-induced overexpression of angiogenic factors and reduction of ischemia/reperfusion injury in stroke. Current neurovascular research. 2004;1(5):411-20.
[8] Gavin TP, Robinson CB, Yeager RC, England JA, Nifong LW, Hickner RC. Angiogenic growth factor response to acute systemic exercise in human skeletal muscle. Journal of applied physiology. 2004;96(1):19-24.
43
plasma VEGF response to exercise in sedentary and endurance-trained men. Journal of applied physiology. 2004;96(4):1445-50. [10] Prior BM, Yang HT, Terjung RL. What makes vessels grow with exercise training? Journal of applied physiology. 2004;97(3):1119-28.
[11] Unwith S, Zhao H, Hennah L, Ma D. The potential role of HIF on tumour progression and dissemination. International journal of cancer. 2015;136(11):2491-503.
[12] Allard WJ, Matera J, Miller MC, Repollet M, Connelly MC, Rao C, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clinical cancer research : an official journal of the American Association for Cancer Research. 2004;10(20):6897-904.
[13] Conteduca V, Kopf B, Burgio SL, Bianchi E, Amadori D, De Giorgi U. The emerging role of anti-angiogenic therapy in ovarian cancer (review). International journal of oncology. 2014;44(5):1417-24. [14] Bunn HF, Poyton RO. Oxygen sensing and molecular adaptation to hypoxia. Physiological reviews. 1996;76(3):839-85.
[15] Amann A, Zwierzina M, Koeck S, Gamerith G, Pechriggl E, Huber JM, et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific reports. 2017;7(1):2963.
[16] Ravi M, Ramesh A, Pattabhi A. Contributions of 3D Cell Cultures for Cancer Research. Journal of cellular physiology.
44 2017;232(10):2679-97.
[17] Verbridge SS, Choi NW, Zheng Y, Brooks DJ, Stroock AD, Fischbach C. Oxygen-controlled three-dimensional cultures to analyze tumor angiogenesis. Tissue engineering Part A. 2010;16(7):2133-41.
[18] Chwalek K, Bray LJ, Werner C. Tissue-engineered 3D tumor angiogenesis models: potential technologies for anti-cancer drug discovery. Advanced drug delivery reviews. 2014;79-80:30-9. [19] Bray LJ, Binner M, Holzheu A, Friedrichs J, Freudenberg U, Hutmacher DW, et al. Multi-parametric hydrogels support 3D in vitro bioengineered microenvironment models of tumour angiogenesis. Biomaterials. 2015;53:609-20.
[20] Taubenberger AV, Bray LJ, Haller B, Shaposhnykov A, Binner M, Freudenberg U, et al. 3D extracellular matrix interactions modulate tumour cell growth, invasion and angiogenesis in engineered tumour microenvironments. Acta biomaterialia. 2016;36:73-85.
[21] Bray LJ, Binner M, Freudenberg U, Werner C. Hydrogel-Based In Vitro Models of Tumor Angiogenesis. Methods in molecular biology. 2017;1612:39-63.
[22] Chiew GGY, Wei N, Sultania S, Lim S, Luo KQ. Bioengineered three-dimensional co-culture of cancer cells and endothelial cells: A model system for dual analysis of tumor growth and angiogenesis. Biotechnology and bioengineering. 2017;114(8):1865-77.
45
[23] Dahlin RL, Kasper FK, Mikos AG. Polymeric nanofibers in tissue engineering. Tissue engineering Part B, Reviews. 2011;17(5):349-64.
[24] Stocco TD, Bassous NJ, Zhao S, Granato AEC, Webster TJ, Lobo AO. Nanofibrous scaffolds for biomedical applications. Nanoscale. 2018;10(26):12228-55.
[25] Prabhakaran MP, Ghasemi-Mobarakeh L, Ramakrishna S. Electrospun composite nanofibers for tissue regeneration. Journal of nanoscience and nanotechnology. 2011;11(4):3039-57.
[26] Li WJ, Danielson KG, Alexander PG, Tuan RS. Biological response of chondrocytes cultured in three-dimensional nanofibrous poly(epsilon-caprolactone) scaffolds. Journal of biomedical materials research Part A. 2003;67(4):1105-14.
[27] Liu H, Ding X, Zhou G, Li P, Wei X, Fan Y. Electrospinning of Nanofibers for Tissue Engineering Applications. Journal of Nanomaterials. 2013;2013:1-11.
[28] Sankaran KK, Subramanian A, Krishnan UM, Sethuraman S. Nanoarchitecture of scaffolds and endothelial cells in engineering small diameter vascular grafts. Biotechnology journal. 2015;10(1):96-108.
[29] Kim TE, Kim CG, Kim JS, Jin S, Yoon S, Bae HR, et al. Three-dimensional culture and interaction of cancer cells and dendritic cells in an electrospun nano-submicron hybrid fibrous scaffold. International journal of nanomedicine. 2016;11:823-35.
46
[30] Chen M, Patra PK, Warner SB, Bhowmick S. Role of fiber diameter in adhesion and proliferation of NIH 3T3 fibroblast on electrospun polycaprolactone scaffolds. Tissue engineering. 2007;13(3):579-87.
[31] Ma Z, He W, Yong T, Ramakrishna S. Grafting of gelatin on electrospun poly(caprolactone) nanofibers to improve endothelial cell spreading and proliferation and to control cell Orientation. Tissue engineering. 2005;11(7-8):1149-58.
[32] Jayson GC, Kerbel R, Ellis LM, Harris AL. Antiangiogenic therapy in oncology: current status and future directions. Lancet. 2016;388(10043):518-29.
[33] Yang Y, Sun M, Wang L, Jiao B. HIFs, angiogenesis, and cancer. Journal of cellular biochemistry. 2013;114(5):967-74.
[34] Epstein AC, Gleadle JM, McNeill LA, Hewitson KS, O'Rourke J, Mole DR, et al. C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation. Cell. 2001;107(1):43-54.
[35] Kang D, Kim JH, Jeong YH, Kwak JY, Yoon S, Jin S. Endothelial monolayers on collagen-coated nanofibrous membranes: cell-cell and cell-ECM interactions. Biofabrication. 2016;8(2):025008.
47
Abstract
Angiogenesis is critical element for local growth and metastasis of tumor cells. It is a mechanism that supports the growth of cancer cells through the generation of new blood vessels from existing ones. The purpose of this study was to establish a nanofibrous scaffold-based two-layer co-culture system of endothelial and cancer cells using poly ε-caprolactone (PCL) polyester. PCL was dissolved on either chloroform or dimethylformamide solvent and subsequently electrospun to produce chloroform-PCL (C-PCL-M) and chloroform and dimethylformamide-PCL (CD-PCL-M). Either C-PCL-M or CD-PCL-M was attached to the transwell insert (upper layer), while C-PCL-M was used at the bottom of the 24-well plate (lower layer). bEnd.3 endothelial cells and CT26 cancer cells were seeded and assembled on the upper and lower layer of the co-culture system, respectively. The growth rate of bEnd.3 cells in CD-PCL-M was decreased over time compared to bEnd.3 cells seeded in C-PCL-M in the absence of vascular endothelial growth factor (VEGF). However, the growth rate of bEnd.3 cells in CD-PCL-M was increased upon co-cultured with CT26 cells. The growth rate of these bEnd.3 cells was blocked using anti-VEGF antibody and anti-cancer drug sorafenib. In addition, when the chemical hypoxia inducer CoCl2 was added in the
co-culture environment, the expression of VEGF and HIF-1α in cancer cells were
increased and the growth of co-cultured endothelial cells was also improved. Thus, the growth of endothelial cells from nanofibrous scaffold is dependent on the composition of nanofibers, and this co-culture system can be utilized to analyze the cellular functions of endothelial cells in the presence of cancer cells.