392
In vivo Hollow Fiber Assay for Anticancer Drugs' Responsiveness in a Bladder Cancer Model
Ki Hyuck Moon, Byoung Kyu Han, Seong Jin Jeong, Sung Kyu Hong, Seok-Soo Byun, Sang Eun Lee
From the Department of Urology, Seoul National University College of Medicine, Seongnam, Korea
Purpose: The National Cancer Institute (NCI)'s Hollow Fiber Assay (HFA) is currently used as an in vivo screening model to quantitatively define anticancer activity. To investigate the use of HFA in a bladder cancer model, we conducted in vitro and in vivo experiments with several anticancer drugs in nude mice.
Materials and Methods: The human bladder cancer cell lines (CRL2742, 253JP, SW1710, HTB9) were cultured both in vitro and in vivo in polyvinylidene fluoride (PVDF) hollow fibers. The fibers were implanted intraperitoneally (ip) and subcutaneously (sc) into female athymic nude mice (C57BL/6), and the mice were then treated with gemcitabine 120 mg/kg (bolus), cisplatin (3mg/kg), paclitaxel (15mg/kg) or vehicle only (control) for 4-consecutive days. After 6 days, the fibers were retrieved and the viable cell density was analyzed by MTT assay.
Results: The difference between in vitro and in vivo growth was not significant for the CRL2742, 253J-P and SW1710 cell lines; the difference between the ip and sc fibers was also not significant in the CRL2742, SW1710 and HTB9 cell lines. After drug treatment, the percent of growth inhibition revealed constant and effective anticancer activities for the 3 individual drugs.
Conclusions: This study demonstrates the possibility of measuring and quantifying the anticancer effect with using in vivo hollow fiber assay in a bladder cancer model. (Korean J Urol 2008;49:392-397)
Key Words: Hollow fiber assay, Bladder, Neoplasm
대한비뇨기과학회지 제 49 권 제 5 호 2008
서울대학교 의과대학 비뇨기과학교실
문기혁ㆍ한병규ㆍ정성진 홍성규ㆍ변석수ㆍ이상은
접수일자:2007년 12월 31일 채택일자:2008년 4월 4일
교신저자: 문기혁
분당서울대학교병원 비뇨기과 경기도 성남시 구미동 300번지
463-707
TEL: 031-787-7349 FAX: 031-787-4057 E-mail: kihyuckmoon@
hotmail.com
서 론
Polyvinylidene fluoride (PVDF) membrane은 약 500,000 Dalton 이하의 수분, 영양소 및 약물은 통과할 수 있으나 동 물세포는 통과하지 않는다는 특징이 있다. Hollow fiber assay (HFA)란 반투과성의 PVDF 재질로 만들어진 hollow fiber (길이 34cm, 내경 1.0mm, 외경 1.2mm) 내부에 암세포 를 배양한 다음 이것을 생체 내에 일시적으로 이식한 후 반응 여부를 알고자 하는 약물에 노출시켰다가, 이식되었 던 fiber 내부 세포들의 성장억제 정도를 생체 밖에서 정량 적으로 분석하는 것이다. 1995년 미국 National Cancer Institute (NCI)의 Hollingshead 등1에 의해 고안되어 현재까
지 생체 약물 선별 (drug screening)에 쓰여지고 있다.
1950년대 초반부터 NCI의 Developmental Therapeutics Program (DTP)에서는 현존하는 약 500,000가지의 화합물에 대한 약물 선별을 해오고 있다. 초기에는 임상적으로 용이 하게 얻을 수 있는 혈액암세포를 대상으로 하였다가 1990 년에 이르러 고형암세포까지 확대하였는데, 이들 종양세포 의 종류는 9개 장기 (뇌, 혈액, 골수, 유방, 대장, 신장, 폐, 난소, 전립선, 피부) 종양에서 수립된 60종의 인체유래 암세 포주로서 총칭하여 NCI-60로 불린다.2
HFA는 일반적 생체모델인 이종이식 (xenograft)법과 비교 하여 몇 가지 장점이 있다. 첫째, 시간이 적게 소요되고 (10 일), 둘째, 고전적 방법 (이종이식 모델에서 Vernier caliber로 종양의 용적을 계산)에 비해 약제의 효과를 보다 더 정확하
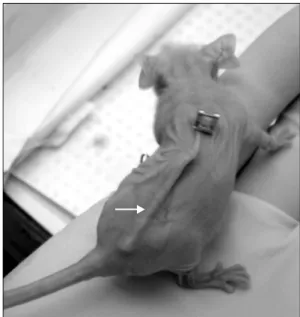
Fig. 1. Implanted sc fibers (arrow) in a nude mouse (ip fibers are not shown). sc: subcutaneous, ip: intraperitoneal.
게 정량화할 수 있고 셋째, 한 개체 내에 3종 이상 (최대 6 종)의 암세포주를 이식할 수 있기 때문에, 단시간에 적은 노력과 비용으로 다양한 암세포에 대해 많은 종류의 항암 제를 선별할 수 있는 매우 효과적인 방법이라고 할 수 있다.
이후 시행된 많은 연구에서 생체외 (in vitro) 결과와 함께 HFA 방법을 이용한 생체내 (in vivo) 결과를 같이 제시하고 있고,3-7 최근 국내에서도 다양한 암세포주를 대상으로 HFA 와 이종이식의 연관성을 보고한 예가 있지만,8 아직까지 방 광암세포주에서 HFA가 시도된 보고는 없다. 이에 저자들 은 현재 임상에서 방광암 항암치료제로 사용되는 3가지 약 제들 (cisplatin, gemcitabine, paclitaxel)의 반응성에 대해 4종 의 인체 방광암세포주 (CRL2742, 253J-P, SW1710, HTB9)를 대상으로 생체외 및 in 생체내 HFA를 시행하여 이를 정량 적으로 분석하고자 하였다.
재료 및 방법 1. 생체외 세포배양
인체 방광암 세포주는 Dr. Theodorescu (University of Virgi- nia, Charlottesville, USA)로부터 제공받은 CRL2742, 253J-P, SW1710, HTB9을 이용하였고, 각각 RPMI1640 및 MEM 배 지를 사용하여 100ml cell culture plate (56.7cm2)에 37oC, 95%
air, 5% CO2 조건에서 배양하였다. 세포들이 80-90%에 도달 했을 때 계대배양하였고 총 10-계대 미만의 것을 사용하였 다.
2. Hollow fiber preparation
Polyvinylidene fluoride (PVDF) hollow fiber (Spectrum Labo- ratories, Inc. Rancho Dominguez, USA)는 개별 세포주의 식 별을 위해 2가지색 (white, yellow)을 사용하였다. HF는 70%
에탄올로 내부를 통과시킨 다음 에탄올 용액 내에 실온보 관하였다가 3차 증류수에 고압 멸균한 후 세포 주입 전 RPMI 1640 (20% 우태아 혈청)배지에 넣어 37oC, 95% air, 5% CO2 조건에서 4시간 동안 보관하였다. 개별 세포주는 2.5x106cells/ml의 부유액을 만들어 무균조작으로 34cm의 HF 내부를 채운 다음 2cm 간격으로 잘라 fiber 양쪽 선단을 가열 밀봉한 다음, 세포들의 안정화를 위해 생체에 이식하 기 전날 RPMI-1640 (20% 우태아 혈청)배지에 37oC, 95% air, 5% CO2 조건에서 24시간 동안 배양하였다.
3. 실험동물 및 HF 이식 및 배양
생후 6주령의 암컷 무흉선 누드마우스 (C57BL/6)를 사용 하였고 평균 체중은 19.54±0.59g이었다. Isoflurane (Abbott, Abbott Park, Elgin, USA) 흡입마취 후, 좌측 요부 및 배부에
작은 절개창을 넣어 복강내 (intraperitoneal; ip)와 피하 (sub- cutaneous; sc)에 각각 2종류의 HF를 이식하고 봉합하였다 (Fig. 1). 생체내 실험에 대한 대조군으로 마우스에 하였던 동일한 HF를 생체외에서 RPMI-1640 (20% 우태아혈청)배지 에 37oC, 95% air, 5% CO2 조건에서 7일 동안 배양하였다.
4. Chemotherapy
Cisplatin (시스플라틴주 10mg/20ml vial, 중외, 화성시, 한 국), gemcitabine (젬자 200mg/vial, Lily, Fegersheim, France), paclitaxel (제넥솔 30mg/5ml, 삼양사, 대전시, 한국)은 분당 서울대학교병원 전임상실험실에서 구입하여 생리식염수에 녹인 후 실험기간 동안 실온에 차광 보관하였다. HF 이식 후 3, 4, 5, 6일째에 cisplatin (3mg/kg), paclitaxel (15mg/kg)을 4일간 복강내 주사 (0.1cc/10g)하였고, gemcitabine (120mg/
kg)은 3일째에만 bolus로 투여하였다. 약제 주입 전에 개체 당 3g 이상의 체중감소가 있으면 투약을 중단하였다. 음성 대조군은 동량의 생리식염수를 4일 동안 복강내 주사 (0.1cc/10g) 하였다.
5. Fiber extraction and cell viability assay
4일간 항암제를 투여받은 군의 평균체중은 19.23±0.7g, 대조군은 19.5±0.7g이었다. 실험 7일째에 마우스를 동일한 방법으로 마취 및 절개하여 ip, sc fiber를 꺼내고, 동물실험 윤리규정에 따라 CO2 gas를 사용하여 안락사시켰다. 추출 된 fiber들은 MTT (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl- tetrazolium bromide)와 4시간 동안 반응시킨 후 4oC 에서 24
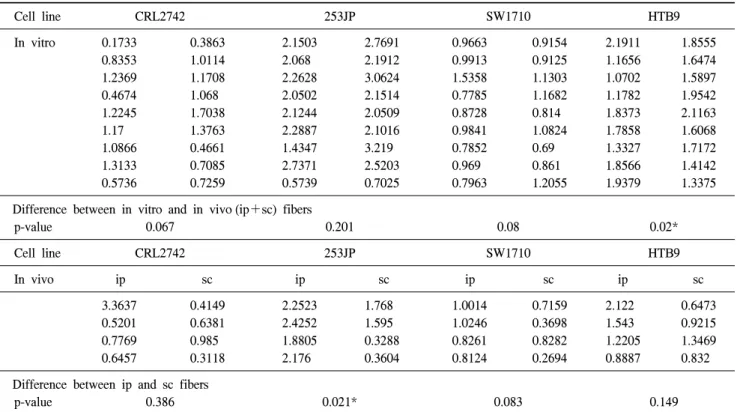
Table 1. The MTT absorbance of the in vitro (upper) fibers (18 fibers per each cell line) and the in vivo (lower) intraperitoneal (ip) and subcutaneous (sc) fibers (8 fibers per each cell line)
Cell line CRL2742 253JP SW1710 HTB9
In vitro 0.1733 0.3863 2.1503 2.7691 0.9663 0.9154 2.1911 1.8555
0.8353 1.0114 2.068 2.1912 0.9913 0.9125 1.1656 1.6474
1.2369 1.1708 2.2628 3.0624 1.5358 1.1303 1.0702 1.5897
0.4674 1.068 2.0502 2.1514 0.7785 1.1682 1.1782 1.9542
1.2245 1.7038 2.1244 2.0509 0.8728 0.814 1.8373 2.1163
1.17 1.3763 2.2887 2.1016 0.9841 1.0824 1.7858 1.6068
1.0866 0.4661 1.4347 3.219 0.7852 0.69 1.3327 1.7172
1.3133 0.7085 2.7371 2.5203 0.969 0.861 1.8566 1.4142
0.5736 0.7259 0.5739 0.7025 0.7963 1.2055 1.9379 1.3375
Difference between in vitro and in vivo (ip+sc) fibers
p-value 0.067 0.201 0.08 0.02*
Cell line CRL2742 253JP SW1710 HTB9
In vivo ip sc ip sc ip sc ip sc
3.3637 0.4149 2.2523 1.768 1.0014 0.7159 2.122 0.6473
0.5201 0.6381 2.4252 1.595 1.0246 0.3698 1.543 0.9215
0.7769 0.985 1.8805 0.3288 0.8261 0.8282 1.2205 1.3469
0.6457 0.3118 2.176 0.3604 0.8124 0.2694 0.8887 0.832
Difference between ip and sc fibers
p-value 0.386 0.021* 0.083 0.149
*: statistically significant (p<0.05) by the Mann-Whitney U test. ip: intraperitoneal, sc: subcutaneous
Fig. 2. The differences between in vitro and in vivo (ip+sc) fibers in each of the bladder cancer cell lines. Three of four the cell lines (CRL2742, 253J-P, SW1710) except the HTB9 cell line, reveal no significant differences between the in vitro and in vivo fibers. The difference between the ip and sc fibers was also not significant, except for the 253J-P cell line. ip: intraperitoneal, sc: subcutaneous.
시간 동안 2.5% protamine sulfate 용액에 고정시킨 다음 fiber의 중간부분을 절단하여 fiber 내부의 세포들을 추출하 여 spectrophotometer (SpectraMax Plus384, Molecular Devices, Sunnyvale, USA)를 이용하여 540nm에서 흡광도를 측정하 였다. 대조군에 비해 50% 이상의 성장억제를 보일 때 효과 가 있는 것으로 판정하였다.
6. 통계분석
SPSS 13.0 프로그램을 이용하여 Mann-Whitney test를 시 행하였고 p값이 0.05 미만일 때 통계적으로 유의한 것으로 판정하였다.
결 과 1. Control fibers in vitro and in vivo
각 세포주 (CRL2742, 253J-P, SW1710, HTB9)에서 생체 외 fiber와 생체내 (ip, sc) control fiber에서 얻어진 흡광도는 Table 1과 같다. 생체외 보다 생체내에서 세포증식이 떨어 지는 것처럼 보이나 HTB9를 제외하고 나머지 CRL2742, 253J-P, SW1710에서 통계적으로 양 군 간 (생체외 vs 생체 내)의 유의한 차이는 없었고, 각 세포주에서 ip fiber와 sc
fiber 간의 차이 역시 sc에서 낮아 보이나, 253JP를 제외하고 나머지 CRL2742, SW1710, HTB9에서 통계적으로 양 군 간 (ip vs sc) 유의한 차이는 없었다 (Table 1) (Fig. 2).
Table 2. The MTT absorbance after drug exposure (cisplatin 3mg/kg, paclitaxel 15mg/kg or gemcitabine 120mg/kg bolus) at 4-days (1-day for gemcitabine) after intraperitoneal injection. The control group received vehicle (normal saline) injection only. The individual growth inhibition % for each drug (lower)
CRL2742 253JP SW1710 HTB9
ip sc ip sc ip sc ip sc
Cisplatin 0.1883 0.2958 0.5091 0.2632 0.2136 0.0795 0.337 0.162
0.4271 0.4301 0.2993 0.2888 0.2949 0.4868 0.7606 0.3375
Paclitaxel 0.414 0.1549 0.1767 0.1957 0.6858 0.3903 0.2023 0.2714
0.241 0.1381 1.3467 0.6691 0.3288 0.14 0.2732 0.2642
Gemcitabine 0.3484 0.2072 0.6843 0.7212 0.2918 0.2584 0.3871 0.2932
0.1927 0.2557 0.5154 0.2255 0.2474 0.2494 0.2124 0.2786
Control (mean)
0.6370 1.8983 0.7310 1.1902
Growth inhibition (%)
Cisplatin 52.6% 17.9% 36.8% 33.5%
Paclitaxel 37.2% 31.5% 52.8% 21.2%
Gemcitabine 39.4% 28.3% 35.8% 24.6%
Fig. 3. Percent (%) of growth inhibition (decease of MTT absorbance) after drug (cisplatin, paclitaxel, gemcitabine) injection for each of the cell lines. (A) % growth inhibition for the in vivo (ip+sc) fibers, (B) % growth inhibition for the in ip and sc fibers. ip: intraperitoneal, sc: subcutaneous, Cis: cisplatin, Tax: paclitaxel, Gem: gemcitabine.
2. Hollow fiber 내의 cell viability의 정량적 분석
Cisplatin (3mg/kg)과 paclitaxel (15mg/kg)은 4일간, gemci- tabine (120mg/kg)은 1회 bolus로 복강내 주사한 다음 실험 7일째 얻은 결과로 3가지 약제 모두 CRL2742, 253JP, SW1710, HTB9 세포주에서 대조군 (vehicle injection only)에 비해 흡광도가 낮게 나타났으며, 대조군 (100%) 기준으로 감소된 정도를 % of growth inhibition로 환산한 결과 CRL2742, 253JP, SW1710, HTB9 4종 세포주 모두에서 (17.9-52.8% of growth inhibition) 종양억제 효과를 나타냈다 (Table 2) (Fig. 3).
고 찰
종양에 대한 항암약제의 생체내 반응 정도를 측정하는 것은 독성평가와 더불어 필수적이다. 전임상 연구단계 생 체외에서 작용기전이 밝혀진 약제라도 실제 생체에 투여된 후 표적까지 도달하여 체내 미세환경에서 종양세포와 접촉 하여 약리작용을 하기까지는 여러 가지 변수가 존재하기 때문이다.
전임상 단계에서 각종 암에 대한 항암제의 효과를 알아
보는 과정 중에, 생체외에서 효과가 있는 것으로 밝혀진 항 암제는 다음 단계인 생체내에서 이종이식을 이용한 동물실 험으로 항암효과를 평가한다. 하지만 새로운 항암제가 끊 임없이 개발되고 있는 상황에서 이러한 방법은 시간과 비 용, 인력이 많이 들 뿐 아니라 상용화 이전 단계의 물질의 경우 약물 선별에 충분한 양을 확보하기가 쉽지 않다. 이종 세포를 encapsulation을 통해 실험동물에게 이식하려는 시도 는 이전에도 있었으나,9-11 현재 NCI에서는 HFA가 실제 약 물 선별 과정의 한 단계로 사용되고 있다.2,12
HFA로 얻어진 결과를 해석하는 데에, NCI-60 세포주의 경우는 이미 축적된 자료들이 있기에 Decker 등13이 제시한 NCI's scoring system이 추천되며 HFA 결과로써 항암제에 대한 이종이식실험 결과를 예측할 수 있으나, 본 실험에 사 용된 방광이행상피암 세포주의 경우 NCI-60에 포함되어 있 지 않아 scoring system을 적용시키기 애매하기 때문에 대신 일반적으로 대조군에 비해 50% 이상의 세포성장 억제를 보 였을 때 효과가 있는 것으로 판정하였다.
Cisplatin, gemcitabine, paclitaxel은 CRL2742, 253J-P, SW1710, HTB9를 포함한 40종의 인체방광암 세포주를 대상으로 한 in vitro 실험에서 효과가 입증되었을 뿐 아니라,14 현재 임상 에서도 널리 쓰이는 검증된 약제이기 때문에 본 실험결과 에서도 효과적인 항암작용을 보여주었다.
생체내에서는 약물의 상호작용, 독성, 약동학/약력학적 사항을 고려하여 항암제 투여 계획을 다양하게 변경할 수 있는데, 본 실험에서 cisplatin (3mg/kg)과 paclitaxel (15mg/
kg)은 마우스 최대허용농도 이하로 4일간 투여하였지만,3,15 gemcitabine의 경우는 1회 bolus로 투여하였다. 그 이유는 gemcitabine의 체내 반감기가 매우 짧고 대부분의 연구에서 daily schedule (2.5-3.0mg/kg)보다는 bolus (120mg/kg)로 투여 하는 것이 더 효과적으로 나타났기 때문이다.16-18
HF 내에 주입하는 세포부유액의 농도는 세포의 성장주 기에 따라 조절할 수 있는데, HFA가 일반적으로 7일간 배 양하기 때문에 성장주기가 빠르거나 느린 경우 세포부유액 의 농도를 1x106-1x107의 농도로 조절하면 20,000-200,000 cells/20μl/2cm fiber을 만들 수 있으며,1 일반적으로 HFA 는 7일간 세포를 배양하지만 매우 느리게 자라는 세포주의 경 우 수주까지 HFA 내에 배양이 가능하다.19
시판되는 PVDF membrane은 세포주의 식별을 위해 4가 지 (white, yellow, blue, green) 색이 제공되므로 개체당보다 많은 세포주를 이식할 수 있으나, 본 실험에서는 2종류만을 사용하였다. 본 실험에서는 단순히 대조군과 투약군의 cell viability만을 측정하였으나, 보다 정확한 성장곡선의 변화 를 얻기 위해서는 HF 이식 당일 및 24시간대 별로 fiber를 추출하여 분석할 필요가 있다.20,21 본 연구의 경우 case가 적
기 때문에 향후 보완이 필요하지만, 방광암 세포에서 HFA 를 이용하여 항암제효과를 정량화 할 수 있다는 가능성을 제시하였다.
HFA의 한계점으로 지적되는 것들로서, 첫째, HFA가 실 제 체내 미세환경 (microenvironment)과 얼마나 유사한지, 둘째, ip fiber와 sc fiber에서의 측정되는 값의 차이가 무엇을 의미하는지에 대해서는 아직 논란의 여지가 있다. 혹자는 복강 내의 풍부한 혈관 때문에 ip fiber가 sc fiber에 비해 세 포성장 면에서는 유리할 것으로 주장한 반면,22 약물의 전달 은 혈관의 영향보다는 혈관외 확산 (extravascular diffusion) 을 통해 이루어지므로 오히려 sc fiber가 생체내 반응을 좀 더 정확히 예측할 수 있다는 주장도 있다.23
최근 연구자들은 HFA protocol을 조금씩 변형하여 사용 하기도 하는데, 혹자는 면역적격인 (immunocompetent) 마우 스를 사용하여 무흉선 마우스에서와 같은 결과를 얻었다는 보고가 있고,24 혹자는 레트 (rat) 모델에서 HFA를 시도하기 도 하였다.25
HFA가 고안된 근본적인 목적은 약물 선별분야에서 시간 과 비용을 절감하기 위해 일차적인 선별이므로, HFA가 이 종이식 실험을 전적으로 대치할 수는 없으며 또한 실제 임 상실험을 시도하기에 앞서 이종이식을 통한 효과판정은 매 우 중요한 과정이다. HFA의 기존 가치에도 향후 몇 가지 기대되는 점은, 첫째, 이종이식에 실패한 세포주에 대해 생 체내 실험을 할 수 있다는 것과, 둘째, 임상자료가 충분하지 않은 희귀종양의 경우 항암제의 선택에 있어 신속한 생체 내 약물 선별을 할 수 있는 점이라 할 수 있다.21
결 론
생체내 약물 선별방법인 HFA는 항암제의 효과를 보다 정확히 정량화 할 수 있으며, 이종이식에 실패한 세포주에 대한 생체내 실험 및 임상 자료가 부족한 희귀종양의 항암 제 선택에 있어 유용하고 중요한 역할을 담당할 것으로 생 각한다.
REFERENCES
1. Hollingshead MG, Alley MC, Camalier RF, Abbott BJ, Mayo JG, Malspeis L, et al. In vivo cultivation of tumor cells in hollow fibers. Life Sci 1995;57:131-41
2. Suggitt M, Bibby MC. 50 years of preclinical anticancer drug screening: empirical to target-driven approaches. Clin Cancer Res 2005;11:971-81
3. Alami N, Paterson JS, Belanger S, Grieshaber CK, Leyland- Jones B. In vitro and in vivo activity of C1311 and paclitaxel
in three cancer tumor models. AACR Meeting Abstracts 2004;
2004:1069-70
4. Hassan S, Dhar S, Sandstrom M, Arsenau D, Budnikova M, Lokot I, et al. Cytotoxic activity of a new paclitaxel for- mulation, Pacliex, in vitro and in vivo. Cancer Chemother Pharmacol 2005;55:47-54
5. Sadar MD, Akopian VA, Beraldi E. Characterization of a new in vivo hollow fiber model for the study of progression of prostate cancer to androgen independence. Mol Cancer Ther 2002;1:629-37
6. Leong CO, Suggitt M, Swaine DJ, Bibby MC, Stevens MF, Bradshaw TD. In vitro, in vivo, and in silico analyses of the antitumor activity of 2-(4-amino-3-methylphenyl)-5-fluoroben- zothiazoles. Mol Cancer Ther 2004;3:1565-75
7. Hovstadius P, Lindhagen E, Hassan S, Nilsson K, Jernberg- Wiklund H, Nygren P, et al. Cytotoxic effect in vivo and in vitro of CHS 828 on human myeloma cell lines. Anticancer Drugs 2004;15:63-70
8. Lee KH, Rhee KH. Correlative effect between in vivo hollow fiber assay and xenografts assay in drug screening. Cancer Res Treat 2005;37:190-200
9. McMahon J, Schmid S, Weislow O, Stinson S, Camalier R, Gulakowski R, et al. Feasibility of cellular microencapsulation technology for evaluation of anti-human immunodeficiency virus drugs in vivo. J Natl Cancer Inst 1990;82:1761-5 10. Wells RS, Campbell EW, Swartzendruber DE, Holland LM,
Kraemer PM. Role of anchorage in the expression of tumo- rigenicity of untransformed mouse cell lines. J Natl Cancer Inst 1982;69:415-23
11. Gorelik E, Ovejera A, Shoemaker R, Jarvis A, Alley M, Duff R, et al. Microencapsulated tumor assay: new short-term assay for in vivo evaluation of the effects of anticancer drugs on human tumor cell lines. Cancer Res 1987;47:5739-47 12. Peterson JK, Houghton PJ. Integrating pharmacology and in
vivo cancer models in preclinical and clinical drug develop- ment. Eur J Cancer 2004;40:837-44
13. Decker S, Hollingshead M, Bonomi CA, Carter JP, Sausville EA. The hollow fibre model in cancer drug screening: the NCI experience. Eur J Cancer 2004;40:821-6
14. Havaleshko DM, Cho H, Conaway M, Owens CR, Hampton G, Lee JK, et al. Prediction of drug combination chemo- sensitivity in human bladder cancer. Mol Cancer Ther 2007;
6:578-86
15. Peters GJ, Bergman AM, Ruiz van Haperen VW, Veerman G, Kuiper CM, Braakhuis BJ. Interaction between cisplatin and gemcitabine in vitro and in vivo. Semin Oncol 1995;22(4 Suppl 11):72-9
16. Shipley LA, Brown TJ, Cornpropst JD, Hamilton M, Daniels WD, Culp HW. Metabolism and disposition of gemcitabine, and oncolytic deoxycytidine analog, in mice, rats, and dogs.
Drug Metab Dispos 1992;20:849-55
17. Braakhuis BJ, Ruiz van Haperen VW, Boven E, Veerman G, Peters GJ. Schedule-dependent antitumor effect of gemcitabine in in vivo model system. Semin Oncol 1995;22(4 Suppl 11):42-6
18. van Moorsel CJ, Pinedo HM, Veerman G, Vermorken JB, Postmus PE, Peters GJ. Scheduling of gemcitabine and cisplatin in Lewis lung tumour bearing mice. Eur J Cancer 1999;35:808-14
19. Casciari JJ, Hollingshead MG, Alley MC, Mayo JG, Malspeis L, Miyauchi S, et al. Growth and chemotherapeutic response of cells in a hollow-fiber in vitro solid tumor model. J Natl Cancer Inst 1994;86:1846-52
20. Suggitt M, Swaine DJ, Pettit GR, Bibby MC. Characterization of the hollow fiber assay for the determination of microtubule disruption in vivo. Clin Cancer Res 2004;10:6677-85 21. Bridges EM, Bibby MC, Burchill SA. The hollow fiber assay
for drug responsiveness in the Ewing's sarcoma family of tumors. J Pediatr 2006;149:103-11
22. Phillips RM, Pearce J, Loadman PM, Bibby MC, Cooper PA, Swaine DJ, et al. Angiogenesis in the hollow fiber tumor model influences drug delivery to tumor cells: implications for anticancer drug screening programs. Cancer Res 1998;58:
5263-6
23. Hollingshead MG, Bonomi CA, Borgel SD, Carter JP, Shoemaker R, Melillo G, et al. A potential role for imaging technology in anticancer efficacy evaluations. Eur J Cancer 2004;40:890-8
24. Shnyder SD, Cooper PA, Scally AJ, Bibby MC. Reducing the cost of screening novel agents using the hollow fibre assay.
Anticancer Res 2006;26:2049-52
25. Jonsson E, Friberg LE, Karlsson MO, Hassan SB, Freijs A, Hansen K, et al. Determination of drug effect on tumour cells, host animal toxicity and drug pharmacokinetics in a hollow- fibre model in rats. Cancer Chemother Pharmacol 2000;46:
493-500